Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 135-140
Действие Hg2+ на HydSL гидрогеназу пурпурной серной бактерии Thiocapsa roseopersicina BBS
Н. А. Зорин 1, *, А. С. Стародубов 1, А. А. Цыганков 1
1 Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение Федерального государственного бюджетного учреждения науки “Федеральный исследовательский центр “Пущинский научный центр биологических исследований Российской академии наук”
142290 Московской обл., Пущино, Россия
* E-mail: zorin-na@mail.ru
Поступила в редакцию 10.07.2019
После доработки 20.09.2019
Принята к публикации 01.11.2019
Аннотация
Изучено ингибирующее действие хлорида ртути (II) на активность и структуру гидрогеназы Thiocapsa roseopersicina BBS (HydSL). Определена кинетика ее инактивации в присутствии различных концентраций ингибитора. Установлен необратимый характер действия Hg2+ и определены константы ингибирования гидрогеназы при разных температурах. Присутствие этого ингибитора в растворе фермента значительно снижало его стабильность и вызывало денатурацию при температуре выше 50°С. В течение процесса инкубации фермента с Hg2+ происходило обесцвечивание полосы поглощения в видимой области спектра, что указывало на разрушение железосерных кластеров. Сравнительный анализ ИК-Фурье-спектров гидрогеназы без добавления ингибитора и после инкубации с ним свидетельствовал о разрушении NiFe-активного центра.
Гидрогеназа относится к металлоферментам и катализирует обратимую реакцию восстановления протонов до молекулярного водорода.
Более трех десятков гидрогеназ получено в гомогенном состоянии из микроорганизмов разных таксономических групп, для части из них установлена трехмерная кристаллическая структура [1, 2]. По содержанию металлов в активном центре различают три типа гидрогеназ [1]. 1. [NiFe]-гидрогеназы содержат биметаллический железо-никелевый активный центр и являются в своем большинстве гетеродимерами. 2. [FeFe]-гидрогеназы содержат двухатомный кластер железа в активном центре. 3. Fe-гидрогеназы не содержат металлов, но включают Fe-содержащий кофактор. Для изученных [NiFe]-гидрогеназ показано, что биметаллический кластер активного центра ковалентно связан с белком четырьмя остатками цистеина, два из которых образуют связывающий мостик между ионами Ni и Fe, а два других координируют ион Ni. В зависимости от редокс-состояния фермента между ионами металлов может присутствовать небелковый лиганд. Атом железа в составе кластера связан с тремя небелковыми двухатомными лигандами, один из которых является СО лигандом и два − CN– лигандами [3].
Термостабильная HydSL-гидрогеназа из пурпурной серной бактерии Thiocapsa roseopersicina BBS относится к [NiFe]-гидрогеназам и состоит из двух субъединиц с молекулярными массами 64 и 34 кДа. Биметаллический активный центр глубоко погружен в большой субъединице, а малая субъединица содержит три железосерных кластера, которые образуют транспортную систему для внутримолекулярного переноса электронов между активным центром и поверхностью фермента [4, 5]. В межмолекулярном переносе электронов от гидрогеназы к акцептору важную роль играют электростатические взаимодействия между ферментом и субстратом [6]. Показано, что в составе активного центра гидрогеназы T. roseopersicina также содержатся двухатомные СО и СN– лиганды [7].
Необходимость изучения действия тяжелых металлов на гидрогеназы обусловлена двумя причинами. Во-первых, метаболизм водорода у пурпурной несерной бактерии T. roseopersicina играет важную роль при росте как в фототрофных анаэробных, так и хемогетеротрофных микроаэробных условиях. Следует отметить, что эта бактерия содержит не менее 5 гидрогеназ, кодируемых разными генами. При этом 4 из них являются функционально активными, синтезируются в различных условиях и участвуют в поглощении и выделении водорода [8, 9]. Таким образом, действие тяжелых металлов на гидрогеназу может существенно нарушать метаболизм водорода у T. roseopersicina. Во-вторых, иммобилизованная на электроде HydSL-гидрогеназа T. roseopersicina является перспективным водород-активирующим катализатором для разработки новых типов топливных элементов и водородных сенсоров на основе прямого биоэлектрокатализа [10, 11]. В связи с этим в практическом плане важно понимать механизм действия тяжелых металлов на HydSL гидрогеназу.
Действие ртути на [NiFe] гидрогеназу из T. roseopersicina [12], Desulfovibrio gigas [13] и D. vulgaris [14] было изучено ранее. Во всех работах показано, что ионы ртути необратимо ингибировали гидрогеназную активность. Отмечено также, что при действии ртути у всех гидрогеназ происходило разрушение железосерных кластеров, хотя количественные показатели различались. Действие ртути на активный центр гидрогеназ не изучалось. В связи с этим необходимо установить связана ли необратимая потеря активности гидрогеназы, наблюдаемая при длительной инкубации фермента с Hg2+, с разрушением FeS-кластеров, а не NiFe-активного центра фермента.
Цель работы − оценить количественно влияние хлорида ртути(II) на HydSL-гидрогеназу из T. roseopersicina в широких временном и концентрационном диапазонах.
МЕТОДИКА
Клетки пурпурной серной бактерии T. roseopersicina BBS выращивали в анаэробных фотогетеротрофных условиях на модифицированной среде Пфеннига [15] в присутствии 0.2%-ного ацетата натрия при освещении лампами накаливания (30−50 Вт м–2) и 28°С.
В работе использовали метилвиологен и реактивы для электрофореза в ПААГ (“Sigma”, Германия), фенилсефарозу CL-4B (“Pharmacia”, Швеция), ДЭАЭ-целлюлозу DE52 (“Whatman”, Англия), и дитионит натрия (“Fluka”, Швейцария). Остальные реактивы – отечественного производства марок х. ч. и ос. ч.
Получение экстрактов клеток и очистка гидрогеназы. Клетки отделяли от культуральной жидкости в конце экспоненциальной фазы роста и ресуспендировали (200 г) в 20 мМ К-фосфатном буфере, рН 7.0, в соотношении 1 : 1. Затем клетки разрушали обработкой 80%-ным ацетоном и ультразвуком на дезинтеграторе УЗГТ-01/22 22 кГц, 3 раза по 10 мин при 10°С, как описано ранее [12]. Из экстрактов клеток гидрогеназу фракционировали сульфатом аммония и последовательно подвергали жидкостной хроматографии на фенилсефарозе CL-4B и ДЭАЭ-целлюлозе DE52 [16]. Окончательную стадию очистки фермента осуществляли с использованием препаративного электрофореза в 7%-ном ПААГ, как описано ранее [17].
Влияние хлорида ртути (II) на активность гидрогеназы. Действие хлорида ртути (II) определяли в широком диапазоне концентраций ингибитора и фермента. Использовали свежеприготовленный запасной раствор 0.1 М HgCl2 в 20 мМ фосфатном буфере, рН 7.0. Константу скорости реакции инактивации определяли графическим методом [18].
Определение гидрогеназной активности. Активность гидрогеназы определяли спектрофотометрическим методом по реакции восстановления окисленного метилвиологена водородом в кювете Тунберга [12]. Реакционная смесь (общий объем 2 мл) содержала 50 мМ трис-HCl буфер, рН 9.0, 4 мМ метилвиологена и 1–10 мкг гидрогеназы. Кювету заполняли водородом, а для инициирования реакции при необходимости добавляли следовые количества (5–10 мкл) 20 мМ раствора дитионита натрия, приготовленного в анаэробных условиях. Все измерения активности фермента проводили при 30°С. Для расчета использовали коэффициент поглощения восстановленного метилвиологена (ε600 = 13.00 мМ–1 · см–1). Ферментативную активность выражали в мкмоль Н2/мин на 1 мг белка. Активность гидрогеназы по реакции изотопного обмена водорода в системе Н2/D2O регистрировали по образованию HD на изотопном масс-спектрометре Delta V Advantage (“Thermo Fisher”, Германия).
Регистрация и обработка спектров. ИК-Фурье спектры гидрогеназы регистрировали на спектрофотометре Nicolet 6700 (“Bruker”, Германия) в стандартной жидкостной кювете с окнами из фторида кальция. Растворы гидрогеназы концентрировали до примерно 1 мМ концентрации (около 100 мг/мл) с использованием микроконцентраторов “Microcon-10” (“Amicon”, США). Полученный концентрированный раствор в 10 мМ К-фосфатном буфере, рН 7.0, объемом 10 мкл наносили на окно из CaF2. На него помещали спейсер 50 мкм, сверху второе окно из CaF2 и собирали ячейку. ИК спектры регистрировали в диапазоне 4000–1000 см–1 с детектором МСТ (“Visinic”, Израиль) с разрешением 2 см–1 при комнатной температуре.
Для получения ИК-спектров с Фурье преобразованием первоначально измеряли 128 сканов базовой линии на воздухе с пустым кюветным отделением, затем записывали 128 сканов контроля (фосфатный буфер) или гидрогеназы в буфере. Измерения повторяли 2 раза, усредняли 2 спектра и получали спектр поглощения. Из ИК-спектра поглощения гидрогеназы вычитали ИК-спектр поглощения буфера, нормированный в максимуме полосы поглощения воды при ~2130 нм. Искажения базовой линии в полученном спектре корректировали в ручном режиме в программе Origin.
Спектры поглощения растворов гидрогеназы в области 350–600 нм измеряли на спектрофотометре “Shimadzu 1600” (“Shimadzu”, Япония). Концентрацию фермента определяли по поглощению при 400 нм с использованием для расчета коэффициента экстинкции: (ε400 = 42 мМ–1 · см–1).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Инактивирующее действие хлорида ртути на гидрогеназы проявлялось при всех изученных его концентрациях (рис. 1а). В присутствии 5 мМ HgCl2 степень ингибирования фермента достигала 90% в течение 2 ч. При уменьшении концентрации ингибитора кинетика инактивации была более медленной (рис. 1а).
Рис. 1.
Кинетика инактивации HydSL-гидрогеназы T. roseopersicina в 20 мМ фосфатном буфере, рН 7.0, в присутствии 1 (1), 3 (2) и 5 мМ (3) HgCl2 при 20°С (а): б − линериаризация данных в полулогарифмических координатах; в − зависимость наблюдаемой константы скорости реакции инактивации первого порядка от концентрации HgCl2 (константа скорости необратимого взаимодействия HgCl2 с ферментом равна 3.95 ± 0.41 М–1 · мин–1).
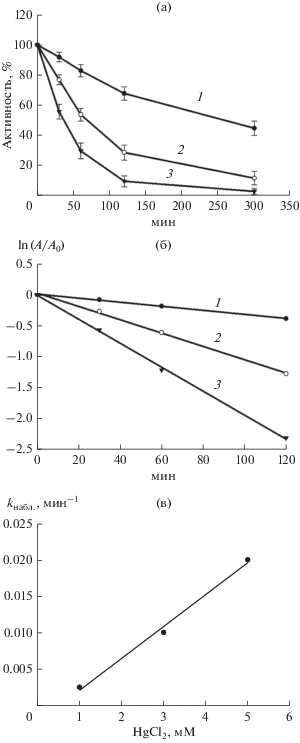
При значительном снижении концентрации ингибитора путем разбавления реакционной среды в 1000 раз восстановления активности фермента не наблюдалось, т.е. степень ингибирования не изменялась. Практически полное удаление HgCl2 при трехкратной промывке гидрогеназы на микроконцентраторах “Microcon10” (“Electro Terminal”, Германия, удаление соединений с массой <10 кДа) также не приводило к восстановлению активности фермента, что указывало на необратимый характер ингибирования.
Для определения количественных параметров ингибирования гидрогеназы HgCl2 измеряли кинетику его действия при 20 и 50°С. Взаимодействие гидрогеназы с этим ингибитором является необратимой бимолекулярной реакцией, которая характеризуется константой скорости реакции второго порядка kII. Кинетические кривые инактивации (рис. 1а, 1б) описываются уравнением первого порядка с кажущейся константой скорости реакции первого порядка kI, которая является функцией концентрации HgCl2. По тангенсу угла наклона линейной зависимости kI от концентрации HgCl2 (рис. 1в) определяли константу скорости реакции второго порядка, величина которой составляла 3.95 ± 0.41 М–1 · мин–1 при 20°С (рис. 1в) и увеличивалась до 17.5 ± 1.4 М–1 · мин–1 при 50°С (данные не приведены).
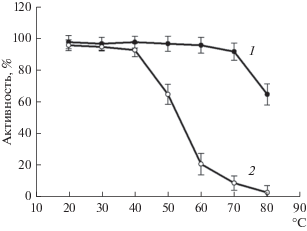
Как было показано ранее, HydSL-гидрогеназа из пурпурной бактерии T. roseopersicina BBS характеризовалась высокой термостабильностью, и еe инактивация наблюдалась при температуре выше 70°С [19]. Однако в присутствии 1 мМ HgCl2 стабильность этого фермента значительно снижалась. Так, при нагревании гидрогеназы в присутствии ингибитора в течение 10 мин происходила значительная инактивация уже при 50°С (рис. 2). При более длительном (>60 мин) нагревании при этой температуре происходила полная инактивация, фермент полностью терял активность, что указывало на совместный эффект инактивирующего действия нагревания и HgCl2.
Рис. 2.
Инактивация гидрогеназы (1 мг/мл) без добавления (1) и в присутствии 1 мМ HgCl2 (2) после нагревания при заданной температуре в течение 10 мин.
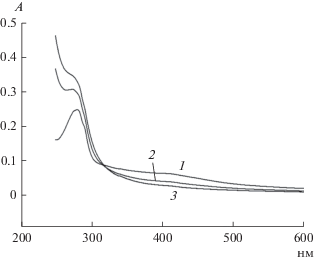
Железосерные кластеры в составе гидрогеназы обладают характерным поглощением в области 410 нм [12]. После длительной инкубации гидрогеназы с Hg2+ наблюдалось практически полное обесцвечивание этой полосы поглощения (рис. 3), что свидетельствовало о разрушении железосерных кластеров в составе фермента. При этом скорость обесцвечивания этой полосы близка кинетике инактивации гидрогеназы в присутствии Hg2+, что соответствовало полученным раннее данным о гидрогеназах из сульфатредуцирующих бактерий [13, 14].
Рис. 3.
Спектры нативной гидрогеназы с концентрацией 2.4 мг/мл (1) и после инкубации с 1 мМ HgCl2 в течение 1 (2) и 5 ч (3) при 20°С.
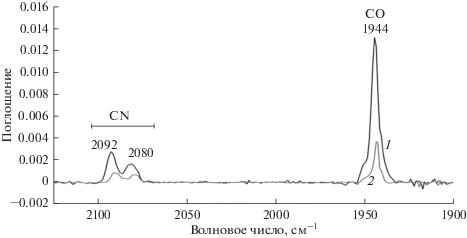
ИК-Фурье-спектры гидрогеназы T. roseopersicina проявляли характерные полосы для двухатомных лигандов, изменение которых при действии ингибитора может характеризовать состояние активного центра. Для проверки влияния хлорида ртути (II) на активный центр 1 мМ гидрогеназы инкубировали с ингибитором в течение 20 ч, а затем измеряли остаточную активность и регистрировали ИК-Фурье-спектры (рис. 4). Степень ингибирования гидрогеназной активности ионами ртути достигала приблизительно 75%, т.е. остаточная активность составляла 25%. Амплитуда пиков двухатомных лигандов в ИК-спектре гидрогеназы уменьшалась в 3.5 раза для всех трех пиков, причем положение полос лигандов не изменялось. Таким образом, полученные данные свидетельствуют о разрушении активного центра при ингибирующем действии Hg2+ (рис. 4). Неполная инактивация гидрогеназы при использовании 10 мМ хлорида ртути (II) и его инкубации с ферментом в течение 20 ч выглядит противоречащей предыдущим результатам рис. 1а, показавшим, что 5 мМ хлорид ртути (II) инактивировал более 95% активности в течение 5 ч. Однако учитывая, что при записи спектров FTIR использовалась высокая концентрация гидрогеназы (около 1 мМ), можно предположить, что использованной концентрации ингибитора было недостаточно для полного взаимодействия с гидрогеназой.
Рис. 4.
ИК-Фурье-спектры нативной гидрогеназы (концентрация ~100 мг/мл, 1) и после инкубации с 10 мМ HgCl2 в течение 20 ч (2) при 20°С.
На разрушение активного центра фермента при действии Hg2+ указывало также и отсутствие способности инактивированной гидрогеназы катализировать реакцию изотопного обмена водорода в системе Н2/D2O. Гидрогеназа проявляла высокую активность в реакции дейтериевого обмена без добавления ингибитора [20], а после взаимодействия с 1 мМ хлоридом ртути (II) в течение 24 ч активность фермента в реакции изотопного обмена водорода не обнаруживалась.
Ранее было показано, что гидрогеназа T. roseopersicina проявляла относительно высокую термостабильность и устойчивость к действию мочевины, детергентов, отдельных органических растворителей и протеолитических ферментов [19, 21, 22]. По устойчивости к таким каталитическим ядам как СО и H2S, фермент превосходит платину, которая широко используется в качестве водородактивирующего катализатора в топливных элементах [8]. Определение пределов устойчивости гидрогеназы к действию ряда других денатурирующих факторов, в том числе влиянию тяжелых металлов необходимо для разработки новых преобразователей энергии на основе этого активирующего водород фермента.
Химическая модификация отдельных функциональных групп гидрогеназы при действии различных ингибиторов позволит получить новую информацию о механизме ее каталитического действия. Газообразные ингибиторы (СО, О2 и С2Н2) обратимо взаимодействуют с активным центром, но не влияют на структуру фермента [23]. Взаимодействие цианида с гидрогеназой T. roseopersicina приводило к разрушению железосерных кластеров, но не влияло на структуру активного центра [7]. При длительной инкубации фермента с Hg2+ разрушались как железосерные кластеры, так NiFe-активный центр. В тоже время структура и размер пептидов (большой и малой субъединиц) не изменялись при такой обработке, на что указывало совпадение положения белковых зон при электрофорезе в ПААГ с Na-ДДС нативной и обработанной Hg2+ гидрогеназы (данные не приведены).
Таким образом, в данной работе показано, что ионы ртути (II) необратимо ингибировали HydSL гидрогеназу. При этом белковые субъединицы не разрушались, но деградировали железосерные кластеры и активный центр фермента.
Авторы выражают благодарность А.А. Забелину за содействие в регистрации и обработке ИК-Фурье-спектров гидрогеназы.
Список литературы
Vignais P., Billoud B. // Chem. Rev. 2007. V. 107. № 10. P. 4206–4272.
Yagi T., Higuchi Y. // Proc. Japn. Acad., Ser. B, Phys. Biol. Sci. 2013. V. 89. № 1. P. 16–13.
Shafaat H.S., Rudiger O., Ogata H., Lubitz W. // Biochim. Biophys. Acta. 2013. V. 1827. № 8–9. P. 986–1002.
Гоготов И.Н., Задворный О.А., Зорин Н.А., Серебрякова Л.Т. Фотосинтезирующие микроорганизмы / Ред. В.Ф. Гальченко. Труды Института микробиологии им. С.Н. Вернардского, № 15. М.: МАКС Пресс, 2010. С. 260–289.
Абдуллатыпов А.В., Цыганков А.А. // Компьютерные исследования и моделирование. 2013. Т. 5. № 4. С. 737–747.
Абдуллатыпов А.В., Зорин Н.А., Цыганков А.А. // Биохимия. 2014. Т. 79. № 8. Р. 1009–1014.
Zorin N.A., Zabelin A.A., Shkuropatov A.Ya., Tsygankov A.A. // J. Inorg. Biochem. 2017. V. 177. № 1. P. 190–197.
Laurinavichene T.V., Rakhely G., Kovacs K.L., Tsygankov A.A. // Arch. Microbiol. 2007. V. 188. № 4. P. 403–410.
Rakhely G., Laurinavichene T.V., Tsygankov A.A., Kovacs K.L. // Biochim. Biophys. Acta-Bioenergetics. 2007. V. 1767. № 6. P. 671–676.
Karyakin A.A., Morozov S.V., Karyakina E.E., Zorin N.A., Perelygin V.V., Cosnier S. // Biochem. Soc. Trans. 2005. V. 33. № 1. P. 73–75.
Воронин О.Г., Конищева Е.В., Зорин Н.А., Федотенков Ф.А., Карякина Е.Е., Карпачева Г.П., Орлов А.В., Киселева С.Г., Карякин А.А. // Нано- и микросистемная техника. 2013. Т. 5. № 1. С. 15–19.
Задворный О.А., Зорин Н.А., Гоготов И.Н. // Биохимия. 2000. Т. 65. № 11. С. 1525–1529.
Fernandez V.M., Rua M.L., Reyrs P., Cammack R., Hatchikian E.C. // Eur. J. Biochem. 1989. V. 185. № 3. P. 449–454.
Kamachi T., Uno S., Hiraishi T., Okura I. // J. Mol. Catal. A: Chemical. 1995. V. 96. № 3. P. 329–333.
Богоров Л.А. // Микробиология. 1974. Т.43. № 2. С. 326–333.
Шерман М.Б., Орлова Е.В., Зорин Н.А., Смирнова Е.А., Куранова И.П., Гоготов И.Н. // Докл. АН СССР. 1987. Т. 295. № 8. С. 509–512.
Gogotov I.N., Zorin N.A., Serebriakova L.T., Kondratieva E.N. // Biochim. Biophys. Acta. 1978. V. 523. № 2. P. 335–343.
Варфоломеев С.В., Гуревич К.Г. Биокинетика: Практический курс. / Ред. М.А. Островский, Г.Б. Сергеев. М.: ФАИР-ПРЕСС, 1998. 720 с.
Зорин Н.А., Гоготов И.Н. // Биохимия. 1982. Т. 47. № 5. С. 827–833.
Zorin N.A., Dimon B., Gagnon J., Gaillard J., Carrier P., Vignais P.V. // Eur. J. Biochem. 1996. V. 241. № 4. P. 675–681.
Serebryakova L.T., Zorin N.A., Karyakin A.A. // Enzyme Microb. Technol. 2009. V. 44. № 3. P. 329–333.
Kovacs K.L., Bagyinka Cs., Tigy G. // Biochim. Biophys. Acta. 1988. V. 935. № 2. P. 166–172.
Zorin N.A. // Biochimie. 1986. V. 68. № 1. P. 97–101.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


