Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 141-146
Выделение в гомогенном состоянии конститутивных изоферментов сукцинатдегидрогеназы из щитков кукурузы и исследование их характеристик
А. Т. Епринцев 1, *, Д. Н. Федорин 1
1 “Воронежский государственный университет”
394018 Воронеж, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 02.09.2019
После доработки 30.09.2019
Принята к публикации 01.11.2019
Аннотация
Применение модифицированной 4-стадийной схемы очистки позволило получить электрофоретически гомогенные препараты конститутивных форм сукцинатдегидрогеназы из щитков кукурузы на поздних стадиях прорастания. Установлено, что изоферменты значительно отличались четвертичной структурой. Так, сукцинатдегидрогеназа 1 оказалась гетеротетрамером, а сукцинатдегидрогеназа 2 – гетеродимером. Обнаружено, что их основные каталитические и кинетические характеристики также различались, в частности, их сродство к субстрату (сукцинат) и значение рН-оптимума катализируемой реакции. Сукцинатдегидрогеназа 2 отличалась повышенной устойчивостью к специфическому ингибитору, малонату.
Сукцинат:убихинон оксидоредуктаза (сукцинатдегидрогеназа, СДГ, КФ 1.3.5.1) представляет собой ферментный комплекс внутренней мембраны митохондрий, обеспечивающий функционирование электрон-транспортной цепи (ЭТЦ). СДГ принимает также участие в работе цикла Кребса, окисляя сукцинат с запасанием энергии в виде ФАДН. Обсуждается роль СДГ-системы в обеспечении других биосинтетических процессов клетки, в частности, глюконеогенеза, где она участвует в утилизации сукцината, образующегося в результате работы глиоксилатного цикла [1, 2]. Формирование набора изоферментов СДГ, участвующих в различных метаболических процессах клетки, обусловлено генетическим полиморфизмом этой ферментной системы, характерной для растений. Так, модельное растение Arabidopsis thaliana L. содержит в ядерном геноме 8 генов, кодирующих СДГ-систему [3]. Аналогичная ситуация характерна и для С4-растения кукурузы, в ядерном геноме которого также обнаружено 8 генов, кодирующих субъединицы СДГ [4].
Наличие в растениях значительного генетического полиморфизма СДГ позволяет клетке, с одной стороны, формировать набор изоферментов для обеспечения ее нормального функционирования, а, с другой – адаптироваться к стрессовым факторам. Ранее у кукурузы и арабидопсиса было обнаружено наличие на разных этапах развития растения нескольких молекулярных форм СДГ. Так, при прорастании семян в щитках кукурузы обнаруживаются 4 изофермента с различной электрофоретической подвижностью, различающиеся по кинетическим характеристикам [5]. Однако на всех этапах прорастания присутствуют две постоянные изоформы фермента, которые принято обозначать как конститутивные [5, 6]. Сходные данные были получены и для модельного объекта арабидопсиса, в семенах которого при прорастании также обнаружено 4 формы СДГ [7, 8]. Для определения их функциональной роли необходимо изучить их физико-химические и каталитические характеристики.
Установлено, что формирование изозимного полиморфизма обусловлено дифференциальной экспрессией генов, кодирующих СДГ-комплекс [6, 9]. В частности, гены его каталитического димера имеют сходную структуру и кодируют гомологичные белки, однако показана их дифференциальная экспрессия на разных этапах прорастания семян кукурузы и арабидопсиса [6, 8, 10].
Координация метаболических процессов при прорастании семян и переходе к фотосинтезу является основным механизмом регуляции клеточного метаболизма. Ферментные системы, в том числе СДГ, играют значительную роль в процессе зеленения проростков при изменении типа питания с гетеротрофного на автотрофный [11].
В связи с этим особый интерес представляет процесс прорастания жирозапасающих семян, в которых активно идет липолиз и последующий глюконеогенез из жирных кислот. Особый тип метаболизма был описан для щитка кукурузы, в котором помимо мобилизации запасных липидов происходит ацидификация эндосперма за счет экскреции органических кислот из щитка, что приводит к активации гидролаз и ускорению гидролиза запасных питательных веществ [12]. Ранее было показано, что в зависимости от степени масличности семян кукурузы и активности глиоксилатного цикла меняется изоферментный состав другого фермента цикла трикарбоновых кислот (ЦТК) – малатдегидрогеназы [13].
Получение препаратов СДГ на разных этапах развития семян и сравнительная характеристика их свойств откроет перспективы для изучения ее функциональной значимости в организации клеточного метаболизма. Изучение структуры и свойств изоферментов СДГ на поздних стадиях развития семян позволит установить их роль в организации метаболизма щитков при трансформации клеточного метаболизма с гетеротрофного типа питания на автотрофный.
Цель работы – выделение конститутивных изоферментов СДГ из щитков кукурузы на завершающей стадии прорастания и изучение их физико-химических и кинетических характеристик.
МЕТОДИКА
В качестве объектов исследования использовали щитки 8-суточных прорастающих семян кукурузы (Zea mays L.) сорта “Воронежская 76”, выращенных гидропонным методом при 12-часовом световом дне с интенсивностью света 25 Дж/(м2 с) при 20°С.
Активность фермента определяли на Т70+ UV-VIS спектрофотометре (“PG Instruments Limited”, Великобритания) спектрофотометрическим методом, основанном на использовании искусственных акцепторов электронов с соответствующим редокс-потенциалом [8]. Содержание белка в пробе определили по методу Лоури [14].
Для разделения изоферментов СДГ использовали схему очистки, включающую несколько стадий. Гомогенат получали из 2 г растительного материала, который гомогенизировали в соотношении 1 : 10 в среде для выделения, содержащей 50 мМ Трис-HCl-буфер, рН 7.5, и 2.5 мМ ЭДТА, 1 мМ КСl и 4 мМ MgCl2. Белки осаждали фракционированием сульфатом аммония 20–60% насыщения, осадок ресуспендировали в 10 мМ фосфатном буфере, рН 7.8. Полученные ферментные фракции наносили на колонку (1.5 × 20 см) с сефадексом G-25 (“Pharmacia”, Швеция) для освобождения от низкомолекулярных примесей. Объем наносимого раствора не превышал 3 мл. Белки элюировали 10 мМ фосфатным буфером, рН 7.8, содержащим 20 мМ сукцинат натрия, со скоростью 15–20 мл/ч. Ионообменную хроматографию проводили на колонке (1.5 × 12 см) с ДЭАЭ-целлюлозой (“Whatman”, Великобритания), уравновешенной 30 мМ фосфатным буфером, рН 7.8, содержащим 30 мМ KCl. Фермент десорбировали линейным градиентом концентрации KCl в 20 мМ фосфатном буфере, рН 7.8, содержащем 20 мМ сукцинат. Во фракциях (2 мл) определяли активность изоферментов СДГ.
Свойства изоферментов СДГ изучали, используя электрофоретически гомогенные препараты.
Электрофоретические исследования белков проводили в 7.5%-ном полиакриламидном геле [15]. Универсальное окрашивание белков в гелях осуществляли с помощью AgNO3 [16], для специфической идентификации СДГ использовали тетразолиевый метод и 0.1 М калий-фосфатный буфер, рН 7.5, содержащий 0.1 М сукцинат натрия, 0.5 мг/мл нитросинего тетразолия и 1 мг/мл феназин метасульфата.
Опыты проводили в 3–4-кратной повторности, аналитические определения для каждой пробы осуществляли в трех повторностях. Предварительная оценка характера распределения проводилась по асимметрии и эксцессу (Excel, Microsoft Office), а также с помощью критерия Колмогорова-Смирнова. Полученные значения позволили оценить характер распределения как нормальный. Критерий Стьюдента использовался с применением поправки на множественные сравнения (поправка Бонферрони) [17]. Дополнительно применялся однофакторный дисперсионный анализ ANOVA, который показал, что исследуемый в работе фактор действительно оказывал влияние (влияние фактора достоверно при p < 0.05).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
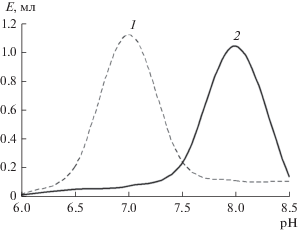
На начальных этапах прорастания семена осуществляют гетеротрофный тип питания, используя в качестве субстратов запасные вещества [9]. Значительное увеличение активности СДГ в первые сутки онтогенеза, вероятно, связано с необходимостью метаболизации дополнительного сукцината, образующегося в глиоксилатном цикле [18]. Снижение интенсивности функционирования СДГ после 4 сут прорастания происходит в результате перехода развивающегося растительного организма на автотрофный тип питания. В этом случае уменьшается интенсивность функционирования глиоксилатного цикла, приводя к снижению активности СДГ [7, 9].
В щитках кукурузы на 8 сут прорастания электрофоретическим анализом в полиакриламидном геле было обнаружено присутствие двух изоферментов СДГ с Rf 0.29 и 0.33 (рис. 1).
Рис. 1.
Изоферментный состав сукцинатдегидрогеназы щитков кукурузы на 8 сут прорастания: Р1 − первая изоформа, Р2 − вторая изоформа, F – фронт красителя.

Предыдущее изучение изоферментного состава СДГ позволило выявить индуцибельные и конститутивные формы фермента в щитках кукурузы. Так, оказалось, что изоферменты СДГ, мигрирующие в геле с Rf = 0.29 и 0.33, являются конститутивными, поскольку эти формы проявлялись в течение всего периода прорастания семян кукурузы [7]. Можно предположить, что они являются компонентами цикла Кребса и ЭТЦ митохондрий, принимающими участие в окислительном метаболизме при гетеротрофном типе питания. Ранее об интенсификации ЦТК на этом этапе развития кукурузы сообщалось в других работах [19, 20].
Можно предположить, что, начиная с 8 сут прорастания, процессы фотосинтеза становились достаточно активными и растение перешло к автотрофному типу питания, в то время как в щитках оставались активными две конститутивные изоформы СДГ, свойства и условия работы которых отличались от тех, в которых они функционировали при переходе к автотрофному типу питания (рис. 1).
Для получения электрофоретически гомогенных препаратов изучаемого фермента щитков кукурузы была проведена 4-стадийная очистка, результаты которой представлены в табл. 1. После десорбции изоферментов с ДЭАЭ-целлюлозы линейным градиентом концентрации KCl (50–250 мМ) были получены два препарата, обладающие сукцинатдегидрогеназной активностью. Удельная активность для первого изофермента (СДГ1) равнялась 1.130 Е/мг белка, при этом степень очистки составила 61.86 раз и выход – 9.44%. Для второго изофермента (СДГ2) значение удельной активности было 0.833 Е/мг белка, а степень очистки и выход – 45.61 раз и 5.07% соответственно (табл. 1).
Таблица 1.
Очистка сукцинатдегидрогеназы из щитков кукурузы (n = 4, p ≤ 0.05)
| Стадия очистки | Объем фракций, мл | Количество белка, мг | Общая активность, Е |
Удельная активность, Е/мг белка |
Выход, % | Степень очистки |
|---|---|---|---|---|---|---|
| Гомогенат | 10 | 74.05 | 2.30 | 0.034 | 100 | 1 |
| Фракционирование сульфатом аммония 20–60% | 6 | 6.86 | 0.86 | 0.125 | 37.42 | 3.68 |
| Гель-фильтрация на сефадексе G-25 | 4 | 3.85 | 0.95 | 0.240 | 41.34 | 13.14 |
| Хроматография на ДЭАЭ-целлюлозе | 1* 2 2** 2 |
0.19 0.14 |
0.22 0.12 |
1.130 0.833 |
9.44 5.07 |
61.86 45.61 |
Таким образом, ионообменная хроматография позволила разделить изоформы и получить изоферменты в высокоочищенном состоянии. Гомогенность полученных препаратов изоферментов СДГ подтверждена методом электрофореза в ПААГ.
Электрофорез в 7.5%-ном ПААГ с последующей окраской геля нитратом серебра показал гомогенность полученных ферментативных препаратов, о чeм свидетельствовало наличие только одной белковой полосы в каждом из них (рис. 2).
Рис. 2.
Электрофорез сукцинатдегидрогеназы из щитков кукурузы в 7%-ном ПААГ после окрашивания нитратом серебра (а) и специфического окрашивания на активность фермента (б): Р1 − первая изоформа, Р2 − вторая изоформа, F – фронт красителя.
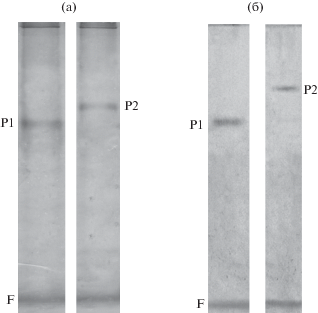
Компоненты, определенные после специфического проявления активности СДГ и окрашивания белка, совпадали и характеризовались мигрированием в геле с Rf, равным 0.28 и 0.34 для первой и второй форм соответственно. Таким образом, было установлено, что в щитке кукурузы на 8 сут прорастания семян присутствовали 2 формы фермента, а проведенный электрофорез в ПААГ показал, что выделенные из них ферменты были электрофоретически гомогенны (рис. 2).
С помощью специфического проявления активности СДГ, осуществленного тетразолиевым методом, было установлено, что белковые компоненты, обнаруженные на электрофореграммах, обладали сукцинатдегидрогеназной активностью (рис. 2б). При этом было показано присутствие в щитках кукурузы 4 изоформ фермента с Rf 0.28 и 0.34.
У арабидопсиса, модельного растительного объекта, СДГ в растительном организме кодируется набором генов, который может достигать 8. В связи с этим формирование множественных молекулярных форм этого фермента могло быть обусловлено различной дифференциальной экспрессией этих генов и комбинацией пептидных компонентов. Поэтому с целью установления набора входящих в состав полученных изоферментов белковых компонентов необходимо изучение их субъединичного строения.
Для изучения четвертичной структуры белковых молекул изоферментов СДГ из щитков кукурузы использовали метод электрофореза в присутствии денатурирующего агента – додецилсульфата натрия (ДДС-Na). Нативную молекулу каждой формы СДГ денатурировали ДДС-Na, что позволяло обнаружить присутствие субъединиц белка. Результаты электрофореза в ПААГ в присутствии ДДС-Na приведены на рис. 3. Было установлено субъединичное строение изоферментов СДГ и определена молекулярная масса отдельных субъединиц. При этом молекула СДГ2 содержала 4 субъединицы с различной молекулярной массой. Большая субъединица имела молекулярную массу 72 кДа, средняя – 37 кДа, малые 13 и 15 кДа. Таким образом, можно заключить, что исследуемая форма СДГ2 представляла собой гетеротетрамер.
Рис. 3.
Электрофорез изоферментов СДГ в ПААГ с ДДС-Na: Р1 – Р4 – субъединицы, М – белки- маркеры молекулярной массы (кДа): 1 – целлюлаза (94.6), 2 – бычий сывороточный альбумин (66.2), 3 – яичный альбумин (45), 4 – карбоангидраза (31), 5 – ингибитор трипсина (21.5) и 6 – лизоцим (14.4).

Изучение субъединичного строения молекулы СДГ1 показало, что она представляла собой гетеродимер и состояла из 2 субъединиц с молекулярными массами 72 и 37 кДа. Сопоставление этих данных с данными, полученными с помощью гель-хроматографии, позволило заключить, что обе формы изучаемого фермента являлись гетеропептидами.
Величины константы Михаэлиса для изоферментов СДГ из щитков кукурузы определяли по методу Лайнуивера-Берка в системе двойных обратных координат.
Было установлено, что для первой изоформы величина Kм соответствовала 0.38 мМ, а для второй изоформы – 0.14 мМ. Анализ полученных значений Kм свидетельствовал, что сродство второй изоформы СДГ к сукцинату было выше, чем для первой.
Изучение зависимости активности изоферментов СДГ от рН среды показало, что рН-оптимумы для СДГ1 и СДГ2 находились при 7.0 и 8.0 (рис. 4).
Показано также, что СДГ1 характеризовалась высокой каталитической активностью при более низком значении рН по сравнению со второй изоформой (рис. 5).
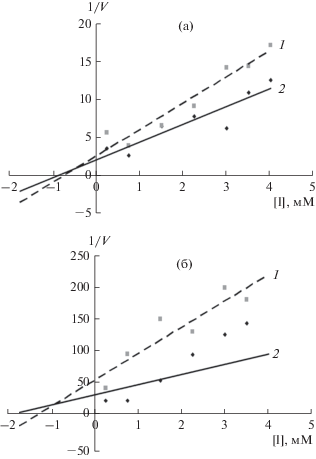
Рис. 5.
Определение константы ингибирования малонатом изофермента СДГ1 (а), СДГ2 (б) в присутствии 1 (1) и 2 мМ (2) сукцината натрия.
Изменения свойств изоферментов могли отражаться на их функционировании в щитках кукурузы в условиях изменения типа питания растений с гетеротрофного на автотрофный.
Ранее рядом исследователей было показано, что малонат является конкурентным ингибитором для СДГ, выделенной из различных организмов [20–22]. Было установлено, что Кi по малонату для СДГ1 составляла 0.5 мМ, при этом для СДГ2 данный показатель был выше и равнялся 0.95 мМ (рис. 5). Установлено, что малонат ингибировал скорость реакции у изоферментов СДГ из щитков кукурузы. При этом ингибирование изофермента СДГ2 происходило при более низких концентрациях малоната, что указывало на его большую чувствительность к ингибитору. Такая разница полученных значений констант ингибирования могла быть обусловлена разницей в структуре изучаемых изоферментов, связанной с их различной генетической детерминацией.
Было изучено влияние малоната на активность изоформ СДГ, поскольку в ряде работ [21, 22] он описывался как один из самых сильных конкурентных ингибиторов. Ранее было показано, что оксалоацетат является более сильным ингибитором СДГ, чем малонат. Это связывают с его защитной функцией против обратного тока электронов по дыхательной цепи митохондрий к первому комплексу, что имеет большое значение для снижения образования активных форм кислорода [23].
Таким образом, был разработан эффективный способ очистки изоферментов СДГ из щитков кукурузы на поздних этапах прорастания. Использование ионообменной хроматографии на ДЭАЭ-целлюлозе позволило разделить две изоформы СДГ. Изоферменты СДГ десорбировались с ДЭАЭ-целлюлозы при разных концентрациях хлорида калия, что могло указывать на различие структурной организации их полипептидных компонентов.
Электрофоретические исследования очищенных препаратов изоферментов СДГ показали, что каждый из них электрофоретически гомогенен.
Оказалось, что физико-химические свойства и кинетические характеристики выделенных изоферментов значительно различались. Установлены различия их четвертичной структуры. Так, изофермент СДГ1 представлял собой гетеротетрамер, а СДГ2 – гетеродимер. Это было подтверждено при определении молекулярных масс нативных изоферментов с помощью электрофореза в ПААГ с Na-ДДC.
Определены значения Км для СДГ1 и СДГ2. При этом наименьшее сродство к субстрату характерно для первой формы. Различные кинетические и каталитические характеристики изоформ свидетельствовали об их участии в катализе различных метаболических процессов.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 19-14-00150).
Список литературы
Епринцев А.Т., Попов В.Н., Шевченко М.Ю. Экспрессия и регуляция ферментов глиоксилатного цикла. Воронеж: Центр.-Черн. Книжное изд-во, 2005. 224 с.
Eprintsev A.T., Fedorin D.N., Sazonova O.V., Igamberdiev A.U. // Plant Physiol. Biochem. 2016. V. 102. P. 161–166.
Figueroa P., Leon G., Elorza A., Holuigue L., Araya A., Jordana X. // Plant Mol. Biol. 2002. V. 50. № 4–5. P. 725–734.
Millar A.H., Eubel H., Jänsch L., Kruft V., Heazlewood J.L., Braun H-P. // J. Plant Mol. Biol. Biotech. 2004. V. 56. № 1. P. 77–90.
Епринцев А.Т., Федорин Д.Н., Селиванова Н.В., Ахма-д Дж.А., Попов В.Н. // Известия РАН. Серия биологическая. 2010. № 3. С. 324–332.
Eprintsev A.T., Fedorin D.N., Karabutova L.A., Igamberdiev A.U. // J. Plant Physiol. 2016. V. 205. № 1. P. 33–40.
Епринцев А.Т., В.Н. Попов, Д.Н. Федорин. Сукцинатдегидрогеназа высших растений. Воронеж: Центр. Черн. Книжное изд-во, 2010. 184 с.
Попов В.Н., Епринцев А.Т., Федорин Д.Н. // Физиология растений. Т. 54. 2007. № 3. С. 409–415.
Епринцев А.Т., Федорин Д.Н., Селиванова Н.В., Ву Т.Л., Махмуд А.С., Попов В.Н. // Физиология растений. 2012. Т. 59. № 3. С. 332–340.
Elorza A., Roschzttardtz H., Go’mez I., Mouras A., Holuigue L., Araya A., Jordana X. // Plant Cell Physiol. 2006. V. 47. № 1. P. 14–21.
Eprintsev A.T., Fedorin D.N., Nikitina M.V., Igamberdiev A.U. // J. Plant Physiol. 2015. V. 181. № 1. P. 14–19.
Епринцев А.Т. Глиоксилатный цикл. Универсальный механизм адаптации? М.: Академкнига, 2007. 231 с.
Пинейру де Карвалью М.А.А., Землянухин А.А., Епринцев А.Т. Малатдегидрогеназа высших растений. Воронеж: Издательство ВГУ, 1991. 216 с.
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. // J. Biol. Chem. 1951. V. 193. № 1. P. 265–275.
Davis B.J. // Ann. N. Y. Acad. Sci. 1964. V. 121. № 2. P. 404–427.
Shevchenko A., Wilm M., Vorm O., Mann M. // Anal. Chem. 1996. V. 68. № 5. P. 850–858.
Лакин Г.Ф. Биометрия. М.: Высшая школа, 1990. 351 с.
Igamberdiev A.U., Eprintsev A.T. // Front Plant Sci. 2016. V. 15. № 7. P. 1042. https://dx.doi.org/10.3389%2Ffpls.2016.01042
Day D.A., Dry I.B., Soole K.L., Wiskich J.T., Moore A.L. // Plant Physiol. 1991. V. 95. № 3. P. 948–953.
Епринцев А.Т., Попов В.Н. Ферментативная регуляция метаболизма ди- и трикарбоновых кислот в растениях. Воронеж: Изд-во Воронеж. ун-та, 1999. 192 с.
Valls-Lacalle L., Barba I., Miró-Casas E., Alburquerque-Béjar J.J., Ruiz-Meana M., Fuertes-Agudo M., Rodríguez-Sinovas A., García-Dorado D. // Cardiovasc Res. 2016. V. 109. № 3. P. 374–384.
Belt K., Huang S., Thatcher L.F., Casarotto H., Singh K.B., Van Aken O., Millar A.H. // Plant Physiol. 2017. V. 173. № 4. P. 2029–2040.
Muller F.L., Liu Y., Abdul-Ghani M.A., Lustgarten M.S., Bhattacharya A., Jang Y.C., Van Remmen H. // Biochem J. 2008. V. 409. № 2. P. 491–499.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология