Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 156-164
Влияние белого фосфора на выживаемость, протеом и клеточную морфологию Aspergillus niger
А. З. Миндубаев 1, *, С. В. Кузнецова 2, В. Г. Евтюгин 2, А. Г. Даминова 2, Т. В. Григорьева 2, Ю. Д. Романова 2, В. А. Романова 2, В. М. Бабаев 1, Д. Н. Бузюрова 1, Э. В. Бабынин 2, Е. К. Бадеева 1, С. Т. Минзанова 1, Л. Г. Миронова 1
1 Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
420088 Казань, Россия
2 “Казанский (Приволжский) федеральный университет”
420008 Казань, Россия
* E-mail: mindubaev-az@yandex.ru
Поступила в редакцию 21.06.2019
После доработки 10.10.2019
Принята к публикации 01.11.2019
Аннотация
В работе исследовали механизмы устойчивости штаммов Aspergillus niger АМ1 и АМ2 к белому фосфору. Показано, что присутствие белого фосфора в концентрации 0.25% в среде мало влияло на соотношение живых и мертвых клеток при выращивании грибов, то есть устойчивость к токсиканту у грибов была достаточно высока. Методами электронной микроскопии установлено увеличение толщины клеточной стенки гриба, барьера на пути проникновения белого фосфора в клетку. Методом MALDI показан биосинтез новых белков-ферментов, которые могли участвовать в обезвреживании белого фосфора. Помимо этого, белый фосфор вызывал активацию метаболизма, сопровождающуюся ростом числа митохондрий в клетках.
Белый фосфор Р4 – один из самых опасных загрязнителей окружающей среды [1]. Вместе с тем, Р4 широко применяется в промышленности и при производстве лекарств, фосфорных удобрений, полимеров и ряда других важнейших веществ и материалов [2], что может приводить распространению этого токсиканта в окружающей среде. Протокол III к “Конвенции о конкретных видах обычного оружия” 1980 г. запрещает использование Р4 в военных целях. Однако запрет постоянно нарушается, что влечет за собой человеческие жертвы и значительное загрязнение окружающей среды. Эффективные методы очистки природных сред от этого загрязнителя до сих пор не созданы [3].
В то же время, фосфор обладает уникальными качествами: высокой токсичностью в виде простого вещества (Р4) и свойствами биогенного элемента, абсолютно необходимого всем живым организмам, в окисленном состоянии [4]. Чтобы найти эффективный и экологически безвредный способ окисления белого фосфора до фосфата, было предложено использование активных микроорганизмов, способных расти в присутствии этого токсиканта.
В настоящее время биодеградация – часто применяемый на практике метод для обезвреживания промышленных стоков, обогащенных неприродными веществами самых разнообразных классов, в том числе токсичных соединений [5, 6]. При биодеградации микроорганизмы осуществляют деструкцию ксенобиотиков, в результате чего они не попадают в окружающую среду . Известны способы биодеградации некоторых токсичных соединений фосфора, которые применяются на практике [7], однако для белого фосфора таких данных в литературе не найдено.
Ранее было показано, что микроорганизмы способны выживать при контакте с белым фосфором, адаптируясь к его присутствию в среде, превращая его при этом в менее токсичные соединения – кислородсодержащие соединения фосфора [8, 9].
Исследование биохимических механизмов устойчивости микроорганизмов к белому фосфору важно для разработки технологии его обезвреживания, выяснения влияния Р4 на микробный метаболизм, развитие адаптивных реакций и возможности его использования микроорганизмами в качестве биогенного элемента.
Цель работы − структурно-морфологические и протеомные исследования грибов Aspergillus niger АМ1 и АМ2, способных обезвреживать белый фосфор.
МЕТОДИКА
Подготовка проб. Для протеомного анализа споры грибов с поверхности агаризованной среды Aspergillus niger АМ1 и АМ2 [10] переносили в пробирки с 4 мл среды, следующего состава (г/л): NaCl − 2.5, MgSO4 − 0.5, KNO3 − 2.0, глюкоза − 8.0. В четырех пробирках в качестве источника фосфора использовали фосфаты (контроль), а в четырех других 0.25%-ную эмульсию белого фосфора (опыт). В контрольную среду в качестве источника фосфора вносили (г/л) K2HPO4 · 3H2O – 7.4, KH2PO4 – 2.38. Пробирки инкубировали 4 сут при 25°С до получения плотного мицелия на поверхности жидкой среды.
Белый фосфор в опыте был единственным источникам фосфора и вносился перед посевом. Эмульсию белого фосфора готовили следующим образом: 1 г белого фосфора Р4 диспергировали в 50 мл (концентрация 2%) стерильного физиологического раствора в ультразвуковой ванне “Сапфир” (Россия) 30 мин при 50°С. Концентрацию белого фосфора в среде рассчитывали после культивирования методом ЯМР, как описано ранее [11].
Описанную выше схему посева и культивирования использовали также при при микроскопическом исследовании мицелия.
Конфокальная микроскопия. Для проведения конфокальной микроскопии посев Aspergillus niger АМ1 и АМ2 проводили в шестилуночные планшеты, с жидкой средой, описанной выше. Мицелий извлекали из лунок планшета, переносили в пробирки Эппендорфа, окрашивали флуоресцентными красителями. и исследовали методом конфокальной микроскопии между покровными стеклами с использованием лазерного конфокального микроскопа Carl Zeiss LSM 780 (“Carl Zeiss”, Германия).
Для определения жизнеспособности грибных гиф в контрольном и опытном образцах двух штаммов использовали коммерческий набор красителей LIVE/DEAD®BacLightTM (“Thermo Fisher Scientific”, США). Мицелий окрашивали смесью красителей пропидиум йодид и SYTO 9 (“Thermo Fisher Scientific”, США), флуоресцирующих при разных длинах волн. Для этих красителей длины возбуждения и эмиссии 480/500 нм(SYTO 9) и 490/635 нм (пропидиум йодид) [12]. Интенсивность флуоресценции оценивалась при помощи программы ZEN 3.0 (ZEN lite), разработанной на фирме “Carl Zeiss”, позволяющей сравнивать на фотографиях количество пикселей интересующих цветов.
Электронная микроскопия. Для проведения электронной микроскопии мицелий гриба выращивали также в шестилуночных планшетах на описанной выше среде. Отобранный из лунок мицелий, промывали фосфатным буфером 3 раза и фиксировали по стандартному протоколу, основанному на обезвоживания и полимеризации материала в смоле Epon 812, как описано в работе [13].
Мицелий Aspergillus niger контрольного и опытного образцов двух штаммов фиксировали 12 ч в 1%-ном растворе глутарового альдегида, приготовленного на 0.1 М фосфатном буфере, pH 7.2. Далее фиксированные образцы переносили в 2.5%-ный раствор глутарового альдегида на 2 ч. Фиксацию проводили в 1%-ном растворе OsO4 с добавлением 25 мг/мл сахарозы в течение 2 ч. Образцы обезвоживали последовательно в серии растворов с увеличивающейся концентрацией этилового спирта, затем в окиси пропилена, после чего последовательно пропитывали в течение 24 ч эпоксидной смолой Epon 812 (“Fluka”, Швейцария) и окисью пропилена в соотношениях: 1 : 2, 1 : 1, 2 : 1.
Затем образцы помещали в чистую смолу и поэтапно проводили полимеризацию при температурах 37, 45 и 60°С, каждый этап в течение 24 ч. После фиксации, в соответствии с протоколом для электронной микроскопии, ультратонкие срезы клеток получали на микротоме Leica UC7 (“Leica”, Германия) и помещали на 3 мм медные сеточки и окрашивали 20 мин насыщенным водным раствором уранилацетата, а затем 5 мин цитратом свинца как описано в работе [14]. Срезы просматривали с помощью просвечивающего электронного микроскопа Hitachi HT 7700 Exalens (“Hitachi”, Япония) при ускоряющем напряжении 100 кэВ с разрешением 0.144 нм.
Разделение и анализ белков. Для извлечения белков из мицелия Aspergillus niger использовали метод экстракции, описанный ранее в статье [15], с некоторыми изменениями. Другие методы экстракции белка не подходили, так как для необходимо было разрушение содержащей хитин клеточной стенки гриба.
Для извлечения белков биомассу предварительно промывали водой и растирали в ступке с жидким азотом. Навеску мицелия массой 50 мг переносили в чистую микропробирку и добавляли 400 мкл 0.5 М Tрис-HCl (pH 8.3), 2%-ный вес/об. 3 – ((3-холамидопропил) диметиламмонио)-1-пропансульфонат, 20 мM MgCl 2%-ный вес/об. дитиотреитол, 1 мM фенилметилсульфонилфторид; 2.5% об./об. октилфенокси-поли(этиленокси)этанол. К раствору добавляли шарики из оксида циркония диаметром 0.1 и 0.5 мм для разрушения на гомогенизаторе “Fast Prep”( “MP Biomedicals”, США) в течение 30 с, с охлаждением на льду в течение 2 мин между повторами. Общее время гомогенизации составляло 3 мин. Полученный гомогенат центрифугировали 15 мин при 12 000 g и 4°С. Надосадочную жидкость переносили в чистую пробирку, белки из раствора осаждали добавлением 4 об. холодного раствора 10%-ной трихлоруксусной кислоты в ацетоне с 0.007% дитиотреитола. Образцы инкубировали на льду в течение 30 мин, а затем центрифугировали при 5000 g 20 мин и 4°С. Осадок промывали от трихлоруксусной кислоты охлажденным раствором 0.007%-ного дитиотреитола в ацетоне трижды. После чего осадок белков подсушивали 10 мин при комнатной температуре и перерастворяли в 50 мкл буфера, следующего состава: 7 М мочевина, 2 M тиомочевина, 3%-ный вес/об. 3 – ((3-холамидопропил) диметиламмонио)-1-пропансульфонат, 2%-ный вес/об. нонилфеноксиполиэтоксилэтанол, 10 мМ Трис–HCl, рН 8.5.
Концентрацию белка в растворе определяли модифицированным методом Лоури с бицинхониновой кислотой [16].
После определения концентрации белка отбирали аликвоты образцов так, чтобы в пробе содержалось по 150 мкг белка. Белки в пробах окрашивали 3 мкл 2 мМ раствора флуоресцентных красителей Су3 или Су5 (“Lumiprobe”, Россия) в диметилформамиде в течение 1 ч на льду в темноте, согласно инструкции производителя. Реакцию останавливали добавлением 2 мкл 10 мМ раствора лизина. Затем смешивали контрольный (выращенный в среде с фосфатом) и опытный (выращенный в среде с белым фосфором) образцы, доводили объем смеси до 300 мкл растворителем белка, следующего состава: 8 М мочевина, 3%-ный вес/об. 3 – ((3-холамидопропил) диметиламмонио)-1-пропансульфонат, 2%-ный вес/об. нонил феноксиполиэтоксилэтанол, 0.2% амфолитов с рН 3-10 (“GE Healthcare”, Швейцария), 50 мМ дитиотреитол, 10 мМ HCl, рН 8.5.
Далее проводили изоэлектрофокусирование белков на коммерческих IPG (immobilized pH gradient) -стрипах (“Bio-Rad”, 17 см, рН 3–10). Полученную смесь в объеме 300 мкл наносили на IPG стрип и проводили активную регидратацию под напряжением (13 ч), а затем 8 ч изоэлектрофокусирование на приборе “Protean i12 IEF cell” (“Bio-Rad”, США) в соответствии с рекомендациями производителя. После изоэлектрофокусировки стрипы инкубировали 10 мин в растворе, следующего состава: 6 М мочевина, 50 мМ Трис-HCl, pH 8.0, 30%-ный глицерин, 2%-ный додецилсульфат натрия и 30 мМ дитиотреитол, а затем еще 10 мин в растворе, содержащем 6 М мочевину, 50 мМ Трис-HCl, pH 8.0, 30%-ный глицерина, 2%-ный додецилсульфат натрия и 5%-ный йодацетамид. После изоэлектрофокусировки отмытый IPG-стрип использовали для разделения белков по массе методом электрофореза в градиентном полиакриламидном геле от 9 до 16% акриламида (20 × 18 см) в денатурирующих условиях в течение 5 ч при 10°С. Программа источника напряжения на 1 гель: 20 мин – 20 мА, 3 ч – 40 мА, 2 ч – 35 мА. Гели фиксировали в растворе 20%-ного изопропанола и 10%-ной уксусной кислоты.
Флуоресцентно окрашенные белковые пятна визуализировали с помощью высокоразрешающего лазерного сканера гелей “Typhoon FLA 9500” (“GE Healthcare”, Швейцария). Изображения гелей с флуоресцетно-окрашенными белковыми пятнами анализировали в программе ImageQuant (“GE Healthcare”, Швейцария), сравнивая интенсивность сигналов красок Су3 и Су5 одних и тех же белков. Изображения гелей сохраняли в электронном формате и использовали в качестве разметки для последующих этапов.
На следующем этапе работы все гели были окрашены серебром по стандартной методике, как описано в работе [17]. После чего из гелей было вырезано 30 белковых точек, интенсивности сигналов которых отличались от контроля (белковый профиль гриба, выращенного в среде с фосфатом). Вырезанные кусочки гелей с белком были отмыты от серебра раствором 30 мМ ферроцианид калия и 100 мМ раствора тиосульфата натрия. Гидролиз белков проводили с использованием трипсина (“Promega”, США), который добавляли к гелю в количестве 0.1 мкг в 5 мкл 50 мМ аммоний-бикарбонатного буфера. Инкубацию проводили при 37°С в течении 16 ч, реакцию останавливали добавлением 5 мкл 0.1%-ной трифторуксусной кислоты (ТФУ). Экстракцию полученных пептидов проводили на ультразвуковой бане. Полученные экстракты высушивали на центрифужном концентраторе “Concentrator plus” (“Eppendorf”, Германия) при 45°С.
Масс-спектрометрия пептидов. Пептиды растворяли в 0.1%-ном растворе ТФУ в воде. Масс-спектры получали на масс-спектрометре Ultraflex III TOF/TOF (“Bruker Daltonik GmbH”, Германия), оснащенном лазером Nd:YAG (λ = 355 нм, частота 100 Гц), в режиме рефлектрона с регистрацией положительно заряженных ионов. Масс-спектр был получен с ускоряющим напряжением 25 кВ и временем задержки экстракции ионов 30 нс. Итоговый масс-спектр был сформирован за счет 50-кратного облучения кристалла лазером. Использовалась металлическая мишень MTP (target plate ground steel). На мишень последовательно наносили и упаривали 0.5 мкл полунасыщенного раствора матрицы (2.5-дигидроксибензойная кислота ) в смеси ацетонитрил−0.1%-ный водный раствор ТФУ 7 : 3 об. и 2 мкл раствора образца в 0.1%-ном водном растворе ТФУ. После полного высушивания получали спектры пептидов в диапазоне от 700 до 3500 Да. Внутреннюю калибровку спектров проводили по пикам пептидов – продуктов автолиза (самогидролиза) трипсина. Для построения масс-листов использовали моноизотопные массы, идентификацию белков проводили с помощью программы MASCOT против базы данных Aspergillus, которая включает в себя нуклеотидные последовательности рода Aspergillus. В параметрах поиска указывали 1 возможный пропущенный сайт трипсинолиза, ошибка MS –0.3 Да, вероятная модификация – окисление метионина.
Данные были получены с помощью программы FlexControl (“Bruker Daltonik GmbH”, Германия) и обработаны с помощью программы FlexAnalysis 3.0 (“Bruker Daltonik GmbH”, Германия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
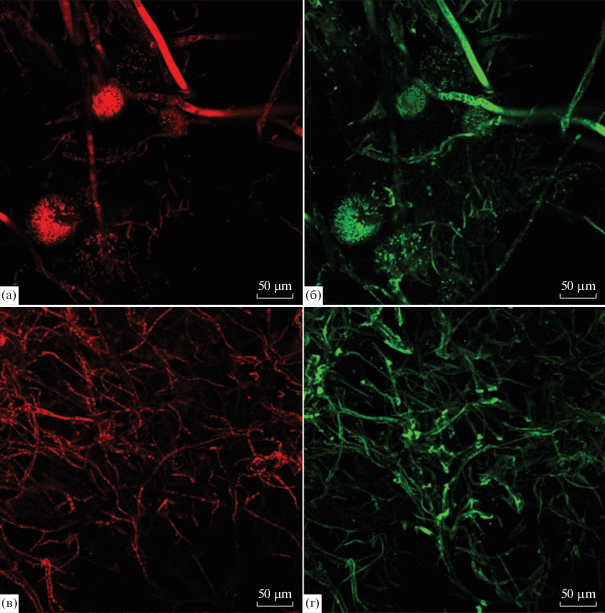
Для определения влияния белого фосфора на жизнеспособность клеток грибов A. niger АМ1 и АМ2 использовали метод конфокальной микроскопии. После обработки флуоресцентными красителями жизнеспособные гифы окрашивались в зеленый цвет, а мертвые – в красный. Можно было предположить, что в присутствии токсичного вещества соотношение количества мертвых клеток к живым будет выше по сравнению с контролем. Однако как показали результаты, это соотношение мало зависело от присутствия белого фосфора в среде. У штамма АМ1 в контроле (рис. 1а, 1б) интенсивность красной флуоресценции составила 17.620 ед. (рис. 1а), а зеленой 27.493 (рис. 1б). В опыте у АМ1 (рис. 1в, 1г) эти величины составили 24.707 (рис. 1в) и 34.022 соответственно (рис. 1г). Для штамма АМ2 в контроле интенсивность красной флуоресценции составила 24.172, зеленой 26.980 (рис. 2а, 2б), а в опыте 26.855 и 27.589 (рис. 2в, 2г) соответственно. То есть, как в контроле так и в присутствии Р4 у обоих исследуемых штаммов A. niger живые клетки преобладали над мертвыми. Таким образом, белый фосфор в исследуемой концентрации (0.25%) оказывал на выживаемость мицелия гриба незначительное влияние.
Рис. 1.
Изображения мицелия A. niger AM1, выросшего на среде с фосфатом (контроль, а, б), и на среде с белым фосфором (в, г), окрашенного пропидиум йодидом (а, в, мертвый мицелий, красная флуоресценция) и SYTO 9 (б, г, живые клетки, зеленая флуоресценция).
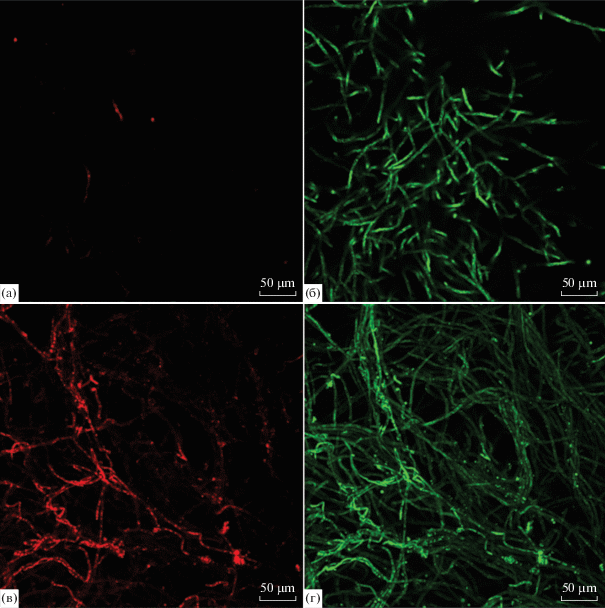
Рис. 2.
Изображения мицелия A. niger AM2, выросшего на среде с фосфатом (контроль, а, б) и на среде с белым фосфором (в, г), окрашенного пропидиум йодидом (а, в, мертвый мицелий − красная флуоресценция) и SYTO 9 (б, г, живые клетки − зеленая флуоресценция).
Исследование поперечных срезов клеток мицелия в электронном микроскопе показало, что клетки контрольного образца гриба имели электронноплотную цитоплазму с хорошо выявляемыми органеллами: митохондрии с кристами, шероховатый эндоплазматический ретикулум с рибосомами, вакуоли с электронно-прозрачным содержимым. На продольных септах и поперечных срезах гиф хорошо видна клеточная стенка гриба. Цитоплазматическая мембрана имела целостную структуру, без разрывов и повреждений. Также у части клеток наблюдались электронно-плотные включения запасных веществ (рис. 3). При воздействии белого фосфора наблюдалось увеличение плотности и толщины клеточной стенки (с 2.5–3 мкм в контроле до 5 мкм в опыте). Также значительно увеличивалось количество митохондрий в клетках гиф (рис. 3в), а на поверхности клеточной стенки появлялся дополнительный волокнистый слой, состоящий из протеогликанов [18]. При этом поверхность гиф становилась ворсистой, чего не наблюдалось в контроле (рис. 3а). В структуре клеточного содержимого изменений выявлено не было, никаких разрушений органелл, нарушений в структуре цитоплазматической мембраны и цитоплазме не наблюдалось.
Рис. 3.
ТЭМ изображение поперечного среза мицелия A. niger AM1(а) и АМ2(б), выращенных в среде с фосфатом и AM1, выращенного в среде с белым фосфором (в).
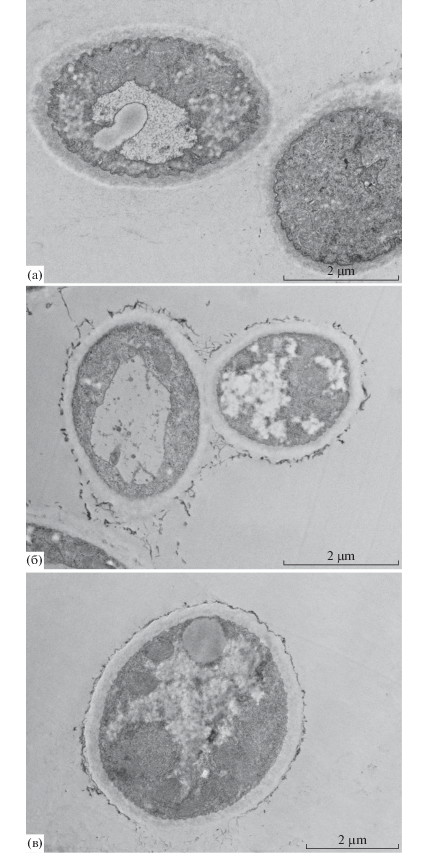
Следует отметить, что штамм А. niger АМ2 оказался более адаптированным к росту в присутствии белого фосфора по сравнению с исходным АМ1 [19], так как имел утолщенную клеточную стенку и развитый волокнистый слой даже в контроле при отсутствии белого фосфора в среде (рис. 3б). Штамм был отобран по признаку устойчивости к воздействию этого токсиканта, поэтому, вероятно такая структура поверхностности грибной клетки стала для отобранного штамма АМ2 его характерной морфологической осбенностью.
Исследования протеома А. niger АМ2 и АМ1 продемонстрировало некоторые различия в экспрессии генов и белковых профилях экстракта мицелия при выращивании гриба в отсутствии и присутствии белого фосфора. На рис. 4 представлены белковые профили в контрольном и опытном образцах после проведения двумерного электрофореза. После получения MALDI-спектров и обработки данных были идентифицированы белки № 6, 9 и 22, соответственно нумерации пятен белков на геле.
Рис. 4.
Сканированное изображение двумерного электрофореза протеома Aspergillus niger. Белки, экстрагированные из мицелия, выращенного на среде с фосфатами (контроль) окрашены красным, белки мицелия, выращенного на среде белым фосфором, – зеленым. Желтая флуоресценция – результат наложении белков контроля и опыта. Белыми кругами отмечены вырезанные для идентификации пятна белков.
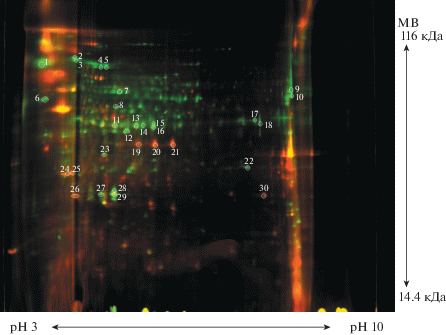
Белок № 6 − дигидронеоптеринальдолаза, участвующая в биосинтезе фолиевой кислоты и близких к ней птериновых коферментов. Вероятно, их присутствие стимулировало метаболические процессы и способствовало детоксикации белого фосфора и его токсичных производных [20, 21]. Белок № 9 − оксидоредуктаза, возможно, принимающая участие в окислении белого фосфора и его производных [22]. Белок № 22 оказался белком с неизвестной функцией. Его появление в ответ на действие белого фосфора дает основание предполагать, что, возможно, данный белок может участвовать в защите от стрессовых воздействий. Например, он может оказаться ферментом, участвующем в обезвреживании белого фосфора, или его транспорте внутрь клетки, а также одним из белков, инициирующих каскадный механизм реакции на стресс.
В предыдущих работах было показано, что все изучаемые штаммы A. niger обладали устойчивостью к Р4 и были способны использовать это вещество в качестве источника фосфора [23]. Следовательно эти штаммы имели защитные механизмы, позволявшие им проявлять устойчивость к этому токсичному загрязнителю окружающей среды. Устойчивость бактерий к присутствию в среде этого токсиканта была значительно ниже [23], по сравнению со штаммами A. niger АМ1. Возможно, большая устойчивость гриба была связана с его морфологическими особенностями, в первую очередь со строением клеточной стенки. Дальнейшие исследования с применением оптической и электронной микроскопией подтвердили данное предположение.
Конфокальная микроскопия показала, что белый фосфор в исследуемой концентрации (0.25%) оказывал незначительное влияние на жизнеспособность мицелия гриба. Электронная микроскопия продемонстрировала утолщение клеточных стенок гриба при его выращивании в присутствии белого фосфора, увеличение ее плотности, а также появление на наружной поверхности волокнистого слоя и увеличение числа митохондрий в гифах. Данные признаки, по-видимому, были связаны с защитой от внешних воздействий: клеточная стенка служит барьером, а митохондрии осуществляют энергетический обмен, поддерживая метаболическую активность. У адаптированного к присутствию белого фосфора штамма А. niger АМ2 эти признаки проявлялись постоянно, в том числе и в контроле.
Методом MALDI была показана существенная разница в генной экспрессии у грибов в контроле и опыте (в присутствии белого фосфора). Отмечено появление новых белков, не характерных для грибов этого вида. Один из белков обладал неизвестной функцией.
Представленная работа открывает возможность создания биологических методов обезвреживания белого фосфора. Помимо этого, в работе применены современные подходы к исследованию адаптации микроорганизмов к новым веществам, обладающим высокой токсичностью.
Авторы выражают благодарность Фонду содействия инновациям за финансовую поддержку проекта № 39113 (заявка № С1-34299).
Лазерная конфокальная микроскопия и просвечивающая электронная микроскопия проводились на базе Междисциплинарного центра “Аналитическая микроскопия” КФУ. Масс-спектрометрические исследования проведены в ЦКП-САЦ ФИЦ КазНЦ РАН.
Список литературы
Duerksen-Hughes P., Richter P., Ingerman L., Ruoff W., Thampi S., Donkin S. Toxicological Profile for White Phosphorus. U.S. Department of Health and Human Services. USA. 1997. 248 p.
Gleason W. // JOM. 2007. V. 59. № 6. P. 17–19.
Walsh M.E., Collins C.M., Racine C. Persistence of White Phosphorus Particles in Sediment / US Army Cold Regions Research and Engineering Lab Hanover New Hampshire 1995. 51 p.
Cummins C.C. // Daedalus. 2014. V. 143. №.4. P. 9–20.
Хоменков В.Г., Шевелев А.Б., Жуков В.Г., Загустина Н.А., Безбородов А.М., Попов В.О. // Прикл. биохимия и микробиология. 2008. Т. 44. № 2. С. 133–152.
Миндубаев А.З. // Экологический вестник Северного Кавказа. 2018. Т. 14. № 1. С. 11–23.
Singh B.K., Walker A. // FEMS Microbiol. Rev. 2006. V. 30. № 3. P. 428–471.
Миндубаев А.З., Волошина А.Д., Бабынин Э.В., Бадее-ва Е.К., Хаяров Х.Р., Минзанова С.Т., Яхваров Д.Г. // Экология и промышленность России. 2018. Т. 22. № 1. С. 33–37.
Миндубаев А.З., Бабынин Э.В., Бадеева Е.К., Пискунов Д.Б., Махиянов А.Н., Минзанова С.Т., Миронова Л.Г., Волошина А.Д. // Известия вузов. Прикладная химия и биотехнология. 2019. Т. 9. № 1. С. 81–94.
Миндубаев А.З., Волошина А.Д., Акосах Й.А. // Экологический вестник Северного Кавказа. 2019. Т. 15. № 1. С. 51–57.
Миндубаев А.З., Волошина А.Д., Бадеева Е.К., Хаяров Х.Р., Яхваров Д.Г. // Российский журн. прикладной экологии. 2018. Т. 1. № 13. С. 28–32.
Gorshkov V., Petrova O., Gogoleva N., Gogolev Y. // FEMS Immunol. Med. Microbiol. 2010. V. 59. № 3. P. 378–385.
Бисерова Н.М. Методы визуализации биологических ультраструктур. Практическое руководство для биологов. Москва: Издательство КМК, 2013. 110 с.
Reynolds E.S. // J. Cell Biol. 1963. V. 17. № 1. P. 208–212.
Bhadauria V., Peng Y.-L. // Indian J. Microbiol. 2010. V. 50. № 1. P. S127–S131.
The Protein Protocols Handbook: Second Edition. / Ed. J.M. Walker. The Bicinchoninic Acid (BCA) Assay for Protein Quantitation. Totowa, New Jersey: Humana Press, 2002. P. 11–14.
Lelong C., Chevallet M., Luche S., Rabilloud T. // Methods Mol. Biol. 2009. V. 519. P. 339–350.
Kang X., Kirui A., Muszyński A., Widanage M.C.D., Chen A., Azadi P., Wang P., Mentink-Vigier F., Wang T. // Nat.Commun. 2018. V. 9. №. 2747. P. 1–12.
Миндубаев А.З., Волошина А.Д., Хаяров Х.Р., Сахапов И.Ф., Бадеева Е.К., Стробыкина А.С., Валидов Ш.З., Бабаев В.М., Минзанова С.Т., Миронова Л.Г., Акосах Й.А., Яхваров Д.Г. // Бутлеровские сообщения. 2017. Т. 51. № 8. С. 1–26.
Adams N.E., Thiaville J.J., Proestos J., Juárez-Vázq-uez A.L., McCoy A.J., Barona-Gómez F., Iwata-Reuyl D., de Crécy-Lagard V., Maurelli A.T. // MBio. 2014. V. 5. № 4. e01378-14. P. 1–14.
Maita N., Okada K., Hatakeyama K., Hakoshima T. // PNAS. 2002 . V. 99. № 3. P. 1212–1217.
Harriff M.J., Danelishvili L., Wu M., Wilder C., McNamara M., Kent M.L., Bermudez L.E. // J. Bacteriol. 2009. V. 191. № 4. P. 1132–1142.
Миндубаев А.З., Бабынин Э.В., Бадеева Е.К., Кабирова Г.К., Синицина А.А., Шайхутдинов Р.К.-У., Шарипов А.А., Минзанова С.Т., Миронова Л.Г., Акосах Й.А. // Бутлеровские сообщения. 2018. Т. 56. № 11. С. 1–24.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


