Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 165-173
Изучение деградации N-фенил-2-нафтиламина бактериями Rhizobium leguminosarum bv. viciae, Pseudomonas syringae pv. pisi, Clavibacter michiganensis sps. sepedonicus
Л. Е. Макарова 1, *, А. С. Мориц 1, Н. А. Соколова 1, И. Г. Петрова 1, А. А. Семенов 1, Л. В. Дударева 1, М. С. Третьякова 1, А. В. Сидоров 1, 2
1 Сибирский институт физиологии и биохимии растений СО РАН
664033 Иркутск, Россия
2 Иркутский государственный медицинский университет Минздрава России
664003 Иркутск, Россия
* E-mail: makarova@sifibr.irk.ru
Поступила в редакцию 28.03.2019
После доработки 27.08.2019
Принята к публикации 30.08.2019
Аннотация
Изучен состав ароматических соединений в жидкой культуральной среде и в клетках бактерий Rhizobium leguminosarum bv. viciae, Pseudomonas syringae pv. pisi, Clavibacter michiganensis sps. sepedonicus, выращенных в присутствии негативного аллелопатического соединения N-фенил-2-нафтиламина (N-ФНА), обнаруженного в корневых экссудатах бобовых культур. Показано, что основные продукты его деградации N-ФНА − фталаты. Бактерии могут активно секретировать их во внешнюю среду и преобразовывать одни виды фталатов в другие путем изменения в их молекулах алкильных группировок, связанных эфирной связью с о-фталевой кислотой. Исследуемые бактерии различались по скорости деградации N-ФНА (10 и 100 мкМ), который по разному влиял на их жизнеспособность и рост. Предложены возможные механизмы регуляции состава бактерий и их численности в ризосфере бобовых растений N-ФНА и фталатами, секретируемыми корнями в экссудаты, а также фталатами, образовавшимися при деградации N-ФНА в клетках бактерий.
По современным представлениям регуляция растительно-микробных взаимоотношений и регуляция межвидового взаимодействия микроорганизмов в ризосфере растения осуществляются при участии секретируемых растением во внешнюю среду различных по структуре соединений, включая ароматические компоненты растительных экссудатов [1–4]. Механизмы этой регуляции с участием ароматических соединений растительного происхождения до сих пор недостаточно изучены, но как полагают, их функции в растительной ризосфере многообразны [2–5].
Среди ароматических соединений, с которыми можно связывать негативную регуляцию растительно-микробных взаимодействий особый интерес могут вызывать вещества, которые накапливаются в биосфере и имеют одновременно техногенное и биотическое происхождение. К числу таких соединений относятся N-фенил-2-нафтиламин (N-ФНА) и фталаты, которые в настоящее время причислены к опасным для живых организмов веществам [6–10].
N-ФНА относят к алкалоидам необычного строения [11, 12]. Данное соединение производится предприятиями химической промышленности и находит применение в производстве красителей и других органических химических веществ, в качестве антиокислителя резины, полимеров, в смазках, а также в смазочных и трансформаторных маслах, используется в качестве стабилизатора в электроизоляционных эмалях. Биотическое происхождение этого соединения доказано наличием его в тканях нескольких видов наземных и у двух представителей водных растений [12–18]. При этом у некоторых из этих растений N-ФНА нашли в составе компонентов корневых экссудатов [17, 18]. Данные о биосинтезе N-ФНА в клетках растений и микроорганизмов в литературе в настоящее время отсутствуют. Для оценки роли N-ФНА в ризосфере растения следует обратиться к результатам работ [18–20], доказывающих его негативный эффект на рост ризосферных бактерий.
Имеющиеся в настоящее время в литературе данные [21–23] указывают на существенные различия путей деструкции N-ФНА в клетках животных и бактерий. У бактерий при деструкции N-ФНА, по-видимому, основными конечными продуктами являются фталаты [23].
Фталаты попали в поле зрения исследователей с начала 70-х гг. 20-го столетия, когда обнаружилось накопление данных соединений в окружающей среде в связи с их широким применением в химической промышленности: в производстве пластмасс в качестве пластификаторов, для получения косметических средств и др. [24]. В клетках бактерий были выявлены фталаты, установлены основные пути биодеструкции этих соединений [26], определены предшественники их образования − полициклические ароматические углеводороды (ПАУ) [25–27]. Один из двух путей биодеградация ПАУ, приводящий к образованию о-фталевой кислоты, чаще всего выявляли у представителей таких родов бактерий, как Pseudomonas, Rhodococcus, Bacillus, Acinetobacter, Sphingomonas, Micrococcus, Burkholderia [27–30]. Результаты исследований более поздних исследований указывают на самостоятельный биосинтез фталатов в клетках некоторых видов бактерий [31, 32]. Этот путь биосинтеза фталатов у бактерий пока не исследован, но в бактериальных клетках имеются возможности для синтеза бензольного кольца из углеводов по шикимовокислотному пути [33].
Фталаты в тканях растений, а также в составе их корневых экссудатов обнаружены сравнительно недавно [18, 34, 35]. Результаты исследований [18, 31, 36, 37] раскрывают действие фталатов, секретируемых в ризосфере растений, в качестве ингибиторов роста бактерий. Степень негативного воздействия фталатов на клетки бактерий, очевидно, определяется не только их концентрацией в среде, но и видом алкильных группировок в их молекулах, которые соединены эфирной связью с о-фталевой кислотой, а также видом бактерий, подвергающихся их действию [31, 37]. В некоторых случаях причину подавления и даже гибели бактериальных клеток связывали с накоплением в них о-фталевой кислоты, как конечного продукта при деградации полициклических соединений [38]. Возможно, это происходит из-за нарушения этерификации о-фталевой кислоты, приводящей к образованию фталатов. Стимулирование роста бактерий фталатами возможно при наличии в клетках ферментных систем, позволяющих высвобождать из эфиров о-фталевую кислоту и далее метаболизировать ее с подключением β-кетоадипатного пути расщепления бензольного кольца до образования интермедиатов цикла Кребса [26, 28, 39 ] .
Результаты приведенных выше работ позволяют предположить, что N-ФНА и фталаты в ризосфере секретирующих их растений, могут иметь большое значение в регуляции концентрации бактерий и их агрегации в виде биопленок на поверхности корней, а также в поддержании видового состава бактерий в ризомикробиоте. Механизмы этой регуляции, вероятно, связаны со скоростью деградации N-ФНА и чувствительностью к действию образующихся при этом фталатов. Возникающие под действием абиотических факторов изменения в составе фталатов, секретируемых растением [42], также могут влиять на ризосферные бактерии. Возможности для негативного влияния N-ФНА на метаболомную систему бактерий обусловлены легким проникновением его в клетки, вследствие высокой степени липофильности [8] и высокой антиоксидантой активности [23].
Цель работы − исследование состава продуктов деградации N-ФНА в ризосфере растений и их влияния на рост и жизнеспособность бактерий.
МЕТОДИКА
Объекты исследований. В экспериментах использовали бактерии Rhizobium leguminosarum bv. viciae (Rhiz), штамм 245а (получен из ВНИИСХМ, Пушкин, Россия), Pseudomonas syringae pv. pisi (Psp), штамм 1845 и Clavibacter michiganensis sps. sepedonicus (Cms), штамм 6889 из коллекции Центра коллективного пользования “Биоресурсный центр” Сибирского института физиологии и биохимии растений СО РАН (Иркутск, Россия).
Бактерии выращивали на твердых агаризованных средах, составленных по прописи из работы [41]. Суспензию с клетками (смыв с твердого субстрата) переносили в конические колбы с жидкой минимальной средой, приготовленной, как описано в работе [42], для 1-суточной адаптации, а также для использования в экспериментах по изучению влияния веществ на рост бактерий. При исследовании продуктов деструкции N-ФНА в клетках бактерий в среде для выращивания отсутствовали другие источники углерода. При сравнении скорости деструкции N-ФНА и преобразований дибутил- и диоктилфталатов бактериями для стимуляции увеличения биомассы бактерий в среду вносили 0.1% глюкозы.
Бактерии выращивали в колбах на роторной качалке без освещения при температуре 20–22°С. Титр бактерий в средах в начале экспериментов при исследованиях деградации N-ФНА составлял 1.5 × 103 кл./мл, а при изучении влияния на рост бактерий – 4.5 × 103 кл./мл. Титр определяли по оптической плотности среды с бактериями, измеренной на планшетном спектрофотометре “Immunochem-2100” при 675 нм (“High Technology Inc.”, США).
Изучение роста бактерий. Рост бактерий в присутствии 10 или 100 мкМ N-ФНА (коммерческий препарат, “Sigma”, США) контролировали по показателям КОЕ, измеряли титр по оптической плотности при 675 нм.
Для измерения количества КОЕ суспензию из колб высевали на твердые агаризованные среды. Твердые среды для ризобий и псевдомонад готовили, как описано в работе [41]. Среда для бактерий Cms готовилась на отваре из клубней картофеля с добавлением 10 г/л дрожжевого экстракта, 10 г/л глюкозы, 20 г/л агара (pH 7.0.).
Процент жизнеспособных клеток в составе аутоагрегатов бактерий, присутствовавших в культуральных средах, определяли по флуоресценции после обработки последовательно, 0.5%-ным пропидий йодидом (маркер для мертвых клеток), затем 50 мМ флуоресцеин диацетатом (маркер для живых клеток). Для просмотра бактерий-содержащих суспензий использовали инвертированный микроскоп “Axio Observer” (“Carl Zeiss Microsco-py”, Германия). Определяли процент живых клеток от общего количества клеток в составе плавающих в культуральной жидкости аутоагрегатов (скопление бактерий, погруженных в слизистую матрицу) на 10-ти случайно взятых полях.
Получение экстрактов, содержащих ароматические продукты деструкции N-фенил-2-нафтиламина из культуральных сред и бактерий. Выросшую культуру центрифугировали при 8000 g в течение 20 мин при 4°С. Из супернатанта ароматические соединения экстрагировали этилацетатом после подкисления 2 н HCl до рН 3.0–4.0. Осадок с клетками бактерий трехкратно промывали 20 мМ Трис-НСl-буфером, рН 8.0, содержащем 25 мкМ дитиотриетол и после каждой промывки клетки переосаждали (при 4°С). Клетки последовательно осаждали центрифугированием при 10 000 g (20 мин.), при 16 000 g (30 мин.) и при 20 000 g (30 мин.), используя центрифуги моделей “Avanti J-26 XP JLA” 10.500 и “Allegra TM-64” (“Beckman Coulter”, США). Осадок бактерий в небольшом объеме того же буфера помещали в холодильник на –70°С. Перед разрушением ультразвуком 0.2–0.5 г бактериальной массы отмывали от остатков буфера небольшим объемом бидистиллята. После центрифугирования при 5000 g 20 мин и 4°С осадок бактерий переносили в 5 мл свежего бидистиллята в стеклянные стаканчики для разрушения ультразвуком в ледяной бане. Полученный после обработки ультазвуком гомогенат переносили в конические колбы на 100 мл в 50 мл бидистиллята и после подкисления 2 н. HCl до рН 4.0 экстрагировали ароматические соединения этилацетатом.
Полученные экстракты упаривали досуха в вакууме в темноте, сухие остатки перерастворяли в небольших объемах этилацетата (для ГХ-МС-анализа) или метанола (для ВЭЖХ-анализа), и помещали в стеклянные бутылочки.
Анализ состава ароматических соединений методом ГХ-МС. Для изучения состава соединений методами ГХ-МС-анализа использовали экстракты культуральных сред и клеток бактерий. Анализ образцов проводили методом ГЖХ с масс-спектрометрическим детектором с использованием хромато-масс-спектрометра “7000QQQTripleQuad/7890A MSD/DS” (“Agilent Technology”, США). Объем вводимой пробы 0.2 мкл, температура испарителя 250°С, источника ионов 230°С, детектора 150°С, линии, соединяющей хроматограф с масс-спектрометром, 280°С. Диапазон сканирования 50–600 а. е. м. Капиллярная колонка HP-5MS (30 м × × 0.250 мм × 0.50 мкм), неподвижная фаза – 5%‑ный фенилметилполисилоксан. Градиент температуры: от 100 до 280°С со скоростью 5°С/мин, 2 мин при 280°С, затем от 280 до 340°С со скоростью 5°С/мин. Подвижная фаза – гелий, скорость потока газа 1 мл/мин. Режим разделения потоков 5 : 1. Способ ионизации – электронный удар (ЭУ), энергия ионизации: 70 эВ. Анализ проводили в режиме регистрации полного ионного тока (SCAN). Для идентификации анализируемых соединений использовали библиотеки масс-спектров NIST08 и WILEY7, а также проводили сравнение с аутентичными образцами бис (2-этил-гексил) фталата (синоним – диоктилфталат), диэтилфталата (“Sigma–Aldrich”, Германия) и дибутилфталата (“Реахим”, Россия).
Определение содержания N-ФНА методом ВЭЖХ. Сравнение скорости деградации бактериями N‑ФНА, внесенного в среды до концентрации 100 мкМ, проводили через 2 сут выращивания. Этилацетатные экстракты получали из культуральных жидкостей (КЖ), после отделения клеток бактерий центрифугированием при 8000 g в течение 20 мин при 4 оС. Экстракты упаривали досуха, в остатке, растворенном небольшим объемом метанола, методом ВЭЖХ определяли количество N-ФНА. ВЭЖХ-анализ осуществляли на хроматографе “Shimadzu LC-10ATvp” с УФ-детектором (“Shimadzu”, Япония,). Разделение содержавшихся в экстрактах фенольных компонентов проводили на колонке Perfect Bond, 250 × × 4.6 мм, 5 мкм в возрастающем градиенте А:В от 30 до 90% в течение 80 мин при скорости 0.5 мл/мин. А- ацетонитрил, В – 0.2 н. перхлорат Li в 0.1%-ном водном растворе трифторуксусной кислоты, рН 4.0. Объем пробы, вносимой на колонку – 5 мкл, детектирование при 280 нм. Количественные расчеты производили по адсорбционным профилям с использованием калибровочного графика, построенного для разных концентраций N-ФНА с величиной достоверности аппроксимации R2 = 0.96. Показатели времени удерживания N-ФНА в адсорбционных профилях исследуемых экстрактов подтверждали УФ-спектрами, полученными в остановленном потоке элюента.
Статистическая обработка данных. Полученные результаты обрабатывали статистически, с вычислением средних значений и стандартных отклонений для них. Эксперименты проводили в трех биологических повторностях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В табл. 1 представлены результаты исследования состава ароматических продуктов, образующихся при деградации 100 мкМ N-ФНА в КЖ и клетках бактерий, методом ГХ-МС. По значениям относительных показателей площадей пиков соединений (S, %, табл. 1) среди продуктов деструкции N-ФНА преобладали фталаты. При этом содержание фталатов (сумма S, %) в экстрактах из КЖ, превосходило содержание их в экстрактах из клеток бактерий, что свидетельствовало о секреции этих соединений во внешнюю среду (КЖ) клетками бактерий. Среди фталатов, идентифицированных в экстрактах из КЖ, самый больший процент приходился на дибутилфталат (табл. 1). В меньшем количестве бактерии секретировали в среду диоктил- и диэтилфталаты.
Таблица 1.
Состав продуктов деструкции 100 мкМ N-ФНА в этилацетатных экстрактах из КЖ и клеток бактерий после 2 сут культивирования
| Соединение | Место обнаружения | tуд., мин | Ver., % | S, % | ||
|---|---|---|---|---|---|---|
| Rhiz | Psp | Cms | ||||
| 1.2.3.4-тетрагидро-нафталин | Клетки | 5.121 | 21.1 | 0.23 | 0.03 | 0 |
| 2-метил-1,2,3,4,-тетрагидро-нафталин | Клетки | 6.024 | 20.1 | 0.13 | 0.02 | 0 |
| 6-метил-1,2,3,4,-тетрагидро-нафталин | Клетки | 6.945 | 40.9 | 0.24 | 0.03 | <0.01 |
| 1,7-диметил-нафталин | Клетки | 10.159 | 17.7 | 0.28 | 0.04 | 0 |
| Бутил-надецилфталат | Клетки | 19.677 | 13.3 | 0 | 0.01 | 0 |
| Диэтилфталат | Среда | 14.338 | 71.0 | 1.32 | 1.55 | 0.9 |
| Дибутилфталат | Клетки | 21.651 | 43.6 | 0.43 | 0.39 | 0.09 |
| Среда | 4.28 | 2.82 | 3.96 | |||
| Диоктилфталат | Клетки | 31.586 | 60.1 | 0.28 | 0.27 | 0.21 |
| Среда | 0.62 | 0.6 | 0.68 | |||
Примечание: tуд. – время удерживания, Ver, % – вероятность, S, % – относительная площадь пика. (S, % для N-ФНА в каждом из экстрактов принята за 100). Приведены средние показатели для S, % (стандартные отклонения для них не превышали 10% от средних значений) из трех экспериментов. Rhiz–Rhizobium leguminosarum bv. viciae; Psp – Pseudomonas syringae pv. pisi; Cms – Clavibacter michiganensis sps. Sepedonicus.
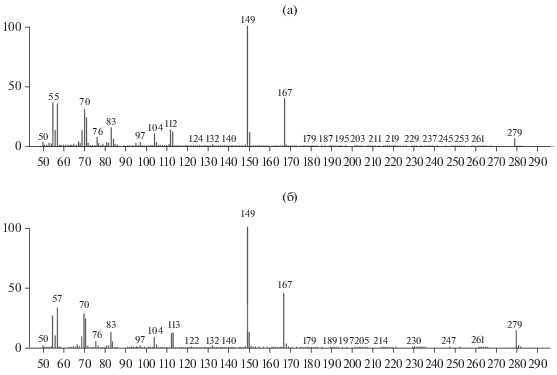
Все перечисленные выше виды фталатов идентифицированы по степени вероятной сходимости с данными для этих соединений из библиотеки NIST08 (см. табл. 1, 2) и при сравнении ионных спектров исследуемых соединения и их аутентичных образцов (рис. 1). Диэтилфталат обнаружен только в КЖ, что может указывать на более активную, по сравнению с другими видами фталатов, секрецию его из клеток бактерий во внешнюю среду. Необходимо отметить, что данный вид фталата не выявлялся в КЖ среди продуктов деструкции 10 мкМ N-ФНА [23]. Появление диэтилфталата среди продуктов деградации N-ФНА может указывать на изменения в катаболической цепи превращений данного субстрата при его высокой концентрации
Таблица 2.
Состав ароматических соединений, идентифицированных методами ГХ-МС-анализа в этилацетатных экстрактах из культуральной среды бактерий, выращенных 1 сут в присутствии 10 мкМ дибутилфталата*
| Соединение | tуд., мин | Ver, % | S, % | |
|---|---|---|---|---|
| Rhiz | Psp | |||
| Диизононилфталат | 35.303 | 69.3 | 0 | 1.37 ± 0.17 |
| Бутил-8-метилнонил фталат | 26.999 | 12.4 | 6.09 | 0 |
| Бутил-надецил фталат | 27.008 | 17.6 | 0 | 4.21 ± 0.06 |
| Бутил-тетрадецил фталат | 19.792 | 21.2 | 0.50 ± 0.06 | 0 |
| Дибутилфталат | 21.731 | 34.8 | 95.78 ± 2.6 | 100 ± 0.00 |
| Диоктилфталат | 31.639 | 45 | 100 ± 0.00 | 4.05 ± 0.03 |
| Фталевый ангидрид | 8.007 | 74.3 | 0.37 ± 0.05 | 0.05 ± 0.01 |
* Обозначения как в табл. 1.
Рис. 1.
Масс-спектры образца бис(2-этилгексил)фталата (диоктилфталат) (а) и экстракта из КЖ и клеток бактерий (б), выращенных в присутствии N-ФНА.
Только в экстрактах из клеток найдены соединения нафталиновой структуры (табл. 1): четыре у Rhizobium leguminosarum bv. viciae (Rhiz) и Pseudomonas syringae pv. pisi (Psp) и одно – у Clavibacter michiganensis sps. sepedonicus (Cms). В клетках всех видов бактерий, выросших на N-ФНА и без него, обнаружен небольшой процент азотсодержащего одноядерного ароматического соединения – дифениламина, синтез которого в клетках бактерий, очевидно, не связан с деградацией N-ФНА.
В работе [39 ] приведены примеры преобразования бактериями одних видов фталатов в другие путем изменения размеров алкильных цепочек, связанных эфирной связью с о-фталевой кислотой. Данные ГХ-МС-анализа в табл. 2 для экстрактов КЖ, полученных через 1 сут культивирования бактерий Rhizobium и Pseudomonas с 10 мкМ дибутилфталата, позволили обнаружить у этих бактерий способность к преобразованию дибутилфталата по появлению в среде других видов фталатов. Соотношение площадей пиков для дибутилфталата и фталатов, образовавшихся из дибутилфталата (см. табл. 2), позволяет сравнить активность процесса преобразования фталатов у ризобий и псевдомонад. Степень изменения этого соотношения в сторону вновь появившихся фталатов свидетельствует о более высокой активности преобразования дибутилфталата в другие видов фталатов у ризобий. Более активными, по сравнению с псевдомонадами, оказались ризобии и при трансформации диоктилфталата (данные не представлены). Оба вида бактерий обнаруживали значительно меньшую активность в преобразовании данного субстрата, по сравнению с дибутилфталатом. Оказалось, что даже после 2-суточного выращивангия с 10 мкМ диоктилфталата в экстрактах КЖ обоих видов бактерий суммы площадей пиков для образовавшихся из него дибутил-, бутил-тетрадецил- и диметилфталатов относительно диоктилфталата составляли у ризобий 4.4%, у псевдомонад – менее 2.0%.
При оценке значения N-ФНА и фталатов при негативной регуляции формирования растительно-микробных взаимодействий важны показатели их влияния на рост бактерий и агрегацию бактерий в биопленки. Известно, что интеграция в биопленки позволяет бактериям быть защищенными от внешних воздействий и, возможно, способствовать поверхностной колонизации корней. Из результатов работ [18–20] следует, что для заметного подавления роста бактерий Cms необходима в 5 раз более высокая концентрация N-ФНА, чем для микросимбионтов гороха Rhizobium и Pseudomonas. В табл. 3 и на рис. 2 приведены данные по влиянию N-ФНА на те же виды бактерий, рост которых в планктонной культуре осуществлялся в условиях олиготрофного питания в минимальной жидкой среде с 0.1% углеводов или без них (при изучении состава продуктов в клетках бактерий). Отсутствие дополнительных углеводов в среде требовалось для более корректной оценки катаболизма бактериями изучаемого ароматического соединения, а фенольные соединения, образующиеся в клетках из углеводов, могли изменить показатели [33]. Условия олиготрофного питания обеспечивали рост бактерий, но по сравнению с условиями роста в богатой органическими соединениями среде приводили к уменьшению длительности стационарной фазы роста и к гибели большой части клеток [19, 20]. Об этом свидетельствовали результаты определения процента жизнеспособных клеток в среде (табл. 3), которые снижались на 2 сут культивирования по мере расходования углеводородных источников питания, и показателей КОЕ. Рассчитанные по показателям КОЕ относительные показатели роста бактерий (рис. 2), свидетельствовали о различной степени негативного действия N-ФНА на рост исследуемых видов бактерий в 1 и 2 сут культивирования, и об усилении ингибирования их роста при концентрации 100 мкМ. Ингибирование ростовых процессов у симбионтов гороха (ризобии и псевдомонады) в 1 сут более выражено по сравнению с Cms. На 2 сут заметна разница между исследуемыми видами бактерий по степени ингибирования их размножения только при концентрации N-ФНА 100 мкМ, при этом в наибольшей мере подавлялся рост бактерий Cms.
Таблица 3.
Процент жизнеспособных клеток в составе аутоагрегатов бактерий в планктонных культурах без внесения (контроль) и с внесением в среду 10 и 100 мкМ N-ФНА
| Вариант | Период экспозиции, сут |
Вид бактерий* | ||
|---|---|---|---|---|
| Rhiz | Psp | Cms | ||
| Контроль | 1 | 8.2 ± 1.7 | 15.0 ± 4.7 | 17.5 ± 3.5 |
| 2 | 4.0 ± 1.6 | 8.0 ± 1.6 | 10.0 ± 2.6 | |
| 10 мкМ N-ФНА |
1 | 3.2 ± 1.2 | 4.8 ± 2.2 | 11.0 ± 3.2 |
| 2 | 1.0 ± 0.0 | 5.5 ± 2.6 | 1.8 ± 0.9 | |
| 100 мкМ N-ФНА |
1 | 3.0 ± 0.7 | 3.5 ± 1.2 | 4.0 ± 1.6 |
| 2 | 0.5 ± 0.0 | 0.5 ± 0.0 | 0.8 ± 0.3 | |
Рис. 2.
Влияние N-ФНА в концентрации 10 (I) и 100 (II) мкМ на рост бактерий на 1 (1) и 2 (2) сут роста бактерий на среде с N-ФНА. Rhiz–Rhizobium leguminosarum bv. viciae; Psp – Pseudomonas syringae pv. pisi; Cms – Clavibacter michiganensis sps. sepedonicus.
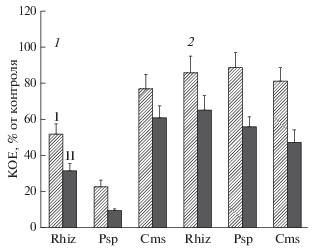
Повышение относительных показателей роста бактерий на вторые сутки экспозиции (рис. 2) могут указывать на появление среди продуктов распада N-ФНА соединений, которые могут быть для клеток и источником углерода, и стимулировать рост. Такое заключение можно было сделать при наблюдении за накоплением биомассы бактерий, хотя и очень слабым, когда в среды не вносили углеводный источник питания, а N-ФНА был единственным источником углеводорода. Возможно, что в данном случае у бактерий для образования необходимых для их роста метаболитов происходила индукция ферментов деградации бензольного фрагмента, отщепленного от молекулы N-ФНА. Предполагаемый процесс расщепления бензольного кольца, вероятно, осуществляется по пути альтернативному фталатному, поскольку подтверждений полного распада фталатов в КЖ и в клетках исследуемых видов бактерий не было получено. Одним из подтверждений может быть присутствие в изучаемых экстрактах конечного ароматического продукта распада фталатов по β-кетоадипатному пути − протокатеховой кислоты [26]. Однако данное вещество не было найдено ни в одной из исследуемых нами КЖ, куда вместе с бактериями вносили N-ФНА.
В обсуждаемых экспериментах рост исследуемых видов бактерий, по-видимому, зависел от особенностей катаболизма N-ФНА в их клетках, скорости деградации данного субстрата до образования фталатов. Как следует из рис. 3, скорость деградации N-ФНА при его концентрации в среде 100 мкМ наиболее высокая у ризобий, немного ниже она у псевдомонад и самая низкая у бактерий Cms. Следует отметить, что за 2-суточный период наблюдений при указанной концентрации N-ФНА суммарное содержание фталатов в клетках и КЖ, определенное по относительным показателям площадей пиков (S, %), у исследуемых бактерий составляла 5.6–7.0% (от площади пика для N-ФНА). Различия в скорости деструкции N-ФНА у исследуемых видов бактерий не приводили к заметной разнице в содержании фталатов, хотя их количество в среде как и скорость деструкции N-ФНА были наибольшими у ризобий (табл. 1).
Рис. 3.
Содержание N-ФНА (% в среде относительно содержания в КЖ без бактерий) в КЖ через 2 сут выращивания. Rhiz–Rhizobium leguminosarum bv. viciae; Psp – Pseudomonas syringae pv. pisi; Cms – Clavibacter michiganensis sps. sepedonicus.
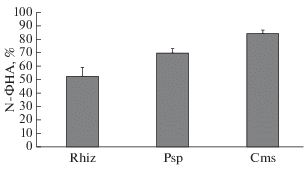
Сопоставление относительных показателей площадей пиков для фталатов в КЖ бактерий из табл. 1 с данными табл. 4 позволяет увидеть разницу в скорости деградации N-ФНА при концентрациях вещества в средах 10 и 100 мкМ. Сотношение суммарного содержания фталатов к N-ФНА показывает, что оно более высокое при концентрации субстрата 10 мкМ. При этой концентрации N-ФНА в КЖ с ризобиями содержание фталатов превышало содержание деградируемого субстрата в 3.5 раза, в среде с псевдомонадами – в 1.3 раза, а в КЖ с Cms фталаты составляли только 22% от количества N-ФНА (табл. 4). По-видимому, при 10 мкМ в большей степени, чем при 100 мкМ N-ФНА активизированы процессы деструкции с образованием фталатов и выведение их из клеток во внешнюю среду. Полученные результаты позволяют заключить, что при концентрации 100 мкМ одновременно с усилением ингибированием роста бактерий (рис. 2), ингибируется и процесс катаболизма N-ФНА в бактериальных клетках. Показатели соотношения площадей пиков, указывающие на активность катаболизма N-ФНА у исследуемых видов бактерий, позволяют предположить различные механизмы действия N-ФНА на метаболические процессы бактерий при его различных концентрациях. Вероятно, при повышенной аккумуляции N-ФНА в бактериальных клетках идет торможение метаболических процессов, чему могут способствовать высокая липофильность и высокая антиоксидантная активность этого соединения [8, 22]. Предполагают также, что в результате свободного прохождения N-ФНА через мембраны и значительного накопления его в клетках, а также высокой активности соединения может происходить нарушение структуры мембран [8].
Таблица 4.
Состав продуктов деструкции 10 мкМ N-ФНА в этилацетатных экстрактах из ростовой среды бактерий после 1 сут экспозиции
| Соединение | tуд., мин | Ver., % | S, % | ||
|---|---|---|---|---|---|
| Rhiz | Psp | Cms | |||
| Фталевый ангидрид | 10.159 | 42.4 | 0.32 | 0.19 | 0.65 |
| Бутил-тетрадецил фталат | 19.677 | 21.2 | – | – | 2.28 |
| Дибутилфталат | 21.651 | 43.6 | 3.21 | 74.04 | 19.33 |
| N-фенил-2-нафтиламин | 26.743 | 68.8 | 30.23 | 100 | 100 |
| Диоктилфталат | 31.586 | 60.1 | 100 | 60.13 | – |
| Диизононилфталат | 32.499 | 56.7 | 1.16 | – | – |
Примечание. tуд., Ver, %, S, % как в табл. 1. Приведены средние показатели для S (%), стандартные отклонения для них не превышали 10% от средних значений.
Сведения для фталатов, характеризующие механизмы их действия на метаболические процессы живых клеток, в настоящее время в литературе отсутствуют. Тем не менее, для дибутил-, диоктил- и диэтилфталатов, образующихся из N-ФНА в клетках исследуемых нами видов бактерий (табл. 1), результаты работ [30, 31, 37, 43, 44] позволяют оценить их влияние на ростовые процессы разных видов бактерий. Дибутилфталат для многих видов бактерий может быть стимулятором размножения, а возможность его полной деградации этими бактерий [30], позволяет использовать его в качестве источника углерода для них.
В работе [37] показано, что эффект фталатов на бактерии может зависеть от их химической структуры, от состояния бактерий (находятся они в планктонной культуре или в виде биопленок), а также от их видовой принадлежности. Одни и те же концентрации дибутилфталата (10, 20, 30 мкМ) в разной степени стимулировали рост патогенных бактерий Cms и Pectobacterium carotovorum ssp.carotovorum при глубинном выращивании, но подавлял образование биопленок. При глубинном выращивании в присутствии диоктилфталата наблюдали зависимое от концентрации подавление роста бактерий Cms и стимуляцию некротрофных бактерий P. carotovorum. У обоих видов бактерий процесс формирования биопленок ингибировался, но при этом у Cms – начиная с концентрации 10 мкМ, а у P. carotovorum – только при концентрациях 20 и 30 мкМ.
Антибиотические свойства диоктилфталата и диизононилфтатата по отношению к достаточно широкому ряду бактерий были показаны в работах [31, 43]. Появление диизононилфталата в ризосфере растений гороха вероятно при преобразовании дибутилфталата бактериями Pseudomonas, а также в результате его секреции корневыми клетками растения при неблагоприятных условиях среды [40].
Роль высокотоксичного диэтилфталата в негативной регуляции растительно-микробных взаимодействий может определяться его участием в деструкции липопротеиновых комплексов живых клеток [44].
В приведенной выше работе [37] показаны стимуляция роста бактерий в планктонной культуре при действии дибутилфталата и ингибирование его при действии диоктилфталата. В настоящей работе было установлено различное действие внесенного в ростовую среду дибутилфталата (10 мкМ) на рост в ризобий и псевдомонад в 1 и 2 сут культивирования. Оказалось, что титр клеток относительно контроля возрастал в 1 сут выращивания у ризобий в 1.5 раза, у псевдомонад – в 1.3 раза. На 2 сут, возможно в результате выхода в среду к концу 1 сут диоктилфталата при выращивании ризобий, а в среде с псевдомонадами диоктил- и диизононилфталатов (табл. 2), происходило ингибирование роста этих бактерий в 1.7 и 1.3 раза соответственно. Можно утверждать, что для трех изучаемых нами видов бактерий диоктилфталат являлся ингибитором роста. Вместе с данным соединением в подавлении роста псевдомонад вероятно участвовал и диизононилфталат, негативное действие которого на бактерии были отмечены в работе [43].
Полученные нами результаты показывают, что исследуемые виды бактерий способны деградировать N-ФНА с разной скоростью, в то же время данное соединение в различной степени ингибировало рост бактерий.
Результаты исследования высоких концентраций ризобий на ростовые процессы проростков гороха [45] указывают на важность регуляции со стороны растения концентрации этих бактерий в его ризосфере для устранения излишней инфекционной нагрузки с помощью различных соединений. Участие N-ФНА и фталатов возможно при регуляции концентрации клеток в ризосфере гороха не только при инокуляции Rhizobium leguminosarum bv. viciae, проникающих в корни бобового растения, но и при инокуляции Pseudomonas syringae pv. pisi, не инфицирующих корни гороха, но поражающих его надземные органы.
Чувствительным к действию тех же соединений оказался процесс формирования биопленок у трех исследуемых видов бактерий [19, 20, 37], их колонизирующая активность (формирования биопленок на поверхности корней) регулируется с участием N-ФНА и фталатов.
Наиболее активными по скорости деградации N-ФНА и образования фталатов из исследованных видов бактерий оказались R. leguminosarum. Можно предположить, что этот микросимбионт растений гороха играет большую роль в контролировании видового состава ризосферной микробиоты. Этот контроль может осуществляться с помощью секретируемых производных фталатов, образовавшихся из N-ФНА и появившихся при преобразовании фталатов, присутствующих в корневых экссудатах корневых клеток растения [18, 40].
Таким образом, приведенные выше результаты позволяют предположить, что N-ФНА и фталаты, образующиеся из N-ФНА при участии ризосферных бактерий и присутствующие в составе корневых экссудатов растения, вероятно, могут участвовать в регуляции взаимоотношений между растением и бактериями. Неоднозначное действие N-ФНА и фталатов на различные виды бактерий может быть определяющим для селекции видов в составе микробиоты в ризосфере растительных культур, синтезирующих эти соединения.
Работа выполнена на оборудовании Центра коллективного пользования (ЦКП) “Биоаналитика” Сибирского института физиологии и биохимии растений СО РАН (Иркутск, Россия).
Список литературы
D’Arcy–Lameta A. // Plant and Soil. 1986. V. 92. № 1. P. 113–123
Shaw L.J., Morris P., Hooker J.E. // Environmental Microbiolo-gy. 2006. V. 8. № 11. P. 1867−1880.
Makoi J.H.J.R., Ndakidemi P.A. // African J. Biotechnol. 2007. V. 6. № 12. P. 1358−1368.
Кузмичева Ю.В., Шапошников А.И., Азарова Т.С., Петрова С.Н., Наумкина Т.С., Борисов А.Ю., Белимов А.А., Кравченко Л.В., Парахин Н.В., Тихонович И.А. // Физиология растений. 2014. Т. 61. № 1. С. 121–128.
Hassan S., Mathesius U. // J. Exp. Botany. 2012. V. 63. № 9. P. 3429−3444.
Brack W., Altenburger R., Ensenbach U., Möder M., Segner H., Schüürmann G. // Archives of Invironmental Contamination and Toxicology. 1999. V. 37. № 2. P. 164−174.
Hauser R., Calafat A.M. // Occup Environ Med. 2005. V. 62. № 11. P. 806−818.
Altenburger R., Brak W., Greco W.R., Groot M., Jung K., Ovari A., Riedl J., Schwab K., Kữster E. // Environ. Sci. Technol. 2006. V. 40. №. 19. P. 6163−6169.
Mankidy R., Wiseman S., Ma H., Giesy J.P. // Toxicol. Letters. 2013. V. 217. P. 50−58.
Ma T., Teng Y., Christie P., Luo Y. // Front. Environ. Sci. Eng. 2015. V. 9. № 2. P. 259−268.
Paul L. Schiff Jr. Alkaloids: Chemical and Biological Perspectives. V. 11. N.Y.: Pergamon Press, 1996. P. 1−236.
Yu R., Li B.-G., Ye Q., Zhang G.-l. // Natural Product Research. 2005. V. 19. № 4. P. 359−362.
Султанходжаев М.Н., Таджибаев М.М. // Химия природных соединений. 1976. Т. 12. № 3. С. 406.
Евстратова Р.И., Запесочная Г.Г. // Химия природных соединений. 1977. № 4. С. 582.
Жанаева T.A., Кривощекова О.Е., Семенов А.А., Минаева В.Г. // Химия природных соединений. 1989. Т. 25. № 3. С. 377.
Shi D.Y., Han L.J., Sun J., Wang Y., Yang Y.C., Shi J.G., Fan X. // Zhongguo Zhong Yao Za Zhi., 2005. V. 30. № 5. P. 347−350.
Wu Z.B., Zhang S.H., Wu X.H., Cheng S.P., He F. // A-llelopathy J. 2007. V. 20. № 2. P. 327−338.
Макарова Л.Е., Смирнов В.И., Клыба Л.В., Петрова И.Г., Дударева Л.В. // Прикл. биохимия и микробиология. 2012. Т. 48. № 4. С. 394–403.
Ломоватская Л.А. Макарова Л.Е., Кузакова О.В., Романенко А.С., Гончарова А.М. // Прикл. биохимии микробиология, 2016. Т. 52. № 3. С. 306–311.
Ломоватская Л.А., Гончарова А.М., Макарова Л.Е., Филинова Н.В., Романенко А.С. // Прикл. биохимия и микробиология. 2018. Т. 54. № 3. С. 313–319.
Weiss T., Bolt H.M., Schlüter G., Koslitz S., Taeger D., Welge P., Brüning T. // Arch. Toxicol. 2013. V. 87. № 7. P. 1265–1272.
Marek E.V., Koslitz S., Weiss T., Fartasch M., Schlüter G., Käfferlein H.U. Brüning T. // Arch Toxicol. 2017. V. 91. № 11. P. 3587–3596.
Макарова Л.Е., Мориц А.С. Фенольные соединения: функциональная роль в растениях // Сб. научн. статей по материалам X межд. симпозиума “Фенольные соединения: фундаментальные и прикладные аспекты”. М.: PRESS-BOOK.RU, 2018. С. 258–262.
Keyser P., Pujar B.G., Eaton R.W., Ribbons D.W. // Environmental Health Perspectives. 1976. V. 18. P. 159–166.
Kiyohara H., Nagao K. // J. Gen. Microbiol. 1978. V. 105. № 1. P. 69–75.
Пунтус И.Ф., Филонов А.Е., Ахметов Л.И., Карпов А.В., Боронин А.М. // Микробиология. 2008. Т. 77. № 1. С. 11–20.
Seo J.S., Keum Y.-S., Li Q.X. // Int. J. Environ. Res. Public Health. 2009. V. 6. P. 279–309.
Eaton R.W., Ribbons D.W. // J. Bacteriol. 1982. V. 151. № 1. P. 48-57.
Chang H.K., Zylstra G.J. // J. Bacteriol. 1998. V. 180. № 24. P. 6529-6537.
Liang D.-W., Zhang T., Fang H.H.P., He J. // Appl. Micro-biol. Biotechnol. 2008. V. 80. № 2. P. 183–198.
Alim Al-Bari M.A., Sayeed M.A., Rahman M.S., Mossadik M.A. // Research J. Medical Sciences. 2006. V. 1. № 2. P. 77–81.
Babu B., Wu J.-T. // Science of the Total Environment. 2010. V. 408. № 21. P. 4969–4975.
Parke D., Ornston L.N. // J. Bacteriol. 1986. V. 165. № 1. P. 288–292.
Husein A.I., Ali-Shtayeh M.S., Jamous R.M., Jondi W.J., Zatar N.A-A. // Int. J. Curr. Res. Aca. Rev. 2014. V. 2. № 9. P. 195–203.
Семенов А.А., Еникеев А.Г., Снеткова Л.В., Пермяков А.В., Соколова Н.А., Дударева Л.В. // Докл. Академии наук. 2016. Т. 471. № 3. С. 366–367.
Kim S.-J., Kim S.-I., Han Y.-S. // Corean J. Gerontology. 1997. V. 7. № 3. P. 70–76.
Шафикова Т.Н., Омеличкина Ю.В., Еникеев А.Г., Бояркина С.В., Гвильдис Д.Э., Семенов А.А. // Докл. Академии наук. 2018. Т. 480. № 3. С. 381–383.
Krishnan S., Prabhu Y., Phale P.S. // Indian J. Biochem. & Biophysics. 2004. V. 41. № 5. P. 227–232.
Пастухова Е.С., Егорова Д.О., Ястребова О.В., Плотникова Е.Г. // Вестник Пермского ун-та. Биология. 2010. № 3. С. 24–28.
Макарова Л.Е., Мориц А.С., Соколова Н.А., Нестеркина И.С. Механизмы устойчивости растений и микроорганизмов к неблагоприятным условиям среды. Сборник материалов Годичного собрания ОФР, Всеросс. научн. конф. Иркутск: Изд-во Ин-та географии им. В.Б. Сочавы СО РАН, 2018. С. 488–492. https://doi.org/10.31255/978-5-94797-319-8-488-491
Берестецкий В.А. Методические рекомендации по получению новых штаммов Rhizobium leguminosarum и оценки их эффективности. Л.: ВНИИСХМ, 1976. 31 с.
Hartwig U.A., Josef C.M., Phillips D.A. // Plant Physiol. 1991. V. 95. № 3. P. 797–803.
Santi V., Kannagi A. // J. Chem. Pharm. Res. 2016. V. 8. № 3. P. 700–707.
Kim S.M., Yoo J.A., Baek J.M., Cho K.H. // Toxicology in Vitro. 2015. V. 30. № 1. Part B. P. 383–393.
Акимова Г.П., Соколова М.Г., Нечаева Л.В. // Физиол. растений. 1999. Т. 46. № 5. С. 806–810.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


