Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 147-155
Вторичные метаболиты сибирских штаммов грибов Heterobasidion annosum sensu lato
Т. В. Антипова 1, В. П. Желифонова 1, Ю. А. Литовка 2, 3, И. Н. Павлов 2, 3, Б. П. Баскунов 1, А. А. Тимофеев 2, 4, А. Г. Козловский 1, *
1 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН − обособленное подразделение Федерального государственного бюджетного учреждения науки “Федеральный исследовательский центр “Пущинский научный центр биологических исследований Российской академии наук”
142290 Пущино, Россия
2 Институт леса им. В.Н. Сукачева Сибирского отделения Российской академии наук
660036 Красноярск, Россия
3 Сибирский государственный университет науки и технологий им. М.Ф. Решетнева
660049 Красноярск, Россия
4 Федеральный исследовательский центр “Красноярский научный центр Сибирского отделения
Российской академии наук”
660036 Красноярск, Россия
* E-mail: kozlovski@ibpm.pushchino.ru
Поступила в редакцию 29.09.2019
После доработки 15.10.2019
Принята к публикации 01.11.2019
Аннотация
Изучен состав вторичных метаболитов у базидиальных грибов рода Heterobasidion, выделенных на территории Средней и Западной Сибири, а также Южной Кореи. На основе морфолого-культуральных и молекулярно-генетических методов установлена принадлежность исследуемых культур к видам H. annosum (Fr.) Bref. (5 штаммов), H. abietinum Niemelä & Korhonen (4 штамма) и H. ecrustosum Tokuda, T. Hatt. & Y.C. Dai (1 штамм). В профиле метаболома трех штаммов H. annosum и всех штаммов H. abietinum преобладал фоманноксин. Два штамма H. annosum синтезировали близкие по структуре к фоманноксину соединения 2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбальдегид и 2-(2-гидроксипропан-2-ил)- бензофуран-5-карбальдегид. У H. annosum 45-2 были идентифицированы фоманнозин и его предшественники. Показано, что состав ферментационной среды оказал влияние на количество и состав синтезируемых метаболитов. В условиях in vitro все исследуемые штаммы H. annosum и H. abietinum проявляли фитопатогенное действие в отношении сеянцев Pinus sylvestris L., вызывая различной степени некротическое поражение стеблей и гибель растений. Более высокая фитопатогенность была характерна для штаммов H. аnnosum, максимальная агрессивность, наибольшее разнообразие соединений в профиле метаболома и активная продукция фоманноксина отмечена у H. annosum 45-2.
Проблема корневых гнилей хвойных пород, вызываемых фитопатогенными грибами рода Heterobasidion, привлекает пристальное внимание вследствие огромных размеров ущерба, причиняемого лесному хозяйству [1, 2]. К наиболее опасным и вредоносным возбудителям корневых и комлевых гнилей хвойных растений относят грибы комплекса Н. annosum sensu lato (s. l.) (корневая губка) [3–7]. Этот комплекс состоит из пяти видов грибов, распространенных в умеренных климатических регионах планеты. Виды комплекса различаются по морфологическим, генетическим и экологическим признакам, а также географическому распространению. Виды H. annosum senso stricto (s. s.) (Fr.) Bref., H. abietinum Niemela & Korhonen и H. parviporum Niemelä & Korhonen распространены повсеместно в Евразии. Виды Н. irregulare (Underw.) Garbelotto & Otrosina и H. occidentale Otrosina & Garbelotto встречаются в Северной Америке [2]. В Сибири грибы рода Heterobasidion представлены преимущественно видами Н. annosum и H. abietinum. Наибольший вред корневая губка наносит насаждениям Pinus sylvestris L. в ленточных борах Минусинской котловины и Алтайского края [8–10]. Все они являются эндофитами и сапро-некротрофными фитопатогенами, паразитирующими на более чем двухстах видах растений.
Механизм заражения деревьев H. annosum s. l. представляет собой инфицирование смешанного типа [2]. Первичное инфицирование происходит воздушно-капельным путем, преимущественно базидиоспорами на свежеповрежденные поверхности деревьев (верхушки пней и стволовые и корневые раны). После основного заражения может возникнуть вторичное инфицирование неповрежденных деревьев за счет вегетативного роста мицелия и его распространения через корневые контакты. К важным факторам в патогенезе корневой губки относятся ферментные системы, активно разлагающие биополимеры древесины, а также низкомолекулярные соединения. Известно, что грибы комплекса H. annosum s. l. способны продуцировать вторичные метаболиты − фоманнозин, фоманноксин, фомаджорины и др. [11–13]. Показано, что фоманноксин и фоманнозин обладают антибактериальной, антифунгальной и фитотоксичной активностью [12]. Недавно установлено, что фоманноксин является ингибитором биосинтеза бета-амилоидного пептида, который вовлечен в развитие болезни Альцгеймера [14].
Работы по изучению видовой принадлежности изолятов корневой губки, географического места их выделения, спектра метаболитов и их биологической активности единичны [13]. В настоящее время отсутствуют данные о составе вторичных метаболитов у сибирских штаммов различных видов Heterobasidion и их связи с фитопатогенностью.
Цель работы − изучение in vitro биосинтеза вторичных метаболитов и фитопатогенности у 10 штаммов грибов рода Heterobasidion, выделенных из хвойных насаждений с различной степенью патологического опада на территории Средней и Западной Сибири, а также Южной Кореи (о. Чеджу).
МЕТОДИКА
Выделение и идентификация штаммов. Объектами исследования служили 10 штаммов Н1, Н2, Н3, Н4, A-Ha-1, K-Ha-4, Hо-16K, Hp-8, Т-Ha и 45-2 грибов рода Heterobasidion из коллекции чистых культур лаборатории лесных культур, микологии и фитопатологии Института леса им. В.Н. Сукачева ФИЦ КНЦ СО РАН (Красноярск, Россия). Штаммы были выделены в 2014–2018 гг. из плодовых тел и базидиом Heterobasidion, произраставших на различных хвойных породах, либо (в единичном случае) из древесины поваленного дерева с характерными признаками поражения корневой губкой. Штаммы были изолированы в чистые культуры на селективных питательных средах: мальт-экстракт-агар (МЭА), содержащий 0.5% танина и Норкранс-агар (НРКА) [15, 16]. Хранение культур осуществляли на скошенном МЭА при 6°С.
Морфологические признаки изучали у грибов, выращенных на морковном агаре, МЭА и НРКА при 24 ± 1°С. Микроструктуры оценивали методами фазово-контрастной и светопольной микроскопии с использованием светового микроскопа Nikon Eclipse Сi с системой фотодокументации (“Nikon”, Япония) и электронного сканирующего микроскопа Hitachi SEM ТМ-1000 с 10 000 кратным увеличением и разрешением 30 нм (“Hitachi Ltd.”, Япония). Видовую идентификацию штаммов верифицировали молекулярно-генетическими методами. Секвенирование участков генетических маркеров ITS (internal transcribed spacer) и TEF-1alpha (transcription elongation factor 1-alpha) проводили на секвенаторе Illumina MySeq (“Illumina”, США) с использованием оборудования ЦКП “Инновационные технологии защиты растений” Всероссийского научно-исследовательского института защиты растений (Санкт-Петербург-Пушкин, Россия) и ЦКП “Геномика” (ИХБФМ СО РАН, Новосибирск, Россия). ДНК выделяли по методу фенол-хлороформной экстракции [17]. Таксономическое положение штаммов и эволюцию определяли с помощью программного обеспечения MEGA-X [18, 19]. Нуклеотидные последовательности сравнивали с последовательностями известных штаммов из базы NCBI (Information, U.S. National Library of Medicine).
Условия культивирования грибов, выделение, идентификация и количественное определение вторичных метаболитов. При изучении продукции вторичных метаболитов штаммы культивировали в глубинных условиях в колбах (750 мл) со 100 мл среды на шейкере (220 об./мин) в течение 11 сут при 24°С. При скрининге была использована синтетическая среда НРК [16]. Для сравнения биосинтетической способности продуктивных штаммов использовали две органно-минеральные среды. Среда 2 содержала (г/л дистиллированной воды): глюкозу – 5.0, мальт экстракт – 5.0, KH2PO4 – 0.5, MgSO4 ⋅ 7H2O – 0.5, рН 5.5 [20]. Среда 3, имела следующий состав (г/л дистиллированной воды): глюкоза – 4.0, дрожжевой экстракт – 4.0, мальт-экстракт – 10.0, рН 5.5 [21]. Среды засевали 7-суточным мицелием, выращенным глубинно в среде, содержавшей 3% мальт-экстракта.
Вторичные метаболиты экстрагировали из фильтрата культуральной жидкости хлороформом трехкратно при рН 3 и 8. Экстракты анализировали методом ТСХ на пластинках силикагеля (Silica gel F254, “Merck”, Германия) в системах хлороформ–метанол–25%-ный аммиак (90 : 10 : 0.1) и хлороформ–ацетон (93 : 7). Метаболиты обнаруживали по поглощению и флуоресценции при 254 и 366 нм. Метаболиты выделяли с помощью препаративной ТСХ (ПТСХ) на пластинках силикагеля (Silica gel F254, “Merck”, Германия) в системах растворителей. Идентификацию выделенных метаболитов осуществляли на основе сравнения данных УФ-спектроскопии и масс-спектрометрии с литературными источниками [11–13, 22, 23]. Подробную информацию о структуре соединений получали при анализе МС/МС спектров при энергии коллизии 20–40%.
УФ-спектры соединений в метаноле получали на спектрофотометре UV-160А (“Shimadzu”, Япония). Масс-спектры соединений регистрировали на квадрупольном масс-спектрометре LCQ Advantage MAX (“Thermo Finnigan”, Германия), используя одноканальный шприцевой насос для прямого ввода образца в камеру для химической ионизации.
Количественное содержание фоманноксина определяли спектрофотометрически после ПТСХ на пластинках силикагеля (Silica gel F254, “Merck”, Германия) в метаноле при 280 нм. Расчет проводили, используя калибровочную кривую для фоманноксина.
Исследование фитопатогенной активности штаммов. Фитопатогенность оценивали по модифицированному методу [24] с использованием для культивирования грибов полужидкой питательной среды НРК.
Поверхностно стерилизованные семена P. sylvestris проращивали в течение 8–10 сут на поверхности 5%-ного водного агара при 20°С. Проростки перед инфицированием выдерживали при 4°С в течение времени, необходимого для достижения длины корней 1.5–2.5 см, а затем помещали на поверхность 10-суточной культуры гриба так, чтобы их корни были погружены в полужидкую питательную среду НРК. Посевы инкубировали в климатокамере (“Jeio Tech”, Корея) с 12 ч фотопериодом в течение 18 сут при 22°С. По окончании эксперимента оценивали жизнеспособность растений (% от контроля), длину надземной части здоровых проростков (мм), агрессивность штамма грибов (% растений с некрозом от общего количества растений).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Исследование морфолого-культуральных особенностей подтвердило принадлежность изучаемых культур к роду Heterobasidion, а изучение их микроструктур методами растровой электронной микроскопии не выявило значительных микроморфологических различий. На плотных питательных средах формировался хорошо развитый воздушный мицелий с полупрозрачными, тонкостенными генеративными гифами, имеющими септы. Гифы, ветвящиеся под острым, реже под прямым углом, были шириной 1.5–5.0 мкм. Анастомозы протяженностью от 2 до 40 мкм – умеренные. Редкие и простые пряжки размером 2.0–5.5 мкм располагались на прямой широкой гифе. Конидиофоры с апикальной конидиогенной везикулой – прямостоячие, простые или разветвленные, гиалиновые до 200 мкм в длину и 4–10 мкм в диаметре. Диаметр апикальной везикулы составлял 6–15 мкм, поверхность была с коническими зубцами, на которых располагались многочисленные конидии. Конидии размером 3.5–8.0 × × 2.5–6.5 мкм были одноклеточные, гладкие и гиалиновые, они имели форму от яйцевидной до почти шаровидной (рис. 1).
Рис. 1.
Растровая электронная микроскопия вегетативных (мицелий) и репродуктивных (апикальные везикулы с конидиями) структур H. annosum s. s. (а, увеличение ×2500) и H. abietinum (б, увеличение ×4000).

Видовую идентификацию проводили с использованием молекулярно-генетических методов, включающих секвенирование участков генетических маркеров ITS и TEF-1alpha с последующим биоинформатическим анализом. Филогенетическое дерево (рис. 2) построено по методу попарного внутригруппового невзвешенного среднего [18] и модели [25] с bootstrap тестом [26] в 10 000 репликаций. Всего было проанализировано 29 нуклеотидных последовательностей, при этом генетическое расстояние между видами составило не менее 0.015. Филогенетический анализ консервативных регионов ДНК изученных культур грибов позволил установить четыре устойчивых клада, характерных для видового разделения, и определить принадлежность штаммов H-2, A-Ha-1, K-Ha-4, Т‑Ha и 45-2 к виду H. annosum s. s. (Fr.) Bref., штаммов Hp-8, H-1, H-3 и H-4 к виду H. abietinum Niemelä & Korhonen и штамма Hе-16K к виду H. ecrustosum Tokuda, T. Hatt. & Y.C. Dai.
Рис. 2.
Филогенетическое дерево грибов Heterobasidion sp., составленное на основании сравнительного анализа региона ITS1-ITS2 (△ − обозначены исследуемые штаммы).

Вторичные метаболиты у Heterobasidion изучали после выращивания штаммов в среде НРК, которая обычно применяется при культивировании базидиомицетов [16]. У всех изученных штаммов видов H. annosum s. s. и H. abietinum был обнаружен метаболит 1, мигрирующий при ТСХ с Rf = 0.29 (II). УФ-спектр метаболита 1 имел значения полос поглощения (λмакс 209, 232, 278, 294 нм), близкие фоманноксину, и положительный молекулярный ион 207(M + H)+. В МС/МС спектре также наблюдалось отщепление двух карбоксильных фрагментов и гидроксильной группы. На основании полученных данных метаболит был идентифицирован как 2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбальдегид. У этих штаммов также был идентифицирован метаболит 2, который имел молекулярный ион 205(M + H)+, характер расщепления которого был аналогичен предыдущему с разницей в две единицы, что могло указывать на появление двойной связи в фурановом кольце, он представлял собой 2-(2-гидроксипропан-2-ил)-бензофуран-5-карбальдегид (табл. 1).
Таблица 1.
Физико-химические свойства выделенных метаболитов грибов рода Heterobasidion
| № | Метаболит | УФ-спектр, λмакс., нм | Энергия коллизии/молекулярный ион и характеристические пики в МС/МС-спектрах (интенсивность, %) |
|---|---|---|---|
| [M + H]+ | |||
| 1 | 2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбальдегид | 209, 232, 278 (пл.), 294 | 24/207(96), 189(100), 161(39), 147(10), 135(24), 107(10) |
| 2 | 2-(2-гидроксипропан-2-ил)-бензофуран-5-карбальдегид | 209, 232, 278 (пл.), 294 | 25/205 (86), 187(60), 159(92), 149(36), 135(100), 107(54) |
| 3 | Фоманноксин | 209, 228, 280(пл.), 293 | 25/189(51), 161(100), 133(8), 119(12) |
| 4 | 1-(2-(проп-1-ен-2-ил)-2,3-дигидробензофуран-5-ил)пропан-1,2 диол | 209, 230, 290 | 25/217 (90),199(100),175 (66) |
| 5 | Иллудолактон А | 256 | 22/247(86), 229(100), 219(22), 205(29), 201(50) |
| 6 | Метилиллудолактон А | 259 | 20/261(69), 247(47), 229(100), 201(7) |
| 7 | Фоманнозин | 256 | 22/263(82), 245(100), 227(11) |
У штаммов H. annosum Т-Ha, 45-2 и H-2 и H. abietinum Hp-8, H-1, H-3 и H-4 основным метаболитом было соединение 3, мигрирующее при ТСХ с Rf = 0.52 (II). УФ-спектр выделенного метаболита имел максимальные значения полос поглощения при 209, 228, 280 (пл.) и 293 нм. Масс-спектр метаболита 3 показал положительный молекулярный ион 189 (M + H)+. В МС/МС спектре метаболита наблюдали последовательное отщепление двух карбоксильных и пропенильной групп (табл. 2). На основании литературных данных этот метаболит был идентифицирован как фоманноксин.
Таблица 2.
Вторичные метаболиты штаммов грибов рода Heterobasidion, выделенных из хвойных пород деревьев в различных географических регионах
| Метаболиты | H. abietinum | H. annosum | H. ecrustosum | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Hp-8 | H-1 | H-3 | H-4 | H-2 | K-Ha-4 | Т-Ha | 45-2 | A-Ha-1 | He-16K | |
| Красноярский край | Алтай | Ю. Корея | ||||||||
| Larix sibirica | Abies sibirica | Pinus koraiensis | Picea obovata | Abies sibirica | Pinus sylvestris |
Abies sibirica | Pinus sylvestris | Pinus thunbergii | ||
| Фоманноксин | + | + | + | + | + | – | + | + | – | – |
| 2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбаль-дегид | + | + | + | + | + | + | + | + | + | – |
| 2-(2-гидроксипропан-2-ил)-2,3-гидробензофуран-5-карбальдегид | + | + | + | + | + | + | + | + | + | – |
| 1-(2-(проп-1-ен-2-ил)-2,3-дигидробензофуран-5-ил)пропан-1,2 диол | + | + | + | + | + | – | + | + | – | – |
| Иллудолактон А | – | – | – | – | – | – | – | + | – | – |
| Метилиллудолактон А | – | – | – | – | – | – | – | + | – | – |
| Фоманнозин | – | – | – | – | – | – | – | +* | – | – |
У изучаемых штаммов при ТСХ также был также обнаружен метаболит 4 с Rf = 0.18 (II), который имел УФ-спектр с максимальными значениями полос поглощения при 209, 230 и 290 нм и масс-спектр с положительным молекулярным ионом 217 (M + H)+. МС/МС спектр метаболита 4 указывал на наличие двух гидроксильных групп. Метаболит 4 был идентифицирован как 1-(2-(проп-1-ен-2-ил)-2,3-дигидробензофуран-5-ил)пропан-1,2-диол.
Штамм Н. annosum 45-2 синтезировал метаболит 5, мигрирующий с Rf = 0.47 при ТСХ (II), который имел УФ-спектр с λмакс = 256 нм, характерный для сесквитерпена фоманнозина. Масс-спектр метаболита 5 характеризовался положительным молекулярным ионом 247(M + H)+ и наличием гидроксильной и карбонильной групп. На основании полученных данных этот метаболит был идентифицирован как иллудолактон А. У данного штамма также был обнаружен метаболит 6, мигрирующий с Rf = 0.25 (II) при ТСХ, который имел УФ-спектр с λмакс = 259 нм и молекулярный ион 261 (M + H)+, отличающейся от предыдущего метаболита метильной группой. Этот метаболит не был идентифицирован, но УФ-спектр и фрагментация молекулярного иона, схожие с иллудолактоном А, позволяли предположить, что этот метаболит являлся метильным производным иллудолактона А. В органо-минеральной среде 3 H. annosum 45-2 помимо указанных выше метаболитов синтезировал метаболит 7, который имел УФ-спектр с λмакс = 256 нм и масс-спектр с положительным молекулярным ионом 263 (M + H)+. Этот метаболит был идентифицирован как фоманнозин. У штамма H. ecrustosum Не-16 К вышеуказанные вторичные метаболиты не были идентифицированы.
Установлено, что изопреноидный блок фоманноксина образуется из фарнезилдифосфата, предшественником которого является мевалоновая кислота [11]. Ароматическое кольцо соединения синтезируется по шикиматному пути при последовательном элиминировании пирувата из хоризмовой кислоты с образованием гидроксибензойной кислоты с последующим восстановлением до альдегида (рис. 3). Далее в биосинтетическом пути наступает ключевая реакция, ведущая к образованию фоманноксина, а именно алкилирование ароматического кольца изопреноидной единицей, которое осуществляется пренилтрансферазой. Дальнейшая окислительная циклизация приводит к образованию бензогидрофуранового скелета и 2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбальдегида, из которого путем элиминирования воды образуется либо фоманноксин, либо в результате окисления 2-(2-гидроксипропан-2-ил)-бензофуран-5-карбальдегид. Из фоманноксина под действием пируватдекарбоксилазы и последующего восстановления образуется 1-(2-(проп-1-ен-2-ил)-2,3-дигидробензофуран-5-ил)пропан-1,2-диол. Биосинтез фоманнозина начинается с циклизации универсального предшественника сесквитерпенов фарнезилпирофосфата с образованием Δ6-протоиллудена предположительно под действием терпенциклазы [12]. Окисление протоиллудена монооксигеназами и дегидрогеназами с образованием иллудола, иллудолактона А и других промежуточных соединений приводит к образованию фоманнозина.
Рис. 3.
Предполагаемый биосинтез фоманноксина и соединений, близких ему по структуре [13]: 1 – 2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбальдегид; 2 – 2-(2-гидроксипропан-2-ил)-бензофуран-5-карбальдегид; 3 – фоманноксин; 4 – 1-(2-(проп-1-ен-2-ил)-2,3-дигидробензофуран-5-ил)-пропан-1,2-диол.
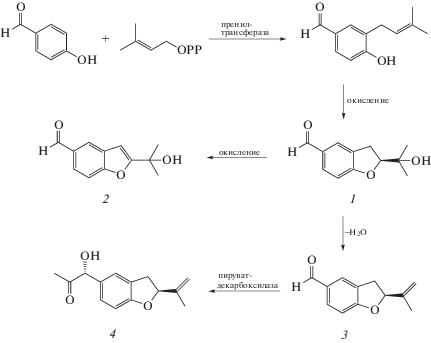
Таким образом, в спектре всех исследованных штаммов вида H. аbietinum и трех штаммов H. annosum присутствовало 4 метаболита фоманноксинового ряда с преобладанием фоманноксина. Это предполагает функционирование у них двух энзиматических путей, преобразующих 2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбальдегид. Однако у двух штаммов H. annosum наблюдался только процесс окисления этого соединения. В то время как у штамма H. annosum 45-2 активно функционировали пренилтрансферазы и терпенциклазы, ключевые ферменты, ведущие к образованию метаболитов фоманноксиного и фоманнозиного ряда.
Известно, что филогенетически близкие виды могут синтезировать сходный профиль вторичных метаболитов [13]. Проведенные исследования по установлению связи между видами грибов комплекса H. annosum s. l. и спектром вторичных метаболитов показало, что образование фоманноксина явилось определяющим фактором для видов Н. annosum s. s. и Н. irregulare. Вид Н. irregulare отличался биосинтезом сесквитерпена-дезоксифоманнозина А, а характерной особенностью видов H. abietinum, H. occidentale была продукция эпоксидрименола и его производных. У изученных штаммов фоманноксин преобладал у трех штаммов H. annosum, а у двух других были обнаружены метаболиты, близкие ему по структуре. Эти результаты соответствовали предложенным хемотаксономическим критериям для вида H. annosum s. s. У фоманноксин-синтезирующего штамма H. annosum 45-2 был идентифицирован фоманнозин и его биосинтетические предшественники, ранее обнаруженные у видов H. irregulare и H. occidentale [11, 12]. У всех изученных штаммов вида H. аbietinum был найден фоманноксин и близкие ему соединения, в то время как отсутствовал эпоксидрименол, характерный для этого вида по данным [13]. Можно предположить, что образование фоманноксина у грибов этого комплекса определяется регуляцией генов его биосинтетического пути в зависимости от применяемых условий культивирования.
Изучение фитопатогенности сибирских штаммов Heterobasidion, проведенное в условиях in vitro, показало, что все штаммы видов H. annosum и H. abietinum проявляли фитопатогенное действие на сеянцы P. sylvestris, вызывая некротическое поражение стеблей и гибель растений. Было обнаружено, что показатели вирулентности штаммов вида H. annosum оказались выше, чем у штаммов вида H. abietinum (табл. 3). Максимальную вирулентность проявлял Н. annosum 45-2, выделенный из плодового тела, произраставшего на A. sibirica (Красноярский край, Россия) и синтезирующий наиболее широкий спектр вторичных метаболитов. Жизнеспособность сеянцев на 6 сут составила 37% на фоне замедления развития стебля по сравнению с контролем в 3.5 раза и массовых некротических поражений (до 70% от общего количества растений). На 12 сут инкубации была отмечена 100%-ная гибель P. sylvestris. На момент завершения эксперимента (18 сут) 100%-ную гибель сеянцев наблюдали при воздействии H. annosum А-На-1 и К-На-4, выделенных с плодовых тел, произраставших на P. sylvestris (Красноярский край и Алтай соответственно, Россия) (табл. 2). Показатели вирулентности H. annosum Т-На и Н2, выделенных с плодового тела, произраставшего на P. sylvestris, и пораженной древесины A. sibirica (Красноярский край, Россия) были несколько ниже. Жизнеспособность сеянцев на 18 сут составила около 30% на фоне замедления в 2 раза развития стебля по сравнению с контролем и некротических поражений до 93% от общего количества растений.
Таблица 3.
Фитопатогенная активность сибирских штаммов Heterobasidion по отношению к проросткам Pinus sylvestris
| Вид, штамм | Продолжительность инкубирования, сут | |||||||
|---|---|---|---|---|---|---|---|---|
| 6 | 12 | 18 | ||||||
| жизнес-пособность, % от контроля | длина стебля, мм |
растения
с некрозом, % |
жизнес-пособность, % от кон-троля | растения
с некрозом, % |
жизнес-пособность, % от кон-троля | длина стебля, мм |
растения
с некрозом, % |
|
| Н. annosum | ||||||||
| 45-2 | 37.0 | 14.7 | 70.0 | 0.0 | 100.0 | |||
| А-На-1 | 55.6 | 20.5 | 45.3 | 20.3 | 85.1 | 0.0 | – | 100.0 |
| К-На-4 | 60.1 | 22.7 | 41.3 | 30.2 | 81.3 | 0.0 | – | 100.0 |
| Т-На | 69.4 | 25.8 | 34.9 | 54.1 | 75.1 | 32.1 | 30.1 | 94.0 |
| Н2 | 70.4 | 26.3 | 32.1 | 59.3 | 72.9 | 36.7 | 31.8 | 93.0 |
| H. abietinum | ||||||||
| H1 | 76.7 | 28.9 | 19.7 | 66.7 | 70.0 | 54.7 | 34.5 | 92.0 |
| H3 | 100.0 | 29.8 | 7.2 | 100.0 | 44.4 | 97.0 | 35.8 | 70.3 |
| Hр-8 | 70.4 | 29.3 | 20.1 | 59.3 | 72.9 | 46.7 | 30.8 | 97.0 |
| H4 | 74.1 | 32.6 | 5.3 | 66.7 | 77.8 | 58.8 | 37.5 | 91.0 |
| H. ecrustosum | ||||||||
| Не-16К | 100.0 | 45.8 | 0.0 | 100.0 | 4.4 | 100.0 | 55.8 | 7.4 |
| Контроль | 100.0 | 51.3 | 0.0 | 100.0 | 0.0 | 100.0 | 60.7 | 1.0 |
Вирулентность штаммов вида H. abietinum оказалась ниже по сравнению со штаммами H. annosum (табл. 3). На 18 сут эксперимента жизнеспособность растений варьировала от 47 до 59% на фоне замедления в 1.6–1.8 раза развития стебля по сравнению с контролем и некротических поражений от 70 до 92% от общего количества растений. Эти штаммы были выделены в Красноярском крае (Россия) с плодовых тел, произраставших на A. sibirica, P. koraiensis и P. obovata соответственно. К высоковирулентному штамму можно было отнести H. abietinum Нр-8, изолированный из плодового тела с L. sibirica в Красноярском крае. Корейский штамм H. ecrustosum Не-16К, выделенный из плодового тела на P. thunbergii, характеризовался отсутствием выраженной вирулентности. Так, на 18 сут эксперимента жизнеспособность растений и распространение некроза мало отличалось от контроля (табл. 3).
Известно, что фоманноксин является фактором вирулентности грибов Heterobasidion [23, 27]. Было показано, что обработка сеянцев Picea sitchensis 150 мкг/мл фоманноксина через 3 нед. инкубации приводила к быстрому отмиранию корней, хлорозу и опаданию игл. Была установлена in vitro прямая зависимость между концентрацией этого метаболита в среде и прорастанием семян Sitka spruce. Фоманноксин оказался единственным вторичным метаболитом Heterobasidion, который был выделен в концентрации 0.3 мкг/г древесины из зараженной части дерева перед грибными гифами [27]. Эти результаты позволили сделать вывод, что токсин секретируется в растительную ткань перед началом грибной инфекции. Наличие в тканях токсина приводило к гибели клеток растений и способствовало дальнейшему распространению гиф гриба и разрушению древесины.
Для фоманнозина и иллудолактона А также показана фитотоксичная активность [12]. Эти соединения вызывали локальный некроз, приводящий к системной гибели сосны Pinus taeda. Было показано также, что фоманнозин ингибировал рост суспензии клеток ели, Picea abies и Nicotiana tabacum.
Было обнаружено, что сибирские штаммы корневой губки существенно различались по продукции фоманноксина. В среде НРК наиболее активным продуцентом оказался H. abietinum H-1, синтезирующий 55 мкг/мл фоманноксина. Его продукция у H. abietinum Hp-8, H-3 и H-4 была ниже и составила 11, 4 и 5 мкг/мл соответственно. H. annosum 45-2, H-2 и Т-Ha синтезировали 16. 7 и 3 мкг/мл фоманноксина соответственно. У H. annosum K-Ha-4 и A-Ha-1 продукция фоманноксина отсутствовала, но они синтезировали метаболиты фоманноксинового ряда: 2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбальдегид и 2-(2-гидроксипропан-2-ил)-бензофуран-5-карбальдегид.
На трех штаммах было изучено влияние двух других по составу питательных сред на продукцию фоманноксина. Обнаружено, что у H. abietinum H-1 концентрация фоманноксина в органоминеральных средах 2 и 3 была в 2.2 и 4.2 раза ниже по сравнению со средой НРК. Наиболее благоприятной для биосинтеза фоманноксина H. annosum 45-2 была среда 3, поскольку содержание фоманноксина в ней было в 2 раза выше по сравнению со средой НРК, при этом наблюдался также биосинтез фоманнозина. В средах 2 и 3 H. abietinum Hp-8 не синтезировал фоманноксин, но в них были идентифицированы другие метаболиты фоманноксинового ряда: (2-(2-гидроксипропан-2-ил)-2,3-дигидробензофуран-5-карбальдегид и 2-(2-гидроксипропан-2-ил)-бензофуран-5-карбальдегид.
Таким образом, биосинтез фоманноксина определялся физиолого-биохимическими особенностями исследуемых штаммов, при этом состав среды культивирования оказывал регуляторное влияние на биосинтез вторичных метаболитов фоманноксинового ряда. Отсутствие биосинтеза фоманноксина у H. abietinum Hp-8 в органоминеральных средах подтверждало, что его биосинтез определялся регуляцией генов биосинтетического пути в зависимости от условий культивирования.
Сравнение данных фитопатогенности и продукции фоманноксина штаммами показало, что высоко патогенный H. annosum 45-2 характеризовался высокой продукцией фоманноксина (16–32 мкг/мл) и широким спектром синтезированных метаболитов, обладающих фитотоксичными свойствами. У всех штаммов, проявляющих фитопатогенные свойства, были обнаружены вторичные метаболиты фоманоксинового ряда. Различия в степени патогенности и содержания фоманноксина связаны с совокупностью различных факторов, влияющих на эти процессы, например, с отличиями в условиях роста грибов in vivo и in vitro. Недавно было показано, что в процесс грибной инфекции Heterobasidion могут быть также вовлечены небольшие секретируемые белки [28]. Можно предположить, что фитопатогенностью обладают метаболиты, близкие по структуре к фоманноксину, что было показано для штаммов H. annosum K-Ha-4 и A-Ha-1. Эти метаболиты, так же, как и фоманноксин, содержат в структуре ароматическую карбонильную группу, которая, отвечает в основном за повреждающее действие на растительные клетки [29]. Отсутствие биосинтеза фоманноксина и других соединений этой группы у корейского штамма H. ecrustosum He-16K согласовывалось c наблюдениями в работе [30], что этот вид не проявляет патогенные свойства и является сапрофитом.
Список литературы
Asiegbu F.O., Adomas A., Stenlid J. // Mol. Plant Pathol. 2005. V. 6. № 4. P. 395–409.
Garbelotto M., Gonthier P. // Ann. Review Phytopathol. 2013. V. 51. P. 39–59.
Федоров Н.И. Корневые гнили хвойных пород. М.: Лесн. пром., 1984. 160 с.
Василяускас А.П. Корневая губка и устойчивость экосистем хвойных лесов. Вильнюс: Мокслас, 1989. 175 с.
Стороженко В.Г., Иголкина Т.В. // Лесное хозяйство. 1991. № 3. С. 47–50.
Корхонен К. Грибные сообщества лесных экосистем: материалы координационных исследований. Т. 2. / Ред. В.Г. Стороженко, В.И. Крутова. М.; Петрозаводск: КарНЦ РАН, 2004. С. 89–113.
Павлов И.Н., Барабанова О.А., Кулаков С.С., Юшкова Т.Ю., Агеев А.А., Пашенова Н.В., Тарасов П.А., Шевцов В.В., Иванова Т.Н. // Хвойные бореальной зоны. 2010. Т. 27. № 3–4. С. 263–272.
Павлов И.Н., Корхонен К., Губарев П.В., Черепнин В.Л., Барабанова О.А., Миронов А.Г., Агеев А.А. // Хвойные бореальной зоны. 2008. Т. 25. № 1–2. С. 28–36.
Pavlov I.N. // Contem. Probl. Ecol. 2015. T. 8. № 4. C. 440–456.
Литовка Ю.А., Павлов И.Н. Грибные сообщества лесных экосистем. Т. 5. / Ред. В.Г. Стороженко, А.В. Руоколайнен, А.В. Кикеева. М.; Петрозаводск: КарНЦ РАН, 2018. С. 68–76.
Hansson D., Menkis A., Olson E., Stenlid J., Broberg A., Karlsson K. // Phytochemistry. 2012. V. 84. P. 31–39.
Hansson D., Menkis A., Himmelstrand K., Thelander M., Olson E., Stenlid J., Karlsson M., Broberg A. // Phytochemistry. 2012. V. 82. P. 158–165.
Hansson D., Wubshet S., Olson A., Karlsson M., Staerk D., Broberg A. // Phytochemistry. 2014. V. 108. P. 243–251.
Gonzales-Ramirez M., Gavilan J., Silva-Grecchi T., Cajas-Madriaga D., Trivino S., Becerra J., Saez-Orellana F., Perez C., Fuentealba J.J. // Alzheimer Disease. 2018. V. 61. № 4. P. 1463–1475.
Методы экспериментальной микологии / Ред. В.И. Билай. Киев: Наукова думка, 1982. 552 с.
Бухало А.С. Высшие съедобные базидиомицеты в чистой культуре. Киев: Наукова думка, 1988. 144 с.
Каюмов А.Р., Гимадутдинов О.А. Практикум по молекулярной генетике. Казань: КФУ, 2016. 36 с.
Sneath P.H.A., Sokal R.R. Numerical Taxonomy: The principles and Methods of Numerical Classification. San Francisco: W.H. Freeman & Co, 1973. P. 18–24.
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. // Mol. Biol. Evol. 2018. V. 35. № 6. P. 1547–1549.
Stenlid J. // Can J. Bot. 1985. V. 63. № 12. P. 2268–2273.
Horlacher N., Nachtigall J., Schulz D., Sussmuth R.D., Hampp R., Fiedler H.P., Schrey S.D. // J. Chem. Ecol. 2013. V. 39. № 7. P. 931–941.
Kepler J.A., Wall M.E., Mason J.E., Basset C., McPhail A.T., Sim G.A. // J. Am. Chem. Soc. 1967. V. 89. № 5. P. 1260–1261.
Heslin M.C., Stuart M.R., Murchy P.O., Donnelly D.H.X. // Eur. J. For. Path. 1983. V. 13. № 1. P. 11–13.
Olson A., Lind M., Stenlid J. // For. Path. 2005. V. 35. № 5. P. 321–331.
Kimura M. // J. Mol. Evol. 1980. V. 16. № 2. P. 111–120.
Felsenstein J. // Evol. 1985. V. 39. № 4. P. 783–791.
Hirotani M., O’Reilly J., Donnelly D.M.X. // Tetrahedron Lett. 1977. V. 18. № 7. P. 651–652.
Raffaello T., Asiegbu F.O. // Sci Rep. 2017. V. 7. № 1. P. 8000. https://doi.org/10.1038/s41598-017-08010-0
Zweimüller M., Antus S., Koväcs T. Sonnenbichler J. // Biol. Chem. 1997. V. 378. № 8. P. 915–921.
Tokuda S., Hattori T., Dai Y., Ota Y., Buchanan P.K. // Mycoscience. 2009. V. 50. № 3. P. 190e202.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


