Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 182-189
Усиление донором оксида азота холодоиндуцированных изменений антиоксидантной и осмопротекторной систем злаков
Ю. Е. Колупаев 1, *, Е. И. Горелова 1, Т. О. Ястреб 1, Н. И. Рябчун 2, А. М. Резник 2
1 Харьковский национальный аграрный университет им. В.В. Докучаева
62483 Харьков, Украина
2 Институт растениеводства им. В.Я. Юрьева Национальной академии аграрных наук Украины
61060 Харьков, Украина
* E-mail: plant.biology.knau@gmail.com
Поступила в редакцию 30.07.2019
После доработки 10.10.2019
Принята к публикации 01.11.2019
Аннотация
Исследовали влияние прайминга семян озимых ржи (Secale cereale L., сорт Память Худоерко) и пшеницы (Triticum aestivum L., сорт Досконала) донором оксида азота нитропруссидом натрия на их морозоустойчивость. Донор оксида азота (0.1–0.5 мМ) повышал способность проростков обоих злаков к холодовому закаливанию (6 сут при 2–4°С), вследствие этого значительно увеличивалось их выживание после промораживания при –6 и –8°С. Обработка семян нитропруссидом натрия способствовала повышению содержания в проростках злаков сахаров, пролина, антоцианов и флавоноидов, поглощающих в УФ-B. В них также наблюдали увеличение активности супероксиддисмутазы и гваяколпероксидазы. После холодового закаливания и особенно после промораживания содержание малонового диальдегида (продукта пероксидного окисления липидов) в проростках, выращенных из семян, праймированных нитропруссидом натрия, было ниже, чем в соответствующих контролях. Сделано заключение об усилении оксидом азота холодоиндуцированной активации антиоксидантной и осмопротекторной систем злаков.
В последние десятилетия для повышения устойчивости растений к действию стресс-факторов различной природы наряду с подходами классической селекции и генетической инженерии все большую популярность приобретает прием предстрессовой обработки соединениями, индуцирующими протекторные системы. Такой подход получил название “прайминг” (priming). Прайминг вызывает эффекты, похожие во многом на естественные процессы закаливания растений, позволяющие им адаптироваться к экстремальным температурам и другим неблагоприятным факторам [1]. После воздействия праймирующих соединений растение оказывается в состоянии, при котором активация защитных реакций на действие стресс-факторов происходит быстрее и (или) проявляется более заметно, чем у не праймированных растений [2]. Механизмы этих явлений понятны еще не полностью, однако в целом они обусловлены предшествующей действию стрессора активацией сигнальной сети.
Оксид азота (NO) относится к наиболее изученным молекулам-газотрансмиттерам у растений [3, 4]. К настоящему времени накоплен большой объем сведений о его роли в гормональной регуляции, формировании цитоскелета, процессах прорастания семян, деэтиоляции и ризогенеза [3, 5, 6], а также во взаимодействии растений с симбионтами [7] и патогенами [8]. Особая роль отводится участию NO в процессах адаптации растений к неблагоприятным условиям среды [6, 9]. Однако его значение для адаптации растений к действию холода остается малоизученным, хотя при действии низких температур в органах растений ряда видов (Arabidopsis thaliana, Pisum sativum, Citrus aurantium, Brassica raniflora, Triticum aestivum) зарегистрировано повышение содержания NO [6, 10–12].
Положительное влияние NO на холодоустойчивость растений может быть связано с S-нитрозилированием целевых белков. Так, у Brassica juncea обнаружен эффект дифференцированного S-нитрозилирования 10 белков, среди которых и антиоксидантные ферменты – дегидроаскорбатредуктаза и глутатион-S-трансфераза [13]. Также показано повышение активности супероксиддисмутазы (СОД) и аскорбатпероксидазы вследствие S-нитрозилирования [10].
В некоторых исследованиях показано положительное влияние экзогенного NO на устойчивость растений к гипотермии. Обработка растений бермудской травы (Cynodon dactylon) донором NO нитропруссидом натрия (НПН) снижала вызываемые холодом (4°С) выход электролитов из тканей и повышение в клетках содержания малонового диальдегида (МДА) – продукта пероксидного окисления липидов (ПОЛ) [14]. При этом у растений, обработанных НПН, отмечались более высокие величины активности СОД, пероксидазы и каталазы, а также усиление экспрессии генов антиоксидантных ферментов. Фолиарная обработка молодых растений яровой пшеницы 0.1 мМ НПН способствовала их адаптации к трехдневному действию низкой положительной температуры (2–5°С), что выражалось в уменьшении проявления индуцируемого холодом окислительного стресса и повышении активности СОД, каталазы и пероксидазы [15]. Показано, что замачивание семян яровой пшеницы в 0.1 мМ растворах НПН способствовало сохранению близких к нормальным показателей роста и водного режима у растений, подвергнутых действию 4°С в течение 6 ч [16].
В то же время практически неисследованным остается значение NO для устойчивости растений к действию отрицательных температур. Известно, что формирование их морозоустойчивости происходит в процессе достаточно длительного действия на них низких положительных температур и включает в себя глубокие перестройки метаболизма [17]. Среди них большое значение имеют накопление криопротекторов и активация антиоксидантной защитной системы, которая предотвращает вторичные окислительные повреждения [18]. Влияние NO на эти процессы у морозоустойчивых злаков до настоящего времени не исследовалось.
Цель работы – изучение влияния прайминга семян озимых ржи (Secale cereale L.) и пшеницы (Triticum aestivum L.) донором NO НПН на формирование их морозоустойчивости и связи этого процесса с накоплением низкомолекулярных протекторов и модификацией ферментативной антиоксидантной системы.
МЕТОДИКА
В работе использовали этиолированные проростки озимых ржи сорта Память Худоерко и пшеницы сорта Досконала. Несмотря на биологическое сходство, у этих видов злаков проявляются заметные различия по морозоустойчивости. Проростки ржи, в отличие от пшеницы, обладают определенным уровнем конститутивной морозоустойчивости, а после закаливания у них формируется больший уровень резистентности к отрицательным температурам [18].
Семена в течение 40 мин обеззараживали в 6%-ном растворе пероксида водорода и тщательно промывали дистиллированной водой. После этого семена опытных вариантов праймировали донором NO путем погружения на 1 ч в растворы 0.1–2 мМ НПН [16], а семена контрольного варианта выдерживали 1 ч в дистиллированной воде. В отдельных сериях опытов в качестве дополнительного контроля использовали так называемый раствор “истощенного” НПН, содержащий продукты разложения этого соединения, но утративший NO [8], который получали путем выдерживания раствора НПН в открытой посуде на свету в течение 2 сут.
Семена проращивали в течение 4 сут в темноте при 20–22°С на фильтровальной бумаге, смоченной очищенной водопроводной водой. Через 4 сут этиолированные проростки использовали для биохимических анализов и подвергали промораживанию в течение 5 ч в камере (“Danfoss”, Нидерланды) в отсутствие света при –6°С, снижая температуру со скоростью 1°C/ч. Для оттаивания проростков температуру в камере повышали до 2°С со скоростью 1°С/ч. После этого проростки продолжали выращивать в течение 3 сут при 20–22°С и освещенности 6 клк и оценивали их выживание.
В вариантах с холодовым закаливанием 3-суточные этиолированные проростки помещали на 6 сут в холодильную камеру (без освещения) при 2–4°С. Оптимальный режим закаливания проростков был выбран на основании результатов экспериментов, описанных в предыдущей работе [18]. В качестве контроля использовали 4-суточные этиолированные проростки, не подвергавшиеся закаливанию. Поскольку при низкой температуре развитие проростков замедлялось, 9-суточные закаленные растения были такими же, как 4-суточные контрольные, выращенные при 20–22°С.
После закаливания проростки подвергали промораживанию в течение 5 ч в отсутствие света при –6 или –8°С, снижая температуру со скоростью 1°С/ч. Затем образцы оттаивали и продолжали выращивать на свету для оценки выживания, как описано выше.
Суммарное содержание сахаров в проростках анализировали методом Морриса–Роэ с использованием антронового реактива с модификациями, описанными ранее [18], и выражали в мг/г сухой массы. Содержание пролина определяли с использованием нингидринового реактива [19], выражая в мкмоль/г сухой массы. Содержание продуктов ПОЛ (преимущественно МДА) в проростках определяли с использованием 2-тиобарбитуровой кислоты [18].
Для определения содержания антоцианов и бесцветных флавоноидов, имеющих максимум поглощения в области УФ-B, навески побегов гомогенизировали в 1%-ном растворе HCl в метаноле. После центрифугирования гомогената на центрифуге MPW 350R (“MedInstruments”, Польша) при 8000 g в течение 15 мин определяли оптическую плотность супернатанта при 300 и 530 нм [20]. Содержание антоцианов и бесцветных флавоноидов выражали в условных единицах как величины A530/г сухой массы и A300/г сухой массы соответственно.
Активность антиоксидантных ферментов СОД (КФ 1.15.1.1), каталазы (КФ 1.11.1.6) и гваяколпероксидазы (КФ 1.11.1.7) определяли по методикам, описанным ранее [18, 21]. Навески проростков гомогенизировали при 2–4°С в 0.15 М K, Na-фосфатном буфере, pH 7.6, содержащем ЭДТА (0.1 мМ) и дитиотреитол (1 мМ). Для анализа использовали супернатант после центрифугирования гомогената при 8000 g в течение 10 мин при 2–4°С. Активность СОД определяли, используя метод, основанный на способности фермента конкурировать с нитросиним тетразолием за супероксидные анион-радикалы, образующиеся вследствие аэробного взаимодействия НАДH и феназинметосульфата. Активность каталазы оценивали по количеству пероксида водорода, разложившегося за единицу времени. Активность гваяколпероксидазы определяли, используя в качестве донора водорода гваякол, а в качестве субстрата – пероксид водорода. Активность СОД и гваяколпероксидазы выражали в усл. ед./(г сухой массы × мин), активность каталазы – в ммоль H2O2/(г сухой массы × мин).
Биологическая повторность опытов трехкратная. В таблице и на рисунках приведены средние величины и их стандартные ошибки. За исключением случаев, которые в тексте указаны специально, обсуждались различия, достоверные при P ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Незакаленные проростки ржи частично выживали после 5-часового промораживания при –6°С, в то время как проростки пшеницы не проявляли базовой морозоустойчивости и полностью погибали после криостресса (табл. 1), что согласовывалось с результатами, полученными ранее для других сортов [18]. Прайминг семян НПН почти не влиял на устойчивость незакаленных проростков к промораживанию. Можно отметить лишь тенденцию к небольшому повышению выживания проростков ржи после их обработки 0.2 мМ НПН (табл. 1).
Таблица 1.
Влияние праймирования семян НПН на выживание (%) проростков ржи и пшеницы после 5-часового промораживания при –6 и –8°С
| Вариант | Промораживание незакаленных проростков (5 ч при –6°С) |
Промораживание закаленных проростков (5 ч при –6°С) |
Промораживание закаленных проростков (5 ч при –8°С) |
|---|---|---|---|
| Secale cereale | |||
| Контроль | 23.4 ± 2.0 | 48.2 ± 3.0 | 40.6 ± 2.8 |
| НПН (0.1 мМ) | 24.7 ± 2.3 | 64.8 ± 2.4 | 55.2 ± 2.6 |
| НПН (0.2 мМ) | 27.2 ± 1.8 | 71.6 ± 2.6 | 60.6 ± 2.2 |
| НПН (0.5 мМ) | 25.9 ± 2.1 | 59.1 ± 3.1 | 51.6 ± 2.8 |
| НПН (2.0 мМ) | 23.2 ± 1.8 | 43.3 ± 3.3 | 46.2 ± 3.0 |
| Triticum aestivum | |||
| Контроль | 0 | 34.2 ± 2.8 | 19.6 ± 2.4 |
| НПН (0.1 мМ) | 0 | 58.8 ± 3.2 | 34.9 ± 2.7 |
| НПН (0.2 мМ) | 0 | 59.6 ± 3.4 | 35.8 ± 2.9 |
| НПН (0.5 мМ) | 0 | 41.3 ± 2.7 | 26.3 ± 2.8 |
| НПН (2.0 мМ) | 0 | 31.7 ± 2.9 | 24.2 ± 2.6 |
После 6-суточного холодового закаливания проростки обоих злаков приобретали свойство морозоустойчивости: они частично выживали после действия низких температур (–6 и –8°С). При этом морозоустойчивость проростков ржи была существенно выше, чем пшеницы (табл. 1).
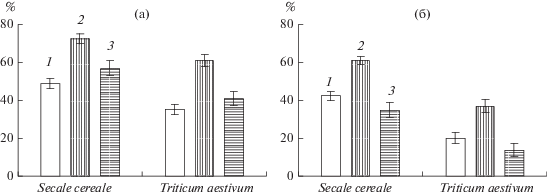
Прайминг семян 0.1–0.5 мМ НПН вызывал повышение морозоустойчивости обоих злаков. Наиболее существенное положительное влияние оказывала обработка семян 0.2 мМ раствором НПН (табл. 1). Такая закономерность проявлялась при промораживании проростков как при ‒6, так и –8°С. Для доказательства специфичности действия НПН в качестве донора NO сравнивали влияние на морозоустойчивость прайминга семян свежеприготовленным и “истощенным” НПН. Обработка семян ржи и пшеницы продуктами светоиндуцированного разложения НПН не оказывала достоверного влияния на морозоустойчивость проростков (рис. 1), что давало основания связывать наблюдаемые эффекты НПН с его действием как донора NO, а не соли.
Рис. 1.
Сравнение влияния свежеприготовленного и “истощенного” НПН на выживание (%) закаленных проростков ржи и пшеницы после промораживания в течение 5 ч при –6°С (а) и –8°С (б). 1 – контроль; 2 – НПН (0.2 мМ); 3 – “истощенный” НПН (0.2 мМ).
Незакаленные проростки ржи содержали большее количество сахаров по сравнению с проростками пшеницы (рис. 2а). В отсутствие низкотемпературного закаливания обработка семян НПН вызывала некоторое повышение содержания сахаров в проростках обоих злаков. Закаливание приводило к более существенному увеличению количества растворимых углеводов. При этом прайминг 0.2 мМ НПН способствовал накоплению большего количества сахаров при закаливании проростков злаков обоих видов (рис. 2а).
Рис. 2.
Содержание сахаров (а), пролина (б), антоцианов (в) и “бесцветных” флавоноидов (г) в проростках ржи и пшеницы при действии НПН и холодового закаливания (6 сут при 2–4°С). 1 – контроль; 2 – НПН (0.2 мМ); 3 – закаливание; 4 – НПН (0.2 мМ) + закаливание.
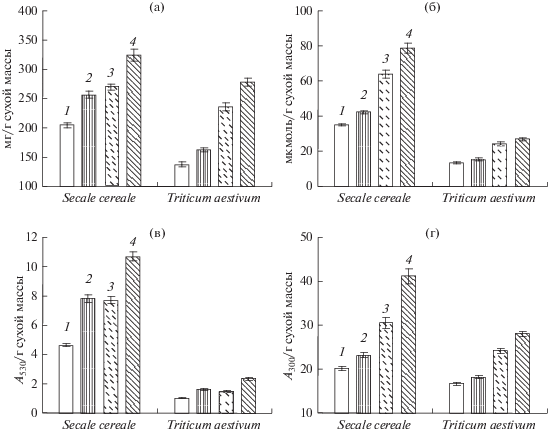
Содержание пролина в незакаленных проростках ржи было выше, чем в проростках пшеницы приблизительно в 2.7 раза (рис. 2б). В отсутствие низкотемпературного закаливания обработка НПН вызывала достоверное увеличение его содержания только у проростков ржи. Под влиянием низкотемпературного закаливания у обоих злаков происходило почти двукратное повышение содержания пролина. При этом прайминг семян донором NO вызывал дополнительное существенное накопление пролина при закаливании проростков ржи, а у проростков пшеницы такой эффект проявлялся лишь на уровне тенденции (рис. 2б).
Содержание антоцианов в контрольных проростках ржи было в 4.5 раза выше, чем в проростках пшеницы (рис. 2в). Обработка семян НПН при росте проростков в обычных температурных условиях вызывала заметное повышение их количества у обоих видов, однако абсолютные величины у ржи были намного больше. Под влиянием закаливания также происходило накопление антоцианов в проростках ржи и пшеницы. Прайминг НПН усиливал этот эффект у обоих злаков, при этом абсолютная величина содержания антоцианов у ржи существенно превышала таковую у пшеницы (рис. 2в).
В обычных температурных условиях количество флавоноидов, поглощающих в УФ-B, несколько увеличивалось у проростков обоих злаков под влиянием прайминга семян донором NO (рис. 2г). После закаливания их содержание при отсутствии прайминга существенно повышалось у обоих злаков. Предобработка НПН вызывала дополнительное накопление флавоноидов, при этом более заметным оно было у проростков ржи (рис. 2г).
Активность СОД у проростков пшеницы в контроле оказалась выше, чем у ржи (рис. 3а). Прайминг НПН в отсутствие холодового закаливания вызывал достоверное повышение активности фермента только у проростков ржи, а после холодового закаливания она повышалась в проростках обоих видов. При этом прайминг семян НПН способствовал увеличению активности фермента, как в проростках ржи, так и пшеницы (рис. 3а).
Рис. 3.
Активность СОД (а), каталазы (б) и гваяколпероксидазы (в) в проростках ржи и пшеницы при действии НПН и холодового закаливания (6 сут при 2–4°С). 1 – контроль; 2 – НПН (0.2 мМ); 3 – закаливание; 4 – НПН (0.2 мМ) + закаливание.
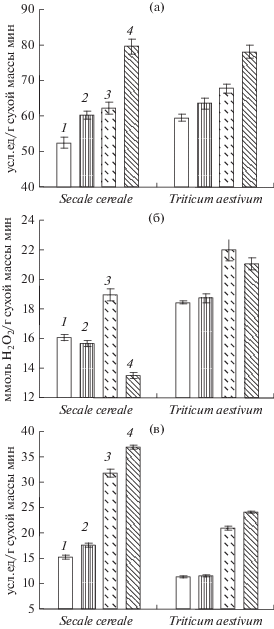
Активность каталазы, как и СОД, в контроле была более высокой у проростков пшеницы (рис. 3б). Холодовое закаливание вызывало повышение активности этого фермента у проростков и ржи, и пшеницы. Обработка семян НПН в обычных условиях существенно не влияла на активность каталазы в проростках обоих видов. В то же время после закаливания в проростках ржи, выращенных из семян, праймированных донором NO, отмечались более низкие значения ее активности (рис. 3б).
Конститутивная активность гваяколпероксидазы в проростках ржи была выше, чем в проростках пшеницы (рис. 3в). В отсутствие холодового закаливания прайминг семян НПН не оказывал существенного влияния на активность этого фермента у обоих видов злаков. Под влиянием закаливания активность гваяколпероксидазы существенно увеличивалась как у ржи, так и у пшеницы. При этом обработка семян донором NO способствовала повышению ее активности у обоих видов.
Под влиянием прайминга НПН в проростках ржи и пшеницы в обычных температурных условиях уменьшалось содержание продукта ПОЛ МДА (рис. 4). Похожий эффект вызывало и низкотемпературное закаливание. При этом в проростках обоих видов, выращенных из семян, обработанных донором NO, отмечались наименьшие величины содержания МДА.
Рис. 4.
Содержание МДА (% к контролю) в проростках ржи и пшеницы при действии НПН, холодового закаливания (6 сут при 2–4°С) и промораживания (5 ч при –6°С). 1 – НПН (0.2 мМ); 2 – закаливание; 3 – НПН (0.2 мМ) + закаливание; 4 – закаливание + + промораживание; 5 – НПН (0.2 мМ) + закаливание + промораживание.
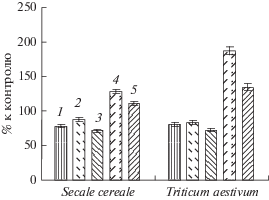
После промораживания содержание МДА в проростках увеличивалось, но особенно заметно это проявлялось у менее морозоустойчивой пшеницы. Праймирование семян НПН заметно уменьшало проявление такого эффекта окислительного стресса у обоих злаков (рис. 4).
В целом, полученные результаты свидетельствовали о положительном влиянии донора NO на формирование морозоустойчивости озимых злаков. Такой эффект в значительной степени связан с накоплением низкомолекулярных полифункциональных протекторов (сахаров, пролина и антоцианов) и отчасти с активацией ферментативной антиоксидантной системы (рис. 2, 3). Об этом свидетельствовало менее выраженное проявление окислительных повреждений после промораживания проростков ржи и пшеницы, выращенных из семян, праймированных НПН (рис. 4).
Следует отметить, что рожь и пшеница заметно различались по вкладу отдельных компонентов антиоксидантной и осмопротекторной систем в формирование устойчивости к криострессу [18]. Так, в условиях данных экспериментов для проростков более морозоустойчивой ржи был характерен достаточно высокий базовый уровень содержания пролина, антоцианов и бесцветных флавоноидов, а также активности гваяколпероксидазы (рис. 2, 3). При этом холодовое закаливание вызвало повышение этих показателей. Прайминг НПН способствовал накоплению пролина у проростков ржи, но не пшеницы как при обычной, так и (в большей степени) при закаливающей температуре (рис. 2б). Влияние донора NO на содержание флавоноидов также более заметно проявлялось у проростков ржи (рис. 2г). В то же время прайминг НПН вызывал увеличение содержания антоцианов и сахаров у обоих злаков, причем как на фоне закаливания, так и в обычных условиях (рис. 2).
Антоцианы обладают высокой антиоксидантной активностью [22]. Они, наряду с другими флавоноидными соединениями, проявляют полифункциональное защитное действие в растительных клетках, составляющими которого являются их осмопротекторные эффекты, способность связывать тяжелые металлы и пр. [23]. Методами биоинформатики показано, что NO задействован в регуляции экспрессии генов, контролирующих синтез флавоноидов, в том числе антоцианов [24]. Полученные результаты согласовывались с такими представлениями.
Другой составляющей положительного влияния прайминга семян на морозоустойчивость проростков злаков донором NO, по-видимому, являлось усиление накопления пролина. Установлено, что холод-индуцированная экспрессия гена Δ1-пирролин-5-карбоксилатсинтазы и накопление пролина у арабидопсиса происходят с участием NO [25]. У злаков, по-видимому, также возможно индуцирование синтеза пролина под действием NO (рис. 2б). Можно предположить, что пределы накопления пролина при экзогенных воздействиях лимитируются видовыми генотипическими особенностями. Так, в условиях холодового закаливания усиление накопления пролина в варианте с праймингом донором NO было существенным у ржи и почти не проявлялось у проростков пшеницы. В то же время ранее было показано, что при фолиарной обработке взрослых растений пшеницы донор NO НПН в зависимости от концентрации может, как усиливать, так и ослаблять проявление индуцированного засухой накопления пролина в листьях [21].
В растительных клетках сахара считаются одними из главных криопротекторов [17]. Прайминг семян обоих видов злаков НПН способствовал их накоплению, причем как на фоне холодового закаливания, так и при обычной температуре (рис. 2а). В литературе мало сведений о влиянии NO на содержание растворимых углеводов у растений. Однако показано, что при фолиарной обработке растений ячменя НПН в условиях засухи повышается содержание сахаров в листьях [6]. Можно предположить, что при стрессах, сопровождающихся осмотическими эффектами (криостресс и засуха), сахара выполняют множественные функции, связанные как с повышением водоудерживающей способности, так и со стабилизацией мембран и антиоксидантной защитой [17, 26].
Феномены сложного (как положительного, так и отрицательного) влияния NO на активность антиоксидантных ферментов описаны в многочисленных работах (например, в обзорах [8, 27]). Однако в условиях описанных экспериментов влияние прайминга семян злаков на активность антиоксидантных ферментов было менее заметным по сравнению с его действием на содержание низкомолекулярных протекторов. Тем не менее, следует отметить заметное увеличение активности СОД под влиянием НПН у проростков обоих видов злаков при холодовом закаливании (рис. 3а).
Известны данные о возможности регуляции NO активности СОД не только на генетическом уровне, но также путем посттрансляционных модификаций. Предполагается, что обратимое нитрозилирование может быть одним из механизмов изменения активности Cu/Zn-СОД [27]. Однако в клетках сладкого картофеля при обработке НПН наблюдали усиление экспрессии гена Cu/Zn-SOD [28]. На изолированных листьях кукурузы получены данные, свидетельствующие о регуляции NO активности СОД с участием многих компонентов сигнальной сети и экспрессии соответствующих генов, о чем свидетельствует снятие его эффекта ингибиторами MAP-киназ (от MAP – mitogen-activated protein kinase) [29].
Наряду с активностью СОД в проростках пшеницы и ржи, выращенных из семян, праймированных донором NO, увеличение активности гваяколпероксидазы при холодовом закаливании было более существенным, чем в вариантах без обработки (рис. 3в). В условиях in vitro показана способность NO к связыванию с гемом пероксидаз [27]. Такой эффект может сопровождаться ингибированием активности фермента. NO in vivo может вызывать активацию экспрессии генов, кодирующих пероксидазы [29]. Можно предположить, что этим обусловлены описанные эффекты повышения активности разных форм пероксидаз при обработке растений донорами NO, в том числе при низкотемпературном стрессе [14, 15]. Примечательно, что в условиях описанных выше экспериментов прайминг НПН вызывал снижение активности другого гемсодержащего фермента – каталазы (рис. 3б). Однако такой эффект четко проявлялся только у проростков ржи, причем на фоне холодового закаливания. В связи с этим представляется маловероятным прямое ингибирование фермента за счет связывания NO с гемовым активным центром [27]. Можно предположить, что снижение активности каталазы у проростков ржи, выращенных из семян, праймированных НПН, связано с регуляторными процессами, например, большим вкладом в обезвреживание АФК других компонентов антиоксидантной системы, в частности, пероксидазы и низкомолекулярных антиоксидантов.
Таким образом, в настоящей работе показан феномен усиления донором NO эффекта низкотемпературного закаливания проростков злаков, приводящий к повышению их морозоустойчивости. Его биохимическими составляющими являлись в первую очередь усиление накопления низкомолекулярных полифункциональных протекторов (сахаров, пролина и флавоноидных соединений) и отчасти повышение активности антиоксидантных ферментов (СОД и гваяколпероксидазы). Вполне естественно, что обработка экзогенным NO могла способствовать и активации других протекторных систем. Например, у растений арабидопсиса показана зависимость от NO-статуса экспрессии таких специфических холод-чувствительных генов как CBF1, CBF2, CBF3, LTI30, LTI78 и COR15a [10, 11]. Экспрессия гена протеинкиназы CPK27 при холодовой акклимации томата оказалась зависимой от NO [30]. В целом NO, по-видимому, можно рассматривать в качестве агента, активирующего криозащитные механизмы. Однако такая активация, по крайней мере, в рамках исследуемой модели, четко проявлялась только на фоне действия низкой закаливающей температуры. Можно предположить, что активация ключевых механизмов, связанных с экспрессией генов и обусловливающих развитие морозоустойчивости, запускается действием низких положительных температур, а NO, наряду с другими компонентами сигналинга, участвует в обеспечении этого процесса.
Список литературы
Savvides A., Ali S., Tester M., Fotopoulos V. // Trends Plant Sci. 2016. V. 21. № 4. P. 329–340.
Filippou P., Tanou G., Fotopoulos V. // Plant Acclimation to Environmental Stress. / Eds. Tuteja N., Singh Gill S. N.Y.: Springer, 2013. P. 1–27.
Wilson I.D., Neill S.J. Hancock J.T. // Plant Cell Environ. 2008. V. 31. № 5. P. 622–631.
Kolupaev Yu.E., Karpets Yu.V., Dmitriev A.P. // Cytol. Genet. 2015. V. 49. № 5. P. 338–348.
Масленникова Д.Р., Аллагулова Ч.Р., Федорова К.А., Плотников А.А., Авальбаев А.М., Шакирова Ф.М. // Физиология растений. 2017. Т. 64. № 5. С. 355–362.
Yemets A.I., Karpets Yu.V., Kolupaev Yu.E., Blume Ya.B. // Reactive Oxygen, Nitrogen and Sulfur Species in Plants: Production, Metabolism, Signaling and Defense Mechanisms. V. 2 / Eds. Hasanuzzaman M., Fotopoulos V., Nahar K., Fujita M. John Wiley & Sons Ltd., 2019. P. 873–922. https://doi.org/10.1002/9781119468677.ch39
Глянько А.К., Васильева Г.Г. // Прикл. биохимия и микробиология. 2010. Т. 46. № 1. С. 21–28.
Мамаева А.С., Фоменков А.А., Носов А.В., Мошков И.Е., Мур Л.А.Дж., Холл М.А., Новикова Г.В. // Физиология растений. 2015. Т. 62. № 4. С. 459–474.
Khan M.N., Mohammad F., Mobin M., Ali Saqib M. // Nitric Oxide in Plants: Metabolism and Role in Stress Physiology. / Eds. Khan M.N., Mobin M., Mohammad F., Corpas F. Switzerland: Springer Intern. Pub., 2014. P. 225–242.
Puyaubert J., Baudouin E. // Plant Cell Environ. 2014. V. 37. № 12. P. 2623–2630.
Baudouin E., Jeandroz S. // Nitric Oxide Action in Abiotic Stress Responses in Plants / Eds. Khan M.N., Mobin M., Mohammad F., Corpas F. Switzerland: Springer Intern. Pub., 2015. P. 129–139.
Fancy N.N., Bahlmann A.K., Loake G.J. // Plant Cell Environ. 2017. V. 40. № 4. P. 462–472.
Sehrawat A., Deswal R. // J. Proteome Res. 2014. V. 13. № 5. P. 2599–2619.
Fan J., Chen K., Amombo E., Hu Z., Chen L., Fu J. // Plos ONE. 2015. V. 10. № 7. e0132991.
Esim N., Atici Ö. // Front. Life Sci. 2015. V. 8. № 2. P. 124–130.
Bibi A., Majid S.A., Ulfat A., Khatoon S., Munir A., Javed G. // J. Animal Plant Sci. 2017. V. 27. № 1. P. 186–191.
Трунова Т.И. Растение и низкотемпературный стресс: 64-е Тимирязевское чтение. М.: Наука, 2007. 54 с.
Колупаев Ю.Е., Рябчун Н.И., Вайнер А.А., Ястреб Т.О., Обозный А.И. // Физиология растений. 2015. Т. 62. № 4. С. 533–541.
Bates L.S., Walden R.P., Tear G.D. // Plant Soil. 1973. V. 39. № 1. P. 205–210.
Ястреб Т.О., Колупаев Ю.Е., Луговая А.А., Дмитриев А.П. // Прикл. биохимия и микробиология. 2016. Т. 52. № 2. С. 223–229.
Колупаев Ю.Е., Карпец Ю.В., Ястреб Т.О., Луговая А.А. // Прикл. биохимия и микробиология. 2018. Т. 54. № 4. С. 400–407.
Neill S.O., Gould K.S. // Funct. Plant Biol. 2003. V. 30. № 8. P. 865–873
Khlestkina E.K. // Cereal Res. Commun. 2013. V. 41. № 2. P. 185–198
Palmieri M.C., Sell S., Huang X., Scherf M., Werner T., Durner J., Lindermayr C. // J. Exp. Bot. 2008. V. 59. № 2. P. 177–186.
Zhao M.G., Chen L., Zhang L.L., Zhang W.H. // Plant Physiol. 2009. V. 151. № 2. P. 755–767.
Ramel F., Sulmon C., Bogard M., Couée I., Gouesbet G. // BMC Plant Biol. 2009. V. 9. P. 28
Arora D., Jain P., Singh N., Kaur H., Bhatla S.C. // Free Radical Res. 2016. V. 50. № 3. P. 291–303.
Lin C.C., Jih P.J., Lin H.H., Lin J.S., Chang L.L., Shen Y.H., Jeng S.T. // Plant Mol. Biol. 2011. V. 77. № 3. P. 235–249.
Zhang, A., Jiang, M., Zhang, J. Ding H., Xu S., Hu X., Tan M. // New Phytol. 2007. V. 175. № 1. P. 36–50.
Lv X., Li H., Chen X., Xiang X., Guo Z., Yu J., Zhou Y. // J. Exp. Bot. 2018. V. 69. № 16. P. 4127–4139.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


