Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 190-197
Антибактериальная и иммуномодулирующая активность наночастиц серебра на модели экспериментального туберкулеза мышей
О. В. Калмантаева 1, *, В. В. Фирстова 1, Н. С. Грищенко 1, Т. И. Рудницкая 1, В. Д. Потапов 1, С. Г. Игнатов 1
1 “Государственный научный центр прикладной микробиологии и биотехнологии” Роспотребнадзора
142279 Московская обл., Оболенск, Россия
* E-mail: kalmantaevaov@yandex.ru
Поступила в редакцию 16.09.2019
После доработки 10.10.2019
Принята к публикации 01.11.2019
Аннотация
Исследовали антибактериальную активность наночастиц серебра размером 43.6 ± 10.7 нм в отношении штамма Mycobacterium tuberculosis H37Rv в экспериментах in vitro (изученные концентрации наночастиц 0.1, 1.0, 10, 25 и 50 мкг/мл) и на экспериментальной мышиной модели хронического туберкулеза. Показано, что наночастицы серебра в концентрации 50 мкг/мл подавляли рост микобактерий in vitro в 2 раза. Ингаляционное введение наночастиц серебра в дозе 0.1 мг/кг мышам, больным туберкулезом, приводило к снижению обсемененности легких и селезенок M. tuberculosis на 2 порядка. У этих животных снижалось количество белка в жидкости бронхо-легочного лаважа в 2 раза до показателя 1908.5 ± 105.7 (Р < 0.001), что свидетельствовало об уменьшении воспалительных процессов в легких; увеличивался уровень продукции активных форм кислорода нейтрофилами, отражающий их бактерицидный потенциал, который до лечения был снижен в 2.7 раза по сравнению с контрольной группой животных (Р < 0.001). После введения наночастиц серебра было отмечено восстановление соотношения популяций лимфоцитов в селезенке и цитокинового баланса, выраженное в снижении уровней интерферона-гамма (ИФН-γ), фактора некроза опухоли-альфа (ФНО-α) и интерлейкина-4 (ИЛ-4) в сыворотке крови и жидкости бронхо-легочного лаважа у больных туберкулезом мышей. Таким образом, впервые было показано, что ингаляционное введение наночастиц серебра, стабилизированных поливинилпирролидоном, приводило не только к заметному бактерицидному эффекту, но и восстанавливало баланс иммунной системы мышей.
Туберкулез (ТБ) является социально значимой инфекцией в мире. По данным Всемирной Организации Здравоохранения туберкулез – одна из десяти самых распространенных причин смерти в человеческой популяции. Несмотря на все проводимые мероприятия по борьбе с ТБ, уровень заболеваемости и смертности от данной инфекции остается высоким. В 2017 г. туберкулезом заболело 10 миллионов человек, а умерло около 1.3 миллиона человек [1].
Основным компонентом в лечениии туберкулеза остается антибиотикотерапия. Однако противотуберкулезная химиотерапия имеет серьезные недостатки. Увеличивается резистентность Mycobacterium tuberculosis к используемым антибиотикам, проявляется их побочное действие из-за длительности приема, больших доз и необходимости применять в комбинации сразу нескольких антибиотиков. Рекомендованные схемы лечения имеют низкую эффективность, высокую стоимость и требуют длительного лечения [2].
Растущая заболеваемость ТБ и устойчивость микобактерий к антибиотикам побуждает ученых искать другие эффективные противотуберкулезные агенты. Сегодня в этой области разрабатываются несколько направлений, включающих использование моноклональных антител [3, 4], микобактериофагов [5, 6], бактериальных вакцин [https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC3634041/], иммуномодуляторов [7] и наночастиц серебра (НЧС) [8, 9]. С древних времен серебро являлось одним из основных антимикробных средств в медицине и использовалось в лечении инфекционных заболеваний. Терапевтические свойства серебра известны более 2000 лет [10]. В настоящее время развитие нанотехнологий позволило изменять размеры и свойства веществ на наноуровне, результатом чего стало увеличение антимикробного потенциала серебра путем использования его в форме наночастиц. Применение серебра в виде наночастиц позволяет в сотни раз снизить концентрацию серебра с сохранением бактерицидных свойств [11] и использовать данные препараты в медицине (перевязочные материалы, покрытия медицинских приборов, антимикробные препараты) [https:// link.springer.com/article/10.1186/2228-5326-2-32, 12]. Наночастицы серебра характеризуются бактерицидностью против широкого спектра грамотрицательных и грамположительных микроорганизмов [https://www.ncbi.nlm.nih.gov/pmc/articles/ PMC3199605/,13], включая антибиотикорезистентные штаммы [14]. В ряде научных работ показана антибактериальная активность НЧС в отношении микобактерий, в том числе лекарственно-устойчивым клиническим изолятам, а также отмечается значительное увеличение эффективности применения противотуберкулезных антибиотиков в комбинации с наночастицами серебра [8, 9, 15]. Изучение взаимосвязи проводимого лечения с иммунным статусом больных туберкулезом является одним из наиболее важных и активно развивающихся направлений во фтизиатрии [16]. Ранее было показано, что наночастицы активны против M. tuberculosis со множественной устойчивостью к антибиотикам (https://www.frontiersin. org/articles/10.3389/fmicb.2018.02207/full), а ингаляционное введение наночастиц повышает эффективность антибиотиков [17]. Однако, вопрос одновременной оценки бактерицидной и иммуномодулирующей активности наночастиц, остается открытым. Недавно были опубликованы данные об одновременной оценки бактерицидной и иммуномодулирующей активности наномодифицированных поверхностей [18]. Но эта работа проводилась на других микроорганизмах и без применения животных моделей.
Цель работы − изучение антимикробной активности наночастиц серебра в отношении возбудителя туберкулеза M. tuberculosis и оценка иммунных показателей экспериментальных животных после воздействия данных наночастиц.
МАТЕРИАЛЫ И МЕТОДЫ
Наночастицы серебра. В работе использовали водную дисперсию наночастиц серебра, стабилизированных низкомолекулярным полимером медицинского назначения поливинилпирролидоном (НЧС-ПВП) (препарат “Арговит”, ООО НПЦ “Вектор-Вита”, Россия). В предыдущих исследованиях нанодисперсного компонента данного препарата было показано, что в нем содержится 1.0–1.4% серебра (по массе) и 18.6–19.0% ПВП с молекулярной массой 15–30 кДа, а средний диаметр наночастиц серебра составляет 43.6 ± 10.7 нм [19, 20].
Штамм Mycobacterium tuberculosis H37Rv. Приготовление стоков Mycobacterium tuberculosis осуществляли из лиофильно высушенной культуры, полученной из отдела коллекционных культур ФБУН ГНЦ ПМБ (“ГКПМ – Оболенск” ФБУН ГНЦ ПМБ). Бактерии культивировали во флаконах объемом 100–500 мл в модифицированной жидкой среде Middelbrook 7H9 (“Himedia”, Индия) с добавкой 10% OADC и 0.05% Твина 80 в течение 21 сут при температуре 37°С в микроаэрофильных условиях. Культуры выращивали до оптической плотности, соответствующей 5 × 107–108 КОЕ.
Определение антимикробной активности наночастиц серебра. Определение антимикробной активности наночастиц серебра in vitro проводили суспензионным методом (МУ 3.5.2596-10). Для этого готовили рабочую суспензию штамма Mycobacterium tuberculosis H37Rv в концентрации 1 × × 109 КОЕ/мл, что обеспечивало возможность создания в смеси (наночастицы серебра с суспензией) концентрацию микроорганизмов порядка 1 × 108 КОЕ/мл. Смешивали суспензию микобактерий и наночастиц серебра в соотношении 1 : 9. Проверяли концентрации 0.1, 1.0, 10, 25 и 50 мкг/мл. Концентрация 50 мкг/мл была максимальной для данного препарата, поэтому ингибирующее действие оценивали не по значению минимальной ингибирующей концентрации (МИК), а по подавлению роста (КОЕ) микобактерий. Экспозиция наночастиц серебра с микобактериями составила 1 ч при 37°С. Данной экспозиции достаточно для необратимого взаимодействия наночастиц серебра с мембранными структурами бактерий. В контрольные пробирки вместо наночастиц добавляли забуференный физиологический раствор. После экспозиции из смеси проиводили посев из каждой пробы по 0.1 мл на чашки Петри с плотной питательной средой Middlebrook 7Н11 AgarBase (“HiMedia”, Индия) с добавлением 10% сыворотки КРС и культивировали в термостате при 37°С 21 сут. Затем проводили подсчет КОЕ.
Экспериментальные животные. В работе использовали мышей линии С57Bl/6: самки в возрасте 7–8 нед., весом 18–20 г. Животные были получены из филиала “Андреевка” “Научный центр биомедицинских технологий” Российской академии медицинских наук (пос. Андреевка, Россия). Мышей содержали группами по 5 животных в микроизоляторах. В свободном доступе мыши получали стандартный гранулированный корм и питьевую воду.
Схема эксперимента. Животные были разделены на три группы (две опытные и контрольная) по 15 мышей в каждой. Животные опытных групп были заражены штаммом М. tuberculosis H37Rv внутрибрюшинно введением 0.2 мл суспензии микобактерий в забуференном физиологическом растворе в дозе 5 × 104 КОЕ/животное (мышиная модель экспериментального хронического туберкулеза). Через 4 мес. мышей из одной опытной группы (ТБ+НЧС-ПВП) ингаляционно обработали НЧС-ПВП в аэрозольной камере СО 099С А4224 (“GLAS-COL Apparatus”, США). При ингаляционном введении аэрозоль генерировался из водной дисперсии наночастиц серебра калиброванным стеклянным распылителем, представляющим конструктивно трубку Вентури с объемом распыляемой жидкости до 7 см3. Введение препарата проводили однократно в дозе 0.1 мг наночастиц серебра на 1 кг массы тела. Мышей из второй опытной группы (ТБ) через 4 мес. после заражения ингаляционно однократно обработали физиологическим раствором аналогичным способом. Контрольная группа животных (контроль) – здоровые мыши, однократно ингаляционно обработанные физиологическим раствором аналогичным способом. Микробиологические высевы из легких и селезенок опытных групп животных проводили на 1, 10 и 30 сут после обработки наночастицами серебра. Оценку иммунных показателей проводили у мышей всех групп животных. Изучение многократного ингаляционного воздействия наночастиц серебра на аналогичные иммунные показатели здоровых мышей в дозе 0.1 мг/кг было проведено и опубликовано ранее [20].
Определение КОЕ M. tuberculosis. Определение КОЕ M. tuberculosis H37Rv в органах зараженных животных проводили высевом гомогенатов органов в 10-кратном разведении в забуференном физиологическом растворе на плотную питательную среду Middelbrook 7H11 AgarBase (“Himedia”, Индия) с добавлением 10%-ной сыворотки КРС. Учет колоний проводили на 28 сут.
Получение культуры спленоцитов [21]. Селезенки опытных и контрольных групп мышей стерильно гомогенизировали через капроновый фильтр в среду RPMI-1640 (“ПанЭко”, Россия). Клеточную суспензию отмывали путем центрифугирования при 250 g по 10 мин. Осадок ресуспендировали в полной питательной среде RPMI-1640. Число жизнеспособных клеток определяли в тесте с трипановым синим с помощью автоматического клеточного счетчика CountessTM (“Invitrogen”, Корея). Количество жизнеспособных спленоцитов доводили до концентрации 5 × 106 кл./мл.
Получение нейтрофилов перитонеального экссудата [21]. Для рекрутизации нейтрофилов в брюшную полость мышам вводили внутрибрюшинно 2 мл мясо-пептонного бульона и через 2 ч эвтаназировали мышей. После декапитации и обескровливания животного асептически готовили рабочую область. Затем делали небольшое отверстие в брюшной стенке и пятикратно промывали брюшную полость холодным (4°С) раствором Хенкса. Полученную из брюшной полости клеточную суспензию помещали на ледяную баню и использовали для экспериментов не позже, чем через 1 ч после получения. Число жизнеспособных клеток определяли в тесте с трипановым синим с помощью автоматического клеточного счетчика CountessTM (“Invitrogen”, Корея). Количество жизнеспособных нейтрофилов доводили до концентрации 5 × 106 кл./мл.
Определение субпопуляционного состава лимфоцитов и количества цитокинпродуцирующих Т-лимфоцитов селезенки. Определение проводили методами проточной цитофлюорометрии как описано [21, 22]. Спленоциты (5 × 106 кл./мл) опытных и контрольных групп мышей окрашивали моноклональными антителами CD3 PerCP, CD4 APC, CD8 PE, CD19 APC, IFN-γ FITC и TNF-α APC (“eBioscience”, США) в течение 20 мин в темноте при 20°С в соответствии с инструкцией производителя. Полученные образцы отмывали в фосфатно-солевом буфере и фиксировали 1%-ным раствором формалина. Образцы анализировали на проточном цитофлюориметре FACSCalibur (“Becton Dickinson”, США). Процентное содержание субпопуляций клеток в образцах определяли с использованием программы “CellQuest Pro”.
Определение количества ИФН-γ и ФНО-а в сыворотке крови и жидкости бронхо-легочного лаважа. Определение проводили методом иммуноферментного анализа с использованием наборов “Mouse IFN-γ ELISA” и “TNF-α ELISA” (“Bender MedSystems”, Австрия) в соответствии с руководством производителя. Оптическую плотность измеряли на планшетном многофункциональном анализаторе Victor X3 2030 (“Perkin Elmer”, Финляндия) при длине волны 450 нм.
Определение продукции активных форм кислорода нейтрофилами методом люминолзависимой хемилюминесценции (ХЛ). В каждую лунку 96-луночного планшета вносили суспензию нейтрофилов (5 × × 106 кл./мл), для усиления ХЛ применялся раствор люминола с концентрацией 5.6 × 10–4 М (“BioChemika”, Чехия). В качестве индуктора фагоцитоза был использован опсонизированный зимозан в концентрации 2 мг/мл (“Sigma”, США). Значение ХЛ измерялось 6 раз на универсальном планшетном многофункциональном анализаторе Victor X3 2030 (“Perkin Elmer”, Финляндия) при 37°С. Длительность одного измерения составляла 10 мин. Интенсивность хемилюминесценции выражали количеством импульсов, накопленных за одно измерение.
Определение количества белка, содержащегося в жидкости бронхо-легочного лаважа. Определение проводили с использованием набора PierceTM BCA Protein Assay Kit (“Sigma”, США). Оптическую плотность измеряли на планшетном многофункциональном анализаторе Victor X3 2030 (“Perkin Elmer”, Финляндия) при длине волны 562 нм.
Статистическая обработка результатов. Достоверность различий определяли с помощью t‑критерия Стьюдента. Различия между группами признавали достоверными при уровне значимости P < 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Результаты определения антимикробной активности наночастиц серебра разной концентрации in vitro представлены в табл. 1. Подавление роста микобактерий штамма M. tuberculosis H37Rv на плотной питательной среде Middelbrook 7H11 AgarBase (“Himedia”, Индия) с добавлением 10% сыворотки КРС наблюдалось после экспозиции в суспензии с НЧС-ПВП в концентрациях 10, 25 и 50 мкг/мл. Количество выросших КОЕ микобактерий снижалось в 2 раза после воздействия НЧС-ПВП в концентрации 50 мкг/мл (табл. 1).
Таблица 1.
Содержание субпопуляций лимфоцитов в селезенке мышей (%)
| Показатель | Содержание лимфоцитов в селезенке мышей линии C57Bl/6, % | |||
|---|---|---|---|---|
| Т-лимфоциты | Т-хелперы | цитотоксические лимфоциты | В-лимфоциты | |
| ТБ | 41.89 ± 2.25* | 28.47 ± 1.37* | 4.13 ± 0.18 | 27.14 ± 1.38* |
| ТБ + НЧС-ПВП | 37.23 ± 1.85 | 24.31 ± 1.23 | 5.54 ± 0.27 | 34.02 ± 1.72 |
| Контроль | 36.12 ± 1.72 | 23.02 ± 1.15 | 6.32 ± 0.31 | 35.41 ± 1.82 |
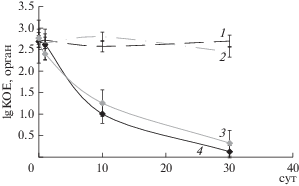
В экспериментах, проведенных на мышах с хронической формой туберкулеза, до введения НЧС-ПВП среднее количество микобактерий в легких было 4.2 × 102 КОЕ, а в селезенке – 4.4 × × 102 КОЕ. Через 10 сут после ингаляционного введения НЧС-ПВП животным наблюдалось резкое снижение обсемененности органов (среднее количество микобактерий в легких составило 10 КОЕ, а в селезенке – 21 КОЕ), которое сохранялось до 30 сут (рис. 1).
Рис. 1.
Динамика снижения обсемененности органов M. tuberculosis у мышей, больных хроническим ТБ, в течение месяца после ингаляционного воздействия НЧС-ПВП: 1 – обсемененность легких микобактериями в группе больных ТБ мышей; 2 – обсемененность селезенок микобактериями в группе больных ТБ мышей; 3 – обсемененность селезенок микобактериями в группе больных ТБ мышей после введения НЧС-ПВП; 4 – обсемененность легких микобактериями в группе больных ТБ мышей после введения НЧС-ПВП.
Полученные нами данные об антимикробной активности НЧС-ПВП в отношении М. tuberculosis H37Rv согласуются с работами других исследователей. Так, Selim et al.по-русски или в работе [9] показали, что минимальная подавляющая концентрация наночастиц серебра (50 нм) для штамма M. tuberculosis H37Rv составила 1 мкг/мл [9]. Захаров с соавт., изучили совместное воздействие наночастиц серебра (3–60 нм) с изониазидом в экспериментах in vitro и in vivo. Было установлено, что в сочетании с изониазидом в концентрации 1 мкг/мл минимальная подавляющая концентрация наночастиц серебра для микобактерий составляла 2.5 мкг/мл. В экспериментах in vivo авторы определяли влияние НЧС на продолжительность жизни мышей, больных ТБ. Так, индекс выживаемости животных при использовании только НЧС в дозах 12.5 и 50 мкг/кг был равен индексу выживаемости животных, получавших изониазид в дозе 50 мг/кг, и составлял 40%. А при лечении НЧС в дозе 25 мкг/кг индекс выживаемости увеличивался до 60%. При совместном использовании НЧС с изониазидом (50 мг/кг) индекс выживаемости мышей составлял от 80 до 100% [15].
Течение и исход туберкулезной инфекции во многом определяется степенью активации Th1-лимфоцитов и фагоцитов [23]. Ключевая роль в формировании клеточного иммунного ответа при туберкулезной инфекции отводится различным субпопуляциям Т-лимфоцитов: CD4+–Т-лимфоцитам-хелперам, регулирующим фагоцитарную и бактерицидную активность макрофагов и CD8+ цитотоксическим-Т-лимфоцитам, способным оказывать прямое цитотоксическое действие на клетки, инфицированные микобактериями [24]. В группе больных ТБ мышей было выявлено увеличение относительного количества Т-лимфоцитов за счет субпопуляции Т-хелперов и снижение относительного количества цитотоксических-Т-лимфоцитов и В-лимфоцитов в селезенке. В группе больных ТБ мышей после введения НЧС-ПВП относительное количество Т-лимфоцитов (в том числе Т-хелперов и цитотоксических-Т-лимфоцитов) и B-лимфоцитов в селезенке не отличалось от значений данных показателей в контрольной группе животных (табл. 2 ).
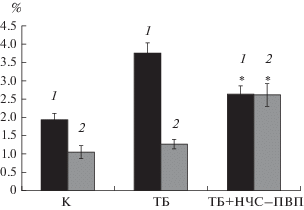
При микобактериальных инфекциях происходит преимущественное образование Т-лимфоцитов 1 типа, характерными чертами которых является продукция цитокинов ИФН-γ и ФНО-α [23]. Оба цитокина способны стимулировать антимикобактериальную активность макрофагов, чем в первую очередь, и обусловлен протективный эффект Т-хелперов. В проведенных экспериментах показано, что в группе мышей больных ТБ процентное содержание продуцирующих ИФН-γ Т‑хелперов возрастало в 2 раза по сравнению с контролем (рис. 2). Ингаляционное введение НЧС-ПВП больным ТБ мышам приводило к снижению относительного количества ИФН-гамма-продуцирующих лимфоцитов в селезенке. Можно предположить, что уменьшение относительного количества продуцирующих ИФН-γ лимфоцитов в селезенке больных ТБ мышей после введения НЧС-ПВП вызвано уменьшением количества клеток M. tuberculosis. По мнению ряда авторов, высокое содержание продуцирующих ИФН-γ-лимфоцитов у больных туберкулезом является следствием перманентной стимуляции Т‑клеток антигенами микобактерий и увеличением пула антигенспецифических Т-лимфоцитов. Лечение туберкулеза сопровождается снижением количества ИФН-γ-позитивных клеток [25].
Рис. 2.
Количество (%) продуцирующих цитокин Т‑хелперов (CD3+CD4+): 1 – CD3+CD4+ИФН-γ+; 2 – CD3+CD4+ФНО-α +. К (контроль)– группа здоровых мышей, ТБ – группа больных ТБ мышей, ТБ + + НЧС-ПВП – группа больных ТБ мышей через месяц после введения НЧС-ПВП. Результат статистически достоверен по сравнению с группой мышей, больных ТБ (Р < 0.05).
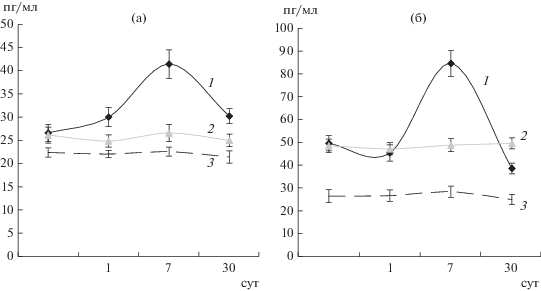
Изучение динамики изменения содержания свободного ИФН-γ в сыворотке крови больных ТБ мышей в течение месяца после введения НЧС-ПВП показало достоверное увеличение количества данного цитокина на 7 сут после воздействия. Содержание ИФН-γ в группе больных ТБ мышей составляло 26.6 ± 1.83 пг/мл, а на 7 сут после введения НЧС-ПВП – 41.34 ± 3.06, Р < 0.05. На 30 сут уровень ИФН-γ снижался до 30.20 ± ± 1.62 пг/мл, но оставался достоверно выше показателей контрольной группы и группы мышей, больных ТБ (рис. 3а). В жидкости БЛЛ больных ТБ мышей на 7 сут после введения НЧС-ПВП также наблюдалось значительное увеличение содержания ИФН-γ до значения 85.00 ± 5.68 пг/мл по сравнению с уровнем данного цитокина до введения НЧС-ПВП (50.01 ± 3.33 пг/мл, Р < 0.05). НА 30 сут после введения НЧС-ПВП содержание ИФН-γ составляло 39.00 ± 2.35 пг/мл, что достоверно ниже содержания данного цитокина в группе больных ТБ мышей (Р < 0.05)(рис. 3б). Значительное увеличение содержания данного цитокина в сыворотке и жидкости БЛЛ через 7 сут после введения НЧС-ПВП больным ТБ мышам по времени совпадало с уменьшением количества микобактерий в легких и селезенке. В работе [25]отмечается, что у больных туберкулезом уровень ИФН-γ в крови снижен по сравнению со здоровыми лицами, а лечение туберкулеза сопровождалось повышением сывороточного уровня ИФН-γ.
Рис. 3.
Динамика изменения содержания ИФН-γ в сыворотке крови мышей (а) и в жидкости бронхо-легочного лаважа (б) в течение месяца. 1 – группа больных ТБ мышей после введения НЧС-ПВП, 2 – группа больных ТБ мышей, 3– группа здоровых мышей.
Несмотря на то, что ингаляционное введение НЧС-ПВП больным ТБ мышам приводило к увеличению относительного количества ФНО-α-продуцирующих Т-хелперов в селезенке (рис. 2), количество свободного ФНО-а в сыворотке крови и жидкости БЛЛ – уменьшалось (рис. 4, 5), что указывало на снижение уровня воспалительных реакций организма [23, https://www.ncbi.nlm.nih.gov/ pubmed/22761866].
Рис. 4.
Содержание цитокинов в сыворотке крови мышей: 1 – ИФН-γ, 2 – ФНО-α, 3 – ИЛ-4. К (контроль) – группа здоровых мышей, ТБ – группа больных ТБ мышей, ТБ + НЧС-ПВП – группа больных ТБ мышей через 1 мес. после введения НЧС-ПВП. *Результат статистически достоверен по сравнению с группой мышей, больных ТБ (Р < 0.001).
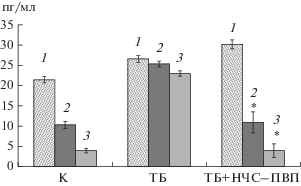
Рис. 5.
Содержание цитокинов в жидкости бронхо-легочного лаважа мышей: 1− ИФН-γ, 2 − ФНО-α, 3 − ИЛ-4. К (контроль) – группа здоровых мышей, ТБ – группа больных ТБ мышей, ТБ + НЧС-ПВП – группа больных ТБ мышей через 1 мес. после введения НЧС-ПВП. * Результат статистически достоверен по сравнению с группой мышей, больных ТБ (Р < 0.001).
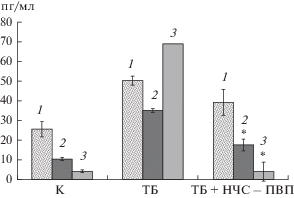
Для лучшего понимания воздействия НЧС-ПВП на течение хронического туберкулеза мы определили содержание противовоспалительного цитокина интерлейкина-4 (ИЛ-4) в сыворотке крови и жидкости БЛЛ экспериментальных животных. В результате проведенных исследований в группе больных ТБ мышей было установлено значительное увеличение содержания свободного ИЛ-4 в сыворотке крови и в жидкости БЛЛ в 6 и 17 раз соответственно относительно значений данных показателей в контрольной группе (3.67 ± 0.72 и 4.12 ± 0.64 пг/мл, Р < 0.001). Через 30 сут после введения наночастиц серебра у мышей, больных ТБ, наблюдалось снижение уровня ИЛ-4 до 4.23 ± ± 1.08 пг/мл в сыворотке крови и до 3.91 ± ± 0.55 пг/мл в жидкости БЛЛ (Р < 0.001), что достоверно не отличалось от содержания ИЛ-4 в исследованных биологических жидкостях животных контрольной группы (рис. 4, 5). Фтизиатры отмечают, что при тяжелых формах туберкулезной инфекции, а также на ее поздних стадиях наблюдается локальное и системное повышение продукции ИЛ-4 [26]. Однако иммунный ответ с избыточной продукцией ИЛ-4 скорее является иммунопатологическим, чем защитным и не может уничтожить микобактериальную инфекцию (бактериостатический иммунный ответ) [27], поэтому снижение содержания ИЛ-4 является благоприятным прогностическим маркером после противотуберкулезной химиоиммунотерапии [28].
Нейтрофилы являются одними из первых клеток, которые мигрируют в очаг туберкулезной инфекции, где постепенно накапливаются с развитием хронической стадии заболевания [23, 29]. Нейтрофилы человека и мыши эффективно фаго-цитируют микобактерии, участвуют в инициации Т-клеточного ответа [30, 31] и в образовании гранулемы [32]. Одним из механизмов бактерицидного действия нейтрофилов является продукция активных форм кислорода (окислительный взрыв) [33], уровень которой может быть измерен с помощью метода люминолзависимой хемилюминесценции. В нашей экспериментальной работе в группе больных ТБ мышей наблюдалось достоверное снижение уровня продукции активных форм кислорода (АФК) нейтрофилами в 2.7 раза по сравнению с контрольной группой животных (Р < 0.001).
В группе больных мышей, обработанных НЧС-ПВП, через 1 и 7 сут после введения наночастиц также отмечалось снижение продукции АФК относительно контроля, однако через 30 сут было установлено достоверное увеличение данного показателя в 2.5 раза (Р < 0.001) относительно группы больных ТБ мышей, необработанных наночастицами серебра (рис. 6). Наблюдаемое в нашей работе снижение продукции АФК нейтрофилами у больных ТБ мышей согласуется с данными работы [34] или по русски фамилию, где отмечается, что у мышей, зараженных микобактериями, нарушается окислительный взрыв нейтрофилов. Установленное нами увеличение продукции АФК нейтрофилами через 30 сут после введения НЧС-ПВП опосредовано, скорее всего, снижением микобактериальной нагрузки организма.
Рис. 6.
Уровень продукции АФК нейтрофилами мышей в контроле и эксперименте после введения НЧС через 1 (а), 7 (б) и 30 (в) сут. Контроль (К)– группа здоровых мышей, ТБ – группа больных ТБ мышей, ТБ + НЧС-ПВП – группа больных ТБ мышей после введения НЧС-ПВП. Значение ХЛ измерялось в течение 1 ч 6 раз, длительность одного измерения 10 мин. Каждый столбец – одно измерение. * Результат статистически достоверен по сравнению с контролем (Р < 0.001). ** Pезультат статистически достоверен по сравнению с группой мышей, больных ТБ (Р < 0.001).

Воспаление всегда сопровождает инфекцию и представляет собой важнейший компонент иммунной защиты хозяина. Однако гипервоспалительные реакции могут способствовать обострению заболевания [23]. Повышение концентрации белка в жидкости бронхо-легочного лаважа является одним из признаков легочного воспаления, так как отражает альвеолярно-капиллярную проницаемость [35]. Данный показатель был выбран нами для оценки уровня воспаления в легких экспериментальных животных. У мышей, больных ТБ, наблюдалось увеличение содержания белка в жидкости БЛЛ в 4 раза по сравнению с таковым показателем в контрольной группе животных (табл. 3 ). После воздействия НЧС-ПВП количество белка в жидкости БЛЛ снижалось в 2 раза до показателя 1908.5 ± 105.7 (Р < 0.001), что отражает уменьшение воспаления в легких (табл. 3 ).
На основании проведенной работы можно заключить, что наночастицы серебра обладают антимикробной активностью в отношении штамма M. tuberculosis H37Rv в экспериментах in vitro и in vivo. В проведенной нами работе отмечено восстановление иммунных показателей больных ТБ мышей после воздействия НЧС. В предыдущей работе [20] было показано, что многократное ингаляционное введение НЧС-ПВП здоровым мышам в той же дозе не вызывало иммунопатологических изменений у экспериментальных животных, поэтому НЧС могут рассматриваться в качестве перспективных препаратов в мероприятиях профилактики и лечения туберкулеза.
Работа выполнена в рамках отраслевой программы Роспотребнадзора.
Содержание и манипуляции с животными проводили в соответствии с “Руководством по содержанию и использованию лабораторных животных” (Institute of Laboratory Animals Resources, Commission on Life Sciences, National Research Council. – National Academy Press: Washington. 1996. 138 с.)
Список литературы
Global tuberculosis report 2018. Geneva: World Health Organization, 2018. Licence: CC BY-NC-SA 3.0 IGO.
Caminero J.A., Scardigli A. // Eur. Respir. J. 2015. V. 46. P. 887–893.
Balu S., Reljic R., Lewis M.J., Pleass R.J., McIntosh R., Kooten C. et al. // The J. Immunol. 2011. V. 186. № 5. P. 3113–3119.
Abate G., Hoft D.F. // ImmunoTargets and Therap. 2016. V. 5. P. 37–45.
Gondil V.S., Chhibber S. // Biomed. Biotechnol. Res. J. 2018. V. 2. № 1. P. 9–15.
Kiefer B., Dahl J.L. // Adv. Microbiol. 2015. V. 5. P. 699–710.
Abate G., Hoft D.F. // ImmunoTargets and Therapy. 2016. V. 5. P. 37–45
Banu A., Rathod V. // J. Nanomed. Biotherapeut. Discov. 2013. V. 3. № 1. https://doi.org/10.4172/2155-983X.1000110
Selim A., Elhaig M.M., Taha S.A., Nasr E.A. // Rev. Sci. Tech. 2018. V. 37. № 3. P. 823–830.
Alexander, J.W. // Surg. Infect. (Larchmt). 2009. V. 10. № 3. P. 289–292.
Фастовец И.А., Верховцева Н.В., Пашкевич Е.Б., Нетрусов А.И. // Проблемы агрохимии и экологии. 2017. № 1. С. 51–62.
Schierholz J.M., Lucas L.J., Rump A., Pulverer G. // J. Hospital Infection. 1998. № 40. P. 257–262.
Franci G., Falanga A., Galdiero S., Palomba L., Rai M., Morelli G. et al. // Molecules. 2015. V. 20. P. 8856–8874.
Lara H.H., Ayala-Nuñez N.V., Ixtepan-Turrent L, Rodriguez-Padilla C. // World J. Microbiol. Biotechnol. 2010. V. 26. P. 615–621
Захаров А.В., Эргешов А.Э., Хохлов А.Л., Кибрик Б.С. Эффективность сочетания изониазида и наночастиц серебра в лечении экспериментального туберкулеза // Туберкулез и болезни легких. 2017. Т. 95. № 6. С. 51–58.
Аршинова С.С., Симонова А.В., Стаханов В.А., Пинегин Б.В. // Медицинская иммунология. 2001. Т. 3. № 4. С. 567–573.
Ellis T., Chiappi M., García-Trenco A., Al-Ejji M., Sarkar S. et al. // CS Nano. 2018. V. 126. P. 5228–5240.
Ponomarev V.A., Sheveyko A.N., Permyakova E.S., Lee J., Voevodin A.A. et al. ACS Appl. Mater. Interfaces. 2019. V. 11. № 32. P. 28699–28719.
Шумакова А.А., Смирнова В.В., Тананова О.Н., Трушина Э.Н., Кравченко Л.В., Аксенов И.В. и др. // Вопросы питания. 2011. Т. 80. № 6. С. 9–18.
Калмантаева О.В., Фирстова В.В., Потапов В.Д., Зырина Е.В., Герасимов В.Н., Ганина Е.А. и др. // Российские нанотехнологии. 2014. Т. 9. № 9–10. С. 78–82.
Coligan J.E., Bierer E.B., Margulies H.D., Shevach E.M., Stroder W. Short rotocols in Immunology: a Compendium of Methods from Current Protocols in Immunology / Ed. J.E. Coligan. Hoboken, New Jersey: John Wiley and Sons Inc, 2005.
Kaufmann S.H.E., Kabelitz D. Methods in Microbiology. Immunology of infection. 2 Ed. / Ed. S.H.E. Kaufmann, D. Kabelitz. London: Acad. Press, 2002. V. 32. 806 p.
Cardona P.J. Understanding Tuberculosis – Analyzing the Origin of Mycobacterium Tuberculosis Pathogenicity / Ed. P.J. Cardona. Croatia: InTech, 2012. 560 p.
Колобовникова Ю.В., Уразова О.И., Новицкий В.В., Воронкова О.В., Михеева К.О., Игнатов М.В. и др. // Бюллетень сибирской медицины. 2012. № 1. С. 39–45.
Лядова И.В., Гергерт В.Я. // Туберкулез и болезни легких. 2009. № 11. С. 9–18.
Перельман М.И. Национальное руководство. Фтизиатрия / Ред. М.И. Перельмана. М.: ГЭОТАР-Медиа, 2007. 512 с.
Report of the Expert Consultation on Immunotherapeutic Interventions for Tuberculosis. Geneva: World Health Organization, 2007. @cтpaницы
Лысов А.В, Никонов С.Д., Редькин Ю.В., Анфилофьева О.Ю., Казаков А.В., Буркова И.В. // Terra Medica Nova. 2009. № 4–5. С. 13–16.
Appelberg R. // Clin. Exp. Immunol. 1992. V. 89. P. 120–125.
Abadie V., Badell E., Douillard P., Ensergueix D., Leenen P., Tanguy M. et al. // Blood. 2005. V. 106. № 5. P. 1843–1850.
Blomgran R., Ernst J. // J. Immunol. 2011. V. 186. № 12. P. 7110–7119.
Seiler P., Aichele P., Bandermann S., Hauser A., Lu B., Gerard N. et al. // Eur. J. Immunol. 2003. V. 33. № 10. P. 2676–2686.
Elsbach P., Weiss J. // Immunol. Lett. 1985. V. 11. P. 159–163.
Seiler P., Aichele P., Raupach B., Odermatt B., Steinhoff U., Kaufmann S. // J. Infec. Dis. 2000. V. 181. P. 671–680.
Muller J., Huaux F., Moreau N., Misson P., Heilier J.F., Delos M. et al. // Toxicol. Appl. Pharmacol. 2005. V. 207. № 3. P. 221–231.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


