Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 174-181
Влияние лектинов азоспирилл на активность аскорбатпероксидазы и содержание аскорбиновой кислоты в корнях проростков пшеницы при абиотических стрессах
С. А. Аленькина 1, *, В. Е. Никитина 1
1 Институт биохимии и физиологии растений и микроорганизмов РАН
410049 Саратов, Россия
* E-mail: alenkina_s@ibppm.ru
Поступила в редакцию 30.07.2019
После доработки 10.10.2019
Принята к публикации 01.11.2019
Аннотация
Изучали влияние лектинов двух штаммов азоспирилл, Azospirillum brasilense Sp7 (эпифит) и Azospirillum brasilense Sp245 (эндофит), на активность аскорбатпероксидазы и содержание аскорбиновой кислоты в корнях этиолированных проростков пшеницы (Triticum aestivum L.) при смоделированных абиотических стрессах, включающих действие гипо-(+5°С), гипертермии (+42°С), засоления (1%-ным NaCl), засухи (5%-ной сахарозой) и тяжелых металлов (CoSO4, ZnSO4, Pb(CH3COO)2 и CuSO4). Показано, что оба лектина вызывали увеличение активности аскорбатпероксидазы и содержания аскорбата в корнях проростков при действии стрессовых факторов. На основании полученных данных высказано предположение, что антиоксидантное действие лектинов азоспирилл при абиотических стрессах вызывало защитный эффект этих белков по отношению к корням проростков пшеницы.
Увеличение продуктивности сельскохозяйственных культур, эффективное и ограниченное использование удобрений и средств защиты растений, а также повышение их устойчивости и адаптации к неблагоприятным агроклиматическим условиям и антропогенным воздействиям являются актуальными вопросами современного сельского хозяйства. Решение этих задач привлекает внимание многих ученых, работающих в различных областях науки: растениеводстве, почвоведении, агрономии, агрохимии, экологии, микробиологии и других. Особенно важными и перспективными являются микробиологические подходы и приемы, которые основаны на использовании потенциала растений и почвенных микроорганизмов, а также биологических механизмов взаимодействия компонентов растительно-микробных систем.
Неблагоприятные климатические условия, создающие абиотические стрессы, относятся к основным ограничивающими факторами снижения продуктивности сельскохозяйственных культур, среди которых доминируют такие абиотические стрессы как засуха, низкая/высокая температура, засоление и воздействие тяжелых металлов. В последние несколько десятилетий большое внимание уделяется изучению роли микроорганизмов в их облегчении для растений. Микробы с их потенциальными внутренними метаболическими и генетическими способностями уменьшают действие абиотических стрессов на растения [1, 2].
Так, показано, что ризобактерии, обладающие потенциалом стимулировать рост и развитие растений, так называемые PGPR, могут также нивелировать неблагоприятные эффекты абиотических стрессов на их рост [3, 4]. Была продемонстрирована роль нескольких обитателей ризосферы, принадлежащих к родам Pseudomonas [1], Azotobacter [2], Azospirillum [5], Rhizobium [1], Bacillus и Enterobacter [1], в стимуляции роста растений и смягчения множественных видов абиотических стрессов.
Ассоциативные бактерии рода Azospirillum занимают важное место среди микроорганизмов, обладающих потенциалом стимулировать рост и развитие растений. Растения получают непосредственную выгоду от способности микроорганизмов к азотфиксации, продукции фитогормонов, солюбилизации фосфатов, улучшению водного и минерального статуса, продукции ряда соединений, увеличивающих мембранную активность, пролиферацию тканей корневой системы, а также осуществляют контроль многочисленных фитопатогенов [6–8].
Азоспириллы колонизируют как поверхность корня, так и внутренние ткани. Штамм A. brasilense Sp245 был найден в ксилеме корня, а штамм A. brasilense Sp7 был обнаружен на его поверхности [9]. Эндофитные бактерии представляют особый интерес, поскольку они способны мутуалистически жить внутри растительных тканей, что позволяет им в меньшей степени по сравнению с другими микроорганизмами зависеть от внешних факторов среды и одновременно проявлять комплекс хозяйственно полезных свойств. При этом однажды внедрившись в ткани растения, эндофиты могут способствовать формированию длительной защиты макроорганизма от стрессовых факторов окружающей среды [10].
Среди высокомолекулярных и специфичных веществ, участвующих в межорганизменной коммуникации, важная роль принадлежит лектинам – (глико)протеинам, связывающим строго определенные углеводные группы на поверхности клетки-мишени. Роль растительных лектинов в колонизации бактериями растения-хозяина и перестройке метаболизма бактерии-симбионта характеризуется уже довольно большой доказательной базой [11]. Также показана адаптогенная активность растительных лектинов по отношению к растениям [12]. Бактериальные лектины являются участниками “молекулярного диалога”, важного для формирования симбиоза, хотя данных об их роли намного меньше [13, 14].
Ранее было показано присутствие на поверхности клеток азоспирилл лектинов, вовлеченных в бактериальную адгезию к корням. С поверхности двух штаммов ассоциативных азотфиксирующих бактерий, A. brasilense Sp7 и A. brasilense Sp245, отличающихся по способу колонизации растений, были изолированы лектины, представляющие собой гликопротеины с различными молекулярными массами и углеводной специфичностью. Лектин A. brasilense Sp7 имел молекулярную массу 36 кДа и проявлял специфичность к L-фукозе (1.87 мM) и D-галактозе (20 мM). Лектин A. brasilense Sp245 проявлял сродство к собственному полисахариду – кислому D-рамнану и имел молекулярную массу 67 кДа [15, 16].
Накопившиеся обширные экспериментальные данные о лектинах азоспирилл свидетельствют об их полифункциональности. Так, лектины способны не только обратимо и специфически связываться с клетками-мишенями, но и быть биологически активными веществами, способными в низких концентрациях вызывать клеточные ответы. Этот факт нашел подтверждение в предыдущих исследованиях по изучению влияния лектинов азоспирилл на прорастание семян [17], митогенную и ферментмодифицирующую активности и изменение содержания стрессовых метаболитов в растительной клетке [8, 18–20]. Последнее свидетельствует о способности лектинов выступать в качестве индукторов адаптационных процессов корней проростков пшеницы [15].
В растении под действием одного или нескольких стресс-факторов, происходит индукция защитного ответа, который позволяет ему выживать и адаптироваться к изменившимся внешним условиям.
Аскорбиновая кислота (аскорбат) является одним из наиболее стабильных низкомолекулярных антиоксидантов растительных клеток [21]. Аскорбат задействован в функционировании не только неферментативной и ферментативной составляющих антиоксидантной системы, но и в клеточной сигнализации [22]. В то же время связь между содержанием аскорбата и устойчивостью растений к стрессорам далеко неоднозначна. Так, показано, что растения, сверхэкспрессирующие дегидроаскорбатредуктазу, были более устойчивы к озону, хлориду натрия и ПЭГ [21, 23]. В то же время растения с повышенным редокс-статусом аскорбата в замыкающих клетках отличались большей устьичной проводимостью и меньшей засухоустойчивостью [21].
Аскорбатпероксидаза (КФ 1.11.1.11) является важным компонентом ферментативной антиоксидантной системы растений. Функция этого фермента заключается в обезвреживании пероксида водорода. Аскорбатпероксидаза высокоаффинна к аскорбату и локализована как в хлоропластах, так и в цитоплазме, митохондриях, пероксисомах и апопласте [24]. Имеются сведения об участии этого фермента в адаптивных реакциях растений на абиотические стрессоры [23].
Цель работы – сравнительное изучение роли лектинов A. brasilense эпифитного Sp7 и эндофитного штаммов Sp245 в изменении активности аскорбатпероксидазы и содержания аскорбата в корнях проростков пшеницы при смоделированных абиотических стрессах.
МЕТОДИКА
Микроорганизмы и условия культивирования. Объектом исследования служили два штамма азотфиксирующих ассоциативных бактерий рода Azospirillum, A. brasilense Sp7, полученного из коллекции Института микробиологии им. С.Н. Виноградского РАН (Россия) и A. brasilense Sp245 из коллекции микроорганизмов ИБФРМ РАН (Россия, http://collection.ibppm.ru).
Получение препаратов лектинов. Выделение лектинов с поверхности клеток бактерий осуществляли по методу [25]. Очистку белков проводили гель-фильтрацией на колонке (30 × 2.2 см) с сефадексом G-75 (диаметр частиц 40–120 мкм). Выход белковых фракций фиксировали на приборе Uvicord S11 (“LKB”, Швеция) при λ = 278 нм. В качестве элюентов использовали 0.1 М СН3СООН (рН 4.8), а также 0.05 М фосфатный буфер (рН 7.0), содержавший 0.15 М NaCl. Скорость потока – 1.5 мл/мин. Лектиновую активность определяли реакцией агглютинации, используя 2%-ную суспензию трипсинизированных кроличьих эритроцитов.
Определение концентрации белка. Количество белка определяли по методу Бредфорд [26].
Стерилизация семян, получение корней проростков и предобработка корней препаратами лектинов при воздействии стрессовых факторов. Семена пшеницы Triticum aestivum L. сорта “Саратовская 29” (ГНУ НИИ Сельского хозяйства Юго-Востока РСХА, Россия) были поверхностно стерилизованы в 70%-ном (v/v) этаноле в течение 1 мин и отмыты стерильной водой. Для получения корней проростков семена выращивали в асептических условиях в чашках Петри на стерильной дистиллированной воде и инкубировали в темноте при 25°C. Для экспериментов были использованы четырехдневные проростки.
Для изучения влияния стресса на изучаемые параметры корни в течение 2 ч подвергали совместному воздействию 1%-ной NaCl и 5%-ной сахарозе при 5 и 42°С (5–40 мкг/мл) лектинов и (1 мМ) тяжелых металлов (CoSO4, ZnSO4, Pb(CH3COO)2 и CuSO4) [27]. В качестве контроля использовали корни проростков, выращенные при 25°С. Затем корни гомогенизировали в 0.15 М фосфатном буфере, рН 7.8. Гомогенат центрифугировали при 7000 g в течение 10 мин, надосадочную жидкость использовали для определения активности аскорбатпероксидазы и аскорбиновой кислоты.
Определение активности аскорбатпероксидазы. Активность аскорбатпероксидазы определяли по снижению поглощения аскорбата при 290 нм модифицированным методом [28]. Активность фермента рассчитывали с использованием коэффициента экстинкции восстановленного аскорбата (2.8 мМ–1 · см–1) и выражали в мкМ аскорбата/мин · г сырой массы корней.
Определение содержания аскорбата. Для количественного определения восстановленного аскорбата к 200 мкл нейтрализованного экстракта приливали 100 мкл дистиллированной воды. Затем добавляли 200 мкл 10%-ной ТХУ, 200 мкл 44%-ной фосфорной кислоты, 200 мкл 4%-ного 2,2'-дипиридила и 100 мкл 3%-ного раствора FeCl3. Контрольная проба вместо экстракта содержала разбавленный K–Na фосфатный буфер, pH 7.4, и была обработана так же, как и опытные. Все пробы инкубировали в течение 60 мин и затем измеряли их поглощение при 524 нм на спектрофотометре. Концентрацию аскорбата определяли, используя молярный коэффициент поглощения ε = 8.7 мМ–1 см–1 [29].
Статистическая обработка результатов. Опыты проводили в трехкратной биологической повторности и каждый воспроизводили независимо 3 раза. На рисунках и в таблице приведены средние величины и их стандартные отклонения (M ± σ). Достоверность различий между вариантами оценивали с использованием t-критерия Стьюдента. Обсуждаются различия, достоверные при P ≤ 0.05.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Для изучения воздействия лектинов на активность аскорбатпероксидазы и содержание аскорбата в корнях проростков пшеницы в условиях абиотических стрессов время инкубации лектинов с корнями было ограничено 2 ч. Выбор концентраций лектинов, составляющие от 5 до 40 мкг/мл, и времени инкубации был основан на ранее полученных результатах.
Результаты показали, что при воздействии всех видов изучаемых стрессовых факторов происходило повышение активности аскорбатпероксидазы. При гипо-, гипертермическом воздействии и засолении активность фермента для обоих лектинов эпифитного Sp7 и эндофитного Sp245 штаммов максимально возрастала после 60 мин инкубации с корнями. При этом различными были эффективные концентрации лектинов. Во всех случаях для лектина A. brasilense Sp7 максимум был отмечен при концентрации 20 мкг/мл, а для A. brasilense Sp245 при 10 мкг/мл (табл. 1).
Таблица 1.
Влияние лектинов A. brasilense Sp7 и Sp245 на активность аскорбатпероксидазы в корнях проростков пшеницы при абиотических стрессах. Контроль – корни (100%)
| Концентрация лектина, мкг/мл |
Время воздействия, мин | |||||||
|---|---|---|---|---|---|---|---|---|
| 15 | 30 | 60 | 120 | |||||
| Sp7 | Sp245 | Sp7 | Sp245 | Sp7 | Sp245 | Sp7 | Sp245 | |
| 5°С | ||||||||
| 5 10 20 40 |
98 ± 2 96 ± 3 100 ± 3 101 ± 2 |
96 ± 2 98 ± 4 98 ± 3 100 ± 2 |
95 ± 3 120 ± 4 140 ± 2 105 ± 3 |
130 ± 3 165 ± 2 180 ± 4 101 ± 3 |
94 ± 3 160 ± 4 200 ± 2 120 ± 3 |
130 ± 3 250 ± 2 180 ± 4 101 ± 3 |
100 ± 3 105 ± 4 145 ± 2 102 ± 3 |
130 ± 3 150 ± 2 110 ± 4 101 ± 3 |
| 42°С | ||||||||
| 5 10 20 40 |
95 ± 2 100 ± 3 102 ± 3 91 ± 2 |
95 ± 2 96 ± 4 94 ± 3 101 ± 2 |
94 ± 3 105 ± 4 150 ± 2 97 ± 3 |
100 ± 3 175 ± 2 120 ± 4 101 ± 3 |
94 ± 3 100 ± 4 180 ± 2 95 ± 3 |
80 ± 3 230 ± 2 100 ± 4 101 ± 3 |
94 ± 3 100 ± 4 115 ± 2 95 ± 3 |
95 ± 3 130 ± 2 110 ± 4 101 ± 3 |
| 1% NaCl | ||||||||
| 5 10 20 40 |
102 ± 3 96 ± 2 101 ± 4 100 ± 3 |
95 ± 3 101 ± 2 100 ± 4 98 ± 2 |
100 ± 2 105 ± 3 125 ± 4 105 ± 3 |
115 ± 3 155 ± 4 110 ± 4 102 ± 3 |
110 ± 2 140 ± 3 270 ± 4 120 ± 3 |
115 ± 3 300 ± 4 120 ± 4 110 ± 3 |
110 ± 2 110 ± 3 170 ± 4 120 ± 3 |
115 ± 3 190 ± 4 120 ± 4 103 ± 3 |
| 5% сахароза | ||||||||
| 5 10 20 40 |
102 ± 3 180 ± 2 310 ± 4 120 ± 3 |
350 ± 3 185 ± 2 130 ± 4 98 ± 2 |
96± 3 150 ± 2 210 ± 4 120 ± 3 |
250 ± 3 165 ± 2 120 ± 4 102 ± 2 |
100 ± 2 105 ± 3 98 ± 4 100 ± 3 |
105 ± 3 98 ± 4 100 ± 4 100 ± 3 |
101 ± 4 97 ± 4 102 ± 3 100 ± 2 |
100 ± 3 100 ± 3 95 ± 2 96 ± 3 |
| CoSO4 | ||||||||
| 5 10 20 40 |
101 ± 3 96 ± 2 100 ± 4 100 ± 3 |
98 ± 3 101 ± 2 102 ± 4 98 ± 2 |
105 ± 2 110 ± 3 135 ± 4 105 ± 3 |
110 ± 3 130 ± 4 170 ± 4 105 ± 3 |
110 ± 2 140 ± 3 170 ± 4 120 ± 3 |
115 ± 3 160 ± 4 220 ± 4 110 ± 3 |
95 ± 2 105 ± 3 110 ± 4 102 ± 3 |
100 ± 3 100 ± 4 120 ± 4 100 ± 3 |
| ZnSO4 | ||||||||
| 5 10 20 40 |
98 ± 2 100 ± 3 94 ± 3 100 ± 2 |
98 ± 2 100 ± 4 98 ± 3 100 ± 2 |
100 ± 3 102 ± 4 136 ± 2 100 ± 3 |
95 ± 3 114 ± 2 170 ± 4 103 ± 3 |
94 ± 3 120 ± 4 200 ± 2 95 ± 3 |
80 ± 3 115 ± 2 210 ± 4 101 ± 3 |
100 ± 3 105 ± 4 105 ± 3 98 ± 2 |
96 ± 3 100 ± 4 120 ± 2 98 ± 3 |
| Pb(CH3COO)2 | ||||||||
| 5 10 20 40 |
120 ± 3 160 ± 2 130 ± 4 100 ± 3 |
130 ± 3 110 ± 2 100 ± 4 98 ± 2 |
130 ± 3 350 ± 4 185 ± 3 98 ± 2 |
400 ± 3 150 ± 4 110 ± 2 103 ± 3 |
105 ± 3 140 ± 2 105 ± 4 100 ± 3 |
115 ± 3 155 ± 2 100 ± 4 98 ± 2 |
100 ± 4 100 ± 4 104 ± 3 106 ± 2 |
100 ± 3 100 ± 3 95 ± 2 96 ± 3 |
| CuSO4 | ||||||||
| 5 10 20 40 |
102 ± 3 96 ± 2 101 ± 4 100 ± 3 |
95 ± 3 101 ± 2 100 ± 4 98 ± 2 |
105 ± 2 130 ± 3 110 ± 4 100 ± 3 |
106 ± 3 160 ± 4 115 ± 4 105 ± 3 |
110 ± 2 180 ± 3 170 ± 4 120 ± 3 |
115 ± 3 200 ± 4 120 ± 4 110 ± 3 |
102 ± 2 120 ± 3 110 ± 4 100 ± 3 |
100 ± 3 135 ± 4 105 ± 4 100 ± 3 |
Комбинированное воздействие лектинов и CoSO4, ZnSO4, Pb(CH3COO)2, CuSO4 также приводило к повышению ферментативной активности в корнях проростков. Для обоих лектинов максимальный эффект по отношению к активности фермента был отмечен после 30 мин инкубации с Pb(CH3COO)2 при концентрации лектина эпифитного штамма – 10 мкг/мл (170%) и эндофитного штамма – 5 мкг/мл (230%). При инкубации с другими солями активность фермента в присутствии обоих лектинов достигала максимального значения после 1 ч. Так, в присутствии CoSO4 и ZnSO4 оно наблюдалось при концентрации лектинов – 20 мкг/мл, а CuSO4 – 10 мкг/мл (табл. 1).
В случае комбинированного воздействия лектина A. brasilense Sp7 и смоделированной засухи наибольшее повышение активности фермента было отмечено уже после 15 мин инкубации с корнями и концентрации лектина 20 мкг/мл. Для лектина эндофитного штамма максимальное повышение ферментативной активности было отмечено также после 15 мин инкубации при его концентрации 5 мкг/мл (табл. 1).
Проведенные исследования показали, что изучаемые лектины индуцировали повышение активности аскорбатпероксидазы в корнях проростков при всех видах изучаемых стрессов и полученные данные хорошо коррелировали с результатами определения содержания аскорбиновой кислоты.
При гипо-, гипертермии и засолении воздействие лектинов A. brasilense Sp7 и A. brasilense Sp245 приводило к одинаковому результату. Количество аскорбата максимально возрастало после 60 мин инкубации с корнями. Однако эффективные концентрации лектинов оказались различными. Так, для лектина штамма Sp7 максимум был отмечен при концентрации 20 мкг/мл, а для Sp245 – 10 мкг/мл (рис. 1 и 2).
Рис. 1.
Влияние лектинов Azospirillum brasilense Sp7 (I, III, V, VII) и Sp245 (II, IV, VI, VIII) на содержание, аскорбата в корнях проростков пшеницы при гипо- (a) и гипертермическом воздействии (б). 1 – контроль, корни (100%); 2 – 5 мкг/мл, 3 – 10 мкг/мл, 4 – 20 мкг/мл, 5 – 40 мкг/мл. I, II – время инкубации 15 мин, III, IV, − 30 мин; V, VI, − 60 мин; VII, VIII − 120 мин.
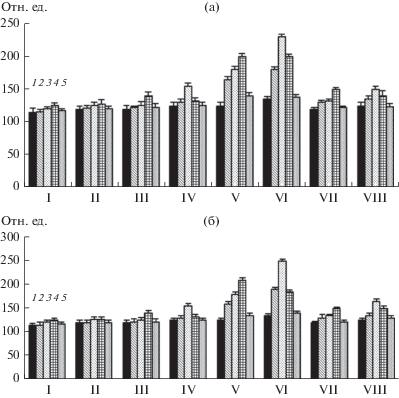
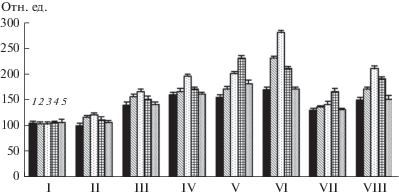
Рис. 2.
Влияние лектинов Azospirillum brasilense Sp7 (I, III, V, VII) и Sp245 (II, IV, VI, VIII) на содержание, аскорбата в корнях проростков пшеницы при воздействии 1%-ного NaCl: 1 – контроль, корни (100%); 2 – 5, 3 – 10, 4 – 20, 5 – 40 мкг/мл. I, II – время инкубации 15 мин, III, IV, − 30 мин; V, VI, − 60 мин; VII, VIII − 120 мин.
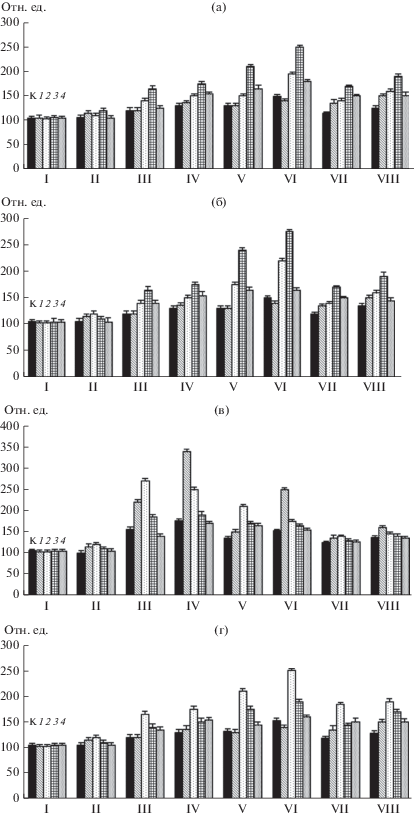
При комбинированном воздействии лектинов с солями тяжелых металлов также отмечалась тенденция к повышению содержания аскорбиновой кислоты в корнях проростков. Для обоих изучаемых лектинов при воздействии CoSO4, ZnSO4 и CuSO4 наблюдалось наибольшее повышение после 1 ч инкубации с корнями и концентрации лектина 20 мкг/мл для CoSO4 и ZnSO4, 10 мкг/мл – для Cu-SO4.
Наиболее максимальное воздействие лектинов по отношению к данному антиоксиданта было отмечено в присутствии Pb(CH3COO)2. Для лектина A. brasilense Sp7 максимум достигался после 30 мин инкубации при его концентрации 10 мкг/мл. При этом количество аскорбата возрастало на 150%. Лектин A. brasilense Sp245 повышал количество аскорбата после 30 мин инкубации при самой низкой изучаемой его концентрации 5 мкг/мл. При этом величина прироста аскорбата намного превышали значение, которое наблюдалось в присутствии другого лектина, и составляло 210% (рис. 3).
Рис. 3.
Влияние лектинов Azospirillum brasilense Sp7 (I, III, V, VII) и Sp245 (II, IV, VI, VIII) на содержание аскорбата в корнях проростков пшеницы при воздействии ZnSO4 (а), CoSO4 (б), Pb(CH3COO)2 (в), CuSO4 (г). К – контроль, корни (100%): 1 – 5, 2 – 10, 3 – 20, 4 – 40 мкг/мл. I, II – время инкубации 15 мин, III, IV, − 30 мин; V, VI, − 60 мин; VII, VIII − 120 мин.
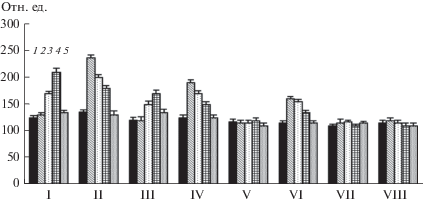
Комбинированное воздействие лектинов и смоделированной засухи приводило к максимальному повышению содержания аскорбата в корнях проростков пшеницы уже через 15 мин инкубации. В случае с лектином A. brasilense Sp7 наибольшее повышение было отмечено при концентрации лектина 20 мкг/мл. Для лектина эндофитного штамма максимальный эффект в отношении данных антиоксидантов был отмечен при концентрации 5 мкг/мл (рис. 4). В естественных условиях растения подвергаются действию постоянно меняющихся экологических факторов, активно реагируя на их отклонения от оптимума. Известно, что процесс адаптации растений к неблагоприятным условиям внешней среды происходит при активном участии антиоксидантной системы, контролирующей в клетках уровень активных форм кислорода (АФК) [22, 30]. Эффективность функционирования антиоксидантной системы обусловлена уровнями низкомолекулярных компонентов и активностью антиоксидантных ферментов.
Рис. 4.
Влияние лектинов Azospirillum brasilense Sp7 (I, III, V, VII) и Sp245 (II, IV, VI, VIII) на содержание, аскорбата в корнях проростков пшеницы при инкубировании на 5%-ной сахарозе: 1 – контроль, корни (100%); 2 – 5, 3 – 10, 4 – 20, 5 – 40 мкг/мл. I, II – время инкубации 15 мин, III, IV, − 30 мин; V, VI, − 60 мин; VII, VIII − 120 мин.
Аскорбатпероксидаза принимает участие в регуляции метаболизма в ходе онтогенеза и имеет особое значение для растений в обеспечении быстрой приспособляемости к постоянно меняющимся условиям внешней среды. Функционирование аскорбатпероксидазы необходимо для детоксикации перекиси водорода в условиях окислительного стресса. В антиоксидантной защите значительная роль принадлежит и низкомолекулярным соединениям, в частности аскорбиновой кислоте, которая может нейтрализовать пероксид водорода непосредственно в реакции, катализируемой аскорбатпероксидазой, а также участвовать в обезвреживании радикальных АФК [29, 31].
В результате проведенных исследований показано, что лектины A. brasilense Sp7 и Sp245 оказывали существенное влияние на активность аскорбатпероксидазы и содержание аскорбата в начальный период влияния на растения при смоделированных абиотических стрессах. При этом динамика изменения активности фермента и содержания аскорбата имела аналогичную тенденцию. Повышение активности аскорбатпероксидазы во всех случаях происходило на фоне повышения содержания аскорбата и могло быть связано с активным использованием этого антиоксиданта в качестве субстрата в реакции, катализируемой этим ферментом.
В целом можно полагать, что лектины азоспирилл могут оказывать влияние на аскорбатзависимую составляющую антиоксидантной системы, задействованной в адаптивных реакциях проростков пшеницы на гипо, гипертермию, обезвоживание, засуху и воздействие тяжелыми металлами. Можно предположить, что при этом участие лектинов в адаптации растений к стрессу, вызванному тяжелыми металлами и засухой, более существенно.
Следует отметить, что во всех случаях лектины A. brasilense Sp7 и A. brasilense Sp245 обладали различной степенью активности, что согласуется с ранее полученными результатами [8, 19, 20, 32–34]. Причина различий в функциональной активности лектинов может быть объяснена различной углеводной специфичностью, структурными различиями белков, и как следствие, различным взаимодействием с поверхностью растительной клетки, что является определяющим фактором для включения последующих этапов.
Концентрационные различия, при которых лектины проявляли эффекты, вероятно, связаны с влиянием изучаемых неблагоприятных факторов на процесс связывания лектинов с рецепторами на корнях. Концентрационные зависимости могут способствовать возникновению высокой физиологической гетерогенности даже при небольших естественных вариациях концентрации. В связи с этим изучение концентрационных зависимостей достаточно актуально для понимания процессов, происходящих при адаптации растений к условиям окружающей среды, а также и при практическом использовании таких регуляторов роста, как лектины.
Полученные в работе результаты демонстрируют более широкий, чем считалось ранее, спектр влияния лектинов азоспирилл на метаболизм растения-хозяина и в сочетании с уже имеющимися знаниями (сведениями) позволят сформировать целостную картину взаимодействия бактерий с растениями на молекулярном уровне.
Список литературы
Sorty A.M, Meena K.K., Choudhary K., Bitla U.M., Minhas P.S., Krishnani K.K. // Appl. Biochem. Biotechnol. 2016. V. 180. № 5. P. 872–882.
Sahoo R.K., Ansari M.W., Pradhan M., Dangar T.K., Mohanty S., Tuteja N. // Plant Signal Behav. 2014. V. 9. e29377.
Arzanesh M.H., Alikhani H.A., Khavazi K., Rahimian H.A., Miransari M. // Int. J. Bot. 2009. V. 5. № 3. P. 244–249.
Pereyra M.A., Zalazar C.A., Barassia C.A. // Plant Physiol. Biochem. 2006. V. 44. № 11–12. P. 873–879.
Omar M.N.A., Osman M.E.H., Kasim W.A., Abd El-Daim I.A. // Tasks Veg. Sci. 2009. V. 44. P. 133–147.
Baldani J.I., Baldani V.L.D. // An. Acad. Bras. Cienc. 2005. V. 77. № 3. P. 549–579.
Bashan Y., Holguin G., de-Bashan L.E. // Can. J. Microbiol. 2004. V. 50. P. 521–577.
Alen’kina S.A., Payusova O.A., Nikitina V.E. // Plant Soil. 2006. V. 283. № 1–2. P. 147–151.
Schloter M., Wiehe W., Assmus B., Steindl H., Becke H., Hoftich G., Hartmann A. // Appl. Environ. Microbiol. 1997. V. 63. № 5. P. 2038–2046.
Assmus B., Hutzler P., Kirchhof G., Amann R., Lawrence J.R., Hartmann A. // Appl. Environ. Microbiol. 1995. V. 61. № 3. P. 1013–1019.
Антонюк Л.П., Евсеева Н.В. // Микробиология. 2006. Т. 75. № 4. С. 544–549.
Шакирова Ф.М., Безрукова М.В. // Журн. общей биологии. 2007. Т. 68. № 2. С. 98–114.
Никитина В.Е., Аленькина С.А., Пономарева Е.Г., Савенкова Н.Н. // Микробиология. 1996. Т. 65. № 2. С. 165–170.
Castellanos T., Ascencio F., Bashan Y. // Curr. Microbiol. 1998. V. 36. № 4. P. 241–244.
Никитина В.Е., Пономарева Е.Г., Аленькина С.А. Молекулярные основы взаимоотношений ассоциативных микроорганизмов с растениями / Ред. В.В. Игнатова. М.: Наука, 2005. С. 70–97.
Шелудько А.В., Пономарева Е.Г., Варшаломидзе О.Э., Ветчинкина Е.И., Кацы Е.И., Никитина В.Е. // Микробиология. 2009. Т. 78. № 6. С. 749–756.
Никитина В.Е., Богомолова Н.В., Пономарева Е.Г., Соколов О.И. // Известия РАН. Серия биологическая. 2004. Т. 31. № 4. С. 431–435.
Чернышева М.П., Аленькина С.А., Никитина В.Е., Игнатов В.В. // Прикл. биохимия и микробиология. 2005. Т. 41. № 4. С. 444–448.
Аленькина С.А., Никитина В.Е. // Микробиология. 2015. Т. 84. № 5. С. 553–560.
Alen’kina S.A., Nikitina V.E. // J. Plant Regul. 2017. V. 36. № 2. P. 522–527.
Chen Z, Gallie D. // Plant Physiol. 2005. V. 138. № 3. 1673–1689.
Foyer Ch. H and Noctor G. // Plant Physiology. 2011. V. 155. № 1. P. 2–18.
Eltayeb S., Staal J.B., Kennes J., Lamberts H.G.P., de Bie R.A. // BMC Musculoskeletal Disord. 2007. V. 8. P. 68–73.
Foyer C.H., Noctor G. // Plant Cell Environ. 2015. V. 38. № 2. P. 239–239.
Echdat Y., Ofek I., Yachow-Yan Y., Sharon N., Mirelman D. // Biochem. Biophis. Res. Commun. 1978. V. 85. № 4. P. 1551–1559.
Bradford M.M. // Anal. Biochem. 1976. V. 72. № 1–2. P. 248–254.
Грузнова К.А. // Агрохимия. 2016. № 10. С. 89–93.
Nakano Y., Asada K. // Plant Cell Physiol. 1981. V. 22. № 5. P. 867–880.
Bartoli C.G., Yu., Gómez F., Fernández L., McIntosh L., Foyer C.H. // J. Exp. Bot. 2006. V. 57. № 8. P. 1621–1631.
Маевская С.Н., Николаева М.К. // Физиология растений. 2013. Т. 60. № 3. С. 351–359.
Ranieri A., Castagna A., Soldatini G.F. // J. Plant Physiol. 2000. V. 156. № 2. P. 266–271.
Аленькина С.А., Матора Л.Ю., Никитина В.Е. // Микробиология. 2010. Т. 79. № 6. С. 856–858.
Alen’kina S.A., Bogatyrev V.A., Matora L.Yu., Sokolova M.K., Chernysheva M.P., Trutneva K.A., Nikitina V.E. // Plant Soil. 2014. V. 381. № 3. P. 337–349.
Alen’kina S.A., Romanov N.I., Nikitina V.E. // Braz. J. Bot. 2018. V. 41. № 3. P. 579–587.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


