Прикладная биохимия и микробиология, 2020, T. 56, № 2, стр. 198-205
Иммобилизация микробных клеток на полимерных матрицах, модифицированных плазменной обработкой
О. И. Гулий 1, 2, *, В. В. Симаков 3, О. А. Караваева 1, А. В. Смирнов 4
1 Институт биохимии и физиологии растений и микроорганизмов РАН
410049 Саратов, Россия
2 Саратовский государственный аграрный университет им. Н.И. Вавилова
410012 Саратов, Россия
3 Саратовский национальный исследовательский государственный университет им. Н.Г. Чернышевского
410005 Саратов, Россия
4 Институт радиотехники и электроники им. В.А. Котельникова РАН
125009 Москва, Россия
* E-mail: guliy_olga@mail.ru
Поступила в редакцию 05.09.2019
После доработки 15.10.2019
Принята к публикации 01.11.2019
Аннотация
Показана возможность иммобилизации микробных клеток на полимерных матрицах, модифицированных плазменным травлением. На примере микробных клеток Azospirillum brasilense Sp7, A. lipoferum Sp59b и Escherichia coli XL-1 установлено, что эффективность иммобилизации биологических объектов зависит от времени обработки полимерных пленок в плазме. Обработка пленки полистирола в плазме высокочастотного разряда позволяла существенно увеличить время жизни клеток, иммобилизованных на ее поверхности. Показано, что оптимальное время обработки пленок в плазме составляло 30 с, время для иммобилизации микробных клеток ~ 20 мин, после иммобилизации бактерии сохраняли жизнеспособность до 6 мес. Предложено использование полимерных матриц, модифицированных плазменным травлением, в качестве носителя для иммобилизации клеток при создании биосенсоров.
Развитие методов иммобилизации бактерий и поиск оптимального носителя открывает новые возможности при создании биосенсоров. Иммобилизованные клетки называются “иммобилизованные биокатализаторы” (в соответствии с номенклатурой Европейской федерации по биотехнологии) [1]. Основные подходы к иммобилизации клеток состоят из их включения внутрь носителя или их фиксации на его поверхности. Адсорбционные методы иммобилизации относятся к числу наиболее простых и “естественных”, которые, как правило, слабо влияют на ферментативную систему клеток [2]. Адсорбентом могут быть различные вещества, такие как активированный уголь, глина, волокна ацетата целлюлозы и др. Наиболее широко для иммобилизации используются следующие электропроводящие полимеры: полианилин, полипиррол, политиофен и др. [3]. К значительным преимуществам полимерных покрытий относятся как удобство их формирования на поверхностях любой формы и размеров, так и переход к композиционным покрытиям путем введения в объем полимера наноразмерных включений. Полимерные пленки, в том числе и пленки полистирола (ПС), находят широкое применение в различных областях медицины, нано- и биотехнологии, а также сенсорных технологиях [4, 5]. К преимуществам пленок ПС можно отнести относительно небольшую удельную плотность, необходимый уровень прочности, высокие влагостойкость и сопротивляемость к низким температурам, инертность к агрессивному воздействию кислот и щелочей, а также отличные электроизоляционные и диэлектрические качества. Однако недостаточная адсорбционная способность пленок ПС вносит некоторые ограничения в области их применения [6]. От таких параметров как шероховатость, смачиваемость, морфология поверхности, наличие на поверхности функциональных групп, зависят показатели бактериальной и клеточной адгезии и последующей пролиферации и др. Одним из эффективных способов управления адсорбционной способностью является обработка поверхности пленки в плазме. Плазменная технология стала стандартным элементом инженерии поверхностей, приводящей к снижению или повышению поверхностного натяжения, обезжириванию металлических частей и полимеризации пленок с заданными свойствами. При этом поверхностная плазменная модификация является уникальным инструментом, который позволяет избирательно улучшать поверхностные свойства материала, не затрагивая его объемных свойств, обеспечивать биосовместимость пленок и увеличивать их адсорбционные свойства [7–11].
Значительный интерес представляет оценка возможности применения пленок ПС, модифицированных плазменным травлением, для иммобилизации микробных клеток и создания биокатализаторов для сенсорных систем.
Цель работы – исследование возможности иммобилизации бактериальных клеток на поверхности пленок ПС, модифицированных плазменной обработкой, и оценка времени сохранения жизнеспособности бактерий.
МЕТОДИКА
Микробные клетки и условия их культивирования. В работе использовали микробные клетки Azospirillum brasilense Sp7 (IBPPM 150), Escherichia coli XL-1 (IBPPM 632) and A. lipoferum Sp59b (IBPPM 173), полученные из коллекции ризосферных микроорганизмов ИБФРМ РАН (Россия), (http:// collection.ibppm.ru).
Для получения бульонных культур микроорганизмов использовали жидкую питательную среду LВ следующего состава (г/л): NaCl – 5; дрожжевой экстракт – 10 и пептон – 5. Культивирование проводили при интенсивном перемешивании на шейкере (160 об./мин) в течение 18 ч при 30 ± 1°С. После достижения логарифмической фазы роста клетки промывали дистиллированной водой (электропроводность 2 мкСм/см), отделяли центрифугированием при 3354 g в течение 5 мин и затем использовали для иммобилизации.
Формирование и модификация пленок полистирола. Пленки ПС получали методом центрифугирования. В качестве подложек использовали пластины монокристаллического кремния размером 10 × 10 мм2. Гранулированный ПС растворяли в четыреххлористом углероде (CCl4, 96 мас. %). Затем полученную смесь методом центрифугирования наносили на подложки в герметичной камере в атмосфере насыщенных паров растворителя. Скорость вращения подложки составляла 2000 об./мин. Толщина полученных пленок оценивалась по сколу образцов методом сканирующей электронной микроскопии (СЭМ) и составляла 280 ± 20 нм. Модификацию поверхности пленок ПС осуществляли в вакуумной камере установки Orion-40T (“VTC”, Южная Корея). Подложки с нанесенной пленкой ПС располагали в зоне эрозии мишени магнетрона. Высокочастотный разряд (13.56 МГц) зажигался в атмосфере аргона. Мощность разряда составляла 100 Вт, рабочее давление в камере поддерживалось на уровне 10–3 мбар. Обработка пленок ПС осуществлялась в течение 10, 20 и 30 с. Подробные результаты изучения влияния времени плазменной обработки на морфологию и структуру поверхности пленок ПС приведены в работе [11]. Морфология образцов полимерных покрытий изучалась при помощи СЭМ Mira II (“Tescan”, Чехия).
Определение концентрации микробных клеток. Концентрацию микробных клеток определяли по величине оптической плотности при 540 нм (D540) в кювете с толщиной оптического слоя 1.0 см на спектрофотометре “Specol-221” (“Carl Zeiss, Jena”, Германия), массу сухих клеток (г/л) рассчитывали на основании предварительно построенных калибровочных кривых.
Иммобилизация микробных клеток. Перед иммобилизацией проверяли оптическую плотность суспензии клеток. Для адсорбции ПС помещали в среду с клетками так, чтобы она полностью была покрыта суспензией, и инкубировали при интенсивной аэрации в течение ~20 мин при температуре 35°С. Процент адсорбированных микробных клеток определяли по разнице их содержания в суспензии до и после инкубации с носителем (% иммобилизации клеток на носителе). Данный вариант расчета не исключал ошибки при определении абсолютных величин сорбции, но воспроизводимость результатов свидетельствовала об их достоверности.
Атомно-силовая микроскопия. После иммобилизации микробных клеток поверхность ПС изучали методом атомно-силовой микроскопии (АСМ) с помощью зондовой нанолаборатории NtegraSpectra (“NT-MDT”, Россия). Изображения поверхности ПС получали в полуконтактном режиме с помощью кремниевого зонда NSG-10. Область сканирования составляла 5 × 5 мкм (25 мкм2). Обработку изображений проводили с помощью программного комплекса Gwyddion.
Просвечивающая электронная микроскопия (ПЭМ). Подготовку препаратов для получения электронно-микроскопических снимков проводили, как описано в работе [12]. Изображения получали при помощи просвечивающего электронного микроскопа Libra 120 (“Carl Zeiss”, Германия) при ускоряющем напряжении 120 кВ в Центре коллективного пользования на научном оборудовании в области физико-химической биологии и нанобиотехнологии “Симбиоз” ИБФРМ РАН.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
В качестве носителя при иммобилизации микробных клеток были выбраны пленки из ПС. Для улучшения адсорбционных свойств пленок ПС проводилась их обработка в плазме ВЧ разряда в течение 10, 20 и 30 с.
Как видно из рис. 1а поверхность необработанной пленки полистирола выглядела относительно гладкой. Обработка пленок ПС в плазме ВЧ разряда приводила к ее изменению (рис. 1б–1г). Поверхность образца после обработки представлена образованиями неправильной формы диаметром 0.21 и длиной 1.8 мкм. На рис. 1в–1г отчетливо видно, что поверхность имела микродоменную структуру, состоящую из последовательно соединенных частиц неправильной формы. Частицы представляли собой полимерные цепи, свернутые в клубки-глобулы, которые имели разный размер из-за разной длины полимерных цепей. Плазменная обработка образцов полимерных пленок в течение 30 с приводила к уменьшению глубины пор (рис. 1г).
Рис. 1.
СЭМ-изображение поверхности пленки полистирола до (а) и после обработки плазмой в течение 10 (б), 20 (в) и 30 с (г).

После модификации пленок ПС плазменным травлением проводили оптимизацию условий иммобилизации микробных клеток трех штаммов A. brasilense Sp7, A. lipoferum Sp59b и E. coli XL-1, которая включала подбор оптимальной микробной нагрузки для каждого исследуемого штамма, рН раствора, в котором проходила иммобилизация, и температуры. Также изучали влияние различного времени обработки пленок в плазме (10, 20 и 30 с) на эффективность иммобилизации биологических объектов на примере микробных клеток A. brasilense Sp7, A. lipoferum Sp59b и E. coli XL-1. Оптимальное время обработки в плазме составило 30 с, так как при таком времени обработки на поверхности пленок было определено наибольшее количество микробных клеток. Были выбраны оптимальные условия адсорбции микробных клеток на пленках ПС. Так, время иммобилизации клеток составляло 15–20 мин, значение рН среды, в которой проводили сорбцию – 7.0–7.2 и количество клеток в исходной суспензии (микробная нагрузка) ~1.30–1.42 г сухих клеток/л для всех штаммов. Использование более высокого содержания клеток оказалось нецелесообразным, поскольку при этом уменьшалось количество клеток, адсорбировавшихся на носителе, а количество клеток оставшихся в свободном состоянии – увеличилось. Иммобилизацию клеток проводили при 25–27°С.
На рис. 2 представлены ПЭМ-изображения микробных клеток использованных штаммов до иммобилизации. На рис. 2г представлено АСМ-изображение поверхности полимерной пленки с иммобилизованными клетками E. coli XL-1, в качестве примера.
Рис. 2.
ПЭМ-изображение свободных клеток E. coli XL-1 (а), A. brasilense Sp7 (б) и A. lipoferum Sp59b (в) (×10 000). АСМ-изображение поверхности пленки полистирола с иммобилизованными на поверхности клетками E. coli XL-1 (г).

Как правило, иммобилизованные клетки сохраняют способность к размножению после их иммобилизации и длительного использования в биотехнологических процессах. При этом кинетические характеристики роста (удельная скорость роста и время удвоения) иммобилизованных клеток существенно не отличаются от аналогичных характеристик свободных клеток [1, 13].
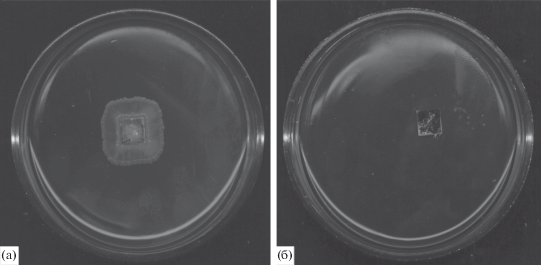
Жизнеспособность микроорганизмов определяется, прежде всего, их способностью к делению. После иммобилизации клеток всех изученных штаммов на поверхности пленок ПС проводили микробиологическую оценку их жизнеспособности. Определяли наличие зон роста клеток после внесения полученного иммобилизованного биокатализатора с клетками в чашку Петри с плотной питательной средой LB (рис. 3а). В качестве контроля использовали пленки ПС, которые наносили на твердую питательную среду LB (рис. 3б) без предварительной иммобилизации на них клеток.
Рис. 3.
Пленки полистирола с иммобилизованными на их поверхности клетками (а) и без них (б) на твердой питательной среде LB в чашках Петри.
Далее каждые 14 сут определяли время сохранения жизнеспособности биокатализаторов на основе клеток A. brasilense Sp7, A. lipoferum Sp59b и E. coli XL-1 в процессе их хранения при 4°С. Полученный биокатализатор, содержащий иммобилизованные клетки, в некоторых случаях сохранял активность при 4°С в течение 6 мес. (табл. 1).
Таблица 1.
Результаты определения жизнеспособности микробных клеток
| Микробные клетки | Время обработки носителя, с | Оценка жизнеспособности через 1–6 мес. | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| после иммобилизации | 1 | 2 | 3 | 4 | 5 | 6 | ||||||||
| A. lipoferum Sp59b | Без обработки | +* | + | + | + | + | + | + | –* | – | – | – | – | – |
| 10 | + | + | + | + | + | + | + | + | + | + | + | + | – | |
| 20 | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| 30 | + | + | + | + | + | + | + | + | + | + | + | + | + | |
| A. brasilense Sp7 | Без обработки | + | + | + | + | + | + | + | + | – | – | – | – | – |
| 10 | + | + | + | + | + | + | + | + | + | + | – | – | – | |
| 20 | + | + | + | + | + | + | + | + | + | + | + | – | – | |
| 30 | + | + | + | + | + | + | + | + | + | + | + | – | – | |
| E. coli Xl-1 | Без обработки | + | + | + | + | + | – | – | – | – | – | – | – | – |
| 10 | + | + | + | + | + | + | – | – | – | – | – | – | – | |
| 20 | + | + | + | + | + | + | + | + | – | – | – | – | – | |
| 30 | + | + | + | + | + | + | + | + | + | + | – | – | – | |
Предполагают, что носитель играет роль защитного барьера для иммобилизованных клеток, “экранируя” их от негативного воздействия метаболитов, препятствуя их проникновению в матрицу. Однако, согласно результатам, полученным в работе [13], матрица носителя не является препятствием для проникновения в клетки даже таких высокомолекулярных соединений, как ДНК. Можно предположить, что одной из возможных причин длительного сохранения жизнеспособности бактерий после иммобилизации является капиллярная конденсация паров воды из окружающей среды в порах модифицированных ПС покрытий при их хранении.
Известно, что процесс адсорбции клеток зависит от площади доступной поверхности, которая определяется размерами пор, превышающими размер микробных клеток [2]. Результаты анализа СЭМ-изображений поверхности модифицированных полистирольных покрытий показали, что пленки ПС имели пористую структуру с открытыми цилиндрическими порами радиусом R0 (50–200 нм).
При капиллярной конденсации внутри капилляров модифицированных ПС-покрытий вода образовывала вогнутый мениск. При частичном заполнении капилляра (поры катализатора) жидкостью на трехфазной границе раздела жидкость–газ–твердое тело действовали поверхностные силы, которые и обусловливали существование мениска – искривленной поверхности раздела газ–жидкость. Давление насыщенного пара над искривленной поверхностью мениска ps определяется уравнением Кельвина [14]:
где ps0 – давление насыщенного пара над плоской поверхностью, σ – поверхностное натяжение воды на границе раздела жидкость–пар, Vm – мольный объем воды, R – универсальная газовая постоянная, T – температура окружающей среды, r = R0/cos(θ) – радиус мениска жидкости в капилляре, R0 – радиус капилляра и θ – краевой угол смачивания водой стенок капилляра.Состояние равновесия между жидкостью в капилляре и окружающей средой достигается при условии:
(2)
${{p}_{{s0}}}\exp \left( {\frac{{2\sigma \cos (\theta ){{V}_{m}}}}{{{{R}_{0}}RT}}} \right) = {{p}_{{r.h.}}},$Капиллярная конденсация наблюдалась в порах с критическим радиусом:
(3)
${{R}_{0}} = \frac{{RT}}{{2\sigma \cos (\theta ){{V}_{m}}}}{{\ln }^{{ - 1}}}\left( {\frac{{r.h.}}{{100\% }}} \right).$При хранении микробного биокатализатора в условиях пониженных температур вплоть до 4°С относительная влажность воздуха существенно изменялась по сравнению с условиями хранения при комнатной температуре (25°С).
В процессе подготовки и хранения иммобилизованных на пленках ПС микробных клеток температура окружающего воздуха изохорически понижалась с комнатной до температуры хранения (с 25 до 4°С), что приводило к увеличению влажности окружающего воздуха:
(4)
$r.h. = \frac{p}{{{{p}_{0}}}} \times 100\% = \frac{{p(25)}}{{{{p}_{0}}}}\frac{T}{{T(25)}} \times 100\% ,$Учитывая, что давление паров воды при комнатной температуре определяется влажностью окружающего воздуха, получим:
где r. h.(25) – относительная влажность при температуре 25°C.Давление насыщенного водяного пара над плоской поверхностью p0 зависит от температуры и приблизительно его можно определить на основании соотношения Бака [15]:
(6)
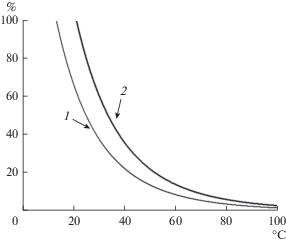
${{p}_{s}}(T) = 6.1121{{e}^{{\frac{{\left( {18.67\,\,{\text{B}}\, - \,\frac{T}{{234}} \times 5} \right)T}}{{257.14 + T}}}}},$На рис. 4 представлена температурная зависимость влажности воздуха после его охлаждения. Видно, что охлаждение воздуха с заданной влажностью до некоторой критической температуры повышает его относительную влажность до 100%, что может приводить к конденсации паров воды.
Рис. 4.
Зависимость влажности воздуха после его охлаждения от начальной температуры 25°С и относительной влажности 50 (1) и 80% (2).
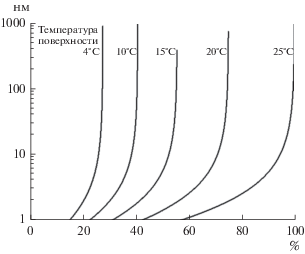
На рис. 5 представлена зависимость критического радиуса капилляра R0 от влажности окружающего воздуха r.h. Следует отметить, что если иммобилизованный биокатализатор с открытыми порами хранить охлажденным, то при определенной влажности в порах любых размеров наблюдается конденсация паров воды (при температуре поверхности 15°С).
Рис. 5.
Зависимость критического радиуса капилляра (нм) от влажности окружающего воздуха (%) при 25°С (краевой угол смачивания водой стенки капилляра составлял θ ≈ 60°).
Таким образом, понижая температуру хранения микробного биокатализатора можно создать условия для капиллярной конденсации влаги в порах ПС-пленки, модифицированной плазменным травлением. Конденсированная в порах полимерных матриц влага может способствовать сохранению жизнеспособности иммобилизованных на ее поверхности биологических объектов (бактерий) и сохранение их активности до 6 мес.
Результативность работы иммобилизованного биокатализатора на основе микробных клеток во многом определяется эффективностью снабжения иммобилизованных клеток питательными элементами, а также легкостью отвода метаболитов. Эти факторы зависят, главным образом, от диффузионных барьеров, создаваемых материалом носителя [16]. В основе интенсификации жизнедеятельности иммобилизованных микробных клеток лежат специфичные условия, возникающие на поверхности раздела фаз “жидкость–твердая поверхность”. Можно предположить, что граница раздела жидкости и твердого тела служит микросредой, в которой клеткам легче изменить условия своей жизнедеятельности в благоприятную для себя сторону.
Иммобилизованные биокатализаторы должны работать в достаточно широких диапазонах температур, значений pH, давлений, а также обеспечивать необходимую воспроизводимость в промышленных условиях. Немаловажным критерием при выборе носителя является возможность его повторного использования, что приводит к поиску дешевых и потенциально доступных материалов [22, 26 ] . Возможности применения органических и неорганических носителей для иммобилизации микробных клеток продемонстрированы в ряде работ [13, 17–24]. Возможности использования микробных клеток, иммобилизованных на пленках ПС, модифицированных плазменным травлением, продемонстрированы в биосенсорной детектирующей системе на основе сверхвысокочастотного (СВЧ) резонатора (5–8.5 ГГц) [20, 21].
Проведенное на примере клеток A. brasilense Sp7, A. lipoferum Sp59b и E. coli XL-1 изучение показало перспективность использования пленок ПС для иммобилизации с возможностью их многократного использования. Преимущества данного носителя – простота иммобилизации (путем адсорбции) и короткое время для иммобилизации клеток (~20 мин), при этом процесс обработки ПС в плазме составлял ~30 с, а микробные клетки после иммобилизации сохраняли жизнеспособность до 6 мес.
Полученные результаты представляют интерес с практической точки зрения для применения полимерных покрытий, модифицированных плазменным травлением, в качестве носителя для иммобилизации клеток при создании биосенсоров.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (проекты № 18-29-23042-мк и 19-07-00304).
Список литературы
Beshay U., El-Enshasy H., Ismail I.M.K., Moawad H., ABD-El-Ghany S. // Pol. J. Microbiol. 2011. V. 60. № 2. P. 133–138.
Синицин А.П., Райнина Е.И., Лозинский ВИ., Спасов С.Д. Иммобилизованные клетки микроорганизмов. М.: Издательство Московского университета, 1994. 288 с.
Arslan F., Ustabaş S., Arslan H. // Sensors. 2011. V. 11. № 8. P. 8152–8163.
Tsui O.K.C. Polymer Thin Films. / Eds. Tsuiand O.K.C., Russell T.P. Singapore: World Sci, 2008. P. 267–294.
Otero T.F. Polymer Sensors and Actuators. / Eds. Osada Y., De Rossi D.E. Berlin: Springer, 2000. P. 295–324.
Шереметьев С.В., Штейнберг Е.М. Использование функциональных полимеров в медицине. Казань: СибАК, 2012. 145 с.
Chu P.K., Chen J.Y., Wang L.P., Huang N. // Mat. Sci. Eng. R. 2002. V. 36. № 5. C. 143–206.
Jacobs T., Morent R., De Geyter N., Dubruel P., Leys C. // Plasma Chem. Plasma P. 2012. T. 32. № 5. C. 1039–1073
Hagiwara K., Hasebe T., Hotta A. // Surface and Coatings Technology. 2013. V. 216. P. 318–323.
van Kooten T.G., Spijker H.T., Busscher H.J. //Biomaterials. 2004. V. 25. №. 10. P. 1735–1747.
Smirnov A.V., Atkin V.S., Gorbachev I.A., Grebennikov A.I., Sinev I.V., Simakov V.V. // BioNanoScience. 2017. T. 7. № 4. C. 680–685.
Guliy O.I., Zaitsev B.D., Borodina I.A., Shikhabudinov A.M., Teplykh A.A., Staroverov S.A., Fomin A.S. // Talanta. 2018. V. 178. P. 569–576.
Крякунова Е.Д., Канарский А.В. // Вестник Казанского технологического университета. 2012. Т. 15. № 17. С. 189–194.
Adamson A.W., Gast A.P. Physical Chemistry of Surfaces. 6th Ed. Wiley.1997. 808 p. ISBN: 978-0-471-14873-9.
Buck A.L. // J. Appl. Meteorol. 1981. V. 20. № 12. P. 1527–1532.
Писарев O.А., Ежова Н.М. // Сорбционные и хроматографические процессы. 2008. Т. 8. № 4. С. 535–552.
Almeida C., Branyik T., Moradas-Ferreira P., Teixeira J. // J. Biosci. Bioeng. 2003. V. 96. № 6. P. 513–518.
Kumar S.S., Ghosh A.R. // Microbiology. 2019. V. 165. № 6. P. 593–610.
Gui Q., Lawson T., Shan S., Yan L., Liu Y. // Sensors. 2017. V. 17. № 7. P. 1623. https://doi.org/10.3390/s17071623
Гулий О.И., Зайцев Б.Д., Смирнов А.В., Караваева О.А., Бородина И.А. // Прикл. биохимия и микробиология. 2017. Т. 53. № 6. С. 642–650.
Guliy O.I., Zaitsev B.D., Smirnov A.V., Karavaeva O.A., Borodina I.A. // Biosens. Bioelectron. 2019. V. 130. № 4. P. 95–102
Longo G., Alonso-Sarduy L., Marques Rio L., Bizzini A., Trampuz A., Notz J., Dietler G. and Kasas S. // Nat. Nanotechnol. 2013. V. 8. № 7. P. 522–526.
Su L., Wenzhao J., Changjun H. // Biosens. Bioelectron. 2011. V. 26. № 5. P. 1788–1799.
Bilal M., Iqbal H.M.N. // Process Safety and Environmental Protection 2019. V. 124.P. 8–17.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


