Прикладная биохимия и микробиология, 2019, T. 55, № 5, стр. 460-464
Влияние способа синтеза нанокомплексов на протеолитическую активность химотрипсина, иммобилизованного на наночастицах серебра
А. В. Плющенко 1, 2, Л. Н. Боровикова 1, О. А. Писарев 1, 2, *
1 Институт высокомолекулярных соединений РАН
199004 Санкт-Петербург, Россия
2 Санкт-Петербургский политехнический университет Петра Великого
19251 Санкт-Петербург, Россия
* E-mail: chrom79@yandex.ru
Поступила в редакцию 16.01.2019
После доработки 20.03.2019
Принята к публикации 22.04.2019
Аннотация
На основе реакции восстановления азотнокислого серебра боргидридом натрия разработаны два способа синтеза гибридных органо-неорганических нанокомплексов, включающих химотрипсин и наночастицы серебра. Согласно первому способу синтеза фермент добавляли в реакционную среду одновременно с другими реагентами, а второму – его добавляли в реакционную среду через определенные промежутки времени после начала реакции восстановления. Химотрипсин, иммобилизованный в составе нанокомплексов, стабилизировал наночастицы серебра. Полученный обоими способами иммобилизованный фермент обладал повышенной по сравнению с нативным ферментом протеолитической активностью и в кислой и в сильно щелочной среде. При этом химотрипсин, иммобилизованный на наночастицах серебра вторым способом синтеза, обладал наибольшей активностью.
Физико-химические условия, в которых используются ферменты в медицине и различных биотехнологических процессах, нередко оказываются неоптимальными для их функционирования, что приводит к значительному снижению их ферментативной активности. В связи с этим разработка новых методов иммобилизации ферментов, способствующих сохранению их активности при неоптимальных условиях среды, относится к одной из важнейших задач современной биотехнологии.
В настоящее время большое внимание уделяется исследованиям, связанным с разработкой методов иммобилизации ферментов на неорганических наночастицах. Это обусловлено двумя обстоятельствами. Во-первых, такой подход приводит к реализации многоточечного взаимодействия фермента с наночастицами, что повышает его температурную и рН стабильность и длительность хранения. Во-вторых, вследствие отсутствия стерических препятствий диффузионный транспорт субстрата к активному центру иммобилизованного фермента существенно “облегчается” (в отличие от иммобилизации ферментов на полимерах), что во многих случаях приводит к увеличению его ферментативной активности [1–3]. Использование в качестве носителей наночастиц, обладающих также биологической активностью, позволяет создавать полифункциональные органо-неорганические нанокомплексы, в которых каждая составляющая обеспечивает различную биологическую активность [4, 5].
Наночастицы серебра (Ag) обладают антибактериальными, а также уникальными физическими и электрическими свойствами [6, 7]. Нанокомплексы на основе химотрипсина (ХТ) и наночастиц Ag, сочетающие протеолитические и бактерицидные свойства, способны стать основой полифункциональных лекарственных препаратов для лечения ран, ожогов и других воспалительных процессов [5].
Цель работы – синтез и изучение размерных свойств нанокомплексов, включающих ХТ и наночастицы Ag, а также изучение протеолитической активности иммобилизованного ХТ.
МЕТОДИКА
В работе использовали α-химотрипсин (КФ 3.4.21.1, “AppliChem”, Германия), казеинат натрия (“ООО Бригантина”, Россия), нитрат серебра, боргидрид натрия, трихлоруксусную кислоту, гидроксид натрия, уксусную, ортофосфорную и борную кислоты и тирозин (“Вектон”, Россия).
Иммобилизация ХТ на наночастицах Ag осуществлялась путем введения фермента в реакцию восстановления (1) азотнокислого серебра (AgNO3) боргидридом натрия (NaBH4) с образованием коллоидного Ag.
(1)
$\begin{gathered} {\text{AgN}}{{{\text{О }}}_{3}} + {\text{NaB}}{{{\text{H}}}_{4}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = {\text{Ag}} + {\text{NaN}}{{{\text{O}}}_{3}} + {\text{B}}{{\left( {{\text{OH}}} \right)}_{3}} + {{{\text{H}}}_{2}}. \\ \end{gathered} $Эта реакция осуществлялась в водной среде при атмосферном давлении, 4°С и 24-кратном (относительно эквимолярного) избытке NaBH4. Величины концентраций Ag (СAg) и ХТ (CХТ) составляли 0.1 и 2 мг/мл соответственно.
В качестве восстановителя был выбран NaBH4, поскольку при его значительном избытке можно получить наночастицы размером меньше 50 нм вследствие большой разницы редокс-потенциалов восстановителя (–1.24 В, в щелочной среде) и Ag (0.8 В). Такого размера стабилизированные наночастицы Ag нетоксичны и обладают высокой бактерицидной активностью [8], а иммобилизованный ХТ одновременно выполнял функцию стабилизатора наночастиц Ag в растворе.
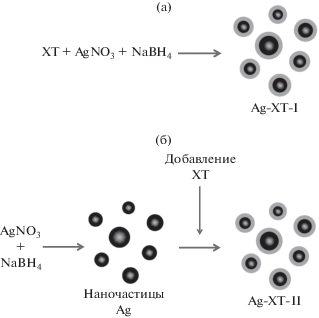
Были изучены два способа образования нанокомплексов (рис. 1):
а) ХТ добавляли в реакционную среду одновременно с другими реагентами (метод иммобилизации I, Ag-ХТ-I);
б) ХТ добавляли в реакционную среду через определенные промежутки времени после начала реакции синтеза (метод иммобилизации II, Ag-ХТ-II).
Значения рН растворов измеряли на рН-метре рН-673М (“Измерительная техника”, Россия), а их оптическую плотность определяли в кварцевых кюветах (1 × 1 см) в диапазоне от 220 до 800 нм на спектрофотометре Specord M-40 (“Carl Zeiss”, Германия).
Эффективные гидродинамические радиусы (Rh) наноструктур определяли методом динамического рассеяния света (ДРС) [9]. Корреляционную функцию интенсивности рассеянного света получали с помощью коррелятора Photocor-FC с числом каналов 288 (“ООО Фотокор”, Россия). Анализ корреляционной функции осуществляли с помощью программы обработки данных DLS Dynals (“Гелиос”, Россия).
Протеолитическую активность ХТ определяли согласно ГОСТ 20264.2-88. Гидролиз казеината натрия, который использовался в качестве белкового субстрата, осуществляли при 37°С. Раствор казеината натрия готовили путем его растворения в универсальном буфере с заданным значением рН. Для приготовления универсального буферного раствора использовали 0.1 н. уксусную, ортофосфорную и борную кислоты, которые смешивали в равных объемных соотношениях. Значение рН раствора изменялось добавлением различного количества 1 н. NaOH. Для осуществления гидролиза в 68 мл раствора субстрата (С = 10 мг/мл) вносили 3.4 мл раствора нативного ХТ (СХТ = = 2 мг/мл), либо нанокомплекса (СХТ = 2 мг/мл). Через определенные промежутки времени из реакционной смеси отбирали по 2 мл, добавляли 3 мл 0.5 н трихлоруксусной кислоты для остановки гидролиза. В качестве контроля использовали 2 мл раствора казеината натрия. Затем выпавший осадок отфильтровывали и измеряли оптическую плотность надосадочной жидкости при 280 нм. Концентрацию прогидролизованного белка определяли, используя калибровочную кривую, полученную для тирозина.
За единицу активности (ед.) принимали количество фермента, необходимое для высвобождения 1 мкмоль тирозина в мин в условиях эксперимента. Активность фермента рассчитывалась по формуле:
где A – активность фермента, мкмоль мин–1, P – концентрация продукта реакции, мкмоль л–1, t – время реакции, мин.Удельную активность рассчитывали как число единиц активности на 1 мг фермента:
где Aудел – удельная активность фермента, ед. мг–1, m – масса фермента, мг.РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Известно, что оптимальные условия для действия нативного ХТ рН ~8.0, фермент быстро теряет свою активность при рН ниже 7.0 и выше 9.0 [10]. В связи с этим было проведено изучение протеолитической активности нанокомплексов ХТ с наночастицами Ag при значениях рН, равных 6.0, 8.0 и 11.0.
Размеры нанокомплексов Ag-ХТ-I (рис. 1а), определенные методом просвечивающей электронной микроскопии, находились в диапазоне от 2 до 5 нм [11]. Для получения более крупных стабилизированных наночастиц ХТ добавляли в реакционную среду через определенные промежутки времени после начала реакции синтеза (Ag-ХТ-II, рис. 1б).
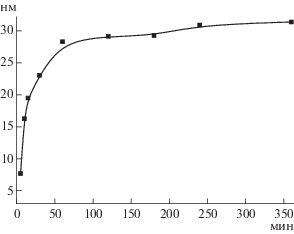
На рис. 2 представлена зависимость среднего гидродинамического радиуса нанокомплексов Ag-ХТ-II от времени введения ХТ в реакционную смесь после начала реакции синтеза наночастиц Ag. При добавлении ХТ в реакционную смесь после небольшого промежутка времени (10–25 мин) наблюдался постепенный рост размеров нанокомплексов Ag-ХТ-II. Можно предположить, что введение ХТ в реакционную смесь на ранних этапах синтеза, когда окислительно-восстановительная реакция не завершена, способствовало стабилизации не полностью сформировавшихся наночастиц Ag. Вместе с тем, при дальнейшем увеличении продолжительности реакции синтеза наночастиц Ag до добавления ХТ (более 1 ч) не наблюдалось значительного изменения размеров образующихся нанокомплексов. По-видимому, в этом случае введение ХТ в реакцию восстановления приводило к предотвращению возможной агрегации наночастиц.
Рис. 2.
Зависимость среднего гидродинамического радиуса нанокомплексов Ag-ХТ-II от времени введения ХТ в реакционную смесь после начала реакции синтеза наночастиц Ag.
В связи с этим, была изучена протеолитическая активность нанокомплексов Ag-ХТ-I и Ag-ХТ-II, которые были получены путем введения ХТ в реакцию синтеза через 1 ч после начала реакции.
В табл. 1 представлены значения удельных протеолитических активностей нативного ХТ и нанокомплексов Ag-ХТ-I и Ag-ХТ-II при рН 6.0, 8.0 и 11.0. Видно, что при рН 8.0 наибольшую активность проявлял нативный ХТ (3.45 ед. мг–1), превышая удельную активность нанокомплексов Ag-ХТ-I и Ag-ХТ-II на ~17 и ~21% соответственно. Однако при рН 6.0 и 11.0 наибольшей активностью обладал нанокомплекс Ag-ХТ-II. Так, его удельная активность превышала как активность ХТ, так и нанокомплекса Ag-ХТ-I, при рН 6.0 на ~17 и ~25% соответственно, а при рН 11.0 – на ~33 и ~41% соответственно.
Таблица 1.
Влияние рН на удельную протеолитическую активность нативного ХТ и нанокомплексов
| Образец | Аудел, ед. мг–1 | ||
|---|---|---|---|
| рН 6.0 | рН 8.0 | рН 11.0 | |
| ХТ | 2.40 | 3.45 | 1.62 |
| Ag-ХТ-I | 2.22 | 2.87 | 1.43 |
| Ag-ХТ-II | 2.87 | 2.73 | 2.42 |
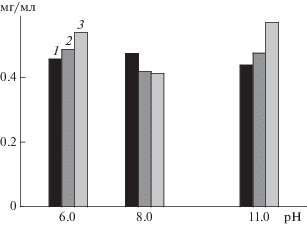
Однако, значения удельной активности фермента, определяемые на начальном этапе реакции в условиях избытка субстрата, не описывали полностью картину изучаемых процессов. В связи с этим была изучена кинетика накопления продукта ферментативной реакции для нативного и иммобилизованных ферментов (рис. 3а, 3б, 3в). На диаграмме (рис. 4) представлены суммарные данные по влиянию рН на максимальное количество продуктов реакций гидролиза.
Рис. 3.
Влияние способа синтеза нанокомплексов Ag-ХТ на кинетику накопления продукта реакции гидролиза, катализируемой ХТ (1), Ag-ХТ-I (2) и A-g‑ХТ-II (3), при рН 6.0 (а), 8.0 (б) и 11.0 (в).
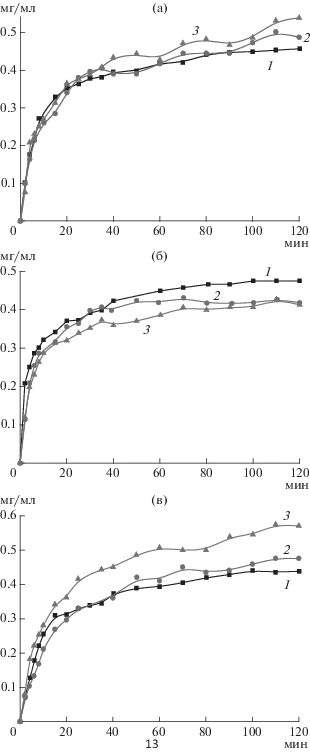
Рис. 4.
Зависимость от рН максимальной концентрации продукта реакции гидролиза казеината натрия, катализируемой ХТ (1) и нанокомплексами Ag-ХТ-I (2) и Ag-ХТ-II (3).
При рН 8.0 конечное содержание продукта реакции гидролиза субстрата при использовании нативного фермента превышало эту величину для нанокомплексов на ~13% вне зависимости от метода синтеза. Следовательно, иммобилизация ХТ на наночастицах Ag значительно не снижала его ферментативной активности при рН 8.0. При этом максимальное количество продукта реакции наблюдалось после ~30 мин гидролиза нанокомплексом Ag-ХТ-I, и после ~70 мин – нанокомплексом Ag-ХТ-II. Таким образом, при рН 8.0 реакция гидролиза ферментом, иммобилизованным на наночастицах Ag меньшего размера (Ag-ХТ-I), протекала быстрее, чем при его иммобилизации на более крупных наночастицах (Ag-ХТ-II).
При рН 6.0 и 11.0 наблюдалось повышение конечного содержания продукта реакции гидролиза при использовании нанокомплексов по сравнению с нативным ХТ (рис. 4). При этом наивысшую протеолитическую активность проявлял нанокомплекс Ag-ХТ-II. Так, конечное содержание продукта реакции, катализируемой этим нанокомплексом, повышалось при рН 6.0 по сравнению с нативным ХТ на ~15%, а нанокомплексом Ag-ХТ-I – на ~10%, а при рН 11.0 – по сравнению с нативным ХТ – на ~23%, а нанокомплексом Ag-ХТ-I – на ~17%.
В щелочной среде эффект повышения по сравнению с нативным ХТ протеолитической активности фермента, иммобилизованного на наночастицах, наблюдался и при его иммобилизации на наночастицах селена [3]. Отметим также, что протеолитическая активность нанокомплекса Ag-ХТ-II при рН 6.0 и 11.0 увеличивалась и по сравнению с нанокомплексом Ag-ХТ-I.
Таким образом, иммобилизация ХТ на наночастицах Ag повышала его протеолитическую активность в кислой и сильно щелочной среде, то есть в неоптимальных условиях функционирования нативного фермента.
Список литературы
Arsalan A., Younus H. // Int. J. Biol. Macromol. 2018. V. 118. № 11. P. 1833–1847.
Zewde B., Ambaye A., Stubbs J. III.,Dharmara R. // Nanotechnol. Nanomed. 2016. V. 4. № 2. P. 1043–1056.
Плющенко А.В., Боровикова Л.Н., Писарев О.А. // Прикл. биохимия и микробиология. 2018. Т. 54. № 4. С. 362–365.
Walper S.A., Turner K.B., Medinz I.L. // Curr. Opinion. Biotechnol. 2015. V. 34. № 1. P. 232–241.
Писарев О.А., Титова А.В., Боровикова Л.Н., Киппер А.И., Ворошилова Т.М., Панарин Е.Ф. // Изв. Акад. наук. Сер. хим. 2016. Т. 64. № 3. С. 790–794.
Bhosale M.A., Bhanage B.M. // Curr. Org. Chem. 2015. V. 19. № 8. P. 708–727.
Терентьева E.A., Апяри В.В., Кочук Е.В., Дмитриенко С.Г., Золотов Ю.А. // Журн. аналит. химии. 2017. Т. 72. № 11. С. 978–999.
Moritz M., Geszke M. // Chem.Eng. Journ. 2013. V. 226. № 2. P. 596–613.
Brown W. Dynamic Light Scattering: the Method and Some Application. Oxford: Clarondon Press, 1993. 617 p.
Кулаков В.И., Насонова В.А., Савельев В.С. Системная энзимотерапия. Опыт и перспективы. Санкт-Петербург: Интер-Медика, 2004. 264 с.
Плющенко А.В., Митусова К.А., Боровикова Л.Н., Киппер А.И., Писарев О.А. // Оптика и спектроскопия. 2018. Т. 125. № 2. С. 234–239.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология