Прикладная биохимия и микробиология, 2019, T. 55, № 5, стр. 465-470
Детекция гидролиза РНК биназой по флуоресценции акридинового оранжевого
А. Н. Дойникова 1, Н. Л. Векшин 2, *
1 Казанский (Приволжский) федеральный университет
420008 Казань, Россия
2 Институт биофизики клетки РАН
142290 Пущино, Московской обл., Россия
* E-mail: nvekshin@rambler.ru
Поступила в редакцию 14.09.2018
После доработки 04.03.2019
Принята к публикации 22.04.2019
Аннотация
С помощью флуоресцентной спектроскопии изучен специфический гидролиз рибосомальной РНК биназой в водных буферных растворах. Для окрашивания РНК использовался акридиновый оранжевый. При связывании красителя с РНК вследствие образования устойчивого комплекса интенсивность его флуоресценции возрастала вдвое. При гидролизе РНК биназой в течение 1–20 мин этот комплекс распадался, что сопровождалось почти двукратным снижением флуоресценции. Степень поляризации флуоресценции красителя при гидролизе снижалась в 5.5 раз. При рН 5.0–6.0 реакция гидролиза проходила медленнее, чем при рН 7.0–8.0, но при этом почти до конца. Гидролиз замедлялся при увеличении ионной силы буфера и подавлялся ионами магния. Изученная реакция может быть в дальнейшем использована в качестве удобного селективного флуориметрического метода детекции однонитевых рибосомальных РНК и исследования их свойств.
Измерение концентрации РНК в биологических образцах относится к важной прикладной задаче. Биохимические методы, используемые для этого, слишком трудоемки. Одним из наиболее простых и высокочувствительных способов детекции РНК является окрашивание флуоресцентными красителями. Однако эти красители обычно флуоресцируют не только при связывании с РНК, но также с ДНК, белками и липидами. Чтобы сделать метод селективным по отношению к РНК, можно использовать специфический гидролиз с помощью рибонуклеазы.
Рибонуклеазы (РНКазы) представляют собой ферменты, которые разрушают РНК и тем самым обеспечивают внутриклеточный баланс между синтезом и гидролизом их различных видов [1]. Биназа – катионная гуанил-специфичная РНКаза, секретируется Bacillus pumilis (B. intermedius) [2]. Она обладает цитотоксичностью и способностью вызывать селективный апоптоз раковых клеток [3, 4] и вируса пандемического гриппа A (H1N1) [5]. В структуре биназы присутствуют 3 альфа-спирали и 2 бета-складки [6]. Она представляет собой эндонуклеазу, которая расщепляет фосфодиэфирную связь между 3'-гуаниновым остатком и 5'OH-остатком соседнего нуклеотида с образованием промежуточного соединения – 2',3'c-GMP. Последующий гидролиз 2',3'c-GMP до 3'-фосфата является высокоспецифичным, но протекает медленно, и 2',3'c-GMP обнаруживается в реакционной смеси в течение 1 ч [7]. Один из каталитических остатков – His101 – локализуется на подвижной петле, а другой – Glu72 – находится в бета-структуре белка. Остатки Phe55 и Tyr102 являются частью субстрат-связывающего участка. По этому участку связываются гуаниновые основания [8]. Каталитическая активность биназы по отношению к синтетическим полинуклеотидам и высокополимерной дрожжевой РНК была охарактеризована ранее стандартными методами [9, 10].
Кинетические исследования функционирования РНКаз при различных условиях являются одним из наиболее важных инструментов для понимания их взаимодействия с РНК. Для биназы и ее гомолога барназы было показано, что ферменты стабильны в широком диапазоне рН от 3 до 10 с оптимумом при рН 8.5 и им для проявления активности не требуются ионы металлов [11]. Биназа в растворе способна образовывать димеры, что необходимо для эффективного гидролиза РНК [12].
При решении прикладных задач можно определять содержание РНК в различных биологических образцах, окрашивая ее флуоресцентным красителем и используя биназу в качестве специфического сенсора. Ранее краситель акридиновый оранжевый (АО) применяли при изучении клеточного цикла, структуры нуклеиновых кислот (НК) и апоптоза [13], а также злокачественного роста клеток in vivo и in vitro [14].
Цель работы – флуоресцентное определение гидролиза однонитевой рибосомальной РНК биназой при разных условиях in vitro с помощью красителя АО, связанного с РНК.
МЕТОДИКА
В работе использована биназа – гуанил-специфичная РНКаза B. pumilis дикого типа (КФ 3.1.27.3, молекулярная масса 12.3 кДа, 109 аминокислотых остатков, pI 9.5, (“Биохимический завод”, Латвия), которая была очищена и проверена на отсутствие ДНКаз, высокомолекулярная дрожжевая однонитевая рРНК (“Serva”, США), фрагментированная лососевая ДНК (х. ч.) и акридиновый оранжевый (чда, “Диаэм”, Россия).
Использовали 0.05 М трис-HCl-буфер, рН 7.0, содержащий 0.1 М NaCl и 0.05 M NaAc, (буфер-1) и 0.05 М трис-фосфат-буфер, рН 7.0 (буфер-2).
Раствор АО смешивали с одним из буферов при различных температурах и рН в конечной концентрации 5 мкМ. В используемой концентрации АО не связывался с биназой и не подавлял ее активность по отношению к РНК. Конечная концентрация биназы была 20 мкг/мл, РНК по нуклеотидам – 260 мкМ.
Концентрацию АО и РНК определяли на спектрофотометре 5400УФ (“ПромЭкоЛаб.”, Россия) при 490 и 260 нм соответственно, а биназы – при 280 нм. Образование комплекса РНК с АО и последующий гидролиз биназой измеряли по спектрам излучения АО в диапазоне 500–700 нм или в зависимости от условий по интенсивности в максимуме спектра (528–531 нм) на спектрофлуориметре Cary (“Cary”, США) при λ возбуждения 490 нм. Реакцию гидролиза РНК детектировали также по уменьшению степени поляризации флуоресценции АО.
Растворы РНК смешивали с раствором АО и добавляли биназу после связывания РНК с красителем. Смесь инкубировали необходимое время в фиксированных условиях при определенной температуре. Затем пробы охлаждали до комнатной температуры и проводили измерения в стеклянных кюветах (1 см) на спектрофлуориметре Cary (спектров и кинетики интенсивности флуоресценции) или SLM-4800 (поляризованной флуоресценции с применением поляризационных призм Глан-Томсона).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
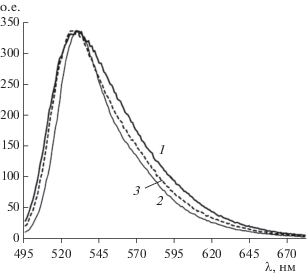
В рибосомальной РНК модифицированы около 70% нуклеотидов, в частности, они метилированы, содержат СН3-группу во втором положении рибозы, а также в азотистых основаниях, поэтому образуют шпильки, а 30% нуклеотидов – собой мало упорядоченные нитевидные участки. При взаимодействии с однонитевыми, шпилечными и двунитевыми НК мономеры АО флуоресцируют зеленым светом, а димеры АО – красным [15]. В данной работе при нейтральных значениях рН ~ 7 наблюдалась наибольшая интенсивность зеленой флуоресценции АО в комплексе c однонитевой рибосомальной РНК (при 20°С) с максимумом спектра при 529 нм (рис. 1).
Рис. 1.
Спектры флуоресценции в буфере 1 при рН 7.0 и 20°C АО (1), комплекса АО с РНК (2) и АО после гидролиза РНК биназой в течение 20 мин (3).

Поскольку спектры АО с РНК и без РНК по форме и положению оказались довольно близки (рис. 2), то это свидетельствовало о том, что краситель встраивался не столько между плоскостями нуклеотидов, сколько в полярных (фосфатных) областях макромолекулы РНК, в которых контактировал с водной фазой. При низком соотношении краситель/нуклеотиды ~1/50 АО не образовывал димеров (флуоресцирующих в красной области), а комплекс с рибосомальной РНК, поэтому наблюдалась только зеленая мономерная флуоресценция. Это свидетельствовало о том, что в растворе длинная РНК в некоторых местах складывалась, образуя двунитевые области, в которые встраивался краситель. При этом спектр АО в комплексе с РНК имел меньшую полуширину, чем с фрагментированной ДНК (рис. 2).
Рис. 2.
Нормированные в максимуме спектры флуоресценции АО в водной фазе (1), АО с РНК (2) и фрагментированной ДНК (3); нормирование проводили умножением двух спектров на два коэффициента, делающих одинаковой интенсивность всех трех спектров в максимуме.
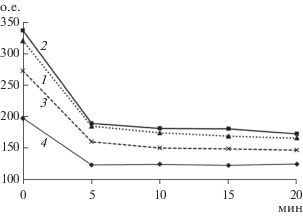
После внесения биназы в раствор АО с рРНК наблюдали постепенный гидролиз РНК (рис. 1 и 3). Увеличение температуры обычно приводит к резкому увеличению скорости реакций. Но в случае гидролиза биназой повышение температуры до 37 или 56°С вызывало лишь небольшое ускорение гидролиза. При отсутствии нагревания гидролиз протекал немного медленней, а интенсивность флуоресценции АО не возвращалась полностью до исходного уровня контроля (АО в буфере 1 без РНК). При более высоких температурах (37 и 56°С) реакция осуществлялась быстрее, чем при 20°С (рис. 3). Она завершалась через 5 мин и проходила полностью, поскольку интенсивность флуоресценции комплекса АО и рРНК падала до начального уровня (данные получены в режиме “кинетика”). Разница в начальных интенсивностях была связана с разной температурой, влияющей на квантовый выход флуоресценции красителя и его связывание. В случае гидролиза при комнатной температуре для гидролиза требовалось в несколько раз больше времени, примерно 15 мин (табл. 1, рис. 1 – спектры флуоресценции АО и рРНК при 20°С). Это свидетельствовало о том, что заключительная стадия реакции гидролиза РНК оказалась лимитирующей и слабо зависела от температуры. Известно, что малая зависимость от температуры характерна для мономолекулярных ферментативных реакций с энергией активации, близкой к нулю (в том числе реакций гидролиза с участием РНКаз). Поскольку реакция гидролиза РНК биназой осуществляется только в сформировавшихся комплексах, а не при столкновениях, то она не слишком сильно зависит от температуры.
Рис. 3.
Интенсивность флуоресценции (о.е.) комплекса АО с РНК после инкубации с биназой при 20 (1), 37 (2) и 56°С (3).
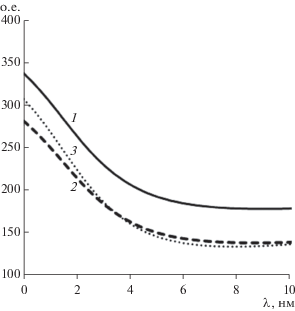
Таблица 1.
Интенсивность флуоресценции АО до и после образования комплекса с РНК в буфере-1 при различных условиях
| Показатель | Интенсивность флуоресценции + биназа | ||||
|---|---|---|---|---|---|
| Температура (рН 7.0) | АО | АО + НК | 5 мин | 15 мин | 25 мин |
| РНК | |||||
| 20°С | 150 ± 1 | 337 ± 1.1 | 192 ± 2.1 | 174 ± 1.3 | |
| 37°С | 135 ± 1.3 | 281 ± 1.3 | 149 ± 1.3 | 142 ± 1.2 | |
| 56°С | 130 ± 0.8 | 307 ± 0.9 | 144 ± 0.9 | 146 ± 0.5 | |
| рН (при 20°С) | |||||
| рН 5.0 | 150 ± 0.7 | 196 ± 1.9 | 122 ± 1.6 | 123 ± 1.5 | |
| рН 6.0 | 140 ± 1.2 | 272 ± 1.9 | 159 ± 1.8 | 148 ± 1.8 | |
| рН 7.0 | 150 ± 1.5 | 336 ± 2.5 | 188 ± 0.9 | 180 ± 1.2 | |
| рН 8.0 | 135 ± 0.9 | 319 ± 2.3 | 184 ± 0.2 | 168 ± 0.9 | |
| Ионы (при рН 8.0, 20°C) | |||||
| 100 мкМ MgCl2 | 126 ± 2 | 179 ± 1.9 | 155 ± 1.3 | 141 ± 1.6 | 137 ± 1.3 |
| 400 мМ NaCl | 109 ± 1.5 | 229 ± 2.6 | 181 ± 2 | 154 ± 2.1 | 146 ± 1.8 |
| Трис (буфер 2) | 120 ± 1 | 224 ± 1.6 | 141 ± 1.4 | 130 ± 1.4 | |
| ДНК (контроль) | 121 ± 1.2 | 178 ± 1.8 | 179 ± 2 | 179 ± 1.9 | 179 ± 1.5 |
Можно предположить, что различия интенсивности флуоресценции АО и рРНК при комнатной температуре и при нагревании, обусловлены тем, что красителю при нагревании рРНК, имеющей температуру плавления выше 56°С (присутствие соли в буфере увеличивает ее), сложнее интеркалировать в нее, так как она при нагреве сильно расплетается.
После нагревания биназы в течение 20 мин при 37°С исчезала тирозиновая полоса (при 310 нм) флуоресценции фермента. И при нагревании до 56°С тирозиновая флуоресценция также практически отсутствовала. Небольшое ~15% снижение триптофановой флуоресценции при 350 нм наблюдали лишь при нагревании фермента при 56°С в течение 2 ч (рис. 4). При этом также исчезала тирозиновая компонента, обычно появляющаяся при денатурации белков в районе 310 нм [17]. Это свидетельствовало об очень высокой устойчивости бактериальной рибонуклеазы к нагреванию. Даже при кипячении в течение 15 мин при 90°С ферментативная активность биназы сохранялась. Таким образом, фермент оказался очень устойчив к температуре, он легко ренатурировал и не терял активности при нагревании.
Рис. 4.
Спектры флуоресценции исходной биназы (1) и после нагревания при 56°С в течение 20 (2) и 120 мин (3).

При изучении влияния рН на скорость гидролиза комплекса АО с рРНК наибольшую интенсивность флуоресценции наблюдали при рН 7.0–8.0. Вследствие гидролиза биназой флуоресценция падала почти в 2 раза в течение 5 мин. Изменение интенсивности флуоресценции комплекса АО и рРНК при гидролизе через различные промежутки времени (данные получены по точкам) показано на рис. 5. При рН 5.0 интенсивность флуоресценции комплекса АО с РНК оказалась в 1.5 раза ниже, чем при рН 7.0–8.0, несмотря на то, что оптимум рН действия биназы равен 8.5. Таким образом, при рН 5.0 или 6.0 наблюдалось более полное возвращение интенсивности флуоресценции АО до уровня контроля (в течение 5 мин), то есть гидролиз осуществлялся до конца, и, возможно, происходил частичный кислотный гидролиз олигонуклеотидов. При значениях рН 7.0–8.0 реакция гидролиза проходила тоже в течение 5 мин, но не до конца (рис. 5), то есть часть макромолекул РНК оставалась не расщепленной до коротких олигонуклеотидов.
Рис. 5.
Зависимость интенсивности флуоресценции (о.е.) комплекса АО с РНК, измеренной “по точкам” через 0, 5, 10, 15 и 20 мин при рН 8.0 (1), 7 (2), 6 (3) и 5 (4).
При большой ионной силе (при добавлении 0.4 М NaCl в буфер 1 или буфер 2) интенсивность флуоресценции АО уменьшалась по сравнению с обычными условиями. Как в буфере 1, так и 2 наблюдали схожую картину кинетики гидролиза РНК ферментом. Однако скорость гидролиза при существенном увеличении ионной силы буфера была гораздо меньше. Чтобы проверить влияние буфера 1 на образование комплекса АО с РНК (вследствие присутствия хлорида натрия и ацетата натрия) был использован буфер 2, который ранее применяли другие исследователи биназы [2–5]. Значения интенсивности флуоресценции и скорости гидролиза РНК не изменились (табл. 1, рис. 5). Для оценки влияния ионов магния и ионной силы добавляли MgCl2 (конечная концентрация 3 мМ) и NaCl (конечная концентрация 0.4 М). При этом уменьшалась интенсивность флуоресценции по сравнению с нормальными условиями (рис. 1). Выбранные соли были взяты в указанных концентрациях, поскольку эти ионы присутствуют в клетке именно в таких количествах. Схожую картину кинетики гидролиза наблюдали, как в буфере 1, так и 2, поэтому в дальнейшем использовали буфер 1.
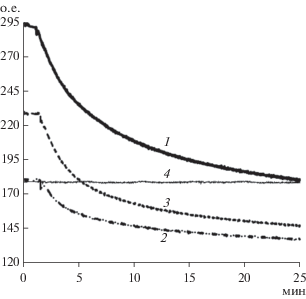
В рибосомах РНК существует в комплексе с ионами магния, компенсирующими ее отрицательный заряд. В данной работе при рН 8.0 добавление 100 мкМ MgCl2 к раствору РНК существенно уменьшало флуоресценцию АО (рис. 6). Гидролиз РНК биназой в присутствии магния протекал заметно медленнее. Это свидетельствовало о том, что отрицательные заряды фосфатных групп РНК играли важную роль в формировании комплексов с биназой, а магний мешал комплексооброазованию. Необходимо заметить, что сначала проверяли устойчивость комплекса АО и РНК в присутствии ионов (плато на рис. 6) и только потом добавляли биназу.
Рис. 6.
Кинетика гидролиза РНК биназой, детектируемая в буфере-1 при рН 8.0 и 20°C по флуоресценции АО (1) и в присутствии 100 мкМ хлорида магния (2) или 0.4 М хлорида натрия (3), а также отсутствие гидролиза фрагментированной ДНК биназой (4).
Для дифференциальной идентификации ДНК и РНК используют метахроматические свойства АО [13–15]. Подобранные в работе условия специфичны для определения длинной однонитевой рибосомальной РНК, образующей в растворе двунитевые участки. Влияние ионной силы, присутствия катионов двухвалентных металлов и рН на разные РНК и ДНК может различаться [16].
Для проверки специфичности биназы в качестве контроля использовали фрагментированную лососевую ДНК, для которой также известно образование комплекса с АО. Наблюдалось образование комплекса АО с ДНК при рН 8.0 и 20°С (рис. 2). Однако флуоресценция оказалась меньше, чем в случае комплекса с РНК (рис. 5). И, что самое важное, не происходило гидролиза ДНК биназой (рис. 6). Таким образом, показана высокая специфичность метода, а также исключена возможность “спонтанного” гидролиза РНК в отсутствие биназы, в том числе вследствие случайного попадания РНКаз извне.
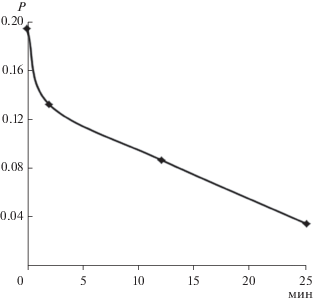
Был также использован метод поляризационной флуориметрии, в котором использовали длину волны возбуждения не в максимуме поглощения при 490 нм, а в длинноволновой области при 510 нм, чтобы степень поляризации (Р) была как можно выше [17] (концентрации веществ не изменяли). При связывании АО с РНК наблюдали увеличение Р в 6 раз, что вызвано перераспределением свободно вращающейся в воде молекулы красителя в вязкую макромолекулу РНК. Последующее добавление биназы снижало поляризацию в 5.5 раз (рис. 7) почти до исходного уровня (АО без РНК), что свидетельствовало о практически полном гидролизе РНК. Свободный АО в растворе имеет практически нулевую Р из-за своего быстрого вращения, а в комплексе с “вязкой” макромолекулой РНК – высокую. Как видно из сравнения поляризационной кинетики (рис. 7) и кинетики интенсивности (рис. 3–5), первая из них позволяла проследить процесс гидролиза РНК до его полного завершения, в то время как кинетика интенсивности информировала о начальных стадиях гидролиза.
Рис. 7.
Падение степени поляризации флуоресценции АО в течение гидролиза РНК биназой при рН 7.0 и 20°C; длина волны возбуждения 510 нм, излучения – 540 нм, щели монохроматоров 8.
Хотя разработанный в данной работе флуоресцентный метод менее чувствителен, чем метод двухфотонной корреляционной спектроскопии НК, меченных ковалентно двумя флуорофорами [18], он имеет ряд важных преимуществ: 1) нет необходимости в трудоемкой процедуре ковалентного мечения РНК или ДНК красителями, 2) не требуется использования корреляционного микроскопа и сложной техники двухфотонной спектроскопии и 3) метод можно использовать не только in vitro, но также in vivo для изучения живых клеток и клеточных органелл (это будет описано в отдельной работе).
Таким образом, в настоящей работе предложен метод определения РНК с помощью флуоресцентной и поляризационной спектроскопии с использованием АО и селективного “сенсора” – биназы. Данный метод будет в дальнейшем апробирован в качестве доступной альтернативы для определения рибосомальной РНК в биологических образцах.
Список литературы
Shlyakhovenko V.A. // Exp. Oncol. 2009. V. 31. № 3. P. 127–133.
Ulyanova V., Vershinina V., Ilinskaya O. // FEBS J. 2011. V. 278. № 19. P. 3633–3643.
Ilinskaya O.N., Dreyer F., Mitkevich V.A., Shaw K.L., Pace C.N., Makarov A.A. // Protein Sci. 2002. V. 11. № 10. P. 2522–2525.
Cabrera-Fuentes H.A., Aslam M., Saffarzadeh M., Kolpakov A., Zelenikhin P., Preissner K.T., Ilinskaya O.N. // Toxicon. 2013. V. 69. № 3. P. 219–226.
Shah Mahmud R., Ilinskaya O.N. // Acta Naturae. 2013. V. 5. № 4. P. 44–51.
Reibarkh M.Ya., Nolde D.E., Vasilieva L.I., Bocharov E.V., Shulga A.A., Kirpichnikov M.P., Arseniev A.S. // FEBS Lett. 1998. V. 431. № 2. P. 250–254.
Сокуренко Ю.В., Зеленихин П.В., Ульянова В.В., Колпаков А.И., Мюллер Д., Ильинская О.Н. // Биоорг. хим. 2015. Т. 41. № 1. С. 37–43. (Sokurenko Yu.V., Zelenikhin P.V., Ulyanova V.V., Kolpakov A.I., Muller D., Ilinskaya O.N. // Russian J. Bioorganic Chem. 2015. V. 41. № 1. P. 37–43.)
Wang L., Pang Y., Holder T., Brender J.R., Kurochkin A.V., Zuiderweg E.R. // Proc. Natl. Acad. Sci. USA. 2001. V. 98. № 14. P. 7684–7689.
Yakovlev G.I., Moiseyev G.P., Struminskaya N.K., Borzykh O.A., Kipenskaya L.V., Znamenskaya L.V., Leschinskaya I.B., Chernokalskaya E.B., Hartley R.W. // FEBS Lett. 1994. V. 354. № 3. P. 305–306.
Ilinskaya O.N., Karamova N.S., Ivanchenko O.B., Kipenskaya L.V. // Mutat. Res. 1996. V. 354. № 2. P. 203–209.
Takahashi K., Moore S. The enzymes. N.Y.: Acad. Press, 1982. V. 15. Nucleic acids, part B. P. 435–467.
Dudkina E., Kayumov A., Ulyanova V., Ilinskaya O. // PLoS ONE. 2014. V. 9. № 12. P. 1–14.
Сясина Т.В., Козлов А.В., Бессмельцев С.С., Удальева В.Ю. // Приоритетные направления развития науки, технологий и техники. Материалы межд. конф. Египет: Современные наукоемкие технологии, 2011. № 1. С. 63–64.
Беляева Т.Н., Салова А.В., Леонтьева Е.А., Моженок Т.П., Корнилова Е.С., Кроленко С.А. // Цитология. 2009. Т. 51. № 10. С. 830–837.
Сайфитдинова А.Ф. Двумерная флуоресцентная микроскопия для анализа биологических образцов. Учебно-методическое пособие, 2-е изд. СПб.: “Соло”, 2011. 111 с.
Андреева И.С., Закабунин А.И. // Biological Sciences, “Сolloquium-J.”. 2017. № 2. P. 8–15.
Vekshin N.L. Photonics of Biopolymers. Berlin: Springer, 2002. 230 p.
Kettling U., Koltermann A., Schwille P., Eigen M. // Proc. Natl. Acad. Sci. USA. 1998. V. 95. № 4. P. 1416–1420.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


