Прикладная биохимия и микробиология, 2019, T. 55, № 5, стр. 481-491
Влияние состава крахмала на биосинтез иммунодепрессанта такролимуса (FK-506) штаммом Streptomyces tsukubaensis ВКМ Aс-2618Д
В. Ю. Пошехонцева 1, 2, В. В. Фокина 2, 3, *, Г. В. Суходольская 2, 3, А. А. Шутов 2, 3, М. В. Донова 2, 3
1 Пущинский государственный естественно-научный институт
142290 Московская обл., Пущино, Россия
2 Федеральный исследовательский центр “Пущинский научный центр биологических исследований
Российской академии наук”, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Московская обл, Пущино, Россия
3 ООО “Фарминс”
142290 Московская обл., Пущино, Россия
* E-mail: fokina@ibpm.pushchino.ru
Поступила в редакцию 24.10.2018
После доработки 14.01.2019
Принята к публикации 22.04.2019
Аннотация
Изучена зависимость биосинтеза макролидного иммуносупрессорного агента такролимуса (F-K‑506) штаммом Streptomyces tsukubaensis ВКМ Ас-2618Д на крахмалсодержащих средах от молекулярного веса и состава полисахаридов картофельных крахмалов. Показано, что при близких значениях показателей роста культуры использование в качестве источника углерода высокомолекулярных разветвленных крахмалов обеспечивало более высокий выход такролимуса по сравнению с линейными низкомолекулярными полисахаридами. Предложены подходы, обеспечивающие достижение максимально высоких показателей процесса биосинтеза такролимуса при использовании высоко- и низкомолекулярных крахмалов и декстринов. Проведение процесса биосинтеза в условиях периодического культивирования с дробным внесением дополнительных порций крахмалов значительно (до 2 раз) повышало его выход, поддерживало количество биомассы на более высоком уровне и снижало скорость деструктивных процессов. При внесении добавок высокомолекулярных картофельных крахмалов после перехода культуры в фазу замедления роста максимально увеличивалась эффективность биосинтеза такролимуса, в то время как при внесении низкомолекулярных крахмалов и декстринов максимальный позитивный эффект отмечался позднее (в стационарной фазе роста). Полученные результаты могут быть полезны при создании биотехнологии производства фармацевтической субстанции такролимуса.
При многих тяжелых заболеваниях часто последней надеждой на спасение жизни пациента остается трансплантация донорских органов. Количество ежегодно проводимых в мире операций по пересадке органов и тканей превышает 40 тыс. на 1 млн пациентов и, по некоторым прогнозам, в ближайшей перспективе составит не менее 50% всех операций. В настоящее время успех подобных операций во многом обусловлен использованием современных иммуносупрессорных препаратов, из которых наиболее широкое применение получил такролимус.
Такролимус (FK-506) представляет собой 23‑членный макроциклический поликетид, продуцируемый рядом таких стрептомицетов, как Streptomyces tsukubaensis, S. tacrolimicus и S. clavuligerus [1]. Максимальным уровнем продуктивности обладают штаммы S. tsukubaensis.
В настоящее время такролимус широко используется в иммуносупрессивной терапии для предотвращения отторжения трансплантата, лечения аутоиммунных и кожных заболеваний [1], что объясняет большой интерес к способам его получения. Работы по повышению производительности процессов биосинтеза направлены как на создание высокопроизводительных штаммов-продуцентов [2], так и на оптимизацию условий роста штаммов и этапов биосинтеза [3].
Для биосинтеза такролимуса, как правило, используют богатые комплексные среды, обычно включающие несколько источников углерода (моно-, ди- и полисахариды, органические кислоты, растительные масла и др.) и органический источник азота (кукурузный или дрожжевой экстракты, гидролизаты казеина и аминокислоты). Повышению выхода FK-506 способствует добавление в среду таких его близких предшественников, как пипеколат, хоризмат и шикимат [4–6]. Однако дороговизна этих соединений и недоступность в необходимых количествах значительно ограничивает их использование для его промышленного получения. В качестве альтернативных источников углерода при биосинтезе такролимуса были предложены меласса и отходы переработки зерна [7], а источников углерода и органического азота – перьевая мука [8].
Известно, что присутствие в среде таких легко-усвояемых источников углерода, как глюкоза и глицерин, может приводить к снижению или даже полному блокированию синтеза вторичных метаболитов по механизму, предположительно сходному с катаболитной репрессией [9]. Имеются противоречивые сведения о влиянии легкоусвояемых источников углерода на биосинтез такролимуса. Так, не было отмечено какое-либо негативное влияние глюкозы на его биосинтез культурой S. tsukubaensis [10]. Однако в более поздних работах показано, что биосинтез FK-506 этой культурой блокируется в присутствии глюкозы, такое же репрессирующее действие оказывает глицерин [11]. Наиболее подходящими источниками углерода, обеспечивающими достижение высокого выхода такролимуса, признаны крахмалы [10–13].
Крахмал – растительный полисахарид, содержащий в своем составе амилозу и амилопектин. Молекула амилозы имеет линейную структуру, включающую до 1000 остатков α-D-глюкопиранозы, соединенных α-1,4-гликозидными связями. Растворимость амилозы в воде не превышает 11 г/л, при этом образуются нестойкие растворы со сравнительно низкой вязкостью. Молекула амилопектина характеризуется разветвленной структурой, в которой образующие ее остатки α‑D-глюкопиранозы связаны между собой, помимо α-1,4-, также α-1,6-гликозидными связями (около 5% от общего количества связей). Амилопектин обладает большей растворимостью, составляющей порядка 20 г/л, и образует вязкие растворы. Оба полисахарида относятся к редуцирующим сахарам, так как содержат концевую группу, отвечающую за восстановительные свойства [14, 15]. Крахмалы могут быть представлены также частично разветвленной амилозой, по своим свойствам занимающей промежуточное положение между амилозой и амилопектином [16].
Состав и физико-химические характеристики крахмалов, зависящие от их природных источников и способов получения, могут оказывать влияние на биосинтез такролимуса [8, 10, 17]. Как правило, промышленно произведенные крахмалы являются продуктами частичного гидролиза нативного крахмала, что обусловливает их повышенную растворимость по сравнению с исходным полисахаридом.
Сложности биотехнологического применения крахмалов в качестве компонентов питательных сред связаны с гелеобразованием и высокой вязкостью их растворов, которые вызывают проблемы при стерилизации, обеспечения эффективности массопереноса и др., что существенно ограничивает применение крахмалов в высоких концентрациях. Гелеобразование и вязкость растворов крахмалов во многом зависят от соотношения коротких и длинных, а также линейных и разветвленных полисахаридов. Низкомолекулярные полисахариды, как правило, являются более эффективными с точки зрения реологии и технологичности использования по сравнению с высокомолекулярными.
Данные литературы об утилизации полисахаридов стрептомицетами, продуцирующими макролиды, весьма ограничены. Оболочка бактериальной клетки, как правило, непроницаема для коллоидов, к которым относятся растворы крахмалов. В связи с этим на начальном этапе утилизации крахмала микроорганизмом необходим его гидролиз внеклеточными ферментами. Образовавшиеся при гидролизе глюкоза и другие низкомолекулярные сахара переносятся в клетку соответствующими транспортными системами [18].
В группу амилолитических (гидролизующих крахмал) ферментов входят α-амилаза, β-амилаза, глюкоамилаза, α-глюкозидаза, изоамилаза и пуллуланаза. α-Амилазы (КФ 3.2.1.1) представляют собой эндоферменты, расщепляющие случайным образом в молекуле крахмала α-D-(1 → 4)-О-гликозидные связи. β-Амилазы (КФ 3.2.1.2) относятся к амилолитическим экзоферментам и расщепляют молекулу крахмала с нередуцирующего конца. β‑Амилазы, α-глюкозидазы (КФ 3.2.1.20) и глюкоамилазы (КФ 3.2.1.3), наряду с глюкозой и мальтозой, могут образовывать из крахмала мальтоолигосахариды [19].
Данные о полисахаридном составе растворимых коммерческих крахмалов отсутствуют или не дают полной информации об их полисахаридном составе. Между тем качественный и количественный состав крахмала (соотношение амилозы и амилопектина, низко- и высокомолекулярных, линейных и разветвленных полисахаридов) не только определяют физико-химические свойства сред, но и влияют на рост и биосинтетическую активность стрептомицетов, которая зависит от их способности к утилизации тех или иных полисахаридов за счет наличия гидролитических ферментов [20]. Изучение влияния крахмалов на биосинтез такролимуса носит единичный характер и не дает полного представления о преимущественном влиянии каких-либо компонентов на этот процесс.
Штамм S. tsukubaensis ВКМ Ac-2618Д эффективно синтезирует такролимус на крахмалсодержащих средах [12, 21, 22]. В предыдущей работе [17] была проведена оценка эффективности его биосинтеза на средах, содержащих крахмалы различного происхождения (картофельный, кукурузный, нативный и модифицированный тапиоковый и гороховый). Было показано преимущество растворимого картофельного крахмала, при использовании которого выход целевого продукта повышался до 500 мг/л. В дальнейшем оказалось, что выход FK-506 существенно варьирует в зависимости от физико-химических свойств используемых картофельных крахмалов, которые различаются у разных производителей. Подобная зависимость отмечалась в работе [10].
Цель работы – изучение влияния состава и физико-химических свойств картофельных крахмалов на эффективность биосинтеза такролимуса штаммом S. tsukubaensis ВКМ Ac-2618Д.
МЕТОДИКА
Реактивы. В работе использовали амилодекстрин (растворимый крахмал, К1, “Купавнареактив”, Россия), растворимый крахмал (К2, “Difco”, США), водорастворимый крахмал (К3, “Индикатор”, Россия), растворимый крахмал (К4, “Лабкомплект”, Россия), декстрин желтый (ЖД, “Panreac”, США), мальтодекстрин Glucidex®19 (МД, “Roquette”, Франция), лиофилизированный кукурузный экстракт (“Sigma”, США), дрожжи хлебопекарные сухие (“Саф-Момент”, Франция), амберлитный сорбент XAD (“Sigma”, США), α-амилазу Aspergillus oryzae (“Serva”, Германия), стандартный препарат такролимуса для ВЭЖХ анализа (“Zhejiang Hisun Pharmaceutical Co. Ltd.”, Китай). Остальные реактивы были квалификации х. ч. или ч. д. а. производства России.
Микроорганизм. Штамм Streptomyces tsukubaensis ВКМ Ас-2618Д был получен из Всероссийской коллекции микроорганизмов Института биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН (ВКМ ИБФМ РАН).
Культивирование штамма и биосинтез такролимуса. Посевную культуру S. tsukubaensis ВКМ Ac-2618Д выращивали в качалочных колбах объемом 750 мл с 250 мл среды с рН 6.8–7.0 следующего состава (г/л дистиллированной воды): К1 – 40, лиофилизированный кукурузный экстракт – 12.5, сухие хлебопекарные дрожжи – 16.6, СаСО3 – 3.0 и MnSO4 – 0.05 (среда А). Культуру выращивали аэробно на качалке (220 об./мин) в течение 48 ч при 25°С. Для засева среды использовали криогенную культуру (5% об.).
Посевной материал (10% по об.) переносили в качалочные колбы объемом 750 мл в 50 мл среды с рН 6.8–7.0 следующего состава (г/л дистиллированной воды): К1 (или декстрин) – 40, лиофилизованный кукурузный экстракт – 12.5, сухие хлебопекарные дрожжи – 16.6, СаСО3 – 3.0, MnSO4 – 0.05, лизин – 5 и сорбент XAD – 40 (среда Б). Биосинтез такролимуса проводили в течение 10 сут в указанных выше условиях. Во время ферментации с 4 по 7 сут культивирования (схема I ) или со 2 по 7 сут культивирования (схема II ) проводили подпитку 5%-ным раствором крахмала или декстрина (концентрация в одной добавке – 6 г/л). МД и ЖД использовали для сравнения.
Определение биомассы. Биомассу определяли на двух средах: на среде Б, не содержавшей сорбента, в указанных выше условиях в режиме периодического культивирования и в условиях культивирования с подпиткой по схемам I и II , а также в течение 48 ч в режиме без подпитки на среде с рН 6.8–7.0 следующего состава (г/л дистиллированной воды): источник углерода – 20, пептон – 12, дрожжевой экстракт – 12, кислотный гидролизат казеина – 1.5, MgSO4 ⋅ 7Н2О – 0.25 и К2НРО4 – 1 (среда В). Концентрация источника углерода в среде В была выбрана на основании растворимости амилозы и амилопектина (11–20 г/л). В качестве источника углерода использовали К1-К4, ЖД, МД и глюкозу (Г).
Биомассу высушивали и взвешивали. Отбирали аликвоты культуральной жидкости (2 мл), добавляли α-амилазу A. oryzae до конечной концентрации 0.5 г/л для удаления не утилизированного крахмала, инкубировали в течени1е 2 ч при 40°С. Затем центрифугировали в течение 2 мин при 10000 × g и комнатной температуре. Осадок дважды промывали дистиллированной водой и сушили в течение 48 ч при 80°С. При определении биомассы на среде Б учитывали разведение.
Электронная микроскопия. Получение обезвоженных препаратов и их контрастирование напылением золотом осуществляли по известной методике [23]. Препараты изучали в сканирующем электронном микроскопе JSM-6510 (“JEOL”, Япония).
Выделение и анализ такролимуса. Культуральную жидкость после 10 сут культивирования центрифугировали при 15 300 × g в течение 40 мин при 4°С для отделения осадка, содержащего сорбент с такролимусом. Такролимус двукратно элюировали этанолом. Для анализа использовали объединенный этанольный экстракт. Количественное определение такролимуса проводили с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографической системы Agilent 1200 (“Agilent Technology”, Германия) с колонкой LiChrospher®100 RP-18 (5 мкм, 125 × 4 мм) (“Merck”, США) и с предколонкой Daltosil 100, RP-18 (4 мкм, 4.6 × 76 мм) (“Serva”, Германия). Состав мобильной фазы: вода, ацетонитрил, метилтретбутиловый эфир и трифторуксусная кислота (58.3 : 34.4 : 7.3 : 0.01, об./об.), скорость потока 1.5 мл/мин, температура 60°C. Детекцию осуществляли при 200 нм. Расчет концентрации такролимуса проводили на основании значений площадей пиков по калибровке внешним стандартом. Выход такролимуса в контроле принимали за 100%.
Оценка содержания полисахаридов. Предварительную качественную оценку высокомолекулярных сахаров в заводских крахмалах оценивали с помощью йодной пробы согласно ГОСТ 10163–76.
Количественное определение содержания амилозы в крахмалах осуществляли по методу [24], основанному на образовании нерастворимых клатратных комплексов амилозы с бутанолом. Осадки высушивали до постоянного веса при 45°С. Долю амилозы в составе крахмалов рассчитывали, как отношение сухого веса бутанолового комплекса к весу исходно внесенного крахмала.
Качественное и количественное определение содержания других сахаридов проводили в соответствии с методом [14], основанном на осаждении сахаров различной молекулярной массы этиловым спиртом. К аликвотам 2%-ных растворов крахмалов (2 мл) добавляли 10-кратный объем 40, 70 и 96%-го этанола (осаждение амило-, эритро- и ахродекстринов соответственно). Смесь перемешивали, инкубировали в течение 24 ч при комнатной температуре, центрифугировали и высушивали до постоянного веса при 45°С. Поскольку растворимость полисахаридов возрастала в смесях, содержащих моно-, ди- и олигомеры глюкозы, проводили повторную экстракцию 96%-ным этанолом полисахаридов из супернатантов, оставшихся после осаждения 40 и 70%-ным этанолом. Содержание каждой из фракций сахаров оценивали по сухому весу.
Определение редуцирующих веществ (РВ) проводили в 1.5%-ных растворах крахмалов и декстринов по методу [25]. Оптическую плотность измеряли на 2-лучевом спектрофотометре “Shimadzu” (Япония) при 610 нм. Концентрацию редуцирующих сахаров определяли по калибровочному графику, полученному для глюкозы.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Влияние картофельных крахмалов на биосинтез такролимуса. В предшествующей работе [17] было показано, что при ферментации S. tsukubaensis ВКМ Ac-2618Д наиболее высокий выход такролимуса достигался на средах с высоким содержанием картофельных крахмалов. Однако увеличение концентрации крахмала выше предела его растворимости приводило к целому ряду проблем, связанных с клейстеризацией и увеличением вязкости среды.
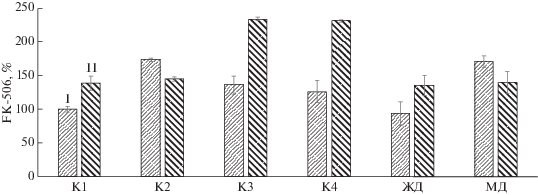
В настоящей работе крахмалы К1-К4 использовали в концентрации 40 г/л, соответствующей пределу растворимости К3 и К4. Выход такролимуса при их использовании составлял 246.0 ± 32.5 мг/л, более низкие выходы наблюдали при применении К1 и К2, а также декстринов (рис. 1).
Рис. 1.
Биосинтез такролимуса на средах с крахмалами и декстринами при периодическом (I) и периодическом культивировании с подпиткой по схеме I (II) (представлены средние значения трех повторностей).

Режим ежесуточной подпитки (по схеме I ) приводил к существенному повышению выхода FK-506 при использовании всех изученных источников углерода. Наиболее значительный эффект отмечался при использовании К2 и МД (почти двукратное увеличение выхода: до 385.5 ± 10.0 и 380.5 ± 32.5 мг/л соответственно), а менее значительный – K1, K3, K4 и ЖД (рис. 1).
При периодическом культивировании (без подпиток) к 8 сут в мицелии накапливались деструктивные изменения, которые характеризовались утратой четкости границ гиф, искривлением их профиля и изменением его прямой конфигурации на извилистую (рис. 2а, 2б). Применение подпиток способствовало более длительному сохранению популяции (рис. 2в, 2г). Так, на поздних сроках ферментации (8 сут) популяция была представлена активным мицелием без видимых признаков деструкции (рис. 2г), морфологически сходным с мицелием на ранних сроках культивирования (4 сут) (рис. 2в).
Рис. 2.
Морфология S. tsukubaensis ВКМ Ас-2618Д при биосинтезе такролимуса в течение 4 (а, в) и 8 сут (б, г) на среде, содержащей К1, при периодическом (а, б), периодическом с подпиткой культивировании по схеме I (в, г); (сканирующий электронный микроскоп, величина масштабной линейки – 5 мкм).

Таким образом, полученные результаты свидетельствовали о преимуществах применения периодического культивирования с подпиткой вне зависимости от типа использованного крахмала или декстринов.
Физико-химические свойства и состав крахмалов и декстринов. Полученные выше результаты подтверждали зависимость выхода такролимуса при культивировании S. tsukubaensis ВКМ Ас-2618Д от свойств используемого крахмала (рис. 1). Для определения характеристик крахмала, наиболее существенных при использовании для биосинтеза такролимуса, анализировали физико-химические свойства ряда картофельных крахмалов и декстринов (табл. 1).
Таблица 1.
Физико-химические свойства крахмалов и декстринов
| Сахар | Содержание амилозы, % | РВ, г/л | Окрашивание йодного комплекса | Содержание фракций осажденных этанолом, % | Содержание фракций повторно осажденных 96% этанолом, % | |||
|---|---|---|---|---|---|---|---|---|
| 40% | 70% | 96% | 40–96% | 70–96% | ||||
| К1 | 20 ± 0.5 | 0.123 ± 0.25 × 10–3 | Сине-фиолетовое | 10 ± 1.2 | 10 ± 1.4 | 10 ± 0.4 | 30 ± 5.5 | 76 ± 5.8 |
| К2 | 0 | 1.334 ± 3.34 × 10–3 | Отсутствует* | 0 | 0 | 20 ± 1.3 | 0 | 0 |
| К3 | 96 ± 0.3 | 0.031 ± 1.41 × 10–3 | Синее | 34 ± 1.7 | 34 ± 2.5 | 66 ± 2.5 | 54 ± 4.2 | 60 ± 2.2 |
| К4 | 92 ± 0.3 | 0.034 ± 1.44 × 10–3 | Синее | 33 ± 3.3 | 32 ± 1.5 | 66 ± 3.4 | 51 ± 2.2 | 57 ± 2.9 |
| ЖД | 0 | 0.697 ± 0.27 × 10–3 | Отсутствует* | 3 ± 0.1 | 3 ± 0.1 | 53 ± 3.1 | н.о. | н.о. |
| МД | 0 | 1.56 ± 4.67 × 10–3 | Отсутствует | 0 | 0 | 100 | н.о. | н.о. |
Полученные данные свидетельствовали о том что, что К1 преимущественно содержал высокомолекулярные полисахариды. На это указывали как очень низкий уровень РВ (0.123 г/л), так и интенсивное синее окрашивание йодом. При этом последнее характеризовало присутствие в нем линейных полисахаридов, из которых 20% были представлены амилозой (табл. 1). Повторное осаждение 96%-ным этанолом приводило к выпадению осадков, что также указывало на доминирование высокомолекулярных сахаров в составе К1 (табл. 1). Эти осадки впоследствии растворялись в воде, а полученные растворы окрашивались йодом в интенсивно-синий цвет, что свидетельствовало о том, что полисахариды в них имели линейную структуру [14, 15, 26].
Однако основными компонентами К2 оказались низкомолекулярные полисахариды – ахродекстрины и мальтодекстрины, не окрашиваемые йодом, что обуславливало высокий уровень РВ (1.334 г/л) (табл. 1). Окрашивание йодом концентрированных растворов этого крахмала позволило обнаружить минорные количества эритродекстринов (красновато-охровое окрашивание при двукратном увеличении объема йода) (табл. 1). Повторное осаждение 96%-ным этанолом не привело к выпадению осадков, что свидетельствовало о низкой степени полимеризации полисахаридов К2 [15, 26].
К3 и К4 представлены, главным образом, амилозой – 96 и 92% соответственно, что следовало из преобладающего количества образовавшихся бутаноловых комплексов с амилозой, а также интенсивного синего окрашивания йодом и крайне низкого содержания РВ (0.031 и 0.034 г/л соответственно) (табл. 1). При повторном осаждении 96%-ным этанолом были получены осадки, указывающие на преобладание в их составе высокомолекулярных полисахаридов. Эти осадки не растворялись в воде, а при взаимодействии с йодом давали интенсивное синее окрашивание взвешенных частиц.
Доминирующая фракция полисахаридов в ЖД представлена ахро- и мальтодекстринами, что следовало из отсутствия окрашивания йодом среднего уровня РВ 0.697 г/л, а также выпадения осадка при осаждении 96%-ным этанолом (табл. 1). Эритродекстрины обнаруживались в следовых количествах при окрашивании йодом концентрированного раствора с получением красно-бурого цвета.
Согласно паспорту производителя МД содержит 91% олиго- и полисахаридов, состоящих, в основном, из 19 глюкозных остатков, а также 2% глюкозы и 7% мальтозы. Компоненты МД при осаждении 96%-ным этанолом выпадали в осадок практически количественно. Окрашивание йодом было отрицательным, а уровень РВ – высоким, равным 1.56 г/л (табл. 1).
Влияние состава крахмала на биосинтез такролимуса. Сравнительный анализ влияния состава крахмалов, приведенных в табл. 1, на биосинтез такролимуса (рис. 1) свидетельствовал о том, что высокомолекулярные полисахариды (К1, К3 и К4) не способствовали его высокому выходу в условиях периодического культивирования с подпиткой (по схеме I ). Можно предположить, что гидролиз полимерной цепи таких крахмалов затруднен из-за недостаточного количества в молекуле субстрата мест связывания с концевыми амилолитическими ферментами.
Известно, что у штаммов S. tsukubaensis, как правило, отсутствуют эндогидролазы (α-амилазы) и присутствуют экзогидролазы (глюкоамилазы, β‑амилазы и α-глюкозидазы): так, в геноме близкородственного штамма S. tsukubaensis NRRL 18488Т отсутствовали гены, кодирующие эндогидролазы (α-амилазы), но присутствовали кодирующие экзогидролазы (GenBank: AJSZ00000000, https:// www.ncbi.nlm.nih.gov).
При отсутствии α-амилаз высокомолекулярные полисахариды К1, К3 и К4 не могли быть гидролизованы на более короткие фрагменты, что приводило к ограничению действия экзогидролаз, для которых необходимо достаточное количество нередуцирующих концов в молекуле полисахарида (рис. 3).
Рис. 3.
Схема действия α-амилазы (I), β-амилазы (II), глюкоамилазы и α-глюкозидазы (III) на крахмал [27].
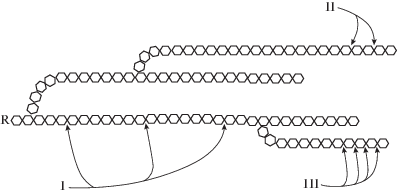
Если допустить, что количество нередуцирующих остатков, необходимых для проявления действия концевых амилолитических ферментов, равно числу редуцирующих, то у К2 в полимерной цепи мест связывания с экзогидролазами от 11 до 43 раз больше, чем у других изученных крахмалов (табл. 2), что может определять его более эффективное потребление штаммом-продуцентом.
Таблица 2.
Расчетные данные по количеству ангидроглюкозных единиц (АГЕ) в полимерной цепи крахмалов (согласно содержанию РВ)
| Крахмал | РВ, г/л | Количество АГЕ (С/РВ)* |
АГЕкрахмал (2)/АГЕкрахмал (n) | ММ, кДа |
|---|---|---|---|---|
| 1 | 0.123 ± 0.25 × 10–3 | 122 | 11 | ∼19.8 |
| 2 | 1.334 ± 3.34 × 10–3 | 11 | 1 | ∼1.8 |
| 3 | 0.031 ± 1.41 × 10–3 | 484 | 43 | ∼78.4 |
| 4 | 0.034 ± 1.44 × 10–3 | 441 | 39 | ∼71.4 |
Исходя из полученных данных, можно предположить, что раннее введение подпитки способствовало повышению выхода такролимуса. При предварительном изучении влияния различных режимов введения подпитки (со 2 по 7 и с 3 по 7 сут) наблюдали стабильное повышение выхода такролимуса в случае внесения добавки в период со 2 по 7 сут культивирования (схема II ). Результаты применения подпитки для изученных крахмалов и декстринов по схеме II приведены на рис. 4.
Рис. 4.
Биосинтез такролимуса на средах, содержащих крахмалы и декстрины в режиме периодического культивирования с подпиткой по схеме I (I) и схеме II (II) (представлены средние значения трех повторностей).
В условиях ведения подпитки по схеме II наблюдали увеличение выхода такролимуса при использовании К1, К3, К4 и ЖД на 38.6, 72.0, 83.4 и 44.3% соответственно по сравнению с выходом при более позднем начале подпитки (по схеме I ). В тоже время при выращивании на средах, содержащих К2 и МД, более раннее начало подпитки приводило к снижению выхода такролимуса на 19.6 и 22.6% соответственно. Таким образом, несмотря на незначительное различие по количеству суммарно добавленного раствора крахмала или декстрина по схеме I или II , наблюдались существенные различия в достигаемых уровнях выхода такролимуса при изменении времени начала подпиток.
Можно предположить, что высокий выход такролимуса, достигаемый при использовании К3 и К4, опосредован наличием в их молекулах бόльшего количества не редуцирующих концов (до 4 раз) по сравнению с молекулами К1 (табл. 2). Совокупность характеристик К3 и К4 (табл. 1 и 2), включающих молекулярный вес (по расчетам 78.4 и 71.4 кДа соответственно), низкий уровень РВ (0.031 и 0.034 мг/л соответственно), образование нерастворимых частиц при растворении в воде осадков, полученных при осаждении этанолом, и вязких не текучих растворов, характерных для амилопектина, а также присущее амилозе интенсивное синее окрашивание при взаимодействии с йодом, позволяет предположить, что они представлены частично разветвленной амилозой [16].
В свою очередь возможной причиной снижения выхода такролимуса при выращивании на средах, содержавших К2 и МД, при подпитке по схеме II был предполагаемый избыток по сравнению со схемой I низкомолекулярных сахаров, в частности глюкозы. Для вторичного биосинтеза, как правило, характерно использование штаммом-продуцентом полимеризованной глюкозы. Однако свободная экзогенная глюкоза может подавлять процесс биосинтеза такролимуса [11].
Во всех вариантах сред, использованных для выращивания, наиболее низкий выход такролимуса наблюдался при использовании ЖД, который получают путем химического гидролиза крахмала при повышенной температуре, сопровождающегося частичной карамелизацией. Как следует из табл. 1, ЖД содержал низкомолекулярные соединения с показателем РВ, вдвое уступающим этой величине продуктов ферментативного гидролиза крахмала – К2 и МД. При этом отсутствие при анализе ЖД окрашивания йодом, характерного для К2 и МД, могло свидетельствовать о наличии в его составе низкомолекулярных нелинейных сахаров, образующихся при карамелизации путем внутри- и межмолекулярной конденсации. Можно предположить, что особенности строения ЖД обуславливают его ограниченную доступность для амилолитических ферментов штамма-продуцента.
На рис. 5 представлена зависимость роста S. tsukubaensis ВКМ Ас-2618Д от используемых в средах крахмалов. Следует отметить, что в целом различия по биомассе, достигаемой при росте на низко- и высокомолекулярных крахмалах, были незначительны (15.4 ± 1.2 г/л), а снижение показателей роста наблюдали только на среде, содержавшей ЖД.
Рис. 5.
Рост S. tsukubaensis ВКМ Ас-2618Д на среде В, содержащей К1 (1), К2 (2), К3 (3), К4 (4), ЖД (5), МД (6) и Г (7) (представлены средние значения трех измерений).
Во всех случаях кривая роста имела характерный S-образный вид. Рост на среде с МД не отличался от роста на среде с К1-К4 (рис. 5). При этом количество биомассы на среде с ЖД было меньше на 20.5% (13.1 ± 0.7 г/л). Можно предположить, что это связано с вышеописанными особенностями его состава, модифицированной структурой и, как следствие, снижением его утилизации продуцентом (рис. 5).
Определение биомассы в динамике при биосинтезе такролимуса на среде Б, не содержащей сорбента, осложнялось, помимо высоких концентраций крахмалов, превышающих предел их растворимости, содержанием в ней ряда таких нерастворимых компонентов, как сухие дрожжи и карбонат кальция. Результаты оценки накопления биомассы в процессе биосинтеза такролимуса на среде Б приведены на рис. 6.
Рис. 6.
Рост S. tsukubaensis ВКМ Ac-2618Д на среде Б без сорбента в присутствии К1 (а), К2 (б), К3 (в), К4 (г), ЖД (д) и МД (е) без добавок (1) и с добавками по схеме I (2) и II (3) (представлены средние значения трех измерений).

Биомасса на среде Б, содержащей К2, низкомолекулярные растворимые полисахариды, а также МД, обладающей сходным составом, достигала через 2 сут культивирования максимального уровня 21.7 ± 0.7 г/л. Впоследствии наблюдалось снижение биомассы до 6.7 ± 0.1 г/л в условиях периодического культивирования и до 12.9 ± 1.2 г/л при культивировании с подпиткой (более плавное для К2 и резкое для МД) (рис. 6б, 6е).
Динамика изменения биомассы S. tsukubaensis на среде Б, содержащей высокомолекулярные крахмалы К1, К3 и К4, имела сходный вид (рис. 6а, в, г). Максимальный уровень биомассы отмечался также через 2 сут от засева и составил 24.2 ± 0.6 (К1) и 26.4 ± 0.7 г/л (К3 и К4). Следует отметить, что, несмотря на использование для обеспечения возможности измерения биомассы в использованных средах α-амилазы, расщепляющей крахмалы, нельзя полностью исключить погрешности, связанные с наличием остаточного крахмала, что могло привести к некоторому завышению значений в течение начальных этапов культивирования (первые 2 сут). Тем не менее, проведенные исследования позволяли оценить общие закономерности изменения биомассы в процессе биосинтеза такролимуса. После 2 сут культивирования также наблюдалось снижение биомассы до 11.2 ± 3.2 г/л к 10 сут, в режиме как периодического культивирования, так и культивирования с подпиткой по схемам I и II (рис. 6а, 6в, 6г).
Динамика изменения биомассы при биосинтезе такролимуса на среде, содержавшей ЖД, имела вид, отличающийся от динамики других изученных полимеризованных источников углерода, не наблюдалось существенной разницы по биомассе при различных режимах культивирования (рис. 6д).
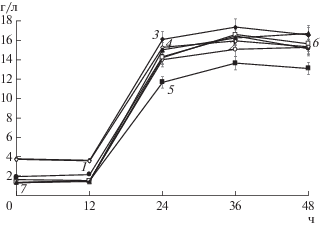
Однако из данных по убыли РВ следовало (рис. 7), что, несмотря на то, что состав изучаемых полисахаридов, добавленных в среду В, не влиял значительным образом на количество биомассы (рис. 5), скорость их утилизации продуцентом зависела от их состава.
Рис. 7.
Динамика потребления S. tsukubaensis ВКМ Ac-2618Д К1 (1), К2 (2), К3 (3), К4 (4), ЖД (5) и МД (6), а также Г (7) (представлены средние значения трех измерений).
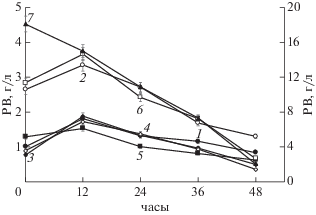
Как видно на рис. 7, низкомолекулярные субстраты (глюкоза и компоненты К2 и МД) утилизировались с наибольшей скоростью, а медленнее потреблялись высокомолекулярные (К1, К3 и К4) и трудноусваиваемые (ЖД) субстраты. Однако характер кривых во всех случаях был близок. Так, в первые 12 ч наблюдали рост РВ, что свидетельствовало о преобладании процесса гидролиза высокомолекулярного субстрата над потреблением образовавшихся низкомолекулярных продуктов – глюкозы и мальтозы, в последующие сут превалировали процессы потребления продуктов гидролиза крахмала (рис. 7). К концу 4–5 сут культивирования во всех случаях скорости образования и потребления продуктов гидролиза крахмалов и декстринов были уравновешены, и при этом достигались близкие значения РВ (0.66 ± 0.19 г/л) (данные не показаны).
Таким образом, культура эффективно росла на средах, содержавших все изученные полисахариды. Активный гидролиз полисахаридных субстратов в логарифмической фазе роста обеспечивал значительный прирост биомассы с достижением ее максимального уровня к 2 сут культивирования. При этом более высокий уровень биомассы отмечался при выращивании на высокомолекулярных крахмалах (25–26 г/л), однако, в целом, различия максимальных значений не превышали 15%. Последующий рост сопровождался значительным снижением уровня биомассы, коррелировавшим с деструктивными процессами, которые были подтверждены микроскопическими исследованиями. К 10 сут культивирования при отсутствии подпиток содержание биомассы снижалось до сопоставимых уровней (6–8 г/л), при этом отсутствовала корреляция различий количества биомассы, выращенной на средах, содержавших различные полисахариды, и выхода синтезируемого такролимуса. Корреляция между достигаемой биомассой и продукцией вторичных метаболитов описана в работе [27].
Ежесуточное внесение дополнительных порций крахмалов поддерживало содержание биомассы на более высоком уровне, что наиболее отчетливо проявлялось в средах с низкомолекулярными полисахаридами (K2 и MД). Для них же наблюдали максимальный выход такролимуса (380–385 мг/л) при начале внесения дополнительных порций соответствующих полисахаридов (К2 и МД) в стационарной фазе (4 сут культивирования) (рис. 1). В то же время, когда дополнительные порции низкомолекулярных полисахаридов вносили при переходе культуры в фазу замедления роста (со 2 сут культивирования), наблюдалось снижение выхода такролимуса (рис. 2), хотя более раннее внесение подпиток способствовало поддержанию биомассы на более высоком уровне (рис. 6б).
На средах, содержащих высокомолекулярные крахмалы (К1, К3 и К4), достигались более высокие значения биомассы (25–27 мг/л). Однако максимальное увеличение выхода такролимуса (до 500–520 мг/л, с К3 и K4) было достигнуто в начале внесения дополнительных порций крахмалов в фазе замедления роста (с 2 сут культивирования), в то время как при более позднем внесении подпиток эффект был менее значительным.
На основании полученных данных можно заключить, что при использовании высокомолекулярных крахмалов (показатель РВ – менее 1.0 г/л) наиболее целесообразно проведение процесса в режиме периодического культивирования с началом дополнительного дробного внесения добавок крахмалов при переходе культуры в фазу замедления роста (с 2 сут культивирования). Для достижения высокого выхода такролимуса на средах, содержащих низкомолекулярные крахмалы (показатель РВ – более 1.0 г/л), следует осуществлять добавки крахмалов позднее при достижении культурой стационарной фазы, коррелирующей с началом деструктивных процессов (с 4 сут ферментации).
Полученные результаты могут быть использованы при разработке биотехнологии производства такролимуса штаммом S. tsukubaensis ВКМ Ac-2618Д.
Работа проводилась в рамках государственного задания (Фокина В.В., Шутов А.А., Донова М.В.) и при частичной финансовой поддержке Фондом содействия инновациям по программе “УМНИК” 16–12 (договор № 12081ГУ/2017, Пошехонцева В.Ю.).
Список литературы
Barreiro C., Martínez-Castro M. // Appl. Microbiol. Biotechnol. 2014. V. 98. № 2. P. 497–507.
Mo S., Lee S.K., Jin Y.Y., Oh C.H., Suh J.W. // Appl. Microbiol. Biotechnol. 2013. V. 97. № 7. P. 3053–3062.
Singh B.P., Behera B.K. // Lett. Appl. Microbiol. 2009. V. 49. № 2. P. 254–259.
Nielsen J.B., Hsu M-Jo, Byrne K.M., Kaplan L. // J. Biochem. 1991. V. 30. № 23. P. 5789–5796.
Turło J., Gajzlerska W., Klimaszewska M., Krol M., Dawidowski M., Gutkowska B. // Enzyme Microb. Technol. 2012. V. 51. № 6–7. P. 388–395.
SangJoon M., Sung-Kwon L., Ying-Yu J., Joo-Won S. // J. Microbiol. Biotechnol. 2016. V. 26. № 2. P. 233–240.
Turło J.Z., Gutkowska B., Gajzlerska W. // Acta Pol. Pharm. 2006. V. 63. № 5. P. 463–465.
Глаголев В.И., Джавахия В.В., Попова Е.Д., Воинова Т.М. // МНИЖ. 2017. Т. 11. № 65. С. 64-70.
Sánchez S., Chávez A., Forero A., García-Huante Y., Romero A., Sánchez M., Rocha D., Sánchez B., Avalos M., Guzmán-Trampe S., Rodríguez-Sanoja R., Langley E., Ruiz B. // J. Antibiot. (Tokyo). 2010. V. 63. № 8. P. 442–459.
Martinez-Castro M., Salehi-Najafabadi Z., Romero F., Perez-Sanchiz R., Fernandez-Chimeno R.I., Martin J.F., Barreiro C. // Appl. Microbiol. Biotechnol. 2013. V. 97. № 5. P. 2139–2152.
Ordóñez-Robles M., Santos-Beneit F., Albillos S.M., Liras P., Martín J.F., Rodríguez-García A. // Appl. Microbiol. Biotechnol. 2017. V. 101. № 22. P. 8181–8195.
Пaтeнт PФ. 2012. № 2495937.
Патент США. 2008. № 0318289 А1.
Рихтер М., Аугустат З., Ширбаум Ф. Избранные методы исследования крахмала. М.: Пищевая промышленность, 1975. 180 с.
Яковишин Л.А. Избранные главы биоорганической химии. Севастополь: Стрижак-пресс, 2006. 196 с.
Mukerjea R., Robyt J.F. // Carbohydr. Res. 2010. V. 345. № 3. P. 449–451.
Пошехонцева В.Ю., Гулевская С.А., Суходольская Г.В., Фокина В.В. // “Биология – наука XXI века”. Материалы 19-ой межд. школы-конф. молодых ученых. Пущино: Пущинский Научный центр РАН, 2015. С. 39.
El-Fallal A., Dobara M.A., El-Sayed A., Omar N. Starch and Microbial α-Amylases: From Concepts to Biotechnological Applications. in: Carbohydrates – Comprehensive Studies on Glycobiology and Glycotechnology / Ed. Chuan-Fa Chang. Croatia, Rijeka: InTech, 2012. P. 459–488.
Международный патент. 2009. № 061378.
Boldon M., Effront P. // Crit. Rev. Biochem. Mol. Biol. 2000. V. 24. № 4. P. 329–418.
Пошехонцева В.Ю., Гулевская С.А., Донова М.В. // Журнал научного фонда “Биолог”. 2014. № 3. С. 119–122.
Пошехонцева В.Ю., Суходольская Г.В., Гулевская С.А., Фокина В.В., Донова М.В. // Росс. иммунол. журнал. 2015. Т. 9. № 18. С. 746–748.
Arinbasarova A.Y., Machulin A.V., Biryukova E.N., Sorokin V.V., Medentsev A.G., Suzina N.E. // Can. J. M-icrobiol. 2018. V. 64. № 5. P. 359–365.
Закирова А.Ш., Ягофаров Д.Ш., Канарский А.В., Сидоров Ю.Д. // Вестник Казанского технологического университета. 2010. № 9. Р. 621–625.
Gusakov A.V., Kondratyeva E.G., Sinitsyn A.P. // Int. J. Anal. Chem. 2011. V. 2011. 4 pages. https://doi.org/10.1155/ 2011/283658
Дроздов Н.С., Матеранская Н.П. Практикум по биологической химии. М: Высшая школа, 1970. 256 с.
Ellaiah P., Srinivasulu B., Adinarayana K. // Process Biochem. 2004. V. 39. № 5. P. 529–534.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


