Прикладная биохимия и микробиология, 2019, T. 55, № 5, стр. 492-497
Выделение и очистка лактатдегидрогеназы из корней гороха (Pisum sativum L.) при гипоксии и исследование ее регуляторных свойств
А. Т. Епринцев 1, Н. Р. Комарова 1, М. И. Фалалеева 1, А. А. Белоглазова 1, *
1 Воронежский государственный университет
394006 Воронеж, Россия
* E-mail: bc366@bio.vsu.ru
Поступила в редакцию 19.02.2019
После доработки 16.04.2019
Принята к публикации 22.04.2019
Аннотация
В условиях затопления в корнях гороха (Pisum sativum L.) повышалась активность лактатдегидрогеназы. В результате многостадийной очистки, включающей фракционирование сульфатом аммония, ионобменную хроматографию на ДЭАЭ-сефацеле и гель-хроматографию на cефадексе G-200 был получен электрофоретически гомогенный фермент со степенью очистки 43.4, выходом 2.5% и удельной активностью 80.5 Е/мг белка. Молекулярная масса нативной молекулы лактатдегидрогеназы – 138 кДа, молекулярная масса субъединиц, определенная методом электрофореза в ПААГ в присутствии ДДС-Na, – 34 кДа. Фермент представлял собой гомотетрамер. Установлены кинетические и регуляторные свойства фермента, значения констант Михаэлиса, изучено влияние рН и температуры на катализируемые им прямую и обратную реакции. Установлено, что лактатдегидрогеназа ингибировалась АТФ.
Лактатдегидрогеназа (ЛДГ, КФ 1.1.1.27) катализирует реакцию взаимопревращения лактата и пирувата, сопровождаемую изменением НАДН и НАД+. Этот фермент широко распространен в природе, так как пируват занимает ключевое положение в углеводном обмене. Важной функцией ЛДГ является регуляция соотношения количества НАД+ и НАДН, поскольку именно его значение влияет на скорость многих каталитических реакций [1].
В настоящее время достаточно хорошо изучен фермент животных. ЛДГ в органах большинства млекопитающих представлена пятью изоформами [1], каждая из которых является тетрамером и состоит из четырех субъединиц двух типов, мышечной (muscle, М, А) и сердечной (heart, Н, В) локализации. Синтез этих субъединиц контролируется двумя генами — ldh A и ldh B [2]. Эволюционная значимость появления генных локусов ldh-A или ldh-B, которые произошли после дупликации единого предка гена ldh [3, 4], заключалась в необходимости адаптации животных к условиям среды. Так, присутствие гомотетрамера ЛДГ-5 (4A) наблюдалось в тех тканях, которые испытывают дефицит кислорода (то есть функционируют в анаэробных условиях) [5].
У ЛДГ из разных растений методом электрофореза было обнаружено несколько белковых компонентов, обладающих активностью фермента. Это интерпретировали, как присутствие изоферментов, которые представляли собой тетрамеры, образованные двумя различными пептидными последовательностями [6]. В работе [7] было обнаружено присутствие двух субъединиц в гипоксических корнях и проростках риса.
В настоящее время отсутствуют данные о ее физико-химических свойствах, кинетике и регуляции активности ЛДГ большинства растительных организмов. Поскольку ферментативная утилизация лактата в некоторых из них осуществляется в сопряжении с гликолатоксидазой [8], то для изучения этих свойств необходимо получить электрофоретически гомогенный фермент.
Цель работы – выделение и очистка до электрофоретически гомогенного состояния ЛДГ из корней гороха, выращенного в условиях гипоксии, изучение физико-химических и регуляторных свойств фермента.
МЕТОДИКА
Растительный материал. В качестве объекта исследований использовали 20-суточные проростки гороха (Pisum sativum L., сорт Амброзия), выращенные гидропонным методом при 25°С. Проростки были погружены в воду на 2–3 см выше корневой шейки для имитации условий дефицита кислорода. Через 72 ч растения были использованы для исследований [9].
Фермент экстрагировали из гомогенизированных корней растений. Экстракт подвергали гель-фильтрации на колонке (1.5 × 20 см) с сефадексом G-25 (“Pharmacia”, Швеция), а затем ионообменной хроматографии на колонке (1.5 × 15 см) с ДЭАЭ-целлюлозой (“GE Healthcare”, Швеция), уравновешенной 50 мМ трис-HCl-буфером, рН 7.4. Целевой белок после элюции линейным градиентом (0.1–0.35 М) NaCl гель-хроматографировали на колонке (2.0 × 30 см) с сефадексом G-200 (“GE Healthcare”, Швеция) по методике, описанной в работах [10, 11].
Для определения активности фермента измеряли скорость окисления НАДН спектрофотометрически при 340 нм на спектрофотометре (“ЛОМО СФ-56”, Россия). Реакционная среда содержала 2 мл 50 мМ трис-HCl-буфера, рН 7.4, 0.06 мМ НАДН и 1 мМ пирувата натрия. Реакцию запускали добавлением пирувата натрия [12]. Активность ЛДГ в прямой реакции измеряли в 50 мМ трис-HCl-буфере, рН 7.4, содержащем 0.5 мМ НАД+ и 25 мМ лактата натрия. За единицу ферментативной активности принимали количество фермента, которое в течение 1 мин образовывало (прямая реакция) или превращало (обратная реакция) 1 мкмоль НАДН при 25°С.
Молекулярную массу белка определяли методом гель-фильтрации на колонке с сефадексом G-200, для калибровки которого был использован Dextran blue (2000 кДа). Значение молекулярной массы рассчитывали по формуле
Молекулярную массу субъединиц определяли методом электрофореза в 12%-ном ПААГ в присутствии ДДС-Na. В качестве белков-маркеров молекулярной массы использовали набор стандартных белков, включавший β-галактозидазу (116.0), БСА (66.2), овальбумин (45.0), ЛДГ (35.0), REase Bspl98 (25.0), b-лактоглобулин (18.4) и лизоцим (14.4). Белковые компоненты в геле окрашивали нитратом серебра как описано в работе [13].
Электрофорез ЛДГ также проводили в 8%-ном ПААГ по методу Девиса в неденатурирующих условиях [14]. Для окрашивания белковых компонентов в геле применяли нитрат серебра [13], для специфического определения фермента − тетразолиевый метод [15]. Определение белка проводили по методу Лоури.
Влияние рН на скорость ферментативной реакции изучали в 50 мМ трис-HCl-буфере, рН 5.0–10.0 [6].
Кинетические константы (Kм) прямой и обратной реакций, катализируемых ЛДГ из листьев гороха, были определены методом Лайнуивера–Берка. Каталитические константы Kм для субстратов, пирувата и L-лактата, определяли в стандартной реакционной смеси при рН 7.5 и 25°С. Концентрацию субстратов варьировали от 0 до 60.0 мМ, а количество других компонентов поддерживали постоянным [8].
Влияние температуры на скорость ферментативных реакций ЛДГ изучали в диапазоне температур реакционной смеси от 15 до 80°С.
Эксперименты проводили в 4–6 биологических повторностях, аналитические определения – в трех. В таблице и на рисунках приводятся результаты по средним арифметическим из трех определений. Для расчета их достоверности использовали метод вариационной статистики с помощью критерия Стьюдента. Обсуждаются статистически достоверные различия при р ≤ 0.05 [16]. Для построения графиков использовали данные, обработанные с помощью программ линейной и параболической аппроксимации.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
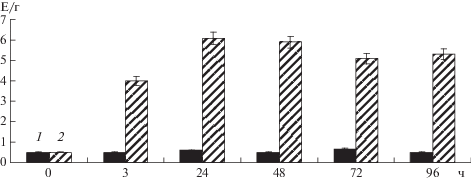
Повышение лактатдегидрогеназной активности в корнях гороха, инкубированых в условиях гипоксии, отмечалось уже через 3 ч от начала эксперимента. Через 2 сут была установлена максимальная активность, которая сохранялась на протяжении 4 сут (рис. 1). Уровень активности фермента увеличивался в 11–12 раз по сравнению с контрольными растениями. Можно предположить, что это обусловлено адаптацией метаболизма клеток тканей корня к гипоксии. Ранее подобный эффект был обнаружен у растений сорго [7, 17] и в листьях гороха [18].
Рис. 1.
Динамика активности ЛДГ в корнях гороха в контрольной (1) и экспериментальной (2) группах растений.
Корни гороха, инкубированные в условиях дефицита кислорода в течение 3 сут, были использованы для получения ЛДГ в высокоочищенном состоянии. Результаты очистки ЛДГ из корней гороха приведены в табл. 1.
Таблица 1.
Этапы очистки лактатдегидрогеназы из корней гороха, выросших в условиях гипоксии
| Стадии очистки | Общий объем, мл | Общая активность, Е | Белок, мг | Удельная активность, Е/мг | Степень очистки | Выход, % |
|---|---|---|---|---|---|---|
| Супернатант | 35 | 304.5 ± 9.135 | 164.2 ± 4.92 | 1.9 ± 0.05 | 1.0 | 100 |
| Фракционирование сульфатом аммония (60–80%) | 6 | 91.35 ± 2.74 | 20.2 ± 0.6 | 4.5 ± 0.13 | 2.5 | 30 |
| Гель-фильтрация через сефадекс G-25 | 2 | 60.9 ± 1.8 | 7.3 ± 0.21 | 8.4 ±0.25 | 4.6 | 20 |
| Ионообменная хроматография на ДЭАЭ-целлюлозе | 1 | 8.41 ± 0.25 | 0.3 ± 0.009 | 26.1 ± 0.78 | 14.1 | 2.8 |
| Гель-хроматография на сефадексе G-200 | 0.5 | 7.51 ± 0.23 | 0.09 ± 0.003 | 80.53 ± 2.42 | 43.4 | 2.5 |
Полученный методом многостадийной очистки фермент с выходом 2.5% был электрофоретически гомогенен и обладал высокой удельной активностью (80.53 Е/мг белка). При ионообменной хроматографии на ДЭАЭ-целлюлозе максимальное количество лактатдегидрогеназной активности было десорбировано с сорбента элюцией NaCl (120–150 мМ). При электрофорезе в ПААГ в неденатурирующих условиях был обнаружен один белковый компонент с Rf – 0.41, который окрашивался нитратом серебра (рис. 2). Этот компонент взаимодействовал с тетразолиевым синим, с помощью которого идентифицируют специфическую активность ЛДГ (рис. 2). Результаты показали, что полученный препарат ЛДГ был электрофоретически гомогенен и обладал лактатдегидрогеназной активностью. Ранее выделенная и очищенная до электрофоретически гомогенного состояния ЛДГ из листьев гороха имела более высокие показатели степени очистки и выхода, а также большее значение молекулярной массы [18].
Рис. 2.
Электрофорез в ПААГ очищенной лактатдегидрогеназы при pH 7.5. Окраска нитратом серебра (1) и специфическим тетразолиевым синим (2); F – фронт (бромфеноловый синий).
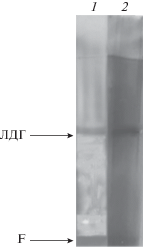
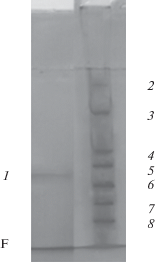
Анализ полученных значений молекулярных масс нативной ЛДГ из корней гороха, определенных методом гель-хроматографии на сефадексе G‑200, а также проведение электрофореза в ПААГ с ДДС-Na (рис. 3) позволили предположить, что молекула фермента имела четвертичную структуру. На основании значения молекулярной массы нативной молекулы 138 кДа и молекулярной массы субъединицы, равной 34 кДа, можно заключить, что молекула ЛДГ из корней гороха аналогично молекуле из листьев гороха представляла собой гомотетрамер [18].
Рис. 3.
Электрофорез в ПААГ в присутствии ДДС-Na очищенной лактадегидрогеназы (1). Белки-маркеры молекулярной массы (кДа): 2 – b-галактозидаза (116.0); 3 – БСА (66.2); 4 – овальбумин (45.0); 5 – ЛДГ (35.0); 6 – REase Bspl98 (25.0); 7 – b-лактоглобулин (18.4); 8 – лизоцим (14.4).
Определение каталитических характеристик очищенной ЛДГ показало, что значение константы Михаэлиса по пирувату составило 35 мкМ, что свидетельствовало о менее высоком сродстве к субстрату (рис. 4) по сравнению с ЛДГ из листьев гороха [18]. Высокое сродство ЛДГ к пирувату может обеспечить быстрое окисление гликолитического НАДН [19].
Рис. 4.
Определение значений Км ЛДГ из корней гороха, подверженных кислородному голоданию на протяжении 72 ч: 1 – пируват, 2 – НАДН, 3 – лактат, 4 – НАД+.
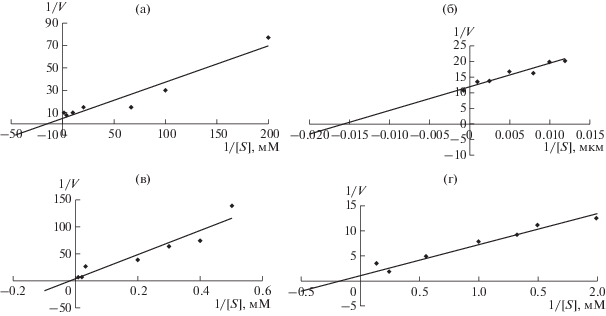
Показано, что величина Kм ЛДГ-5 из мышц грудной клетки бентической изоподы (Saduria entomon) при использовании в качестве субстрата пирувата составляла 180 мкМ [20], а фермента, экстрагированного из скелетных мышц ящерицы (Agama stellio) – 20 мкМ [21]. Величина Kм по НАДН для ЛДГ из корней гороха составила 63 мкМ (рис. 4), что свидетельствовало о ее достаточно высоком сродстве к данному коферменту. Значение константы для фермента колебалось от 15.6 до 40 мкМ для ЛДГ-5 из мозга свиньи и мышц ящерицы соответственно [21, 22].
Определение кинетических параметров для субстратов обратной реакции выделенной ЛДГ показало значения величин Kм значительно более высокие по сравнению с ферментом из листьев гороха [18]. Так, значение Kм ЛДГ, экстрагированной из корней, по лактату составило 33 мМ, а по НАД – 5.1 мМ (рис. 4). Аналогичные результаты изменения сродства ЛДГ к субстратам обратной реакции были получены и для ферментов из других источников. Так, значения Kм по лактату для ЛДГ из печени варана и бентической изоподы составили 12.4 мМ [23] и 90.04 мМ [20] соответственно, а для НАД+ – от 20 мкМ для фермента из мышц ящерицы до 3.2 мМ – печени крыс [21, 24].
Важно отметить, что особенностью 4А типа изоформы ЛДГ является ее ингибирование АТФ. В работе [25] было показано ингибирование ЛДГ-5 из проростков сои 30 мкМ АТФ. Активность ЛДГ из корней гороха частично ингибировалась при внесении 30–60 мкМ АТФ, полностью – при добавлении 240 мкМ АТФ. Полученные данные могли свидетельствовать о принадлежности изучаемого фермента к гомотетрамеру, состоящему из субъединиц А-типа.
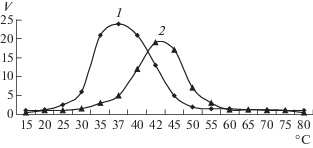
Влияние температуры на активность выделенной ЛДГ было изучено в интервале от 15 до 70°C. Температурный оптимум действия фермента в прямой реакции составил 37°С, а обратной – 42°С (рис. 5). Полученные данные коррелировали с температурными оптимумами ЛДГ из разных организмов, которые, как правило, находятся в пределах 30–60°С [9, 21]. Было также установлено, что диапазон рабочих температур ЛДГ-5 ниже, чем у ЛДГ-1 [22].
Рис. 5.
Влияние температуры на скорость реакции, катализируемой ЛДГ из корней гороха, при восстановлении пирувата (1) и при окислении лактата (2).
Результаты, полученные при изучении влияния концентрации ионов водорода на активность выделенной ЛДГ, показали, что оптимальное значение рН для протекания прямой реакции – 7.2 и для обратной – 8.3 (рис. 6). По данным, опубликованным в работах [23, 25], значения рН 7.5 и 9.5 являются оптимальными для прямой и обратной реакций, катализируемых ЛДГ-5 из печени варана, а уровни pH, соответствующие значениям 6.8 и 9.5, оптимальны для функционирования фермента, выделенного из проростков сои.
Рис. 6.
Зависимость скорости реакции от pH среды для ЛДГ из корней гороха при восстановлении пирувата (1) и при окислении лактата (2).

Показано, что очищенная ЛДГ полностью сохраняла стабильность при хранении в течение 6 мес. при –74°С, а также при –20°С при добавлении смеси 5 мМ ЭДТА и 5 мМ MgCl2.
Таким образом, из корней растений гороха, инкубированных в гипоксических условиях, была выделена и очищена до электрофоретически гомогенного состояния ЛДГ. Изучение физико-химических и регуляторных характеристик фермента показало их отличие от других ферментов. В частности для ЛДГ из корней гороха было характерно более высокое сродство к пирувату, по сравнению с лактатом, что обуславливало ее участие в реокислении гликолитического НАДН. Об участии этой ферментативной системы в адаптивной реакции клеточного метаболизма корня может косвенно свидетельствовать тот факт, что для катализа восстановления пирувата оптимальное значение рН равно 7.2, а для окисления лактата – 8.3 [23, 25]. Анализ эффективности ингибирования активности фермента АТФ позволил отнести очищенную ЛДГ к A-типу этих ферментов [25]. Полученные данные открывают перспективы для изучения роли ЛДГ (совместно с ЛДГ, экстрагированной из листьев гороха) в развитии адаптивных реакций клеточного метаболизма к условиям гипоксии, возникающим в корне при затоплении [17].
Работа выполнена при финансовой поддержке государственного задания Министерства науки и высшего образования РФ (проект № 6.6927.2017/8.9).
Список литературы
Райдер К., Тейлор К. Изоферменты. М.: Мир, 1983. 197 с.
Rossignol F., Solares M., Balanza E., Coudert J., Clottes E. // J. Cell Biochem. Physiology. 2003. V. 89. № 1. P. 67–79.
Корочкин Л.И., Серов О.Л., Пудовкин А.И., Аронштам А.А., Боркин Л.Я., Малецкий С.И., Полякова Я.В., Манченко Г.П. Генетика изоферментов. М.: Наука, 1977. 275 с.
Tsuji S., Qureshi M.A., Hou E.W., Fitch W.M., Li S.S. // Proc. Natl. Acad. Sci. U. S. A. 1994. V. 91. № 20. P. 9392–9396.
Унжаков А.Р., Илюха В.А., Мацук Н.В., Белкин В.В. // Труды КарНЦ РАН. 2007. № 11. С. 118–126.
Mulcahy P., O’Carra P. // Phytochemistry. 1997. V. 45. № 5. P. 889−896.
Jain V., Singla N.K., Jain S., Gupta K. // Physiol. Mol. Biol. Plants. 2010. V. 16. № 3. P. 241–247.
Engqvist M.K.M., Schmitz J., Gertzmann A., Florian A., Jaspert N., Arif M., Balazadeh S., Mueller-Roeber B., Fernie A.R., Maurino V.G. // Plant Physiol. 2015. V. 169. № 2. P. 1042–1061.
Rivoal J., Richard B., Pradet A. // Plant Physiol. 1991. V. 95. № 3. P. 682−686.
Hoffman N.E., Hanson A.D. // Plant Physiol. 1986. V. 82. № 3. P. 664–670.
Eprintsev A.T., Fedorin D.N., Nikitina M.V., Igamberdiev A.U. // Plant Physiol. 2015. V. 181. P. 14–19. (http://dx.doi.org/)https://doi.org/10.1016/j.jplph.2015.03.012
Setsuko K., Takahiro M., Hiroshi Y. // PLos One. 2013. V. 8. № 6. URL: https://www.ncbi.nlm.nih.gov/pmc/ articles/PMC3683008 (дата обращения 15.10.2018)
Shevchenko A., Wilm M., Vorm O. // Anal. Chem. 1996. V. 68. № 5. P. 850–858.
Davis B.J., Ornstein L. // Ann. N.Y. Acad. Sci. 1964. V. 121. № 2. P. 404–427.
Fieldes M.A. // Electrophoresis. 1992. V. 13. № 1–2. P. 82–86.
Лакин Г.Ф. Биометрия. М.: Высш. шк., 1990. 352 с.
Narsai R., Whelan J. // Front Plant Sci. 2013. V. 4. P. 349–363. doi 10.3389 / fpls.2013.00349
Епринцев А.Т., Комарова Н.Р., Фалалеева М.И. // Прикл. биохимия и микробиология. 2019. Т. 55. № 2. С. 159–164.
Zheng Y., Si X., He Q., Jin S., Hong J. // Essays Biochem. 2008. 2015. V. 59. P. 1−41. https://doi.org/10.1042/bse0590001
Mulkiewicz E., Zietara M.S., Stachowiak K., Skorkowski E.F. // Comp. Biochem. Physiol. B Biochem. Mol. Biol. 2000. V. 126. № 3. P. 337–346.
С. Аль-Джасаби // Биохимия. 2002. Т. 67. № 7. С. 786–789.
Goto T., Sugawara K., Nakamura S., Kidokoro S., Wakui H., Nunomura W. // Biochem. Biophys. Res. Commun. 2016. V. 479. № 4. P. 860–867.
Massod J.H., Syed M.I.A., Abida N.H., Asifa A., Ishaq M. // Exp. Mol. Med. 1997. V. 29. № 1. P. 25–30.
Fregoso-Peñuñuri A.A., Valenzuela-Soto E.M., Figueroa-Soto C.G., Peregrino-Uriarte A.B., Ochoa-Valdéz M., Leyva-Carrillo L., Yepiz-Plascencia G // Protein. Expr. Purif. 2017. V. 137. P. 20–25. https://www.ncbi.nlm.nih.gov/pubmed/28625911
Tihanyi K., Fontanell A., Talbot B., Thiron J.P. // Arch. Biochem. Biophys. 1989. V. 274. № 2. P. 626–632.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


