Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 264-270
Биосинтез протоиллуденовых сесквитерпеновых арильных эфиров сибирскими штаммами грибов рода Аrmillaria
В. П. Желифонова 1, Т. В. Антипова 1, Е. А. Литвинова 2, 3, Б. П. Баскунов 1, Ю. А. Литовка 2, 3, И. Н. Павлов 2, А. Г. Козловский 1, *
1 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Пущино, Россия
2 Институт леса им. В.Н. Сукачёва СО РАН
660036 Красноярск, Россия
3 Сибирский государственный университет науки и технологий им. М.Ф. Решетнева
660049 Красноярск, Россия
* E-mail: kozlovski@ibpm.pushchino.ru
Поступила в редакцию 29.09.2018
После доработки 19.11.2018
Принята к публикации 18.12.2018
Аннотация
Изучен состав вторичных метаболитов у базидиальных грибов Armillaria borealis Marxm. и Korhonen, A. cepistipes Velen., A. gallica Marxm., A. ostoyae (Romagn.) Herink и A. sinapina Bérubé и Dessur, выделенных на территории Южной Сибири (Красноярский край и Республика Тыва) и Дальнего Востока (Сихотэ-Алинь). У видов A. borealis, A. cepistipes и A. sinapina идентифицированы метаболиты, относящиеся к классу протоиллуденовых сесквитерпеновых арильных эфиров к группе меллеолидов. У штаммов отмечены различия спектров синтезируемых меллеолидов. A. borealis штамм 74г синтезировал более широкий спектр меллеолидов по сравнению с другими представителями этого вида: меллеолиды В, C, D и H, мелледоналы В и С, 5'-О-метилмелледонал, 13-гидрокси-5'-О-метилмелледонал и армилларинин. Состав среды влиял на количество синтезированных метаболитов. Все изученные штаммы, синтезирующие меллеолиды, проявляли токсикогенное и фитопатогенное действие по отношению к семенам и сеянцам Picea abies (L.) H. Karst. и Abies sibirica Ledeb, ингибируя энергию прорастания, лабораторную и грунтовую всхожесть, а также развитие корневой системы сеянцев хвойных. Максимальную ингибирующую активность проявляла культуральная жидкость A. borealis 74г, отличающаяся наибольшим количеством и разнообразием меллеолидов в профиле метаболома.
Комплекс грибов Armillaria mellea sensu lato объединяет свыше 40 видов, существенно различающихся по фитопатогенным свойствам. Высоко агрессивные корневые патогены (A. solidipes Peck, A. mellea (Vahl) P. Kumm. и A. sinapina) поражают широкий круг растений-хозяев, включая древесные насаждения (Abies, Picea, Pinus и Pseudotsuga) и агрономические посевы, нанося значительный экономический ущерб. Куртинное усыхание деревьев при воздействии Armillaria протекает стремительно и, как правило, без предварительного ослабления древостоя. Вирулентность грибов этого рода связывают с наличием у них мощных ферментных систем, активно разлагающих биополимеры древесины. Обсуждается также роль в патогенезе протоиллуденовых сесквитерпеновых арильных эфиров, продуцируемых Armillaria [1].
В настоящее время известно около 60 структур протоиллуденовых сесквитерпеновых арильных эфиров, которые различаются положением двойных связей и функциональных групп в молекулах [2]. Следует отметить, что у одного изолята гриба, как правило, присутствует не более 10 соединений, а их состав у представителей одного вида различается. Однако единичны работы по изучению видовой принадлежности изолятов, географического места их выделения, спектра метаболитов и биологической активности [3].
Известно, что некоторые виды (A. gallica, A. mellea и A. ostoyae) широко распространены в лесных древостоях Северного полушария. Ареал A. borealis ограничен преимущественно Центральной Европой и Китаем, в то время, как вид A. sinapina встречается повсеместно за исключением Центральной Европы [1]. Данные о видах Armillaria, выделенных в Сибири и на Дальнем Востоке, до настоящего времени широко не обсуждались в зарубежной литературе, вследствие отсутствия их генетической верификации.
На территории Южной Сибири (Красноярский край и Республика Тыва) и части Дальнего Востока (Сихотэ-Алинь) комплекс Armillaria mellea sensu lato представлен несколькими видами (A. borealis, A. calvescens, A. cepistipes, A. gallica, A. ostoyae и A. sinapina). Абсолютное доминирование вида A. borealis выявлено в лесах Красноярского края на площади, ограниченной с севера 58° с.ш., с юга – 52° с.ш. [4, 5]. Сведения об образовании протоиллуденовых сесквитерпеновых арильных эфиров сибирскими штаммами Armillaria отсутствуют.
Цель работы – изучение вторичных метаболитов, токсикогенности и фитопатогенности у 11 штаммов Armillaria, включающих виды A. borealis, A. cepistipes, A. gallica, A. ostoyae и A. sinapina, выделенные на территории Южной Сибири и Дальнего Востока в 2009–2016 гг.
МЕТОДИКА
Штаммы грибов и условия выращивания. Объектами исследования служили сибирские штаммы грибов рода Armillaria из коллекции чистых культур лаборатории лесных культур, микологии и фитопатологии Института леса им. В.Н. Сукачёва СО РАН (Россия), включающие − А. borealis Marxm и Korhonen 206г, 74г, 111 и D48/14, A. cepistipes Velen. 27D и 73/8, A. gallica Marxm. 6D и 22/12, A. ostoyae (Romagn.) Herink 26D и A. sinapina Bérubé и Dessur S3-16 и A2-16. Штаммы были изолированы из плодовых тел и базидиоспор Armillaria, а также из пораженной древесины, и выращены на селективных питательных средах методами, описанными в работах [6–8].
Видовая идентификация была установлена в результате скрещивания моноспоровых культур с тестерами европейских и китайских видов, а также подтверждена секвенированием участков генетических маркеров ITS и TEF-lalpha с использованием оборудования ЦКП “Инновационные технологии защиты растений” Всероссийского научно-исследовательского института защиты растений (Санкт-Петербург-Пушкин, Россия) и ЦКП “Геномика” Института химической биологии и фундаментальной медицины СО РАН (Новосибирск, Россия).
При изучении продукции вторичных метаболитов штаммы культивировали глубинно в колбах (750 мл) со 100 мл среды на шейкере (220 об/мин) в течение 21 сут при 24°С. При скрининге использовали синтетическую среду Норкранс (НРК), содержащую (г/л дистиллированной воды): глюкоза – 10.0, аммоний виннокислый – 1.0, K2HPO4 – 1.0, MgSO4 ⋅ 7 H2O – 0.5, железо лимоннокислое – 0.005, ZnSO4 ⋅ 7 H2O – 0.004, CaCl2 – 0.056, тиамин – 0.04, рН 6.5 [9]. Для сравнения биосинтетической способности штаммов использовали органно-минеральную среду (2), содержащую (г/л дистиллированной воды): глюкозу – 10.0, пептон – 5.0, KH2PO4 – 0.3, MgSO4 ⋅ 7 H2O – 1.0), рН 5.6 [10], и глюкозо-картофельную среду (3). Среды засевали суспензией мицелия, снятого с 14-суточных культур, выращенных на скошенном МА.
Выделение, идентификация и количественное определение вторичных метаболитов. Вторичные метаболиты извлекали из фильтрата культуральной жидкости трехкратной экстракцией хлороформом при рН 3.0. Экстракты анализировали методом ТСХ на пластинках силикагеля Silica gel F254 (“Merck”, Германия) в системах хлороформ-метанол-25%-ный аммиак (90 : 10 : 0.1) и хлороформ-ацетон (93 : 7). Метаболиты обнаруживали по поглощению и флуоресценции при 254 и 366 нм и после опрыскивания пластин 10%-ным раствором фосфорномолибденовой кислоты в этаноле и 5%-ным раствором FeCl3 ⋅ 6 Н2О в метаноле. Метаболиты выделяли с помощью препаративной ТСХ на пластинках силикагеля Silica gel F254 (“Merck”, Германия) в системах растворителей. Идентификацию выделенных метаболитов осуществляли на основе сравнения данных УФ-спектроскопии и масс-спектрометрии с литературными источниками [11] и базами данных (http:// www.hmdb.ca/metabolites). Подробную информацию о структуре соединений получали при анализе МС/МС спектров при энергии коллизии 20–40%.
УФ-спектры соединений в метаноле получали на спектрофотометре UV-160А (“Shimadzu”, Япония). Масс-спектры соединений регистрировали на квадрупольном масс-спектрометре LCQ Advantage MAX (“Thermo Finnigan”, Германия), используя одноканальный шприцевой насос для прямого ввода образца в камеру для химической ионизации при атмосферном давлении.
Анализ суммарного содержания меллеолидов в экстрактах определяли полуколичественно с помощью ТСХ и спектрофотометрически в метаноле при 303 нм. Расчет проводили, используя коэффициент молярной экстинкции меллеолида С (ε = 6300) [11].
Определение фитотоксической и фитопатогенной активности. Фитотоксическую активность штаммов изучали стандартными методами [7], используя в качестве биотестов семена и проростки Picea abies и Abies sibirica. Фильтрат культуральной жидкости получали из 21-сут культур на среде НРК путем асептической фильтрации жидкости через мембранные фильтры с размерами пор 0.45 мкм (Владипор МФАС-ОС-2, Россия).
Фитопатогенность Armillaria оценивали на двух тест-объектах. При проведении 1 теста семена Picea abies проращивали на стерильной ватно-марлевой подложке, размещенной на слое частично прогруженной в среду НРК стерильной (контроль) щепы и щепы, предварительно инокулированной грибами Armillaria. Тест продолжался в течение 24 сут при 25°С и 12 ч фотопериоде. Для 2 теста семена Abies sibirica высевали в контейнеры на поверхность стерильного песка, размещенного над стерильной (контроль) и инокулированной Armillaria щепой. Растения инкубировали в течение 3 мес. при 25°С и 12 ч фотопериоде. Оценивали следующие основные показатели: энергию прорастания семян (%), лабораторную и грунтовую всхожесть семян (%), послевсходовую гибель сеянцев (%) и морфометрические показатели растений.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
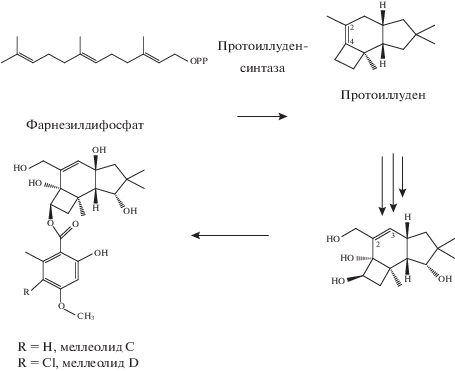
Скрининг вторичных метаболитов у штаммов Armillaria проводили на среде НРК, которая обычно применяется для выращивания базидиомицетов [9]. Он показал, что грибы видов A. borealis, A. cepistipes и A. sinapina синтезировали вторичные метаболиты, которые различались по хроматографической подвижности, поглощали УФ-свет и реагировали с 5%-ным раствором FeCl3 в метаноле и 10%-ным раствором фосфорномолибденовой кислоты в этаноле. УФ-спектры выделенных соединений содержали максимальное значение полос поглощения при 216, 263 и 302–304 нм, что указывало на наличие общего структурного ядра в молекулах в виде гидроксилированного ароматического кольца. Все штаммы синтезировали метаболит 1, который образовывал молекулярный ион 447 [M-H]–. В его МС/МС спектре наблюдали фрагментарный ион, который создавался при расщеплении сложной эфирной связи, что свидетельствовало о наличии 2-гидрокси-4-метокси-6-метилбензоата с m/z 181 [C9H9O4]. У всех штаммов был обнаружен также метаболит 2, с молекулярным ионом 481 [M-H]–, который содержал атом хлора с изотопным распределением интенсивностей 3 : 1. В МС/МС спектре метаболита 2 наблюдали фрагментный ион m/z 215, также содержащий атом хлора. Этот фрагмент соответствовал 3-хлоро-6-гидрокси-4-метокси-2-метилбензоату. На основе литературных данных эти метаболиты были идентифицированы как меллеолид С и его хлорпроизводное меллеолид D (рис. 1) [11].
Другие штаммы, кроме A. borealis 111 и A. sinapina A2/16 синтезировали метаболиты 3 и 4 с молекулярными массами 432 и 466 Да, которые также давали фрагментарные ионы m/z 181 и m/z 215 соответственно. На основе базы данных эти метаболиты были идентифицированы как меллеолид В и его хлорпроизводное мелледонал В. У трех штаммов A. borealis 74г, 206г и D48/14 были обнаружены метаболиты 5 и 6 с массами 446 и 480 Да, идентифицированные как 5'-О-метилмелледонал и его хлорпроизводное мелледонал С (табл. 1). Штамм 74г синтезировал также метаболиты 7, 8 и 9 с молекулярными массами 430, 462 и 464 Да, которые соответствовали меллеолиду Н, 13-гидрокси-5'-О-метилмелледоналу и армилларинину (табл. 1). Следует отметить, что штамм 74г являлся наиболее активным продуцентом меллеолидов. У видов A. gallica и A. ostoyae не были обнаружены соединения, идентифицированные у других видов.
Таблица 1.
Масс-спектрометрические характеристики выделенных метаболитов
| № | Тривиальные названия структур метаболитов | Энергия коллизии/молекулярный ион и характеристические пики в МС/МС спектрах (% интенсивности) [M-H]– |
|---|---|---|
| 1 | Меллеолид В | 23/431(99), 181(100), 137(5) |
| 2 | Мелледонал В | 23/465(100), 215(55) |
| 3 | Меллеолид С | 23/447(70), 181(100), 137(8) |
| 4 | Меллеолид D | 22/481(100), 215(67), 171(12) |
| 5 | Мелледонал С | 23/479(100), 281(17), 215(94), 171 (5) |
| 6 | 5'-О-метилмелледонал | 22/445(100), 281(40), 181(62), 137(6) |
| 7 | Меллеолид Н (= армилларигин) | 22/429(100), 181(75) |
| 8 | 13-гидрокси-5'-О-метилмелледонал | 23/461(84), 181(100), 137(5) |
| 9 | Армилларинин | 22/463(100), 215(25) |
По структуре метаболиты, идентифицированные у видов A. borealis, A. cepistipes и A. sinapina, относились к группе трициклических сесквитерпеновых арильных эфиров − меллеолидов. Их отличительной особенностью являлось наличие протоилуденнового ядра, связанного эфирной связью с замещенным ароматическим кольцом орселиновой кислоты. Биосинтез прототоиллудена начинался с циклизации универсального предшественника сесквитерпеноидов – фарнезилдифосфата (рис. 1). Эта реакция катализируется протоиллуденсинтазой Pro 1 [12]. Продукт реакции 6-протоиллуден имел двойную связь между Δ2,3 атомами углерода. Далее протоиллуден с помощью цитохром Р450-зависимой монооксигеназы изомеризовался в продукт с двойной связью между Δ2,4 атомами углерода. В образовании орселиновой кислоты принимает участие синтаза орселиновой кислоты ArmB [13]. Известно, что у многих микроорганизмов в качестве вторичных метаболитов синтезируются орселиновая кислота и ее производные, а протоиллуданы встречаются у гомобазидиомицетов. Уникальная способность связывать эти два строительных блока посредством этерификации была обнаружена только у грибов рода Armillaria [14].
Комбинация таких биосинтетических процессов, как гидроксилирование в различных положениях сесквитерпена, окисление первичного спирта при С-1 до альдегида или карбоксильной группы, сдвиг или восстановление двойной связи циклогексена, образование метилового эфира при O-5' и хлорирование при С-6' приводит к образованию около 60 различающихся структурных вариантов молекул [2, 3].
Было обнаружено, что у всех сибирских штаммов видов A. borealis, A. cepistipes и A. sinapina преобладали меллеолид С и его хлорпроизводное меллеолид D, а остальные соединения присутствовали в незначительных количествах. Это совпадало с данными, полученными при изучении спектров меллеолидов у видов A. cepistipes, A. gallica, A. mellea и A. ostoyae, выделенных в Северной Америке и Западной Европе [3].
У сибирских изолятов были обнаружены штаммовые различия в спектре меллеолидов (табл. 2). Так, у трех из четырех изученных штаммов A. borealis спектр меллеолидов различался. Наиболее разнообразные по структуре соединения обнаружены у штамма A. borealis 74г. Отсутствие меллеолидов у изученных штаммов A. gallica и A. ostoyae, вероятно, связанно с трудностями их идентификации вследствие низкого уровня накопления в среде. Известно, что грибы этих видов синтезируют меллеолиды, но североамериканские штаммы A. ostoyae отличаются их низкой продукцией [3].
Таблица 2.
Вторичные метаболиты сибирских штаммов рода Armillaria
| Вид | Штамм | Идентифицированные вторичные метаболиты |
|---|---|---|
| A. borealis | 74г | Меллеолиды В, C, D, H, мелледоналы В и С, 5'-О-метилмелледонал, 13-гидрокси-5'-О-метилмелледонал, армилларинин |
| 111 | Меллеолиды С и D | |
| 206г | Меллеолиды В, С, D, мелледоналы В и С, 5'-О-метилмелледонал | |
| D48/14 | Меллеолиды В, С, D, мелледоналы В и С, 5'-О-метилмелледонал | |
| A. cepistipes | 27D, 73/8 | Меллеолиды В, С, D, мелледонал В |
| A. sinapina | S3-16 | Меллеолиды В, С, D, мелледонал В |
| A2/16 | Меллеолиды С и D |
Изучение биосинтеза меллеолидов штаммами A. borealis 74г и D48/14 при росте на трех питательных средах показало, что состав среды влиял на количество синтезированных метаболитов. Их концентрация на органоминеральной среде 2 оказалась выше в 2 раза по сравнению с другими изученными средами (рис. 2). Можно предположить, что входящий в состав этой среды пептон способствовал активному функционированию биосинтетического пути, ведущего к образованию сесквитерпеновых арильных эфиров. Однако штаммы различались по биосинтетической активности и независимо от состава среды. Так, A. borealis 74г был более активным продуцентом меллеолидов, чем A. borealis D48/14 (рис. 2).
Рис. 2.
Продукция меллеолидов (мг/л) A. borealis штаммов 74г и D48/14 при росте на средах НРК, 2 и 3.
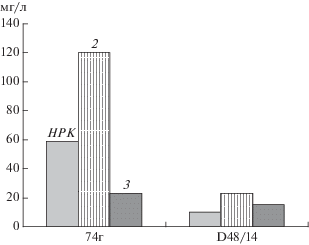
При изучении влияния состава питательной среды на биосинтез меллеолидов A. borealis 74г и D48/14 было обнаружено, что спектр синтезированных метаболитов не изменялся, но содержал разное соотношение меллеолидов. Если на среде НРК у штаммов основными метаболитами были меллеолиды С и D, то у A. borealis 74г на органоминеральной среде 2 преобладал мелледонал В, а на среде 3 − меллеолид С. У штамма A. borealis D48/14 на средах 2 и 3 доминировали 5'-О-метилмелледонал и меллеолид D соответственно. Таким образом, состав среды оказывал и регуляторное влияние на синтез меллеолидов.
Изучение фитотоксичности метаболитов Armillaria показало, что все изученные меллеолид-синтезирующие штаммы A. borealis, A. cepistipes и A. sinapina проявляли токсикогенное действие по отношению к семенам и проросткам P. abies с различной степенью интенсивности (табл. 3). На фоне незначительного снижения лабораторной всхожести (в среднем в 1.2 раза по сравнению с контролем) наблюдали пролонгированное действие биологически активных соединений по отношению к корневой системе. Так, длина главного корня оказалась меньше в 1.2–2 раза по сравнению с контролем, а масса сухого проростка – в 1.2–1.6 раз. Начиная с 12–14-х сут вегетации, активно протекали некротические процессы более чем у 30% тестируемых растений, приводящие к отмиранию корневой системы. Максимальной фитотоксичностью культуральной жидкости характеризовался штамм A. borealis 74г. Фитотоксическая активность практически отсутствовала у штаммов видов A. gallica и A. ostoyae, не синтезирующих меллеолиды в идентифицируемых количествах.
Таблица 3.
Фитотоксичные и фитопатогенные свойства сибирских штаммов рода Armillaria
| Вид | Штамм | Семена Picea abies, обработанные культуральным фильтратом Armillaria |
Семена и сеянцы
Picea abies на щепе, инокулированной Armillaria |
Сеянцы Abies sibirica
на песке с щепой, инокулированной Armillaria |
||||
|---|---|---|---|---|---|---|---|---|
| лабораторная всхожесть, % | длина главного корня, мм | масса сухого проростка, мг | энергия прорастания, % | лабораторная всхожесть, % | грунтовая всхожесть семян, % | погибшие сеянцы, % от общего количества | ||
| A. borealis | 206г | 71.1 | 16.1 | 1.5 | 41.8 | 55.7 | 16.2 | 48.3 |
| 74г | 67.1 | 9.1 | 1.1 | 61.3 | 71.5 | 19.2 | 56.1 | |
| 111 | 71.3 | 15.1 | 1.4 | 66.1 | 71.1 | 22.4 | 47.6 | |
| D48/14 | 73.3 | 14.7 | 1.4 | 69.2 | 79.3 | 18.6 | 35.2 | |
| A. cepistipes | 27D | 72.5 | 15.7 | 1.6 | 56.3 | 77.7 | 23.4 | 39.7 |
| 73/8 | 71.2 | 11.4 | 1.3 | 42.3 | 57.4 | 15.9 | 43.1 | |
| A. gallica | 6D | 77.1 | 18.1 | 1.8 | 71.3 | 91.2 | 23.7 | 43.2 |
| 22/12 | 79.1 | 20.2 | 2.0 | 64.5 | 89.1 | 26.1 | 47.2 | |
| A. ostoyae | 26D | 78.1 | 19.4 | 2.0 | 67.7 | 87.5 | 22.6 | 32.4 |
| A. sinapina | S3-16 | 72.4 | 15.1 | 1.6 | 62.4 | 72.3 | 19.8 | 39.8 |
| A2-16 | 71.3 | 15.7 | 1.5 | 64.1 | 74.2 | 21.6 | 46.6 | |
| Контроль | – | 82.1 | 19.8 | 1.9 | 70.8 | 93.5 | 24.9 | 20.3 |
Следует отметить, что фитотоксическое действие Armillaria связывают с присутствием протоиллуденового ядра в структуре меллеолидов [1, 14]. Так, на листьях салата была показана фитотоксичность многих меллеолидов [14] и, в том числе, меллеолида D, 5'-О-метилмелледонала и армилларинина, идентифицированных и у сибирских штаммов.
Изучение фитопатогенности живых культур A-rmillaria на проростках и сеянцах хвойных позволило установить, что некоторые меллеолид-синтезирующие штаммы обладали более выраженными фитопатогенными свойствами (табл. 3). Так, наблюдали максимальное снижение энергии прорастания и лабораторной всхожести семян P. abies в 1.7 раза, а также грунтовой всхожести семян A. sibirica в 1.5 раза под действием штаммов A. borealis 206г и A. cepistipes 73/8.
Послевсходовая гибель сеянцев пихты A. sibirica под влиянием всех изученных культур Armillaria варьировала в пределах 32.4–56.1%, что в 1.6–2.8 раз превышало естественную смертность в контроле. Высокий летальный уровень более взрослых растений, по-видимому, был обусловлен не только биосинтезом меллеолидов, но и другими факторами патогенности, поскольку высокую гибель сеянцев (до 47%) наблюдали и в присутствии штаммов, не образующих метаболиты этой группы.
Меллеолиды проявляют цитотоксичность по отношению к различным клеточным линиям рака человека, ингибируя синтез ДНК [15–17], при этом цитостатическое действие не зависит от положения двойной связи в протоиллуденовом кольце. Отмечено снижение цитотоксичности меллеолидов при увеличении гидрофобности молекул, при этом чем меньше в молекуле гидроксильных групп, тем выше цитотоксичность соединения [18].
Некоторые меллеолиды оказывают антифунгальное действие на микоризные базидиомицеты, вызывающие корневые гнили деревьев (Fomitopsis pinicola, Omphalotus illudens, Pleurotus ostreatus и Tapinella panuoides), а также на различные почвенные грибы из родов Aspergillus и Penicillium (P. notatum, Р. oxalicum, A. flavus, A. nidulans). Меллеолиды не оказывают влияния на Mucor racemosus и Trichoderma harzianum, повсеместно присутствующие в почве [3, 16]. Известно, что антимикотическую активность проявляют только меллеолиды, имеющие Δ2,4 – двойную связь в протоиллуденовом кольце, но для меллеолидов с Δ2,3 – двойной связью она не показана [3, 16]. Все меллеолиды, идентифицированные у сибирских штаммов Armillaria, содержат Δ2,3 – двойную связь в протоиллуденовом кольце и, поэтому их присутствие не будет препятствовать колонизации корней другими грибам. Известно, что меллеолиды, в том числе С и D, проявляют антибактериальную активность по отношению к грам-положительным бактериям [10, 11]. В связи с этим было высказано предположение об экологической роли этих соединений. Метаболиты этой группы могут сдерживать развитие конкурентной микробиоты и предотвращать колонизацию корней другими организмами [1]. Таким образом, сибирские штаммы грибов Armillaria, благодаря образованию меллеолидов, обладают антибактериальной и цитотоксичной активностью.
При изучении состава вторичных метаболитов грибов Armillaria у 8 из 11 сибирских штаммов были идентифицированы меллеолиды. Все продуценты видов A. borealis, A. cepistipes и A. sinapina образовывали меллеолид С и его хлорпроизводное меллеолид D. Отмечены штаммовые различия в спектре синтезируемых меллеолидов. Штамм A. borealis 74г синтезировал более широкий спектр меллеолидов (меллеолиды В, C, D, H, мелледоналы В и С, 5'-О-метилмелледонал, 13-гидрокси-5'-О-метилмелледонал и армилларинин) по сравнению с другими представителями этого вида. Показано, что состав среды культивирования влиял, как на количество, так и на соотношение меллеолидов у штаммов A. borealis 74г и D48/14. Все изученные меллеолид-синтезирующие штаммы проявляли токсикогенное и фитопатогенное действие по отношению к семенам и сеянцам P. abies и A. sibirica, ингибируя энергию прорастания, лабораторную и грунтовую всхожесть и развитие корневой системы сеянцев хвойных. Максимальной фитотоксичностью характеризовалась культуральная жидкость штамма A. borealis 74г, содержащая наибольшее количество и разнообразие меллеолидов в профиле метаболома. У штаммов A. gallica и A. ostoyae, не синтезирующих меллеолиды в идентифицируемых количествах, фитотоксическая активность практически отсутствовала. Это могло свидетельствовать о наличии связи между способностью синтезировать протоиллуденовые сесквитерпеновые арильные эфиры изученными штаммами Armillaria и высокой степенью их фитотоксичности.
Авторы выражают благодарность К. Корхонену (Finnish Forest Research Institute) за активное участие в проведение исследований по видовой идентификации грибов рода Armillaria.
Список литературы
Baumgartner K., Coetzee M.P., Hoffmeister D. // Mol. Plant Pathol. 2011. V. 12. № 6. P. 515−534.
Wick J., Heine D., Lackner G., Misiek M., Tauber J., Jagusch H., Hertweck Ch., Hoffmeister D. // Appl. Environ. Microbiol. 2016. V. 82. № 4. P. 1196–1204.
Misiek M., Hoffmeister D. // Mycol. Progress. 2012. V. 11. № 1. P. 7–15.
Pavlov I.N. // Contemp. Probl. Ecol. 2015. T. 8. № 4. C. 440–456.
Павлов И.Н., Литовка Ю.А., Литвинова Е.А., Тимофеев А.А., Пашенова Н.В., Сафронова И.Е., Кулаков С.С., Мулява В.В., Мулява В.Е. // АгроЭкоИнфо. 2017. Т. 29. № 3. 18 с.
Методы экспериментальной микологии / Ред. Билай В.И. Киев: Наукова думка, 1982. 552 с.
Maloy O.C. // Plant Dis. Reporter. 1974. № 58. P. 902–904.
Whitney R.D., Myren D.T., Britnell W.E. // Can. J. For. Res. 1978. № 8. P. 348–351.
Бухало А.С. Высшие съедобные базидиомицеты в чистой культуре. Киев: Наукова думка, 1988. 144 с.
Momose I., Sekizava R., Hosokawa N., Iinuma H., Matsui S., Nakamura H., Naganawa H., Hamada M., Takeuchi T. // J. Antibiotics. 2000. V. 53. № 2. P. 137–143.
Arnone A., Cardillo R., Nasini G. // Phitochemistry. 1986. V. 25. № 2. P. 471−474.
Engels B., Heining U., Grothe T., Stadler M., Jennewein S. // J. Biol. Chem. 2011 V. 286. № 9. P. 6871–6878.
Lackner G., Bohnert M., Wick J., Hoffmeister D. // Chem. Biol. 2013. V. 20. № 9. P. 1101–1106.
Kobori H., Sekiya A., Suzuki T., Choi J., Hirai H., Kawagishi H. // J. Nat. Prod. 2015. V. 78. № 1. P. 163–167.
Bohnert M., Miethbauer S., Dahse H.M., Ziemen J., Nett M., Hoffmeister D. // Bioorg. Med. Chem. Lett. 2011. V. 27. № 7. P. 2003−2006.
Bohnert M., Nutzmann H.-W., Schroeckh V., Horn F., Dahse H.-M., Brakhage A.A., Hoffmeister D. // Phytochemistry. 2014. V. 105. № 9. P. 101−108.
Li Zh., Wang Y., Jiang B., Li W., Zheng L., Yang X., Bao Y., Luguo Sun L., Yanxin Huang Y., Li Y. // J. Ethnopharmacol. 2016. V. 184. № 3. P. 119–127.
Peipp H., Sonnenbichler J. // Biol. Chem. Hoppe-Seyler. 1992. V. 373. № 8. P. 675–683.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология