Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 271-281
Метаболитные профили и биологическая активность экстрактов из культуры гриба Alternaria sonchi S-102 при различных способах его культивирования
А. О. Берестецкий 1, *, А. А. Далинова 1, Н. С. Волосатова 1
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
* E-mail: aberestetskiy@vizr.spb.ru
Поступила в редакцию 26.01.2018
После доработки 09.11.2018
Принята к публикации 18.12.2018
Аннотация
В составе метаболитов гриба Alternaria sonchi – патогена осота полевого были впервые идентифицированы 4-хлорпинзелин, хлоромонилиниковые кислоты B и C, эмодин и альтернариол. Способ культивирования и метод экстракции оказывали существенное влияние на метаболитные профили экстрактов. Для получения альтернэтаноксина А, хлоромонилицина и 4-хлорпинзелина с выходом около 460, 70, 2760 мг/кг соответственно предпочтительным было твердофазное культивирование гриба на пшенной крупе, альтернэтаноксинов B (215 мг/кг) и D (29 мг/кг) – на перловой крупе. Экстракты культуральной жидкости и биомассы гриба, полученной методом поверхностного культивирования, содержали 4-хлорпинзелин, альтернариол, эмодин, а также неизвестные ранее для A. sonchi биологически активные соединения. Относительно низкая фитотоксическая и антимикробная активность экстрактов культур гриба, а также следовые количества альтернариола в них предполагают токсикологическую безопасность A. sonchi S-102 как продуцента биогербицида.
Гриб Alternaria sonchi Davis является патогеном трудноискоренимых видов сорных растений из рода Sonchus (осот), распространенных в Европе, Канаде и Австралии, и представляет интерес как возможный продуцент биогербицида для борьбы с ними [1–3]. Основными факторами, определяющими коммерческих успех биогербицидов, являются полевая эффективность, экономичность производства пропагул (конидий или мицелия), а также безопасность для защищаемых культур и окружающей среды [4, 5]. При оценке безопасности микробных гербицидов учитывают также их селективность и токсигенность [6].
Грибы рода Alternaria известны своей способностью синтезировать соединения, относящиеся к разным классам вторичных метаболитов, обладающих широким спектром биологической активности [7]. Среди них, метаболиты, обладающие фитотоксическими свойствами, могут служить маркерами качества микогербицидов, а микотоксины при этом являются нежелательными компонентами [8].
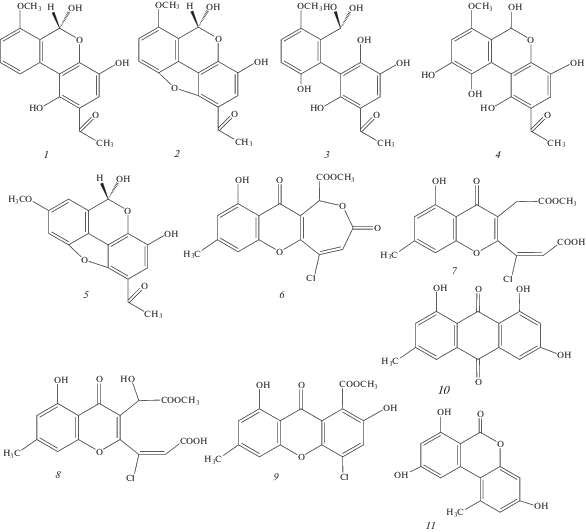
Ранее из культуры A. sonchi S-102 при твердофазном культивировании на перловой крупе, было выделено 5 полициклических этанонов (альтернэтаноксины А–Е) и хлорсодержащий ксантон – хлоромонилицин (рис. 1). Альтернэтаноксины А, В и С проявляли неспецифическую фитотоксическую активность на листьях осота полевого и пырея ползучего в концентрации 2 мг/мл. Альтернэтаноксины С и D, а также хлоромонилицин обладали антимикробными свойствами [9–12]. Однако образование этих и других биологически активных метаболитов не изучено при культивировании гриба на других твердых субстратах, а также жидких питательных средах.
Рис. 1.
Структура метаболитов, синтезируемых грибом A. sonchi S-102: 1 – альтернэтаноксин А, 2 – альтернэтаноксин В, 3 – альтернэтаноксин С, 4 – альтернэтаноксин D, 5 – альтернэтаноксин Е, 6 – хлоромонилицин, 7 – хлоромонилиниковая кислота В, 8 – хлоромонилиниковая кислота С, 9 – 4-хлорпинзелин, 10 – эмодин, 11 – альтернариол.
Исследований, посвященных изучению влияния состава питательных сред на образование вторичных метаболитов грибов рода Alternaria, очень мало. Основная часть работ посвящена изучению условий биосинтеза микотоксинов (альтернариола, метилового эфира альтернариола и тенуазоновой кислоты) у токсигенных видов этого рода. Так, Брцонкалик с соавт. [13] показали, что ацетат натрия в качестве единственного источника углерода и фенилаланин в качестве единственного источника азота в среде Чапека повышали продукцию альтернариола в глубинной культуре A. alternata, тогда как другие источники углерода и азота полностью ингибировали образование этого токсина. Максимальное содержание альтернариола и его метилового эфира в культуре гриба A. arborescens обнаружено при культивировании на томатном агаре в течение 40 сут при повышенной температуре (30°С) и высоком уровне активности воды (aw 0.995) [14]. Образованию фитотоксина брассициколина А грибом A. brassicicola способствовало культивирование на картофельно-декстрозной среде, повышенная температура (30°С) и отсутствие нитрата в питательной среде [15]. Таким образом, можно предположить, что изменение состава питательного субстрата повлияет на качественный и количественный состав экстрактов из культур A. sonchi, что, в свою очередь, позволит регулировать образование целевых веществ и снизить токсичность.
Цель работы – изучение состава метаболитов – биологически активных веществ A. sonchi при выращивании на различных средах, оценка токсикологических рисков его применения в качестве микогербицида.
МЕТОДИКА
Штамм гриба. В работе был использован штамм S-102 A. sonchi из рабочей коллекции чистых культур Лаборатории микологии и фитопатологии ВИЗР [1]. Культуру хранили в пробирках на скошенном картофельно-глюкозном агаре при температуре 4°С.
Культивирование гриба Alternaria sonchi S-102 на различных питательных субстратах. Гриб культивировали на трех стандартных жидких питательных средах: среде Чапека с добавлением биотина и тиамина (5 и 1 мкг/л соответственно), среде YES (дрожжевой экстракт – 20 г/л, сахароза – 150 г/л), среде ДМГ (дрожжевой экстракт – 4 г/л, мальтозный экстракт – 10 г/л, глюкоза – 10 г/л), рН всех сред доводили до 6.0. Указанные жидкие среды используются для получения метаболитов Alternaria spp. [16, 17]. Культивирование проводили в конических колбах на 500 мл, содержащих 100 мл жидкой питательной среды.
Для твердофазного культивирования A. sonchi использовали крупы (перловую, пшенную и рисовую), также используемые для получения вторичных метаболитов грибов рода Alternaria [18, 19]. Для приготовления твердых питательных субстратов 15 г крупы помещали в конические колбы объемом 100 мл и добавляли 10 мл деионизированной воды. Все питательные среды стерилизовали автоклавированием при температуре 121°С в течение 15 мин.
Субстраты инокулировали агаровыми блоками (d – 5 мм), вырезанными из края 3-недельной посевной культуры A. sonchi S-102. На каждом субстрате гриб культивировали в 3 повторностях. На жидких и твердых питательных средах гриб культивировали в течение 3 нед. в стационарных условиях при искусственном освещении 12 ч/сут и температуре 24 днем и 20°С ночью. Колбы с культурой A. sonchi на твердых субстратах встряхивали каждые 3 сут для предотвращения комкования. Такие условия культивирования стандартны для получения биологически активных веществ грибов [20].
Экстракция метаболитных комплексов из культур A. sonchi, полученных на различных твердых и жидких субстратах. Для выявления различных по полярности и биологической активности липофильных метаболитов гриба использовали несколько экстрагентов. Мицелий гриба отделяли фильтрованием, высушивали на взвешенных бумажных фильтрах в ламинарном боксе током стерильного воздуха. Метаболиты из фильтрата культуральной жидкости последовательно экстрагировали гексаном, что позволяло селективно экстрагировать хлоромонилицин, и этилацетатом, двукратно каждым экстрагентом в соотношении части культуральной жидкости и 1 часть экстрагента (об./об.). Полученные гексановые и этилацетатные экстракты по-отдельности обезвоживали с помощью безводного Na2SO4, растворители из экстрактов упаривали досуха при помощи ротационного испарителя при температуре водяной бани 40°С.
Высушенный в потоке стерильного воздуха мицелий, измельчали, помещали в колбу и экстрагировали двумя порциями ацетона в течение 10 мин в ультразвуковой ванне (S30H, “Elma”, Германия), растворитель упаривали досуха при помощи ротационного испарителя при 40°С.
Колонизированные грибом твердые субстраты высушивали в ламинарном боксе током стерильного воздуха. Высушенный материал измельчали и двукратно экстрагировали сначала гексаном, а затем 50%-ным водным ацетоном по 10 мин в ультразвуковой ванне. Полученные экстракты по-отдельности фильтровали через бумажные фильтры. Гексановый экстракт упаривали досуха, как описано выше. Из экстракта, полученного 50%-ным ацетоном, упаривали органический растворитель, после чего метаболиты гриба переэкстрагировали из оставшейся водной вытяжки этилацетатом. Полученный экстракт обезвоживали с помощью безводного Na2SO4, после чего отгоняли этилацетат на ротационном испарителе. Сухой остаток взвешивали.
Анализ полученных экстрактов методом В-ЭЖХ/УФ. Анализ состава экстрактов осуществляли методом ВЭЖХ с помощью хроматографа Waters Acquity UPLC H-Class (“Waters”, США), оснащенного диодно-матричным детектором. Для разделения экстрактов (сухой остаток растворяли в ацетонитриле до концентрации 10 мг/мл) были использованы колонки UPLC Acquity BEH 2.1 × 50 мм с зернением 1.7 мкм (“Waters”, США) с различными привитыми фазами: С18, С8, Phenyl и RP18. Объем вводимой пробы составлял 1 мкл. Элюирование проводили смесью ацетонитрила и 0.1%-ной муравьиной кислоты в линейном градиенте ацетонитрила (от 10 до 100% ацетонитрила в течение 5 мин, а затем ацетонитрил – еще в течение 2 мин). Скорость потока элюента составляла 300 мкл/мин, температура колонки 40°С, детектирование в диапазоне длин волн 200–800 нм с использованием функции MaxPlot программы Empower 3 (“Waters”, США). Гомогенность пиков исследуемых соединений на хроматограммах экстрактов определяли при помощи программного обеспечения Empower 3 (“Waters”, США). В таких условиях наиболее эффективное разделение компонентов экстрактов получали при использовании колонки с привитой фазой RP18.
Вариабельность метаболитных профилей экстрактов из культуры A. sonchi, полученной на различных питательных субстратах оценивали методом кластерного анализа. Для построения метаболомной матрицы учитывались пики с соотношением сигнал/шум не менее 10 : 1, различающиеся по времени удерживания и УФ-спектрам. Матрица была приведена к виду “наличие/отсутствие признака”, для этого присвоили значение “1” всем ячейкам с ненулевым содержимым. В качестве алгоритма кластеризации использовали метод средней связи, в качестве метрики расстояния – коэффициент несогласия. Расчеты проведены с помощью программного обеспечения Statistica 8.0.
Выделение и анализ метаболитов A. sonchi. Очистку и идентификацию известных соединений гриба A. sonchi проводили с помощью ранее описанных методов препаративной хроматографии [9, 10, 12]. Кроме того, в ходе этой работы были выделены и другие соединения: 4-хлорпинзелин [21], эмодин [22], хлоромониликовые кислоты B [23] и C [24]. Их идентификацию проводили с помощью анализа УФ-, масс-, 1Н–ЯМР спектров. Для ВЭЖХ/УФ/МС использовали систему Thermo Scientific TSQ Quantum Access (тройной квадруполь, США) с ионизацией электроспреем в режиме съемки положительных ионов в диапазоне 50–1000 m/z. Условия хроматографирования образцов веществ были следующими: колонка Zorbax CB-С18, размеры колонки 150 × 2.1, зернение 1.8 µm (“Agilent”, США), элюирование в градиентном режиме в системе ацетонитрил – 0.1% муравьиная кислота 1–95% ацетонитрила (по объему), скорость потока 250 мкл/мин. Протонные ЯМР спектры записывали с помощью ЯМР-спектрометра Bruker AVANCE III 400 Ultrashield Plus (Германия) на частоте 400.1 МГц. Альтернэтаноксины А, B, D, E, хлоромонилицин, эмодин были растворены в ацетоне-d6, хлоромонилиниковые кислоты В и С – в метаноле-d4. Спектральные данные идентифицированных соединений приведены в табл. 1.
Таблица 1.
Физико-химические свойства идентифицированных метаболитов Alternaria sonchi S-102
| Вещество | tR, мин | λmax, нм | ВЭЖХ-МС | 1Н-ЯМР |
|---|---|---|---|---|
| Альтернариол | 3.73 | 255, 288, 299, 337 | 258.96 [M + H]+ | 7.26 c (1 H); 6.71 д, J = 2 Гц (1 Н); 6.62 д, J = 3 Гц (1 Н); 6.37 с (1 Н); 2.77 с (3 Н) |
| 4-Хлорпинзелин | 4.37 | 238, 264, 297, 387 | 334.93 [M + H]+, 302.91 [M + H–CH3OH]+ |
7.64 с (1 Н); 6.94 с (1 Н); 6.68 с (1 Н); 3.93 с (3 Н); 2.48 с (3 Н) |
| Хлоромонилиниковая кислота В | 3.92 | 247, 334 | 352.91 [M + H]+, 320.90 [M + H–CH3OH]+ |
6.82 с (1 Н); 6.71 с (1 Н); 6.66 с (1 Н); 3.69 с (3 Н); 3.52 с (2 Н); 2.42 с (3 Н) |
| Хлоромонилиниковая кислота С | 3.53 | 246, 333 | 368.88 [M + H]+, 390.85 [M + Na]+, 350.86 [M + H–H2O]+ |
6.87 с (1 Н); 6.72 с (1 Н); 6.70 с (1 Н); 5.10 с (1 Н); 3.73 с (3 Н); 2.45 с (3 Н) |
| Хлоромонилицин | 4.20 | 205, 279 | 350.82 [M + H]+ | 7.16 с (1 Н); 7.02 с (1 Н); 6.81 с (1 Н); 6.48 с (1 Н); 3.82 с (3 Н); 2.49 с (3 Н) |
| Эмодин | 4.62 | 221, 287, 438 | 270.87 [M + H]+ | 7.60 с (1 Н); 7.28 с (1 Н); 7.17 с (1 Н); 6.69 с (1 Н); 2.49 с (3 Н) |
| Альтернэтаноксин А | 3.22 | 205, 284 | 302.87 [M + H]+ | 7.48 д, J = 8 Гц (1 Н); 7.29 т, J = 7.5 Гц (1Н); 7.14 д, J = 8 Гц (1 Н); 6.21 с (2 Н); 3.70 с (3 Н); 2.21 с (3 Н) |
| Альтернэтаноксин В | 3.96 | 235, 262, 295, 384 | 300.87 [M + H]+, 268.85 [M + H–CH3OH]+ |
7.56 кв (2 Н); 6.85 c (1 H); 6.64 с (1 Н); 3.93 с (3 Н); 2.45 с (3 Н) |
| Альтернэтаноксин C | 3.51 | 205, 286 | 336.93 [M + H]+ | 7.50 кв (2 Н); 6.23 с (2 Н); 3.72 с (3 Н); 2.22 с (3 Н) |
| Альтернэтаноксин D | 4.46 | 241, 309, 353 | 334.93 [M + H]+, 302.91 [M + H–CH3OH]+ |
7.09 с (1 Н); 6.96 с (1 Н); 6.69 с (1 Н); 3.93 с (3 Н); 2.48 с (3 Н) |
| Альтернэтаноксин E | 4.18 | 234, 306, 350 | 300.87 [M + H]+, 268.85 [M + H–CH3OH]+ |
7.00 д, J = 2 Гц (1 Н); 6.91 д, J = 2 Гц (1 Н); 6.84 с (1 Н); 6.64 с (1 Н); 3.93 с (3 Н); 2.45 с (3 Н) |
Количественное определение альтернэтаноксинов (A, B, D и Е), хлоромонилицина, 4-хлорпинзелина и альтернариола в экстрактах проводили с помощью ВЭЖХ методом абсолютной калибровки. В качестве стандарта альтернариола использовали образец, предоставленный сотрудником ВИЗР Г.М. Фроловой, спектральные данные которого приведены в табл. 1. Для построения калибровочной зависимости по методике анализа экстрактов на колонке UPLC Acquity BEH RP18 2.1 × 50 мм были получены хроматограммы стандартов метаболитов в концентрациях 1, 10 и 100 мкг/мл (в трех повторностях для каждой концентрации). По полученным данным при помощи программного обеспечения Empower 3 (“Waters”, США) были построены графики зависимости среднего значения площади пика от концентрации метаболита в градуировочном растворе. Зависимость площади пика на хроматограммах от концентрации метаболита была линейной в диапазоне концентраций 1–100 мкг/мл (значение коэффициента линейной корреляции для всех анализируемых соединений R2 > 0.999). Отклонение от приведенных времен удерживания (табл. 1) в ходе эксперимента не превышало 2%. Количественный анализ хлоромонилиниковых кислот В и С не проводили, так как при использованных условиях хроматографирования происходило наложение на них пиков других соединений.
Определение биологической активности экстрактов. Для оценки фитотоксического действия экстрактов использовали ранее описанный метод [25]. Образцы экстрактов массой 1 мг растворяли сначала в 10 мкл этанола, затем добавляли 190 мкл воды, конечная концентрация экстрактов в растворе составляла 5 мг/мл. На поврежденные острой иглой высечки (d – 1 см) из листьев осота полевого и отрезки по 2 см листьев пырея ползучего (по 6–8 штук) наносили 10 мкл экстракта над местом надкола. Определение диаметра некротического пятна для осота и длины некротического пятна для пырея проводили через 48 ч инкубации при температуре 24°С и переменном искусственном освещении (12 ч в сутки).
Для оценки антимикробной активности методом бумажных дисков в качестве тест-микроорганизмов использовали бактерии Bacillus subtilis, Escherichia coli и дрожжи Candida tropicalis. Активность экстрактов оценивали в концентрации 500 мкг/диск. Радиус зоны ингибирования роста бактерий замеряли через 24 ч инкубации при 30°С. Опыты проводили в трех повторностях.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выход биомассы и экстрактивных веществ. При культивировании A. sonchi на жидкой среде YES через 3 нед. выход биомассы был в несколько раз больше, чем выход биомассы на средах ЧАВ и ДМГ (табл. 2), что, очевидно, связано с более высокой концентрацией источника углерода в этой среде. При этом выход экстрактивных веществ из мицелия гриба при пересчете на массу сухого мицелия, был значительно ниже, чем на двух других питательных средах (табл. 2). Таким образом, биомасса, накапливаемая в большом количестве при культивировании A. sonchi на среде YES, содержала гораздо меньше экстрактивных веществ, чем при культивировании на средах ЧАВ и ДМГ. Это могло быть связано с ингибированием синтеза вторичных эндометаболитов высокой концентрацией источника углерода [26].
Таблица 2.
Выход экстрактивных веществ при культивировании A. sonchi на жидких питательных средах*
| Среда | Сухая биомасса, г/л среды | Экстрактивные вещества | |||
|---|---|---|---|---|---|
| мицелий | культуральная жидкость | ||||
| мг/г сухого мицелия | мг/л среды |
(гексан) мг/л |
(этилацетат) мг/л |
||
| YES | 36.3 ± 8.1 | 9.6 ± 0.3 | 372 ± 74 | 26.0 ± 11.0 | 277.5 ± 55.7 |
| ДМГ | 5.6 ± 1.4 | 48.5 ± 2.9 | 213 ± 83 | 29.0 ± 12.7 | 38.0 ± 0.5 |
| ЧАВ | 3.1 ± 0.6 | 48.5 ± 1.9 | 162 ± 58 | 21.5 ± 10.6 | 77.5 ± 16.3 |
Выход этилацетатных экстрактов из КЖ A. sonchi существенно зависел от состава жидкого питательного субстрата, тогда как выход гексановых экстрактов варьировал слабо. При этом, выход экстрактивных веществ из КЖ был существенно (в 3–10 раз) выше при использовании этилацетата в качестве экстрагента, чем при извлечении грибных метаболитов гексаном (табл. 2). Среди гексановых экстрактов максимальный выход экстрактивных веществ отмечен в экстракте из КЖ гриба на среде ДМГ (29 мг/л). Наиболее высокое содержание экстрактивных веществ в этилацетатных экстрактах (277 мг/л) отмечено в экстракте из культурального фильтрата, полученного при выращивании A. sonchi на жидкой среде YES (табл. 2).
Суммарный выход экстрактивных веществ из твердофазных культур A. sonchi составил 7.0–9.3 г/кг субстрата. При культивировании A. sonchi на перловой и пшенной крупах выходы гексановых и этилацетатных экстрактов практически не различались, в то время как при культивировании гриба на рисовом субстрате выход этилацетатного экстракта был в два раза выше, чем выход гексанового (табл. 3). Возможно, различия в выходе экстрактивных веществ из твердофазных культур A. sonchi обусловлены различным химическим составом круп, использованных для приготовления субстрата: пшено содержит 3.3 жиров и 11.5% белка в расчете на сухое вещество, в то время как перловая крупа содержит 1.3 и 9.3%, а рисовая – всего 1.0 и 7.0% жиров и белка соответственно [27].
Таблица 3.
Выход экстрактивных веществ из твердофазных культур A. sonchi
| Субстрат | Выход экстрактивных веществ, г/кг субстрата | Суммарный выход экстрактивных веществ, г/кг субстрата |
|
|---|---|---|---|
| гексан | этилацетат | ||
| Перловая крупа | 3.8 ± 0.5 | 4.4 ± 2.1 | 8.3 ± 2.2 |
| Пшенная крупа | 5.7 ± 1.7 | 4.6 ± 0.3 | 10.2 ± 1.5 |
| Рисовая крупа | 2.1 ± 0.7 | 5.2 ± 0.9 | 7.3 ± 0.2 |
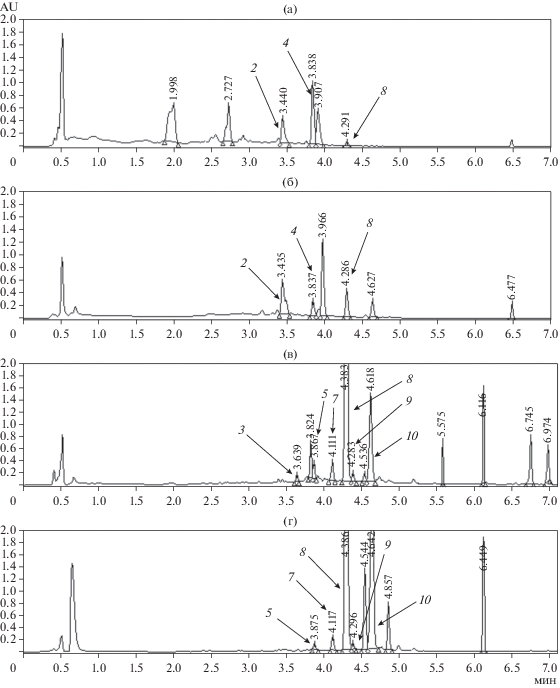
Анализ хроматографических профилей экстрактов из различных культур A. sonchi S-102. Анализ метаболитных профилей, полученных методом ВЭЖХ/УФ-спектроскопии, показал, что способ культивирования оказывал существенное влияние на состав метаболитов гриба. Типичные хроматограммы экстрактов твердофазной культуры A. sonchi приведены на рис. 2. Хроматограммы экстрактов из КЖ A. sonchi, полученные на средах ДМГ и ЧАВ представлены на рис. 3. При повторении эксперимента отмечена хорошая воспроизводимость хроматографических профилей экстрактов.
Рис. 2.
Метаболитные профили гексанового (а) и этилацетатного (б) экстрактов из культуры A. sonchi, полученных при выращивании продуцента на пшенной крупе: 1 – альтернэтаноксин А, 2 – хлоромонилиниковая кислота С, 3 – альтернариол, 4 – хлоромонилиниковая кислота В, 5 – альтернэтаноксин В, 6 – альтернэтаноксин Е, 7 – хлоромонилицин, 8 – хлорпинзелин, 9 – альтернэтаноксин D.
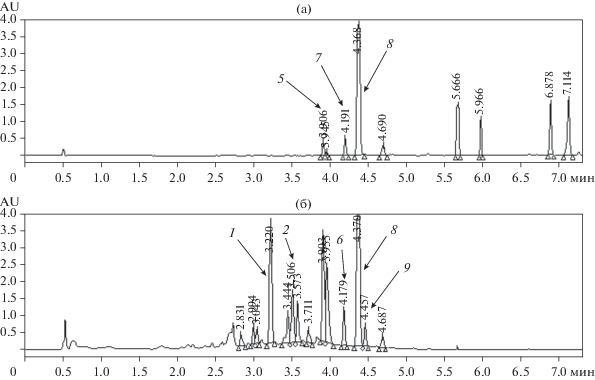
Рис. 3.
Метаболитные профили этилацетатных экстрактов фильтрата культуральной жидкости и мицелия A. sonchi, полученных при культивировании гриба на средах ДМГ (а – этилацетатный экстракт КЖ, б – экстракт из мицелия) и ЧАВ (в – этилацетатный экстракт КЖ, г – экстракт из мицелия). 1 – альтернэтаноксин А, 2 – хлоромонилиниковая кислота С, 3 – альтернариол, 4 – хлоромонилиниковая кислота В, 5 – альтернэтаноксин В, 6 – альтернэтаноксин Е, 7 – хлоромонилицин, 8 – хлорпинзлин, 9 – альтернэтаноксин D, 10 – эмодин.
Из 40 пиков, обнаруженных на хроматограммах экстрактов, 18 пиков (45%) было обнаружено только в экстрактах из жидких культур гриба (биомассы и КЖ). Из них 11 пиков были уникальны для экстрактов из КЖ, 4 – для экстрактов из биомассы, остальные 3 – были общими для экстрактов из КЖ и биомассы. Доля пиков, характерных только для экстрактов из твердофазных культур A. sonchi S-102, составляла 30% (12 пиков) от числа обнаруженных. Пять пиков были общими для экстрактов из жидкофазного и твердофазного мицелия, пять – общими для всех экстрактов.
Кластерный анализ метаболомной матрицы показал значительное влияние способа культивирования и экстрагента на метаболитные профили экстрактов из культур A. sonchi. Совокупность экстрактов разделялась на 2 главных кластера: кластер А – этилацетатные экстракты из твердофазных культур и кластер Б – остальные экстракты. Кластер Б, в свою очередь, разделился на 2 субкластера: субкластер Б1 – этилацетатные экстракты из КЖ на средах YES и ДМГ и субкластер Б2 – остальные экстракты. В кластере Б2 существенно различался метаболитный профиль гексановых экстрактов из КЖ и твердофазных культур. Экстракты из биомассы и этилацетатный экстракт из КЖ на ЧАВ разместились в различных субкластерах кластера Б. Максимальное варьирование в составе метаболитов наблюдали в этилацетатных экстрактах из КЖ (коэффициент несогласия 0.18) и биомассы (коэффициент несогласия 0.15), минимальное – в гексановых экстрактах из мицелия A. sonchi из твердофазных и жидкофазных культур (коэффициент несогласия 0.10).
Путем сравнения со стандартами метаболиты с tR 3.22, 3.92, 4.18, 4.21 и 4.46 мин в экстрактах A. sonchi были идентифицированы как альтернэтаноксины А, В, Е, хлоромонилицин и альтернэтаноксин D соответственно (табл. 1). Метаболиты с tR 3.52, 3.72, 3.92, 4.37 и 4.61 мин были идентифицированы как хлоромонилиниковая кислота С [24], альтернариол [28], хлоромонилиниковая кислота В [23], 4-хлорпинзелин [21] и эмодин [22] соответственно (табл. 1). Эти вещества в культуре гриба A. sonchi выявлены впервые. За исключением альтернариола, все они являются предшественниками или продуктами деградации хлоромонилицина [21–23]. При этом, альтернэтаноксины А и Е были обнаружены только в экстрактах из твердофазных культур гриба; хлоромонилиниковая кислота С, альтернариол и эмодин – найдены в экстрактах из культуральной жидкости и биомассы; альтернэтаноксины В и D, хлоромонилицин, 4-хлорпинзелин и хлоромонилиниковая кислота В образовывались при культивировании A. sonchi как на твердых, так и на жидких питательных субстратах (табл. 4).
Таблица 4.
Влияние состава питательного субстрата на содержание идентифицированных метаболитов при выращивании Alternaria sonchi S-102 на жидких и твердых средах
| Вещество | Содержание идентифицированных метаболитов (мг/л; мг/кг) | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| жидкая среда | твердая среда | ||||||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| Альтернэтаноксин А | – | – | – | – | – | – | – | – | – | – | 154 | – | 460 | – | 302 |
| Хлоромониликовая кислота С | – | – | – | – | ++ | – | – | ++ | – | – | – | – | – | – | – |
| Альтернариол | – | – | <1 | – | – | <1 | – | – | – | – | – | – | – | – | – |
| Хлоромониликовая кислота В | – | + | – | + | ++ | – | – | + | – | – | ++ | – | ++ | – | ++ |
| Альтернэтаноксин В | – | – | – | – | – | 46 | – | – | <1 | 8 | 215 | 6 | – | 2 | 38 |
| Альтернэтаноксин Е | – | – | – | – | – | – | – | – | – | – | 56 | – | 87 | – | 89 |
| Хлоромонилицин | – | – | – | – | – | 2 | – | – | 1 | 25 | – | 72 | – | 27 | – |
| 4-хлорпинзелин | <1 | – | 27 | <1 | <1 | 61 | <1 | <1 | 48 | 700 | 1179 | 1492 | 1271 | 472 | 1384 |
| Альтернэтаноксин D | – | – | – | <1 | – | <1 | – | – | <1 | – | 29 | – | 26 | – | 7 |
| Эмодин | – | – | – | – | – | – | – | ++ | ++ | – | – | – | – | – | – |
Примечание. Обозначения экстрактов: “субстрат/экстрагент” - для твердых питательных субстратов, “питательная среда – источник/экстрагент” – для жидких питательных сред. 1 – YES-фильтрат/гексан; 2 – YES-фильтрат/этилацетат; 3 – YES-биомасса/ацетон; 4 – ДМГ-фильтрат/гексан; 5 – ДМГ-фильтрат/этилацетат; 6 – ДМГ-биомасса/ацетон; 7 – ЧАВ-фильтрат/гексан; 8 – ЧАВ-фильтрат/этилацетат; 9 – ЧАВ-биомасса/ацетон; 10 – перловая крупа/гексан; 11 – перловая крупа/этилацетат; 12 – пшенная крупа/гексан; 13 – пшенная крупа/этилацетат; 14 – рисовая крупа/гексан; 15 – рисовая крупа/этилацетат. “–" – вещество не обнаружено; "+" – хорошо детектируемый минорный пик; “++” – мажорный пик.
Количественное определение некоторых идентифицированных соединений показало, что состав питательного субстрата оказал влияние на их накопление в культуре A. sonchi. Максимальный выход 4-хлорпинзелина (2763 мг/кг), альтернэтаноксина А (460 мг/кг) и хлоромонилицина (72 мг/кг) получен при культивировании гриба на пшенной крупе. Перловая крупа была оптимальной для биосинтеза грибом альтернэтаноксина В (215 мг/кг) и альтернэтаноксина D (29 мг/кг). Максимальная концентрация альтернэтаноксина Е (89 мг/кг) найдена в твердофазной культуре A. sonchi на рисовой крупе. Микотоксин альтернариол был обнаружен в следовых количествах в биомассе гриба, полученной на жидких средах YES и ДМГ, в то время как эмодин образовывался при культивировании A. sonchi на жидкой среде ЧАВ (табл. 4).
Биологическая активность экстрактов из различных культур A. sonchi S-102. Способ культивирования гриба оказал заметное влияние на степень и спектр биологической активности экстрактов. Так, экстракты из жидких культур гриба (из культуральной жидкости и из биомассы) проявляли в целом большую фитотоксичность в отношении осота полевого, по сравнению с экстрактами из твердофазных культур гриба. Последние, наоборот, проявили более высокую антимикробную активность (табл. 5).
Таблица 5.
Биологическая активность экстрактов из культур Alternaria sonchi S-102, полученных после выращивания гриба на различных средах
| Тест-организм | Жидкие субстраты | Твердые субстраты | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | |
| Фитотоксическая | |||||||||||||||
| Осот* | 2.0 ± 0.6 | 2.8 ± 0.2 | 1.2 ± 0.2 | 2.0 ± 0.4 | 1.6 ± 0.4 | 1.6 ± 0.2 | 2.8 ± 0.5 | 2.0 ± 0.3 | 3.8 ± 0.4 | 0.2 ± 0.2 | 0 | 0.4 ± 0.2 | 0.6 ± 0.6 | 0 | 1.0 ± 0.6 |
| Пырей** | 0.6 ± 0.2 | 1.0 ± 0.3 | 0.4 ± 0.2 | 0.4 ± 0.2 | 1.0 ± 0.3 | 1.2 ± 0.4 | 1.0 ± 0.4 | 2.2 ± 0.4 | 1.6 ± 0.5 | 0 | 1.4 ± 0.4 | 0 | 2.8 ± 0.2 | 0 | 1.4 ± 0 .4 |
| Антимикробная*** | |||||||||||||||
| E. coli | – | 0 | 0 | – | 0 | 2 ± 0 | – | 0 | 2 ± 0 | 1 ± 0 | 1.5 ± 0.5 | 2.0 ± 0 | 2.0 ± 0 | 3.0 ± 0 | 1.0 ± 0 |
| B. subtilis | – | 0 | 1 ± 0 | – | 0.8 ± 0.3 | 2 ± 0 | – | 1 ± 0 | 2 ± 0 | 1.5 ± 0.5 | 3.5 ± 0.5 | 1.5 ± 0.5 | 3.0 ± 0 | 2.0 ± 0 | 2.0 ± 0 |
| C. tropicalis | – | 0 | 1 ± 0 | – | 0 | 2.8 ± 0.3 | – | 0 | 2 ± 0 | 2.5 ± 0.5 | 2.5 ± 0 | 2.3 ± 0.3 | 1.8 ± 0.3 | 4.0 ± 0 | 0.8 ± 0.8 |
* Диаметр некротического пятна, мм. ** Длина некротического пятна, мм. ***Радиус зоны ингибирования роста бактерий, мм. " – " – биотестирование не проводилось из-за малой массы экстракта. Представлены средние значения ± стандартная ошибка Обозначения экстрактов: см. подписи к табл. 4.
Наиболее высокую фитотоксическую активность в отношении осота полевого (диаметр некроза от 2 до 3.8 мм) показали экстракты из КЖ и биомассы, полученной при культивировании A. sonchi на среде ЧАВ. Листья пырея ползучего были высокочувствительны (длина некроза более 2 мм) к этилацетатным экстрактам из КЖ культур гриба на среде ЧАВ и на пшенной крупе (табл. 5).
Этилацетатные экстракты из КЖ A. sonchi содержали фитотоксичные хлоромонилиниковые кислоты В и С (табл. 4 и 5) [24]. Высокая фитотоксическая активность экстрактов из КЖ и мицелия гриба, полученных на среде Чапека с витаминами, может быть связана с наличием неидентифицированных мажорных соединений (tR 4.05, tR 4.72 и tR 4.93 мин). УФ-спектр соединения с tR 4.72 мин схож с УФ-спектрами производных антрахинона [29]. Среди метаболитов грибов рода Alternaria известны производные антрахинона, проявляющие фитотоксическую активность – это представители групп альтерсоланолов [30] и групп альтерпорриолов [31]. Фитотоксическая активность гексановых экстрактов из КЖ A. sonchi (табл. 5) может быть обусловлена присутствием в них неидентифицированных неполярных соединений, например, свободных жирных кислот, многие из которых являются фитотоксичными [32, 33].
Максимальное ингибирование роста Bacillus subtilis (зона лизиса около 3.5 мм) продемонстрировал этилацетатный экстракт из культуры гриба на перловой крупе (табл. 5). В этом и других этилацетатных экстрактах из твердофазных культур A. sonchi обнаружен альтернэтаноксин D (табл. 4), обладающий антимикробными свойствами [12].
Максимальную ингибирующую активность в отношении Escherichia coli и Candida tropicalis (зона лизиса около 3 и 4 мм соответственно) проявил гексановый экстракт из культуры A. sonchi, полученной на рисовой крупе. Среди экстрактов из жидких культур гриба заметной антимикробной активностью обладали экстракты из биомассы ДМГ и ЧАВ (табл. 5). В этих и во всех гексановых экстрактах из твердофазных культур гриба показано наличие хлоромонилицина (табл. 4) – антибиотика с выраженными антифунгальными свойствами [10, 11], что, очевидно, объясняло их антимикробную активность и более высокую чувствительность гриба к этим экстрактам (табл. 5).
Четкой зависимости антимикробной активности экстрактов от концентрации выявленных в них антибиотиков не выявлено. Это может быть связано с наличием в экстрактах неизвестных соединений, также обладающих антимикробной активностью, или с синергетическим действием различных компонентов экстрактов. Механизм синергетического эффекта может заключаться в ингибировании разрушающих антибиотик ферментов, повышении проницаемости клеточных мембран бактериальных клеток, торможении образования биопленок [34, 35]. Например, активность ампициллина и имипенема повышалась при совместном применении с экстрактами из грибов Fistulina hepatica, Tapinella atrotomentosa и Rhodocybe popinalis [36].
Таким образом, состав питательных субстратов оказывал существенное влияние на количественный и качественный состав экстрактов из жидких и твердофазных культур A. sonchi S-102. Значительные различия были выявлены в компонентном составе этилацетатных экстрактов из культуральной жидкости и твердофазных культур гриба. Тщательное изучение метаболитных профилей экстрактов позволило выявить новые для этого гриба вещества: альтернариол, эмодин, 4-хлорпинзелин, хлоромонилиниковые кислоты B и C.
Более 30 веществ в экстрактах из культур гриба остались неидентифицированными. Для их препаративного выделения оптимальны среды YES и ЧАВ (среда Чапека с витаминами) ввиду относительно высоких показателей по выходу экстрактивных веществ и фитотоксической активности. Однако и в экстрактах из твердофазных культур также осталось значительное количество (более 15) неизвестных минорных соединений.
Количественное определение ряда биологически активных веществ в экстрактах A. sonchi S-102 показало, что среди трех использованных круп пшенная оказалась оптимальным субстратом для получения альтернэтаноксина А, хлоромонилицина и 4-хлорпинзелина, а перловая – для получения альтернэтаноксинов B и D.
Относительно низкая биологическая активность экстрактов и лишь следовые количества микотоксина альтернариола могут говорить о малой экологической опасности отработанного субстрата и метаболитов A. sonchi при попадании в окружающую среду с точки зрения воздействия на нецелевую микрофлору почвы и грунтовых вод.
Работа выполнена при поддержке гранта РНФ № 16-16-00085.
Список литературы
Берестецкий А.О., Терлецкий В.М., Ганнибал Ф.Б., Казарцев И.А., Ходорковский М.А. // Микол. фитопатол. 2013. Т. 47. № 2. С. 120–128.
McClay A.S., Peschken D.P. // Biological Control Programmes in Canada, 1981–2000 / Ed. P.G. Mason, J. Theodore. Oxon, NY: CABI International, 2002. P. 416–424.
Scott J.K., McCarren K. // Biological Control of Weeds in Australia / Ed. Julien M.H., McFadyen R.E., Cullen J. Melbourn: CSIRO Publishing, 2012. P. 563–568.
Harding D.P., Raizada M.N. // Front. Plant Sci. 2015. V. 6. Article 659.
Hershenhorn J., Casella F., Vurro M. // Biocontrol Sci. Techn. 2016. V. 26. P. 1313–1328.
Hoagland R.E., Boyette C.D., Weaver M.A., Abbas H.K. // Toxin Reviews. 2007. V. 26. P. 313–342.
Lou J., Fu L., Peng Y., Zhou L. // Molecules. 2013. № 18. P. 5891–5935.
Vurro M. / Novel Biotechnologies for Biocontrol Agent Enhancement and Management. NATO Security through Science Series / Ed. M. Vurro, J. Gressel. Dordrecht: Springer, 2007. P. 53–74.
Evidente A., Punzo B., Berestetskiy A., Andolfi A., Motta A. // J. Agric. Food Chem. 2009. V. 57. P. 6656–6660.
Berestetskiy A., Cimmino A., Sofronova J., Dalinova A., Avolio F., Evidente M., Chisty L., Krivorotov D., Evidente A. // J. Agric. Food. Chem. 2015. V. 63. P. 1196–1199.
Sassa T., Kachi H., Nukina M., Suzuki Y. // J. Antibiot. 1985. V. 38. P. 439–441.
Cimmino A., Pescitelli G., Berestetskiy A., Dalinova A., Krivorotov D., Tuzi A., Evidente A. // J. Antibiot. 2016. V. 69. P. 9–14.
Brzonkalik K., Herrling T., Syldatk C., Neumann A. // Int. J. Food Microbiol. 2011. V. 147. P. 120–126.
Vaquera S., Patriarca A., Pinto V.F. // Int. J. Food Microbiol. 2016. V. 219. P. 44–49.
Pedras M.S., Park M.R. // Mycologia. 2015. V. 107. P. 1138–50.
Gu W. // World J. Microbiol Biotechnol. 2009. V. 25. P. 1677–1683.
Maas M.R., Woody M.A. Chu A.S. // J. Food Safety. 1981. V. 3. P. 39–47.
Wang Y., Yang M.H., Wang X.B., Li T.X., Kong L.Y. // Fitoterapia. 2014. V. 99. P. 153–8.
Li F-Q., Toyazaki N., Yoshizawa T. // J. Food Prot. 2001. V. 64. № 4.
Берестецкий А.О. // Прикл. биохимия и микробиология. 2008. Т. 44. С. 501–514.
Horiguchi K., Suzuki Y., Sassa T. // Agric. Biol. Chem. 1989. V. 53. P. 2141–2145.
Sassa T. // Agric. Biol. Chem. 1991. V. 55. P. 95–99.
Sassa T., Horiguchi K., Suzuki Y. // Agric. Biol. Chem. 1989. V. 53. P. 1337–1341.
Masi M., Meyer S., Clement S., Pescitelli G., Cimmino A., Cristofaro M., Evidente A. // J. Nat. Prod. 2017. V. 80. № 10. P. 2771–2777.
Берестецкий А.О., Юзихин О.С., Каткова А.С., Добродумов А.В., Сивогривов Д.Е., Коломбет Л.В. // Прикл. биохимия и микробиология. 2010. Т. 46. № 1. С. 84–88.
Adnan M., Zheng W., Islam W., Arif M., Abubakar S.Y., Wang Z., Lu G. // Int. J. Mol. Sci. 2018. V.19. № 1. P. 48. https://org/ doi 10.3390/ijms1901004810.3390/ ijms19010048.
Химический состав Российских пищевых продуктов / Ред. Скурихина И.М., Тутельяна В.А. М.: ДеЛи принт, 2002. 236 с.
Tan N., Tao Y., Pan J., Wang S., Xu F., She Z., Lin Y., Jones E.B.G. // Chem. Nat. Comp. 2008. V. 44. № 3. P. 296–300.
Гесслер Н.Н., Егорова А.С., Белозерская Т.А. // Прикл. биохимия и микробиология. 2013. Т. 49. № 2. С. 109–123.
Stoessl A. // Chem. Comm. 1967. P. 307–308.
Suemitsu R., Sakurai Y., Nakachi K., Miyoshi I., Kubota M., Ohnishi K. // Agric. Biol. Chem. 1989. V. 53. № 5. P. 1301–1304.
Fukuda M., Tsujino Y., Fujimori T., Wakabayashi K., Böger P. // Pesticide Biochem. Physiol. 2004. V. 80. P. 143–150.
Lederer B., Fujimori T., Tsujino Y., Wakabayashi K., Böger P. // Pesticide Bioch. Physiol. 2004. V. 80. P. 151–156.
Teethaisong Y., Autarkool N., Sirichaiwetchakoon K., Krubphachaya P., Kupittayanant S., Eumkeb G. // J. Biomed Sci. 2014. V. 21. A. 90.
Rogers S.A., Huigens R.W., Cavanagh J., Melander C. // Antimicrob Agents Chemother. 2010. V. 54. P. 2112–2118.
Liktor-Busa E., Kovács B., Urbán E., Hohmann J., Ványolós A. // Lett Appl Microbiol. 2016. V. 62. P. 437–443.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


