Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 256-263
Соевые ингибиторы трипсина: избирательная инактивация при гидролизе соевых белков рядом ферментных препаратов
Т. А. Муранова 1, Д. В. Зинченко 1, *, Н. А. Белова 1, А. К. Сурин 2, А. И. Мирошников 1
1 Московский государственный университет им. М.В. Ломоносова, биотехнологический факультет
119991 Москва, Россия
2 Институт белка РАН
142290 Московская обл., Пущино, Россия
* E-mail: zdv@bibch.ru
Поступила в редакцию 24.07.2018
После доработки 23.11.2018
Принята к публикации 18.12.2018
Аннотация
Изучена инактивация соевых ингибиторов трипсина Кунитца и Баумана–Бирк при гидролизе соевых белков ферментными препаратами из гепатопанкреаса камчатского краба, пилорических придатков трески и коммерческим ферментным препаратом протосубтилин. Анализ гидролизатов соевого белкового изолята показал, что использованные ферментные препараты полностью гидролизовали трипсиновый ингибитор Кунитца, обеспечивающий 60–70% общей ингибиторной активности по отношению к трипсину, но практически не действовали на ингибитор трипсина и химотрипсина Баумана–Бирк. Все использованные ферментные препараты содержали различные наборы нескольких ферментов, отличающихся друг от друга по протеолитической специфичности, поэтому учитывая данные об уникальной структуре ингибитора Баумана–Бирк, можно сделать вывод, что этот белок обладает очень высокой устойчивостью по отношению к протеолитическим ферментам и не инактивировался при ферментативном гидролизе.
Соя относится к масличным культурам, но основное экономическое значение ее обусловлено белковой составляющей соевых бобов. Многочисленные исследования показали, что в сое присутствуют более десятка антипитательных веществ, которые представлены тремя классами соединений (белки, углеводы и липиды). По крайней мере, 90% (по массе) этих соединений составляют белки, среди которых содержание соевых ингибиторов пищеварительных ферментов колеблется в зависимости от сорта и может достигать 25% от общей белковой массы [1, 2]. Установлено, что в сое содержатся ингибиторы трипсина нескольких семейств, два из которых, являющиеся основными, идентифицированы и хорошо изучены. К ним относится трипсиновый ингибитор Кунитца (ТИК) с одним центром связывания трипсина, изоформы которого имеют молекулярные массы 20–25 кДа [3], а также ингибитор Баумана–Бирк (ИББ) с молекулярной массой около 8 кДа, который содержит два связывающих ферменты центра (1 : 1) и подавляет активность одновременно не только трипсина, но и химотрипсина, что значительно повышает его ингибиторную активность [4–6]. Молекула ИББ состоит из 71 аминокислотного остатка, в его структуре содержатся 7 дисульфидных связей, обеспечивающих высокую стабильность молекулы при различных воздействиях [7].
Содержание ТИК в сое колеблется от 60 до 80% по массе от общего количества ингибиторов трипсина, а на долю ИББ приходится около 10–20% общей ингибирующей активности. По данным работы [8] соевая мука содержит от 1.1 до 19.6 мг ТИК/г, ИББ от <0.2 до 4.9 мг/г. В соевых белковых концентратах присутствует <0.5–6.1 мг/г ТИК и <0.2–1.0 мг/г ИББ, а содержание ТИК в белковом изоляте составляет <0.5–3.6 мг/г, ИББ от 0.3–2.0 мг/г.
Показано, что ТИК быстро инактивируется 0.1 М HCl и желудочным соком человека, что приводит к снижению на 60–70% общей ингибиторной активности соевого белкового изолята по отношению к трипсину и химотрипсину, а оставшиеся 30–40% ингибиторной активности обусловлены присутствием в сое группы ингибиторов, среди которых в количественном отношении основным является ИББ. Этот ингибитор не инактивируется в желудке при кислых значениях рН и пепсином и переходит в кишечник в неизмененном состоянии [9], где препятствует утилизации белков. Высокое содержание соевых продуктов в пище обуславливает значительное снижение протеолитической активности ферментов вследствие присутствия в их составе ингибиторов пищеварительных ферментов, и в результате происходит неполноценное расщепление белков рациона. Переваривание белков прекращается на стадии полипептидов, которые в дальнейшем не усваиваются. При этом теряется пищевой белок, что приводит к снижению веса и роста животных и заболеваниям их желудочно-кишечного тракта [10, 11]. Эксперименты с кроликами при использовании в корме соевой муки, не прошедшей предварительного нагрева, показали замедление роста животных. Было показано, что 40% этого влияния обусловлено присутствием ингибиторов трипсина, а 60% – тем, что не денатурированные белки плохо расщепляются [12]. Ингибиторы трипсина могут стимулировать увеличение секреции пищеварительных ферментов, тем самым индуцируя гипертрофию и гиперплазию поджелудочной железы [11, 13]. К настоящему времени выделены 5 изоформ ИББ – А, В, С-II, D-II и E-I, среди которых преобладающей является изоформа А. Изоформы В, С-II, D-II, E-I подробно описаны в работе [14], в которой показано, что в соевом белке изоформа А ИББ составляет более 90% от общего количества изоформ ИББ. Изоформы А и В идентичны по структуре, но различаются поведением при хроматографии, другие изоформы содержат аминокислотные замены и отличаются действием по отношению к ферментам. Например, изоформы D-II и E-I слабо ингибируют трипсин и не ингибируют химотрипсин и субтилизин, а изоформа С-II, кроме трипсина и химотрипсина, подавляет активность эластазы.
В предыдущих работах [15–17] было показано, что ферментные препараты из гепатопанкреаса камчатского краба и пилорических придатков трески, а также коммерческий ферментный препарат протосубтилин могут быть успешно использованы для гидролиза белков рапса и белков сои, полученных из обезжиренной соевой муки.
Цель работы – изучение инактивации соевых ингибиторов Кунитца и Баумана–Бирк перечисленными выше ферментными препаратами в процессе гидролиза соевых белковых изолятов.
МЕТОДИКА
Материалы. В работе использовали коммерческий соевый белковый изолят Шаньсун-90 (ООО “А-тлант”, Екатеринбург), замороженные гепатопанкреас камчатского краба (ЗАО “Арктиксервис”, г. Мурманск) и пилорические придатки трески (ОАО Мурманский траловый флот, Россия), коммерческий ферментный препарат протосубтилин Г3х (“Сиббиофарм”, Россия), коммерческий соевый ингибитор Баумана–Бирк, химические реактивы (“Sigma”, США).
Протосубтилин. Перед использованием коммерческий препарат протосубтилина промывали дистиллированной водой (1 : 10, вес/об.), отделяли нерастворимый материал центрифугированием в течение 15 мин при 25 000 g на центрифуге J2-21 (“Beckman”, США), супернатант концентрировали ультрафильтрацией через мембрану 3 кДа на ячейке Millipore (“Millipore”, США) и высушивали лиофильно.
Получение ферментного препарата из пилорических придатков трески (ФП ППТ). Замороженные ППТ гомогенизировали в 1%-ном NaCl при соотношении 1 : 20 (вес/об.), гомогенат фильтровали через мембрану 100 кДа, фильтрат высушивали лиофильно. Далее лиофилизованный материал гомогенизировали в 40 мМ трис-HCl буфере, рН 7.5, при соотношении 1 : 25 (вес/об.) и отделяли нерастворимый материал центрифугированием в течение 15 мин при 25 000 g на центрифуге J2-21 (“Beckman”, США). Супернатант концентрировали ультрафильтрацией через мембрану 3 кДа до концентрации белков 2.5 мг/мл и использовали для гидролиза белков.
Ферментный комплекс из гепатопанкреаса камчатского краба (ФП ГПКК). Комплекс выделяли из замороженного ГПКК экстракцией 0.1 М ацетатом натрия, рН 6.0, содержавшем 100 мМ NaCl, (буфер A) с последующим центрифугированием при 22 000 g на центрифуге JA-21 “Beckman” (США). Верхний жировой слой и осадок отбрасывали, а белки из супернатанта осаждали сульфатом аммония (80% насыщения). После центрифугирования при 35 000 g на центрифуге JA-21, “Beckman” (США) белки растворяли в буфере A, диализовали против этого же буфера и хранили при –20°С, либо лиофилизовали и хранили также при –20°С.
Гидролиз коммерческого соевого белкового изолята протосубтилином Г3х. Гидролиз проводили в течение различного времени при рН 7.5 и комнатной температуре. Концентрация белка в реакционной смеси составляла 3 мг/мл, соотношение фермент/субстрат – 1 : 20 или 1 : 100 (вес/об.). В течение гидролиза по мере закисления поддерживали значение рН реакционной среды, равным 7.5. Реакцию останавливали нагреванием в течение 2 мин при 90°С. Гидролизаты охлаждали и хранили в замороженном состоянии при –20°С.
Гидролиз коммерческого соевого белкового изолята ферментным препаратом из пилорических придатков трески. Гидролиз проводили в течение 1, 3 и 20 ч при комнатной температуре, концентрации белков 3 мг/мл, рН 8.0 и соотношении ФП ППТ/белок 1 : 20 или 1 : 100 (вес/вес по белку). Реакцию останавливали нагреванием реакционной смеси в течение 5 мин при 90°С. Гидролизаты охлаждали и хранили в замороженном состоянии при –20°С.
Гидролиз коммерческого соевого белкового изолята ферментным препаратом из гепатопанкреаса камчатского краба. Гидролиз проводили без предварительной денатурации белков при соотношениях ФП ГПКК/белок (1 : 5, 1 : 10, 1 : 20, 1 : 50, 1 : 100) (вес/вес по белку), рН 7.5–8.0, концентрации белка 3 или 5 мг/мл, различное время при комнатной температуре. В течение гидролиза по мере закисления реакционной смеси поддерживали рН 8.0. Реакцию останавливали нагреванием реакционной смеси в течение 5 мин при 90°С. Гидролизаты охлаждали и хранили в замороженном состоянии при –20°С.
Гидролиз коммерческого ингибитора трипсина Баумана–Бирк. Гидролиз осуществляли ферментными препаратами из ГПКК и ППТ, а также коммерческим ферментным препаратом протосубтилин в тех же условиях, что и гидролиз соевых белков.
Концентрацию белков определяли методом Брэдфорд [18].
Электрофорез в ПААГ. Электрофорез белковых препаратов и гидролизатов проводили по методу Лэмли [19] в 15%-ном ПААГ в присутствии 10%-ного ДДС-Na.
Масс-спектрометрический анализ белковых гидролизатов и гидролизатов коммерческого препарата ИББ, предварительно обработанного меркаптоэтанолом, осуществляли после разделения пептидов на нанопотоковом хроматографе EASY-nLC 1000 (“Thermo Scientific”, США). В качестве детектора использовали масс-спектрометр высокого разрешения OrbiTrap Elite (“Thermo Scientific”, Германия). Панорамные масс-спектры регистрировали в диапазоне от 500 до 2000 m/z с разрешением 240 000, фрагментацию ионов проводили в высокоэнергетической камере диссоциации HCD, спектры фрагментации записывали при разрешении 60 000. Пептиды разделяли на капиллярной колонке (150 мм × 75 мкм, “Acuity UPLC BEN300 C4 1.7 µm”, США), уравновешенной 0.05%-ной муравьиной кислотой. Разделение проводили в градиенте концентрации ацетонитрила 0–95%. Детекцию пептидов осуществляли при 220 нм и масс-спектрометрически путем разделения потока на оба детектора одновременно. Масс-хроматограммы получены при использовании детектора масс-спектрометра высокого разрешения, позволяющего определять массы продуктов, элюирующихся с хроматографической колонки в каждый момент времени.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Поскольку соевые ингибиторы трипсина оказались основным препятствием для эффективного использования соевых продуктов в рационе животных, разработаны несколько способов их инактивации в продуктах переработки сои (соевая мука, белковые концентраты и изоляты), используемых в кормах для животных и для пищи человека [1]. В табл. 1 приведено содержание ингибиторов трипсина в различных продуктах переработки сои [20]. Тепловая обработка (тостирование и экструдирование) оказалась наиболее подходящей процедурой для инактивации некоторых ингибиторов и денатурации соевых белков. Так, ТИК быстро терял активность при температуре 90–95°С, а при 105–108°С ингибиторная активность снижалась до минимума через 1–5 с. При нагревании на кипящей водяной бане ТИК инактивировался в течение 20 мин, тогда как ИББ за это же время утрачивал только 5% своей активности. ИББ выдерживал более высокую температуру нагрева и инактивировался только в диапазоне 115–121°С [21, 22]. Методом кругового дихроизма показано, что даже при кипячении на водяной бане в течение 9 ч молекулы ББИ сохраняли свою конформацию. Однако такая обработка энергетически невыгодна. При такой длительной термической обработке экспонированные на поверхности остатки ароматических аминокислоты и дисульфидные связи разрушаются, происходят реакции β-элиминирования, а содержание цистеина, серина и лизина в белках уменьшается [23].
Таблица 1.
Содержание ингибиторов трипсина и степень их деструкции в различных продуктах переработки сои [20]
| Объект исследования | Содержание ингибиторов трипсина*, г/кг продукта | Степень деструкции ингибиторов трипсина в сравнении с исходными семенами, % |
|---|---|---|
| Мука соевая обезжиренная, термически необработанная | 29.03 + 0.21 | 5.4 |
| − | ||
| Мука соевая обезжиренная, термически обработанная | 8.05 + –1.01 | 73.8 |
| Белковый концентрат сои | 5.50 + –0.11 | 82.1 |
| Белковый изолят сои | 1.92 + –0.45 | 93.7 |
| Текстурированные белки (экструдаты) | 4.38 + –0.96 | 85.7 |
В предыдущих работах [15–17] показано, что ферментные препараты из ГПКК, ППТ и коммерческий ферментный препарат протосубтилин могут успешно использоваться для гидролиза белков рапса и белков сои, полученных из обезжиренной соевой муки щелочной экстракцией при рН 8.0 или 10.0. Необходимо отметить, что все использованные ферментные препараты имели сложный состав и содержали различные наборы протеолитических ферментов. Так, ФП ГПКК содержит коллагеназы, выделяемые в особую подгруппу химотрипсиноподобных сериновых протеиназ под общим названием – брахиурины [24]. В настоящее время выделяют три типа сериновых протеиназ крабов, которые включают брахиурины Ia, обладающие широкой протеолитической специфичностью, сходной со специфичностью химотрипсина, трипсина, эластазы и коллагеназы, Ib с широкой специфичностью, но пониженной активностью по отношению к субстратам трипсина, и брахиурины II, являющиеся трипсиноподобными протеиназами. Использованный в данной работе препарат содержал 8 белковых компонентов [15]. Комплексный ферментный препарат протосубтилин, производимый бактерией Bacillus subtilis, содержит в качестве основного компонента протеолитический фермент субтилизин. Его ферментативную активность обеспечивает также комплекс нейтральных и щелочных протеаз, а также сопутствующие минорные компоненты, включающие альфа-амилазу, бета-глюконазу, ксиланазу и целлюлазу (по данным производителя). Пилорические придатки (мешковидные выросты в начале желудочно-кишечного тракта рыб) интенсивно изучаются в ряде стран, так как являются перспективным источником различных ферментов, в том числе протеолитических, участвующих в пищеварительном процессе рыб и расщепляющих белки, углеводы и жиры [25–30].
Гидролизаты коммерческого белкового изолята сои, полученные при использовании вышеперечисленных ферментных препаратов, пытались обнаружить ТИК и ИББ или их фрагменты. После фракционирования гидролизатов методом ВЭЖХ во фракциях определяли массы пептидов с использованием детектора масс-спектрометра высокого разрешения, позволяющего определять массы продуктов, элюирующихся с хроматографической колонки в каждый момент времени. В ходе анализа автоматически сравнивали аминокислотные последовательности пептидов, содержащихся в гидролизатах, с аминокислотной последовательностью соевых ингибиторов трипсина [база данных белковых структур UniProt, http://www.uniprot.org/].
На рис. 1 представлен вариант отчета такого анализа. Подчеркнуты участки аминокислотной последовательности ТИК, соответствующие пептидам, обнаруженным в гидролизатах в ходе масс-спектрометрического анализа. Показано, что в гидролизатах, полученных после действия всех трех ферментных препаратов, присутствовали фрагменты полипептидной цепи ТИК, длина которых варьировала в пределах 5–30 аминокислотных остатков. Таким образом, отсутствие в гидролизатах материала, соответствующего целым молекулам ТИК, и присутствие небольших фрагментов его аминокислотной последовательности указывало на то, что этот ингибитор, обеспечивающий 60–70% общей ингибиторной активности соевых продуктов, полностью гидролизовался использованными ферментными препаратами.
Рис. 1.
Результаты масс-спектрометрического анализа аминокислотных последовательностей пептидов ИТК (подчеркнуты) в гидролизатах коммерческого соевого белкового изолята после гидролиза ферментными препаратами из ГПКК (а), протосубтилином (б) и из ППТ (в) при соотношении ферментный препарат/белок 1 : 20 (по массе белка) и времени гидролиза 20 ч при комнатной температуре.

В то же время в гидролизатах коммерческого изолята соевых белков, методом масс-спектрометрии не были обнаружены пептиды, соответствующие аминокислотной последовательности ИББ. Для проверки устойчивости ИББ к действию использованных ферментных препаратов был проведен гидролиз коммерческого препарата ИББ с последующим анализом гидролизатов различными методами. На рис. 2 приведены результаты ВЭЖХ гидролизатов ИББ. Видно, что коммерческий препарат ИББ состоял из смеси очень близких по молекулярной массе белков (по-видимому, изоформ). Хроматограммы исходного препарата ИББ и его гидролизатов практически совпадали, за исключением присутствия в последних продуктов с несколько меньшей молекулярной массой, что указывало на отщепление очень небольших фрагментов от молекул, входящих в состав коммерческого ИББ. Поскольку молекулы изоформ ИББ характеризуются большим числом дисульфидных мостиков, при приготовлении гидролизатов для электрофореза и масс-спектрометрического анализа добавляли β-меркаптоэтанол для их восстановления до SH-групп. Это позволяло выяснить, разрывались ли в процессе гидролиза ИББ внутренние связи полипептидной цепи. Далее методом электрофореза в ПААГ в присутствии ДДС-Na, было показано, что при гидролизе действительно происходил ограниченный протеолиз его молекулы (рис. 3), который был наиболее эффективным при действии протосубтилина, в состав которого входил субтилизин. Масс-спектрометрический анализ гидролизатов коммерческого соевого ИББ (рис. 4, 5) также показал присутствие в них набора только крупных фрагментов белка, близких по молекулярному весу белкам, входящим в состав исходного препарата ИББ. При этом в гидролизатах не были обнаружены более мелкие пептидные фрагменты аминокислотной последовательности ББИ. Полученные результаты позволили предположить, что при гидролизе ФП ГПКК, ФП ППТ и коммерческим ФП протосубтилин для расщепления оказались доступны только пептидные связи, расположенные в небольших N- или С-концевых участках молекулы ББИ, в то время как основная часть молекулы, благодаря большому количеству дисульфидных связей, сохраняла свою структуру, а, следовательно, и участки связывания протеолитических ферментов. Таким образом, чрезвычайно высокая устойчивость ингибитора Баумана–Бирк по отношению к протеолитическому гидролизу обусловлена уникальными особенностями его первичной структуры.
Рис. 2.
ВЭЖХ коммерческого препарата соевого ИББ (1), после его гидролиза протосубтилином (2) и ферментными препаратами из ППТ (3) и ГПКК (4).
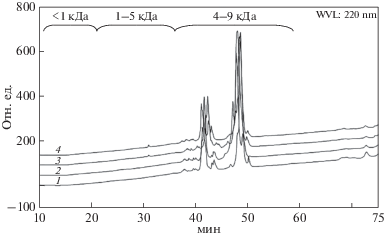
Рис. 3.
Электрофорез в ПААГ в присутствии ДДС-Na исходного коммерческого соевого ИББ (1) и его гидролизатов коммерческими протосубтилином (2) и ферментными препаратами из ППТ (3) и ГПКК (4).
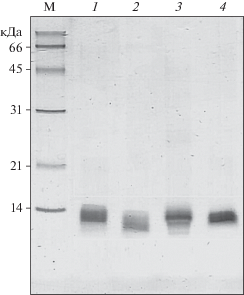
Рис. 4.
Масс-спектрометрический анализ гидролизатов (2–4) коммерческого соевого ИББ (1), полученных после гидролиза протосубтилином (2) и ферментными препаратами из ППТ (3), и ГПКК (4) при соотношении ферментный препарат/белок 1 : 20 (по массе белка) и времени гидролиза 20 ч при комнатной температуре.
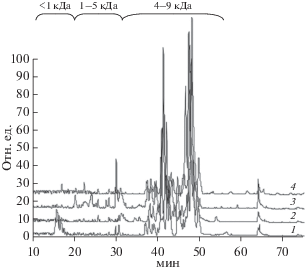
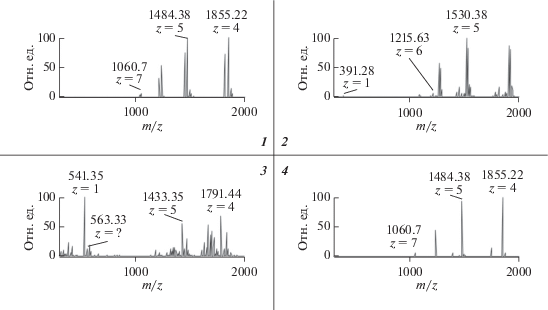
Рис. 5.
Масс-спектры продуктов гидролиза всеми изученными ферментными препаратами, которые элюировались с хроматографической колонки на 40.8 мин; z – заряд иона; масса пептидов равна произведению величин m/z и z с вычетом массы протонов, обуславливающих заряд молекулы в процессе ионизации; номера рисунков соответствуют номерам гидролизатов, указанных на рис. 4.
В заключение необходимо отметить, что, хотя соевый ИТК, который обеспечивает 60–70% общей ингибиторной активности соевых белков, полностью гидролизовался использованными ферментными препаратами, при добавлении гидролизатов соевых белков в рацион животных необходимо учитывать присутствие ИББ, подавляющего активность не только трипсина, но и химотрипсина. Особенное значение это приобретает при использовании в качестве белковой составляющей в стартовых кормах для рыбной молоди гидролизатов соевых белков вместо гидролизатов рыбной муки, поскольку один из важных технологических этапов искусственного выращивания рыб включает подращивание личинок до момента перехода на активное питание. Именно в этот период отмечают их высокую смертность (~ до 50%), обусловленную недостаточно высокой активностью собственных щелочных и кислых протеиназ кишечника у личинок. При высоком содержании соевых продуктов в корме присутствие в них ИББ обусловливает дополнительное снижение протеолитической активности ферментов, которое вызыает неполноценное их расщепление, и, как следствие, не усваивание белковых компонентов рациона.
Работа выполнена при финансовой поддержке РНФ (проект № 16-14-00133).
Список литературы
Anderson R.L., Wolf W.J. // J. Nutr. 1995. V. 125. № 3. P. 581S–587S.
Подобед Л. // Зерно. 2017. V. 7. № 136. P. 184–189.
Kunitz M. // J. Gen. Physiol. 1947. V. 30. № 4. P. 291–310.
Birk Y. // Method enzymology. 1976. V. 45. P. 695–697.
Birk Y. // Method enzymology. 1976. V. 45. P. 700–707.
Odani S., Ikenaka T. // J. Biochem. 1978. V. 83. № 3. P. 737–745.
Odani S., Ikenaka T. // J. Biochem. 1973. V. 74. № 4. P. 697–715.
Dipietro C.M., Liener I.E. // J. Food Sci. 1989. V. 54. № 3. P. 606–609.
Krogdahl A., Holm H. // J. Nutr. 1981. V. 111. № 12. P. 2045–2051.
Hackler L.R., Van Buran J.P., Streinkraus K.H., Rawi I., Hand D.D. // J. Food Science. 1965. V. 30. № 4. P. 723–728.
Holm H., Reseland J.E., Thorsen L.I., Flatmark A., Hanssen I.E. // J. Nutr. 1992. V. 122. № 7. P. 1407–1416.
Kakade M.L., Hoffa D.E., Liener I.E. // J. Nutr. 1973. V. 103. № 12. P. 1772–1778.
Kennedy A.R. // Pharmacol. Ther. 1998. V. 78. № 3. P. 167–209.
Odani S., Ikenaka T.J. // J. Biochem. 1977. V. 82. № 6. P. 1513–1522.
Муранова Т.А., Зинченко Д.В., Кононова С.В., Белова Н.А., Мирошников А.И. // Прикл. биохимия и микробиология. 2017. V. 53. № 6. P. 592–599. (Muranova T.A., Zinchenko D.V., Kononova S.V., Belova N.A., Miroshnikov A.I. // Appl. Biochem. Microbiol. 2017. V. 53. № 6. P. 680–687).
Муранова Т.А., Зинченко Д.В., Меланина Л.А., Мирошников А.И. // Прикл. биохимия и микробиология. 2018. V. 54. № 1. P. 74–81. (Muranova T.A., Zinchenko D.V., Melanina L.A., Miroshnikov A.I. // Appl. Biochem. Microbiol. 2018. V. 54. № 1. P. 76–82).
Зинченко Д.В., Муранова Т.А., Меланина Л.А., Белова Н.А. Мирошников А.И. // Прикл. биохимия и микробиология. 2018. V. 54. № 3. P. 277–285. Zinchenko D.V., Muranova T.A., Melanina L.A., Belova N.A., Miroshnikov A.I. // Appl. Biochem. Microbiol. 2018. V. 54. № 3. P. 294–300).
Bradford M.M. // Anal. Biochem. 1976. V. 72. № 7. P. 248–254.
Laemmly U.K. // Nature. 1970. V. 227. № 8. P. 680–685.
Соловьева В.Ф. // Проблемы харчування. 2003. V. 1. № 1. P. 34–37.
Chen Y., Xu Z., Zhang C., Kong X., Hua Y. // Food Chem. 2014. V. 154. № 1. P. 108–116.
He H., Li X., Kong X., Hua Y., Chen Y. // Food Chem. 2017. V. 232. № 3. P. 712–720.
Voss R.H., Ermler U., Essen I.O., Wenzl C., Kim Y.M., Flecker P. // Eur. J. Biochem. 1996. V. 242. № 1. P. 122–131.
Руденская Г.Н. // Биоорг. химия. 2003. Т. 29. № 2. С. 117–128. (Rudenskaia G.N. // Bioorg. Khim. 2003. V. 29. № 2. P. 117–128.)
Lu B.J., Zhou L.G., Cai Q.K., Hara K., Maeda A., Su W.J., Cao M.J. // Food Chem. 2008. V. 110. № 2. P. 352–360.
Khantaphant S., Benjakue S. // Food Chem. 2010. V. 120. № 3. P. 658–664.
Ronnestad I., Yúfera M., Ueberschär B., Ribeiro L., Sæle O., Izquierdo M., Boglione C. // Rev. Aquacult. 2013. V. 5. № S1. P. S59–S98.
Hamre K., Yúfera M., Rønnestad I., Boglione C., Conceição L.E., Izquierdo M. // Rev. Aquacult. 2013. V. 5. № S1. P. S26–S58.
Barnes M.E., Brown M.L., Rosentrater K.A., Sewell J.R. // Open Fish Sci. J. 2013. V. 6. P. 19–27.
Yamamoto T., Iwashita Y., Matsunari H., Sugita T., Furuita H., Akimoto A., Okamatsu K., Suzuki N. // Aquaculture. 2010. V. 309. № 1–4. P. 173–180.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


