Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 244-255
Повышение уровня продукции ловастатина и экспрессии lov-генов 1,3-диаминопропаном и спермидином через регуляцию LaeA у Aspergillus terreus
А. А. Жгун 1, *, Г. К. Нураева 1, М. В. Думина 1, Т. М. Воинова 2, В. В. Джавахия 1, М. А. Эльдаров 1
1 Институт биоинженерии, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
2 Всероссийский научно-исследовательский институт фитопатологии
143050 Московская обл., пос. Большие Вязёмы, Россия
* E-mail: Zzhgun@mail.ru
Поступила в редакцию 16.08.2018
После доработки 01.11.2018
Принята к публикации 18.12.2018
Аннотация
Симвастатин получают на основе понижающего холестерин препарата ловастатина, основным промышленным продуцентом которого является мицелиальный гриб Aspergillus terreus. Показано, что при ферментации штамма A. terreus дикого типа АТСС 20542 и его высокоактивного мутанта № 43-16 экзогенное введение таких полиаминов, как 1,3-диаминопропан или спермидин, повышало продукцию ловастатина на 20–45%. При этом максимальный уровень (10 г/л) продукции ловастатина штаммом № 43-16 наблюдался на 3 сут раньше, чем в контроле. Было обнаружено, что в этот период ферментации повышались уровни экспрессии генов биосинтеза ловастатина и laeA (глобального регулятора вторичного метаболизма грибов) при сходном профиле экспрессии генов метаболизма полиаминов в обоих штаммах.
Ловастатин (ЛОВ) − первый препарат, используемый для нормализации уровня холестерина в крови, который был одобрен в 1987 г. Управлением по контролю за продуктами и лекарствами США. Этот ценный вторичный метаболит продуцируется различными мицелиальными грибами, в том числе, представителями родов Penicillium, Monascus и др. В промышленном масштабе используют штаммы, полученные на основе Aspergillus terreus, у которых классическими методами случайного мутагенеза и селекции удалось достичь наивысшего выхода этого поликетида [1]. Так, у полученного ранее высокоактивного штамма A. terreus 43-16 (HY) продукция ЛОВ увеличивалась в 200–300 раз по сравнению с исходным штаммом дикого типа АТСС 20542 (WT) [2] и сопровождалась повышением уровня экспрессии генов кластера биосинтеза ЛОВ (lov-генов) в 5–50 раз [3].
Процессы регуляции биосинтеза вторичных метаболитов грибов исключительно сложны, тесно связаны с определенными сигналами окружающей среды и зависят от источников углерода, азота, рН среды и т.д. [4]. Эта многоуровневая иерархическая позитивная и негативная регуляция включает различные сигнальные пути, кластер-специфические и глобальные регуляторы, эпигенетические механизмы, действующие на уровни организации хроматина и т.п. [5, 6]. В работах [7–9] было показано, что эффективными индукторами биосинтеза бета-лактамов у Penicillum chrysogenum и Acremonium chrysogenum были биогенные полиамины – 1,3-диаминопропан (ДАП) и спермидин (СП). Алифатические полиамины (ДАП, путресцин, СП и спермин) широко распространены в живой природе. Наиболее изученные их функции связаны со стимуляцией роста микроорганизмов, увеличением стабильности мембран, взаимодействием с нуклеиновыми кислотами и регуляцией уровня гетерохроматина в клетке. В последнее время обнаружено, что полиамины способны регулировать процессы вторичного метаболизма у представителей царства грибов.
Так, при изучении P. chrysogenum и A. chrysogenum обнаружили индукторную роль ДАП и СП для биосинтеза бета-лактамных антибиотиков [7, 8]. В предыдущих работах [10, 11] было показано, что у высокоактивного штамма A. chrysogenum ВКМ F-4081 введенный экзогенно СП повышал в процессе ферментации выживаемость этого ослабленного продуцента (в частности, увеличивалось число прорастающих колоний и их размер) при культивировании на твердых питательных средах (ТПС), а также уровень биосинтеза цефалоспорина С. Недавно было обнаружено, что добавление СП при культивировании A. flavus стимулировало продукцию таких вторичных метабилитов, как афлатоксины [12].
Повышение продукции статинов при добавлении сравнительно дешевых низкомолекулярных полиаминов может привести к ощутимому практическому эффекту при крупномасштабном промышленном производстве.
Цель работы – изучение взаимосвязи между повышением уровня биосинтеза ЛОВ у A. terreus с изменениями в метаболизме полиаминов и/или работе глобального регулятора вторичного метаболизма грибов LaeA.
МЕТОДИКА
Штаммы, используемые в работе. Использовали штаммы A. terreus: ATCC 20542 (дикий тип), № 43-16 (высокоактивный продуцент ловастатина, получен на основе штамма ATCC 20542 методам УФ-мутагенеза [2]) и их рекомбинантные производные – АТСС 20542/LovE6, АТСС 20542/ACS5 и № 43-16/ACS3, которые экспрессировали гены lovE из A. terreus или ACS1 из Saccharomyces cerevisiae под контролем конститутивного gpdA промотора из A. nidulans [3]. Основные характеристики штаммов, использованных в работе, приведены в табл. 1.
Таблица 1.
Штаммы микроорганизмов, использованные в работе
| Штамм | Обозначение | Источник |
|---|---|---|
| А. terreus ATCC 20542 | WT | Дикий тип, коллекция микроорганизмов ATCC, США |
| А. terreus ATCC 20542/ ACS5 | А5 | Получен в результате введения гена ACS1 из S. cerevisiae в А. terreus АТСС 20542 [3] |
| А. terreus ATCC 20542/ LovE6 | Е6 | Получен в результате введения дополнительной копии гена lovE в А. terreus АТСС 20542 [3] |
| А. terreus № 43-16 | HY | Высокоактивный штамм, получен на основе ATCC 20542 [2] |
| A. terreus № 43-16/ACS3 | A3 | Получен в результате введения гена ACS1 из S.cerevisiae в А. terreus № 43-16 [3] |
Культивирование штаммов A. terreus с полиаминами на ТПС. Использовали подобранную для A. terreus агаризованные среду АТ или Чапека–Докса (ЧД) без добавок или с 5 мМ ДАП или СП (“MP Biomedicals”, США). Среда АТ имела следующий состав (г/л): глюкоза – 100, соевая мука – 20, мальт-экстракт – 5.0, мясной пептон – 5.0, NaCl – 2.0, KH2PO4 – 0.5, MgSO4 · 7H2O – 0.5, агар-аагар – 20, рН 6.1; среда ЧД (г/л): сахароза – 30, NaNO3 – 2.0, K2HPO4 – 1.0, MgSO4 · 7H 2O – 0.5, KCl – 0.5, FeSO4 · 7H2O – 0.01, агар-агар – 20.
Для определения влияния полиаминов на рост и морфологию колоний A. terreus использовали метод разведения капель с некоторыми изменениями, как описано ранее [13]. Клетки A. terreus собирали со скошенного АТ-агара, разводили 0.9%-ным раствором NaCl до оптической плотности OD600 = 0.5 (базовая концентрация) и делали последовательные 10-кратные разведения 0.9%-ным NaCl. Затем по 2 мкл вносили в чашки Петри со средой ЧД без добавок или с добавлением 5 мМ ДАП или СП, инкубировали в течение 3–5 сут (штаммы WT, E6, A5) или 6–8 сут (штаммы HY, A3) при 26°С. Влияние полиаминов оценивали по характеру роста микроорганизма при последовательном разведении на ТПС с 5 мМ ДАП или СП по сравнению с контролем (ТПС без добавок).
Ферментация штаммов A. terreus с полиаминами. Штаммы предварительно выращивали в пробирках со скошенной агаризованной AT-средой в течение 7 сут при 25°С. Выросшими культурами инокулировали 30 мл посевной среды ПAT, следующего состава (г/л): глюкоза – 100, соевая мука – 20, мальт-экстракт – 5.0, мясной пептон – 5.0, NaCl – 2.0, KH2PO4 – 0.5, MgSO4 · 7H2O – 0.5, рН 6.1. После культивирования штаммов на среде ПАТ в течение 48 ч при 26°С одной десятой объема инокулировали ферментационную среду АТ (ФAT), следующего состава (г/л): глюкоза – 200, соевая мука – 40, мальт-экстракт – 5, мясной пептон – 10, NaCl – 2, KH2PO4 – 0.5 и MgSO4 · 7H2O – 0.5, рН 6.1, с добавлением СП или ДАП до конечной концентрации, равной 5мМ. Контрольный опыт проводили в тех же условиях без добавления полиаминов. Ферментацию проводили в течение 8–11 сут при 26°С. Все этапы глубинного культивирования (на средах ПAT и ФAT) осуществляли в колбах Эрленмейера (250 мл) на качалке CERTOMAT®BS-1 (“Sartorius”, Германия) при 230 об./мин в соответствии с разработанным ранее протоколом [2]. Сухую биомассу определяли после 2-кратной промывки 10 объемами Н2О и высушивания аликвоты КЖ при 80°С в течение 96 ч до постоянного веса.
ВЭЖХ-анализ. После проведения ферментации A. terreus из культуральной жидкости экстрагировали соединения этилацетатом. Содержание ЛОВ определяли в экстрактах методом ВЭЖХ на жидкостном хроматографе Agilent 1200 (“Agilent Technologies”, США), используя хроматографическую колонку Agilent-С18 (4.6 × 250 мм) с диаметром частиц 5 мкм. Подвижная фаза содержала метанол/0.1 М уксусная кислота в соотношениях 85 и 15%, и ее расход составлял 1.0 мл/мин. Детекцию проводили при 238 нм.
Получение препаратов тРНК, кДНК, ПЦР-анализ в реальном времени (ПЦР–РВ). Получение суммарной РНК и синтез кДНК осуществляли в соответствии с протоколами, описанными ранее [13, 14]. На основании последовательностей генов lovA, lovB, lovG, ODC, SamDC, SpdS, AZ и laeA в среде Vector NTI v.8 software [15] сконструировали праймеры для оценки уровней их экспрессии (табл. 2). Использовали ранее подобранные пары праймеров для оценки уровней экспрессии других изучаемых lov-генов (lovС, lovD, lovE и lovF), определения копийности кластера генов биосинтеза ЛОВ в HY штамме и нормализацию данных (табл. 2) [3]. Реакции и обработку полученных результатов проводили в соответствии с протоколом [14], при этом для нормализации данных об уровнях экспрессии использовали гены “домашнего хозяйства”, актин и убиквитин-конъюгирующий фермент E2_6.
Таблица 2.
Структура синтетических олигонуклеотидов, использованных в работе
| Олигонуклеотид | Последовательность (5' → 3') | Источник GenBank: |
|---|---|---|
| Act_RT_F | CCACGTTACCACTTTCAACTCC | XM_001209659.1 [3] |
| Act_RT_R | GAGGAGCGATGATCTTGACCT | |
| E2_6_RT_F | TGACCAGCGAAGAAATGACA | XM_001211932.1 [3] |
| E2_6_RT_R | TTATCTTTCATCCATTTCCA | |
| LovA_RT_F1 | GCGATGTCAAGCCACTCCTCATTATG | AH007774.2 |
| LovA_RT_R1 | AGACCCAAGCTCCCAAGTACGTCAAG | |
| LovB_F1 | GCCCCATTCTATAAAAACCTGAGGATTC | AF151722 |
| LovB_R1 | AGTCCTCATTATTCGAGACTCGCAGC | |
| LovC_RT_F | GCAGAGGAGGTCTTTGACTATCG | AH007774.2 [3] |
| LovC_RT_R | GACTCGACGTTGGTGATACAGTCG | |
| LovD_RT_F | GGATCTGGACGGAGAGAACTG | |
| LovD_RT_R | CAGGGTTCCAGTTGGAAGAAC | |
| LovE_RT_F | TCGATGCGTCTACAGTGAGC | |
| LovE_RT_R | TAGCTGTCCGGTGGATCAAG | |
| LovF_RT | TTGCATCTTGCCATTCAGAG | |
| LovF_RT | TCGAGTCAAATGAGTAGGA | |
| LovG_RT_F | GCTCCGTTCCCTTCCTCTGCA | AH007774.2 |
| LovG_RT_R | GGGGTGTTGAGTCTGCCAGTCG | |
| AZ_RT_F | ATCTCAGTCTCCGAAGCGTCCTGG | CH476600.1 |
| AZ_RT_R | CGAGGATTTGTGACCGACATAAGTGG | |
| LaeA_RT_F | GGATGCACGAGAACATAATCCTGGC | NT_165972 |
| LaeA_RT_R | AACTTGTGGAAAAGATCGAGGCGATC | |
| ODC_RT_F | CCCCGGTGAGGAAGATGCGT | CH476600.1 |
| ODC_RT_R | TCGATCTCCGCCTTGGACGC | |
| SamDC_RT_F | TACACGACCTCGCCGTCATCCT | CH476605.1 |
| SamDC_RT_R | CCTTCCAGATCTCCTCCGACACG | |
| SpdS_RT_F1 | GAAGGTCCTGGTCATTGGCGGT | CH476594.1 |
| SpdS_RT_R1 | TCTTGAGGAACTCGAAGCCGTCG |
Определение числа копий кластера генов биосинтеза ЛОВ в последовательности геномной ДНК (гДНК) A. terreus. Дозу lov-генов в штаммах A. terreus ATCC 20542 и A. terreus № 43-16 определяли методом ПЦР-РВ с парами праймеров LovC_RT_F/LovC_RT_R, LovE_RT_F/LovE_ RT_R, LovF_RT_F/LovF_RT_R и Act_RT_F/Act_RT_R относительно ампликонов, полученных на матрицах с известным начальным числом копий.
Для этого предварительно получали ПЦР-фрагменты lovC, lovE, lovF и act, с перечисленными парами праймеров соответственно. Для экстракции гДНК из реакционной смеси использовали набор CleanupMini (“Евроген”, Россия). Выделение гДНК из A. terreus проводили, как описано ранее [16]. Количество очищенной ДНК в ПЦР-фрагментах и выделенной гДНК определяли на флуориметре Qubit® 4 (“Thermo Fisher Scientific”, США) с использованием набора Qubit™ dsDNA HS для количественного определения ДНК (“Thermo Fisher Scientific”, США). Для расчета молекулярной массы (Mr) гДНК использовали данные работы [17]. Mr ПЦР-фрагментов рассчитывали с использованием программы DNA Calculator в пакете он-лайн сервиса Molbiotools (http://www.molbiotools.com/dnacalculator.html), а число копий ПЦР-фрагментов и гДНК в 1 мкл раствора − по формуле (1).
(1)
${\text{ч и с л о }}\,{\text{к о п и й = }}\frac{{{\text{в е с [н г ]}} \times {\text{6}}{\text{.022}} \times {\text{1}}{{{\text{0}}}^{{23}}}}}{{{\text{1}}{{{\text{0}}}^{{\text{9}}}}{{{\text{M}}}_{{\text{r}}}}}},$Для построения калибровочных кривых делали серии последовательных разведений от 5 × 106 до 5 × 102 копий в образце. Значение Ct ПЦР-продуктов, полученных на матрице с различными разведениями гДНК, переводили в число копий, используя стандартные кривые с амплифицированными ПЦР-продуктами. Полученное число копий для каждого гена сравнивали с известным числом копий в гДНК штамма дикого типа, используемого в качестве матрицы для ПЦР. Такой же алгоритм применяли для определения числа копий у высокоактивного штамма.
РEЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Определение числа копий кластера генов биосинтеза ЛОВ A. terreus № 43-16. Известно, что процесс получения высокоактивных продуцентов внеклеточных метаболитов в грибах методом случайного мутагенеза и селекции может сопровождаться хромосомными перестройками, затрагивающими кластер генов целевого метаболита [18]. К важнейшим перестройками относятся дупликации. Дупликации кластеров генов внеклеточных метаболитов обнаружены у многих высокоактивных продуцентов. Так, в штаммах P. chrysogenum P2, AS-P-78 и BW1901 число кластеров генов биосинтеза бета-лактамов увеличено от 2 до 14 [19–21], а у промышленного продуцента DS17690 оказалось 8 копий кластеров этих генов [22, 23]. Однако для многих грибных штаммов, полученных таким способом, подобные изменения отсутствуют. Так, сверхпродукция ЦефС штаммом A. chrysogenum ВКМ F-4081D не была связана ни с повышением дозы гена [14], ни с другими хромосомными перестройками кластеров “ранних” и “поздних” генов биосинтеза бета-лактамов [24]. Дупликации кластеров генов (в том числе, биосинтеза поликетидов) и их последующее функциональное разобщение в грибах может проходить в естественных условиях, что позволяет организму более тонко управлять изменениями уровня продукции метаболита в ответ на различные сигналы окружающей среды [25]. Полногеномное секвенирование штамма A. terreus дикого типа показало наличие одного кластера генов биосинтеза ЛОВ [17]. В связи с этим на первом этапе требовалось определить, увеличилось ли число копий в процессе получения HY штамма A. terreus.
Для определения количества копий кластера lov-генов в последовательности гДНК использовали метод ПЦР-РВ. Полученные результаты четко показали, что у высокоактивного продуцента A. terreus № 43-16 имелась одна копия кластера генов биосинтеза ЛОВ (табл. 3). При этом уровень продукции ЛОВ в этом штамме был увеличен более чем в 100 раз по сравнению с исходным штаммом дикого типа АТСС 20542 (табл. 4). Ранее также было показано значительное увеличение экспрессии lov-генов (в 5–50 раз) A. terreus 43-16 [3]. Это позволяло сделать вывод, что молекулярные основы повышения выхода ЛОВ у HY штамма связаны не с повышением дозы генов, а с изменением регуляции генов имеющегося биосинтетического кластера.
Таблица 3.
Количественная оценка числа копий lov-генов в штаммах A. terreus
| Показатель | Количество используемой гДНК | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 5 × 105 | 5 × 104 | 5 × 103 | ||||||||||
| Ген | act | lovC | lovE | lovF | act | lovC | lovE | lovF | act | lovC | lovE | lovF |
| Штамм | A. terreus ATCC 20542 | |||||||||||
| Количество амплифицированного ПЦР продукта | 3.7 ×105 | 5.1 × 105 | 7.2 × 105 | 5.5 × 105 | 6.3 × 104 | 4.4 × 104 | 4.9 × 104 | 4.7 × 104 | 5.7 × 103 | 5.1 × 103 | 5.4 × 103 | 7.3 × 103 |
| Число копий | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
| Штамм | A. terreus 43-16 | |||||||||||
| Количество амплифицированного ПЦР продукта | 5.4 × 105 | 5.5 × 105 | 6.2 × 105 | 5.9 × 105 | 4.9 × 104 | 5.4 × 104 | 5.9 × 104 | 5.1 × 104 | 3.9 × 103 | 7.1 × 103 | 5.5 × 103 | 4.3 × 103 |
| Число копий | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
Влияние полиаминов на скорость роста штаммов A. terreus при культивировании на агаризованных средах. Полученные результаты по определению числа копий кластера lov-генов создали предпосылки для дальнейшего изучения молекулярного контроля биосинтеза ЛОВ A. terreus. Известно, что полиамины оказывают плейотропное воздействие на микроорганизмы. В частности, показано, что экзогенно введенные полиамины, способны влиять на продукцию вторичных метаболитов грибов. Добавление СП или ДАП может повышать на 10–15% выход таких NRPS-метаболитов, как пенициллин G (penG) [7] или ЦефС [26]. При этом происходит рост уровня экспрессии как соответствующих генов биосинтеза бета-лактамов, так и универсального регулятора вторичного метаболизма грибов laeA [7, 26]. Может ли биосинтез таких вторичных метаболитов поликетидной природы, как ЛОВ, также находиться под контролем полиаминов – вопрос, который приобретает особую актуальность в связи с тем, что у изучаемого HY штамма отсутствовали дупликации кластера lov-генов, а значительное повышение продукции ЛОВ достигалось вследствие изменения регуляции экспрессии входящих в него генов.
На первом этапе изучили влияние полиаминов на рост штаммов A. terreus WT, HY и их рекомбинантных аналогов (E6, A5 и A3) на ТПС. Для этого использовали метод разведения капель на полусинтетической среде ЧД и изучили действие ДАП и СП в диапазоне концентраций от 0.1 до 10 мМ. Добавление 10 мМ полиаминов оказалось токсичным для клеток, а добавление в концентрациях от 0.1–1.0 мМ приводило к незначительным изменениям уровня роста. Наиболее выраженное стимулирующее действие наблюдали при концентрациях 5 мМ ДАП или СП (рис. 1). На ранних этапах роста добавление полиаминов приводило к появлению колоний в результате инокуляции меньшей начальной дозой клеток A. terreus. Так, после 72 ч инкубации на среде без полиаминов WT штамм давал начало колониям после инокуляции посевным материалом, разведенным до концентрации 10–3 (от базовой концентрации при OD600 = 0.0005). На среде ЧД после добавления ДАП появлялись колонии после инокуляции ТПС материалом, разведенным до 10–4 (рис. 1). Штамм E6 с введенной дополнительной копией lovE демонстрировал более активный рост по сравнению с исходным штаммом WT. На среде без добавок при тех же условиях культивирования наблюдали появление колоний, соответствующих посевной дозе, разведенной до 10–4. На среде, содержащей 5 мМ СП или ДАП (рис. 1а, 2) прорастали колонии при разведении 10–5. Такие же результаты были получены при культивировании штамма А5 на средах с 5 мМ полиаминов. Оба высокоактивных штамма HY и его рекомбинантный аналог А3 по скорости роста заметно отставали от штаммов WT и его производных (рис. 1б). Между собой эти штаммы демонстрировали похожий рост. Так, на ТПС без добавок после 72 ч инкубации наблюдали рост колонии на разведениях до 10–2, а добавление 5 мМ ДАП или СП (рис. 1б, 2) стимулировало рост примерно на порядок. Стимулирующее воздействие полиаминов на скорость роста штаммов A. terreus было отмечено в начале культивирования (48–72 ч). Затем контрольные образцы по уровню роста догоняли соответствующие штаммы на ТПС с полиаминами.
Рис. 1.
Анализ воздействия полиаминов на рост штаммов A. terreus WT и E6 (а) и HY и A3 (б) методом разведения капель при культивировании в течение 72 ч при 26°С на агаризованной среде ЧД после добавления 5 мМ ДАП и СП (2), (1 – контроль).

Подобный эффект стимулирующего воздействия полиаминов на рост мицелиальных грибов был обнаружен ранее при культивировании в их присутствии штаммов Penicillium chrysogenum или Aspergillus chrysogenum [9, 26]. Поскольку стимулирующее воздействие ДАП или СП при культивировании на ТПС A. chrysogenum сопровождалось повышением продукции CPC в процессе ферментации, то на следующем этапе работы оценивали влияние полиаминов на синтез ЛОВ при глубинном культивировании штаммов A. terreus.
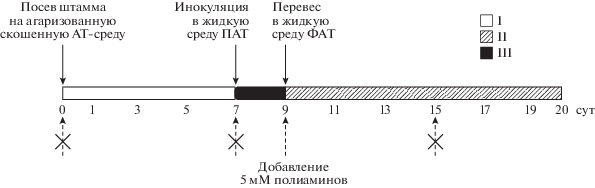
Влияние полиаминов на уровень биомассы, продукцию и удельный выход ЛОВ в процессе ферментации штамма HY A. terreus. Вначале изучили влияние полиаминов на продукцию ЛОВ в процессе ферментации высокоактивного штамма A. terreus № 43-16. Ранее для этого продуцента был оптимизирован процесс ферментации в глубинных условиях в колбах Эрленмейера на 250 мл [2, 3]. В подобранных условиях ферментация протекала 11 сут, продукцию ЛОВ наблюдали, начиная с 5 сут, а затем она стремительно нарастала к 7–9 сут. Далее скорость биосинтеза ЛОВ падала, при этом увеличивалось суммарное количество этого стабильного метаболита. Данные о среднем уровне продукции ЛОВ, удельной активности и сухой биомассы штамма HY A. terreus при ферментации в колбах Эрленмейера c 5 мМ ДАП (или СП) в течение 8 и 11 сут приведены на рис. 2. Полный процесс культивирования, включая подготовку посевного материала и момент добавления полиаминов, представлен на рис. 3. Инокулят штамма A. terreus предварительно культивировали в течение 7 сут на скошенной агаризованной среде АТ, затем засевали жидкую среду ПАТ и культивировали 48 ч, после чего одной десятой объема культуральной смеси инокулировали ферментационную среду ФАТ. Полиамины добавляли на этапе передачи инокулята с ПAT-среды на среду ФAT, поскольку было показано, что этот период ферментации являлся оптимальным для экзогенного внесения полиаминов для повышения продукции вторичного метаболита при ферментации мицеллиальных грибов [7, 26]. В таких условиях наблюдали увеличение продукции ЛОВ при культивировании на среде ФАТ в течение 8 сут. Добавление 5 мМ ДАП приводило к повышению выхода ЛОВ на 30%, а СП – на 45% (рис. 2а). При этом абсолютный выход ЛОВ в контроле составлял в среднем 6500 мг/л, а в отдельных колбах достигал 7500. При добавлении ДАП средний выход ЛОВ был ~ 8700 мг/л, а в отдельных колбах наблюдали до 9700 мг/л. При добавлении СП средний выход ЛОВ оказался на уровне 9500 и достигал 10 900 мг/л. Такой выход ЛОВ обычно наблюдали после окончания ферментации при культивировании без добавок [3]. Также было определено количество сухой биомассы (рис. 2б, 1). Культивирование с ДАП приводило к его падению на 10%, а добавление СП − более чем на 15%. Эти данные могли свидетельствовать о токсичности полиаминов или их действии на формирование тех или иных морфологических форм A. terreus, например, пеллетов, подробно охарактеризованных ранее [27, 28]. Оказалось, что при добавлении ДАП в ферментационную среду штаммов удельная активность ЛОВ при пересчете на сухую биомассу возрастала примерно на 40% при внесении ДАП и на 70% – СП (рис. 2в, 1).
Рис. 2.
Продукция ЛОВ (мкг/мл, а), накопление биомассы (мг/мл, б) и удельная продукция ЛОВ (мкг/мг сухого веса, в) при ферментации штамма A. terreus № 43-16 с ДАП (5 мМ, II) и СП (5 мМ, III) на среде ФАТ течение 8 (1) и 11 (2) сут при 26°С; контроль (I).
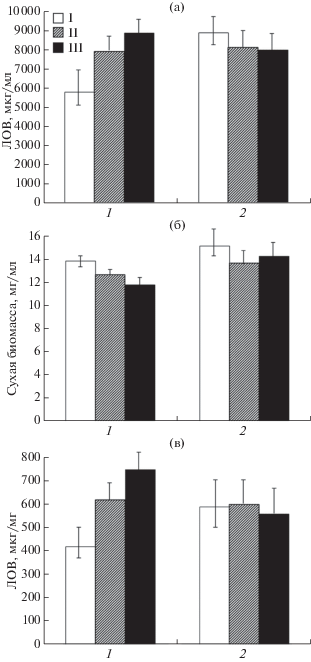
Рис. 3.
Оптимизация этапов биосинтеза ЛОВ штаммами A. terreus с экзогенно введенными полиаминами на агаризованной скошенной АТ-среде (I) и жидких средах ПАТ (II) и ФАТ (III). Этапы культивирования при подготовке и в процессе ферментации показаны стрелкой, а оптимальное время для экзогенного введения полиамина – пунктирной стрелкой; возможное, но не оптимальное время добавления полиамина – перечеркнутой стрелкой.
После окончания ферментации (11 сут) в контроле наблюдали значительный прирост (на 60–65%) продукции ЛОВ по сравнению с 8 сут. При этом незначительно возросло содержание сухой биомассы (в пределах 10%), а удельный выход ЛОВ повысился на 50–55%. К окончанию ферментации продукция ЛОВ в штаммах с экзогенно-введенным ДАП повышалась значительно меньше, чем в контроле, ее прирост составлял ~20%. При этом наблюдали рост содержания сухой биомассы и удельной активности ЛОВ на 10%. При добавлении СП средний рост выхода ЛОВ был незначительным, составив менее 10%, а прирост сухой биомассы оказался выше 20%, в результате чего удельная активность снизилась на 10%.
Добавление полиаминов привело к значительному повышению продукции ЛОВ на 8 сут роста, при этом выход был сопоставим с выходом в контроле на 11 сут роста. Дальнейшее культивирование от 8 до 11 сут приводило к существенному приросту содержания ЛОВ в контроле (до 55%), но не в культурах с полиаминами (только 10–20%). Так, на 11 сут ферментации содержание ЛОВ во всех колбах оказалось примерно одинаковым и в абсолютных величинах составляло от 10 000 до 11 500 мг/л, при этом в контроле оно было несколько выше. Количество ЛОВ в культурах с ДАП снижалось на 3%, а с СП – на 5% (рис. 3a, 2). После 8 сут роста содержание сухой биомассы в культурах с полиаминами существенно снижалось, особенно в тех, в которые вносили СП, при этом наблюдалось максимальное повышение продукции ЛОВ. Затем происходил одинаковый прирост сухой биомассы в контроле и культурах с ДАП, а при внесении СП ее прирост оказался в 2 раза выше, но при этом уменьшался прирост ЛОВ. Так, к окончанию ферментации (11 сут) в колбах с добавленным СП содержание сухой биомассы снижалось незначительно (примерно на 5%) по сравнению с тем, которое было определено после 8 сут (среднее снижение составляло 17.5%). Можно предположить, что эти данные отражали множественные процессы, возникающие при добавлении полиаминов, в частности, характеризовали снижение их токсичности для клеток (рис. 3б). Удельный выход ЛОВ после 11 сут выровнялся, как в контроле, так и культуре с добавленным СП, а в культурах с ДАП оказался выше на 5% (рис. 3в, 2).
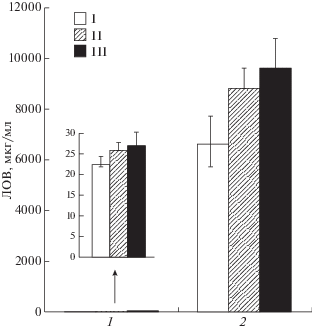
Анализ уровней продукции ЛОВ и экспрессии генов его биосинтеза в штаммах A. terreus WT и HY при экзогенном введении полиаминов в процессе ферментации. Изучение влияния полиаминов на уровень биосинтеза ЛОВ в процессе ферментации позволило выбрать оптимальное время для повышения продукции этого поликетидного вторичного метаболита. Поскольку при добавлении полиаминов максимальный эффект обнаруживался при культивировании на ФАТ в течение 8 сут при 26°С, это время и было выбрано для дальнейшего изучения процесса продукции вторичного метаболита на молекулярном уровне. Результаты определения продукции ЛОВ штаммами A. terreus WT и HY после 8 сут ферментации приведены на рис. 4. В этот период ферментации продукция ЛОВ HY штаммом повышалась в 250–300 раз. Добавление полиаминов приводило к повышению биосинтеза ЛОВ, как у WT (на 15–20%), так и у HY штаммов (на 30–45%). Максимальный эффект наблюдали при добавлении СП (рис. 4). Эти результаты представляются важными, поскольку показывают, что полиамины могут воздействовать на уровень продукции вторичных метаболитов грибов не только штаммами-суперпродуцентами, у которых в процессе случайного мутагенеза и селекции важнейшие ресурсы клетки переориентированы и мобилизованы на продукцию целевого метаболита. Отбираются ли в процессе улучшения грибных штаммов изменения в метаболизме ПА? Например, такие, которые могли снижать уровень его биосинтеза для перераспределения метаболических потоков в пользу целевого метаболита. Экзогенное введение полиаминов в такие улучшенные штаммы могло бы комплементировать дефекты биосинтеза его эндогенных форм. Однако тот факт, что у A. terreus полиамины стимулировали продукцию ЛОВ также и штаммом дикого типа (рис. 4), свидетельствовал о том, что экзогенные его формы влияли на некие универсальные механизмы регуляции вторичных метаболитов у грибов.
Рис. 4.
Уровень продукции ЛОВ при ферментации штаммов A. terreus WT (1) и HY (2) с ДАП (5мМ, II) и СП (5мМ, III) в течение 8 сут при 26°С; контроль (I). Ферментация A. terreus WT (1) показана на врезке (цена деления оси ординат увеличена в 400 раз).
На рис. 5 приведены уровни относительной генной экспрессии lov-генов штаммами A. terreus WT и HY после 8 сут ферментации без добавок и в присутствии 5 мМ СП. Видно, что у штамма HY lov-гены сверхэкспрессированы. Ранее этот эффект продемонстрировали на примере 4 lov-генов (lovC, lovD, lovE и lovF), для которых наблюдали увеличение экспрессии в 5–50 раз [3]. В данной работе дополнительно изучили экспрессию гена цитохрома Р450 (lovA), необходимого для окислительного гидроксилирования дигидромонаколина L до монаколина J, и нонакетида синтазы (lovВ), основной мегасинтазы биосинтеза ЛОВ, создающей нонакетидный остов синтезируемого метаболита. Также была изучена экспрессия гена тиоэстеразы (lovG), открытой последней среди ферментов биосинтеза ЛОВ, но которая необходима для высвобождения дигидромонаколина L из комплекса с LovB [29] и полный набор биосинтетических lov-генов (lovA, lovВ, lovC, lovD, lovF и lovG). Показано, что lovA в штамме HY сверхэкспрессировался в 30–35 раз, lovВ – примерно в 20 раз, lovG – в 2–3 раза. Таким образом, у высокоактивного штамма HY все 6 биосинтетических lov-генов при сохранении их дозы (1 копия) и ген-регулятор биосинтеза ЛОВ (lovE) оказались сверхэкспрессированы. В связи с этим возникал вопрос, в результате каких (или какого) воздействий произошла такая синхронная апрегуляция, и носили ли эти воздействия глобальный характер, затрагивающий другие метаболизмы, или мишень находилась внутри последовательности lov-кластера.
Рис. 5.
Нормализованная экспрессия генов lovA (а), lovB (б), lovC (в), lovD (г), lovE (д), lovF (е) и lovG (ж) после культивирования в течение 8 сут штаммов A. terreus ATCC 20542 (1) и № 43-16 (2) без добавок (I) и с 5 мМ СП (II).
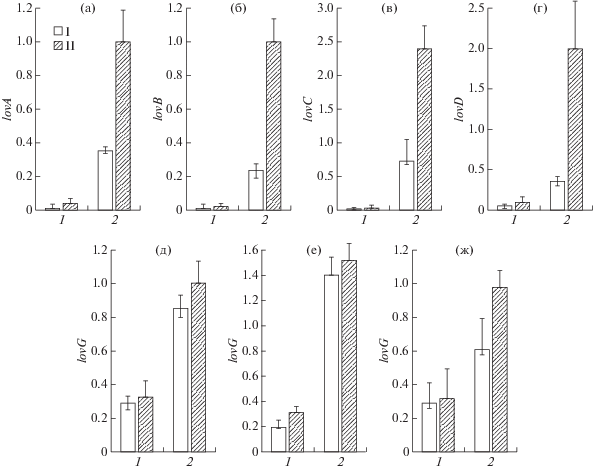
На рис. 5 приведены результаты, показывающие, что добавление 5 мМ СП (при ферментации в течение 8 сут) повышало экспрессию большинства биосинтетических генов у обоих сравниваемых штаммов A. terreus. При добавлении СП к штамму WT наблюдали повышение экспрессии lovA (в 2–3 раза), lovВ (в 1.5–2 раза), lovD (в 1.2–1.5 раз) и lovF (в 1.5–1.8 раз), при этом экспрессия lovC, lovE и lovG была немного выше контроля (рис. 5). У высокоактивного штамма добавление СП приводило к росту экспрессии lovA (в 2–3 раза), lovВ (в 3–5 раз), lovС (в 2–3 раза), lovD (в 4–6 раз) и lovG (в 1.5 раза), а повышение экспрессии lovE и lovF оказалось немного выше уровня контроля.
Таким образом, при ферментации в течение 8 сут с добавлением 5 мМ СП повышалась экспрессия lov-генов. У штамма WT уровень экспрессии увеличивался в 3 раза, штамма HY – в 5 раз и выше. Эти данные коррелировали с наблюдаемым уровнем повышения продукции ЛОВ при культивировании с СП (рис. 4). У штамма HY при добавлении 5 мМ СП значительнее увеличивался выход ЛОВ (до 45%) по сравнению с контролем (штамм HY без 5мМ SP), чем у штамма WT при добавлении СП (до 20%) по сравнению с его контролем (штамм WT без 5мМ SP).
Анализ уровней экспрессии генов метаболизма полиаминов и регуляции вторичных метаболитов грибов (laeA) штаммами A. terreus WT и HY после экзогенного введения полиаминов в процессе ферментации. Для определения возможного воздействия полиаминов на регуляцию метаболизма ЛОВ в штаммах A. terreus была изучена экспрессия генов, кодирующих ключевые ферменты их метаболизма. Известно, что существует гомеостаз концентраций полиаминов в клетке, и он поддерживается ферментами их биосинтеза и катаболизма [30]. К одному из ключевых ферментов биосинтеза полиаминов относится орнитиндекарбоксилаза (ornithine decarboxylase, ODC) [31]. Этот короткоживущий и динамично регулируемый фермент катализирует превращение L-орнитина в путресцин. На рис. 6 видно, что при ферментации на среде без полиаминов в течение 8 сут, уровни экспрессии гена ODC штаммами дикого типа и его высокоактивным аналогом практически совпадали. Добавление экзогенного СП заметно (в 3–4 раза) снижало содержание мРНК ODC в клетках обоих штаммов (рис. 6а). Другая важная регуляция содержания эндогенных полиаминов связана с S-аденозилметионин декарбоксилазой (S-adenosylmethionine decarboxylase, SamDC). Опосредованное SamDC декарбоксилирование S-аденозилметионина (SAMe) приводит к образованию декарбоксилированного S-аденозинметионинамина (dcSAMe) – важного субстрата для биосинтеза полиаминов. Видно, что уровень экспрессии гена SamDC высокоактивным продуцентом ЛОВ и исходным штаммом дикого типа был одинаковым и не изменялся при добавлении к ним 5 мМ СП (рис. 6б). Эти результаты коррелировали с полученными недавно данными при изучении влияния экзогенного введения 0.5 мМ СП на уровень экспрессии ODC и SamDC A. flavus [12]. Уровень экспрессии ODC падал (в 2–3 раза), а уровень экспрессии SamDC – немного повышался.
Рис. 6.
Нормализованная экспрессия генов ODC (а), SamDC (б), SpdS (в), AZ (г) и laeA (д) после культивирования в течение 8 сут штаммов A. terreus ATCC 20542 (1) и № 43-16 (2) без добавок (I) и с 5 мМ СП (II).
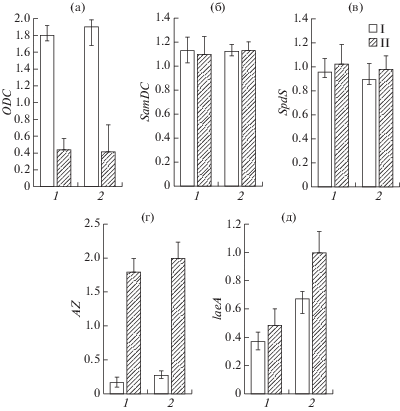
Один из ключевых ферментов биосинтеза полиаминов, спермидинсинтаза (spermidine synthase, SpdS), использует dcSAMe для синтеза СП в реакции аминопропилирования путресцина. У обоих сравниваемых штаммов при культивировании на среде ФАТ без добавок или в присутствии СП уровень экспрессии гена SpdS практически не изменялся (рис. 6в). Ранее было показано, что экспрессия этого гена была необходима для нормального развития, патогенеза и продукции афлатоксинов A. flavus. Добавление в ходе культивирования этого фитопатогена 0.5 мМ СП не изменяло уровень его экспрессии [12]. Для уменьшения концентрации полиаминов в клетке используются несколько механизмов. Так, N1-ацетилирование СП или спермина, катализируемое ферментом, спермидин-ацетилтрансферазой (spermidine acetyltransferase, SAT), приводит к их последующему катаболизму [32]. Другой механизм связан со снижением уровня эндогенного синтеза, который запускается реакцией превращения L-орнитина в путресцин, катализируемой ODC. Белок антизим (antizyme, AZ) служит антагонистом ODC. AZ эффективно связывается и инактивирует ODC, а образующийся гетеродимерный комплекс (ODC/AZ) служит эффективным субстратом для 26S протеосомной убиквитин-независимой деградации [31]. В данной работе показано, что содержание гена AZ в контролях обоих штаммов было примерно одинаковым, а добавление СП увеличивало его экспрессию в 5–7 раз – рис. 6г).
Таким образом, показано, что уровень экспрессии генов метаболизма полиаминов (ODC, SamDC, Spds и AZ) оказался примерно одинаковым в штаммах WT и HY. Можно предположить, что при создании штамма HY не произошло серьезных изменений в регуляции экспрессии рассматриваемых генов метаболизма ПА. Экзогенное введение СП приводило к похожим изменениям уровня экспрессии этих генов. Уровень экспрессии ODC падал, AZ – рос, а SamDC и Spds практически не изменялся. Такой же ответ генов метаболизма полиаминов продемонстрирован в недавней работе с другим фитопатогеном из рода Aspergillus, A. flavus [12]. Заметное снижение уровня экспрессии ODC (до 4 раз) и одновременное увеличение уровня экспрессии AZ (до 7) может быть связано с одной точкой регуляции, а именно, биосинтезом путресцина из L-орнитина. Добавление экзогенного СП подавляло процессы эндогенного синтеза путресцина, являющего исходным субстратом для синтеза других полиаминов.
При сравнении уровня экспрессии генов биосинтеза ЛОВ и метаболизма полиаминов видно, экспрессия lov-генов высокоактивным штаммов значительно увеличена, а экспрессия pа-генов не изменена (рис. 5 и 6). Добавление экзогенного СП при выбранных условиях ферментации повышало выход ЛОВ у обоих штаммов, увеличивало экспрессию lov-генов и изменяло экспрессию pa-генов. Изменения экспрессии как lov-генов, так pa-генов носили сходный профиль для обоих штаммов. При этом экспрессия lov-генов была увеличена в 3−50 раз только у штамма HY. Можно предположить, что эндогенный метаболизм полиаминов не является основным фактором, служащим причиной сверхэкспресии биосинтетических lov-генов и выхода ЛОВ. Известно, что экзогенные полиамины способны увеличивать продукцию вторичных метаболитов в грибах [8, 12, 26].
Для изучения взаимосвязи между метаболизмом полиаминов и биосинтезом ЛОВ был определен уровень экспрессии гена laeA (рис. 6д). SAMe-зависимая метилаза гистонов (LaeA) является фактором ремоделирования хроматина, роль которого изучена у A. terreus. Показано, что этот фермент действует в качестве глобального регулятора вторичного метаболизма у мицеллиальных грибов, [33–36]. Уровень экспрессии laeA у штамма HY оказался повышенным в 2 раза, с этим могла быть связана наблюдаемая сверхэкспресия генов кластера биосинтеза ЛОВ. Добавление 5 мМ СП повышало экспрессию laeA, как штаммом WT (в 1.2 раза), так и в HY (в 1.5 раза). Недавно было показано, что добавление 0.5 мМ СП к A. flavus AF70 WT может, как увеличивать экспрессию laeA (в 2.6 раз), так и повышать продукцию афлатоксинов (AFB1 и AFB2) [12].
В работе показано, что уровень laeA увеличивался в ответ на добавление СП. Этот феномен впервые был обнаружен в работах, в которых было установлено, что добавление СП (или его метаболита, ДАП) к P. chrysogenum повышало продукцию penG и экспрессию кластера генов биосинтеза бета-лактамов и laeA [8, 9]. Можно предположить, что эти изменения связаны с присутствием субстрата SAMe, общего для биосинтеза полиаминов и функционирования LaeA. Подобный эффект наблюдался у штаммов A. chrysogenum. Так, добавление ДАП или СП повышало продукцию ЦефС, уровень экспрессии генов “ранних” и “поздних” кластеров биосинтеза бета-лактамов и экспрессии laeA [26]. Было высказано предположение, что экзогенное введение полиаминов может снижать потребление SAMe для их эндогенного синтеза, при этом увеличивается пул SAMe, что повышает эффективность работы LaeA, положительного регулятора биосинтеза ЦефС [26]. В результате проведенного исследования показано, что существует взаимосвязь между экзогенным введением СП и, с одной стороны, продукцией ЛОВ, а с другой − уровнем экспрессии lov-генов и laeA.
Полученные данные могут быть использованы как для понимания особенностей регуляции биосинтеза ЛОВ A. terreus, так и общих принципов регуляции вторичных метаболитов грибов. Использование относительно дешевых полиаминов потенциально может сократить время промышленного биосинтеза ЛОВ. Однако для понимания общей картины регуляции его биосинтеза и влияния на этот процесс полиаминов требуется дальнейшее изучение работы как белков-партнеров LaeA (VeA, VelB, VosA и VelC [37]), так и других ферментов, вовлеченных в их метаболизм (ADC, AGM, САТ и PAO) [38].
Список литературы
Barrios-González J., Miranda R.U. // Appl. Microbiol. Biotechnol. 2010. V. 85. № 4. P. 869–883.
Пaтeнт PФ. 2005. № 2261901.
Жгун А.А., Думина М.В., Воинова Т.М., Джавахия В.В. Эльдаров М.А. // Прикл. биохимия и микробиология. 2018. Т. 54. № 2. С. 175–185.
Demain A.L. Biosynthesis and Molecular Genetics of Fungal Secondary Metabolites, Fungal Biology / Eds. Martín J.F., Garcia-Estrada C., Zeilinger S. N.Y.: Springer, 2014. 339 p.
Macheleidt J., Mattern D.J., Fischer J., Netzker T., Weber J., Schroeckh V., Valiante V., Brakhage A.A. // Annu. Rev. Genet. 2016. V. 23. № 50. P. 371–392.
Martín J.F. // J. Ind. Microbiol. Biotechnol. 2017. V. 44. № 4–5. P. 525–535.
Martín J., García-Estrada C., Kosalková K., Ullán R.V., Albillos S.M., Martín J.F. // Fungal Genet. Biol. 2012. V. 49. № 12. P. 1004–1013.
García-Estrada C., Barreiro C., Jami M.S., Martín-González J., Martín J.F. // J. Proteomics. 2013. V. 85. P. 129–159.
Martín J., García-Estrada C., Rumbero A., Recio E., Albillos S.M., Ullán R.V., Martín J.F. // Appl. Environ. Microbiol. 2011. V. 77. № 16. P. 5688–5696.
Жгун А.А., Иванова М.А., Домрачева А.Г., Новак М.И., Эльдаров М.А., Скрябин К.Г., Барташевич Ю.Э. // Прикл. биохимия и микробиология. 2008. Т. 46. № 6. С. 663–670.
Эльдаров М.А., Скляренко А.В., Думина М.В., Медведева Н.В., Жгун А.А., Сатарова Д.Э., Сидоренко А.И., Епремян А.С., Яроцкий С.В. // Биомед. химия. 2015. Т. 61. № 5. С. 5–12.
Majumdar R., Lebar M., Mack B., Minocha R., Minocha S., Carter-Wientjes C., Sickler C., Rajasekaran K., Cary J.W. // Front. Plant Sci. 2018. V. 9. P. 317.
Думина М.В., Жгун А.А., Керпичников И.В., Домрачева А.Г., Новак М.И., Валиахметов А.Я., Кнорре Д.А., Северин Ф.Ф., Эльдаров М.А., Бартошевич Ю.Э. // Прикл. биохимия и микробиология. 2013. Т. 49. № 4. С. 372–381.
Dumina M.V., Zhgun A.A., Novak M.I., Domratcheva A.G., Petukhov D.V., Dzhavakhiya V.V., Eldarov M.A., Bartoshevitch Iu.E. // World J. Microbiol. Biotechnol. 2014. V. 30. № 11. P. 2933–2941.
Lu G., Moriyama E.N. // Brief. Bioinform. 2004. V. 5. № 4. P. 378–388.
Zhgun A.A., Avdanina D.A., Potapov M.P., Stepanov M.G., Shitov M.V. // Znan.Misel J. 2018. V. 20. № 1. P. 6–13.
Savitha J., Bhargavi S.D., Praveen V.K. // Genome Announc. 2016. V. 4. № 3. P. e00491-16.
Nijland J.G., Ebbendorf B., Woszczynska M., Boer R., Bovenberg R.A., Driessen A.J. // Appl. Environ. Microbiol. 2010. V. 76. № 21. P. 7109–7115.
Barredo J.L., Díez B., Alvarez E., Martín J.F. // Curr. Genet. 1989. V. 16. № 5–6. P. 453–459.
Fierro F., Barredo J.L., Díez B., Gutierrez S., Fernández F.J., Martín J.F. // Proc. Natl. Acad. Sci. U. S. A. 1995. V. 92. № 13. P. 6200–6204.
Newbert R.W., Barton B., Greaves P., Harper J., Turner G. // J. Ind. Microbiol. Biotechnol. 1997. V. 19. № 1. P. 18–27.
Harris D.M., van der Krogt Z.A., Klaassen P., Raamsdonk L.M., Hage S., van den Berg M.A., Bovenberg R.A., Pronk J.T., Daran J.M. // BMC Genomics. 2009. V. 10. № 75. P. 1–20.
Salo O.V., Ries M., Medema M.H., Lankhorst P.P., Vreeken R.J., Bovenberg R.A., Driessen A.J. // BMC Genomics. BioMed Central. 2015. V. 16. № 937. P. 1–15.
Думина М.В., Жгун А.А., Домрачева А.Г., Новак М.И., Эльдаров М.А. // Генетика. 2012. Т. 48. № 8. С. 918–925.
Zeng G., Zhang P., Zhang Q., Zhao H., Li Z., Zhang X., Wang C., Yin W.B., Fang W. // PLoS Genet. Public Library of Science, 2018. V. 14. № 6. P. e1007472.
Жгун A.A., Калинин С.Г., Новак М.И., Домрачева А.Г., Петухов Д.В., Джавахия В.В., Эльдаров М.А. Бартошевич Ю.Э.// Известия вузов. Прикл. химия и биотехн. 2015. Т. 14. № 3. С. 47–54.
Rodríguez Porcela E.M., Casas Lópeza J.L., Sánchez Péreza J.A., Fernández Sevillaa J.M., Chistib Y. // Biochem. Eng. J. 2005. V. 26. № 2–3. P. 139–144.
Bizukojc M., Ledakowicz S. // Adv. Biochem. Eng. Biotechnol. 2015. V. 149. P. 133–170.
Xu W., Chooi Y.H., Choi J.W., Li S., Vederas J.C., Da Silva N.A., Tang Y. // Angew Chem. Int. Ed. Engl. 2013. V. 52. № 25. P. 6472–6475.
Perez-Leal O., Merali S. // Amino Acids. 2012. V. 42. № 2–3. P. 611–617.
Miller-Fleming L., Olin-Sandoval V., Campbell K., Ralser M. // J. Mol. Biol. 2015. V. 427. № 21. P. 3389–3406.
Mandal S., Mandal A., Johansson H.E., Orjalo A.V., Park M.H. // Proc. Natl. Acad. Sci. U.S.A. 2013. V. 110. № 6. P. 2169–2174.
Bok J.W., Keller N.P. // Eukaryot. Cell. 2004. V. 3. № 2. P. 527–535.
Teresa P., Armando M., Javier B.-G. // Int. J. Curr. M-icrobiol. App. Sci. 2015. V. 4. № 10. P. 537–555.
Niu J., Arentshorst M., Nair P.D., Dai Z., Baker S.E., Frisvad J.C., Nielsen K.F., Punt P.J., Ram A.F. // G3 (Bethesda). 2016. V. 6. № 1. P. 193–204.
Palonen E.K., Raina S., Brandt A., Meriluoto J., Keshavarz T., Soini J.T. // Microorganisms. 2017. V. 5. № 1. P. E12(1–23).
Sarikaya-Bayram Ö., Palmer J.M., Keller N., Braus G.H., Bayram Ö. // Front. Microbiol. 2015. V. 6. № 1. P. 1–7.
Valdés-Santiago L., Ruiz-Herrera J. Polyamines in Fungi: their Distribution, Metabolism, and Role in Cell Differentiation and Morphogenesis/Boca Raton, U.S.A.: CRC Press, 2015. 186 p.
Casas Lópeza J.L, Sánchez Péreza J.A., Fernández Sevillaa J.M., Acién Fernándeza F.G., Molina Grimaa E., Chistib Y. // Enzyme Microb. Technol. 2003. V. 33. № 2–3. P. 270–277.
Vilches Ferrón M.A., Casas López J.L., Sánchez Pérez J.A., Fernández Sevilla J.M., Chisti Y.// World J. Microbiol. Biotechnol. 2005. V. 21. № 2. P. 123–125.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


