Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 293-302
Разработка экспрессной иммунохроматографической тест-системы для детекции D-димера
Н. А. Бызова 1, А. В. Жердев 1, С. М. Придворова 1, Б. Б. Дзантиев 1, *
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: dzantiev@inbi.ras.ru
Поступила в редакцию 15.10.2018
После доработки 22.11.2018
Принята к публикации 18.12.2018
Аннотация
Разработана тест-система для экспрессного определения маркера коагуляции и фибринолиза D-димера, основанная на принципе иммунохроматографии в “сэндвич”-формате. Тест-система позволяет количественно определять D-димер в плазме в диапазоне концентраций от 0.1 до 4.0 мкг/мл, охватывая нормальный, пограничный и патологический уровни D-димера. Точность определения при тестировании проб плазмы составляла 2–8%. Диагностические чувствительность и специфичность определения относительно клинического порога различия нормального и патологического уровня D-димера (0.5 мкг/мл) – 95 и 97% соответственно. Продолжительность анализа – 10 мин. Тестирование проб плазмы не требовало их разведения и другой предварительной подготовки. Разработанная иммунохроматографическая тест-система может представлять перспективное аналитическое средство для экспрессного обнаружения D-димера.
Диагностика в сфере здравоохранения часто базируется на анализе проб крови не только из-за относительной простоты, но и потому, что многие специфически связанные с заболеванием биомолекулы циркулируют в ней [1, 2]. К таким маркерам заболеваний относится белок D-димер (молекулярная масса 2 × 105 Да), который образуется в результате деградации фибрина в плазме (фибринолиза) и содержит два соединяющихся D-фрагмента белка фибриногена. Содержание D-димера в крови используют для характеристики патологических изменений в системе коагуляции [3–5]. Повышение в ней уровня D-димера наблюдается при таких заболеваниях, как диссеминированная внутрисосудистая коагуляция, тромбоз глубоких вен, тромбоэмболия легких, обширные повреждения тканей, сердечная недостаточность и воспалительные процессы [5–7]. Клинический порог различия нормального и патологического уровней D-димера составляет 0.5 мкг/мл [8]. Исключения наблюдают у беременных женщин и пожилых людей, у которых порог повышается до 1–1.5 мкг/мл [9, 10].
В современной клинической практике определение содержания D-димера основано на использовании моноклональных антител. Форматы анализа включают латекс-агглютинацию [11], иммуноферментный анализ (ИФА) [8], микрофлюидные бумажные устройства [12] и иммунохроматографический анализ (ИХА) [13]. Последний из них обладает несомненными преимуществами по сравнению с другими иммунохимическими методами: быстротой (5–15 мин) и простотой анализа, возможностью визуальной оценки результата и диагностики на месте отбора пробы, а также отсутствием пробоподготовки [14].
К настоящему времени иммунохроматографические (ИХ) тесты для контроля D-димера разработаны и коммерциализованы компаниями “Biognostic” и “Preventis” (Германия), “VedaLab” (Франция), “Clearview” (США). Компания “Roche Diagniostics” (Германия) предлагает ИХ-тест для количественного определения концентрации D-димера в комплекте с анализатором Сobas h 232. Во всех этих тест-системах цельную (венозную или капиллярную) кровь или плазму разбавляют от 3 до 10 раз специальным буфером, входящим в состав набора. Эта процедура увеличивает продолжительность анализа и удорожает его.
Важной дополнительной задачей настоящей работы было определение требований к используемым в тест-системе наночастицам золота (НЧЗ), которые наиболее распространены в ИХА в качестве маркера [15]. НЧЗ различного размера могут быть получены путем изменения условий синтеза [16]. Однако вопрос об их оптимальном размере для ИХА остается открытым. Существуют эмпирические рекомендации по использованию НЧЗ в ИХА со средним диаметром 30–40 нм, но характеристики определяемого соединения и формат анализа могут существенно повлиять на этот выбор [17–19]. В настоящей работе проводили сравнение аналитических характеристик тест-систем определения D-димера, изготовленных с использованием НЧЗ различного диаметра.
Цель работы – разработка и характеристика иммунохроматографической тест-системы, которую можно использовать без предварительной пробоподготовки и дополнительных реагентов для детекции D-димера в плазме крови.
МЕТОДИКА
Реактивы. В работе использовали нативный человеческий D-димер, мышиные моноклональные антитела против D-димера, клоны 18D9, 25D5, 41D2 и 138D2 (“Биалекса”, Россия), антитела козы (GAMI) против иммуноглобулинов G мыши (“Arista Biologicals”, США), фибриноген из плазмы человека, конъюгат стрептавидина с пероксидазой, N-гидроксисукцинимидный эфир биотина, дигидрохлорид 3,3',5,5'-тетраметилбензидина (TMБ), трис, Тритон Х-100, этилендиаминтетрацетат натрия (ЭДТА), золотохлористоводородную кислоту (ЗХВК), цитрат натрия, азид натрия (“Sigma”, США), диметилсульфоксид (ДМСО), Твин-20 (“MP Biomedicals”, Великобритания) и бычий сывороточный альбумин (БСА) (“Biowest”, Франция).
Все вспомогательные реагенты (соли, кислоты, щелочи и органические растворители) были аналитической или химической чистоты.
Растворы для получения НЧЗ и их конъюгатов с антителами готовили на деионизированной воде (система Simplicity, “Millipore”, США, удельное сопротивление при 25°С не менее 18.2 MОм × см).
ИФА проводили в 96-луночных прозрачных полистироловых микропланшетах Costar 9018 (“Corning Costar”, США). Для изготовления иммунохроматографических тест-полосок использовали закрепленную на твердой основе нитроцеллюлозную мембрану CNPС с размером пор 15 мкм, мембрану для нанесения конъюгата НЧЗ с антителами PT-R7, сепарирующую мембрану GFB-R4 и конечную адсорбирующую мембрану AP045 (все – производства “Advanced Microdevices”, Индия).
Образцы плазмы с добавлением цитрата или ЭДТА здоровых доноров и пациентов с подтвержденными диагнозами сепсис, тромбоз, тромбоэмболия и послеоперационные осложнения были любезно предоставлены сотрудником биологического факультета МГУ им. М.В. Ломоносова А.Е. Коганом.
Биотинилирование антител. Биотинилирование антител проводили согласно [20]. 200 мкл раствора антител (100 мкмоль) в 50 мМ калий-фосфатном буфере, рН 7.4, содержащим 0.1 М хлорид натрия, (ФБС) смешивали с раствором N-гидроксисукцинимидного эфира биотина в ДМСО (1 ммоль) и инкубировали в течение 2 ч при комнатной температуре и непрерывном перемешивании. Избыток не прореагировавших низкомолекулярных реагентов удаляли диализом против ФБС.
“Сэндвич”-ИФА D-димера. Антитела в концентрации 1 мкг/мл в ФБС иммобилизовали в лунках микропланшета из объема 100 мкл в течение ночи при 4°С. Затем четырехкратно промывали микропланшет ФБС, содержащим 0.05% Тритона Х-100, (ФБСТ). Далее в лунки вносили по 50 мкл раствора D-димера (диапазон концентраций от 0.01 до 10 мкг/мл) в ФБСТ и по 50 мкл биотинилированных антител (1 мкг/мл) в ФБСТ. Микропланшет инкубировали в течение 1 ч при 37°С, промывали, добавляли в лунки по 100 мкл стрептавидина, конъюгированного с пероксидазой (разведение 1 : 5000 в ФБСТ), и снова инкубировали 1 ч при 37°С. После промывки определяли пероксидазную активность связавшейся с носителем ферментной метки. Для этого в лунки микропланшета вносили по 100 мкл 0.4 мМ раствора TMБ в 40 мМ натрий-цитратном буфере, рН 4.0, содержащем 3 мМ пероксида водорода, инкубировали в течение 15 мин при комнатной температуре, останавливали реакцию добавлением 50 мкл 1 М серной кислоты и измеряли оптическую плотность при 450 нм (D450) на микропланшетном спектрофотометре Zenyth 3100 (“Anthos Labtec Instruments”, Австрия).
Зависимость оптической плотности (y) от концентрации антигена в пробе (x) аппроксимировали 4-параметрической сигмоидной функцией
Синтез НЧЗ. НЧЗ были синтезированы по методу Френса [21] с модификациями [16]. К 98.25, 98.0, 97.5, 96.0 или 94.0 мл деионизированной воды добавляли 1.0 мл 1%-ного водного раствора ЗХВК и доводили до кипения. Затем при перемешивании вносили 0.75, 1.0, 1.5, 3.0 или 5.0 мл 1%-ного водного раствора цитрата натрия соответственно. Смеси кипятили в течение 25 мин, охлаждали и хранили при 4–6°С. Полученные препараты были обозначены как НЧЗ1–НЧЗ5. Спектры препаратов НЧЗ регистрировали с помощью спектрофотометра Biochrom Libra S60 (“Biochrom”, Великобритания).
Просвечивающая электронная микроскопия (ПЭМ). ПЭМ НЧЗ проводили по описанной ранее методике [21] с использованием микроскопа CX-100 (“Jeol”, Япония). Фотографии в цифровой форме анализировали с использованием программы Image Tool (“University of Texas Health Science Centre at San Antonio”, США).
Получение флоккуляционных кривых. Флоккуляционные кривые были получены по методу, описанному в [20]. Антитела диализовали против 1000-кратного объема 10 мМ трис-HCl буфера, рН 9.0, в течение 2 ч при 4°C. К раствору НЧЗ (D520 = 1.0) добавляли 0.1 М карбонат калия до достижения рН 9.0. К 0.1 мл растворов антител (концентрации варьировали от 5 до 250 мкг/мл) добавляли по 1.0 мл раствора НЧЗ (D520 = 1.0), перемешивали и инкубировали 10 мин при комнатной температуре. Затем добавляли 0.1 мл 10%-ного водного раствора хлорида натрия, перемешивали и через 10 мин измеряли D580. Зависимость D580 от концентрации антител использовали для выбора соотношений антител и НЧЗ при синтезе конъюгатов.
Синтез конъюгатов антитела–НЧЗ. Были синтезированы две серии конъюгатов антитела–НЧЗ: антитела клонов 18D9, 25D5, 41D2 и 138D2 с НЧЗ3 и антитела клона 41D2 с НЧЗ1, НЧЗ2, НЧЗ4 и НЧЗ5.
В соответствии с описанной ранее методикой [23] в растворы антител клонов 18D9, 25D5, 41D2 и 138D2 (рН 9.0) вносили раствор НЧЗ3 (D520 = 1.0, рН 9.0). Концентрации антител, которые были выбраны на основании флоккуляционных кривых, как описано в разделе “Результаты и их обсуждение”, составили 8, 20, 8 и 10 мкг/мл соответственно. Смеси инкубировали в течение 30 мин при комнатной температуре и перемешивании, после чего вносили водный раствор БСА до конечной концентрации 0.25%. НЧЗ3 с иммобилизованными на них антителами отделяли от не связавшихся антител центрифугированием в течение 30 мин при 15 000 g и 4°С на центрифуге Allegra 64R (“Beckman Coulter”, США). Осадок суспендировали в 20 мМ трис-HCl буфере, рН 7.6, содержащем 1.0% БСА, 1.0% сахарозы, 0.1% твина 20 и 0.1% азида натрия (трис-БСА).
В растворы антител клона 41D2 с концентрациями 8, 8, 10 и 12 мкг/мл вносили растворы НЧЗ1, НЧЗ2, НЧЗ4 и НЧЗ5 (D520 = 1.0, рН 9.0) соответственно и синтезировали конъюгаты, как описано выше. Конъюгаты 41D2 с НЧЗ1, НЧЗ2, НЧЗ4 и НЧЗ5 отделяли от не связавшихся антител центрифугированием при 6000, 10 000, 20 000 и 22 000 g в течение 30 мин и 4°С и суспендировали в буфере трис-БСА. Препараты конъюгатов хранили при 4–6°С.
Изготовление иммунохроматографических тест-полосок. Реагенты наносили на мембраны, входящие в состав тест-системы, автоматическим диспенсером IsoFlow (“Imagene Technology”, США). Для формирования контрольной зоны (КЗ) использовали раствор 1.0 мг/мл антител GAMI в ФБС, содержавшем 0.25% БСА, 0.25% сахарозы и 0.1% азида натрия, а тестовой зоны (ТЗ) – растворы 1.0 мг/мл специфичных к D-димеру антител в том же буфере. На 1 см ширины рабочей нитроцеллюлозной мембраны наносили 2.0 мкл обеих указанных выше растворов. Конъюгаты НЧЗ с антителами наносили на стекловолоконные мембраны в разведениях, соответствующих D520 = 6.0 (16.0 мкл на 1 см ширины мембраны PT-R7). Мембраны с нанесенными иммунореагентами высушивали на воздухе при комнатной температуре не менее 20 ч. Из этих двух мембран, а также мембраны для сепарации пробы и конечной адсорбирующей мембраны собирали мультимембранные композиты и получали из них тест-полоски шириной 3.5 мм, используя автоматический гильотинный нарезчик Index Cutter-1 (“A-Point Technologies”, США). Тест-полоски вместе с расфасованным по 0.6 г силикагелем, применяемым в качестве осушителя, герметично упаковывали в пакеты из комбинированного материала на основе алюминиевой фольги с помощью запаивателя с миниконвейером FR-900 (“Wenzhou Dingli Packing Machinery”, Китай). Нарезку и упаковку проводили при комнатной температуре в специальном помещении с относительной влажностью воздуха не более 30%. Упакованные тест-полоски хранили при комнатной температуре.
Иммунохроматографический анализ. Анализ проводили при комнатной температуре. Вскрывали пакет, извлекали тест-полоску и в вертикальном положении погружали ее нижний конец на 1 мин в аликвоту пробы (70 мкл), после чего помещали тест-полоску на горизонтальную поверхность. Через 10 мин после начала анализа контролировали результат. Измерения каждой пробы проводили в трех повторах.
Цифровое изображение тест-полоски получали, используя сканер Canon CanoScan 9000F (“Canon”, Япония). Интенсивность окрашивания зон связывания рассчитывали с помощью программы TotalLab TL120 (“Nonlinear Dynamics”, Великобритания), как описано в [22]. Зависимость интенсивности окрашивания ТЗ от концентрации антигена в пробе обрабатывали с использованием программного обеспечения Origin 7.5 аналогично ИФА.
Концентрацию антигена, вызывающую 20%-ное ингибирование максимального связывания (IC20), рассчитывали с использованием этой функции. Данный уровень D-димера соответствовал достоверному отличию от фона по критерию “трех сигм” и поэтому использовался для оценки предела обнаружения в ИХА.
Апробация разработанных тест-полосок на пробах плазмы больных и здоровых доноров. В соответствии со стандартными статистическими процедурами [24] тест-полоски применяли для характеристики проб плазмы больных и здоровых доноров. Концентрации D-димера в пробах были подтверждены референс-методом (см. “Результаты и их обсуждение”), который включал иммуноферментный анализ с использованием набора “Д‑димер-ИФА-БЕСТ” (“Вектор-Бест”, Россия). Анализ проводили в соответствии с инструкцией предприятия-изготовителя к набору.
На основании сравнения результатов, полученных с использованием двух методов, определяли аналитические характеристики ИХА. Диагностическую чувствительность рассчитывали как долю положительных результатов ИХА среди проб с подтвержденным положительным диагнозом, а диагностическую специфичность – как долю отрицательных результатов ИХА среди проб с подтвержденным отрицательным диагнозом.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Выбор формата иммуноанализа. Белок D-димер является поливалентным антигеном. Для высокочувствительной иммунодетекции поливалентных антигенов оптимален “сэндвич”-формат ИФА и ИХА, основанный на образовании комплексов иммобилизованное антитело–антиген–меченое антитело. Известно, что данный формат характеризуется возможностью обнаружения меньших концентраций антигена в пробе по сравнению с альтернативными форматами, а качественная оценка результатов ИХА сводится к заключению о наличии или отсутствии окрашивания в тестовой зоне тест-полоски [25].
Характеристика специфических антител. Для реализации “сэндвич”-иммуноанализа использовали антитела против D-димера, клоны 18D9, 25D5, 41D2 и 138D2 (“Биалекса”, Россия). Антигенсвязывающие свойства этих антител характеризовали в “сэндвич”-формате ИФА. Были сопоставлены 16 вариантов ИФА, отличающиеся выбором антител для иммобилизации на твердой фазе и мечения ферментом. Для введения метки в образующиеся иммунные комплексы использовали биотинилированные антитела в сочетании с конъюгатом стрептавидин–пероксидаза. Результаты представлены в табл. 1.
Таблица 1.
Аналитические параметры “сэндвич”-ИФА D-димера – IC20 (мкг/мл) и D (ед. ОП) продукта ферментативной реакции при концентрации D-димера, равной 10 мкг/мл
| Адсорбированные антитела | Конъюгат антител с биотином | |||
|---|---|---|---|---|
| 18D9–Бт | 25D5–Бт | 41D2–Бт | 138D2–Бт | |
| 18D9 | IC20 = 2.5 | IC20 = 0.15 | IC20 = 0.15 | IC20 = 0.15 |
| D = 0.3 | D = 1.0 | D = 1.1 | D = 0.8 | |
| 25D5 | IC20 = 1.5 | IC20 = 0.3 | IC20 = 0.05 | IC20 = 0.15 |
| D = 0.3 | D = 0.9 | D = 1.2 | D = 0.6 | |
| 41D2 | IC20 = 2.5 | IC20 = 0.2 | IC20 = 0.08 | IC20 = 0.1 |
| D = 0.2 | D = 0.9 | D = 1.2 | D = 0.8 | |
| 138D2 | IC20 = 2.5 | IC20 = 0.3 | IC20 = 0.05 | IC20 = 0.07 |
| D = 0.3 | D = 1.0 | D = 1.2 | D = 0.7 | |
Как видно, минимальный предел обнаружения антигена, 0.05 мкг/мл, обеспечивали две комплектации тест-системы, при которых в лунках микропланшета были иммобилизованы антитела 25D5 или 138D2, а с биотином конъюгированы антитела 41D2. Однако сочетания антител, обеспечивающие минимальный предел обнаружения, могут не совпадать для равновесного (иммуноферментного) и кинетического (иммунохроматографического) форматов анализа. Поэтому было целесообразно реализовать и сопоставить все возможные варианты ИХА.
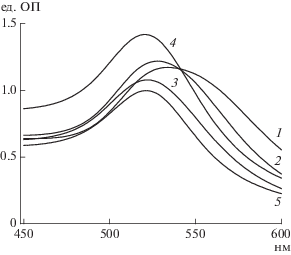
Получение и характеристика реагентов для иммунохроматографии. Цитратным методом были синтезированы пять препаратов НЧЗ (НЧЗ1–НЧЗ5). На рис. 1 приведены их спектральные характеристики. Видно, что с увеличением диаметра частиц наблюдалось смещение максимумов спектров поглощения их растворов в длинноволновую область (520, 522, 524, 528 и 534 нм для препаратов НЧЗ5, НЧЗ4, НЧЗ3, НЧЗ2 и НЧЗ1 соответственно).
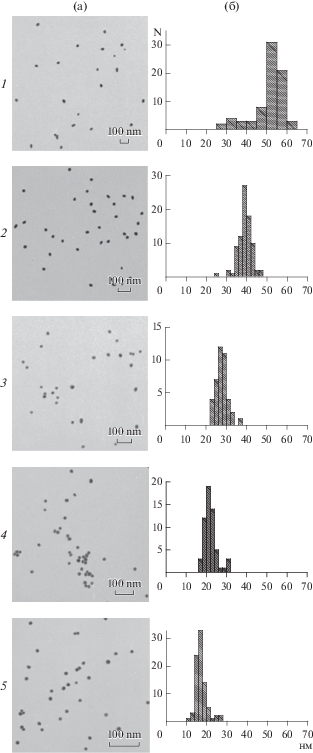
Размеры и однородность НЧЗ определяли с помощью ПЭМ, результаты которой представлены на рис. 2. Показано, что форма НЧЗ во всех пяти препаратах была близка к сферической и препараты не содержали агрегатов. Для электронно-микроскопических изображений частиц (по данным 60–90 измерений) были определены значения средних диаметров, которые составили 51.1 ± 7.9 (рис. 2, 1), 39.2 ± 3.5 (рис. 2, 2), 28.3 ± 3.3 (рис. 2, 3), 21.9 ± 3.3 (рис. 2, 4) и 16.3 ± 2.8 нм (рис. 2, 5).
Рис. 2.
Электронные микрофотографии (1–5, а) и гистограммы распределения препаратов НЧЗ1–НЧЗ5 по диаметру (нм) (1–5, б). Размеры выборок N – 60–90 частиц.
Концентрации антител, использованные при синтезе конъюгатов с НЧЗ, устанавливали на основании флоккуляционных кривых, отражающих агрегацию конъюгатов при высокой ионной силе, как описано в [20]. Были выбраны концентрации антител, на 10–15% превосходящие точки выхода D580 на плато, как рекомендовано в [20]. Для препарата НЧЗ3 (средний диаметр частиц 28.3 нм) эти величины составили 8 для клонов 18D9 и 41D2, 10 для клона 138D2 и 20 мкг/мл для клона 25D5. Для этих условий синтеза мольное соотношение антитела : НЧЗ3 в реакционной смеси равнялось 260 : 1, 320 : 1 и 640 : 1 соответственно, являясь избыточным по сравнению с соотношением 180 : 1, которое для НЧЗ данного размера обеспечивало монослойную иммобилизацию антител (оценка проводилась, исходя из средней площади контакта молекулы антитела с поверхностью НЧЗ, равной 20 нм2). Для НЧЗ1 (средний диаметр частиц 51.1 нм), НЧЗ2 (39.2 нм), НЧЗ4 (21.9 нм) и НЧЗ5 (16.3 нм) оптимальные концентрации антител клона 41D2 составили 8, 8, 10 и 12 мкг/мл соответственно, что также обеспечивало монослойную иммобилизацию антител.
Выбор комплектации иммунохроматографической тест-системы. Для предварительного исследования были изготовлены 16 видов иммунохроматографических тест-систем с использованием четырех препаратов антител и их конъюгатов с НЧЗ среднего диаметра (НЧЗ3; 28.3 нм). Для каждой комплектации, используя пробы ФБСТ с добавленным D-димером, были получены зависимости интенсивности окрашивания ТЗ от концентрации D-димера и вычислены аналитические параметры ИХА (табл. 2). Как следует из представленных в табл. 2 результатов, шесть вариантов адсорбированных антител и их конъюгатов с НЧЗ3 позволили детектировать D-димер в концентрациях до 0.04–0.05 мкг/мл и 10 вариантов – в концентрациях, равных или превосходящих 0.1 мкг/мл. Из шести наиболее чувствительных вариантов два имели также максимальную интенсивность окрашивания ТЗ, равную 150 отн. ед.
Таблица 2.
Аналитические параметры “сэндвич”-ИХА D-димера – IC20 (мкг/мл) и интенсивность окрашивания (I, отн. ед.) тестовой зоны тест-полоски при концентрации D-димера, равной 10 мкг/мл
| Адсорбированные антитела | Конъюгат антител с НЧЗ | |||
|---|---|---|---|---|
| 18D9–НЧЗ | 25D5–НЧЗ | 41D2–НЧЗ | 138D2–НЧЗ | |
| 18D9 | IC20 = 0.3 I = 95 |
IC20 = 0.3 I = 32 |
IC20 = 0.1 I = 140 |
IC20 = 0.05 I = 140 |
| 25D5 | IC20 = 0.05 I = 130 |
IC20 = 3.0 I = 8 |
IC20 = 0.04 I = 150 |
IC20 = 0.13 I = 150 |
| 41D2 | IC20 = 0.1 I = 105 |
IC20 = 0.3 I = 38 |
IC20 = 0.1 I = 145 |
IC20 = 0.04 I = 140 |
| 138D2 | IC20 = 0.05 I = 130 |
IC20 = 0.3 I = 12 |
IC20 = 0.04 I = 150 |
IC20 = 0.3 I = 130 |
Специфичность ИХ-тест-систем характеризовали по реакции с фибриногеном. Перекрестную реактивность с фибриногеном наблюдали в двух случаях из шестнадцати, когда в ТЗ были сорбированы антитела клонов 41D2 или 138D2, а с НЧЗ3 конъюгированы антитела клона 41D2.
Таким образом, представлялся предпочтительным следующий вариант тест-системы: в ТЗ были сорбированы антитела клона 25D5, а с НЧЗ конъюгированы антитела клона 41D2. Для этого варианта тест-системы было изучено влияние размера НЧЗ на аналитические параметры. Были синтезированы препараты антител клона 41D2 с НЧЗ большего (НЧЗ1 и НЧЗ2) и меньшего (НЧЗ4 и НЧЗ5) диаметров и проведено определение в пробах ФБСТ с добавленным D-димером.
Как следует из представленных в табл. 3 результатов, минимальный предел детекции D-димера и максимальная интенсивность окрашивания ТЗ достигались в тест-системе с НЧЗ2 (средний диаметр 39.2 нм). Конъюгат 41D2 с НЧЗ1 (средний диаметр 51.1 нм) оказался нестабильным и неспецифически окрашивал ТЗ в отсутствии D-димера. Время выхода интенсивности окрашивания ТЗ на постоянную величину во всех пяти вариантах тест-систем было одинаковым и составляло 8–9 мин, что связано, по-видимому, с использованием крупнопористой нитроцеллюлозной мембраны, рекомендуемой производителями для анализа образцов сыворотки и плазмы крови.
Таблица 3.
Аналитические параметры “сэндвич”-ИХА D-димера в ФБСТ с использованием конъюгатов антител клона 41D2 с НЧЗ1–НЧЗ5 и антител клона 25D5 в тестовой зоне
| Препарат НЧЗ | Средний диаметр НЧЗ, нм | IC20, мкг/мл | I, отн. ед. | Время выхода окрашивания на постоянную величину, мин |
|---|---|---|---|---|
| НЧЗ5 | 16.3 | 0.16 | 125 | 8 |
| НЧЗ4 | 21.9 | 0.16 | 134 | 8 |
| НЧЗ3 | 28.3 | 0.04 | 150 | 9 |
| НЧЗ2 | 39.2 | 0.02 | 160 | 9 |
| НЧЗ1 | 51.1 | 0.02 | 145 | 9 |
На основании полученных результатов для дальнейшей работы выбрали вариант тест-системы, при котором в тестовой зоне иммобилизованы антитела клона 25D5, а антитела клона 41D2 конъюгированы с НЧЗ2.
Изготовление выбранного варианта тест-системы. Исходя из данных, описанных в предыдущих работах [23, 26], реагенты в контрольную и тестовую зоны наносили из объемов 2.0 мкл на 1 см ширины нитроцеллюлозной рабочей мембраны, что обеспечивало равномерность иммобилизации и при проведении анализа минимальный разброс между изготовленными в одной серии тест-полосками по степени связывания окрашенного маркера. Для формирования контрольной зоны использовали раствор 1.0 мкг/мл GAMI, для формирования ТЗ – раствор 1.0 мкг/мл антител 25D5.
Конъюгат 41D2–НЧЗ2 наносили из раствора с D520 = 6.0 при скорости 16.0 мкл на 1 см ширины стекловолоконной мембраны [23, 26]. Это обеспечивало формирование интенсивно окрашенных зон в ходе анализа в сочетании с полнотой вымывания реагента из стартовой зоны и отсутствием неспецифического окрашивания рабочей мембраны.
Формирование мультимембранного композита проводили в условиях, выбранных в ходе предыдущих исследований [22] и соответствующих общепринятой практике [27]. После нанесения реагентов мембраны высушивали не менее 20 ч при комнатной температуре и последовательно закрепляли на полистироловой подложке таким образом, чтобы их края перекрывались на 1–2 мм. Полученный композит нарезали на тест-полоски, которые с осушителем упаковывали в герметичные пакеты.
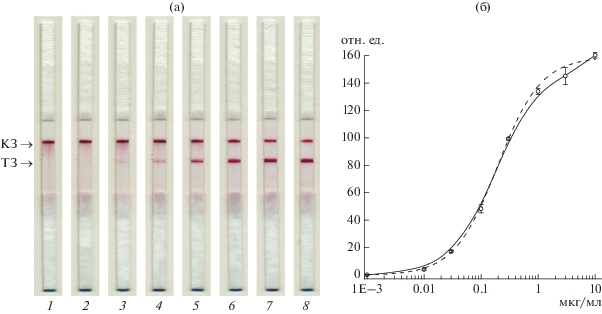
Характеристика разработанной иммунохроматографической тест-системы. Для предварительной оценки возможностей тест-системы было охарактеризовано определение D-димера в ФБСТ. На рис. 3 представлены результаты тестирования проб с разной концентрацией D-димера в ФБСТ. Предел обнаружения D-димера составлял 20 нг/мл, точность определения (среднеквадратичное отклонение регистрируемой интенсивности окрашивания) – 4–6%.
Рис. 3.
Внешний вид тест-полосок после проведения иммунохроматографического определения D-димера в ФБСТ: а − КЗ и ТЗ при концентрации D-димера 0 (1), 0.01 (2), 0.03 (3), 0.1 (4), 0.3 (5), 1.0 (6), 3.0 (7) и 10.0 (8) мкг/мл; б − зависимость интенсивности окрашивания ТЗ (отн. ед.) от концентрации D-димера, мкг/мл. Зависимость интенсивности окрашивания ТЗ (y) от концентрации антигена в пробе (x) аппроксимировали (пунктирная линия) функцией y = (A − D)/(1 + (x/C)B) + D, где A = – 2.01, D = 160.25, C = 0.20, B = 1.04.
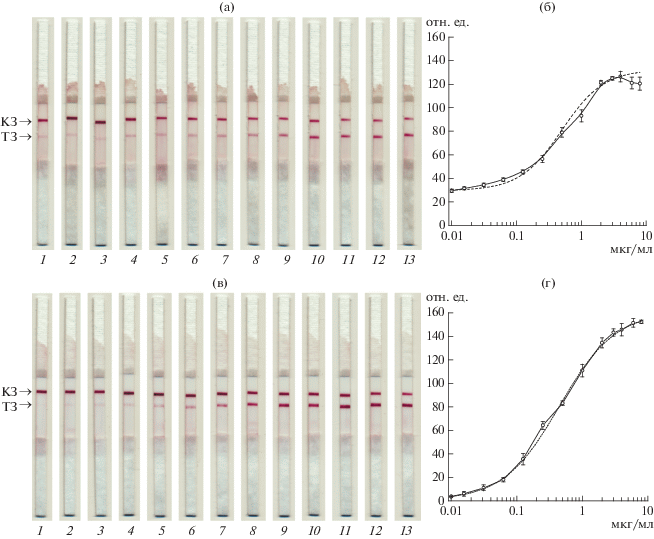
Определяли содержание D-димера, добавленного в пулированную плазму здоровых доноров. В плазме здорового человека концентрация D-димера составляет 0.15–0.2 мкг/мл [8], что соответствует первой точке на полученной концентрационной зависимости (рис. 4а, тест-полоска 1 и рис. 4б). При разбавлении плазмы в 10 раз ФБСТ концентрация D-димера снижалась до порогового уровня и аналитические параметры градуировочной кривой приближались к значениям для определения D-димера в ФБСТ. Как следует из представленных на рис. 4г результатов, рабочий диапазон определяемых концентраций D-димера составлял 0.1–4.0 мкг/мл и захватывал его нормальный (0.1–0.5 мкг/мл), пограничный (0.5 мкг/мл) и патологический (>0.5 мкг/мл) уровни в плазме [8]. Точность определения при тестировании проб плазмы составляла 2–8%. Связывание конъюгата в ТЗ не препятствовало контролю качества тест-системы по взаимодействию непрореагировавшего конъюгата с антивидовыми антителами в контрольной зоне. Как видно на рис. 4, окрашивание контрольной зоны достоверно регистрировалось во всем характеризуемом диапазоне концентраций D-димера.
Рис. 4.
Иммунохроматографическое определение D-димера в неразбавленной (а и б) и разбавленной в 10 раз ФБСТ (в и г) плазме. а и в – внешний вид тест-полосок после проведения анализа (КЗ, ТЗ); концентрации D-димера: 0 (1); 0.016 (2); 0.031 (3); 0,062 (4); 0.125 (5); 0.25 (6); 0.5 (7), 1.0 (8), 2.0 (9), 3.0 (10), 4.0 (11), 6.0 (12) и 8.0 (13) мкг/мл; б и г – зависимости интенсивности окрашивания ТЗ (отн. ед.) от концентрации D-димера (мкг/мл) в неразбавленной (б) и разбавленной в 10 раз ФБСТ (г) плазме. Зависимости интенсивности окрашивания ТЗ (y) от концентрации антигена в пробе (x) аппроксимировали (пунктирная линия) функцией y = (A − D)/(1 + (x/C)B) + D. Для неразбавленной плазмы (б) A = 29.5, D = 132.6, C = 0.5, B = 1.34; для разбавленной в 10 раз плазмы (г) A = 0.39, D = 161.0, C = 0.45, B = 1.02.
Испытание иммунохроматографической тест-системы на пробах плазмы крови пациентов с тромботическими нарушениями. 23 пробы плазмы крови с цитратом натрия от пациентов с подтвержденными диагнозами сепсис (10 проб), тромбоз (7 проб), тромбоэмболия (2 пробы), послеоперационные осложнения (4 пробы), а также 31 проба от здоровых доноров с ЭДТА, были протестированы с использованием изготовленной иммунохроматографической тест-системы и коммерческого иммуноферментного набора “ D-димер-ИФА-Бест” в качестве референсного. Результаты представлены в табл. 4.
Таблица 4.
Результаты ИХА, ИФА и диагноза для проб плазмы больных и здоровых доноров
| Тестирование ИХА | Подтверждение клиническим диагнозом | Подтверждение ИФА |
|---|---|---|
| Положительные – 22 | Положительные – 21 Отрицательные – 1 |
Положительные – 21 Отрицательные – 1 |
| Отрицательные – 32 | Положительные – 1 Отрицательные – 31 |
Положительные – 1 Отрицательные – 31 |
Диагностические чувствительность и специфичность определения D-димера методом ИХА, рассчитанные на основании этих данных по отношению к клиническому диагнозу, составили, соответственно, 95 и 97%. Такие же параметры были получены при сравнении данных ИХА и ИФА.
Полученные результаты свидетельствуют о возможности применения разработанной тест-системы для детектирования D-димера в диапазоне концентраций, охватывающем нормальный, пограничный и патологический уровни D-димера в плазме. Тест-система характеризовалась высокой чувствительностью и специфичностью определения, а также продолжительностью анализа, равной 10 мин. Тестирование проб плазмы крови не требовало их разведения и другой предварительной подготовки. Разработанная иммунохроматографическая тест-система представляется перспективным аналитическим средством для экспрессного выявления D-димера.
Работа проведена при финансовой поддержке Российского научного фонда (грант 14-14-01131).
Список литературы
O’Neill S., Bohl M., Gregersen S., Hermansen K., O’Driscoll L. // Trends Endoc. Metabol. 2016. V. 27. № 6. P. 363–374.
Hegener M.A., Li H., Han D., Steckl A.J., Pauletti G.M. // Biomed. Microdevices. 2017. V. 19. № 3. P. 64–73.
Walker J.B., Nesheim M.E. // J. Biol. Chem. 1999. V. 274. № 8. P. 5201–5212.
Adam S.S., Key N.S., Greenberg C.S. // Blood. 2009. V. 113. № 13. P. 2878–2887.
Thachil J., Lippi G., Favaloro E.J. // Meth. Mol. Biol. 2017. V. 1646. P. 91–104.
Stein P.D., Hull R.D. // Ann. Intern. Med. 2004. V. 140. № 8. P. 589–602.
Segal J.B., Eng J., Tamariz L.J., Bass E.B. // Ann. Fam. Med. 2007. V. 5. № 1. P. 63–73.
La'ulu S.L., Dominguez C.M., Roberts W.L. // Clin. Chim. Acta. 2008. V. 390. № 1–2. P. 148–151.
Kline J.A., Williams G.W., Hernandez-Nino J. // Clin. Chem. 2005. V. 21. № 5. P. 825–829.
Sharp A.L., Vinson D.R., Alamshaw F., Handler J., Gould M.K. // Ann. Emer. Med. 2016. V. 67. № 2. P. 249–257.
Froehling D.A., Elkin P.L., Swensen S.J., Heit J.A., Pankratz V.S., Ryu J.H. // Mayo Clin. Proc. 2004. V. 79. № 2. P. 164–168.
Ruivo S., Azevedo A.M., Prazeres D.M.F. // Anal. Biochem. 2017. V. 538. № 12. P. 5–12.
Dempfle C., Schraml M., Besenthal I., Hansen R., Gehrke J., Korte W., Risch M., Quehenberger P., Handler S., Minar E., Schulz I., Zerback R. // Clin. Chim. Acta. 2001. V. 307. № 1–2. P. 211–218.
Posthuma-Trumpie G., Korf J., van Amerongen A. // Anal. Bioanal. Chem. 2009. V. 393. № 2. P. 569–582.
Dzantiev B.B., Byzova N.A., Urusov A.E., Zherdev A.V. // TrAC Trends Anal. Chem. 2014. V. 55. P. 81–93.
Safenkova I.V., Zherdev A.V., Dzantiev B.B. // J. Immunol. Methods. 2010. V. 357. № 1–2. P. 17–25.
Safenkova I.V., Zherdev A.V., Dzantiev B.B. // Anal. Bioanal. Chem. 2012. V. 403. № 6. P. 1595–1605.
Makhsin S.R., Razak K.A., Noordin R., Zakaria N.D., Chun T.S. // Nanotechnology. 2012. V. 23. № 49. P. 495719.
Dykman L., Khlebtsov N. // Chem. Soc. Rev. 2012. V. 41. № 6. P. 2256–2282.
Hermanson G.T. Bioconjugate Techniques, 3rd edn. Amsterdam: Acad. Press, Elsevier, 2013. 1200 p.
Frens G. // Nat. Phys. Sci. 1973. V. 241. № 105. P. 20–22.
Byzova N.A., Zvereva E.A., Zherdev A.V., Eremin S.A., Dzantiev B.B. // Talanta. 2010. V. 81. № 3. P. 843–848.
Byzova N.A., Zherdev A.V., Vengerov Yu.Yu., Starovoitova T.A., Dzantiev B.B. // Microchim. Acta. 2017. V. 184. № 2. P. 463–471.
Fawcett T. // Pattern Recogn. Lett. 2006. V. 27. № 8. P. 861–874.
Wild D. The Immunoassay Handbook. Theory and Applications of Ligand Binding, ELISA and Related Techniques, 4th edn. Amsterdam: Elsevier Science, 2013. 1036 p.
Бызова Н.А., Лухверчик Л.Н., Жердев А.В., Пивень Н.В., Бураковский А.И., Дзантиев Б.Б. // Прикл. биох. микробиол. 2013. Т. 49. № 6. С. 606–612.
Wong R.C., Tse H.Y. Lateral Flow Immunoassay. N.Y.: Humana Press, 2009. 224 p.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология