Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 286-292
Термостабильность мономеров и тримеров фотосистемы I цианобактерии Arthrospira platensis
Ю. В. Болычевцева 1, И. В. Терехова 1, *, В. В. Шубин 1, Н. П. Юрина 1
1 Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр “Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: terekhova@inbi.ras.ru
Поступила в редакцию 16.10.2018
После доработки 27.11.2018
Принята к публикации 18.12.2018
Аннотация
Изучены изменения спектров кругового дихроизма пигментов антенны и кинетики фотоокисления первичного донора электронов (П700) у тримерных и мономерных комплексов фотосистемы 1 из Ar-throspira platensis после их инкубации при повышенных температурах. Показано, что 10%-ное падение амплитуды сигналов кругового дихроизма антенного хлорофилла наблюдалось после нагревания мономеров до 60°, а тримеров до 70°С. Тепловое нарушение пространственной организации антенного хлорофилла коррелировало с уменьшением концентрации фотоактивного П700. Падение начальной скорости фотоокисления П700, наблюдавшееся уже после 40°С как для мономеров, так и для тримеров, происходило параллельно со снижением интенсивности полосы кругового дихроизма каротиноидов тримеров, но не мономеров, что, по-видимому, обусловлено различием каротиноидного состава этих комплексов. Вероятно, изменение кинетики фотоокисления П700 комплексов фотосистемы 1 при 50–60°С связано не с нарушением процесса миграции энергии на реакционный центр, а с изменением состояния акцепторной части, в частности вторичного акцептора – филлохинона.
Фотосистема 1 (ФС1) представляет собой сложный пигмент-белковый комплекс, погруженный в тилакоидную мембрану, который преобразует солнечную энергию в энергию химических связей. Эта фотосистема осуществляет перенос электронов от пластоцианина или цитохрома с6 с внутренней стороны тилакоидов на ферредоксин или флаводоксин, находящийся на цитоплазматической стороне тилакоидов. ФС1 цианобактерий состоит из 12 белковых субъединиц и 127 кофакторов, поглощающих свет и осуществляющих перенос электронов [1, 2]. Эти кофакторы на каждый мономер ФС1 включают 96 молекул хлорофилла, 22 молекулы каротиноидов, 2 филлохинона, 3 железо-серных кластера (4Fe–4S) и 4 липида. Две большие субъединицы, PsaA и PsaB, содержащие по 11 трансмембранных α-спиральных участков и образующие “ядро” комплекса ФС1, связывают большую часть молекул хлорофилла и каротиноидов, первичный донор электронов П700 – димер хлорофилла, первичный акцептор электронов А0 (мономер молекулы хорофилла), вторичные акцепторы электронов А1A и А1B (филлохиноны) и FX (железо-серный кластер). Конечные акцепторы электронов FA и FB (также железо-серные кластеры) оба связаны PsaC субъединицей, которая (как и PsaD и PsaE) является периферической субъединицей комплекса ФС1 на цитоплазматической стороне тилакоидов. Субъединицы PsaI и PsaL участвуют в формировании и стабилизации тримеров ФС1 цианобактерий [1, 2]. Субъединицы PsaK, -M, и -X, по-видимому, выполняют структурную роль. Свет поглощается большой антенной “ядра” комплекса ФС1, содержащей 90 молекул хлорофилла и 22 молекулы каротиноидов. Энергия квантов света, поглощенных антенным хлорофиллом, мигрирует на реакционный центр ФС1, состоящий из 6 молекул хлорофилла, и индуцирует перенос электрона от первичного донора (хлорофилла П700) на первичный акцептор электрона (А0) и далее на вторичный акцептор – филлохинон (А1) и железосерные центры (FX, FA, FB) [1–3]. Эти реакции протекают за 10–12–10–6 с и характеризуются квантовым входом близким к 1. При окислении П700 образуется долгоживущий катион-радикал П700+, характеризующийся широкой полосой поглощения в области 700–850 нм, что позволяет регистрировать как скорость фотоиндуцированного изменения поглощения, так и концентрацию активного П700 [4].
Одной из важных задач современной науки является создание искусственных систем, способных превращать энергию солнца в энергию химических связей водорода [5] или генерировать фототок и превращаться в чувствительные фотосенсоры [6]. В такие системы в качестве преобразователя энергии часто внедряют комплексы ФСI цианобактерий, которые отличаются значительно более высокой стабильностью, чем ФС1 высших растений и водорослей [5, 6]. Известно, что ФС1 термофильной цианобактерии Thermosynechococcus elongatus очень устойчива к нагреванию: инактивация индуцированного вспышками окисления П700 начинается после 5 мин нагревания при 80°С и достигает 50% при 93°С, в то время как железо-серные центры инактивируются на 50% при 70°С [7]. Показано также, что поглощение антенного хлорофилла, ассоциированного с ФС1 мезофильной цианобактерии Synechocystis PCC6803, снижается на половину примерно при 55°С, а поглощение антенны T. elongatus падает на 50% при 90°С. Интересно, что 80% поглощения хлорофилла, ассоциированного с П700, удерживается для Synechocystis PCC6803 и T. elongatus до 70 и 90°С соответственно [5]. Еще одно отличие ФСI цианобактерий, высших растений и водорослей состоит в том, что в цианобактериях ФСI существует преимущественно в виде тримеров [8]. Следует отметить, что апопротеин тримерных комплексов ФС1 T. elongatus более устойчив к нагреванию, чем апопротеин мономеров [9]. Поскольку ФС1 цианобактерий используют для создания альтернативных источников энергии [5, 6], представляет интерес изучение устойчивости пигментного аппарата их тримеров и мономеров ФСI к различным условиям среды, например, к изменению температуры, освещения и др. Сравнительное изучение начальной скорости фотоиндуцированного изменения поглощения П700, амплитуды этого сигнала и спектральных свойств пигментного аппарата в зависимости от режима тепловой обработки позволит выяснить характер деструкции мономеров и тримеров ФС1 из Arthrospira platensis при повышенной температуре.
Цель работы – выяснение термостабильности реакционных центров и пигментов антенны мономерных и тримерных комплексов ФС1, выделенных из тилакоидных мембран цианобактерии A. platensis.
МЕТОДИКА
Объект исследования. Культуру цианобактерии A. platensis выращивали на среде Зарука, тилакоидные мембраны выделяли по методике, описанной в работе [10]. Тримеры и мономеры ФС1 получали из тилакоидных мембран, обработанных 1%-ным n-додецил-β-D-мальтозидом (соотношение детергент: хлорофилл ~15) в течение 30 мин при 4°C, методом хроматографии на колонке с ДЭАЭ-Toyopearl 650М. Выделенные комплексы ФС1 хранили в 20 мM трис–HCl буфере, pH 7.8, содержащим 0.05% n-додецил-β-D-мальтозида, при –70°C [11].
Тепловая обработка образцов. Для тепловой обработки пигмент-белковых комплексов ФС1 использовали термошейкер TS-100 (“BioSan”, Латвия). На температурной шкале прибора выставляли нужную температуру. Пластиковую пробирку (эппендорф), содержащую 0.35 мл 50–60 мкМ хлорофилла, инкубировали в течение 3 мин при данной температуре, затем охлаждали на ледяной бане в течение 3 мин и использовали для измерений спектров кругового дихроизма (КД) и поглощения при 20°С. Перед измерением фотоиндуцированных сигналов П700 добавляли аскорбат натрия (0.2 мМ) и инкубировали в темноте в течение 5 мин. При такой концентрации аскорбата начальная скорость светового окисления П700 в 40–100 раз превышала начальную скорость темнового восстановления П700+.
Спектрально-кинетические измерения. Все измерения проводили в 2 мм оптических кюветах. Спектры КД и спектры поглощения измеряли на дихрографе Сhirascan (“Applied Photophysics”, Великобритания) при спектральной ширине щели 1 нм и скорости сканирования 10 нм/мин.
Кинетику фотоиндуцированного изменения поглощения П700 регистрировали при 810 нм (против 870 нм) при помощи флуориметра DUAL –PAM–101 с приставкой ED–Р700 DW–101 (“Walz, Effelrich”, Германия) [4]. В качестве источника действующего света 620 нм (130 мкмоль м–2 с–1, 20 с, 1 мин) использовали управляемую импульсную лампу на основе светодиодов (High Power Led-Lamp, Control Unit HPL-C, “Walz”, Германия). Начальную скорость фотоокисления П700 (Vox) определяли по тангенсу угла наклона начального участка кинетической кривой (в диапазоне от 3 до 60 мс) с момента включения света. Концентрацию фотоактивного П700 оценивали по амплитуде фотоиндуцированного окисления П700 (ΔА810) после выхода кинетической кривой в стационарное состояние за 1 мин освещения.
Для измерения интенсивности действующего света 620 нм использовали квантометр Quantitherm (QRT1, “Hansatech”, Германия).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Спектры поглощения. Спектры поглощения, измеренные при комнатной температуре, указывали на то, что тримеры в отличие от мономеров характеризовались высокой оптической плотностью в области поглощения каротиноидов (480–510 нм), что свидетельствовало о высоком их содержании в них (рис. 1).
Рис. 1.
Спектры поглощения тримеров (1) и мономеров (2) ФС1 A. platensis при комнатной температуре. На врезке – относительное изменение поглощения хлорофилла при 679 нм при повышении температуры тепловой обработки тримеров (1) и мономеров (2) ФС1.
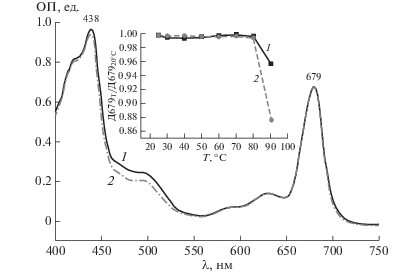
Повышение температуры, при которой инкубировали пигмент-белковые комплексы ФС1 в течение 3 мин, влияло на спектры поглощения. Так, наблюдалось незначительное уширение полосы поглощения хлорофилла, максимум которой заметно сдвигался в коротковолновую область лишь при 90°С (рис. 1, врезка). Это можно было объяснить появлением свободного хлорофилла, а возрастание поглощения при 418 нм, также наблюдаемое при нагревании выше 80°С, по-видимому, связано с превращением хлорофилла в феофитин под действием высокой температуры [12, 13].
Спектры КД хлорофилла и кинетика фотоокисления П700. В спектрах КД ФС1 присутствовали те же спектральные формы хлорофилла, что и в спектрах поглощения, однако соотношение интенсивностей полос значительно отличались. Так, основная полоса поглощения антенного хлорофилла при 679 нм (рис. 1) и полоса поглощения свободного хлорофилла при 662 нм не проявлялись в спектрах КД (рис. 2а, 2б). Амплитуды полос КД оптически активных форм хлорофилла оказались более чувствительны к нарушению пространственной организации пигментов, чем амплитуды полос поглощения. Интенсивность полос КД спектров ФС1 в видимой области определяется пространственной организацией экситонно сопряженных молекул хлорофилла антенны, включенных в структуру комплекса ФС1 [14–17]. Спектры КД антенного хлорофилла как тримеров, так и мономеров при 20°С характеризовались отрицательной полосой при 685 нм и положительной – при 671 нм (рис. 2а, 2б). Инкубация тримеров ФС1 в течение 3 мин при температурах от 20 до 60°С вызывала лишь небольшие изменения спектров КД хлорофилла антенны, в то время как нагревание свыше 65–70°С приводило к заметному снижению интенсивности сигнала КД (рис. 2а).
Рис. 2.
Спектры КД хлорофилла тримеров (а) и мономеров (б) ФС1, инкубированных в течение 3 мин при 20 (1), 50 (2), 70 (3), 80 (4) и 90°С (5). (Оптическая плотность в кювете 2 мм при 679 нм (А679) равна 0.7 для тримеров и 0.8 для мономеров).
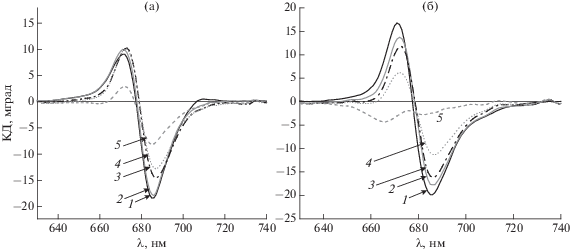
В отличие от тримеров нагревание мономеров ФС1 до 60°С заметно снижало амплитуды полос антенного хлорофилла в спектре КД (рис. 2б). Таким образом, явное нарушение антенны в мономерных комплексах ФС1 начиналось при температуре примерно на 10°С более низкой, чем у тримеров (рис. 2 и 3а, 3б, кривые 1). Если в спектре КД тримеров после инкубации при 90оС амплитуда полосы 685 нм падала на 50–55% (рис. 3а, кривая 1), то после инкубации мономеров при 90°С оставалось лишь около 10% этого сигнала КД (рис. 3б, кривая 1). Для обоих комплексов было характерно снижение интенсивности сигналов КД без существенной деформации спектров, что указывало на кооперативность процесса нарушения пространственной организации оптически активных форм хлорофилла. Эта кооперативность, вероятно, обусловлена кооперативностью процесса денатурации апобелков ФС1. На рис. 3а показано, что амплитуда сигнала КД при 685 нм уменьшалась практически параллельно с уменьшением амплитуды сигнала КД α-спиралей при 222 нм. Более слабое после нагревания выше 80°С падение амплитуды сигнала при 222 нм по сравнению с амплитудой при 685 нм (рис. 3а, кривые 1 и 2) обусловлено тем, что после жесткой тепловой обработки разрушалось только 30–40% α-спиралей. Это различие отчетливо проявлялось при плавлении, при котором нагревание комплексов ФС1 осуществлялось со скоростью 1 градус в мин (данные не показаны).
Рис. 3.
Зависимость от температуры относительного изменения интенсивности полос КД хлорофилла при 685 нм (1), белка при 220 нм (2), концентрации фотоактивного П700 (ΔА810 – 3) и начальной скорости фотоокисления П700 (Vox ‒ 4) для тримеров (а) и мономеров (б) ФС1.
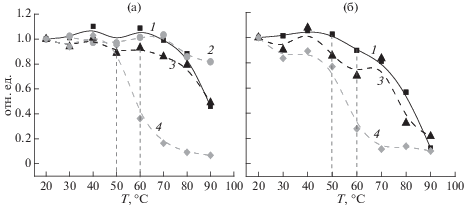
Снижению интенсивности полос антенного хлорофилла в спектрах КД комплексов ФС1 сопутствовало уменьшение концентрации фотоактивного П700, о чем судили по уменьшению амплитуды сигнала фотоокисления П700 (ΔА810) как у тримеров, так и у мономеров (рис. 3, кривые 1 и 3). Амплитуда фотоиндуцированного окисления П700 мономеров при 90°С составляла около 20% от исходной величины (рис. 3б, кривая 3), в то время как амплитуда сигнала от П700 тримеров снижалась примерно на 50% при 90°С (рис. 3а, кривая 3). Сигнал от фотоиндуцированного изменения поглощения П700 исчезал полностью при кипячении (100°С) комплексов ФС1 в течение 3 мин.
При повышении температуры инкубации снижались не только амплитуды сигнала П700 и полосы КД хлорофилла (685 нм), но также и начальная скорость окисления П700 тримеров и мономеров ФС1 (рис. 3а, 3б, кривые 4). Поскольку скорость темнового восстановления П700 была в несколько десятков раз ниже скорости фотоокисления П700 даже при высокой температуре (см. Методику), то реакция прямого восстановления П700+ аскорбатом натрия практически не влияла на снижение концентрации окисленного П700 (П700+). Характерно, что снижение начальной скорости фотоокисления П700 (рис. 3а, 3б, кривые 4) значительно опережало нарушение структурной организации антенного хлорофилла (рис. 3а, 3б, кривые 1) как у тримеров, так и мономеров. Уже при тепловой обработке выше 55°C наблюдалось снижение начальной скорости фотоокисления П700 на 50%, в то время как снижение интенсивности сигнала КД антенного хлорофилла на 50% происходило при температуре более 80°С. Этот факт указывал на то, что снижение скорости поглощения света в результате разрушения структурной организации оптически активных форм антенного хлорофилла не являлось причиной резкого снижения скорости фотоокисления П700 в комплексах ФС1 при 45–55°С. Однако, даже при этой температуре нельзя было исключить снижения эффективности переноса энергии возбуждения от антенных форм на реакционный центр ФС1 (П700).
Спектры КД каротиноидов и кинетика фотоокисления П700. Известно, что, кроме хлорофилла, почти все субъединицы ФС1 (исключая PsaC, D, E и Х) содержат кластеры каротиноидных молекул [1]. Спектры поглощения (рис. 1) свидетельствовали о том, что тримеры содержали большее (на 15–20%) количество каротиноидов, чем мономеры. Однако сила вращения полос при 507 и 480 нм в спектрах КД, приписываемых каротиноидам [18], у тримеров оказалась значительно выше, чем у мономеров (рис. 4). Можно предположить, что это различие обусловлено как различием состава каротиноидов, так и особенностями пространственной организации пигментов. Спектры КД каротиноидов оказались значительно менее устойчивы к тепловому воздействию, чем спектры КД хлорофилла (рис. 2 и 4) Особенно чувствительными к повышению температуры были каротиноиды тримеров (рис. 4а), сила вращения которых резко падала после тепловой инкубации выше 40–50°С.
Рис. 4.
Спектры КД каротиноидов тримеров (а) и мономеров (б) ФС1, инкубированных в течение 3 мин при 20 (1), 30 (2), 50 (3), 60 (4), 70 (5), 80 (6) и 90°С (7)
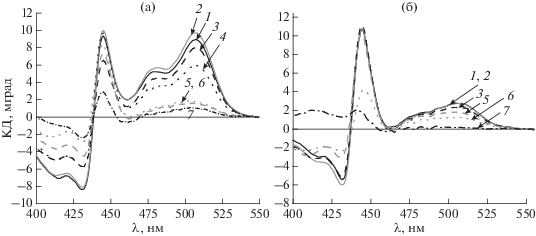
Амплитуда сигнала КД каротиноидов при тепловой обработке выше 40–50°C уменьшалась у мономеров не так резко, как у тримеров (рис. 5а, 5б, кривые 1), что хорошо коррелировало с падением концентрации фотоактивного П700 (рис. 5б, кривая 2). У тримерных комплексов подобной корреляции между амплитудой сигнала КД каротиноидов и концентрацией фотоактивного П700 не наблюдалось (рис. 5а, кривые 1 и 2). Таким образом, изменение содержания фотоактивного П700 (ΔА810) после тепловой обработки мономеров коррелировало с изменением интенсивности сигналов КД как хлорофилла, так и каротиноидов (рис. 3б и 5б). У тримеров изменение содержания фотоактивного П700 коррелировало только с изменением интенсивности сигнала КД хлорофилла (рис. 3а, кривые 1 и 3), но не каротиноидов (рис. 5а, кривые 1 и 2). Наблюдаемое различие зависимости снижения относительной интенсивности каротиноидных полос в спектрах КД комплексов ФС1 от температуры (рис. 5а, 5б) может быть связано с различием состава, содержания и ориентации каротиноидов в тримерах и мономерах ФС1. Действительно, недавно было показано, что в тримерах ФС1 Synechocystis sp. присутствуют молекулы двух ксантофиллов (эхиненона и зеаксантина), расположенные по периферии тримеров. При выделении тримеров в присутствии повышенной концентрации неионного детергента различия по каротиноидам между тримерами и мономерами исчезают в результате удаления этих ксантофиллов [19]. В связи с этим низкое содержание каротиноидов у мономеров по сравнению с тримерами (рис. 1) может быть связано с удалением периферических молекул кислородсодержащих каротиноидов. У мономеров соотношение каротиноидов должно меняться в пользу молекул β-каротина, прочно входящих в антенный комплекс пигментов ФС1 [1, 2]. Этим может объясняться отставание при повышении температуры снижения сигнала КД каротиноидов мономеров по сравнению с тримерами (рис. 5а, 5б).
Рис. 5.
Зависимость от температуры относительного изменения интенсивности полосы КД каротиноидов 506 нм (1), концентрации фотоактивного П700 (ΔА810 – 2) и начальной скорости окисления П700 (Vox – 3) тримеров (а) и мономеров (б) ФС1
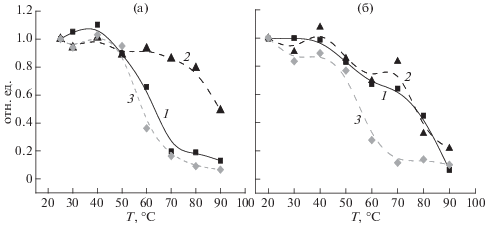
После инкубации комплексов ФС1 при температуре выше 40°C наблюдалось не только снижение относительной интенсивности полос каротиноидов в спектрах КД, но и резкое замедление фотоокисления П700 как у тримеров, так и у мономеров (рис. 5а, 5б, кривые 3). Такое изменение кинетики фотоокисления П700 не сопровождалось ни у тримеров, ни у мономеров столь резким нарушением микроокружения хлорофилла антенны (КД при 685 нм), α-спиральных участков белков (КД при 220 нм) или уменьшением амплитуды фотоокисления П700 (рис. 3а, 3б). У тримеров замедление фотоокисления П700 полностью соответствовало снижению интенсивности позитивных полос каротиноидов (рис. 5а), в то время как у мономеров наблюдалось отставание снижения интенсивности полос каротиноидов в спектрах КД по сравнению с замедлением фотоиндуцированного окисления П700 (рис. 5б). Следует отметить, что характер замедления окисления П700 тримеров и мономеров оказался одинаковым и соответствовал снижению интенсивности позитивных полос КД каротиноидов тримеров (рис. 5а, 5б, кривые 3). Ранее было показано, что две небольшие группы каротиноидных молекул (возможно, это зеаксантин или криптоксантин) находятся в непосредственной близости от вторичных акцепторов электронов в ФС1 – филлохинонов А1А и А1В, и восстановление филлохинонов в ФС1 сопровождается изменениями поглощения при 450 нм и между 500 и 510 нм, что приписывается электрохромному сдвигу полосы от каротиноидных молекул [20]. В связи с этим можно предположить, что параллельное изменение скорости фотоокисления П700 и снижение интенсивности полос каротиноидов в спектре КД тримеров и мономеров после инкубации при температуре до 50°C связано с изменением микроокружения вторичных акцепторов ФС1 (А1А и А1В) вследствие нарушения гидрофобных и электростатических взаимодействий. Снижение скорости фотоокисления П700 после инкубации комплексов ФС1 при температуре выше 50°C может быть вызвано дальнейшей дестабилизацией места связывания филлохинонов, а также нарушением их взаимодействия с железо-серным центром FX [20]. Известно, что железо-серные центры T. elongatus менее устойчивы к нагреванию, чем П700 [7]. В то же время показано, что поглощение кислорода в ФС1 тилакоидных мембран Spirulina (A. platensis) в присутствии метилвиологена нечувствительно к длительному (30 мин) нагреванию до 55°С [21], что свидетельствовало о достаточно высокой устойчивости железо-серных центров к воздействию высоких температур.
Таким образом, в результате выполненных исследований выяснено, что замедление начальной скорости фотоокисления П700 у тримеров и мономеров при температуре 40–50°С коррелировало с нарушением пространственной организации каротиноидов, но не хлорофилла. Нарушение пространственной организации 10% хлорофилла антенны мономеров ФС1 происходило уже при температуре 60°С, в то время как нарушение антенны тримеров – при 70°С. Полученные данные позволили предположить, что деструкция пигмент-белковых комплексов ФС1 A. platensis при воздействии высоких температур происходила в несколько этапов и начиналась с дестабилизации акцепторной части ФС1. При нагревании образцов до 50°C могли нарушаться места связывания вторичных акцепторов (филлохинонов А1А и А1В) и их взаимодействие с FX-центрами, что выражалось в снижении начальной скорости фотоокисления П700. При температуре выше 60°C у тримеров и 50°C у мономеров начиналось нарушение экситонных взаимодействий между молекулами антенного хлорофилла и замедление переноса энергии на хлорофилл реакционного центра ФС1–П700, что выражалось в снижении амплитуды сигнала фотоиндуцированного изменения поглощения П700. Таким образом, тримеры ФС1 оказались более устойчивыми к воздействию высоких температур, чем мономеры, так как при 90°C амплитуда сигнала от фотоокисления П700 тримеров примерно в 2.5 раза больше, чем амплитуда сигнала от П700 мономеров. Заметное изменение микроокружения антенного хлорофилла тримеров начиналось при температуре на 10°C более высокой, чем изменение антенного хлорофилла мономеров.
Работа выполнена при частичной финансовой поддержке Российского фонда фундаментальных исследований (грант № 16-04-01626А и 19-04-00798А), программы Президиума РАН № 1.18 “Молекулярная и клеточная биология и постгеномные технологии” и Министерства науки и высшего образования Российской Федерации.
Список литературы
Fromme P., Jordan P., Krauß N. // Biochim. Biophys. Acta. 2001. V. 1507. № 1–3. P. 5–31.
Fromme P., Grotjohann I. Results and Problems in Cell Differentiation, Bioenergetics / Eds. Schafer G., Penefsky H.S. Berlin, Heidelberg: Springer-Verlag, 2008. V. 45. P. 33–72.
Карапетян Н.В., Болычевцева Ю.В., Юрина Н.П., Терехова И.В., Шубин В.В., Брехт М. // Биохимия, 2014. Т. 79. № 1. С. 283–292. (Karapetyan N.V., Bolychevtseva Yu.V., Yurina N.P., Terekhova I.V., Shubin V.V., Brecht M. // Biochemistry (Moscow). 2014. V. 79. № 1. P. 213–220.)
Schreiber U., Klughammer C., Neubauer C. // Z. Naturforsch. 1988. V. 43c. № 9–10. P. 686–698.
Iwuchukwu I.J., Vaughn M., Myers N., O’Neill H., Frymier P., Bruce B.D. // Nature Nanotechnol. 2010. V. 5. № 1. P. 73–79.
Terasaki N., Yamamoto N., Tamada K., Hattori M., Hiraga T., Tohri A., Sato I., Iwai M., Taguchi Sh., Enami I., Inoue Y., Yamanoi Y., Yonezawa T., Mizuno K., Murata M., Nishihara H., Yoneyama S., Minakata M., Ohmori T., Sakai M., Fujii M. // Biochim. Biophys. Acta. 2007. V. 1767. № 11. P. 653–659.
Sonoike K., Hatanaka H., Katoh S., Itoh Sh. // Plant Cell Physiol. 1990. V. 31. № 6. P. 865–870.
Rögner M., Mühlenhoff U., Boekema E.J., Witt H.T. // Biochim. Biophys. Acta. 1990. V. 1015. № 3. P. 415–424.
Shubin V.V., Terekhova I.V., Bolychevtseva Y.V., El-Mohsnawy E., Rögner M., Mäntele W., Kopczak M.J., Džafić E. // Spectrochim. Acta A Mol. Biomol. Spectrosc. 2017. V. 179. № 1. P. 17–22.
Shubin V.V., Bezsmertnaya I.N., Karapetyan N.V. // FEBS Lett. 1992. V. 309. № 3. P. 340–342.
Schlodder E., Cetin M., Byrdin M., Terekhova I.N., Karapetyan N.V. // Biochim. Biophys. Acta. 2005. V. 1706. № 1–2. P. 53–67.
Haisman D.R., Clarke M.W. // J. Agric. Food Chem.1975. V. 26. № 8. P. 1111–1126.
Weemaes C.A., Ooms V., Van Loey A.M., Hendrickx M.E. // J. Agric. Food Chem. 1999. V. 47. № 6. P. 2404–2409.
Bassi R., Silvestri M., Dainese P., Moya I., Giacometti G.M. // J. Photochem. Photobiol. 1991. V. B 9. № 3. P. 335–354.
Somsen O.J., Grondelle R.V., Amerongen H.V. // Biophys. J. 1996. V. 71. № 4. P. 1934–1951.
Ruban A.V., Calkoen F., Kwa S.L.S., Grondelle R.V., Horton P., Dekker J.P. // Biochim. biophys. Acta. 1997. V. 1321. № 1. P. 61–70.
Schlodder E., Shubin V.V., El-Mohsnawy E., Roegner M., Karapetyan N.V. // Biochim. Biophys. Acta. 2007. V. 1767. № 6. P. 732–741.
Shubin V.V., Tsuprun V.L., Bezsmertnaya I.N., Karapetyan N.V. // FEBS Lett. 1993. V. 334. № 1. P. 79–82.
Vajravela S., Kisa M., Kłodawskab K., Laczko-Dobosa H., Malecb P., Kovácsa L., Gombosa Z., Toth T.N. // Biochim. Biophys. Acta. 2017. V. 1858. № 7. P. 510–518.
Srinivasan N., Golbeck J.H. // Biochim. Biophys. Acta. 2009. V. 1787. № 9. P. 1057–1088.
Venkataramanaiah V., Sudhir P., Murthy S.D.S. // Photosynthetica. 2003. V. 41. № 3. P. 331–334.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


