Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 303-312
Контроль биотехнологических процессов ферментными электродами, модифицированными нанотрубками
В. А. Арляпов 1, *, О. А. Каманина 1, С. С. Каманин 2, А. Н. Решетилов 1, 3, В. И. Швец 4
1 Тульский государственный университет
300012 Тула, Россия
2 ЗАО “Спецприбор”
300028 Тула, Россия
3 Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Московская обл., Пущино, Россия
4 МИРЭА – Российский технологический университет
119454 Москва, Россия
* E-mail: v.a.arlyapov@gmail.com
Поступила в редакцию 31.08.2018
После доработки 21.11.2018
Принята к публикации 18.12.2018
Аннотация
Изучены характеристики биосенсоров на основе печатных электродов, содержащих глюкозооксидазу, алкогольоксидазу, лактатоксидазу и смесь глюкозооксидазы и γ-амилазы. Ферменты были иммобилизованы в проводящий гидрогель на основе поперечно-сшитого бычьего сывороточного альбумина, модифицированный углеродными нанотрубками. Биосенсоры применили для определения содержания глюкозы, этанола, молочной кислоты и крахмала в бродильных средах. Определены аналитические и метрологические характеристики этих биосенсоров. Диапазон определяемых разработанной системой биосенсоров концентраций глюкозы, этилового спирта, лактата и крахмала составил 0.1–2.7, 1–27, 0.02–73 мМ и 0.6–21 г/л соответственно. Проведен анализ образцов алкогольной и кисломолочной продукции, кваса и бродильной массы. Статистический анализ полученных результатов показал, что значения содержаний глюкозы, этанола, молочной кислоты и крахмала, определенные с помощью биосенсоров и полученные референтными методами, различались между собой незначимо. Разработанный набор биосенсоров, основанных на специфически подобранных ферментах, может эффективно использоваться для контроля биотехнологических процессов как альтернативный классическим аналитическим методам.
Для предприятий, связанных с биотехнологической отраслью, особенно важен постоянный контроль хода производственных процессов. В связи с этим проблема проведения комплексного многокомпонентного анализа проб становится актуальной. Такой анализ связан, как правило, с применением различных методов аналитической химии [1]. Так, получение основных продуктов питания включает различного вида процессы ферментации и брожения, поэтому контроль содержания крахмала, глюкозы, этанола и молочной кислоты, как их основных субстратов и продуктов составляет неотъемлемую часть производственного процесса. В настоящее время определение содержания крахмала проводят различными оптическими методами (поляриметрическим и фотометрическим), требующим отделения из раствора всех оптически активных компонентов, в том числе белков [1]. Для определения содержания молочной кислоты используется спектрофотометрический метод или метод капиллярного электрофореза, этилового спирта – газовая хроматография, а глюкозы – жидкостная хроматография, капиллярный электрофорез, поляриметрический метод или метод иодометрического титрования [2]. Эти методы могут эффективно применяться для контроля качества готовой продукции, но не могут быть использованы для экспресс-анализа ферментационных и бродильных сред. Они являются довольно дорогостоящими, должны обслуживаться квалифицированными специалистами, и часто требуют предварительной обработки образца, что приводит к увеличению времени и значительных затрат на анализ. В связи с этим представляется актуальной разработка простого и недорогого метода контроля многих процессов получения полезных продуктов, в том числе бродильных.
Для выполнения такого анализа могут быть использованы электрохимические биосенсоры на основе электродов, изготовленных методом трафаретной печати (печатных электродов). Эти электроды миниатюрны, многофункциональны и могут выпускаться высоким тиражом. Преимущества этой технологии производства позволили ферментным биосенсорам на основе печатных электродов (глюкометрам) стать приборами индивидуального пользования и доминировать на рынке биосенсоров [3]. Адаптация технологии трафаретной печати к нуждам биосенсорного анализа дала возможность нанесения биологического и вспомогательных компонентов на поверхность электрода прямо в процессе его производства, что привело к созданию недорогих одноразовых датчиков, характеризующихся в процессе анализа воспроизводимыми результатами [4]. Используя в качестве биораспознающего элемента ферменты, можно определять содержание различных компонентов в смеси с использованием единого измерительного аналитического оборудования [5].
Практически все описанные в литературе биосенсоры для определения глюкозы, этилового спирта и лактата разрабатывались с целью применения в области здравоохранения, в связи с этим их отличительной особенностью является узкий (в пределах биологических значений) диапазон определяемых концентраций [5–7]. Сложность состава биотехнологических сред диктует необходимость разработки многоканальной аналитической системы, позволяющей одновременно определять в смеси содержание нескольких компонентов [8, 9]. В работе [10] описана система амперометрических биосенсоров, которые могут проводить одновременное селективное определение содержания глюкозы и лактата. Были предприняты попытки использовать проточно-инжекционную систему, включавшую электрод, содержащий иммобилизованные глюкозооксидазу и лактатоксидазу, для последовательного определения содержания глюкозы и лактата, образующиеся в ходе молочнокислого брожения [11]. В работе [12] описана система биосенсоров для одновременного обнаружения глюкозы, лактата, глутамата и глутамина. Показана возможность создания системы печатных электродов, модифицированных берлинской лазурью, для одновременного определения глюкозы, этанола, лактата и крахмала [13]. Описанные системы представляли собой электроды, основанные на детекции пероксида водорода или восстановленной формы синтетического медиатора.
Современный подход в разработке биосенсорных систем, в частности на основе печатных электродов (3 поколение биосенсоров), включает регистрацию аналитического сигнала, формирующегося в результате прямого переноса электронов с активного центра фермента на электрод [14]. Данный подход позволяет обойтись без определения концентрации одного из субстратов или продуктов ферментативной реакции и использования медиаторов электронного транспорта, что существенно снижает мешающее влияние примесей в многокомпонентных системах. Такой подход способен существенно повысить чувствительность анализа [15]. Известен ряд работ по созданию биосенсоров на основе глюкозооксидазы и наноматериалов [16–20]. Так, разработан сенсор на основе одностенных углеродных нанотрубок, ковалентно иммобилизованных с аминопроизводными флавинадениндинуклеотида (ФАД-NH2) на поверхности золотого электрода [16]. В работе [17] показан прямой перенос электронов, который обеспечивался путем иммобилизации глюкозооксидазы в системе углеродные нанотрубки/хитозан. В работе [18] описан лактатный биосенсор на основе графитовых печатных электродов, модифицированных платиновыми наночастицами и углеродными нановолокнами, помещенными на пленку хлорида полидиаллилдиметилдиаммония. В одной из последних работ по разработке лактатного биосенсора [19] лактатоксидазу ковалентно иммобилизовали на гибридном наноматериале, содержащем наночастицы золота и графитизированные нанотрубки. Показана возможность применения биосенсора на основе многослойных углеродных нанотрубок, золотых наночастиц и пленки из нейтрального красного для определения этанола [20].
Однако необходимо отметить, что работы по применению биосенсоров на основе печатных электродов и наноматериалов для анализа других компонентов, кроме глюкозы, носят разрозненный характер. Исследования в области биосенсоров, описанные выше, прежде всего, направлены на обнаружение одного конкретного вещества. Простота и малое время анализа, являющиеся преимуществами биосенсоров, в полной мере проявляют себя при объединении нескольких биосенсоров в единую аналитическую систему, способную одновременно определять содержание нескольких компонентов в бродильных средах. Именно эта задача, традиционно сложная для физико-химических методов анализа, может быть успешно решена с использованием биосенсоров.
Цель работы – изучение характеристик биосенсоров, содержащих печатные электроды, модифицированные углеродными нанотрубками, и специфически подобранные ферменты, которые можно рассматривать как удобный и надежный инструмент для оперативного анализа содержания глюкозы, этанола, молочной кислоты и крахмала в продуктах биотехнологических производств.
МЕТОДИКА
Ферментные препараты. Для модификации графитовых печатных электродов использовали коммерчески доступные препараты оксидоредуктаз: глюкозооксидазы (ГО) из Aspergillus niger (“Sigma-Aldrich”, США), алкогольоксидазы (АО) из Pichia pastoris (“Sigma-Aldrich”, США) и лактатоксидазы (ЛО) из Pediococcus sp. (“Sigma-Aldrich”, США). В состав модифицированного печатного электрода для определения концентрации крахмала входила смесь двух ферментов: ГО и γ-амилазы (Ам) (“Sigma-Aldrich”, США).
Модификация печатных электродов ферроценом и ферментами. В работе использовали графитовые печатные электроды (ГПЭ) (ООО “Русенс”, Россия), выполненные по трехэлектродной схеме. На поверхность рабочего электрода наносили 1 мкл раствора 2 мг/мл ферроцена (Фц) (“Sigma-Aldrich”, США) в ацетоне (“Экрос”, Россия) и оставляли до полного высыхания. В микропробирку помещали 7 мг бычьего сывороточного альбумина (БСА, “BioWest”, Франция), 100 мкл 33 мМ натрий-калий-фосфатного буфера, рН 6.8, и перемешивали. К полученному раствору добавляли 10 мкл раствора 100 мг/мл фермента (активность раствора ГО составляла 15 Е/мл, раствора АО – 17.6, ЛО – 10, Ам – 30 Е/мл), перемешивали и добавляли 15 мкл 25%-ного раствора глутарового альдегида (“Panreac Química S.L.U.”, Испания). После краткого перемешивания 3 мкл полученной смеси быстро переносили на электрод. Время полимеризации составляло 60 мин. Модифицированные печатные электроды перед использованием промывали в буферном растворе в течение 5 мин.
Модификация печатных электродов ОСУНТ и ферментами. Модификацию проводили аналогично созданию электродов с ферроценом и ферментами, но вместо раствора ферроцена на электрод наносили 2 мкл 0.5%-ной суспензии одностенных углеродных нанотрубок (ОСУНТ) (ООО “Углерод Чг”, Россия). Длина углеродных нанотрубок составляла 1–10 мкм, средний диаметр 1.5 нм, внешняя удельная поверхность была равна 450 м2/г. Суспензию углеродных нанотрубок получали в деионизированной воде и оставляли до полного высыхания. Количество ОСУНТ, которое наносили на электрод, было выбрано на основании изучения оптимизации смеси для модификации электрода, проведенного ранее [15]. Полученные электроды хранили при температуре 4°С.
Проведение биосенсорных измерений. Для регистрации сигнала использовали потенциостат EmStat (“PalmSens”, Нидерланды). Рабочий потенциал для электрода с ферроценом составлял +0.25 В, для электрода с ОСУНТ-0.45. В качестве электрода сравнения служил хлоридсеребряный электрод. Измерения проводили в 33 мМ натрий-калий-фосфатном буфере, рН 6.8, в кювете объемом 4 мл при перемешивании магнитной мешалкой (“Экрос”, Россия) со скоростью 200 об./мин. Амплитуду изменения силы тока, проходящего через рабочий электрод, измеренную от момента добавления субстрата до достижения наибольшего уровня, принимали в качестве аналитического сигнала (ответа биосенсора). После каждого измерения электрод промывали буферным раствором в течение 1–2 мин.
Изучение процессов переноса электронов методом циклической вольтамперометрии. Вольтамперометрические измерения проводили в 33 мМ натрий-калий-фосфатном буфере, рН 6.8, в бескислородной среде. Кислород удаляли из буферного раствора барботированием аргоном в течение 10 мин в кювете перед измерением и во время проведения измерений. Режим циклических вольтамперограмм получали с использованием гальванопотенциостата Экотест-ВА (“Эконикс-Эксперт”, Россия). Диапазон потенциалов составлял –0.8–0.8 В, скорость развертки потенциала изменяли в пределах от 10 до 100 мВ/с.
Сканирующая электронная микроскопия (СЭМ). На печатные электроды напыляли тонкий слой платиново-углеродной смеси в вакуумно-напылительной установке JEE-4X (“JEOL”, Япония). Электронно-микроскопический анализ проводили с помощью сканирующего электронного микроскопа JSM-6510 LV (“JEOL”, Япония) в режиме высокого вакуума при регистрации вторичных электронов.
Определение содержания молочной кислоты, глюкозы и крахмала методом капиллярного электрофореза. Измерения проводили с использованием системы капиллярного электрофореза Капель-104Т (“Люмэкс”, Россия) с отрицательной полярностью высокого напряжения, оснащенной кварцевым капилляром (внутренний диаметр 50 мкм, эффективная длина 65 и полная длина 75 см) и фотометрическим детектором, позволяющим проводить измерения при 254 нм. Перед анализом пробы фильтровали через мембрану (“Millipore”, США). Аналитическим сигналом являлась площадь пика. При определении содержания крахмала проводили предварительный гидролиз анализируемого образца. Для этого его нагревали на водяной бане в 1.2%-ной соляной кислоте в течение 15 мин, осаждали белковые вещества, отфильтровывали и проводили анализ, как описано выше.
Определение содержания этилового спирта методом газовой хроматографии. Содержание этилового спирта определяли методом газожидкостной хроматографии (ГХ) на хроматографе “Кристал-5000.2" (ЗАО СКБ "Хроматэк”, Россия) с использованием пламенно-ионизационного детектора и капиллярной колонки DB-FFAP (50 м × 0.32 мм × 0.50 мкм) (“Agilent”, США). Условия анализа были следующие: температура термостата колонки составляла 70, испарителя – 200, детектора – 250°С, скорость потока газа-носителя (гелия) – 0.10 дм3/ч.
Модельный процесс брожения и получение сброженной массы. Пшеничную муку суспендировали в теплой дистиллированной воде и нагревали до 90°C. В полученную массу добавляли ферментный препарат Termamyl (“Novozymes A/S”, Дания), и инкубировали смесь в течение 2 ч в термостате при перемешивании. Затем реакционную массу охлаждали до 60°C и добавляли ферментный препарат SAN Super 360L (“Novozymes A/S”, Дания), инкубировали в термостате в течение 2 ч при перемешивании. После этого смесь охлаждали до 30°C, добавляли к ней дрожжевой препарат (“SuperStart”, Россия) и инкубировали в течение 70 ч для брожения. При этом через 2, 4, 8, 12, 24 и 48 ч после начала процесса отбирали пробы.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Разработка системы модифицированных печатных электродов. В предшествующей работе была показана возможность создания печатного электрода, содержащего ГО и одностенные углеродные нанотрубки, с прямым переносом электронов при окислении глюкозы [15]. В настоящей работе рассмотрена возможность создания системы биосенсоров на основе ферментных печатных электродов, модифицированных ОСУНТ, для определения глюкозы, этанола, лактата и крахмала. При создании печатных электродов для обнаружения глюкозы, лактата и этанола были использованы ферменты подкласса оксидаз. В качестве основы биосенсора для определения содержания глюкозы использовали ГО, которая обладает абсолютной специфичностью по отношению к β-D-глюкозе и катализирует реакцию ее окисления до глюконолактона (рис. 1). Для создания биосенсора, чувствительного к этанолу, печатные электроды модифицировали АО. Она не обладает такой селективностью, как ГО, по отношению к своему субстрату, но по сравнению с другим ферментом – алкогольдегидрогеназой, активно использующимся при создании биосенсоров, АО упрощает процедуру проведения измерений, так как не требует добавления в систему кофактора, который не может быть иммобилизован. Содержание лактата в данной работе предлагалось определять с помощью печатных электродов, модифицированных ЛО. Для определения содержания крахмала были созданы печатные электроды, модифицированные смесью двух ферментов: Ам и ГО. Под действием Ам происходит отщепление β-глюкозы от не редуцирующего конца амилозы и амилопектина крахмала и расщепление α-1,4, α-1,6 и α-1,3-гликозидных связей. Образующаяся в результате гидролиза глюкоза окисляется на электроде ГО до глюконолактона.
Рис. 1.
Схема разработанной системы биосенсоров: 1 – подложка, 2 – графитовый вспомогательный электрод, 3 – хлоридсеребряный электрод сравнения, 4 – графитовый рабочий электрод, модифицированный ферментом (для обнаружения глюкозы используется глюкозооксидаза), 5 – изолятор, 6 – контакты, 7 – потенциостат, 8 – персональный компьютер, 9 – рабочий электрод, модифицированный смесью глюкозооксидазы и амилазы, 10 – рабочий электрод, модифицированный алкогольоксидазой, 11 – рабочий электрод, модифицированный лактатоксидазой. На графике приведено изменение сигнала биосенсора после добавления субстрата.
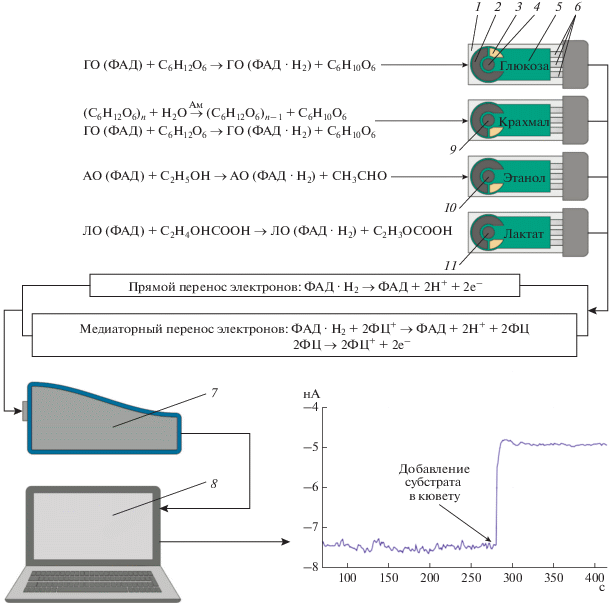
Ранее была показана возможность создания системы биосенсоров на основе печатных электродов, модифицированных берлинской лазурью и содержащих описанные выше ферменты для определения содержания глюкозы, этанола, молочной кислоты и крахмала в бродильных средах [13]. Описанная система сенсоров была основана на косвенной детекции анализируемых веществ за счет определения выделяющегося в ходе ферментативной реакции пероксида водорода. Использование ферментных биосенсоров на основе электродов, модифицированных углеродными нанотрубками, позволила существенно повысить точность и надежность анализа вследствие прямой детекции происходящей ферментативной реакции (рис. 1). В качестве сравнения для изучения эффективности электродов на основе прямого переноса были использованы медиаторные электроды, модифицированные ферроценом. Ферроцен является одним из наиболее широко используемых медиаторов электронного транспорта и обладает высокой обратимостью окислительно-восстановительных процессов [21–23].
Для иммобилизации ферментов был использован метод капсулирования в мембрану белка, поперечно-сшитого БСА. На рис. 2 представлены микрофотографии поверхности разработанных электродов на различных этапах модификации, полученные методом СЭМ.
Рис. 2.
СЭМ изображение поверхности графитового рабочего электрода (а), ОСУНТ, используемых для создания проводящей матрицы (б), поверхности графитового рабочего электрода после нанесения проводящей белковой матрицы с УНТ (в) и поверхности графитового рабочего электрода после нанесения белковой матрицы с ферроценом (г).
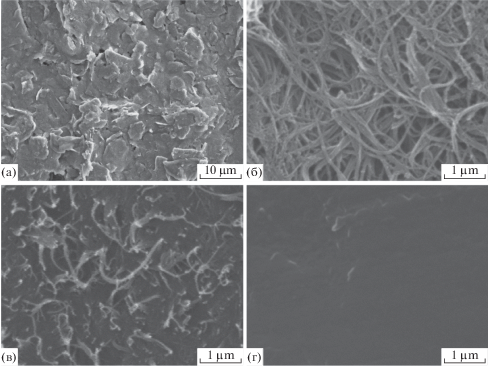
Используемый графитовый рабочий электрод обладал высокоразвитой поверхностью (рис. 2а), что обеспечивало большую площадь контакта фермента и проводящего геля с графитовым материалом поверхности и позволяло добиться высокой чувствительности разработанных печатных электродов. При этом для иммобилизации применяли матрицу на основе БСА, которая прочно удерживала биоматериал наноматериалом вследствие связывания молекул ферментов с БСА глутаровым альдегидом с образованием оснований Шиффа. После модификации матрицы ферментом и ОСУНТ (рис. 2б, 2в) наблюдалось равномерное распределение в ней нанотрубок, пронизывающих мембрану по всему объему. Таким образом, это значительно облегчало перенос электронов от фермента на электрод. Сформированная белковая матрица, содержащая ферроцен, равномерно покрывала поверхность рабочего электрода (рис. 2г). Получаемая после сшивания молекул БСА глутаровым альдегидом структура имела поры, размер которых был сопоставим с размерами используемых ферментов [24] и не препятствовал диффузии субстратов и метаболитов, что положительно сказывалось на характеристиках биосенсора [25, 26].
Благодаря использованию разработанной технологии, модифицированные печатные электроды характеризовались высокой воспроизводимостью при изготовлении. Стандартное отклонение серии ответов на одинаковые концентрации аналитов биосенсоров с электродами на основе разных партий не превышало 10%.
После модификации электрода гидрогелем ковалентно-сшитого БСА с ОСУНТ на циклических вольтамперограммах (ЦВА) печатных электродов в диапазоне потенциалов от –0.8 до 0.8 В (рис. 3) наблюдалось увеличение электропроводности (зависимости “а” и “б” на рис. 3), при этом отсутствовали явно различимые окислительно-восстановительные пики, что свидетельствовало об электрохимически неактивных соединениях в выбранном диапазоне потенциалов. На ЦВА электрода, модифицированного смесью ГО и УНТ, иммобилизованных в гидрогель БСА в буфере, насыщенном аргоном, наблюдали появление пары окислительно-восстановительных пиков, которые указывали на присутствие в системе электроактивной формы фермента (зависимость “в” на рис. 3).
Рис. 3.
Циклические вольамперограммы, записанные при скорости сканирования 50 мВ/с для пустого графитового печатного электрода (1), графитового печатного электрода, содержащего одностенные углеродные нанотрубки (2) и графитового печатного электрода, содержащего глюкозооксидазу и одностенные углеродные нанотрубки, помещенные в насыщенный аргоном буферный раствор (3).
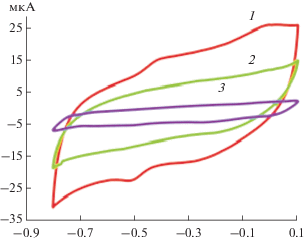
Анодный пик проявлялся при потенциале Epa = = –450 мВ, а катодный – при Epc = –500 мВ. Разделение пиков (ΔEp) составило 50 мВ. Полученные значения анодного и катодного пиков для данного модифицированного печатного электрода хорошо согласовывались с электрохимическим поведением ГО в нейтральных средах [15] и позволяли предположить, что в этих условиях кофермент фермента, ФАД, способен обратимо восстанавливаться до ФАД · H2. Добавление глюкозы в систему увеличивало концентрацию ФАД · Н2 на поверхности электрода (рис. 4), приводя к сокращению концентрации ФАД. При этом катодный пик, соответствующий переходу ФАД в восстановленную форму ФАД · Н2, уменьшался, а анодный пик, соответствующий обратной реакции, увеличивался. Протекание этой реакции в насыщенном аргоном буферном растворе свидетельствовало о том, что переход ФАД · Н2 в окисленную форму происходил без участия кислорода или любого другого акцептора электронов, а вследствие прямого электронного переноса.
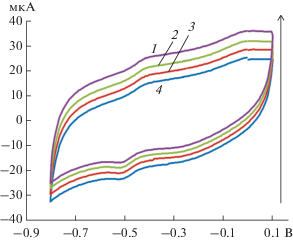
Рис. 4.
Циклические вольатмперограммы биосенсора на основе глюкозооксидазы и углеродных нанотрубок, иммобилизованных на поверхности графитового печатного электрода при добавлении 0.5 (1), 1 (2), 1.5 (3) и 2 мМ (4) глюкозы при отсутствии кислорода; увеличение концентрации глюкозы обозначено стрелкой.
Определение механизма процессов, протекающих на разработанных электродах, проведено в соответствии с алгоритмом, описанным в работе [15]. Показано, что процессы, происходящие на всех разработанных электродах с УНТ, оказались обратимыми и не осложненными сопутствующей химической реакцией, что указывало на прямой перенос электронов между ФАД · H2 и электродом. Обратимое окисление-восстановление ФАД · H2/ФАД на поверхности ОСУНТ протекало под диффузионным контролем. Константы скорости электрохимического процесса составили: 0.006 с–1 (для электродов на основе ГО, и ГО с Ам), 0.005 с–1 (для электрода на основе ЛО) и 0.0007 с–1 (для электрода на основе АО). Полученные константы оказались несколько ниже, чем у аналогов на основе многостенных УНТ и высоко ориентированных полианилиновых нанотрубок [27], однако в целом позволяли предположить, что созданные электроды обладали высокими аналитическими характеристиками.
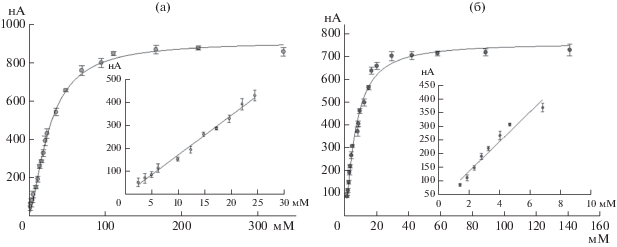
Определение характеристик системы биосенсоров на основе разработанных печатных электродов. Для оценки чувствительности созданных электродов и диапазона определяемых ими концентраций были построены градуировочные зависимости ответов биосенсоров на основе разработанных печатных электродов от концентрации субстратов в измерительной кювете. На рис. 5 представлены такие зависимости для электродов на основе АО с проводящим гелем на основе УНТ и ферроцена. Остальные градуировочные зависимости имели аналогичный вид и в работе не представлены.
Рецепторные элементы на основе ферментов являются биорецепторами каталитического типа, то есть биологический ответ в таких системах обеспечивается ферментативными реакциями. Градуировочную зависимость, приведенную на рис. 4, описывали уравнением типа Михаэлиса–Ментен:
где Rmax – максимальный ответ биосенсора, при котором все молекулы фермента биорецепторного элемента участвовали в образовании фермент-субстратного комплекса; KM – эффективная константа Михаэлиса, численно равная концентрации субстрата, при которой уровень ответа биосенсора достигал половины максимального значения, [S] – концентрация субстрата. Операционная стабильность показывала устойчивость ответа сенсора на одну и ту же концентрацию субстрата при проведении большого числа последовательных измерений и была тесно связана с метрологической характеристикой сходимостью (повторяемостью).В табл. 1 представлены характеристики биосенсоров на основе полученных модифицированных печатных электродов. Таким образом, углеродные нанотрубки в различной степени влияли на характеристики модифицированных сенсоров, однако в большинстве случаев значительно улучшали чувствительность и рабочий диапазон определяемых концентраций по сравнению с аналогом на основе медиатора ферроцена. При взаимодействии нанотрубок с АО сродство фермента к этиловому спирту ухудшалось, что вызывало расширение рабочего диапазона в сторону больших концентраций и снижение чувствительности в ~3 раза. Данный факт можно объяснить нестабильностью конформации фермента при взаимодействии с УНТ [28].
Таблица 1.
Основные характеристики ферментных биосенсоров на основе модифицированных печатных электродов
| Определяемое вещество | Характеристики | Преобразователь | |||
|---|---|---|---|---|---|
| графитовый печатный электрод с УНТ (данная работа) | графитовый печатный электрод с ФЦ (данная работа) | платиновый печатный электрод [78] | графитовый
печатный
электрод с БЛ [13] |
||
| Глюкоза | Коэффициент чувствительности, нА дм3/ммоль | 1700 ± 100 | 85 ± 5 | – | 310 ± 8 |
| Диапазон определяемых концентраций, ммоль/дм3 | 0.1–2.7 | 0.75–2.5 | 0.3–20 | 0.05–1.1 | |
| Операционная стабильность, % | 4.1 | 2.2 | 2.3 | 3 | |
| Длительность одиночного измерения, мин | 1 | 1 | – | 1 | |
| Лактат | Коэффициент чувствительности, нА дм3/ммоль | 30 ± 1 | 10.1 ± 0.8 | – | 11.7 ± 0.5 |
| Диапазон определяемых концентраций, ммоль/дм3 | 0.02–73 | 0.15 - 61 | 0.08–1 | 1–53 | |
| Операционная стабильность, % | 4.6 | 2.8 | 5.4 | 13 | |
| Длительность одиночного измерения, мин | 1 | 1 | – | 1 | |
| Этиловый спирт | Коэффициент чувствительности, нА дм3/ммоль | 17 ± 1 | 60 ± 5 | – | 480 ± 10 |
| Диапазон определяемых концентраций, ммоль/дм3 | 1–27 | 0.6–6.9 | 0.04–2.5 | 0.09–0.9 | |
| Операционная стабильность, % | 3.3 | 3.9 | 4.2 | 2 | |
| Длительность одиночного измерения, мин | 1 | 1 | – | 1–2 | |
| Крахмал | Коэффициент чувствительности, нА дм3/мг | 30 ± 1 | 1.01 ± 0.09 | – | 640 ± 20 |
| Диапазон определяемых концентраций, мг/дм3 | 0.6–21 | 2–30 | – | 0.03–0.59 | |
| Операционная стабильность, % | 3.5 | 5.4 | – | 6 | |
| Длительность одиночного измерения, мин | 3 | 3 | – | 3 | |
Важно отметить, что разработанная система биосенсоров по аналитическим и метрологическим характеристикам не только не уступала мировым аналогам [6, 7, 29], но и частично превосходила их. Так, она обладала более широким диапазоном определяемых концентраций глюкозы, лактата и крахмала по сравнению с описанными прототипами [29, 30]. Характеристики биосенсоров для определения глюкозы и лактата превосходили аналогичные параметры для биосенсоров без прямого переноса [13]. Разработанная система биосенсоров в отличие от известных аналогов позволяла проводить совместное селективное определение содержания крахмала, глюкозы, лактата и этанола в бродильных средах.
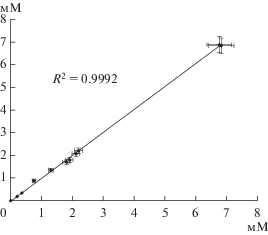
Анализ биотехнологической продукции и бродильной массы. Для апробации разработанной системы биосенсоров на основе проводящего геля с УНТ были использованы продукты, полученные в процессе ферментативного брожения. Они включали алкогольную и кисломолочную продукцию, квас, бродильную массу, отобранную на разных стадиях протекания процесса брожения при получении этилового спирта. В каждой серии анализов определяли содержание глюкозы, лактата, этилового спирта или крахмала биосенсорным и референтными методами. В качестве референтных методов были использованы газовая хроматография и капиллярный электрофорез. Результаты определения содержания этилового спирта различными методами представлены на рис. 6. Для анализа других компонентов графики имели аналогичный вид. Коэффициенты корреляции для анализа глюкозы, молочной кислоты и крахмала составили, соответственно: 0.9985, 0.9989 и 0.9965.
Рис. 5.
Градуировочные зависимости ответа сенсора от концентрации этилового спирта для электрода на основе алкогольоксидазы, модифицированного углеродными нанотрубками (а) или ферроценом (б).
В результате проведения статистического анализа результатов измерений с использованием модифицированного теста Стьюдента оказалось, что значения концентраций определяемых веществ, полученные с использованием системы биосенсоров, разработанной на основе печатных электродов, и референтными методами, различались незначимо. Печатные электроды в сочетании с предложенным методом модификации проводящим гидрогелем на основе УНТ позволяли создавать биосенсоры с высокими аналитическими и метрологическими характеристиками, которые могут применяться для определения содержания лактата, глюкозы и крахмала в бродильных средах. Таким образом, показано, что при модификации полученных трафаретной печатью электродов ферментами и проводящим гидрогелем на основе поперечно-сшитого БСА и одностенных углеродных нанотрубок были получены биосенсоры с высокими характеристиками, частично превышающими описанные ранее. Модификация ОСУНТ вызывала эффект прямого переноса электронов при окислении глюкозы, лактата и этилового спирта. На основе полученных электродов разработана система биосенсоров для контроля биотехнологических процессов. Диапазон определяемых ими концентраций глюкозы, этилового спирта, лактата и крахмала составил 0.1 – 2.7, 1 – 27, 0.02 – 73 мМ и 0.6 – 21 г/л соответственно.
Проведено определение содержания компонентов в алкогольной продукции и бродильной массе с помощью системы биосенсоров на основе разработанных печатных электродов, модифицированных ферментами, и референтными методами. Полученные данные свидетельствовали о том, что модифицированные печатные электроды могут служить основой для создания биосенсоров с высокими аналитическими и метрологическими характеристиками. Таким образом, применение для контроля биотехнологических процессов системы биосенсоров на основе модифицированных ферментами печатных электродов может рассматриваться как альтернатива классическим аналитическим методам.
Рис. 6.
Корреляция результатов определения этанола с использованием биосенсора с данными газовой хроматографии.
В настоящее время биосенсоры на основе печатных электродов широко используются только для анализа глюкозы в крови и являются одноразовыми. Результаты, полученные в работе, позволят расширить возможности их применения и дать перспективу к развитию современной аналитической биотехнологии, а практическое внедрение новых анализаторов – увеличить экономическую отдачу биотехнологических производств и повысить их экологическую безопасность.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 17-74-10078).
Список литературы
Lopez C., Mielgo I., Moreira M.T., Feijoo G., Lema J.M. // J. Biotechnol. 2002. V. 99. № 3. P. 249–257.
D’Este M., Alvarado-Morales M., Angelidaki I. // Biotechnol. Adv. 2018. V. 36. № 1. P. 14–25.
Newman J.D., Turner A.P.F. // Biosens. Bioelectron. 2005. V. 20. I. 12. P. 2435–2453.
Backer M., Rakowski D., Poghossian A., Biselli M., Wagner P., Schoning M.J. // J. Biotechnol. 2013. V. 163. P. 371–376.
Monosik R., Magdolen P., Streďansky M., Sturdik E. // Food Chem. 2013. V. 138. P. 220–226.
Rama E.C., Biscay J., Gonzalez-Garcia M.B., Reviejo A.J., Pingarrón-Carrazon J.M., Costa-García A. // Anal. Chim. Acta. 2012. V. 728. P. 69–76.
Корнеева Л.Х., Борисова А.В., Яшина Е.И., Карякина Е.Е., Воронин О.Г., Косниер С. // Вестник Московского университета. Серия Химия. 2010. № 51. С. 62–70.
Lapa R.A.S., Lima J.L.F.C., Pinto I.V.O.S. // Food Chem. 2003. V. 81. P. 141–146.
Арляпов В.А., Понаморева О.Н., Алферов В.А. // Биотехнология. 2008. C. № 5. 84–91.
Min R.W., Rajendran V., Larsson N., Gorton L., Planas J., Hahn-Hagerdal B. // Anal. Chim. Acta. 1998. V. 366. P. 127–135.
Kumar M.A., Thakur M.S., Senthuran A., Senthuran V., Karanth N.G., Hatti-Kaul R. // World J. Microbiol. Biotechnol. 2001. V. 17. P. 23–29.
Moser I., Jobst G., Urban G.A. // Biosens. Bioelectron. 2002. V. 17. P. 297–302.
Kamanin S.S., Arlyapov V.A., Machulin A.V., Alferov V.A., Reshetilov A.N. // Russ. J. Appl. Chem. 2015. V. 88. № 3. P. 463–472.
Bonanni A., Loo A.H., Pumera M. // Trends Anal. Chem. 2012. V. 37. P. 12–21.
Решетилов А.Н., Арляпов В.А., Каманин С.С., Каманина О.А. // Российские Нанотехнологии. 2017. № 12. С. 76–83.
Hanifah S.A., Heng L.Y., Ahmad M. // Anal. Sci. 2009. V. 25. P. 779–784.
Gupta S., Prabha C.R., Murthy C.N. // J. Environ. Chem. 2016. V. 4. P. 3734–3740.
Lamas-Ardisana P.J., Loaiza O.A., Anorga L., Jubete E., Borghei M., Ruiz V. // Biosens. Bioelectron. 2014. V. 56. P. 345–351.
Loaiza O.A., Lamas-Ardisana P.J., Anorga L., Jubete E., Ruiz V., Borghei M. // Bioelectrochemistry. 2015. V. 101. P. 58–65.
Bilgi M., Ayranci E. // Sensors Actuators B Chem. 2016. V. 237. P. 849–855.
Pandey P.C., Upadhyay S. // Sensors Actuators B Chem. 2001. V. 76. P. 193–198.
Vila N., Walcarius A. // Electrochim. Acta. 2015. V. 179. P. 304–314.
Pandey P.C., Upadhyay S., Tiwari I., Singh G., Tripathi V.S. // Sensors Actuators B Chem. 2001. V. 75. P. 48–55.
Huang B.X., Kim H.-Y., Dass C. // J. Am. Soc. Mass Spectrom. 2004. V. 15. P. 1237–1247.
Brena B., Gonzalez-Pombo P., Batista-Viera F. // Methods Mol. Biol. 2013. V. 1051. P. 15–31.
Арляпов В.А., Понаморева О.Н., Алферов С.В., Алферов В.А., Решетилов А.Н. // Сенсорные Системы. 2011. № 25. С. 352–360.
Wang Z., Liu S., Wu P., Cai C. // Anal. Chem. 2009. № 81. P. 1638–1645.
Yang N., Chen X., Ren T., Zhang P., Yang D. // Sensors Actuators B Chem. 2015. V. 207. P. 690–715.
Rahman M. // Int. J. Biol. Med. Res. 2010. V. 1. P. 9–14.
Lowinsohn D., Bertotti M. // J. Braz. Chem. Soc. 2008. V. 19. P. 637–642.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


