Прикладная биохимия и микробиология, 2019, T. 55, № 3, стр. 237-243
Действие антиоксидантных молекул на сенсорные и репортерные люминесцирующие штаммы
И. Ф. Каримов 1, *, К. С. Кондрашова 1, Н. А. Куликова 1, И. В. Манухов 2
1 Оренбургский государственный университет
460018 Оренбург, Россия
2 Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов
117545 Москва, Россия
* E-mail: ifkarimov@yandex.ru
Поступила в редакцию 16.05.2018
После доработки 14.09.2018
Принята к публикации 18.12.2018
Аннотация
Изучено действие различных типов антиоксидантных молекул на рекомбинантные люминесцирующие бактериальные биосенсоры. Обнаружена способность тиамина активировать промоторы окислительного стресса преимущественно у биосенсоров на основе родительских клеток Salmonella typhimurium LT2. Выявлена индукция промоторов soxS и katG, а также активация системы SOS-ответа использованных биосенсоров в присутствии пиридоксина. Показано, что аскорбиновая кислота обладала выраженными прооксидантными и токсическими свойствами. Другие соединения оказались менее активными и не обеспечивали индукцию антиоксидантных и репарационных систем люминесцирующих биосенсоров на основе родительских клеток S. typhimurium LT2 и Escherichia coli MG1655.
Эволюция живых систем определила изменение внешней среды путем их прямого действия на окружающие объекты. Одним из важнейших проявлений данного воздействия стало формирование современной атмосферы планеты. При этом образовавшийся кислород как продукт фотосинтеза цианобактерий существенно повлиял на метаболические системы клеток и привел к образованию аэробного дыхания. Как следствие, живые организмы сформировали комплекс систем защиты от побочных метаболитов реакции окисления [1].
В этом аспекте антиоксидантные системы можно разделить на два типа: ферментные комплексы и молекулярные ловушки [2]. Первую группу представляют различные типы супероксиддисмутаз (КФ 1.15.1.11), каталаз (КФ 1.11.1.6) и глутатионпероксидаз (КФ 1.11.1.9), обеспечивающих превращение и разрушение активных форм кислорода (АФК) и реактивных форм азота (РФА) [3]. Указанные ферменты синтезируются при воздействии свободных радикалов на рецепторные системы окислительного стресса, ключевую роль среди которых у бактерий играют регулоны soxRS и oxyR, обеспечивающие нейтрализацию супероксид аниона [4] и пероксида водорода [5] соответственно. Вторая группа антиоксидантных систем представлена универсальными соединениями, включающими витамины, каротиноиды, хиноны и флавоноиды, часто применяемые в биомедицинских целях.
Антиоксидантные молекулы снижают уровень окислительного стресса в клетках и тканях, что на модельных системах in vitro регистрируется с использованием 2,2-дифенил-1-пикрилгидразина, а в системах in vivo ‑ по уровню липопероксидации и активности ферментов [6]. При этом химические индикаторы окисления, несмотря на удобство использования, не позволяют полноценно экстраполировать полученные результаты на живые системы вследствие несоизмеримости строения и организации, а оценка косвенных показателей одной из тканей не является достаточной для понимания механизма действия анализируемых соединений.
В настоящее время появляется все больше данных, свидетельствующих о неоднозначности действия антиоксидантных молекул, которое в некоторых случаях носит противоположный характер. В частности, каротиноиды при высокой концентрации демонстрируют прооксидантные свойства [7], а аскорбиновая кислота в присутствии ионов железа(III) обеспечивает реакцию с тиобарбитуровой кислотой [8]. Наличие токсических эффектов [9] и указанные выше факты требуют более жесткого регулирования использования витаминов и подобных небелковых соединений в медицине, часто применяемых в качестве сопутствующих терапевтических препаратов [10, 11].
При изучении процессов окисления может оцениваться активность генов окислительного стресса, которую удобно определять с помощью рекомбинантных бактерий. Реализация такого подхода требует введения плазмид, в которых целевые промоторы сшиты с репортерными генами, обеспечивающими синтез фермента, флуоресцирующего белка или люминесцентного комплекса [7, 8]. Было показано, что действие феруловой и ванилиновой кислот на Escherichia coli с фьюженом aaeXAB::luxCDABE на плазмиде pDMA3 обеспечивает индукцию использованного промотора [12]. Показана возможность изучения активности антиоксидантов с использованием E. coli с плазмидой pKatG::luxCDABE в присутствии пероксида водорода [13].
Цель работы ‑ изучение действия антиоксидантных молекул на сенсорные и репортерные штаммы, у которых конститутивные промоторы и промоторы окислительного стресса и репарации ДНК вшиты перед генами свечения.
МЕТОДИКА
Бактериальные штаммы. В качестве объектов исследования были использованы рекомбинантные штаммы на основе родительских клеток S. typhimurium LT2 и E. coli MG1655, трансформированные плазмидами pSoxS::lux и pKatG::lux, которые характеризуются свечением, индуцируемым в ответ на окислительный стресс, а также плазмидой pRecA::lux, позволяющей обнаружить повреждение ДНК. Применялись также штаммы на основе указанных родительских клеток, трансформированные плазмидой pACXen с конститутивным типом свечения, которые позволяют оценить токсическое влияние изучаемых факторов (АФК и РФА) по характеру биолюминесценции. Во всех штаммах векторы содержат гены luxCDABE природной светящейся бактерии Photorhadus luminescens.
Химические вещества. В качестве антиоксидантных молекул были использованы различные препараты, выпускаемые фармацевтической промышленностью, среди них витамины группы В – тиамин (В1) (“Борисовский завод медицинских препаратов”, Беларусь), пиридоксин (В6) (“Ереванская химико-фармацевтическая фирма”, Армения), никотиновая кислота (B3) (“Органика”, Россия) и аскорбиновая кислота (витамин С) (ЗАО “ФП Мелиген”, Россия) а также ампициллин (ОАО “Синтез”, Россия) и коэнзим Q10 (убихинон) (“Полярис”, Россия) и молекулы аутоиндукторы, в частности N-гексаноил-L-гомосерин лактон (С6-ГСЛ) и N-додеканоил-L-гомосерин лактон (С12-ГСЛ) (“Sigma-Aldrich”, США).
Биолюминесцентный тест. Используемые штаммы культивировали в течение 1 сут на LB-агаре (по Мюллеру) при 37°C с добавлением селективного фактора для штаммов с плазмидами pSoxS::lux, pKatG::lux, pRecA::lux и pXen7 – 100 мкг/мл ампициллина и для штаммов с плазмидой pACXen – 125 мкг/мл тетрациклина. Далее клетки суспендировали в 0.9%-ном растворе NaCl до оптической плотности при 450 нм 0.5 отн. ед., которую измеряли в пластиковых прозрачных лунках на фотометре StatFax 303+ (“Awareness”, США). Затем добавляли 100 мкл готовой суспензии бактерий S. typhimurium LT2 и E. coli MG1655, содержащих плазмиды pSoxS::lux, pKatG::lux и pRecA::lux, в 1400 мкл LB-бульона, и инкубировали 90 мин в шейкере StatFax 2200 (“Awareness”, США) при 500 об./мин и 37°C. В случае сенсорных штаммов 500 мкл бактериальной суспензии клеток S. typhimurium LT2 pACXen и E. coli MG1655 pXen7 вносили в 1000 мкл LB-бульона без дополнительного подращивания.
Для оценки воздействия антиоксидантов анализируемые вещества двукратно разводили в белых непрозрачных лунках планшета, при этом в качестве контрольных проб служили лунки с водой (для детекции фонового свечения бактерий), а также лунки с модельным окислителем для контроля ответной индукции свечения (кроме штаммов с конститутивным типом люминесценции) с использованием для pSoxS::lux – паракват (0.01 М), pKatG::lux – пероксид водорода (0.04 М), pRecA::lux – митомицин С (0.001 М). Во все лунки добавляли по 100 мкл подготовленной суспензии микроорганизмов. Далее планшет помещали в измерительный блок люминометра Infinite 200 (“Tecan”, Австрия) и оценивали люминесценцию в кинетическом режиме в течение 120 мин при 37°C.
Статистика. Эксперименты выполнены не менее чем в трех повторностях. Полученные результаты первично обрабатывали с использованием программного обеспечения планшетного люминометра Magellan (“Tecan”, Австрия), а дальнейшую обработку полученных данных осуществляли с помощью компьютерной программы “Еxcel 2010” (“Microsoft Inc.”, США).
На основании полученных значений строили графики кинетики изменения свечения штаммов, интенсивность которого измеряли в единицах RLU (relative luminescent units). Первичные значения свечения нормализовали по контролю, для чего расчет проводили по формуле:
Применение биолюминесцентного подхода с использованием штаммов S. typhimurium LT2 pACXen и E. coli MG1655 pXen7 позволило установить уровень токсичности индукторов окислительного стресса и рассчитать показатели IС20 и IС50 (такое содержание индуктора, которое вызывало 20 и 50%-ное подавление люминесценции). Для репортерных штаммов оценивали пороговую чувствительность и максимальную амплитуду ответа.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
На первом этапе было оценено действие модельного индуктора, в качестве которого был выбран пероксид водорода, на использованные в работе штаммы микроорганизмов. При этом кинетика свечения штаммов E. coli MG1655 с плазмидами pSoxS::lux и pKatG::lux характеризовалась интенсивной индукцией на действующий агент, достигающей максимума на 30 мин. Для аналогичных штаммов на основе родительских клеток S. typhimurium LT2 максимум достигался на 60 мин, а для репортерных штаммов с плазмидами pRecA::lux ‑ на 120 мин. Промоторы katG оказались наиболее чувствительны к данному индуктору, демонстрируя порог восприятия от 1.52 × 10–5 М и максимум свечения при 0.97 × 10–3 М. Окисление регуляторного белка регулона soxRS наблюдали при высоких концентрациях (от 6.10 × 10–5 М и выше), однако при превышении 10–3 М происходило угнетение свечения, связанное с нарушением жизнедеятельности биосенсора. Об этом свидетельствовала активация генов репарации, при которой максимум свечения плазмиды pRecA::lux при критической концентрации пероксида водорода оказался равным 1.50 × 10–2 М. При этом сенсорные штаммы с конститутивным свечением теряли большую часть люминесценции при концентрации модельного индуктора 6.25 × 10–2 М, а при его больших дозах все биосенсоры утрачивали способность к биолюминесценции.
Среди использованных соединений одним из наиболее сильных прооксидантов оказался тиамин, способный с выраженной специфичностью осуществлять активацию генов окислительного стресса у S. typhimurium LT2 (рис. 1). При этом для штамма с плазмидой pSoxS::lux наблюдалась максимальная индукция при 0.094 М (Imax = 13.1 ± 1.4), а для штамма с плазмидой pKatG::lux ‑ при 0.188 М (Imax = 5.8 ± 1.2), что, вероятно, свидетельствовало о свободнорадикальном механизме данного процесса, а не прямом окислении сенсорных белков (табл. 1). Индукционный ответ от E. coli MG1655 с pSoxS::lux не был обнаружен, что обусловлено особенностями структуры рецепторных систем [14] и различием спектра восприятия данного штамма [15]. Тем не менее уровень его свечения дозозависимо уменьшался вплоть до 6.2 ± 0.9 тыс. RLU по сравнению с 12.5 ± 1.3 тыс. RLU в контрольной пробе (p < 0.001), отражая степень нарушения клеточного метаболизма. Биосенсор E. coli MG1655 с pKatG::lux в ответ на воздействие тиамина не проявлял достоверного увеличения свечения, а индукция люминесценции штаммов с плазмидами pRecA::lux при действии витамина B1 не претерпевала значительных изменений (p > 0.05), что свидетельствовало об отсутствии генотоксического эффекта. При этом также не было зарегистрировано тушение свечения сенсорных штаммов, отражающее наличие токсического влияния аналита, а максимальное подавление люминесценции не превышало 20% от значений контрольной пробы.
Рис. 1.
Зависимость нормализованного индекса свечения (Iнорм) S. typhimurium с pSoxS::lux (1) и pKatG::lux (2), E. coli с pSoxS::lux (3) и pKatG::lux (4) от концентрации (мМ) тиамина (а), аскорбиновой кислоты (б) и пиридоксина (в).
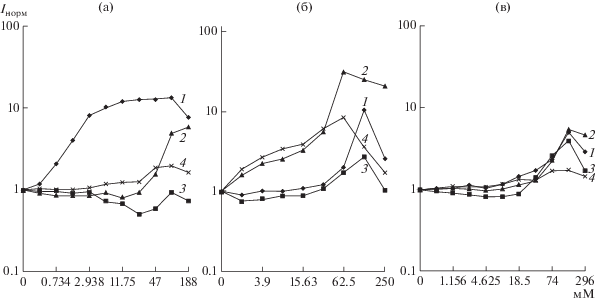
Таблица 1.
Максимальный уровень индукции свечения lux-биосенсоров на основе S. typhimurium LT2 (1) и E. coli K12 MG1655 (2) при концентрации индуктора (дана в скобках)
| Использованные вещества | Генетические конструкции: | |||||
|---|---|---|---|---|---|---|
| pSoxS::lux | pKatG::lux | pRecA::lux | ||||
| 1 | 2 | 1 | 2 | 1 | 2 | |
| Тиамин | 13.1 ± 1.4 (0.094 М) | – | 5.8 ± 1.2 (0.188 М) | – | – | – |
| Пиридоксин | 5.2 ± 0.6 (0.148 М) | 4.1 ± 0.5 (0.148 М) | 6.3 ± 0.5 (0.148 М) | 2.2 ± 0.4 (0.148 М) | 2.2 ± 0.5 (0.5 М) | |
| Никотиновая кислота | – | – | 2.0 ± 0.2 (0.081 М) | – | – | – |
| Аскорбиновая кислота | 10.3 ± 1.1 (0.125 М) | 2.7 ± 0.8 (0.125 М) | 23.8 ± 2.3 (0.0625 М) | 8.4 ± 0.7 (0.0625 М) | 2.7 ± 0.2 (0.0625 М) | 2.4 ± 0.5 (0.0625 М) |
| Коэнзим Q10 | 2.2 ± 0.2 (0.25 М) | – | – | – | – | – |
| N-додеканоил-ГСЛ | – | – | – | – | – | – |
| N-гексаноил-ГСЛ | – | – | – | – | – | – |
| Ампициллин | – | – | – | – | – | – |
Действие пиридоксина характеризовалось более широким спектром активации генов окислительного стресса, но меньшими величинами индукции люминесценции. Диапазон активно действующих концентраций лежал в пределах от 0.074 до 0.296 М, а наиболее выраженная реакция была зарегистрирована для штаммов S. typhimurium LT2 и E. coli MG1655 с плазмидой pSoxS::lux, уровень индукции свечения которых составил 5.2 ± 0.6 и 4.1 ± 0.5 ед. при 0.148 М, и при дальнейшем увеличении концентрации происходило снижение отклика биосенсоров. Штаммы с плазмидами pKatG::lux при указанных выше концентрациях пиридоксина также ответили ростом свечения, однако их значения существенно различались. Так, для S. typhimurium LT2 данный показатель составил 6.3 ± 0.5 ед., тогда как для E. coli MG1655 только 2.2 ± 0.4. Общую закономерность наблюдали для порога чувствительности штаммов с плазмидами pKatG::lux, который оказался в два раза более низким по сравнению с биосенсорами, несущими плазмиду pSoxS::lux. Пиридоксин проявил также генотоксические свойства, которые регистрировались по увеличению свечения штаммов с плазмидами pRecA::lux при концентрации 0.148 М и выше для обоих типов родительских клеток. При этом тушение свечения сенсорных штаммов было незначительным, что свидетельствовало о невысокой токсичности данного антиоксиданта, и возможности клетки позволяли компенсировать его негативное воздействие. В свою очередь, витамин B6 образовывал стабильный кислородный метаболит, способный воздействовать на широкую группу регуляторных систем клетки, проявляя более высокую специфичность по отношению к биосенсорам на основе S. typhimurium LT2.
Никотиновая кислота оказалась одним из наименее активных соединений, в ответ на которое большинство использованных люминесцирующих репортерных и сенсорных биосенсоров не проявляли чувствительность. Исключение составил штамм S. typhimurium LT2 с pKatG::lux, индукция свечения которого достигала 2.0 ± 0.2 единиц при ее концентрации 0.081 М. Меньшие концентрации индуктора не оказывали достоверного эффекта на кинетику люминесценции этого штамма. Присутствие никотиновой кислоты в максимальной концентрации обеспечивало рост свечения штаммов S. typhimurium LT2 с pACXen и E. coli MG1655 с pXen7 на 65.1 ± 1.9 и 16.9 ± 2.8% соответственно.
Аскорбиновая кислота в этом биотесте продемонстрировала выраженные прооксидантые и токсические свойства, обусловленные, в первую очередь, использованием более высоких концентраций по сравнению с другими соединениями. Так, ответ репортерных штаммов с плазмидой pSoxS::lux характеризовался индукцией свечения только при содержании обоих штаммов 0.125 М, но для E. coli MG1655 индекс индукции составил только 2.7 ± 0.8 ед., а для S. typhimurium LT2 – 10.3 ± 1.1 ед., а при их содержании 0.25 М оказался равным 2.6 ± 0.8 ед. Дальнейшее увеличение концентрации этого индуктора вызывало угнетение свечения бактерий. Наиболее сильный ответ был зарегистрирован при действии аскорбиновой кислоты на штамм S. typhimurium LT2 с pKatG::lux, для которого максимальное свечение при 0.0625 М составило 87 000 RLU против 36 000 RLU в контрольной пробе. Индекс индукции в данном случае составил 23.8 ± 2.3 ед., а рост концентрации вещества давал близкие по величине показатели свечения, сменяющиеся на более низкие при 0.5 М и выше. Для данного штамма пороговая чувствительность составила 0.004 М, при которой I равнялась 2.3 ± 0.4 ед. Второй штамм E. coli MG1655 с аналогичной генетической конструкцией pKatG::lux продемонстрировал максимальный ответ на ту же концентрацию, что и штамм S. typhimurium LT2 с pKatG::lux, однако значения индекса индукции составили только 8.4 ± 0.7 ед. При этом эффект “плато” не сохранялся при дальнейшем росте содержания аскорбиновой кислоты, а происходило понижение интенсивности ответа вплоть до полного тушения при 0.5 М. Однако порог чувствительности данного штамма оказался ниже и позволял детектировать 0.002 М с уровнем свечения 148 000 против 79 000 RLU в контрольной пробе. Штаммы S. typhimurium LT2 и E. coli MG1655 с плазмидами pRecA::lux в ответ на 0.0625 М аскорбиновой кислоты ответили индукцией свечения до 2.7 ± 0.2 и 2.4 ± 0.5 единиц соответственно. При этом первый биосенсор при повышении концентрации индуктора до 0.25 М реагировал более интенсивным свечением (до 3.5 ед.), тогда как дальнейшее увеличение содержания действующего агента его тушило. Только при действии аскорбиновой кислоты на оба сенсорных штамма удалось зарегистрировать показатель IC50, равный 0.185 и 0.105 М для S. typhimurium LT2 с pACXen и E. coli MG1655 с pXen7 соответственно. При этом 0.0625 М аскорбиновой кислоты ингибировал свечение биосенсора S. typhimurium LT2 с pACXen на 60 и E. coli MG1655 с pXen7 на 30 мин, а 0.125 М этого соединения сокращало время наступления тушения в два раза (до 30 и 15 мин соответственно). Дальнейшее увеличение концентрации аскорбиновой кислоты вызывало острый токсический эффект, заключающийся в подавлении свечения с первых секунд контакта.
Остальные изученные соединения оказались малоактивными и не оказывали выраженного влияния на экспрессию рассматриваемых бактериальных промоторов. В частности, коэнзим Q10 не обеспечивал рост свечения репортерных штаммов, однако для всех использованных бактериальных культур наблюдалось снижение свечения в присутствии данного соединения. Ампициллин незначительно влиял на все штаммы, за исключением S. typhimurium LT2 с pACXen, не имеющего в составе плазмиды генов резистентности к этому антибиотику, что приводило к развитию бактерицидного эффекта от 10 мМ. Производные гомосерин лактона с различной длиной ацильного заместителя проявляли неодинаковое действие. Так, N-додеканоил-L-гомосерин лактон в большей степени подавлял биолюминесценцию штамма E. coli MG1655 с pSoxS::lux вплоть до 44 ± 1%, тогда как для других штаммов остаточный уровень свечения не опускался ниже 70% от контроля. С другой стороны, N-гексаноил-L-гомосерин лактон оказался гораздо более активным в качестве регулятора люциферазной активности, при этом изменения активности промоторов стресса не было обнаружено. При его действии на штаммы S. typhimurium LT2 с pACXen и E. coli MG1655 с pXen7 было зарегистрировано дозозависимое снижение свечения с показателями IC50, равными 1.8 × 10–5 и 1.6 × × 10–5 М, которое могло быть обусловлено активацией белка SdiA или действием на lux-бокс.
Для многих витаминов постулируются антиоксидантные свойства, оцениваемые по липидному окислению, механизм которого заключается в переносе протонов водорода с пиримидинового или тиазолового кольца [16]. Подобные наблюдения отмечаются как при проведении экспериментов с живыми объектами [17, 18], так и при оценке стабильности пищевых продуктов [19, 20]. Однако было обнаружено, что витамины, в частности тиамин, рибофлавин, никотиновая и фоливая кислоты, способны развивать прооксидантный эффект [21]. Установлено также, что тиамин, пиридоксин и карнитин способны индуцировать окислительный стресс при микросомальной липидной пероксидации в присутствии перхлората железа [22].
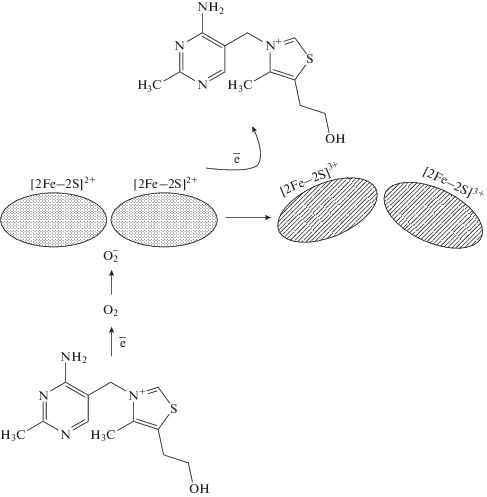
Полученные в данной работе результаты показали, что некоторые антиоксидантые молекулы способны активировать промоторы окислительного стресса и репарации бактерий, в частности, у рекомбинантных люминесцирующих биосенсоров на основе S. typhimurium LT2 и E. coli MG1655. Изучение механизма их действия (рис. 2) на сенсорные белки окислительного стресса позволило предположить природу подобного явления, которое потенциально обеспечивалось их прямым взаимодействием или индукцией через свободные радикалы.
Рис. 2.
Предполагаемый прямой и опосредованный через АФК механизм прооксидного действия тиамина на сенсорные белки с железо-серными кластерами.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 17-44-560554).
Список литературы
Connie C.W., Anke S., Markus L., Steven F.P., John N.M. // Compr. Physiol. 2013. V. 3. № 2. P. 849–915.
Birben E., Sahiner U.M., Sackesen C., Erzurum S., Kalayci O. // World Allergy Organ J. 2012. V. 5. № 1. P. 9–19.
Anu R., Amit K., Vivek S., Brijesh Y., Ruchi T., Sandip C., Kuldeep D. // Res. Int. 2014. V. 2014. Article ID 761264. 19 p.
Antonino B., Joseph S. // Microb. Cell Fact. 2013. V. 12. № 23. P. 1–9.
Qing W., Phu Nguyen Le M., Andreas D., Falk H., Warunya P., Ameer E., Sebastian S., Stéphane P., Daniel C., Daniel H., Susanne H., Pierre C. // Nucleic A-cids Res. 2012. V. 40. № 10. P. 4320–4333.
Alam N., Bristi N.J., Rafiquzzaman M. // Saudi. Pharm. J. 2013. V. 21. № 2. P. 143–152.
Young A.J., Lowe G.M. // Arch. Biochem. Biophys. 2001. V. 385. № 1. P. 20–27.
Riabchenko N.I., Riabchenko V.I., Ivannik B.P., D-zikovskaia L.A., Sin’kova R.V., Grosheva I.P., Degtiareva E.S., Ivanova T.I. // Radiats Biol. Radioecol. 2010. V. 50. № 2. P. 86–94.
Meyers D.G., Maloley P.A., Weeks D. // Arch. Intern. Med. 1996. V. 156. № 9. P. 25–35.
Agarwal A., Sekhon L.H. // Indian J Urol. 2011. V. 27. № 1. P. 74–85.
Lipinski B. // Oxid. Med. Cell Longev. 2011. V. 2011. Article ID 809696. 9 p.
Monnappa K., Lee S., Mitchell R.J. // Bioresource Technol. 2013. V. 127. P. 429–434.
Bartolome A., Macalino B., Pastoral I.L., Sevilla F. // Gen. Engin. Probes Biomed App. 2006. V. 6098. P. 21–26.
Pomposiello P.J., Demple B. // J. Bacteriol. 2000. V. 182. № 1. P. 23–29.
Каримова Д.Н., Манухов И.В., Гнучих Е.Ю., Каримов И.Ф., Дерябин Д.Г. // Прикл. биохимия и микробиология. 2016. Т. 52. № 3. С. 287–295.
Lukienko P.I., Mel’nichenko N.G., Zverinskii I.V., Zabrodskaya S.V. // Bull. Exp. Biol. Med. 2000. V. 130. № 9. P. 874–876.
Li X.Y., Huang H.H., Hu K., Liu Y., Jiang W.D., Jiang J., Li S.H., Feng L., Zhou X.Q. // Fish Physiol. Biochem. 2014. V. 40. № 3. P. 673–687.
Sharma A., Bist R., Bubber P. // J. Physiol. Biochem. 2013. V. 69. № 3. P. 539–546.
Szymandera-Buszka K., Hęś M., Waszkowiak K., Jędrusek-Golińska A. // Acta Sci. Pol. Technol. Aliment. 2014. V. 13. № 4. P. 393–401.
Mirshekar R., Dastar B., Shabanpour B. // Pak. J. Biol. Sci. 2009. V. 12. № 15. P. 1069–1074.
Higashi-Okai K., Nagino H., Yamada K., Okai Y. // J. Univer. Occup. Environ. Health. 2006. V. 28. № 4. P. 359–368.
Hu M.L., Chen Y.K., Lin Y.F. // Chem. Biol. Interact. 1995. V. 97. № 1. P. 63–73.
Дополнительные материалы отсутствуют.
Инструменты
Прикладная биохимия и микробиология


