Палеонтологический журнал, 2021, № 1, стр. 48-60
Морфологическая эволюция мшанок Евразии в течение фамена–турне
a Кубанский государственный университет
Краснодар, Россия
b Казанский (Приволжский) федеральный университет
Казань, Россия
* E-mail: zalatoi@yandex.ru
Поступила в редакцию 13.02.2020
После доработки 28.02.2020
Принята к публикации 28.02.2020
Аннотация
В результате изучения позднедевонско–раннемиссисипских мшанок Евразии установлены основные тенденции их морфологической эволюции на рубеже девона–карбона. С начала фаменского века и до конца турнейского возрастало разнообразие их вертикальных колоний: происходило разрастание везикулярной ткани у Cystoporata, изменение структуры стенок автозооидов у Trepostomata, усложнение полиморфизма у Cryptostomata, изменение строения прутьев у Fenestrata. Наиболее быстрые эволюционные изменения отмечены у рабдомезин из отряда Cryptostomata, выраженные в смене спирального расположения автозооидов на комплексное и высоком разнообразии гетерозооидов и стилей. Развитие в колониях мшанок килей, бугорков, защитных сеток, акантостилей и шипиков, очевидно, было связано с необходимостью защиты от хищников.
ВВЕДЕНИЕ
С ордовика по настоящее время мшанки широко представлены в различных водных биотопах планеты (Boardman et al., 1983; McKinney, Jackson, 1989; Hu, Spjeldnaes, 1991; Ma et al., 2015). Вероятными причинами столь длительного их существования рассматриваются модульная организация мшанок и высокая степень адаптации к различным условиям обитания (Горюнова, 1985; Горюнова и др., 2004; Ernst, 2019). Морфологическая эволюция этих колониальных организмов обусловлена комплексным воздействием разнородных факторов. Среди внутренних причин можно рассматривать нахождение отдельных групп на конкретной фазе эволюционного развития (экстенсивная дивергенция, расцвет, упадок или реликтовая фаза), способ реализации того или иного эволюционного пути (ароморфоз, дивергенция, гомеоморфия, параллелизмы) (Морозова, 2001; Горюнова и др., 2004). С другой стороны, очевидно, важное значение имели существовавшие конструктивные морфологии (структура стенки, развитие или отсутствие гетерозооидов) (Ernst, 2013a, b). К внешним факторам следует отнести глобальные процессы (трансгрессия–регрессия, тектоническая активность, изменение климата и т.д.), а также воздействия со стороны биоты (конкуренция между мшанками разных отрядов, с иными бентосными группами, влияние хищников) (Ernst, 2013a, b). Кроме того, необходимо учитывать и причины локального характера: температуру и соленость воды, глубину, особенности субстрата (Nelson et al., 1988; McKinney, Jackson, 1989; Hageman et al., 1998; Tolokonnikova, Ernst, 2017). Комплексное воздействие условий окружающей среды значительно влияло на форму и строение колоний, вызывало появление или исчезновение в них конкретных структурных элементов.
Цель настоящей работы заключается в анализе морфологических изменений, происходивших у мшанок на протяжении 25.5 млн лет (с раннего фамена до позднего турне). Выбор конкретного временного интервала обусловлен важностью в эволюции рассматриваемых организмов. На границе девона–карбона завершилась смена раннепалеозойских мшанковых сообществ на позднепалеозойские, появились разнообразные внутренние структуры, получившие широкое развитие у каменноугольно–пермских родов. Учтены только данные по территории Евразии, вследствие ограниченности сведений о находках позднедевонско–раннекаменноугольных мшанок на других континентах.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Фактической основой для анализа морфологических изменений мшанок, распространенных в фаменско–турнейских отложениях Евразии, послужила составленная автором база данных. В нее вошли: 1) сведения из всех доступных литературных источников, 2) данные переописанного автором музейного материала (коллекции А.М. Ярошинской и В.Д. Лаврентьевой) и 3) результаты обработки собственных сборов или сборов коллег (около 1200 экз.). Были дополнительно изучены фаменско–турнейские мшанки из коллекций В.П. Нехорошева (ЦНИГР музей), К.Н. Волковой (ЦСГМ СО РАН), В.Б. Тризны (ВНИГРИ), И.П. Морозовой, Т.Д. Троицкой, Р.В. Горюновой, В.Д. Лаврентьевой (ПИН) и А. Эрнста (Гамбургский ун-т). В итоге проанализировано 689 видов, которые по современным представлениям относятся к 127 родам, 41 семейству, четырем отрядам (Cystoporata, Trepostomata, Cryptostomata и Fenestrata). Ископаемые мшанки изучались в ориентированных шлифах, изготовленных из фрагментов их колоний, микроскопическим методом.
ФОРМА КОЛОНИИ И ПОЛИМОРФИЗМ ЗООИДОВ
Палеозойские мшанки строили разнообразные по форме колонии, которые можно рассматривать как совокупный результат филогенетической истории и адаптации к условиям окружающей среды (Hageman et al., 1997, 1998; Taylor, 2005). Развитие первичного зооида колонии – анцеструлы – могло начинаться на литокластике (гальке, песчинке, конкреции) или биокластике (створке раковины, части скелета различных существ), живых организмах (водорослях) (Hageman et al., 1998). Дальнейший рост колонии, помимо генетического контроля, зависел от комплекса локальных абиотических факторов, например, пищевых ресурсов, энергии, температуры и солености воды, скорости седиментации (McKinney, Jackson, 1989). Габитус колоний определялся формой, характером почкования и расположения автозооидов (рис. 1). У мшанок выявлена высокая степень конвергенции между крупными группами (Anstey, Pachut, 1995; Ernst, 2013b), а также гомеоморфия и параллелизмы (Астрова, 1978; Морозова, 2001; Горюнова, 2011).
Рис. 1.
Разнообразие форм колоний мшанок и автозооидов: а – однослойная инкрустирующая колония цистопоратной Fistulipora praetubulosa Lu, 1999 с трубчатыми цилиндрическими автозооидами (ТЦА), экз. КузГПА, № 4/41.1; Россия, Курганская обл., скв. Восточно-Курганская 49, глуб. 767.5 м; верхний девон, фамен, верхнефаменский подъярус, слои с фораминиферами Quasiendothyra kobeitusana–Quasiendothyra communis; б – инкрустирующая однослойная колония трепостоматной Leptotrypa lipovkiensis Tolokonnikova et Pakhnevich, 2019 с трубчатыми призматическими автозооидами (ТПА), голотип СибГИУ, № 12/14.2; Россия, Липецкая обл., местонахождение у с. Липовка; верхний девон, фамен, задонский горизонт; в – тонковетвистая колония криптостоматной Nikiforovastylus ourthensis Tolokonnikova, Ernst, Poty еt Mottequin, 2015 с коленчато-изогнутыми автозооидами (КИА) и срединной осью (СO), голотип Льежский ун-т, ULg PDS-72i; Бельгия, Динантский синклинорий, разрез Pont-de-Scay, слой 72; верхний девон, фамен, формация Cоmblain-au-Pont; г – сетчатая пластинчатая колония фенестратной Spinofenestella abyschevoensis (Trizna, 1958) с коробочковидными автозооидами (КА), экз. ПИН, № 1613/412; Нахичевань, Геранкаласинский разрез; верхний девон, фамен, аршакиахбюрская свита, местная брахиоподовая зона julii–nigra.

На рубеже девона–карбона колонии мшанок характеризовались вертикальными конструкциями, благодаря которым снижалась конкуренция за площадь на субстрате между ними и с другими бентосными организмами. Кроме того, увеличивалась площадь поверхности колонии, орошаемой токами воды, несущими питательные вещества. Анализ строения колоний фаменско–турнейских мшанок из 43 местонахождений Центральной и Южной России показал доминирование ветвистых вертикальных форм в ранне- и позднефаменских мшанковых ассоциациях, и сетчатых – в турнейских (Tolokonnikova, Ernst, 2017). Подобное распределение колониальных форм соответствовало смене доминантов в этих ассоциациях: преобладание в позднем девоне трепостомат, а в раннем карбоне – фенестрат (Толоконникова, 2008; Gutak et al., 2008).
Изменение разнообразия форм колоний в рассматриваемом интервале, вероятно, было связано с осцилляциями площади и глубины морских бассейнов. Трансгрессии в самом конце фамена и в начале турне способствовали формированию на мелководном шельфе (средние глубины 80–200 м) разнообразных типов колоний мшанок. В благоприятных условиях (прогретые воды, нормальная соленость, невысокая энергия воды и низкая скорость седиментации) развивались преимущественно поднятые и приподнятые над субстратом колонии (сетчатые, прямые ветвистые, двуслойно-симметричные ветвистые и пластинчатые). Тонкие веточки мшанок, очевидно, росли в условиях неровностей микрорельефа дна на участках со спокойным движением воды. Инкрустирующие одно- и многослойные колонии формировались недалеко от береговой линии, поскольку они наиболее устойчивы в условиях активной гидродинамики и разнородности субстрата (McKinney, Jackson, 1989; Bone, Wass, 1990). Возрастание доли инкрустирующих колоний в мшанковых сообществах раннего–среднего фамена по сравнению с поздним франом было обусловлено постепенным обмелением бассейнов и, как следствие этого, изменениями солености воды и объема поступавшего терригенного материала, нарушением нормальной циркуляции вод, обеспечивавших мшанок пищей.
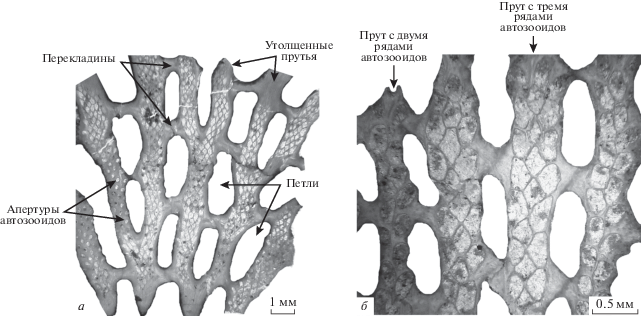
Проявившиеся в начале девона возрастание гетерогенности структурных типов сетчатых колоний фенестрат (пластинчатые, вееровидные, ветвистые, воронковидные и др.) и эволюционное преобразование формы автозооидов стали основой наибольшей значимости этой группы мшанок в каменноугольном периоде (Морозова, 2001). Колонии фенестрат были образованы свободными, анастомозирующими или соединенными перекладинами прутьями. Потоки воды омывали фронтальную поверхность колонии с расположенными на ней апертурами автозооидов, и проходили через петли или свободные промежутки между прутьями, обтекая дорсальную сторону, где апертуры отсутствовали (Cowen, Rider, 1972; Морозова, 1987; McKinney, Jackson, 1989). Кили, разделявшие ряды апертур автозооидов, и бугорки на прутьях, помимо защитных функций, очевидно, были важны для регуляции гидродинамической ситуации вокруг автозооидов и усиления эффективности питания (McKinney, 1981; Ernst, 2013b; Suаrez Andrеs, Wyse Jackson, 2015). Наивысшего расцвета среди фенестрат в начале карбона достигли мшанки семейства Fenestellidae King, 1849 с билатеральной симметрией прутьев, сформированных двумя рядами чередующихся автозооидов. Они составляли 70–80% мшанковых ассоциаций (Морозова, 2001, с. 35). Наибольшим видовым разнообразием (4–9 видов одного рода) в фаменско–турнейских отложениях Евразии отличались мшанки родов Rectifenestella Morozova, 1974, Spinofenestella Termier et Termier, 1971 и Fenestella Lonsdale, 1839 с пластинчатыми, вееровидными или бокаловидными сетчатыми колониями.
К самому началу турне приурочен расцвет семейства Acanthocladiidae Zittel, 1880 (Морозова, 2001), связанный с появлением таких родов, как Arborocladiа Nekhoroshev, 1956, Pseudopolypora Morozova et Lisitsyn, 1996 и с обильным возникновением новых видов у уже существовавших родов. Мшанки семейства Acanthocladiidae отличались усложненными структурными типами колоний (утолщенные прямые или волнистые прутья, свободные либо соединенные перекладинами или анастомозами), развитием прутьев, состоявших из двух–шести рядов автозооидов, присутствием на перекладинах автозооидов, обилием бугорков на обеих сторонах колонии (рис. 2). Значительное увеличение количества автозооидов, формировавших прутья, проявилось и у возникшего в раннем турне семейства Fenestraliidae Morozova, 1963, существовавшего до конца перми. Вероятно, возраставшее количество автозооидов на прутьях было коррелятивно связано с уменьшением на рубеже девона–карбона количества и разнообразия фитопланктона (зеленые водоросли, диатомеи, цианобактерии, акритархи), являвшегося пищей для мшанок (Schwark, Empt, 2006; Strother, 2008; Riegel, 2008). Некоторые авторы связывают это явление с концентрацией углекислого газа (Berner, 2006) или со сменой теплого климата на более прохладный (Lakin et al., 2016). Полиморфизм фенестрат в фамене–турне был слабо выражен. Кроме автозооидов, известны только микрозооиды у рода Permofenestella Morozova, 1974 (Yang et al., 1988), с которым связывается некоторое увеличение разнообразия фенестеллид в начале турне.
Рис. 2.
Мшанки семейства Acanthocladiidae: а – крупнопетлистая сетчатая вееровидная колония Mackinneyella maccoyana (Ulrich, 1890), экз. КузГПА, № 4/31.1; Россия, Курганская обл., скв. Восточно-Курганская 44, глуб. 454.0–466.3 м; нижний карбон, турнейский ярус, верхнетурнейский подъярус; б – мелкопетлистая сетчатая колония Polyporella biseriataformis (Nekh., 1956), экз. КузГПА, № 4/31а.1; местонахождение то же, глуб. 497.0–506.4 м; возраст тот же.
Криптостоматные мшанки Евразии относятся к подотрядам Ptilodictyina Astrova et Morozova, 1956 и Rhabdomesina Astrova et Morozova, 1956. Птилодиктиинам, находившимся, по мнению Горюновой (2007), в реликтовой фазе эволюционного развития, в фамене–турне были свойственны различные формы колонии (ветвистые, пластинчатые и др.), преимущественно с двуслойно-симметричным планом строения. С середины до конца фамена появились и исчезли роды Junggarotrypa Lu, 1999, Geranopora Gorjunova, 2007, Mysticella Gorjunova, 2007 (рис. 3, б, г) и Tamaroclema Gorjunova, 1992, у которых гетерозооиды были представлены только актинотостилями. В турне птилодиктиины были представлены родами Taeniodictya Ulrich, 1888 и Intrapora Hall, 1883. Виды Intrapora, возникшие в середине девона, отличались двуслойно-симметричными пластинчатыми колониями с обильными метазооидами. Билатеральный план строения, с которым связана работа лофофоров на обеих сторонах колонии во время фильтрации воды, был, очевидно, эффективнее при направленном ее орошении. Кроме птилодиктиин, этот план строения известен у цистопоратных мшанок подотряда Hexagonellina Crockford, 1947, у родов Sulcoretepora d’Orbighy, 1849 и Meekopora Ulrich, 1889, а у трепостоматных мшанок подотряда Amplexoporina Astrova, 1965 – у родов Triznotrypa Lavrentjeva, 1997 и Petalotrypa Ulrich, 1890 (рис. 3, а, в).
Рис. 3.
Пример параллелизма у мшанок отрядов Trepostomata и Cryptostomata –билатеральные колонии с мезотекой и акантостилями: а, в – Petalotrypa proprius (Tolokonnikova, 2006), голотип КузГПА, №4/5.1: а – поперечное сечение, в – тангенциальное сечение; Россия, Кузнецкий бассейн, Невский разрез; верхний девон, фамен, подонинский горизонт; б, г – Mysticella sarcosancta Gorjunova, 2007, экз. ПИН, № 1613/695: б – поперечное сечение, г – тангенциальное сечение; Армения, юж. склон г. Бирали-Кузей; верхний девон, фамен, шамамидзорская свита, местная брахиоподовая зона ghorensis–pamiricus.

Параллельное развитие у птилодиктиин (Cryptostomata) и амплексопорин (Trepostomata) билатеральных колоний и стилей отражает один из результатов адаптации разных мшанок к сходным условиям окружающей среды. У криптостоматных мшанок рода Mysticella и трепостоматных мшанок рода Petalotrypa колонии ветвистые двуслойно-симметричные с мезотекой, редкими актинотостилями или акантостилями соответственно (рис. 3).
Исключительно прямые ветвистые колонии рабдомезин со средним диаметром 0.5–1.5 мм отличались спиральной формой роста, увеличивавшей их устойчивость и прочность в освоенных экологических нишах (Горюнова, 1985). Межзооидальные образования в колониях этих мшанок были довольно разнообразно представлены: тектизооидами (Clausotrypa Bassler, 1929 и Pseudonematopora Balakin, 1974), метазооидами (Nikiforovella Nekhoroshev, 1948 и Mediapora Trizna, 1958), макроакантостилями [Rhombopora Meek, 1872 и Klaucena (Klaucena) Trizna, 1958], актинотостилями (Rhenishella Tolokonnikova, Ernst et Herbig, 2014 и Primorella Romanchuk et Kiseleva, 1968), пауростилями у рода Paranicklesopora Gorjunova, 1988 и порами. В колониях большинства родов сочетались гетерозооиды и стили. В ходе эволюции рабдомезин на рубеже девона–карбона происходило постепенное усложнение морфологии и усиленное видообразование у ведущих родов, хорошо прослеживающиеся на примере Nikiforovella. Появившись в начале фамена с видом N. nitida Troizkaya, 1979, этот род к концу турне насчитывал 11 видов (Толоконникова, 2017). Тонкие веточки мшанок Nikiforovella (диаметром 0.60–1.95 мм) образовывались почковавшимися вокруг спиральной оси автозооидами, промежутки между которыми заполнялись метазооидами и акантостилями. Метазооиды выполняли функции укрепления колонии и связи между автозооидами. С начала фамена до конца турне возрастало количество метазооидов (от 1–2 до 5–8 на площадке между апертурами) и увеличивался их диаметр (от 0.02–0.04 до 0.03–0.06 мм). Характер расположения метазооидов вокруг апертур на поверхности колоний менялся в сторону его хаотичности. Аналогичная тенденция проявилась у выполнявших защитную функцию акантостилей: в течение фамена–турне происходило увеличение их количества вокруг одной апертуры (от 2–3 до обильных). К концу турнейского века беспорядочное расположение акантостилей у Nikiforovella почти полностью заместило закономерное, характерное для фаменских представителей этого рода (Толоконникова, 2017).
К концу фамена приурочена вспышка образования родов и семейств у рабдомезин. Анализ динамики родового разнообразия криптостомат на рубеже девона–карбона (Tolokonnikova, 2019) демонстрирует большое количество как появившихся, так и вымерших родов этих мшанок. Их морфологическое разнообразие характеризует узкую специализацию (теломорфоз), связанную с приспособлением к особым условиям существования локального или регионального масштаба. Изменение этих условий вызывало их гибель. В течение фамена появилось и вымерло три рода рабдомезин с упрощенной организацией колоний: Rhenishella Tolokonnikova, Ernst et Herbig, 2014 (только акантостили), Pseudoascopora Gorjunova, 1985 (пучок первичных зооидов и актинотостили), Nikiforovastylus Tolokonnikova, Ernst, Poty et Mottequin, 2015 (метазооиды и актинотостили). Мшанки рода Ipmorella Gorjunova, 1985 с единственным первичным зооидом в центре колонии и редкими метазооидами, возникнув в конце фамена, уже в первой половине турне исчезли из морских бассейнов планеты. Сравнительно успешной эволюционной инновацией стало почкование автозооидов вокруг осевого зооида (род Rhabdomeson Young et Young, 1874) или пучка осевых зооидов (род Ascopora Trautschold, 1876) с дополнительным развитием вокруг них вторичных зооидов, макроакантостилей, актинотостилей и пор. Перечисленные роды просуществовали до конца перми, испытав расцвет видообразования в карбоне. В конце фамена рабдомезины достигли наивысшей степени полиморфизма, более до конца палеозоя не обновлявшегося.
Фаменские трепостоматы формировали радиальные ветвистые, двуслойно-симметричные пластинчатые и ветвистые, обрастающие, массивные колонии с различно выраженной степенью полиморфизма. Кроме автозооидов, были развиты эксилязооиды, как у Eridotrypella Duncan, 1939, Cyphotrypa Ulrich et Bassler, 1904, Leptotrypella Vinassa et Regny, 1921, мезозооиды – у Neotrematopora Morozova, 1960, Minussina Morozova, 1960, акантостили – у Leioclema Ulrich, 1882. У большинства вымерших в фамене родов трепостомат колонии были разнообразными, как, например, у Anomalotoechus Duncan, 1939, Cyphotrypa Ulrich et Bassler, 1904, Schulgina Morozova, 1957, Microcampylus Duncan, 1939. У вида Atactotoechus сеllatus Tolokonnikova, 2010, обитавшего в подонинское время (средний фамен) в Кузнецком бассейне, колонии ветвистые и инкрустирующие, у позднетурнейского А. vaulxensis Ernst, Tolokonnikova et Poty, 2017 из Намюрского бассейна Бельгии – только ветвистые (Tolokonnikova, 2010; Ernst et al., 2017). Виды Anomalotoechus promiscuus Lavrentjeva, 1974 и Schulgina zushaensis Lavrentjeva, 1974 из задонско–лебедянских отложений (нижний–средний фамен) Русской платформы характеризуются инкрустирующими, массивными и ветвистыми колониями (Лаврентьева, 1974). Они формировались во внутренней части мелководного шельфа в периодически изменявшихся условиях (углубление/обмеление) бассейна. Появившиеся в конце девона роды характеризовались преимущественно ветвистыми формами: Tabulipora Young, 1883, Stenopora Lonsdale, 1884, Nikiforopora Dunaeva, 1964. В целом к началу визе произошло снижение разнообразия колониальных форм трепостомат (Tolokonnikova, 2019). Можно заметить, что ветвистая прямая колония являлась довольно широко распространенной формой среди палеозойских мшанок. Еe ветви, поднятые над субстратом, имели большую площадь орошения токами воды, несущей пищевые ресурсы. Однако тонковетвистая колония уязвима при сильной подвижности вод, поэтому она тяготела к относительно гидродинамически спокойным участкам дна (Cheetham, Thomsen, 1981). У появившихся в фамене трепостомат повышение устойчивости и прочности ветвистых колоний достигалось за счет расширения эндозоны и, соответственно, увеличения диаметра колонии, как у мшанок родов Rhombotrypella Nikiforova, 1933 и Nikiforopora Dunaeva, 1964, или за счет возрастания количества и/или размеров гетерозооидов. Толстоветвистые колонии были более устойчивы к активным движениям воды и могли колонизировать верхнюю литораль.
Цистопораты отличались преобладавшими в фамене инкрустирующими колониями, как у Fistulipora McCoy, 1849 и Cyclotrуpa Ulrich, 1896. Однако наряду с ними были пластинчатые, массивные, реже ветвистые – у Eofistulotrypa Morozova, 1959. Инкрустирующие колонии в определенных условиях имели преимущество перед другими формами роста: обрастая любой тип субстрата (Bone, Wass, 1990), они быстро осваивали большую площадь и сохраняли устойчивость к различным внешним воздействиям (McKinney, Jackson, 1989). Полиморфизм у цистопорат не был выражен. Во второй половине турне появились новые роды Fistulamina Crockford, 1947 и Ramipora Toula, 1875 с ленточно-ветвистой формой колоний и с коленчато-изогнутыми более крупными автозооидами. Подобная форма автозооидов считается продвинутой. Она сменила преобладавшую в фамене трубчатую и, очевидно, обеспечивала дополнительную защиту полипидов. Для всех родов цистопоратных мшанок характерно развитие везикул. Их количество в колониях от фамена к турне увеличивалось. Это можно связать с тем, что везикулы придавали дополнительную устойчивость поднимавшимся над субстратом ветвистым, сетчатым, двуслойно-симметричным колониям, доля которых возрастала к началу карбона. Помимо конструктивной функции, обилие везикул увеличивало расстояние между крупными апертурами. Подобный факт был, очевидно, благоприятен для полного раскрытия короны щупалец и создания ресничками более энергично направленного тока воды ко рту (McKinney, Jackson, 1989). Мшанки с крупными полипидами и лофофорами могли потреблять более крупные частицы пищи, чем мшанки с мелкими автозооидами (Ernst, 2013b).
У цистопорат и трепостомат развивались также макулы и монтикулы, образованные крупными автозооидами, как, например, у родов Ratingella Ernst, Tolokonnikova et Herbig, 2015, Fistulipora, и/или скоплениями гетерозооидов (роды Triznotrypa Lavrentjeva, 1997, Petalotrypa Ulrich, 1890). Развитие таких структур на поверхности колоний способствовало усилению циркуляции вод, как поступавших, несущих питательные частицы, так и отфильтрованных (Taylor, 1979; Anstey, 1987; Ernst, 2013b).
ХАРАКТЕРИСТИКА АВТОЗООИДОВ
Форма автозооидов, структура их стенок и внутризооидальные образования мшанок претерпевали на рубеже девона–карбона определенные изменения.
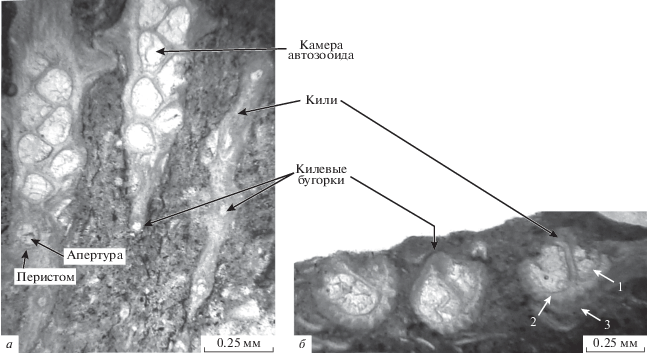
У фаменско-турнейских фенестрат в полости укороченно-трубчатых, грушевидных автозооидов (McKinney, 1981; Snyder, 1991; Морозова, 2001) развивались одна или две гемисепты (напр., у рода Minilya Crockford, 1944), но у некоторых родов гемисепты не были развиты (у Narynella Morozova, 2001). Возможно, эти структуры служили для прикрепления мышц-ретракторов, регулировавших положение щупалец (Blake, 1983). Отсутствие гемисепт у некоторых родов также можно связать с процессом избирательной фоссилизации или сохранностью материала. Автозооиды открывались на поверхности колонии округлыми апертурами с перистомом (рис. 4, а), часто несущим бугорки, шипики, как у рода Rectifenestella Morozova, 1974. Стенки автозооидов у фенестратных мшанок трехслойные (рис. 4, б). Толщина наружного пластинчатого слоя стенок возрастала от фамена к турне (напр., у рода Hemitrypa Phillips, 1841).
Рис. 4.
Автозооиды Rectifenestella aff. nododorsalis (Ulrich, 1890), экз. КузГПА, № 4/35.1: а – округлая апертура с перистомом, тангенциальное сечение; б – слои стенок автозооида: внутренний известковый (1), срединный (2) и наружный пластинчатый (3), поперечное сечение; Россия, Курганская обл., скв. Восточно-Курганская 44, глуб. 497.0–506.4 м; нижний карбон, турнейский ярус, верхнетурнейский подъярус.
Для криптостомат характерно расположение овальных апертур правильными диагонально-пересекающимися рядами. На протяжении 25.5 млн лет ширина апертур увеличивалась. Например, у Nikiforovella этот показатель возрос в среднем от 0.09 мм у фаменских видов до 0.12 мм у турнейских (Толоконникова, 2017). Возможно, это было связано с похолоданием в миссисипии (Davydov et al., 2012). Согласно исследованиям ряда авторов (O’Dea, Okamura, 1999; Taylor, 2005), размер зооидов у современных мшанок возрастает при пониженных значениях температуры. Крупные полипиды могли продуктивнее фильтровать водные потоки, насыщенные пищевыми частицами. В результате секреции стенок в полости трубчатых призматических или цилиндрических автозооидов криптостоматных мшанок могли развиваться гемисепты, как, например, у Paranicklesopora Gorjunova, 1988 и Orthopora Hall, 1886, или диафрагмы, как у Primorella Romantchuk et Kiseleva, 1968 и Rhabdomeson Young et Young, 1874. Образование диафрагм у представителей типа Bryozoa связывают с дегенерацией полипидов и их последующей регенерацией (Горюнова, 1985).
У цистопорат автозооиды почковались от эпитеки и развивались вертикально или под небольшим углом. На поверхности колонии они открывались округлыми апертурами с развитыми лунариями, как у рода Eridopora Ulrich, 1882, или слабо выраженными, как у Cyclotrypa Ulrich, 1896 и Velbertopora Tolokonnikova, Ernst et Herbig, 2014. В полости автозооидов у единичных родов присутствовали гемисепты, например, у Meekopora Ulrich, 1889.
Для трепостомат конец девона был временем максимального развития морфологической специализации (Горюнова и др., 2004; Ernst, 2013a, b). Одним из ее направлений на рубеже девона–карбона стало изменение структуры стенок автозооидов в экзозоне за счет их утолщения (семейства Stenoporidae Waagen et Wentzel, 1886, Dyscritellidae Dunaeva et Morozova, 1967, Aisenvergiidae Dunaeva, 1964, Anisotrypidae Dunaeva et Morozova, 1967). Длительно существовавшие роды, как, например, Dyscritella Girty, 1911, отличаются умеренным отложением кальцита в стенках цистида. У вида D. perforata Tolokonnikova, Ernst, Poty et Mottequin, 2015, распространенного в отложениях Струниан Динантского синклинория Бельгии, толщина стенок автозооидов в экзозоне 0.02–0.05 мм, а у его вероятного потомка D. оrnata Tolokonnikova, Ernst et Poty, 2015 из низов турне того же бассейна – 0.02–0.045 мм (Tolokonnikova et al., 2015a, b). Крайне неравномерное утолщение экзозональных стенок у эндемичных родов Aisenvergia Dunaeva, 1964 и Volnovachia Dunaeva, 1964, возможно, привело к чрезмерному сужению полости автозооидов, что обусловило кратковременное существование этих родов в самом конце фамена (Tolokonnikova, 2019). Развитие гиперутолщенных стенок у узкоспециализированного рода Eodyscritella Troizkaya, 1970 также не способствовало его длительному существованию (рис. 5). Одним из вариантов разрастания экзозональных стенок было образование в них полых расширений – “чёток”, например, у мшанок родов Triplopora Troizkaya, 1970 и Schulgina, исчезнувших к концу фамена. У семейства Atactotoechidae Duncan, 1939, мшанки которого почти полностью вымерли на границе девона–карбона, были, очевидно, исчерпаны адаптивные возможности. Только мшанки родов Leptotrypella Vinassa et Regny, 1921 и Leptotrypa Ulrich, 1883 продолжали существовать до позднего карбона (Астрова, 1978).
Рис. 5.
Eodyscritella clatrata Troizkaya, 1970, экз. КузГПА, № 4/12а.1: а – поперечное сечение, б – продольное сечение; Россия, Кемеровская обл., Топкинский разрез; верхний девон, фамен, топкинский горизонт.
В течение фамена–турне происходила начавшаяся в раннем девоне смена многоугольной формы апертур автозооидов на овально-округлую (Астрова, 1978; Горюнова и др., 2004). Примером могут служить мшанки родов Eridotrypella и Nikiforopora. У вида E. danzikensis Tolokonnikova, 2016 (ранний фамен) апертуры многоугольно-округлые, у E. stellata Tolokonnikova, 2007 (поздний фамен) – овальные (Толоконникова, 2007, 2016а). У N. jurgensis Tolokonnikova, 2010 в позднем фамене апертуры были вытянутые многоугольные, а в позднем турне они стали овальными и округлыми, как у N. arpaensis Tolokonnikova, 2016 (Tolokonnikova, 2010; Толоконникова, 2016б).
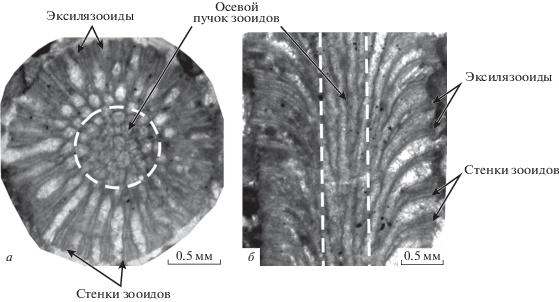
Интересным фактом является формирование у ветвистых колоний трепостоматных мшанок родов Rhombotrypella и Eodyscritella (рис. 5) осевого пучка автозооидов в эндозоне, который аналогичен пучку первичных (осевых) зооидов рабдомезин (напр., у родов Pseudoascopora, Ascopora). Наличие осевого пучка зооидов у ветвистых колоний мшанок разных отрядов можно рассматривать как явление параллелизма. Такой пучок увеличивал диаметр колонии в целом и способствовал усилению прочности конструкций. В полости автозооидов трепостомат развивались разнообразные микроструктуры: гемифрагмы (род Tabuliporella), диафрагмы – у родов Anomalotoechus, Atactotoechus (рис. 6) и цистифрагмы – у рода Eridocampylus. Гемифрагмы могли развиваться совместно с диафрагмами. У представителей рода Nikiforopora количество этих структур в полости автозооида с середины фамена (N. jurgensis Tolokonnikova, 2010) до позднего турне (N. arpaensis Tolokonnikova, 2016) было постоянно: 1–2 гемифрагмы и 1–2 диафрагмы (Tolokonnikova, 2010; Толоконникова, 2016б).
Рис. 6.
Внутризооидальные структуры трепостоматных мшанок (в продольном сечении): а – Atactotoechus vaulxensis Ernst, Tolokonnikova et Poty, 2017, голотип Льежский ун-т, ULg. РА.Mil./1с; Бельгия, карьер Le Milieu около дер. Vaulx; нижний карбон, турнейский ярус, Ivorian подъярус, формация Tournai (Providence Mb.); б – Tabuliporella nakhichevanica Tolokonnikova, 2016, экз. ПИН, № 1613/719-3; Нахичевань (Азербайджан), разр. №11, слой 22; нижний карбон, турнейский ярус, верхнетурнейский подъярус, местная брахиоподовая зона tornacensis–michelini.

ЗАЩИТНЫЕ СТРУКТУРЫ
Поедание мшанок различными животными (рыбами, моллюсками, членистоногими, иглокожими) рассматривается как одна из причин развития у них защитных морфологических адаптаций (McKinney et al., 2003; Lidgard, 2008). Пассивная защита от хищников осуществлялась у мшанок разных отрядов различными способами. У фенестрат происходило формирование прочных массивных сетчатых колоний и шипов на перистоме апертур, разрастание килей на прутьях, килевых бугорков (рис. 2, 4), образование защитных сеток (=суперструктуры) (McKinney, 1987; Ernst, 2013a). Защитные сетки получили наибольшее развитие в начале девона в семействе Semicosciniidae Morozova, 1987. К концу девонского периода большинство узкоспециализированных родов семикосциниид исчезло, а единичные выжившие роды вымерли в турнейском (Qudrisemicoscinium Plamenskaya, 1991, Semicoscinium Prout, 1859) или в визейском (Eosemucoscinium Morozova, 1987) веках. Данный факт связывают со снижением “давления” хищников (Bambach, 1999; Sallan et al., 2011) и уменьшением активности гидродинамического режима из-за углубления бассейнов, вследствие глобальной трансгрессии в раннем карбоне (Haq, Schutter, 2008). Однако для мшанок с аналогичными защитными сетками, принадлежавших к родам Hemitrypa и Pseudounitrypa Nekhoroshev, 1926 (семейство Fenestellidae King, 1849), эти обстоятельства не стали лимитирующими, они существовали до конца карбона и начала перми соответственно.
У криптостомат в рассматриваемом интервале на поверхности колоний развивались бугорки, крупные макроакантостили (род Rhombopora) и/или обильные мелкие микроакантостили (рис. 7, а).
Рис. 7.
Акантостили (указаны стрелками) у мшанок разных отрядов (в тангенциальном сечении): а – криптостоматная Rhombopora floriformis Trizna, 1958, экз. КузГПА, № 4/49; Россия, Кузнецкий бассейн, Костенковский разрез; нижний карбон, турнейский ярус, фоминский горизонт; б – криптостоматная Nikiforovella cavernosa (Nekhoroshev, 1932), экз. Геол. ин-т Кельнского ун-та, GIK 2500 (V4-13b); Германия, Рейнские горы, скв. Velbert, глуб. 103.8–131.5 м; верхний девон, фамен, формация Velbert; в – трепостоматная Tabulipora corticosa Nekhoroshev, 1956, экз. КузГПА, 4/50; Россия, Кузнецкий бассейн, разрез Прокопьевский-2; нижний карбон, турнейский ярус, фоминский горизонт; г – трепостоматная Leioclema numerosum Morozova, 1961, экз. КузГПА, № 4а/2.1; Россия, Кузнецкий бассейн, разрез Косой Утес; верхний девон, фамен, косоутесовский горизонт.
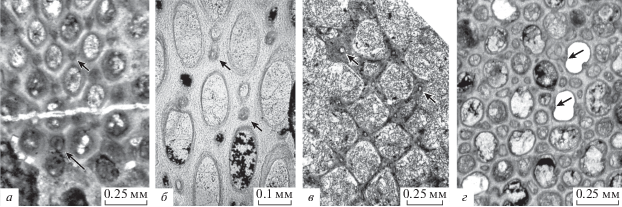
У трепостоматных мшанок в возникшем в среднем фамене семействе Stenoporidae до конца перми происходило равномерное (реже неравномерное) утолщение стенок автозооидов в экзозоне, например, у родов Rhombotrypella, Stenophragmidium Bassler, 1952, Nikiforopora, Tabulipora. У трепостомат также развивались для защиты многочисленные акантостили (рис. 7, в, г). С раннего фамена до позднего турне прослежено два направления изменения указанных стилей. У одних родов (Atactotoechus, Eridotrypa Ulrich, 1893, Leptotrypa) выявлена тенденция уменьшения размера акантостилей при возрастании их количества. У среднефаменской мшанки Atactotoechus сеllatus Tolokonnikova, 2010 вокруг каждой апертуры было 3–5 акантостилей диаметром 0.025–0.05 мм, у позднетурнейской А. vaulxensis Ernst, Tolokonnikova et Poty, 2017 – 0–1 акантостиль диаметром 0.01–0.02 мм (Tolokonnikova, 2010; Ernst et al., 2017). У других родов (Dyscritella Girty, 1911, Eostenopora Duncan, 1939) происходила их дифференциация по размерам (крупные и мелкие) в пределах одной колонии. Например, позднефаменский вид Dyscritella perforata Tolokonnikova, Ernst, Poty et Mottequin, 2015 из Намюро-Динантского бассейна характеризовался 2–6 акантостилями диаметром от 0.015 до 0.045 мм вокруг одной апертуры, а его турнейский потомок D. ornata Tolokonnikova, Ernst et Poty, 2015 из того же бассейна – 2–8 акантостилями, диаметром от 0.015 до 0.06 мм (Tolokonnikova et al., 2015a, b). Длительно существовавшие роды (напр., Leioclema Ulrich, 1882) отличались обилием крупных акантостилей, которые вдавались в апертуры, придавая им тем самым петалоидный облик (рис. 7, г).
Параллелизмы среди акантостилей у представителей отрядов Trepostomata и Cryptostomata (рис. 7) являются результатом не только прикрепленного образа жизни, но и таких сходных условий существования, которые требовали развития структур для защиты от хищников. У цистопорат такие защитные структуры на поверхности колоний в рассматриваемом интервале не выявлены.
ВЫВОДЫ
В трех из четырех рассматриваемых отрядов под воздействием условий обитания эволюция шла по пути выработки разных форм колоний при доминировании к концу турне вертикальных поднятых над субстратом. Их разнообразие возрастало у цистопорат, и у наиболее развитых в карбоне фенестрат, но оно снижалось у трепостомат;
– у большинства мшанок происходило увеличение экзозонального скелета (за счет разрастания везикулярной ткани у цистопорат, утолщения и изменения структуры стенок автозооидов у трепостомат, усложнения полиморфизма у криптостомат, утолщения и изменения строения прутьев у фенестрат);
– у рабдомезин (отряд Cryptostomata) изменялась внутренняя структура колоний (образование срединной оси, комплексная упаковка автозооидов), их эволюция шла по пути теломорфоза;
– в трех из четырех рассматриваемых отрядов развивались защитные структуры (кили, бугорки, защитные сетки у фенестрат; акантостили и утолщенные стенки автозооидов в экзозоне у трепостомат; акантостили, шипики и бугорки у криптостоматных рабдомезин);
– у мшанок отрядов Trepostomata и Cryptostomata изменялась форма автозооидов и апертур, в полости автозооидов развивались различные внутренние структуры (гемисепты, диафрагмы, гемифрагмы, цистифрагмы).
* * *
Автор благодарна коллегам, предоставившим каменный материал или способствовавших изучению музейных коллекций: О.Б. Вейс, Т. Кампену, Л.В. Нехорошевой, О.П. Мезенцевой, Г.А. Мизенсу, А.В. Пахневичу, Л.Г. Пороховниченко, Э. Поти, О.А. Родине, Х.-Г. Хербигу и А. Эрнсту. За критический просмотр рукописи и ценные замечания, способствовавшие ее улучшению, автор признательна Л.А. Висковой. Исследования выполнены при поддержке РФФИ (проект 18-05-00245a) и в рамках государственной программы повышения конкурентоспособности Казанского (Приволжского) федерального университета среди ведущих мировых научно-образовательных центров.
Список литературы
Астрова Г.Г. История развития, система и филогения мшанок отряда Trepostomata. М.: Наука, 1978. 240 с.
Горюнова Р.В. Морфология, система и филогения мшанок (отряд Rhabdomesida). М.: Наука, 1985. 152 с. (Тр. ПИН АН СССР. Т. 208).
Горюнова Р.В. Новые криптостомидные мшанки из верхнего девона Закавказья и некоторые аспекты эволюции отряда Cryptostomida // Палеонтол. журн. 2007. № 6. С. 12–23.
Горюнова Р.В. Семейство Сoelotubuliporidae fam. nov. и морфологические параллелизмы в эволюции мшанок // Палеонтол. журн. 2011. № 5. С. 37–49.
Горюнова Р.В., Марков А.В., Наймарк Е.Б. Эволюция и биогеография палеозойских мшанок: результаты количественного анализа. М.: ГЕОС, 2004. 182 с.
Лаврентьева В.Д. Позднедевонские и раннетурнейские мшанки центральной части Русской платформы // Палеонтол. журн. 1974. № 2. С. 45–53.
Морозова И.П. Морфогенез, система и колониальная интеграция мшанок отряда Fenestrida // Морфогенез и пути развития колониальности мшанок и кишечнополостных. М.: Наука, 1987. С. 70–88 (Тр. ПИН АН СССР. Т. 222).
Морозова И.П. Мшанки отряда Fenestellida (морфология, система, историческое развитие). М.: ГЕОС, 2001. 177 с. (Тр. ПИН РАН. Т. 277).
Толоконникова З.А. Мшанки абышевского горизонта Кузбасса // Вестн. Томского гос. ун-та. 2007. № 297. С. 171–174.
Толоконникова З.А. Палеонтология Кузбасса. Фаменские мшанки западной части Алтае-Саянской складчатой области. Новокузнецк: КузГПА, 2008. 125 с. (Тр. н.-и. лаб. “Палеонтологии и палеогеографии”. Вып. 2).
Толоконникова З.А. Новые фаменские мшанки (верхний девон) Азербайджана и Армении // Палеонтол. журн. 2016а. № 3. С. 34–42.
Толоконникова З.А. Новые данные о турнейских мшанках (нижний карбон) Азербайджана и Армении // Палеонтол. журн. 2016б. № 4. С. 68–75.
Толоконникова З.А. Ранние представители мшанок рода Nikiforovella Nekhoroshev, 1948 и их стратиграфическое значение для позднего девона–раннего карбона // Литосфера. 2017. Т. 17(5). С. 53–66.
Anstey R.L. Astogeny and phylogeny: evolutionary heterochrony in Paleozoic bryozoans // Paleobiology. 1987. V. 13. P. 20–43.
Anstey R.L., Pachut J.F. Phylogeny, diversity history, and speciation in Paleozoic bryozoans // New approaches to speciation in the fossil record. N.Y., Chichester: Columbia Univ. Press, 1995. P. 239–284.
Bambach R.K. Energetics in the global marine fauna: a connection between terrestrial diversification and change in the marine biosphere // Geobios. 1999. V. 32. P. 131–144.
Berner R.A. Geocarbsulf: A combined model for Phanerozoic atmospheric O2 and CO2 // Geochim. et Cosmochim. Acta. 2006. V. 70. P. 5653–5664.
Blake D.B. Introduction to the Suborder Rhabdomesina // Treatise on Invertebrate Paleontology. Part G. Lawrence; Univ. Kansas press, 1983. P. 530–549.
Boardman R.S., Cheetham A.H., Blake D.B., Cook P.L. Bryozoa // Treatise on Invertebrate Paleontology. Part G. Lawrence: Univ. Kansas press, 1983. 625 p.
Bone Y., Wass R.E. Sub-Recent bryozoans-serpulid buildups in the Coorong Lagoon, South Australia // Austr. J. Earth Sci. 1990. V. 38. P. 207–214.
Cheetham A.H., Thomsen E. Functional morphology of arborescent animals: strength and design of cheilostome bryozoan skeletons // Paleobiology. 1981. V. 7. № 3. P. 355–383.
Cowen R., Rider J. Functional analyses of fenestellid bryozoan colonies // Lethaia. 1972. V. 5. P. 145–164.
Davydov V.I., Korn D., Schmitz M.D. The Carboniferous period // The Geologic Time Scale. Amsterdarm: Elsevier, 2012. P. 603–653.
Ernst A. Diversity dynamics and evolutionary patterns of Devonian Bryozoa // Palaeobiodiv. and Palaeoenvironm. 2013a. V. 93. P. 45–63.
Ernst A. Diversity dynamics and evolutionary patterns of the Palaeozoic stenolaemate Bryozoa. Habilitationschrift (unpublished), Christian-Albrechts-Universität zu Kiel, 2013b. 435 p.
Ernst A. Fossil record and evolution of Bryozoa // Handbook of Zoology Online. Berlin: De Gruyter, 2019. P. 1–24.
Ernst A., Tolokonnikova Z., Poty E., Mottequin B.A. bryozoan fauna from the Mississippian (Tournaisian and Viséan) of Belgium // Geobios. 2017. V. 50. № 2. P. 105–121.
Gutak J.M., Tolokonnikova Z.A., Ruban D. A Bryozoan diversity in Southern Siberia at the Devonian-Carboniferous transition: New data confirm a resistivity to two mass extinctions // Palaeogeogr., Palaeoclimatol., Palaeoecol. 2008. V. 264. P. 93–99.
Hageman S.J., Bock P.E., Bone Y., McGowran B. Bryozoan growth habits: classification and analysis // J. Paleontol. 1998. V. 72. P. 418–436.
Hageman S.J., James N.P., Bone Y. Cool water carbonate production from epizoic bryozoans on ephemeral substrates // Palaios. 1997. V. 15. P. 33–48.
Haq B.U., Schutter S.R. A chronology of Paleozoic sea-level changes // Science. 2008. V. 322. P. 64–68.
Hu Z.-X., Spjeldnaes N. Early Ordovician bryozoans from China // Bull. Soc. Sci. Natur. Ouest France. 1991. Mém. HS № 1. P. 179–185.
Lakin J.A., Marshall J.E.A., Troth I., Harding I.C. Greenhouse to icehouse: a biostratigraphic review of latest Devonian–Mississippian glaciations and their global effects // Devonian climate, Sea level and Evolutionary Events. L., 2016. P. 439–464 (Geol. Soc. Spec. Publ. V. 423).
Lidgard S. Predation on bryozoan colonies: taxa, traits and trophic groups // Mar. Ecol. Progr. Ser. 2008. V. 359. P. 117–131.
Ma J., Taylor P.D., Xia F., Zhan R. The oldest known bryozoan: Prophyllodictya (Cryptostomata) from the lower Tremadocian (Lower Ordovician) of Liujiachang, south-western Hubei, central China // Palaeontology. 2015. V. 58. Pt 5. P. 925–934.
McKinney F.K. Planar branch systems in colonial suspension feeders // Paleobiology. 1981. V. 7. № 3. P. 344–354.
McKinney F.K. Paleobiological interpretation of some skeletal characters of Lower Devonian fenestrate Bryozoa, Prague Basin, Chechoslovakia // Bryozoa: past and present. Bellingham: Western Washington University, 1987. P. 161–168.
McKinney F.K., Jackson J.B.C. Bryozoan evolution. Boston: Unwin Hyman, 1989. 238 p.
McKinney F.K., Taylor P.D., Lidgard S. Predation on bryozoans and its reflection in the fossil records // Predator-prey interactions in the fossil record. N. Y.: Kluwer Academic and Plenum Publishers, 2003. P. 239–261.
Nelson C.S., Hyden F.M., Keane S.L. et al. Application of bryozoan zoarial growth-form studies in facies analysis of non-tropical carbonate deposits in New Zealand // Sedimentary Geol. 1988. V. 60. P. 301–322.
O’Dea A., Okamura B. Influence of seasonal variation in temperature, salinity and food availability on module size and colony growth of the estuarine bryozoan Conopeum seurati // Mar. Biol. 1999. V. 135. P. 581–588.
Riegel W. The Late Palaeozoic phytoplankton blackout – Artefact or evidence of global change? // Rev. Palaeobot. Palynol. 2008. V. 148. P. 73–90.
Sallan L.C., Kammer T.W., Ausich W.I., Cook L.A. Persistent predator-prey dynamics revealed by mass extinction // PNAS. 2011. V. 108(20). P. 8335–8338.
Schwark L., Empt P. Sterane biomarkers as indicators of Palaeozoic algal evolution // Palaeogeogr., Palaeoclimatol., Palaeoecol. 2016. V. 240. P. 225–236.
Snyder E.M. Revised taxonomic procedures and paleoecological applications for some North American Mississippian Fenestellidae and Polyporidae (Bryozoa) // Palaeontogr. Amer. 1991. V. 57. P. 1–275.
Strother P.K. A speculative review of factors controlling the evolution of phytoplankton during Paleozoic time // Rev. Micropaleontol. 2008. V. 51. P. 9–21.
Suárez Andrés J.L., Wyse Jackson P.N. Feeding currents: a limiting factor for disparity of Palaeozoic fenestrate bryozoans // Palaeogeogr., Palaeoclimatol., Palaeoecol. 2015. V. 433. P. 219–232.
Taylor P.D. The inference of extrazooidal feeding currents in fossil bryozoan colonies // Lethaia. 1979. V. 12. P. 47–56.
Taylor P.D. Bryozoans and palaeoenvironmental interpretation // J. Palaeontol. Soc. India. 2005. V. 50. № 2. P. 1–11.
Taylor P. D., Ernst A. Bryozoans // The great Ordovician diversification event. N. Y.: Columbia University Press, 2004. P. 147–156.
Tolokonnikova Z.A. Bryozoans from the Jurginskaya Formation (Famennian, Upper Devonian) of the Tom-Kolyvansk area (Western Siberia, Russia) // Geologos. 2010. V. 16. № 3. P. 139–152.
Tolokonnikova Z.A. The influence of the Hangenberg event on the Eurasia bryozoans // 19th Intern. Congr. on the Carboniferous and Permian. Kölner forum für Geologie und Paläontologie. 2019. Bd 23. P. 307–308.
Tolokonnikova Z., Ernst A. Palaeoecology of Famennian–Tournaisian (Late Devonian–Early Carboniferous) bryozoans from central and southern regions of Russia // Palaeobiodiv. and Palaeoenvironm. 2017. V. 97. № 4. P. 731–745.
Tolokonnikova Z., Ernst A., Poty E., Mottequin B. Middle and uppermost Famennian (Upper Devonian) bryozoans from southern Belgium // Bull. Geosci. 2015a.V. 90. № 1. P. 33–49.
Tolokonnikova Z., Ernst A., Poty E. Tournaisian (Lower Mississippian) bryozoans from Belgium // N. Jb. Geol. Paläontol. 2015b. V. 278/1. P. 23–45.
Yang K.C., Hu Z.X., Xia F. Bryozoans from Late Devonian and Early Carboniferous of Central Hunan // Palaeontol. Sin. 1988. V. 174. N. Ser. B 23. P. 1–197.
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


