Палеонтологический журнал, 2019, № 6, стр. 3-15
Консерватизм биоминеральных структур как проблема для кладистических построений (на примере двух групп яиц динозавров)
К. Е. Михайлов *
Палеонтологический институт им. А.А. Борисяка РАН
Москва, Россия
* E-mail: mikhailov@paleo.ru
Поступила в редакцию 23.10.2018
После доработки 11.01.2019
Принята к публикации 14.01.2019
Аннотация
Анализ результатов вовлечения признаков структуры скорлупы и морфологии яиц в кладистический анализ филогении динозавров (в первую очередь, теропод) показал субъективность в оценке состояния признаков при построении матрицы. На примере двух групп яиц динозавров (Elongatoolithidae и Prismatoolithidae) показано, что настроенность на результат подтвердить правильность кладограммы теропод (таксонов-хозяев яиц) зачастую приводит к предвзятой трактовке модальности признаков – в частности, к видению птичьих черт в строении скорлупы, яиц и гнезд. Нами показано, что в действительности наличие этих признаков нельзя продемонстрировать на изучаемом материале. Отмечено, что не критическое отношение к матрице приводит к потере важной биологической информации, в том числе касающейся закономерностей в эволюции морфогенеза.
ВВЕДЕНИЕ
Структура скорлупы яиц зауропсид показательно отражает эволюционный консерватизм в генезисе биокристаллического материала (далее BCM), что ярко проявляется в большом разнообразии макротаксонов современных птиц (Mikhailov, 1997a). В целом, картина такова: (1) в пределах любого традиционного отряда структура BCM скорлупы всегда одна и та же; (2) у многих заведомо неблизких отрядов она может повторяться; (3) все семейства с какими-то уникальными особенностями в строении скорлупы рассматриваются в современной системе птиц в статусе самостоятельных отрядов. Иначе говоря, в разнообразии строения скорлупы нередки гомоплазии на уровне связанных комбинаций признаков (“типов структуры”) и, соответственно, редки сходства, которые можно было бы доверительно трактовать как синапоморфии в сравнении семейств и отрядов. Специфику клады (отряда, семейства) структура скорлупы отражает хорошо (броские отличия сигналят о возможных ошибках в допущении по другим системам признаков особой генеалогической близости двух сравниваемых макротаксонов; Mikhailov, 1997b). В то же время частая повторяемость структур в отдаленных кладах не позволяет уверенно использовать признаки BСM скорлупы для реконструкции филогении. Несовпадения со схемами, полученными на костном материале, тем более ожидаемы, чем в более широком объеме таксонов мы рассматриваем родственные взаимоотношения внутри филума, например, внутри Theropoda (включая в них птиц) и, тем более, внутри Dinosauria или даже зауропсид в целом.
В разрез с этими хорошо обоснованными выводами признаки строения скорлупы яиц стали активно вовлекаться в кладистический анализ филогении динозавров, в первую очередь теропод (Zelenitsky et al., 2002; Varricchio, Jackson, 2004; Grellet-Tinner et al., 2006; Zelenitsky, Terrein, 2008; Tanaka et al., 2011; Lopez-Martines, Vicens, 2012; Ribeiro et al., 2014; Vila et al., 2017; Skutschas et al., 2019 и др.), причем с довольно-таки прозрачной, на наш взгляд, целью – подтвердить на основании изучения скорлупы (в числе других характеристик) наибольшую близость троодонтид (Troodontidae) кладе птиц sensu lato (Avialae) и показать, что все особенности размножения, характерные для птиц (и во многом отличающие их от рептилий – в классическом “функциональном” разделении этих двух прежних классов), на самом деле появляются уже внутри этой “самой птичьей” клады теропод, а не у каких-то других Maniraptora (скажем, у овирапторов). Как и можно было ожидать, результаты этих попыток оказались очень противоречивыми (Mikhailov, 2014).
В формате журнальной статьи невозможно рассмотреть сколько-нибудь полно этот общий вопрос. Акцент будет сделан на конкретном частном в проявлении общего, а именно, на том, что вера в объективность кладистического анализа приводит к “непреднамеренной подтасовке” в трактовке состояния признака и, соответственно, изначальному искажению матрицы признаков. То есть, за декларируемой беспристрастностью кладистического анализа на деле скрывается множество субъективных решений, связанных с выбором признаков и интерпретацией признакового пространства (не говоря уже о влиянии на результаты анализа таких факторов, как полнота выборки). В этом отношении кладизм, в принципе, не отличается от любого другого подхода к познанию филогении и, говоря шире, – от любого когнитивного процесса, связанного с упорядочиванием разнообразия (т.е. классификацией) на основе изначально присущей нашей нейросенсорной системе категоризации потока информации (см. Михайлов, 1997). При этом познавательные операции на каждом этапе анализа (конкретной системы признаков) неизбежно ориентируются как на накопленный данным экспертом его индивидуальный опыт изучения признаков, так и на установки мышления, подсознательно провоцируемые результатом, ранее полученным на другой системе признаков. То есть, этот результат неизбежно выступает в качестве предзаданного рисунка собираемого паззла, канализирующего его сборку.11
Эти скрытые отрицательные эффекты кладистического мышления будут рассмотрены на примере использования в кладистическом анализе двух внешне схожих, но структурно различных групп удлиненных яиц динозавров (оосемейства Elongatoolithidae и Prismatoolithidae). Обе группы яиц характерны для меловых отложений Азии и Северной Америки (одна из групп встречается также в мелу Европы и в юрских отложениях обоих континентов). С обеими группами в настоящее время ассоциируются находки эмбрионов внутри яиц и даже гнезда со скелетами родителей. По тому, какие последствия имели эти сенсационные находки и переопределения эмбрионов, ситуацию с этими группами яиц без преувеличения можно назвать главной проблемой палеоологии начала XXI в.22
Принятые сокращения: BCM – биокристаллический материал; VSUs (“vertical shell units”) – вертикальные отдельности скорлупы (макрокристаллы роста); EZ (“external zone”) – “внешняя зона” макрокристаллов роста; ML (“mammillary layer”) – конусовидный, или сосочковый слой; PL (“prismatic layer”) – призматический слой; SqU (“squamatic ultrastructure”) – “чешуйчатая ультраструктура”.
ХАРАКТЕРТИСТИКА ООCЕМЕЙСТВА ELONGATOOLITHIDAE
Две формы яиц этого семейства (роды Elongatoolithus и Macrооlithus), в том числе в составе полных и неполных кладок (гнезд), обычны в верхнем мелу Китая и Монголии (Carpenter, Alf, 1994; Mikhailov, 1995, 1997с, 2000); скорлупа того же типа встречена также в Северной Америке. Самые крупные яйца (Macroelongatoolithus) известны из верхнего мела Китая и Кореи (Carpenter, 1999; Jin et al., 2007; Kim et al., 2011). Скорлупа элонгатоолитид также описана из мела Японии (Tanaka et al., 2011, 2016), но пока не обнаружена на территории Европы.
Морфология яиц, структура кладок и гнезд (рис. 1, a). Яйца сильно удлиненные (индекс удлиненности 2.0–2.4), симметричные по форме (диаметр яйца в поперечнике почти не меняется вдоль его длинной оси) и нередко слегка уплощены. Их находят в “лежащем положении” (в один или два ряда) сцепленными попарно (одновременно функционировали оба яйцевода; Mikhailov et al., 1994; Clark et al., 1999; Sato et al., 2005), в виде круга вокруг пустого пространства в центре, в котором, по-видимому, находилcя охраняющий гнездо родитель (Kim et al., 2011, рис. 4 ; Norell et al., 2018, рис. 44 ). Поверхность скорлупы выраженно скульптированная; орнамент отражен (в шлифах) в волнистой форме линий нарастания BCM (рис. 2, д).
Рис. 1.
Кладки яиц динозавров из верхнего мела Монгольской Гоби: a – Elongatoolithus frustrabilis Mikhailov, 1994, голотип ПИН, № 3143/126, местонахождение Тугрикийн-Шире (Elongatoolithidae); б – Protoceratopsidovum minimum Mikhailov, 1994, экз. ПИН, № 4477/2, местонахождение Их-Шунхт (Prismatoolithidae; кладка перевернута “вверх дном”, чтобы показать неразрушенные части яиц, прижизненно находившиеся в плотном субстрате). Mасштабная шкала – 5 см.
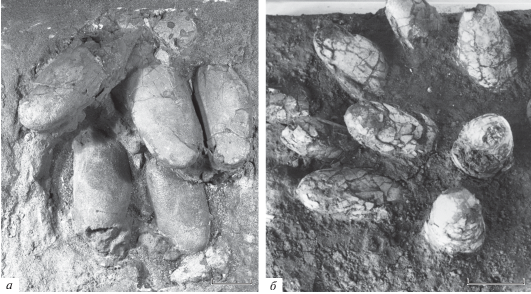
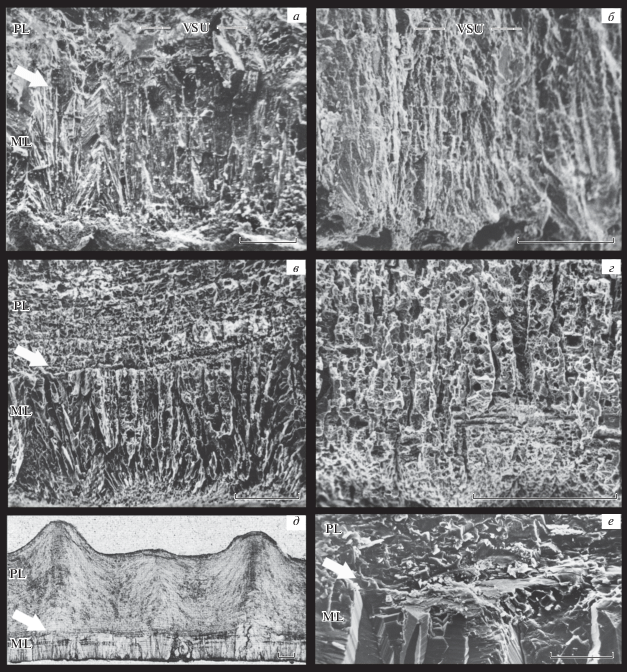
Рис. 2.
Строение скорлупы яиц на поперечных сечениях (СЭМ) в зоне перехода от ML к PL (д – шлиф, световой микроскоп): а, в, д – Macroolithus spp. из верхнего мела Казахстана; б, г – Protoceratopsidovum spp. из верхнего мела Монголии; е – эму Dromaius novaehollandiae (Latham, 1790), современный; а, б, е – фактура скола без травления; в, г – мягкое травление кислотой пришлифовки скола. Резкое изменение в микро- и ультраструктуре BCM хорошо видно на a, в, д, е, (белые стрелки), но отсутствует на б, г; в первом случае узкие субрадиальные элементы (“клинья”) в ML резко обрываются на границе слоев; во втором случае беспрепятственно проходят через условную границу между слоями, продолжаясь в виде таких же узких вертикальных “призм”. Mасштабная шкала – 100 мкм.
По реконструкции К. Сабата (Sabath, 1991; Mikhailov et al., 1994), яйца могли изначально находиться в вертикальном положении в растительном матриксе гнезда, т. е. принимали горизонтальное положение уже после гибели и захоронения гнезда в результате постепенного гниения матрикса. Однако после находки скелетов овирапторид на гнезде с яйцами стало ясно, что субгоризонтальное положение яиц первично. Положение взрослого динозавра в центральном круге гнезда также не оставляет сомнений, что, вопреки многим популярным реконструкциям, он не мог насиживать яйца, и в лучшем случае только укрывал их от солнца оперенными передними конечностями.
Структура скорлупы. В скорлупе четко обозначены два макрослоя (ML и PL), причем во втором слое в обычном свете (в шлифах) и на сколах не выявляются резкие вертикальные границы призм внутри VSUs, а между слоями наблюдается резкая граница в ультра–микроструктуре BCM (рис. 2, a, в, д), что означает перерыв в минерализации и изменение в активности секретирующего эпителия. PL имеет здесь особую ультраструктуру (SqU), которая отражает сложное трехмерное взаимодействие органической и минеральной фаз (табл. I , фиг. 3–6 ; см. вклейку). В целом, структурная зональность скорлупы (на всех уровнях иерархии BCM) – выраженно птичья, причем наиболее сходная с палеогнатами (но нет “внешней зоны” и плохо развиты “клинья” в ML).
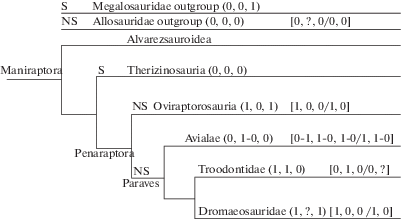
Рис. 3.
Филогения клады Maniraptora (Theropoda; по Brusatte et al., 2014) c проставленными нами модальностями признаков яиц и скорлупы; обозначения: S и NS – сферулитовая и не-сферулитовая организация VSU; цифры в круглых скобках – модальности признаков морфологии яиц (слева направо): яйца не удлиненные (0) или резко удлиненные (1), асимметрия полюсов резко выражена (1) или же не выражена (0), поверхность скорлупы особым образом скульптирована (1) или не скульптирована (0); цифры в квадратных скобках – “формула” структуры скорлупы (косые линии разделяют две размерные группы признаков): макро–микроструктура BCM (слева направо): в PL границы VSUs резко выражены (0) или не выражены (1), в ML клинья доминируют (1) или слабо развиты (0), EZ выявляется (1) или не выявляется (0) по особой форме (shaping) колонок/призм на последней стадии роста VSUs; ультра–микроструктура BCM: SqU определенно есть (1; выражен резкий переход в структуре BCM от ML к PL) или же ее нет (0; переход не выражен), EZ выявляется (1) или не выявляется (0) на уровне тонкой организации BCM.
Таксономия. Гнезда с яйцами этой группы – с эмбрионом внутри яйца и со скелетом родителя на гнезде – были найдены в Монгольской Гоби в местонахождении Укхаа-Толгод (Norell et al., 1994, 2001, 2018). Во всех случаях костные остатки принадлежат овирапторидам (скелет родителя был описан как Citipati osmolskae Clark et al., 2001). Яйца в гнезде относятся к роду Elongatoolithus и, очень вероятно, к оовиду E. frustrabilis Mikhailov, 1994 (это самые обычные яйца и скорлупа рода Elongatoolithus в отложениях сантон–кампанского возраста на территории Монголии; Михайлов, 1994а; Mikhailov, 1995, 2000)33. Со времени этих находок все яйца элонгатоолитид из Азии и Америки трактуются исключительно как “яйца овирапторов”. Череп вылупившегося детеныша, найденный с кладкой самых крупных элонгатоолитид (род Macroelongatoolithus) был соотнесен с гигантским овирапторозавром из Caenagnathidae и описан как Beibelong sinensis Pu et al., 2017.
ХАРАКТЕРИСТИКА ООСЕМЕЙСТВА PRISMATOOLITHIDAE
Две основных формы яиц этого семейства (роды Prismatoolithus и Protoceratopsidovum) обычны в верхнем мелу Северной Америки (первый) и Монголии (второй) (Carpenter, Alf, 1994; Mikhailov, 1995, 1997с, 2000). В Китае, в том числе во Внутренней Монголии, яйца, вероятно, схожие с монгольскими, упоминаются в литературе как различные оовиды Prismatoolithus (Wang et al,. 2018)44. Кладки яиц и скорлупа Prismatoolithidae известны также из отложений верхней юры Северной Америки (Hirsch, 1994) и из мела Европы (Vianey-Liaud, Crochet, 1993; Garcia et al., 2000; Lopez-Martinez, Vicens, 2012).
Морфология яиц, структура кладок и гнезд (рис. 1, б). Яйца сильно удлиненные (индекс удлиненности 2.0–2.5), отчетливо асимметричные по форме (диаметр яйца в поперечнике уменьшается от экватора к полюсам), никогда не бывают уплощенными. Их обычно находят в субвертикальном положении, более тупым полюсом вверх, более или менее равномерно распределенными по площади гнезда (нет пустого круга в центре кладки яиц). Яйца часто плотно “упакованы” в пределах гнезда, что допускает предположение, что у самки также одновременно функционировали оба яйцевода (Varricchio et al., 1997). Однако по расположению яиц в гнезде это далеко не столь очевидно, как в кладках элонгатоолитид. В других гнездах призматоолитид яйца бывают слегка рассредоточены и определенно не соприкасаются краями. По реконструкции Сабата (Sabath, 1991; Mikhailov et al., 1994), яйца находились хотя бы наполовину (или полностью) внутри удерживающего их плотного матрикса (песок, почва и т.д.), хотя, возможно, и были прикрыты сверху растительным материалом. Вопреки многим спекулятивным сценариям, никаких данных о характере поведения родителей у таких гнезд нет55. Поверхность скорлупы гладкая (нет скульптированности). Для оовида Protoceratopsidovum fluxuosum Mikhailov, 1994 описан струйчатый орнамент из очень длинных и плохо выраженных в рельефе ребер (без бугорков), хорошо отличимый от такового элонгатоолитид (полюсы яйца P. fluxuosum всегда без скульптуры; Михайлов, 1994a).
Структура скорлупы. В скорлупе два макрослоя обозначены не четко (ML и PL): макрокристаллы роста (VSUs) в первом “слое” в основном состоят из узких, но мощных “клиньев” (wedges), каждый из которых непосредственно переходит в продолжающую его рост призму второго “слоя” (призмы такие же узкие и многочисленные, их границы резко обозначены в шлифах и на сколах, от чего и происходят термин “angustiprismatic morphotype” и название Prismatoolithidae). На уровне ультра–микроструктуры между клиньями и призмами не выявляется ни резкой границы, ни вообще какого-либо изменения в тонкой организации BCM (рис. 2, б, г) – это указывает на то, что не было перерыва в минерализации, не было изменения в модусе активности секретирующего эпителия; эпителий не секретировал сложный по трехмерной структуре органический матрикс, ответственный за SqU66. В целом, “птичья структура” скорлупы проявляется только на макроуровне (т.е. в общем визуальном эффекте условной двуслойности); птичьей микрозональности BCM нет; в частности, в PL не выявляется явных признаков SqU (см. подробнее ниже).
Таксономия. В одном из яиц Prismatoolithus из Монтаны найдены остатки эмбриона, которые были ошибочно отнесены к гипсилофодону Orodromeus makelai Horner et Weishampel, 1988, однако впоследствии переопределены как Troodon formosus Leidy, 1856 (Horner, Weishampel, 1996; Varricchio et al., 2002). С тех пор все яйца призматоолитид из Америки, Европы и Азии трактуются исключительно как яйца троодонтид. Яйца трех видов рода Protoceratopsidovum из Монгольской Гоби были ранее соотнесены с протоцератопсидами (Михайлов, 1994a) на основе тафономии находок гнезд и скелетов (подробнее см. ниже).
ОБСУЖДЕНИЕ
Иллюзия филогенетического единства парасемейства Prismatoolithidae и самого образа филогении в “кладограммах яиц”. Находка первого гнезда овирапторида Citipati в Монголии (см. выше) послужила основой для априорного убеждения, что структура BCM скорлупы и морфология яиц, свойственные Elongatoolithidae – специфическая синапоморфия овирапторид. Аналогичным образом, после переопределения остатков эмбриона в одном из яиц Prismatoolithus из Монтаны все яйца с призматической макроструктурой скорлупы стали трактоваться как яйца троодонтид. Поскольку китайские Prismatoolithus из Внутренней Монголии и монгольские Protoceratopsidovum, скорее всего, представляют собой один таксон (см. выше), такая широкая трактовка “яиц троодона” автоматически распространилась и на вторые.
Казалось бы, в подтверждение такой широкой трактовки недавно в Укхаа-Толгод был найден череп и скелет нового таксона троодонтид в ассоциации с фрагментами скорлупы, определенной как Protoceratopsidovum (Pei et al., 2017). Эта пока единичная в Азии прямая ассоциация скорлупы Prismatoolithidae c троодонтидами противоречит другой закономерности: топографически и тафономически находки гнезд, яиц и скорлупы Protoceratopsidovum (=Prismatoolithus) коррелируют в Гоби с массовыми захоронениями протоцератопсовых динозавров, а стратиграфически – с отложениями джадохтской и барунгойотской свит (сантон–кампан; Mikhailov, 1995, 2000). Из отложений нэмегетинской свиты (маастрихт) не известны ни яйца и скорлупа Protoceratopsidovum (Михайлов, 1994a; Mikhailov, 1995), ни остатки протоцератопсид (Алифанов, 2008).
Таким образом, ситуация с таксономической привязкой яиц Prismatoolithidae может быть истолкована как неопределенная (двойственная) вообще, и в пределах Центральной Азии, в частности. Даже если принять, что все яйца Prismatoolithus и Protoceratopsidovum из Монголии и Китая откладывали троодоны (которые, в таком случае, должны были быть самыми обычными динозаврами в сантон–кампанское время в Монголии, гнездившимися группами у воды), то массовая ассоциация этих яиц в Гоби со скелетами протоцератопсид (а не с костными остатками троодонтид и вообще теропод) должна получить какое-то ясное палеоэкологическое объяснение (пока его не было сделано). Также необходимо объяснить, какие яйца откладывали на территории Гоби бывшие столь обычными там (по костному материалу) в сантон-кампанское время протоцератопсовые динозавры77.
На фоне этой неопределенности удивляет та легкость, с которой делаются широкие экстраполяции одной–двух привязок (эмбрионов с яйцами) без учета той самой, доказанной на птицах, распространенности гомоплазий как в структуре BCM скорлупы, так и в морфологии яиц (см. Введение)88. В результате делаются поспешные “сенсационные” выводы, которые формируют неоправданные ожидания в отношении многих других образцов, в том числе на основе их положения в “кладограммах яиц”. К примеру, в последнем обстоятельном кладистическом анализе признаков скорлупы “первое яйцо динозавров из Сибири” было определено – именно по положению яйца на кладограмме (!) – как яйцо троодона (Skutschas et al., 2019). Между тем, по структуре BCM это, скорее всего, яйцо птицы. Эта ошибка связана не с неточностью в опознании признаков (вывод о наличии SqU в образце был сделан, по-видимому, правильно), а с предубеждением, что яйцо троодона непременно должно обладать особыми птичьими признаками.
Предубеждение, повлиявшее на отнесение обсуждаемого выше яйца к троодонам, но не к птицам, сформировалось на некритичном отношении к матричной “кладограмме яиц”, которая наследуется из статьи в статью, и в которую подставляются новые образцы, получающие их таксономическую интерпретацию по своему положению в этой кладограмме. Авторы таких кладограмм нередко мало знакомы с признаками скорлупы, уровнями организации BCM и самой сутью биоминерализации (формирование биоминералов в тканях живых организмов; по существу, морфогенез любого BCM, разбираемый на нано-, ультра-, и микроуровне). Начиная с первых детальных кладограмм яиц теропод, во всякой скорлупе Prismatoolithidae видится так называемая слабо выраженная чешуйчатая ультраструктура “ill-defined SqU” (этот вопрос будет разобран ниже), которая без объяснений уподобляется SqU в скорлупе яиц птиц. При этом в новых образцах тонкая структура скорлупы и наличие давно выявленных формативных корреляций в слоистости BCM зачастую вообще не анализируется99. Опознается лишь формальная “призматичность” (на уровне макроструктуры), что позволяет относить яйца к Prismatoolithidae. Между тем, сама “призматичность” скорлупы может повторяться у многих зауропсид в силу того, что VSUs представляют собой макрокристаллы, всегда растущие “снизу вверх” и, в данном случае, в большой изначальной плотности.
К примеру, в гнезде динозавра из юры Португалии найдены остатки эмбриона, соотнесенные с аллозавридом Lourinhanosaurus (Ribeiro et al., 2014). Скорлупа яиц обнаруживает призматическую макроструктуру, из-за чего яйца на кладограмме яиц оказываются в положении рядом с яйцом троодона. Но в структуре скорлупы троодона постулируется наличие “ill-defined SqU” (Zelenitsky et al., 2002), а на фотографиях скорлупы яиц Lourinhanosaurus никаких симптомов SqU нет, как и в большинстве других образцов скорлупы Prismatoolithidae. К тому же, яйца из гнезда Lourinhanosaurus иной формы (овальные, с симметричными полюсами) и уже в силу этого не соответствуют диагнозу рода Prismatoolithus. Многие образцы призматоолитид, описанные как таковые на основе скорлупы (изученной в шлифах, в световом микроскопе, где видна лишь макроструктура VSUs), очень возможно, происходят от яиц разной формы и из разных по строению гнезд и никак не отражают прямые родственные связи их таксонов-хозяев.
Призматическая по макроструктуре скорлупа яиц динозавров является одной из самых распространенных в мире (юра и мел трех континентов), она же обнаруживается во многих семействах современных птиц. Трудно предположить, что при такой протяженности во времени данная макроструктура не повторялась в очень разных группах зауропсид. Этого никто и не предполагал, пока скорлупа не стала использоваться для построения “кладограмм яиц”, и пока опознание яйца как Prismatoolithus не стало козырем в аргументации близости таксона-хозяина к троодонтидам, которые, в свою очередь, рассматриваются как сестринская клада к Avialae, т.е., к птицам. Последнее же – самая горячая тема в обсуждении филогении динозавров, притягивающая к себе внимание широкой аудитории. Такая мотивация повышенного интереса к скорлупе Prismatoolithidae достаточно далека, на наш взгляд, от целей объективного, взвешенного обследования BCM на всех уровнях его организации.
Опора на такой формальный признак, как призматическая макроструктура, являет собой яркий пример бездумного кодирования признаков, которое не может дать удовлетворительных результатов (Wägele, 2004; Зеленков, 2013). По этому признаку в Prismatoolithidae должно быть зачислено большинство яиц неогнатических птиц (из разных отрядов), хорошо отличающихся в микро- и ультраструктурной стратификации скорлупы (Mikhailov, 1997a, 1997b). Нацеленный перевод этой большой “клады яиц” (Prismatoolithidae) в таксономическое пространство продвинутых, близких птицам теропод опирается опять же на единственный образец (“яйцо троодона” из Монтаны). Однако парадокс в том, что если в скорлупе этого яйца действительно есть SqU, то он (образец) не может быть причислен к Prismatoolithidae, где (в массе образцов) в призмах и колонках VSUs нет той тонкой трехмерной организации BCM, которая была описана как “squamatic ultrastructure” (Mikhailov, 1991).
Вызывают удивление попытки построить “древо яиц” внутри этой, скорее всего, сборной группы (Prismatoolithidae), опираясь на такой признак, как соотношение толщины ML и PL. B скорлупе яиц птиц ML и PL – это, действительно, различные по тонкой организации BCM слои как зоны разной секреторной активности эпителия яйцевода (табл. I ), а у призматоолитид это только макроструктурные эпифеномены роста VSUs (конус и колонка), в которых нет различия в ультра–микроструктуре. Граница между ними условна, и точно определить ее в каждом образце невозможно. Таким образом, подобное кодирование лишено смысла.
Не меньшее удивление вызывают такие выделяемые клады (см. цитированные выше работы), как “яйца палеогнат” и “яйца неогнат”. Они не менее искусственны, чем клада Prismatoolithidae. Среди неогнат есть, по меньшей мере, четыре отряда (Galliformes, Anseriformes, Coraciiformes, Piciformes), скорлупа яиц которых обнаруживает палеогнатную организацию BCM (Mikhailov, 1997a, 1997b), что представляет собой один из ярких примеров параллелизмов в эволюции BCM скорлупы яиц птиц, как генеалогической составляющей Theropoda. Нам известна единственная работа, в которой на схеме хоть как-то отражен этот факт (Ribeiro et al., 2014).
Предвзятая трактовка признаков как частное проявление иллюзии “экономного мышления” при кладистических реконструкциях. Как уже было обозначено выше, ошибочность представлений о Prismatoolithidae как реальной кладе и о ее близости птицам (Avialae) восходит к тому моменту, когда в скорлупе “яйца троодона” было постулировано наличие “ill-defined SqU” (Zelenitsky et al., 2002). Именно после этого “особые птичьи признаки” в скорлупе яиц новых описываемых образцов, трактуемых (по макроструктуре) как Prismatoolithidae, увидели как эти же (Zelenitsky, Therrien, 2008; Tanaka et al., 2016; Funston, Curie, 2018), так и многие другие авторы, вообще не касающиеся в своей работе признаков ультра–микроструктуры. Вопреки всем предыдущим заключениям, “ill-defined SqU” была декларирована и в монгольской скорлупе Protoceratopsidovum, как только таковая была найдена в гнезде с костными остатками троодонтид (Pei et al., 2017).1010
Очевидно, что опознание SqU в скорлупе “яйца троодона” из Монтаны и есть отправная точка в широкой таксономической интерпретации всех Prismatoolithidae как троодонтид и некритическом наделении этой скорлупы птичьими признаками. Рассмотрим этот вопрос более основательно. На фотографиях скорлупы образца, приведенных в данной работе (Zelenitsky et al., 2002, рис. 2), видны – в составе призм – микрозерна кальцита, которые авторы истолковали как SqU1111. Однако очевидно, что авторы (Zelenitsky et al., 2002) испытывали сомнение в такой трактовке, этим можно объяснить использование эпитета “ill-defined”, который остается не объясненным – в плане особенностей генезиса структуры. Между тем, упомянутые зерна кальцита видны лишь на редких участках макро-призм (и, по-видимому, далеко не на всех полученных фотографиях). Любая же характерная для роста макрокристаллов микро- и ультраструктура должна выявляться (по условиям синхронности их роста) на большой протяженности “частокола” VSUs (см. табл. I , фиг. 1–6 ), но не в редких точечных участках. Это верно и в случае диагенетической перекристаллизации крайних (снизу и сверху) зон, напрямую контактирующих с физической средой после захоронения (напр., табл. II , фиг. 6 ; см. вклейку). Показанные на фотографиях в этой работе (Zelenitsky et al., 2002) зерна BCM с четким ромбоэдрическим огранением (в том числе – в образцах ископаемой скорлупы яиц птиц, взятой для сравнения) являются обычными для кальцита формами. Они могут выщепляться – на расколе макрокристалла – из любой микроструктуры биокальцита, не являясь при этом надежными сигналами данной специфичной биоструктуры. Вся фактура раскола скорлупы “яиц троодона” (образцы яиц Prismatoolithus из Альберты, Монтаны, Колорадо) демонстрирует ее высокую кристалличность (преобладают геометрически правильные линии расщепления BCM – характерный “fish-bone pattern” в соседних призмах), при этом не видно никаких признаков изменения ультра–микроструктуры при переходе от высоких клиньев (“wedges”) к продолжающим их призмам (“prisms”), а сам этот переход фиксируется лишь условно. Таким образом, вся тонкая трехмерная организация BCM – как она генерируется по мере синхронного роста VSUs – не может быть уподоблена здесь тому, что мы видим в скорлупе яиц птиц (см. табл. I; см. также иллюстративный материал в: Mikhailov, 1997a). Микрозерна кальцита сами по себе не являются признаками SqU, как особого BCM1212. Ключевым является т.н. “lacy-pattern” (“чешуйчатость”), образуемый геометрически неправильными системными микротрещинами, изоморфными трехмерной структуре органических “мембран” и “фибрилл” (табл. I ; см. определение SqU в Mikhailov, 1991, 1997с).
В настоящее время показано (Athanasiadou et al., 2018), что в скорлупе яиц птиц синтез биокальцита контролируется протеинами (в том числе ингибирующим рост макрокристалов остеопонтином) уже на уровне субглобулярных наночастиц (на всем протяжении роста VSUs как макрокристаллов, т.е. как в PL, так и в ML)1313. Зона роста макрокристаллов c SqU образует основную часть скорлупы яиц у всех без исключения птиц (Mikhailov, 1997a) и определяет особые физические свойства скорлупы, в частности, повышенную устойчивость BCM к статическим и ударным нагрузкам (Tyler, 1969; Athanasiadou et al., 2018). Это, в конечном итоге, позволяет птицам значительно сократить общие расходы кальция на одну кладку, как и время пребывания яйца в яйцеводе (рост макрокристаллов в PL идет быстрее, чем в ML). Следовательно, появление зоны роста со SqU представляет собой отнюдь не формальное событие в структурировании скорлуповой оболочки яйца. Оно существенно меняет баланс физиологических затрат на воспроизводство большой кладки яиц при сохранении той прочности скорлупы, которая необходима для перехода к открытому гнездованию и насиживания яиц родителями. Что касается яиц Prismatoolithus (в том числе, в гнезде троодона), то на данный момент нет доказательств, что они вообще испытывали какие-либо подобные нагрузки: эти яйца находились в плотном субстрате в вертикальном положении (см. выше).
Сложности идентификации SqU в ископаемой скорлупе объективны – из-за постепенного разрушения органического матрикса и “залечивания” ультра- и микродефектов кристаллом (см. Mikhailov, 2014). Однако нам кажется очевидным, что решение о “наиболее птичьей” (среди динозавров) структуре скорлупы в “яйце троодона” (и после этого всех Prismatoolithidae) было принято авторами именно из-за стремления найти дополнительную опору “правильной” трактовке филогении клады Paraves, где троодонтиды рассматриваются как сестринская клада к птицам. Вероятно, именно поэтому авторы статьи (Zelenitsky et al., 2002), кроме “ill-defined SqU”, отметили еще четыре “птичьих признака” в скорлупе яйца троодона. Все эти четыре признака – либо очевидные плезиоморфии, либо черты, вообще не имеющие биологической специфики1414. Что касается SqU (это самый весомый “птичий признак” структуры с биологической спецификой), то никаких следов этой био-ультраструктуры, из-за которой PL в скорлупе яиц птиц издавна назывался губчатым слоем (spongy layer), не выявляется и в других классических вариантах яиц призматоолитид – ни в американских Prismatoolithus (Hirsch, Quinn, 1990; Hirsch, 1994), ни в монгольских Protoceratopsidovum (Михайлов, 1994a; Mikhailov, 1997c), что и учитывалось при обосновании диагноза Prismatoolithidae (Mikhailov et al., 1994; Mikhailov, 1997c)1515. Если предположить, что во всех яйцах призматоолитид (многие десятки образцов из юры и мела трех континентов) тонкая сетевая структура органического матрикса (основа SqU) была полностью утрачена в процессе диагенеза BCM, то остается непонятным, почему она всегда утрачивается именно в этой группе яиц, и почти никогда – в сотнях образцов яиц Elongatoolithidae, в том числе, известных (в Монголии и Китае) из тех же слоев и местонахождений, что и яйца Protoceratopsidovum и Prismatoolithus.
Еще одним “птичьим” признаком скорлупы яиц в кладистическом анализе часто принимается так называемая внешняя зона (external zone). Эта зона была описана (Erben, 1970) как тонкий верхний слой вертикальных микрокристаллов (поверх мощной зоны со SqU) в скорлупе яиц курицы и гуся (оба – представители базальной среди неогнатических птиц клады Galloanseres; Зеленков, 2013). Поскольку скорлупа куриных яиц традиционно является основным объектом изучения формирования яйцевых оболочек, широко распространилось мнение, что такая “внешняя зона” – обязательный признак птичьей скорлупы. На самом деле, такая особая структура (sensu Erben, 1970) выражена только у Galloanseres, Palaeognathae и еще в нескольких семействах неогнат. В подавляющем же числе отрядов неогнатических птиц внешней зоны как особого “высококристалличного” слоя с отличной от SqU ульраструктурой BCM нет (Mikhailov, 1997a; табл. II , фиг. 3, 5 ). В скорлупе яиц, по меньшей мере, некоторых энанциорнисовых птиц (Laevisoolithidae: роды Laevisoolithus и Subtiliolithus) внешней зоны опять же нет (Mikhailov, 1991, 1997с); у других (яйца Gobioolithus c эмбрионами Gobipipus reschetovi Kurochkin et al., 2013) ее присутствие проблематично (табл. II , фиг. 6 ). В скорлупе яиц овирапторозавров (Elongatoolithidae) внешней зоны также нет (ни в одном из ее возможных вариантов). В массе образцов изученной скорлупы яиц Prismatoolithidae также не удается обнаружить каких-либо признаков внешней зоны (Hirsch, Quinn, 1990; Михайлов, 1994a; Mikhailov, 1997c; Zelenitsky et al., 2002).1616
В результате описанного выше опознания “птичьих” признаков ультра–микроструктуры скорлупы, такая (“птичья”) трактовка сборной группы Prismatoolithidae в настоящее время широко транслируется как нечто само собой разумеющееся. Трудно не видеть в этом ошибочном или, по крайней мере, очень спорном представлении, некритически транслируемым из статьи в статью, последствий общих проблемных моментов в методологии кладистического анализа и порождаемого этой методологией упрощенного модуса мышления (см. введение).
“Кладограммы яиц” и их трансляция в кладограммы таксонов. Одной из сложившихся за последние 20 лет традиций является построение кладограммы яиц, которую пытаются сопоставить со схемой филогении таксонов, созданной на матрице признаков скелета. Чаще всего эта процедура мотивируется поиском подтверждения уже известной кладограммы в новой выборке признаков1717. Однако самым интересным в этом сопоставлении было бы выявление нестыковок, что может отражать нелинейность эволюции морфогенеза по разным устойчивым сочетаниям признаков. Ниже мы предлагаем сопоставить обе схемы именно на предмет выявления подобных нестыковок.
На рис. 3 показана общепринятая на данный момент кладограмма, отражающая филогению теропод1818. Цифрами на ней проставлены состояния признаков структуры скорлупы и морфологии яиц, которые не входили в матрицу признаков, на которой она основана. Не вдаваясь в специфику этих состояний, мы можем назвать очевидные для нас некоторые результаты сопоставления. Если принимаем, что троодонтиды – ближайшая к птицам группа теропод, то отсутствие у них SqU нарушает “правильность” сопряжения двух кладограмм. Иными словами, “неправильность” в сопряжении порождает диссонанс в восприятии кладограммы яиц, как отражения филогении таксонов.
Этот диссонанс усугубляется тем фактом, что в скорлупе яиц овирапторозавров (Elongatoolithidae), которые по кладограмме теропод удалены от Avialae сильнее, чем троодонтиды, наличие “птичьих признаков” в структуре BCM скорлупы не вызывает сомнений (реальная двухслойность и наличие SqU во втором слое, причем идентичные тому, что выявляется у бескилевых птиц; см. рис. 2, в). “Неправильность” кладограммы яиц принимает почти гротескные формы, если троодонтиды и дромеозавриды действительно являются сестринскими группами внутри единой клады Deinonychosauria (наиболее близкой к Avialae), поскольку в “яйце дейнонихуса” (дромеозавриды) скорлупа отчетливо сходна с таковой более удаленных от птиц овирапторозавров.1919 Получается, что эти две сестринские группы обнаруживают весьма разный уровень сходства с птицами в признаках BCM скорлупы (и, возможно, в строении гнезд), причем именно у троодонтид ультраструктура оказывается в наименьшей степени птичьей.
Еще более “не птичья” скорлупа выявляется у третьей особой клады манирапторов – теризинозаврид. Их скорлупа уже мало чем отличается по структуре BCM от таковой зауропод2020. Искать в ней птичьи признаки бессмысленно, что дискредитирует уверенность в том, что все прогрессивные тероподы (клада Maniraptora) должны обладать хотя бы базовой “прогрессивно-птичьей” структурой скорлупы. “Птичья” организация BCM, действительно, возникла не только уже в ходе эволюции теропод, но и, по-видимому, в процессе эволюции клады Maniraptora. При этом достоверно она проявляет себя только у птиц (Enantiornithes, Palaeognathae и Neognathae) и у овирапторозавров (Oviraptoridae и Caenagnathidae). Если схема филогении клады Paraves, показанная на рис. 3, верна, то признание параллельного появления “птичьих признаков” BCM скорлупы внутри этой клады должно рассматриваться как ведущая презумпция. Это заключение не имеет логической альтернативы.
* * *
Автор выражает благодарность коллегам М. Moрено-Азанза (M. Moreno-Azanza, Universidade Nova de Lisboa, Caparica) и Д. Варричио (D.J. Varricchio, Montana State University) за разъяснения истории деталей находок яиц с эмбрионами и их таксономической интерпретации. Автор благодарен Д. Барте (D. Barta, California State University) и П.П. Скучасу (С.-Петербургский государственный ун-т) за возможность ознакомления с фотографиями шлифов скорлупы яиц овирапторида Citipati и “первого яйца динозавра” из Сибири. Автор глубоко признателен М.А. Шишкину и А.П. Расницыну за серьезный разбор рукописи и конструктивные замечания по логике изложения и аргументации ряда положений изначального текста.
Список литературы
Алифанов В.Р. Миниатюрный рогатый динозавр Gobiceratops minutus gen. et sp. nov. (Bagaceratopidae, Neoceratopsia) из позднего мела Монголии // Палеонтол. журн. 2008. № 6. С. 49–60.
Зеленков Н.В. Система птиц (Aves: Neornithes) в начале XX века // Тр. Зоол. ин-та РАН. 2013. Прил. № 2. С. 174–190.
Михайлов К.Е. Яйца тероподовых и протоцератопсовых динозавров из меловых отложений Монголии и Казахстана // Палеонтол. журн. 1994а. № 2. С. 81–96.
Михайлов К.Е. Яйца зауроподовых и орнитоподовых динозавров из меловых отложений Монголии // Палеонтол. журн. 1994б. № 3. С. 114–127.
Михайлов К.Е. Классификация признаков или иерархия таксонов? // Журн. общ. биол. 1997. Т. 58. № 3. С. 107–112.
Шишкин М.А. О происхождении пионерской фауны амфибий раннего мезозоя // Тр. Палеонтол. об-ва. Т. 1. М: ПИН РАН, 2018. С. 176–185.
Araùjo R., Castanhinha R., Martins R.M.S. et al. Filling the gaps of dinosaur eggshell phylogeny: Late Jurassic theropod clutch with embryos from Portugal // Sci. Rep. 2013. V. 3. № 1924. P. 1–8.
Athanasiadou D., Jiang W., Goldbaum D. et al. Nanostructure, osteopontin, and mechanical properties of calcitic avian eggshell // Sci. Advances. 2018. V. 4. № 3. P. 1–13.
Bever G.S., Norell M.A. The perinate skull of Byronosaurus (Troodontidae) with observations on the cranial ontogeny of paravian theropods // Amer. Mus. Novit. 2009. № 3657. P. 1–51.
Brusatte S.L., Lloyd G.T., Wang S.C., Norell M.A. Gradual assembly of avian body plan culminated in rapid rates of evolution across the dinosaur-bird transition // Curr. Biol. 2014. V. 24. № 20. P. 2386–2392.
Carpenter K. Eggs, nests, and baby dinosaurs: a look at dinosaur reproduction. Bloomington: Indiana Univ. Press, 1999. 336 p.
Carpenter K., Alf K. Global distribution of dinosaur eggs, nests and babies // Dinosaur eggs and babies / Eds. Carpenter K., Hirsch K.E., Horner J.R. Cambridge: Cambr. Univ. Press, 1994. P. 15–30.
Chiappe L.M., Salgado L., Coria R. Embryonic skulls of titanosaur sauropod dinosaurs // Science. 2001. № 293. P. 2444–2446.
Clark J.M., Norell M.A., Chiappe L. An oviraptorid skeleton from the late Cretaceous of Ukhaa Tolgod, Mongolia, preserved in an avianlike brooding position over an oviraptorid nest // Amer. Mus. Novit. 1999. № 3265. P. 1–51.
Cohen S., Cruickshank A.R.I., Joysey K.A. et al. The dinosaur egg and embryo project. Exhibition guide. Leicester: Rock Art, 1995. 16 p.
Elliott A. Family Megapodiidae (Megapods) // Handbook of the birds of the world / Eds. del Hoyo J., Elliott A., Sargatal J. Barcelona: Lynx Eds, 1994. V. 2. P. 278–319.
Erben H.K. Ultrastrukturen und Mineralisation rezenter und fossiler Eischalen bei Vogeln und Reptilien // Biomineralisation. 1970. Bd 1. S. 1–66.
Funston G.F., Currie P.J. The first record of dinosaur eggshell from the Horseshoe Canyon Formation (Maastrichtian) of Alberta, Canada // Can. J. Earth Sci. 2018. V. 55. P. 436–441.
Garcia G., Feist M., Cabot A. et al. New Prismatoolithus oospecies and other Upper Cretaceous dinosaur eggs from the Villeveyrac Meze Basin (Herault, France) // Bull. Soc. Géol. France. 2000. V. 171. P. 283–289.
Grellet-Tinner G., Chiappe L.M., Bottjer D., Norell M. Paleobiology of dinosaur eggs and nesting behaviors // Palaeogeogr., Palaeoclimatol., Palaeoecol. 2006. V. 232. P. 294–321.
Grellet-Tinner G., Makovicky P. A possible egg of the Deinonychus antirrhopus: phylogenetic and biological implications // Can. J. Earth Sci. 2006. V. 43. P. 705–719.
Hirsch K.F. Upper Jurassic eggshells from the Western Interior of North America // Dinosaur eggs and babies / Eds. Carpenter K., Hirsch K.E., Horner J.R. Cambridge: Cambr. Univ. Press. 1994. P. 137–150.
Hirsch K.F., Quinn B. Eggs and eggshell fragments from the Upper Cretaceous Two Medicine formation of Montana // J. Vertebr. Paleontol. 1990. V. 10. P. 491–511.
Horner J.R., Weishampel D.B. Correction to: A comparative embryological study of two ornithischian dinosaurs // Nature. 1996. V. 383. P. 103.
Jackson F.D., Horner J.R., Varricchio D.J. A study of a Troodon egg containing embryonic remains using epifluorescence microscopy and other techniques // Cret. Res. 2010. V. 31. P. 255–262.
Jackson F.D., Zheng W., Imai T. et al. Fossil eggs associated with a neoceratopsian (Mosaiceratops azumai) from the Upper Cretaceous Xiaguan Formation, Henan Province, China // Cret. Res. 2018. V. 91. P. 457–467.
Jin X., Azuma Y., Jackson F.D., Varricchio D.J. Giant eggs from the Tiantai basin // Can. J. Earth Sci. 2007. V. 44. P. 81–88.
Kim B.S., Huh M., Moon K.H., Jang S.J. Excavation and preparation of theropod nest from Aphae-do in Jeollanam-do province, South Korea // J. Geol. Soc. Korea. 2011. V. 47. № 2. P. 205–211.
Kundrát M., Cruickshank A.R., Manning T.W., Nudds J. Embryos of therizinosauroid theropods from the Upper Cretaceous of China: diagnosis and analysis of ossification patterns // Acta Zool. 2008. V. 89. P. 231–251.
Kurochkin E.N., Chatterjee S., Mikhailov K.E. An embryonic enantiornithine bird and associated eggs from the Cretaceous of Mongolia // Paleontol. J. 2013. V. 47. № 11. P. 1252–1269.
Lopez-Martinez N., Vicens E. A new peculiar dinosaur egg, Sankofa pyrenaica oogen. nov. oosp. nov. from the Upper Cretaceous coastal deposits of the Aren Formation, south-central Pyrenees, Lleida, Catalonia, Spain // Palaeontology. 2012. V. 55. P. 325–339.
Manning T.W., Joysey K.A., Cruickshank A.R.I. In ovo tooth replacement in a therizinosauroid dinosaur // First Intern. Symp. Dinosaur Eggs and Babies, Spain. Ext. Abstr. Isona i Conca Dellà: Impremta Prov. de la Diputació Lleida, 2000. P. 129–134.
Mikhailov K.E. Classification of fossil eggshells of amniotic vertebrates // Acta Palaeontol. Pol. 1991. V. 36. P. 193–238.
Mikhailov K.E. Systematic, faunistic and stratigraphic diversity of Cretaceous eggs in Mongolia: comparison with China // 6th Symp. Mesozoic Terrestrial Ecosystems and Biota / Eds. Sun A., Wang Y. Beijing: China Ocean Press, 1995. P. 165–168.
Mikhailov K.E. Avian egg-shells: an atlas of scanning electron micrographs // Brit. Ornithol. Club Occ. Publ. 1997a. № 3. P. 1–88.
Mikhailov K.E. Bird taxonomy based on egg-shell structure // Bull. Brit. Ornithol. Club. 1997b. V. 117. № 2. P. 149–150.
Mikhailov K.E. Fossil and recent eggshell in amniotic vertebrates: fine structure, comparative morphology and classification // Spec. Pap. Palaeontol. № 56. L.: Palaeontol. Assoc., 1997c. P. 1–80.
Mikhailov K.E. Eggs and eggshells of dinosaurs and birds from the Cretaceous of Mongolia // The age of dinosaurs in Russia and Mongolia / Eds. Benton M., Shishkin M.A., Unwin D., Kurochkin E.N. Cambridge: Cambr. Univ. Press, 2000. P. 560–572.
Mikhailov K.E. Eggshell structure, parataxonomy and phylogenetic analysis: some notes on articles published from 2002 to 2011 // Histor. Biol. 2014. V. 26. P. 144–154.
Mikhailov K.E., Sabath K., Kurzanov S.M. Eggs and nests from the Cretaceous of Mongolia // Dinosaur eggs and babies / Eds. Carpenter K., Hirsch K.E., Horner J.R. Cambridge: Cambr. Univ. Press. 1994. P. 88–115.
Norell M.A., Balanoff A.M., Barta D.E., Erickson G.M. A second specimen of Citipati osmolskae associated with a nest of eggs from Ukhaa Tolgod, Omnogov Aimag, Mongolia // Amer. Mus. Novit. 2018. № 3899. P. 1–44.
Norell M.A., Clark J.M., Chiappe L.M. An embryonic oviraptorid (Dinosauria: Theropoda) from the Upper Cretaceous of Mongolia // Amer. Mus. Novit. 2001. № 3325. P. 1–17.
Norell M.A., Clark J.M., Dashzeveg D. et al. A theropod dinosaur embryo and the affinities of the Flaming Cliffs dinosaur eggs // Science. 1994. V. 266. P. 779–782.
Pei R., Norell M.A., Barta D.E. et al. Osteology of a new Late Cretaceous troodontid specimen from Ukhaa Tolgod, Ömnögovi Aimag, Mongolia // Amer. Mus. Novit. 2017. № 3889. P. 1–47.
Pooley M. Ultrastructural relationships of mineral and organic matter in avian eggshells // Scanning Electron Microscopy. 1979. V. 2. P. 475–482.
Ribeiro V., Mateus O., Holwerda F. et al. Two new theropod egg sites from the Late Jurassic Lourinhậ Formation, Portugal // Histor. Biol. 2014. V. 26. № 2. P. 206–217.
Sabath K. Upper Cretaceous amniotic eggs from the Gobi Desert // Acta Palaeontol. Pol. 1991. V. 36. P. 151–192.
Sato T., Cheng Y., Wu X. et al. A pair of shelled eggs inside a female dinosaur // Science. 2005. V. 308. P. 375.
Simons P.C.M. Ultrastructure of the hen eggshell and its physiological interpretation. Wageningen: Center for agricultural publ. and document, 1971. Rep. 758. 90 p.
Skutschas P.P., Markova V.D., Boitsova E.A. et al. The first dinosaur egg from the Lower Cretaceous of Western Siberia, Russia // Histor. Biol. 2019. V. 31. P. 836–844.
Tanaka K., Lu J., Kobayashi J. et al. Description and phylogenetic position of dinosaur eggshells from the Luanchuan area of western Henan Province, China // Acta Geol. Sin. 2011. V. 85. P. 66–74.
Tanaka K., Zelenitsky D.K., Saegusa H. et al. Dinosaur eggshell assemblage from Japan reveals unknown diversity of small theropods // Cret. Res. 2016. V. 57. P. 350–363.
Tyler C. Avian eggshells: their structure and characteristics // Intern. Rev. General Exper. Zool. 1969. V. 4. P. 81–130.
Varricchio D.J., Horner J.R., Jackson F.D. Embryos and eggs for the Cretaceous theropod dinosaur Troodon formosus // J. Vertebr. Paleontol. 2002. V. 22. P. 564–576.
Varricchio D.J., Jackson F.D. Cladistic analysis of eggshell characters: a phylogenic assessment of prismatic dinosaur eggs from the Cretaceous Two Medicine Formation of Montana // J. Vertebr. Paleontol. 2004. V. 24. P. 931–937.
Varricchio D.J., Jackson F., Borkowski J., Horner J.R. Nest and egg clutches of the dinosaur Troodon formosus and the evolution of avian reproductive traits // Nature. 1997. V. 385. P. 247–250.
Vianey-Liaud M., Crochet J.-M. Dinosaur eggshells from the Late Cretaceous of Languedoc (Southern France) // Rev. Paleobiol. 1993. № 7. P. 237–249.
Vila B., Selles A.G., Beetschen J.C. The controversial Les Labadous eggshells: a new and peculiar dromaeosaurid (Dinosauria: Theropoda) ootype from the Upper Cretaceous of Europe // Cret. Res. 2017. V. 72. P. 117–123.
Wägele J.W. Hennig’s phylogenetic systematics brought up to date // Milestones in systematics / Eds. Williams D.M., Forey P.L. Washington: CRC Press, 2004. P. 101–125.
Wang Q., Li Y.-G., Zhu X.-F. et al. New ootype prismatoolithids from the Late Cretaceous, Laiyang Basin and its significance // Vertebr. PalAsiat. 2018. V. 56. P. 264–272.
Zelenitsky D.K., Modesto S.P., Currie P.J. Bird-like characteristics of troodontid theropod eggshell // Cret. Res. 2002. V. 23. P. 297–305.
Zelenitsky D.K., Therrien F. Phylogenetic analysis of reproductive traits of maniraptoran theropods and its implications for parataxonomy // Palaeontology. 2008. V. 51. P. 807–816.
Zhao Z.-K., Li R. First record of Late Cretaceous hypsilophodontid eggs from Bayan Manduhu, Inner Mongolia // Vertebr. PalAsiat. 1993. V. 31. P. 77–84.
Дополнительные материалы отсутствуют.
Инструменты
Палеонтологический журнал


