Журнал общей биологии, 2022, T. 83, № 5, стр. 369-379
Общие закономерности влияния солености на энергетический баланс водных животных в гиперсоленой среде
Е. В. Ануфриева 1, Н. В. Шадрин 1, *
1 Институт биологии южных морей им. А.О. Ковалевского РАН
299011 Севастополь, Пр-т Нахимова, 2, Россия
* E-mail: snickolai@yandex.ru
Поступила в редакцию 24.06.2022
После доработки 08.09.2022
Принята к публикации 19.09.2022
- EDN: DUXOJL
- DOI: 10.31857/S0044459622050037
Аннотация
Балансово-энергетический подход, базируясь на принципах термодинамики, позволяет лишь очертить область возможного, отсечь то, чего не может быть. Его широко используют в гидробиологии/экологии для описания экосистем, однако очень редко – для понимания тех или иных эмпирически найденных закономерностей. В статье на основе анализа собственных и литературных данных сделан ряд эмпирических обобщений по влиянию солености на животных в интервале от 35 до 300 г/л, рассмотренных с использованием балансово-энергетического подхода. По видам осмоадаптационных механизмов животные делятся на два типа: активных осморегуляторов концентрации солей в жидкостях тела и осмоконформеров, у которых осмоадаптация осуществляется внутри клеток (накопление веществ-осмолитов), как у одноклеточных организмов. Животные-осмоконформеры могут не только сами синтезировать разные виды осмолитов, но и получать их с пищей или из растворенного органического вещества. С ростом солености выше оптимальной у организмов обоих типов происходит увеличение трат энергии на работу этих механизмов. Верхний предел галотолерантности у осмоконформеров в первую очередь может определяться наличием доступных осмолитов в среде, а не физиологическими особенностями вида. С ростом солености, связанной с пропорционально увеличивающейся вязкостью раствора, у всех животных происходит увеличение трат на движение. При увеличении солености траты на движение будут стремиться к максимально допустимым, ограничивая объем двигательной активности. Это уменьшает возможность получения необходимого рациона. Эмпирическое обобщение: при увеличении солености выше оптимальной общие траты на обмен будут увеличиваться, а получаемый рацион уменьшаться. Анализ этого обобщения на основе балансово-энергетического подхода позволяет сделать ряд выводов: 1. возможный дефинитивный размер будет уменьшаться с увеличением солености, что и наблюдается в природе и экспериментах; 2. чем выше концентрация пищи, тем менее выражен этот эффект; 3. уменьшение массы тела позволяет виду существовать в более широком диапазоне солености и концентрации пищи. Этим, прежде всего, можно объяснить тот факт, что с ростом солености и при других неблагоприятных/стрессовых условиях из сообщества в первую очередь “выпадают” крупноразмерные виды животных, что и наблюдается в природе. Балансово-энергетический подход можно использовать для понимания найденных экологических закономерностей. При этом подход лишь очерчивает область возможностей и определяет тренды, ничего не говоря о механизмах и о том, как будет идти их конкретная реализация. Он не может дать понимания уникальности конкретных сложных процессов и систем.
Балансово-энергетический подход, разработанный в 1930-х годах выдающимися экологами Г.Г. Винбергом и В.С. Ивлевым, не исчерпал возможностей своего использования в гидробиологии (Шадрин, 2011; Алимов и др., 2013). Данный подход позволяет очертить границы возможного, хотя и не раскрывает действующие при этом механизмы (Винберг, 1981; Шадрин, 2011). Тем не менее, несмотря на его ограниченность, подход может еще многое дать для понимания особенностей функционирования и динамики популяций и сообществ, в частности, экологических эффектов различных факторов. Попытаемся продемонстрировать это на примере солености, рассмотрев ее роль для животных в гиперсоленой среде. Воздействие любого фактора на организм/популяцию одновременно осуществляется разными путями, среди которых имеются как влияющие непосредственно на особь/популяцию, так и опосредованно через модификацию действия иных абиотических и биотических факторов (Ивлев, 1977; Шадрин, 1990). Соленость, действуя прямо и опосредованно, считается одним из основных факторов, влияющих на структуру и функционирование популяций и сообществ в водоемах, особенно гиперсоленых. Анализ общих закономерностей воздействия солености на животных, конечно, можно вести, используя разные теоретические подходы. В настоящем исследовании используется балансово-энергетический подход (Заика, 1985; Алимов и др., 2013), развивающий идею Г.Г. Винберга (1981) о его ценности и ограниченности. Суть подхода можно передать рядом уравнений, кратко представим их. Общее уравнение энергетического баланса особи можно записать следующим образом (Шадрин, 2011; Алимов и др., 2013):
где Р – суммарная продукция особи, А – ассимилированная энергия, R – суммарные траты на обмен.СОЛЕНОСТЬ И ТРАТЫ НА ОБМЕН
Суммарные траты на обмен можно записать следующим образом (Шадрин, 2011):
где R – суммарные траты на обмен; Ro – основной обмен; Ra – траты энергии на внешнюю работу (активный обмен); СДДП – траты энергии на окисление и другие биохимические процессы, связанные с трансформацией пищи и ее использованием для роста (специфическое динамическое действие пищи); Rк – траты энергии на адаптационные процессы для существования в неоптимальной среде, которые увеличиваются при росте некомфортности среды.Не вдаваясь в детали, в общем виде рассмотрим влияние солености на составляющие R. Влияние солености на интенсивность основного обмена (Ro) нельзя считать достаточно изученным, большинство имеющихся данных не позволяют разделять Ro, специфическое динамическое действие пищи (СДДП) и траты на осморегуляцию (Rк). Лишь в небольшом количестве работ сделаны оценки трат, связанных с осмоадаптацией или СДДП, в дальнейшем будем рассматривать сумму этих трат при оценке влияния солености. Анализ опубликованных результатов экспериментов с ракообразными, рыбами, моллюсками (Nelson et al., 1996; Marshall et al., 2003; Gillikin, 2004; Gonzalez et al., 2005; Allan et al., 2006; Gracia-López et al., 2006; Arjona et al., 2007; Resgalla et al., 2007; Shock et al., 2009; Svetlichny et al., 2010; Uliano et al., 2010; Ern et al., 2014; Rivera-Ingraham, Lignot, 2017; Ern, Esbaugh, 2018) показал отсутствие однозначной общей зависимости интенсивности обмена от солености. У животных реализуется два разных типа осмоадаптации (Хлебович, 1974; Gilles, 1979; Аладин, 1987, 1990; Хлебович, Аладин, 2010; Rivera-Ingraham, Lignot, 2017), и они делятся на две группы: осморегуляторы, у которых концентрация солей в жидкостях тела активно регулируется на организменном уровне, и осмоконформеры, у которых, как и у одноклеточных, осмоадаптация осуществляется на клеточном уровне и в клетках создаются высокие концентрации осмолитов.
Энергозатраты на активную осморегуляцию будут расти с увеличением осмотического градиента, что подтверждено многократно (Gillikin, 2004; Gonzalez et al., 2005; Rivera-Ingraham, Lignot, 2017; Ern, Esbaugh, 2018, и др.). Например, у рыб затраты энергии на осморегуляцию могут составлять от 1 до 50% общих энергетических затрат в зависимости от солености среды (Ern et al., 2014; Weaver et al., 2016). В настоящее время основные молекулярно-клеточные механизмы этого феномена поняты (Gonzalez et al., 2005; Ern et al., 2014; Weaver et al., 2016; Rivera-Ingraham, Lignot, 2017). Доля энергии, идущая на реализацию этих процессов, может изменяться в очень широких пределах, маскируя рассматриваемую зависимость. У жаброногих рачков р. Artemia, животных с наилучшей системой осморегуляции (Gajardo, Beardmore, 2012), обмен слабо зависит от солености в широком диапазоне, по крайней мере от 35 до 150 г/л (Gilchrist, 1958; Irwin et al., 2007; El-Gamal, 2011). В то же время потребление кислорода у них постепенно увеличивается при уменьшении солености ниже 35 г/л (Dwivedi et al., 1987; El-Gamal, 2011). Частично это объясняется тем, что в разных диапазонах солености и концентрации кислорода у Artemia способны синтезироваться три типа гемоглобина с разным сродством к кислороду (Moens et al., 1991). Artemia могут существовать в диапазоне солености от 5 до более 300 г/л, реализуя при низкой солености гиперосмотический механизм регуляции, а при солености выше 50–54 г/л – гипоосмотический. При этой критической солености рачки перенастраивают механизм осморегуляции, что, в частности, показано в исследовании влияния малых доз радиации на рачков при разной солености (Мирзоева и др., 2018). У рачков в период перенастройки наблюдается уменьшение устойчивости к действию стрессовых факторов и повышается смертность. Скорее всего, это происходит в результате дополнительных затрат энергии на процесс акклимации. В период акклимации к новой солености или температуре всегда происходит увеличение трат энергии (Ивлева, 1981; Хлебович, 2012). При изменениях солености может варьировать соотношение биохимических субстратов, используемых для получения энергии (Verslycke, Janssen, 2002; Uliano et al., 2010; Ern, Esbaugh, 2018), что также маскирует влияние солености на обмен. Соленость влияет и на экспрессию генов, регулирующих синтез различных ферментов, участвующих в метаболизме и осморегуляции (Rivera-Ingraham et al., 2016; Weaver et al., 2016; Rivera-Ingraham, Lignot, 2017; Lee et al., 2022), уменьшая рост затрат энергии на осморегуляцию. Из приведенного выше вытекает заключение: с ростом солености у животных-осморегуляторов происходит увеличение трат на осморегуляцию, и это – общий тренд. Однако его проявления видо- и местоспецифичны и могут маскироваться действием других факторов (температура, концентрация пищи и кислорода и др.).
Зависимость трат на осмоадаптацию от солености у осмоконформеров не столь очевидна, как у осморегуляторов. В цитозоле клеток животных в значительных количествах всегда имеются органические осмолиты, которые играют важную роль в объемном гомеостазе и являются цитопротекторами (Чеботарева, 2007). Небольшие органические молекулы (моно- и олигосахариды, многоатомные спирты, аминокислоты, бетаины, амины и белки) хорошо растворяются в воде и могут действовать как осмолиты, не нарушая нормальный ход метаболизма в клетке (Yancey, 2001; Деткова, Болтянская, 2007). В клетках животных они могут образовываться за счет расщепления сложных молекул на более простые или поступать из пищи (глицерин, бетаин и т.д.) (Patrick, Bradley, 2000; Yancey, 2001; Yoder et al., 2006; Renault et al., 2016). Животные-осмоконформеры могут не только сами синтезировать разные виды осмолитов, но и использовать осмолиты поедаемых первичных продуцентов (Gilles, 1979; Patrick, Bradley, 2000; Yancey, 2001; Vooys, Geenevasen, 2002; Lindley et al., 2011; Anufriieva, 2015; Rivera-Ingraham et al., 2016). Такое использование животными чужих осмолитов является наименее энергозатратным механизмом. У некоторых видов животных их одноклеточные симбионты – фото- или хемосинтетики – способствуют возможности существования хозяев при высокой солености, обеспечивая их энергией и веществами-осмолитами (Smith et al., 2000; Hickman, 2003; Yancey et al., 2010; Röthig et al., 2016). Возможно, животные-осмоконформеры могут потреблять осмолиты из растворенного органического вещества (РОВ). Можно предположить, что в этом случае также не требуется видимых дополнительных трат энергии для создания повышенной внутриклеточной концентрации осмолитов. При повышении солености первичные продуценты интенсифицируют синтез осмолитов, например, глицерола, и их концентрация в продуцируемой биомассе растет (Шадрин, Ануфриева, 2018). Эффективность же поглощения/усвоения РОВ животными увеличивается с ростом солености выше определенного уровня (Комендантов, Хлебович, 1989). Следовательно, возможность получения осмолитов животными в гиперсоленых водах достаточно высока. Оба механизма (осморегуляция и синтез осмолитов) требуют определенных затрат энергии, таким образом, получение осмолитов с пищей и/или из РОВ может существенно снижать затраты энергии на процессы осмоадаптации (Yoder et al., 2006; Shadrin et al., 2017). Можно допустить, исходя из этого, что верхний предел галотолерантности у осмоконформеров в первую очередь определяется наличием доступных осмолитов в среде, а не энергетических ресурсов. Для различных таксонов животных найдено, что чем в большей степени соленость отклоняется от комфортной, тем выше траты на осмоадаптацию и общее потребление кислорода (Farmer, Beamish, 1969; Skadhauge, Lotan, 1974; Kokkinn, 1986; Villarreal et al., 1994; Iwama et al., 1997; Gillikin, 2004; Gonzalez et al., 2005; Ern et al., 2014; Rivera-Ingraham, Lignot, 2017). Любой тип осмоадаптации требует дополнительных затрат энергии, и при росте солености в результате этого всегда в той или иной степени будет увеличиваться и общий обмен.
Траты на движение (Ra) являются важной составляющей общего обмена животных, в определенных случаях в несколько раз превышающей сумму всех остальных составляющих общего обмена (Dickson, Kramer, 1971; Torres, Childress, 1983; Morris et al., 1985; Cowles, Childress, 1988; Rosewarne et al., 2016; Svetlichny et al., 2017; Hernández-Sandoval et al., 2018). Эти траты зависят от характера и интенсивности двигательной активности животного. Рассмотрим возможное влияние солености на них. В ряде исследований показано, что двигательная активность уменьшается с ростом солености выше оптимального значения (Finney, 1979; Swanson, 1998; McAllen, Taylor, 2001; Zhang et al., 2007; Michalec et al., 2012). Например, средняя скорость движения у науплиусов и метанауплиусов Artemia (длина тела 0.6–1.5 мм) при солености 70 г/л была в среднем на 20% больше, чем при 145 г/л, а у взрослых рачков (длина тела 9–10 мм) различия составляли 30% (Anufriieva, Shadrin, 2014a). При этом в среде с водорослями скорость перемещения рачков была существенно ниже, чем в среде без пищи. С ростом солености в этих опытах наблюдали и увеличение разности между скоростью движения рачков в среде с пищей и без пищи. Подобное отмечено и для других подвижных животных (Ивлев, 1944; Шадрин, 1981; Williamson, 1981; Seuront et al., 2004; Sims et al., 2008). На двигательное поведение влияют и другие факторы. Экспериментально показано, что в присутствии хищников (личинок рыб) у неполовозрелых Artemia разных размеров происходило увеличение скорости движения в среднем в 1.8 раз (Beck, Turingan, 2007).
В опытах с Artemia максимально возможная скорость движения значимо не зависела от солености (Anufriieva, Shadrin, 2014a), что, возможно, объясняется тем, что сопротивление жидкости движению хоть и увеличивается с ростом солености, но увеличение этого же сопротивления делает более эффективным механизм гребли рачков (Alexander, 2003). Следовательно, энергетическая эффективность движения рачков практически независима от солености, но суммарные траты на движение при этом увеличиваются. Таким образом, можно предположить, что максимально возможный обмен, по крайней мере у Artemia, не зависит от солености. Хотя с увеличением солености и пропорционально увеличивающейся вязкости раствора будет происходить рост трат на движение. Следовательно, можно предположить, что при увеличении солености траты на движение будут стремиться к максимально возможным, резко ограничивая возможности двигательной активности. Это, в частности, должно вести к уменьшению возможности получения необходимого рациона. Хотя, скорее всего, это не общее правило, в понимании трофических взаимодействий еще много неясностей. Следует отметить, что влияние солености на локомоторную активность животных и трат энергии на движение являются недостаточно изученными вопросами для случая гиперсоленой среды. Есть еще один механизм снижения трат энергии на активный обмен, связанных с поиском и потреблением пищи. Поиск и потребление животной пищи требует больших затрат энергии, чем растительной, и это может вести к изменению состава рациона рыб (Hossain et al., 2017a, b; Vieira et al., 2020). Так, например, показано, что у высоко галотолерантного вида рыб Atherinella brasiliensis (Quoy, Gaimard, 1854) с увеличением солености в пищевом комке существенно уменьшается доля потребленных животных и увеличивается объем растительной пищи (Vieira et al., 2020).
СОЛЕНОСТЬ И АССИМИЛИРОВАННАЯ ЭНЕРГИЯ
В обобщенном виде зависимость рациона и его ассимилированной части от концентрации пищевых объектов можно представить следующим образом (Шадрин, 1981, 1990; Shadrin et al., 2020):
(3)
$A = \alpha С = \alpha {\text{ }}{{W{\text{p }}} \mathord{\left/ {\vphantom {{W{\text{p }}} {\left( {{{T}_{1}} + {{T}_{2}}} \right)}}} \right. \kern-0em} {\left( {{{T}_{1}} + {{T}_{2}}} \right)}},$T2 необходимо учитывать только при высокой концентрации достаточно крупных жертв, когда их объем близок к объему кишечника (Jeschke et al., 2002). В случае мелких жертв, когда их может помещаться в кишечнике много, T2$ \ll $ T1, и поэтому этим показателем допустимо пренебречь. Учитывая, что T1 = 1/(βVn), где β – коэффициент, n – концентрация пищевых объектов, V – относительная скорость движения животного, равная $\sqrt {(V_{1}^{2} + V_{2}^{2})} $, где V1 и V2 – скорости хищника и жертвы, уравнение (3) можно записать следующим образом (Shadrin et al., 2020):
С уменьшением средней скорости движения рацион будет уменьшаться, что следует из уравнения (4). Существует общий тренд уменьшения двигательной активности в гиперсоленой среде с ростом солености в различных таксонах животных (Finney, 1979; Swanson, 1998; McAllen, Taylor, 2001; Zhang et al., 2007; Michalec et al., 2012). Поэтому рост солености будет вести к падению рациона при одинаковой концентрации пищи. Обсуждая вопрос влияния солености на количество ассимилированной энергии, нельзя упускать из виду возможность животных потреблять растворенное органическое вещество (Stephens, 1968; Anderson, Stephens, 1969; Хайлов, Ерохин, 1978; Комендантов, Хлебович, 1989), учитывая, что его концентрация, как правило, высока в гиперсоленой среде (Shadrin et al., 2019c). Nа+-зависимый обменный транспорт осуществляется через клеточную мембрану, и интенсивность потребления растворенного органического вещества, включая свободные аминокислоты, с ростом солености увеличивается (Stephens, 1964, 1968; Stephens, Vircar, 1966; Siebers, Bulnheim, 1977). Роль этого феномена в гиперсоленых местообитаниях в настоящее время абсолютно неизвестна, но можно предположить, что она значима.
Для организма, чтобы он мог существовать, должно выполняться следующее соотношение (Шадрин, 2011; Алимов и др., 2013):
Из неравенства (5) следует, что верхний предел галотолерантности у животных, в том числе и у одноклеточных (Oren, 2011), определяется биоэнергетическими ограничениями. Исходя из вышеприведенных данных и рассуждений, можно сделать следующее эмпирическое обобщение: с ростом солености траты на обмен несколько увеличиваются, а рацион (при заданной концентрации пищи) будет убывать. Возможность получать достаточное количество энергии с рационом будет определять возможность существования данного вида животных при той или иной солености. Графической иллюстрацией может служить рис. 1.
Рис. 1.
Зависимость трат на обмен и ассимилированной энергии от солености при разной концентрации пищи для абстрактного животного. Обозначения: 1 – ассимилированная энергия при высокой концентрации пищи; 2 – ассимилированная энергия при низкой концентрации пищи; 3 – траты на обмен. Графическое обобщение литературных данных.
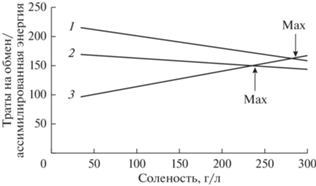
R существенно зависит от эколого-физиологических особенностей вида, в то время как А в большей степени определяется условиями питания, а именно концентрацией и составом доступной пищи (Шадрин, Ануфриева, 2018). Например, для веслоногих рачков Arctodiaptomus salinus (Daday, 1885) было показано, что верхний предел солености, до которого доживали рачки, при очень высокой концентрации микроводорослей был 140–150 г/л, а в сосудах с меньшим количеством микроводорослей – лишь 80 г/л (Ануфриева, Шадрин, 2014). Увеличение осмоадаптационных возможностей с ростом обеспеченности пищей показано и для представителей других таксонов животных, в частности и рыб (Rippingale, Hodgkin, 1977; Swanson, 1998; Kang, King, 2012; Lee et al., 2013; Hossain et al., 2017a; Vieira et al., 2020). Животные, используя осмолиты микроводорослей, могут существенно снижать затраты энергии на их синтез. Вероятно, поэтому ряд галотолерантных копепод и личинок хирономид находили при наивысшей солености только при интенсивном “цветении” микроводорослей (Kokkinn, 1986; Shadrin, Anufriieva, 2013; Anufriieva, 2015; Ануфриева, 2016; Shadrin et al., 2017). Соленость в этом случае является лишь одним из важных экологических фильтров, лимитирующих возможную видовую структуру зооценоза (Shadrin et al., 2019a). Существует общий тренд уменьшения видового обилия с увеличением солености выше 40–50 г/л (Дагаева, 1927; Hedgpeth, 1959; Hammer, 1986; Williams, 1998; Anufriieva, Shadrin, 2018; Sacco et al., 2021). При этом, как правило, в диапазоне от 40 до 120 г/л соленость не является основным фактором, определяющим видовое богатство, биотические факторы играют более важную роль (Williams, 1998; Шадрин, Ануфриева, 2018; Anufriieva, Shadrin, 2018; Shadrin et al., 2019a). Еще в 1955 г. В.С. Ивлев сделал обобщение: “Для выживания подавляющего большинства животных решающее значение имеют биотические факторы. … Лишь критические, летальные напряжения абиотических факторов приобретают мощность биологических причин…” (Ивлев, 1977, с. 7). И проведенный анализ случая гиперсоленых экосистем еще раз подтверждает это общее правило.
СОЛЕНОСТЬ И РОСТ
Исходя из уравнения (1) и вышеприведенных данных об увеличение трат на обмен и уменьшении рациона, можно говорить об общей тенденции убывания продукции с ростом солености выше оптимальной. Экспериментально это подтверждено для одного вида амфипод (Normant, Lamprecht, 2006) и артемий (Barnes, Wurtsbaugh, 2015). Разумеется, количественное проявление этой тенденции является видоспецифичным и зависит также от других факторов (температуры, концентрации пищи и т.д.). Дефинитивная/максимальная масса животного определяется суммой суточных приростов массы за время развития, что можно представить в виде уравнения (Сущеня, 1975; Шадрин, 2011; Алимов и др., 2013):
(6)
$\mathop \smallint \limits_0^t ~\frac{{dW}}{{dt}} = \mathop \smallint \limits_0^t ~\left( {A{\text{\;}} - R} \right) = {\text{\;}}\mathop \smallint \limits_0^t ~({{a}_{1}}{{W}^{{{{b}_{1}}}}} - ~\,\,{{a}_{2}}{{W}^{{{{b}_{2}}}}}),$Разумеется, в уравнении (6) $A$ = ${{a}_{1}}{{W}^{{{{b}_{1}}}}}$ является лишь определенным приближением к реальности, так как рассматривает идеальный случай, когда коэффициенты a1 и b1 не меняются с возрастом и не зависят от факторов среды, чего в природе не бывает. Лишь в контролируемых условиях эксперимента такая зависимость реализуется. Так как обычно b1 < b2 (Сущеня, 1975; Печень-Финенко и др., 1986; Day et al., 1996), из уравнения следует, что при увеличении массы тела удельная скорость роста будет уменьшаться. Есть максимальная масса, при которой A = R, т.е. дальнейший рост невозможен. В идеальном случае эта максимальная масса будет зависеть от рациона (усвоенной энергии), что графически представлено на рис. 2.
Рис. 2.
Зависимость трат на обмен и ассимилированной энергии от массы тела при разной концентрации пищи для абстрактного животного. Обозначения: 1 – ассимилированная энергия при высокой концентрации пищи; 2 – ассимилированная энергия при низкой концентрации пищи; 3 – траты на обмен.
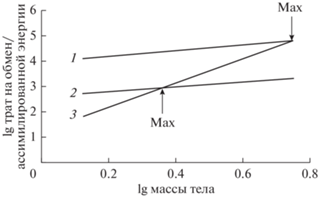
Совместный анализ рис. 1 и 2 позволяет сделать вывод, что возможный дефинитивный размер будет определяться концентрацией пищи, а не только соленостью, и будет уменьшаться с увеличением солености. Это показано на двух видах артемии и личинках Diptera экспериментально в мезокосмах (Barnes, Wurtsbaugh, 2015). Например, размер самок Artemia уменьшался примерно на 30% с увеличением солености от 25 до 225 г/л, масса рачков при этом в среднем уменьшалась от 0.68 до 0.23 мг, почти в 3 раза. Подобная зависимость отмечена и для личинок Ephydra sp., средний размер был почти одинаков в диапазоне солености от 25 до 75 г/л, а потом уменьшался на 40% с увеличением солености до 250 г/л, масса личинок изменялась от 1.1 до 0.6 мг, почти в 2 раза. Для видов ряда таксонов найдено, что в природных популяциях с увеличением солености наблюдается уменьшение средних размеров/массы животных (Carbonnel, 1983; Kokkinn, 1986; Van Harten, 1996; Mezquita et al., 2000; Herbst, 2006; Anufriieva, Shadrin, 2014b; Weaver et al., 2016; Shadrin et al., 2019b). Зависимость среднего размера/массы тела от солености не всегда является линейной. В крымской и марокканской популяциях копеподы Arctodiaptomus salinus происходило существенное уменьшение размеров тела самцов и самок при повышение солености от 15–20 до 70 г/л (Rokneddine, 2004; Anufriieva, Shadrin, 2014b). Другие факторы влияют на характер проявления этой зависимости, прежде всего температура (Rokneddine, 2004; Anufriieva, Shadrin, 2014b). Чем выше температура, тем меньше размер тела A. salinus (Ануфриева, Шадрин, 2014; Anufriieva, Shadrin, 2014b). Температурой определяется и вид зависимости от солености, например, при температуре 10°С была отмечена положительная зависимость длины тела копеподы A. salinus от солености, а при температуре >20°С – отрицательная (Rokneddine, 2004).
При любой концентрации пищи существует максимальная масса животного, при которой оно способно существовать. Максимально возможный размер животного с ростом солености будет уменьшаться тем сильнее, чем меньше концентрация пищи. Таким образом, уменьшение массы тела позволяет виду существовать в более широком диапазоне солености и концентрации пищи. Вероятно этим, прежде всего, можно частично объяснить тот факт, что с ростом солености и при других неблагоприятных/стрессовых условиях из сообщества в первую очередь “выпадают” крупноразмерные виды животных (Плотников, 2016; Shadrin et al., 2019c).
ЗАКЛЮЧЕНИЕ
Суммируя все вышеприведенное, можно сделать общий вывод, что балансово-энергетический подход полезен для понимания найденных экологических закономерностей. При этом следует помнить, как писал Г.Г. Винберг (1981), что наблюдаемые в природе феномены – всего лишь реализованные варианты среди многих нереализованных, эвентуально возможных вариантов. Базируясь на термодинамике, подход может лишь помогать очерчивать области возможного и определяет тренды, не давая понимания закономерностей и механизмов реализации эвентуально возможного. Термодинамика имеет дело с усредненными величинами, которые дают характеристики совокупности каких-либо объектов, она не может дать понимание уникальности отдельных дискретных систем. Балансово-энергетический подход также не может этого сделать в экологии.
Оценивая возможности подхода, уместно вспомнить слова одного из его создателей Г.Г. Винберга (1981): “Экосистема рассматривается как некоторая природная целостность при продукционно-энергетическом исследовании, и оно направляется на выяснение и количественное выражение ее исторически сложившихся особенностей. Затем эти в общих чертах выясненные особенности экосистемы могут и должны подвергаться аналитическому изучению для выяснения механизма характеризующих экосистему явлений и протекающих в ней процессов, взаимодействия и взаимозависимости видов и т.д. Существенно, что в этом случае успеху аналитического исследования подчиненных целому явлений способствует то, что оно ведется при уже известных ограничениях, отражающих место данного явления в экосистеме”.
Список литературы
Аладин Н.В., 1987. Соленостные адаптации и эволюция осморегуляторных способностей в пределах классов Ostracoda и Branchiopoda // Тр. ЗИН АН СССР. Т. 160. С. 106–126.
Аладин Н.В., 1990. Общая характеристика гидробионтов Аральского моря с точки зрения физиологии осморегуляции // Тр. ЗИН АН СССР. Т. 223. С. 5–18.
Алимов А.Ф., Богатов В.В., Голубков С.М., 2013. Продукционная гидробиология. СПб.: Наука. 342 с.
Ануфриева Е.В., 2016. Cyclopoida в гиперсоленых водоемах Крыма и мира: разнообразие, влияние факторов среды, экологическая роль // Журн. СФУ. Сер. Биол. Т. 9. № 4. С. 398–408.
Ануфриева Е.В., Шадрин Н.В., 2014. Arctodiaptomus salinus (Daday, 1885) (Calanoida, Copepoda) в соленых водоемах Крыма // Морской экол. журн. Т. 13. № 3. С. 5–11.
Винберг Г.Г., 1981. Многообразие и единство жизненных явлений и количественные методы в биологии // Журн. общ. биологии. Т. 42. № 1. С. 5–18.
Дагаева В.Н., 1927. Наблюдения над жизнью соленого озера у бухты Круглой у Севастополя // Изв. АН СССР. Сер. VI. Т. 21. Вып. 7. С. 1319–1346.
Деткова Е.Н., Болтянская Ю.В., 2007. Осмоадаптация галоалкофильных бактерий: роль осморегуляторов и возможности их практического применения // Микробиология. Т. 76. № 5. С. 581–593.
Заика В.Е., 1985. Балансовая теория роста животных. Киев: Наукова думка. 191 с.
Ивлев В.С., 1944. Время охоты и проходимый хищником путь в связи с плотностью популяции жертвы // Зоол. журн. Т. 23. № 4. С. 139–145.
Ивлев В.С., 1977. Экспериментальная экология питания рыб. Киев: Наукова думка. 272 с.
Ивлева И.В., 1981. Температура среды и скорость энергетического обмена у водных животных. Киев: Наукова думка. 231 с.
Комендантов А.Ю., Хлебович В.В., 1989. Соленостная зависимость поглощения водными беспозвоночными растворенных органических веществ // Тр. ЗИН АН СССР. Т. 196. С. 22–50.
Мирзоева Н.Ю., Ануфриева Е.В., Шадрин Н.В., 2018. Влияние гамма-облучения цист партеногенетических Artemia (Branchiopoda, Anostraca) на выход науплиусов и постнауплиальную выживаемость при разной солености // Поволжский экол. журн. № 4. С. 418–432. https://doi.org/10.18500/1684-7318-2018-4-418-432
Печень-Финенко Г.А., Аболмасова Г.И., Романова З.А., 1986. Энергетический бюджет двух видов равноногих ракообразных // Экология моря. Вып. 23. С. 54–64.
Плотников И.С., 2016. Многолетние изменения фауны свободноживущих водных беспозвоночных Аральского моря. СПб.: ЗИН РАН. 168 с.
Сущеня Л.М., 1975. Количественные закономерности питания ракообразных. Минск: Наука и техника. 208 с.
Хайлов К.М., Ерохин В.Е., 1978. Вопросы утилизации РОВ рачками Tigriopus brevicornis и Calanus Finmarchicus // Океанология. Т. 11. № 1. С. 117– 126.
Хлебович В.В., 1974. Критическая соленость биологических процессов. Л.: Наука. 235 с.
Хлебович В.В., 2012. Очерки экологии особи. СПб.: ЗИН РАН. 143 с.
Хлебович В.В., Аладин Н.В., 2010. Фактор солености в жизни животных // Вестн. РАН. Т. 80. № 5–6. С. 527–532.
Чеботарева Н.А., 2007. Влияние молекулярного краудинга на ферменты гликогенолиза // Успехи биол. химии. Т. 47. С. 233–258.
Шадрин Н.В., 1981. Некоторые теоретические аспекты питания копепод // Экология морских организмов. Киев: Наукова думка. С. 38–44.
Шадрин Н.В., 1990. Влияние биотических факторов на энергетический баланс гидробионтов // Биоэнергетика гидробионтов. Киев: Наукова думка. С. 102–118.
Шадрин Н.В., 2011. Исчерпал ли себя балансово-энергетический подход в гидробиологии: возможности и ограничения // Морской экол. журн. Т. 10. № 1. С. 98–103.
Шадрин Н.В., Ануфриева Е.В., 2018. Экосистемы гиперсоленых водоемов: структура и трофические связи // Журн. общ. биологии. Т. 79. № 6. С. 418–427. https://doi.org/10.1134/S0044459618060076
Alexander R.M., 2003. Principles of Animal Locomotion. Princeton: Princeton Univ. Press. 372 p.
Allan E.L., Froneman P.W., Hodgson A.N., 2006. Effects of temperature and salinity on the standard metabolic rate (SMR) of the caridean shrimp Palaemon peringueyi // J. Exp. Mar. Biol. Ecol. V. 337. № 1. P. 103–108. https://doi.org/10.1016/j.jembe.2006.06.006
Anderson J.W., Stephens G.C., 1969. Uptake of organic material by aquatic invertebrates. VI. Role of epiflora in apparent uptake of glycine by marine crustaceans // Mar. Biol. V. 4. № 3. P. 243–249. https://doi.org/10.1007/BF00393901
Anufriieva E.V., 2015. Do copepods inhabit hypersaline waters worldwide? A short review and discussion // Chin. J. Ocean. Limnol. V. 33. № 6. P. 1354–1361. https://doi.org/10.1007/s00343-014-4385-7
Anufriieva E.V., Shadrin N.V., 2014a. The swimming behavior of Artemia (Anostraca): New experimental and observational data // Zoology. V. 117. № 6. P. 415–421. https://doi.org/10.1016/j.zool.2014.03.006
Anufriieva E.V., Shadrin N.V., 2014b. Factors determining the average body size of geographically separated Arctodiaptomus salinus (Daday, 1885) populations // Zool. Res. V. 35. P. 132–141.
Anufriieva E.V., Shadrin N.V., 2018. Diversity of fauna in Crimean hypersaline water bodies // J. Sib. Fed. Univ. Biol. V. 11. № 4. P. 294–305. https://doi.org/10.17516/1997-1389-0073
Arjona F.J., Vargas-Chacoff L., Ruiz-Jarabo I., Martín del Río M.P., Mancera J.M., 2007. Osmoregulatory response of Senegalese sole (Solea senegalensis) to changes in environmental salinity // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 148. № 2. P. 413–421. https://doi.org/10.1016/j.cbpa.2007.05.026
Barnes B.D., Wurtsbaugh W.A., 2015. The effects of salinity on plankton and benthic communities in the Great Salt Lake, Utah, USA: A microcosm experiment // Can. J. Fish. Aquat. Sci. V. 72. № 6. P. 807–817. https://doi.org/10.1139/cjfas-2014-0396
Beck J.L., Turingan R.G., 2007. The effects of zooplankton swimming behavior on prey-capture kinematics of red drum larvae, Sciaenops ocellatus // Mar. Biol. V. 151. № 4. P. 1463–1470. https://doi.org/10.1007/s00227-006-0598-4
Carbonnel G., 1983. Morphometrie et hypersalinite chez Cyprideis torosa (Jones) (Ostracoda, Actuel) dans les Salines de Santa-Pola (Alicante, Espagne) // Sci. Geol. Bull. V. 36. P. 211–219.
Cowles D.L., Childress J.J., 1988. Swimming speed and oxygen consumption in the bathypelagic mysid Gnathophausia ingens // Biol. Bull. V. 175. № 1. P. 111–121. https://doi.org/10.2307/1541898
Day O.J., Jones D.A., Howell B.R., 1996. Food consumption, growth and respiration of sole, Solea solea (L.), during early ontogeny in a hatchery environment // Aquac. Res. V. 27. № 11. P. 831–839. https://doi.org/10.1046/j.1365-2109.1996.t01-1-00800.x
Dickson I.W., Kramer R.H., 1971. Factors influencing scope for activity and active and standard metabolism of rainbow trout (Salmo gairdneri) // J. Fish. Res. Board Can. V. 28. № 4. P. 587–596. https://doi.org/10.1139/f71-082
Dwivedi S.N., Diwan A.D., Iftekhar M.B., 1987. Oxygen uptake in the brine shrimp Artemia in relation to salinity // Indian J. Fish. V. 34. P. 359–361.
El-Gamal M.M., 2011. Respiration of Artemia franciscana cultured under different salinities // Anim. Biol. V. 61. № 4. P. 413–425. https://doi.org/10.1163/157075511X596891
Ern R., Esbaugh A.J., 2018. Effects of salinity and hypoxia-induced hyperventilation on oxygen consumption and cost of osmoregulation in the estuarine red drum (Sciaenops ocellatus) // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 222. P. 52–59. https://doi.org/10.1016/j.cbpa.2018.04.013
Ern R., Huong D.T., Cong N.V., Bayley M., Wang T., 2014. Effect of salinity on oxygen consumption in fishes: A review // J. Fish Biol. V. 84. № 4. P. 1210–1220. https://doi.org/10.1111/jfb.12330
Farmer G.J., Beamish F.W., 1969. Oxygen consumption of Tilapia nilotica in relation to swimming speed and salinity // J. Fish. Res. Board Can. V. 26. № 11. P. 2807–2821. https://doi.org/10.1139/f69-277
Finney C.M., 1979. Salinity stress in harpacticoid copepods // Estuaries. V. 2. P. 132–135. https://doi.org/10.2307/1351640
Gajardo G.M., Beardmore J.A., 2012. The brine shrimp Artemia: Adapted to critical life conditions // Front. Physiol. V. 3. https://doi.org/10.3389/fphys.2012.00185
Gilchrist B.M., 1958. The oxygen consumption of Artemia salina (L.) // Hydrobiologia. V. 12. № 1. P. 27–37. https://doi.org/10.1007/BF00035925
Gilles R., 1979. Mechanisms of Osmoregulation in Animals. N.-Y.: Wiley Interscience. 667 p.
Gillikin D.P., 2004. Osmoregulatory ability of Chiromantes ortmanni (Crosnier, 1965) subjected to dilute and hypersaline seawater // Crustaceana. V. 77. № 1. P. 67–74. https://doi.org/10.1163/156854004323037892
Gonzalez R.J., Cooper J., Head D., 2005. Physiological responses to hyper-saline waters in sailfin mollies (Poecilia latipinna) // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 142. № 4. P. 397–403. https://doi.org/10.1016/j.cbpa.2005.08.008
Gracia-López V., Rosas-Vázquez C., Brito-Pérez R., 2006. Effects of salinity on physiological conditions in juvenile common snook Centropomus undecimalis // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 145. № 3. P. 340–345. https://doi.org/10.1016/j.cbpa.2006.07.008
Hammer U.T., 1986. Saline Lake Ecosystems of the World. Dordrecht: Dr. W. Junk Publ. 616 p.
Hedgpeth J.W., 1959. Some preliminary considerations of the biology of inland mineral waters // Archivio di Oceanografia e Limnologia. V. 11. P. 111–141.
Herbst D.B., 2006. Salinity controls on trophic interactions among invertebrates and algae of solar evaporation ponds in the Mojave Desert and relation to shorebird foraging and selenium risk // Wetlands. V. 26. № 2. P. 475–485.
Hernández-Sandoval P., Díaz F., Re-Araujo A.D., López-Sánchez J.A., Martínez-Valenzuela M.D., et al., 2018. Thermal preference, critical thermal limits, oxygen routine consumption and active metabolic scope of Macrobrachium tenellum (Smith, 1871) maintained at different acclimation temperatures // Lat. Am. J. Aquat. Res. V. 46. № 3. P. 558–569. https://doi.org/10.3856/V46-Issue3-fulltext-9
Hickman C.S., 2003. Mollusc-microbe mutualisms extend the potential for life in hypersaline systems // Astrobiology. V. 3. № 3. P. 631–644. https://doi.org/10.1089/153110703322610717
Hossain M.A., Ye Q., Leterme S.C., Qin J.G., 2017a. Spatial and temporal changes of three prey-fish assemblage structure in a hypersaline lagoon: The Coorong, South Australia // Mar. Freshw. Res. V. 68. № 2. P. 282–292. https://doi.org/10.1071/MF15212
Hossain M.A., Hemraj D.A., Ye Q., Leterme S.C., Qin J.G., 2017b. Diet overlap and resource partitioning among three forage fish species in Coorong, the largest inverse estuary in Australia // Environ. Biol. Fishes. V. 100. P. 639–654. https://doi.org/10.1007/s10641-017-0592-3
Irwin S., Wall V., Davenport J., 2007. Measurement of temperature and salinity effects on oxygen consumption of Artemia franciscana K., measured using fibre-optic oxygen microsensors // Hydrobiologia. V. 575. № 1. P. 109–115. https://doi.org/10.1007/s10750-006-0358-y
Iwama G.K., Takemura A., Takano K., 1997. Oxygen consumption rates of tilapia in fresh water, sea water, and hypersaline sea water // J. Fish Biol. V. 51. № 5. P. 886–894. https://doi.org/10.1111/j.1095-8649.1997.tb01528.x
Jeschke J.M., Kopp M., Tollrian R., 2002. Predator functional responses: Discriminating between handling and digesting prey // Ecol. Monogr. V. 72. P. 95–112. https://doi.org/10.1890/0012-9615(2002)072[0095:PFRDBH]2.0.CO;2
Kang S.R., King S.L., 2012. Influence of salinity and prey presence on the survival of aquatic macroinvertebrates of a freshwater marsh // Aquat. Ecol. V. 46. № 4. P. 411–420. https://doi.org/10.1007/s10452-012-9410-3
Kokkinn M.J., 1986. Osmoregulation, salinity tolerance and the site of ion excretion in the Halobiont Chironomid, Tanytarsus barbitarsis Freeman // Aust. J. Mar. Freshw. Res. V. 37. № 2. P. 243–250. https://doi.org/10.1071/MF9860243
Lee C.E., Moss W.E., Olson N., Chau K.F., Chang Y.M., Johnson K.E., 2013. Feasting in fresh water: Impacts of food concentration on freshwater tolerance and the evolution of food × salinity response during the expansion from saline into fresh water habitats // Evol. Appl. V. 6. № 4. P. 673–689. https://doi.org/10.1111/eva.12054
Lee J., Cho B.C., Park J.S., 2022. Transcriptomic analysis of brine shrimp Artemia franciscana across a wide range of salinities // Mar. Genomics. V. 61. Art. 100919. https://doi.org/10.1016/j.margen.2021.100919
Lindley L.C., Phelps R.P., Davis D.A., Cummins K.A., 2011. Salinity acclimation and free amino acid enrichment of copepod nauplii for first-feeding of larval marine fish // Aquaculture. V. 318. № 3–4. P. 402–406. https://doi.org/10.1016/j.aquaculture.2011.05.050
Marshall D.J., Perissinotto R., Holley J.F., 2003. Respiratory responses of the mysid Gastrosaccus brevifIssura (Peracarida: Mysidacea), in relation to body size, temperature and salinity // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 134. № 2. P. 257–266. https://doi.org/10.1016/S1095-6433(02)00258-1
McAllen R., Taylor A., 2001. The effect of salinity change on the oxygen consumption and swimming activity of the high-shore rockpool copepod Tigriopus brevicornis // J. Exp. Mar. Biol. Ecol. V. 263. № 2. P. 227–240. https://doi.org/10.1016/S0022-0981(01)00308-2
Mezquita F., Olmos V., Oltra R., 2000. Population ecology of Cyprideis torosa (Jones, 1850) in a hypersaline environment of the Western Mediterranean (Santa Pola, Alacant) (Crustacea: Ostracoda) // Ophelia. V. 53. № 2. P. 119–130. https://doi.org/10.1080/00785236.2000.10409442
Michalec F.G., Holzner M., Hwang J.S., SouIssi S., 2012. Three dimensional observation of salinity-induced changes in the swimming behavior of the estuarine calanoid copepod Pseudodiaptomus annandalei // J. Exp. Mar. Biol. Ecol. V. 438. P. 24–31. https://doi.org/10.1016/j.jembe.2012.09.013
Moens L., Wolf G., Hauwaert M.L., van, Baere I., de, Beeumen J., van, et al., 1991. The extracellular hemoglobins of Artemia: Structure of the oxygen carrier and respiration physiology // Artemia Biology. N.-Y.: CRC Press. P. 187–220.
Morris M.J., Gust G., Torres J.J., 1985. Propulsion efficiency and cost of transport for copepods: a hydromechanical model of crustacean swimming // Mar. Biol. V. 86. № 3. P. 283–295. https://doi.org/10.1007/BF00397515
Nelson J., Tang Y.O., Boutilier R., 1996. The effects of salinity change on the exercise performance of two Atlantic cod (Gadus morhua) populations inhabiting different environments // J. Exp. Biol. V. 199. № 6. P. 1295–1309.
Normant M., Lamprecht I., 2006. Does scope for growth change as a result of salinity stress in the amphipod Gammarus oceanicus? // J. Exp. Mar. Biol. Ecol. V. 334. № 1. P. 158–163. https://doi.org/10.1016/j.jembe.2006.01.022
Oren A., 2011. Thermodynamic limits to microbial life at high salt concentrations // Environ. Microbiol. V. 13. № 8. P. 1908–1923. https://doi.org/10.1111/j.1462-2920.2010.02365.x
Patrick M.L., Bradley T.J., 2000. Regulation of compatible solute accumulation in larvae of the mosquito Culex tarsalis: Osmolarity versus salinity // J. Exp. Biol. V. 203. P. 831–839. https://doi.org/10.1242/jeb.203.4.831
Renault D., Lombard M., Vingère J., Laparie M., 2016. Comparative salinity tolerance in native flies from the subantarctic Kerguelen Islands: A metabolomic approach // Polar Biol. V. 39. P. 47–56. https://doi.org/10.1007/s00300-014-1605-8
Resgalla C., Jr., Brasil E.D., Salomão L.C., 2007. The effect of temperature and salinity on the physiological rates of the mussel Perna perna (Linnaeus, 1758) // Braz. Arch. Biol. Technol. V. 50. № 3. P. 543–556. https://doi.org/10.1590/S1516-89132007000300019
Rippingale R.J., Hodgkin E.P., 1977. Food availability and salinity tolerance in a brackish water copepod // Aust. J. Mar. Freshw. Res. V. 28. № 1. P. 1–7. https://doi.org/10.1071/MF9770001
Rivera-Ingraham G.A., Lignot J.H., 2017. Osmoregulation, bioenergetics and oxidative stress in coastal marine invertebrates: Raising the questions for future research // J. Exp. Biol. V. 220. № 10. P. 1749–1760. https://doi.org/10.1071/MF9770001
Rivera-Ingraham G.A., Nommick A., Blondeau-Bidet E., Ladurner P., Lignot J.H., 2016. Salinity stress from the perspective of the energy-redox axis: lessons from a marine intertidal flatworm // Redox Biol. V. 10. P. 53–64. https://doi.org/10.1016/j.redox.2016.09.012
Rokneddine A., 2004. The influence of salinity and temperature on the growth of Arctodiaptomus salinus (Daday, 1885) (Copepoda, Calanoida), from the temporary salt marsh, “La Sebkha Zima”, Morocco // Crustaceana. V. 77. № 9. P. 1025–1044. https://doi.org/10.1163/1568540042900259
Rosewarne P.J., Wilson J.M., Svendsen J.C., 2016. Measuring maximum and standard metabolic rates using intermittent-flow respirometry: A student laboratory investigation of aerobic metabolic scope and environmental hypoxia in aquatic breathers // J. Fish Biol. V. 88. № 1. P. 265–283. https://doi.org/10.1111/jfb.12795
Röthig T., Ochsenkühn M.A., Roik A., Merwe R., van der, Voolstra C.R., 2016. Long-term salinity tolerance is accompanied by major restructuring of the coral bacterial microbiome // Mol. Ecol. V. 25. № 6. P. 1308–1323. https://doi.org/10.1111/mec.13567
Sacco M., White N.E., Harrod C., Salazar G., Aguilar P., et al., 2021. Salt to conserve: a review on the ecology and preservation of hypersaline ecosystems // Biol. Rev. V. 96. № 6. P. 2828–2850. https://doi.org/10.1111/brv.12780
Seuront L., Hwang J.S., Tseng L.C., Schmitt F.G., Souissi S., Wong C.K., 2004. Individual variability in the swimming behavior of the sub-tropical copepod Oncaea venusta (Copepoda: Poecilostomatoida) // Mar. Ecol. Progr. Ser. V. 283. P. 199–217. https://doi.org/10.3354/meps283199
Shadrin N.V., Anufriieva E.V., 2013. Dependence of Arctodiaptomus salinus (Calanoida, Copepoda) halotolerance on exoosmolytes: New data and a hypothesis // J. Mediterr. Ecol. V. 12. P. 21–26.
Shadrin N., Yakovenko V., Anufriieva E., 2020. Behavior of Gammarus aequicauda (Crustacea, Amphipoda) during predation on Artemia (Crustacea, Anostraca): New experimental results // Int. Rev. Hydrobiol. V. 105. № 5–6. P. 143–150. https://doi.org/10.1002/iroh.202002059
Shadrin N.V., Anufriieva E.V., Belyakov V.P., Bazhora A.I., 2017. Chironomidae larvae in hypersaline waters of the Crimea: Diversity, distribution, abundance and production // Eur. Zool. J. V. 84. № 1. P. 61–72. https://doi.org/10.1080/11250003.2016.1273974
Shadrin N.V., Belyakov V.P., Bazhora A.I., Anufriieva E.V., 2019a. The role of salinity as an environmental filtering factor in the determination of the Diptera taxonomic composition in the Crimean waters // Knowl. Manag. Aquat. Ecosyst. № 420. Art. 3. https://doi.org/10.1051/kmae/2020024
Shadrin N.V., Belyakov V.P., Bazhora A.I., Anufriieva E.V., 2019b. Does salinity affect body proportions and “size/mass” ratios of highly halotolerant Baeotendipes noctivagus larvae (Diptera, Chironomidae)? // Oceanol. Hydrobiol. Stud. V. 48. № 4. P. 305–315. https://doi.org/10.2478/ohs-2019-0028
Shadrin N., Kolesnikova E., Revkova T., Latushkin A., Chepyzhenko A. et al., 2019c. Macrostructure of benthos along a salinity gradient: The case of Sivash Bay (the Sea of Azov), the largest hypersaline lagoon worldwide // J. Sea Res. V. 154. Art. 101811. https://doi.org/10.1016/j.seares.2019.101811
Shock B.C., Foran C.M., Stueckle T.A., 2009. Effects of salinity stress on survival, metabolism, limb regeneration, and ecdysis in Uca pugnax // J. Crustacean Biol. V. 29. № 3. P. 293–301. https://doi.org/10.1651/08-2990.1
Siebers D., Bulnheim H.P., 1977. Salinity dependence, uptake kinetics and specificity of amino acid absorption across the body surphase of the oligochaete annelid Enchytraeus albidus // Helgoländer Wiss. Meeresunters. V. 29. № 4. P. 473–492. https://doi.org/10.1007/BF01609985
Sims D.W., Southall E.J., Humphries N.E., 2008. Scaling laws of marine predator search behavior // Nature. V. 451. P. 1098–1102. https://doi.org/10.1038/nature06518
Skadhauge E., Lotan R., 1974. Drinking rate and oxygen consumption in the euryhaline teleost Aphanius dispar in waters of high salinity // J. Exp. Biol. V. 60. № 2. P. 547–556.
Smith E.B., Scott K.M., Nix E.R., Korte C., Fisher C.R., 2000. Growth and condition of seep mussels (Bathymodiolus childressi) at a Gulf of Mexico brine pool // Ecology. V. 81. № 9. P. 2392–2403. https://doi.org/10.2307/177462
Stephens G.C., 1964. Uptake of organic material by aquatic invertebrates. III. Uptake of glycine by brackish water annelids // Biol. Bull. V. 126. № 1. P. 150–162. https://doi.org/10.2307/1539425
Stephens G.C., 1968. Dissolved organic matter as a potential source of nutrition for marine organisms // Am. Zool. V. 8. № 1. P. 95–106. https://doi.org/10.1093/icb/8.1.95
Stephens G.C., Virkar R.A., 1966. Uptake of organic material by aquatic invertebrates. IV. The influence of salinity on the uptake of amino acids by the brittle star, Ophiactis arenosa // Biol. Bull. V. 131. № 1. P. 172–185. https://doi.org/10.2307/1539657
Svetlichny L., Hubareva E., Isinibilir M., 2017. Comparative trends in respiration rates, sinking and swimming speeds of copepods Pseudocalanus elongatus and Acartia clausi with comments on the cost of brooding strategy // J. Exp. Mar. Biol. Ecol. V. 488. P. 24–31. https://doi.org/10.1016/j.jembe.2016.12.005
Svetlichny L., Hubareva E., Isinibilir M., Kideys A., Belmonte G., Giangrande E., 2010. Salinity tolerance of Calanus euxinus in the Black and Marmara Seas // Mar. Ecol. Progr. Ser. V. 404. P. 127–138. https://doi.org/10.3354/meps08475
Swanson C., 1998. Interactive effects of salinity on metabolic rate, activity, growth and osmoregulation in the euryhaline milkfish (Chanos chanos) // J. Exp. Biol. V. 201. № 24. P. 3355–3366.
Torres J.J., Childress J.J., 1983. Relationship of oxygen consumption to swimming speed in Euphausia pacifica // Mar. Biol. V. 74. № 1. P. 79–86. https://doi.org/10.1007/BF00393008
Uliano E., Cataldi M., Carella F., Migliaccio O., Iaccarino D., Agnisola C., 2010. Effects of acute changes in salinity and temperature on routine metabolism and nitrogen excretion in gambusia (Gambusia affinis) and zebrafish (Danio rerio) // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 157. № 3. P. 283–290. https://doi.org/10.1016/j.cbpa.2010.07.019
Van Harten D., 1996. Cyprideis torosa (Ostracoda) revisited. Of salinity, nodes and shell size // Proc. 2nd European Ostracodologists Meeting. L.: British Micropalaeontological Society. P. 191–194.
Verslycke T., Janssen C.R., 2002. Effects of a changing abiotic environment on the energy metabolism in the estuarine mysid shrimp Neomysis integer (Crustacea: Mysidacea) // J. Exp. Mar. Biol. Ecol. V. 279. № 1–2. P. 61–72. https://doi.org/10.1016/S0022-0981(02)00339-8
Vieira A.G.F., Jr., Lima D.E.P.C., Sales N.D.S., Terra B.F., Pessanha A., 2020. Trade-offs between ontogenetic changes and food consumption in Brazilian silverside Atherinella brasiliensis from two tropical estuaries // J. Fish Biol. V. 98. № 1. P. 196–207. https://doi.org/10.1111/jfb.14570
Villarreal H., Hinojosa P., Naranjo J., 1994. Effect of temperature and salinity on the oxygen consumption of laboratory produced Penaeus vannamei postlarvae // Comp. Biochem. Physiol. A. Physiol. V. 108. № 2–3. P. 331–336. https://doi.org/10.1016/0300-9629(94)90103-1
Vooys C.G.N., de, Geenevasen J.A.J., 2002. Biosynthesis and role in osmoregulation of glycine-betaine in the Mediterranean mussel Mytilus galloprovincialis LMK // Comp. Biochem. Physiol. B. Biochem. Mol. Biol. V. 132. № 2. P. 409–414. https://doi.org/10.1016/S1096-4959(02)00052-0
Weaver P.F., Tello O., Krieger J., Marmolejo A., Weaver K.F., et al., 2016. Hypersalinity drives physiological and morphological changes in Limia perugiae (Poeciliidae) // Biol. Open. V. 5. № 8. P. 1093–1101. https://doi.org/10.1242/bio.017277
Williams W.D., 1998. Salinity as a determinant of the structure of biological communities in salt lakes // Hydrobiologia. V. 381. № 1–3. P. 191–201. https://doi.org/10.1023/A:1003287826503
Williamson C.E., 1981. Foraging behavior of a freshwater copepod: Frequencychanges in looping behavior at high and low prey densities // Oecologia. V. 50. P. 330–336. https://doi.org/10.1007/BF00344972
Yancey P.H., 2001. Water stress, osmolytes and proteins // Am. Zool. V. 41. № 4. P. 699–709. https://doi.org/10.1093/icb/41.4.699
Yancey P.H., Heppenstall M., Ly S., Andrell R.M., Gates R.D., et al., 2010. Betaines and dimethylsulfoniopropionate as major osmolytes in cnidaria with endosymbiotic dinoflagellates // Physiol. Biochem. Zool. V. 83. № 1. P. 167–173. https://doi.org/10.1086/644625
Yoder J.A., Benoit J.B., Denlinger D.L., Rivers D.B., 2006. Stressinduced accumulation of glycerol in the flesh fly, Sarcophaga bullata: Evidence indicating anti-desiccant and cryoprotectant functions of this polyol and a role for the brain in coordinating the response // J. Insect Physiol. V. 52. № 2. P. 202–214. https://doi.org/10.1016/j.jinsphys.2005.10.005
Zhang P., Zhang X., Li J., Huang G., 2007. The effects of temperature and salinity on the swimming ability of whiteleg shrimp, Litopenaeus vannamei // Comp. Biochem. Physiol. A. Mol. Integr. Physiol. V. 147. № 1. P. 64–69. https://doi.org/10.1016/j.cbpa.2006.11.020
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


