Журнал общей биологии, 2022, T. 83, № 3, стр. 183-201
Муравьи мелового бирманского янтаря: морфологические особенности и структура сообщества
К. С. Перфильева *
Московский государственный университет им. М.В. Ломоносова, биологический факультет
119234 Москва, Ленинские горы, 1, стр. 12, Россия
* E-mail: ksenperf@mail.ru
Поступила в редакцию 01.02.2022
После доработки 02.04.2022
Принята к публикации 04.04.2022
- EDN: JCTMIB
- DOI: 10.31857/S0044459622030058
Аннотация
В статье рассматривается феномен морфологического разнообразия муравьев из мелового бирманского янтаря. Выдвигается этолого-экологическая гипотеза его возникновения и особенностей мирмекокомплексов мезозоя и кайнозоя. Представляется, что некоторые морфологические черты представителей стволовых таксонов позволяют говорить об отсутствии у этих муравьев эффективной коммуникации и, как следствие, координированных действий и коллективной охоты. Таким образом, разнообразие примитивных меловых муравьев, как хищников, отражает пищевую специализацию по типам жертв, при условии семейного образа жизни, что влечет деление экологического пространства на субниши между видами муравьев. Появление ключевой адаптации – эффективной коммуникации и коллективной охоты (мобилизации) – у кроновых групп муравьев позволило им выйти за границы ниш специализированных хищников, поскольку при развитой коммуникации тип и размер жертвы не строго связан с размерами муравья и его челюстей, а также дало возможность обслуживать большие по численности семьи. Благодаря этому мирмекокомплексы современных муравьев устроены не столько по принципу разделения экологических ниш, как мезозойские, сколько по принципу семейного доминирования.
Бирманский янтарь (бирмит, Kachin amber), возрастом около 99 млн лет, богат удивительными по сохранности и таксономическому разнообразию ископаемыми организмами, что дает представление не только о таксономическом разнообразии ориктоценоза, но редкую возможность исследовать структуру вымерших биоценозов. На данный момент описано 651 семейство, 1382 рода, 2038 видов животных, из которых 583 семейства, 1264 рода и 1908 видов членистоногих (Ross, 2021). Муравьи, согласно принятой на данный момент систематике, представлены в бирмите одним семейством Formicidae, 31 видом трех вымерших подсемейств (Haidomyrmecinae, Zigrasimeciinae, Sphecomyrminae) и, судя по некоторым неопубликованным данным, не менее чем тремя кроновыми подсемействами (Ponerinae, Dolichoderinae, Formicinae) (хотя данные по кроновым подсемействам, возможно, справедливы только для более позднего бирманского янтаря – Tilin amber, 72 млн лет) (Zhang et al., 2018; Zheng et al., 2018; Boudinot et al., 2020) (табл. 1). Недавно также были обнаружены два рода (Camelomecia, Camelosphecia), отнесенные к надсемейству Formicoidea в качестве сестринской группы к Formicidae, описанные по крылатым половым особям (две самки и самец трех видов) (Barden, Grimaldi, 2016; Boudinot et al., 2020). Вызывает сомнение отнесение насекомых без метаплевральных желез, как у Camelomecia и Camelosphecia, к формикоидам, а также из-за не формикоидного жилкования крыльев Camelomecia. Однако решение этих вопросов выходит за рамки настоящего исследования. Таксономическое и морфологическое разнообразие (в частности, уникальное строение и разнообразие челюстного аппарата) муравьев-формикоидов в бирмите на данный момент не имеет удовлетворительного объяснения, несмотря на то, что вопросы о том, как и зачем такое морфологическое разнообразие возникло, ставятся почти в каждой публикации с описанием новых видов муравьев из бирманского янтаря, ведь современные муравьи, несмотря на таксономическое богатство (почти 14 000 рецентных видов, 17 подсемейств), не имеют аналогов таких челюстей. Строение мандибул всех современных муравьев имеет общие черты и, хотя есть специализированные формы, модификации мандибул довольно хорошо изучены и выстраиваются в морфологические ряды с общим корнем (Длусский, Федосеева, 1988). Целью настоящего исследования явился анализ представителей мирмекофауны бирманского янтаря, причин специфической морфологической радиации стволовых таксонов и их вымирания.
Таблица 1.
Таксономический состав и некоторые морфологические характеристики муравьев бирмита
| Таксон | Антеннальный индекс* (ИК) | Размеры особей самка/самец/рабочий, мм |
|---|---|---|
| Haidomyrmecinae | ||
| Aquilomyrmex huangi Perrichot et al., 2020 | 0.45 | 9/–/– |
| Chonidris insolita Perrichot et al., 2020 | 0.12 | 10/–/– |
| Dhagnathos autokrator Perrichot et al., 2020 | 0.1 | 14/–/– |
| Dilobops bidentate Lattke, Melo, 2020 | 0.12 | –/–/4.1 |
| Ceratomyrmex ellenbergeri Perrichot et al., 2016 | 0.22 | –/–/5.5 |
| Ceratomyrmex planus Lattke, Melo, 2020 | 0.25 | –/–/3.5 |
| Linguamyrmex brevicornis Perrichot et al., 2020 | 0.27 | 7/–/4 |
| Linguamyrmex rhinocerus Miao, Wang, 2019 | 0.27 | –/–/6.6 |
| Linguamyrmex vladi Barden, Grimaldi, 2017 | Неполные антенны | –/–/~5.6 |
| Protoceratomyrmex revelatus Perrichot et al., 2020 | 0.24 | –/–/4.3 |
| Haidomyrmex cerberus Dlussky, 1996 | 0.21 | –/–/5 |
| Haidomyrmex davidbowiei Lattke, Melo, 2020 | 0.25 | –/–/4.4 |
| Haidomyrmex scimitarus Barden, Grimaldi, 2012 | 0.16 | 8/–/– |
| Haidomyrmex zigrasi Barden, Grimaldi, 2012 | 0.21 | –/–/3.5 |
| Zigrasimeciinae | ||
| Protozigrasimecia chauli Cao et al., 2020 | 0.13 | –/–/11.75 |
| Zigrasimecia ferox Perrichot et al., 2014 | 0.16, 0.17 | 2.8/–/2 |
| Zigrasimecia hoelldobleri Cao et al., 2020 | 0.11, 0.21 | –/–/2.6 |
| Zigrasimecia tonsora Barden, Grimaldi, 2013 | 0.15 | 2.3/–/– |
| Zigrasimecia goldingot Zhuang et al., 2021 | 0.23 | 2.4/–/– |
| Sphecomyrminae | ||
| Gerontoformica gracilis Barden, Grimaldi, 2014 | 0.15 | –/–/6.6 |
| Gerontoformica orientalis Engel, Grimaldi, 2005 | 0.1 | –/–/~5.2 |
| Gerontoformica robusta Barden, Grimaldi, 2014 | 0.11 | –/–/~5.7 |
| Gerontoformica spiralis Barden, Grimaldi, 2014 | 0.15 | –/–/5 |
| Gerontoformica subcuspis Barden, Grimaldi, 2014 | 0.19 | –/–/5.7 |
| Gerontoformica contega Barden, Grimaldi, 2014 | 0.1 | –/–/5.2 |
| Gerontoformica magna Barden, Grimaldi, 2014 | 0.11 | –/–/8.6 |
| Gerontoformica pilosa Barden, Grimaldi, 2014 | 0.13 | –/–/4.3 |
| Gerontoformica rugosa Barden, Grimaldi, 2014 | 0.18 | –/–/4.97 |
| Gerontoformica tendir Barden, Grimaldi, 2014 | ~0.13 | –/–/6.93 |
| Myanmyrma gracilis Engel, Grimaldi, 2005 | 0.09 | –/–/9.5 |
| Myanmyrma maraudera Barden, Grimaldi, 2014 | 0.11 | –/–/8.67 |
МАТЕРИАЛЫ И МЕТОДЫ
В работе проводится анализ опубликованных материалов по исследованиям меловых и современных муравьев. Изображения для прорисовки взяты с ресурса AntWeb (https://www.antweb.org/) с указанием номеров экземпляров, а также из собственного архива. Прорисовки и измерения морфологических структур выполнялись в программе Inkscape, распространяющейся по свободной лицензии. Графики построены в программе Excel2013. Измерения структур и получение недостающей информации проводились по опубликованным снимкам, а также взяты из работ разных авторов по первоначальным описаниям соответствующих меловых муравьев (табл. 1). Для измерения современных муравьев взята выборка, использованная в статье по сравнению морфопространств стволовых и современных муравьев, а также некоторые недостающие измерения меловых муравьев (Barden et al., 2020).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Разнообразие меловых муравьев
Меловой период характеризуется существенными изменениями энтомофауны, связанными со сменой доминирующих групп растений в фитоценозах, а следом и структуры биоценозов. Доля современных семейств в энтомофаунах вырастает с начала мела с половины до трех четвертей, что говорит о формировании в этот период современного облика энтомофауны на уровне семейств (Жерихин, 2003). В меловом периоде наблюдается рост разнообразия насекомых-филлофагов, паразитоидов и других перепончатокрылых. Потрясающее разнообразие членистоногих среднего мела демонстрирует бирманский янтарь (Ross, 2021). Расчеты биоразнообразия членистоногих в бирмите на уровне семейств показывают высокие значения появления новых семейств и “оборота фауны” (сумма впервые встреченных семейств и в последний раз отнесенная к общему числу семейств в данном местонахождении) в этом янтаре (Расницын, 2016). Подобные факты говорят о разнообразной и богатой ресурсной базе для наземных хищных насекомых, существовавшей в этот период.
На сегодняшний день можно говорить, что меловые муравьи представлены не только перечисленными выше вымершими подсемействами, но и несколькими кроновыми подсемействами. Описаны также экземпляры муравьев вымерших родов, пока не отнесенных к какому-либо подсемейству, хотя это скорее результат технического характера – эти представители еще не были изучены авторами последних филогенетических схем на наличие выделенных ими признаков (экземпляры из Таймырского янтаря, Armaniinae). Среди кроновых меловых групп уже описаны по одному виду Dolichoderinae (McKellar et al., 2013), Formicinae (Grimaldi, Agosti, 2000), Aneuretinae (Engel, Grimaldi, 2005), Myrmicinae (Dlussky et al., 2004) и два вида Ponerinae (Dlussky, 1999). В меловой фауне также обнаружены переходные (промежуточные) формы – Armaniinae (в действующей системе входят в состав Formicidae) и недавно описанные крылатые представители сестринской к Formicidae клады, включающей два рода Camelomecia и Camelosphecia. Таким образом, мирмекофауна мелового периода уже имела в своем составе представителей основных кроновых подсемейств, однако основное таксономическое и морфологическое разнообразие демонстрировали вымершие подсемейства, в которых на данный момент описано чуть более 50 видов. На этом основании можно ожидать, что меловой период был временем “формикоидизации”, по аналогии с эволюционными феноменами “артроподизацией”, “орнитизацией” и т.д., т.е. периодом возникновения отдельных признаков современных муравьев в необычных сочетаниях в разных филогенетических ветвях, весь комплекс которых сложился у кроновых таксонов муравьев, считающихся монофилетической группой.
Доля муравьев в ориктоценозах росла на протяжении всего периода существования семейства с конца нижнего мела до настоящего времени, однако в мелу составляла, как правило, первые доли процента и число экземпляров обычно единицы (LaPolla et al., 2013). По нашим предварительным подсчетам в бирманском янтаре муравьи составляют 2.6% видов от всех членистоногих (Ross, 2021). Согласно исследованиям перепончатокрылых в бирманском янтаре, муравьи составляют около 9.1% экземпляров от всех перепончатокрылых (Zhang et al., 2018). С точки зрения оценки богатства ресурсной базы биоценоза важно, что большую или сравнимую долю экземпляров среди перепончатокрылых имеют паразитоиды (Scelionidae – 16.1%, Chrysididae – 11.5%, Bethylidae – 7%). Таким образом, доля муравьев в таксономическом разнообразии бирмита, как и количество особей, были довольно заметны на фоне общего разнообразия членистоногих, хотя и не сравнимы с современным состоянием этой группы насекомых (например, доля экземпляров муравьев в доминиканском янтаре составляет около 36%, а биомасса муравьев в современном тропическом лесу составляет 15–20% от всех животных) (Hölldobler, Wilson, 1990; LaPolla et al., 2013).
Явным свидетельством существенной экологической роли муравьев в палеобиоценозах бирмита является находка Aethiocarenus burmanicus Poinar, Brown, 2017, которая демонстрирует мирмекоморфию, распространенную среди современных безобидных членистоногих в целях самозащиты (случай Бейтсовской мимикрии) (Vršanský et al., 2018). Из бирманского янтаря Качина пока достоверно не описано ни одного представителя кроновых групп муравьев, хотя их обнаружили в более позднем бирманском янтаре Тилина (Zheng et al., 2018).
Гипотезы происхождения современных муравьев
Наиболее известная и широко принятая гипотеза условий возникновения современных муравьев была предложена Уилсоном и Холлдоблером (Wilson, Hölldobler, 2005) и известна под названием “гипотеза династической преемственности” (Dynastic-Succession Hypothesis). Согласно ей, основной родоначальной группой современных муравьев являются формы, приспособленные к хищному образу жизни в подстилке, а именно понерины11, которые, появившись в середине мела, в палеогене распространились по миру и дали начало современным подсемействам, после чего произошел переход к экологическому доминированию муравьев вместе со сменой диеты в связи с экспансией покрытосеменных в тропических регионах. Причин такого вывода две: подстилка – местообитание с очень высокой биомассой, где можно прокормиться хищникам членистоногих, каковыми были меловые муравьи и сейчас являются современные примитивные таксоны (особенно понероморфы). Вторая причина, названная авторами “парадоксом понерин”, состоит в противоречии (как считали авторы) между фактом широкого географического распространения понериновых таксонов при слабой социальной организации их семей, отличительные особенности которой – моногинные семьи с низкой численностью, отсутствие развитых форм полиморфизма и полиэтизма, одиночная охота, примитивная коммуникация – сигнал тревоги, а также практически отсутствует трофаллаксис, мобилизация (вербовка) рабочих к источнику пищи и охрана территории. Таким образом, происхождение муравьев от приспособленных к охоте в подстилке примитивных “понерин” после радиации этой группы в конце мела и палеоцене могло бы объяснить широкое географическое распространение примитивной группы понероморф и удерживание позиций в конкуренции с распространяющимися (появившимися?) позже более прогрессивными мирмицинами, долиходеринами и формицинами, которые появились благодаря изменению диеты, сопутствующему распространению выделяющих падь насекомых, и не смогли полностью вытеснить понероморф, хорошо приспособленных и поделивших экологические ниши в своем местообитании.
С позицией происхождения современных муравьев от специализированных хищников подстилки был не согласен Г.М. Длусский (Длусский, Расницын, 2007). Он указывал на то, что найденные к тому моменту меловые муравьи – сфекомирмины – имели габитус наземного хищника, с успехом фуражирующего на поверхности подстилки и в древесном ярусе, т.е. не похожи на обитателей подстилки, и предположил, что современные крупные филогенетические ветви возникли как жизненные формы, приспособленные к охоте в разных ярусах биоценоза: в почве (понероморфы), на поверхности почвы и древесном ярусе (формицины, долиходерины и мирмицины), в подстилке (анеуретины) (Длусский, Федосеева, 1988).
Сейчас очевидно, что предположение Уилсона о более раннем происхождении таксонов понероморф не подтверждается палеонтологией. Никакого преобладания представителей понероморф среди меловых муравьев также нет, при этом представители “прогрессивных и более молодых” (в рамках гипотезы Уилсона и Холлдоблера) подсемейств есть в меловых ориктоценозах и имеют хорошо выраженные признаки принадлежности к кроновым подсемействам – Formicinae, Dolichoderinae, Myrmicinae, Aneuretinae. Понятно, что результат отсутствия форм, обитающих в подстилке, в палеонтологической летописи вполне закономерен и не может быть основным аргументом. Однако представляется довольно спорным утверждение, что приспособления к хищничеству в подстилке способствовали появлению муравьев кроновых подсемейств. Как видно по современным таксонам, морфология муравьев, обитающих и охотящихся в подстилке, изменяется в сторону уменьшения длины антенн, уменьшения относительного размера глаз, утолщения покровов, специализации мандибул. Это не похоже на признаки, которые достались всем кроновым группам муравьев. При этом я не отрицаю связь с подстилкой предковых таксонов муравьев, только обращаю внимание на отсутствие у них морфологической специализации к жизни в подстилке. Представляется несколько иная картина, чем та, что описана в гипотезе династической преемственности. Предки современных кроновых групп должны были получить морфологические черты, которые почему-то остались закрепленными у всех (практически без исключений) современных кроновых групп: трехзубые (и более) мандибулы, коленчатые антенны с длинным скапусом, строение антенны (относительно длинный изогнутый педицель, увеличенные вершинные членики), наличие простых глазков и сложных глаз. У современных муравьев, у которых один или несколько из этих признаков изменены, это результат специализации и модификации (Длусский, Федосеева, 1988). Гипотеза происхождения муравьев должна объяснить их наличие. Представляется, что в подстилке и в примитивных семьях, таких как у некоторых понероморф, этот комплекс признаков не нужен, а следовательно, не мог сформироваться.
Морфологические особенности муравьев и связь с социальностью
Признавая гипотезу преемственности Уилсона и Холлдоблера рабочей, некоторые авторы парадоксальным образом противоречат ей. Так, Будино и Перришо с соавторами, одни из самых профессиональных исследователей меловых формикоидов, авторы многих статей с анализом их экологии и морфологии, принимая гипотезу преемственности, при этом совершенно справедливо полагают, что муравьи в рамках Formicoidea формировались как активные наземные хищники (Boudinot et al., 2020). Поэтому меловые формикоиды имеют определенный комплекс морфологических признаков, в том числе прогнатность головы (этот признак рассмотрен в работе Е.Б. Федосеевой (2001)), латеральный поворот усиков (однако эта модальность наблюдается далеко не у всех муравьев бирмита – рис. 1а, г, з), удлинение коксов передних ног и другие. Авторы ориентировались на кладистический анализ (т.е. выделяли синапоморфии для всей группы), видимо, поэтому не включили морфологические признаки, имеющиеся и у других Aculeata, но также характеризующие комплекс признаков быстрых наземных хищников, например, крупные сложные глаза и простые глазки, длинные антенны и ноги. Действительно, на настоящий момент описан 31 вид муравьев из более древнего бирманского янтаря (Качинский янтарь) (табл. 1). В анализ не включены три вида Camelomecia и Camelosphecia, из-за отсутствия метаплевральных желез, неформикоидного жилкования крыла у Camelomecia, из-за отсутствия свидетельств наличия бескрылой касты, а следовательно, сомнения в необходимости включать их в Formicoidea.
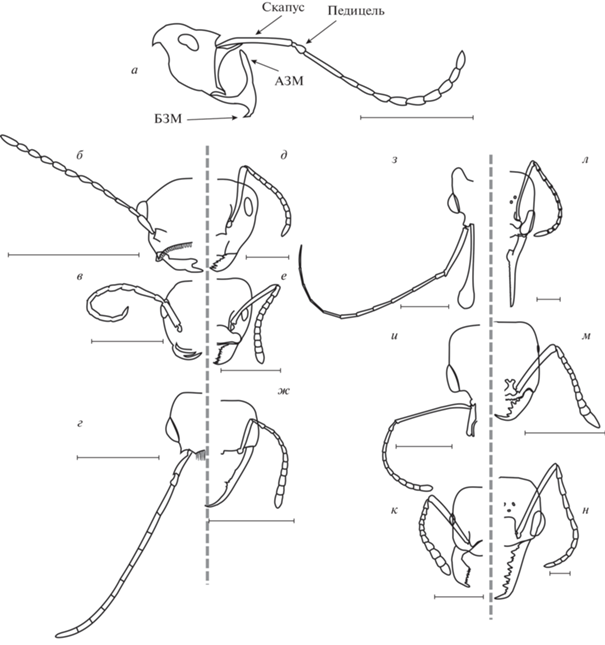
Рис. 1.
Прорисовки с фотоизображений головы с дорсальной стороны (б–н) и профиль (а) меловых (б–г, з, и) и современных (д–ж, к–н) муравьев. Отражено строение антенн, мандибул, клипеуса, форма и размеры глаз и глазков (в скобках указаны номера экземпляров в базе AntWeb): а – Linguamyrmex brevicornis (FANTWEB00035); б – Zigrasimecia tonsora (ANTWEB1008098); в – Gerontoformica orientalis (JWJ-BU19); г – Dilobops bidentata (FANTWEB00039); д – Camponotus abrahami (CASENT0910439); е – Azteca adrepens (CASENT0173823); ж – Martialis heureka (CASENT0106181); з – Ceratomyrmex ellenbergeri (NIGP164022); и – Aquilomyrmex huangi (FANTWEB00024); к – Manica bradleyi (CASENT0106022); л – Harpegnathos saltator (CASENT0101783); м – Onychomyrmex sp. (CASENT0069959); н – Myrmecia sp. (CASENT0006136). АЗМ, БЗМ – апикальный и базальный зубец мандибул. Масштабная линейка: 1 мм.
На данный момент все исследователи мирмекофауны бирмита едины в оценке экологической роли описанных муравьев. Разнообразие размеров муравьев и их челюстей говорят о специализированном хищничестве. Социальность меловых формикоидов дискутируется с момента первых описаний (Wilson et al., 1967; Длусский, 1983, 1987; Wilson, 1985). Барден и Грималди в своем исследовании (Barden, Grimaldi, 2016) резюмировали морфологические доказательства эусоциальности меловых формикоидов (наличие по крайней мере у некоторых из них бескрылой и крылатой каст, при этом имеются репродуктивные самки со следами отброшенных крыльев), а также предположили, что косвенным свидетельством семейственности и наличия группового поведения является наличие сининклюзов довольно редких в меловых ориктоценозах муравьев в одном куске смолы. Упомянутые морфологические характеристики без сомнения указывают на социальность меловых формикоидов, однако предположение о групповом поведении не представляется обоснованным. В статье обсуждаются четыре куска бирмита: JZC Bu1814 – шесть особей Gerontoformica spiralis; JZC Bu116 – 11 особей G. spiralis и один рабочий Haidomyrmex zigrasi; JZC Bu1645 – 21 экземпляр G. orientalis, G. contegus, G. robustus; JZC Bu1646 – схватка двух рабочих муравьев G. tendir и G. spiralis. Совместное нахождение нескольких особей редких (по мнению авторов, но в свете представленных выше фактов это не так) для биоценозов муравьев одного вида, а также схватка двух муравьев трактуется исследователями как координация действий при добывании пищи и агрессивные взаимодействия между видами, однако авторы приходят к выводу, что феромонный след, по-видимому, не использовался. Следует отметить, что авторы считают, что кроновые группы экологически вытеснили стволовые, но механизмов вытеснения не описывают, за исключением замечания, что муравьи со специализированными ротовыми аппаратами (Zigrasimecinae, Haidomyrmecinae), очевидно, зависели от источников пищи. Отмечу дополнительно некоторые моменты, которые важны в контексте обсуждения социальности. Первое – это наличие в рассматриваемых небольших кусках янтаря многих (десятков) других животных, среди них улитка, таракан, оса (Scolebythidae), жуки, паук, коллемболы и другие членистоногие, что делает вторую версию авторов – скопление на источнике пищи – наиболее убедительной. При семейном образе жизни скопление муравьев из близлежащих гнезд двух–трех видов не представляется астрономически невероятным событием даже в отсутствие мобилизации. Вторая особенность – нахождение в одном куске рабочих муравьев разных видов без признаков агрессии – также подкрепляет эту версию и исключает агрессивные взаимодействия. Интересная особенность касается любопытного образца Bu1814, в котором у всех особей отсутствуют вершины метасом (брюшки пустые), т.е. в этот кусок смолы, возможно, попали уже трупы муравьев. В таком случае этот образец больше всех свидетельствует в пользу социальности, и, возможно, что это результат ухода за гнездом. По-видимому, некоторым видам стволовых таксонов муравьев мог быть свойственен также начальный этап полиморфизма – размерные различия рабочих особей (Cao et al., 2020a).
Таким образом, наличие эусоциальности кажется полностью доказанным, однако охрана источника пищи (как и мобилизация к источнику пищи) не является регулярным атрибутом сосуществования в описываемых муравьиных сообществах и, по-видимому, ведется на уровне отдельных особей. Действительно, сининклюзы дерущихся и сильно пострадавших в схватке двух муравьев демонстрируют, что схватка длилась довольно продолжительное время, но тем не менее муравьи остались один на один, в то время как современные муравьи, как правило, имеют подмогу, что запечатлено и в янтарях эоцена (напр., Radchenko, Perkovsky, 2021).
Имеющиеся данные по современным муравьям позволили выделить несколько морфологических признаков и тенденций, характеризующих кроновые группы муравьев, представляющих большую часть современных видов и доминирующих во всех биоценозах (Myrmicinae, Dolichoderinae, Formicinae):
1. Латеральный поворот антенн и коленчатые антенны с длинным скапусом (ИК > 3) (синапоморфия – имеются у всех кроновых групп муравьев, в то время как у стволовых групп муравьев строение антенн не единообразно, часто антенны нитчатые, очень длинные, скапус может быть очень коротким, ИК от 0.1 до 0.25 (см. табл. 1, рис. 1)).
2. Строение антенн – относительно длинный изогнутый педицель и увеличение размеров вершинных члеников жгутика (синапоморфия?) (см. рис. 1).
3. Мандибулы относительно небольшие, имеющие не менее трех зубцов (синапоморфия?) (см. рис. 1).
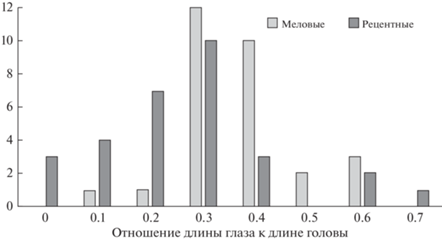
4. Уменьшенные размеры сложных глаз, при этом наличие простых глазков (тенденция) (рис. 2).
5. Трофаллаксис (тенденция в доминирующих подсемействах).
6. При уходе за расплодом облизывают и переносят личинок и куколок (синапоморфия?).
7. Замена ядовитого жала кислой железой (тенденция в доминирующих подсемействах).
Хотя социальность среди муравьев имеет довольно узкий спектр вариаций, в отличие от других высших перепончатокрылых, где можно проследить все стадии формирования эусоциальности от одиночной до гигантских по численности семей пчел, все же черты примитивного социального устройства наблюдаются у довольно большого числа таксонов муравьев. Так, например, число видов (примитивных) понероморф в лесных экосистемах составляет 22.2% (хотя число особей всего 12.4%) (Ward, 2000). Наиболее примитивные муравьи отличаются следующими чертами (у прогрессивных таксонов модальности этих признаков будут иные): наличие минимум двух каст самок, причем довольно часто рабочие у таких видов могут переходить в статус репродуктивных самок, не строят сложное гнездо, добывают пищу одиночным хищничеством, отсутствует мобилизация, не охраняют территорию кормодобывания, нет трофаллаксиса, но распознают общий сигнал тревоги, осуществляют уход за расплодом, переносят личинок и куколок, контактируют друг с другом при встрече, осуществляют груминг. И, как правило, эти виды действительно связаны с подстилкой, что в совокупности, как кажется, подтверждает гипотезу преемственности. Однако все это не объясняет наличия общих морфологических черт муравьев и тенденций, перечисленных выше.
Предлагаемая здесь концепция сводится к идее возникновения кроновых муравьев как быстрых эффективных наземных бескрылых хищников с более развитой по отношению к стволовым таксонам социальной коммуникацией. Г.М. Длусский высказывал предположение, что коленчатость антенн связана с эусоциальностью благодаря возможности манипулирования мелкими предметами, с чем трудно не согласиться (Длусский, 1983; Длусский, Федосеева, 1988). Г.М. Длусским и Е.Б. Федосеевой было показано, что социальные осы и пчелы, ухаживающие за расплодом, имеют относительно удлиненный скапус (ИК ~ 0.3), а позже эти выводы были подкреплены статистически (Borysenko, 2017). Однако в рамках этой концепции сложно объяснить, почему у муравьев длина скапуса продолжила увеличиваться (ИК ≥ 0.3, а у наиболее продвинутых доминирующих подсемейств Formicinae, Myrmicinae, Dolichoderinae ИК ≥ 0.4) и для чего потребовался латеральный поворот антенн, если пчелы и осы весьма успешно справлялись с задачами манипуляции мелкими предметами, а с другой стороны, коленчатые антенны встречаются и у несоциальных наездников, например, Anastatus sp. (Eupelmidae), паразитирующих на яйцах насекомых. Кроме того, у термитов – эусоциальных насекомых не перепончатокрылых – нет тенденции к коленчатости антенн. Поэтому, видимо, необходимо еще какое-то объяснение коленчатости и латерального поворота антенн у кроновых таксонов муравьев. Полагаю, что дальнейшее увеличение относительной длины скапуса и поворот антенн потребовались для повышения эффективности ориентирования быстрому наземному хищнику без крыльев. Возможно, что одной из причин этого мог стать находящийся в педицеле Джонстонов орган, являющийся мультисенсорным организатором, частично отобравший функции ориентирования у зрительного органа. Джонстонов орган у муравьев осуществляет функции ветрового компаса, восприятия гравитации, шагового интегратора (оценка пройденного расстояния) (Grob et al., 2021). С инженерной точки зрения анализировать данные с таких рецепторов тем удобнее, чем дальше друг от друга они находятся. Компромисс между необходимостью разместить анализаторы как можно дальше друг от друга, но при этом полностью контролировать пространство непосредственно около ротового отверстия и мандибул привел к: 1) латеральному повороту антенн, 2) удлинению скапуса и 3) изменению формы педицеля – удлиненный изогнутый в основании членик позволяет жгутику максимально приблизиться к скапусу и, следовательно, к мандибулам и ротовому отверстию.
Третья особенность антенн муравьев в том, что вершинные членики жгутика увеличиваются в относительных размерах, так что вершинный членик самый большой (толщина, длина), а иногда последние членики жгутика могут формировать булаву (см. рис. 1). На мой взгляд, это строение объясняется теми же причинами – повышение эффективности пространственной ориентации, в данном случае за счет увеличения роли обонятельных анализаторов с меньшим по отношению к летающим перепончатокрылым вкладом зрения, уход за потомством, а в последствии и коммуникация посредством обоняния. Эти два вектора отбора (увеличение эффективности ориентирования и контроль за околоротовым пространством) приводят к увеличению числа и концентрации обонятельных рецепторов на вершинных члениках жгутика. Дело в том, что обонятельные рецепторы могут распределяться в жгутике перепончатокрылых практически равномерно по всей его длине (хотя это правило не строгое), однако у муравьев они сконцентрированы на вершинном и предвершинном члениках антенн, особенно явно эта тенденция выражена у мирмицин, у которых членики основания жгутика практически лишены обонятельных сенсилл (Hashimoto, 1990; Nakanishi, 2009; Euzébio et al., 2013; Trible et al., 2017). О решающем значении обонятельных рецепторов в филогенетической ветке муравьев в сравнении с другими насекомыми, в том числе перепончатокрылыми, говорят результаты исследований мозга и геномов муравьев (Guo, Kim, 2007; Gronenberg, 2008; Zhou et al., 2012). Количество генов, ответственных за запаховые рецепторы, у муравьев в несколько раз больше, иногда на порядок, чем у других насекомых. Было показано наличие 340–400 таких генов у исследованных видов муравьев с разной социальной организацией и из разных подсемейств (Dolichoderinae: Linepithema humile, Formicinae: Camponotus floridanus, Ponerinae: Harpegnathos saltator, Myrmicinae: Pogonomyrmex barbatus), при этом у фруктовой мушки Drosophila melanogaster таких генов всего 61, у медоносной пчелы Apis melifera около 170, у осы-паразитоида Nasonia vitripennis около 300. Также было показано, что гены запаховых рецепторов – быстро эволюционирующая и изменчивая группа генов у муравьев. Такие результаты, особенно в сравнении с другими эусоциальными перепончатокрылыми, по мнению специалистов, указывают на более сложную систему коммуникации у муравьев, основанную именно на химической рецепции. Эксперименты по отключению работы генов обонятельных рецепторов подтвердили, что у рабочих особей без обоняния резко снижена или потеряна способность ориентироваться по запаху, общаться с сородичами, следовать феромонному следу, ухаживать за личинками, хотя они могут самостоятельно питаться (Yan et al., 2017). Поэтому эволюция, направленная на оптимизацию органа, несущего обонятельные рецепторы, не вызывает вопросов. Интенсификация функций ориентации в пространстве в антеннах муравьев косвенно подтверждается и относительной редукцией, уменьшением размеров оптических анализаторов – сложных глаз, а также строением мозга современных муравьев, у которых зоны обработки обонятельных сигналов развиты в большей степени, чем визуальных (Gronenberg, Hölldobler, 1999; Gronenberg, 2008). Действительно, летающие ближайшие родственники муравьев имеют просто огромные глаза, многие муравьи стволовых таксонов из бирманского янтаря тоже имеют относительно большие глаза в сравнении с современными муравьями, при этом сохраняют не муравьиное строение антенн, а большие выпуклые смещенные кпереди глаза у современных муравьев связаны с жизненной формой одиночных хищников (Myrmoteras, Gigantiops, Myrmecia, Harpegnathos). Стоит отметить также, что простые глазки у рабочих особей имеются у некоторых представителей Dolichoderinae, Formicinae и практически отсутствуют у Myrmicinae и Ponerinae, тяготеющих к обитанию в подстилке, что говорит о тенденции к утере простых глаз у специализированных обитателей подстилки. В этой связи важно заметить, что для оставления феромонного следа муравьи разных филогенетических линий используют совершенно разные органы и вещества: секрет ядовитой железы, железы Дюфура, секреты мандибулярных желез, выделения задней кишки, секрет специальных желез на ногах, железы Павана и др. (Morgan, 2009). Такое разнообразие свидетельствует о независимом и многократном появлении поведения “следования” в кроновых линиях муравьев, в основе которого, согласно высказываемой здесь гипотезе, лежат механизмы совершенной ориентации и запаховой дифференциации. Таким образом, усовершенствование антенн для целей ориентации послужило толчком к интенсификации химической коммуникации, т.е. явилось морфологической преадаптацией для дальнейшего развития социальности.
Как было показано Г.М. Длусским и Е.Б. Федосеевой (1988) в исследовании кранио-мандибулярных систем (КМС) муравьев, наличие не менее трех зубцов, треугольная форма мандибул и хорошо развитые мандибулярные мышцы тоже относятся к признакам, объединяющим кроновые группы муравьев, и, по-видимому, являются исходными для современных муравьев модальностями верхних челюстей. Авторы полагали, что трехзубые челюсти более эффективно справлялись с функцией удержания добычи, а также с манипуляцией предметами, что необходимо муравьям, поскольку муравьи, в отличие от других перепончатокрылых, во время ухода за личинками транспортируют их. Эти аргументы кажутся хорошо обоснованными. В связи с этим я предполагаю, что наличие и морфология базальных зубцов у муравьев с самыми гигантскими челюстями (Haidomyrmecinae) свидетельствует, что рабочие могли переносить ими своих личинок (рис. 1а, 3б, в). Аналогично современные муравьи с примитивной социальностью Harpegnathos sp. используют базальный зубец на гигантских удерживающих челюстях для переноса личинок (рис. 3). При этом важно, что крылатые репродуктивные самки меловых формикоидов имеют, по всей видимости, такие же челюсти (Barden, Grimaldi, 2016) (т.е. отсутствует полиморфизм рабочей касты), что говорит о примитивном социальном устройстве. Таким образом, эта функция (перенос расплода) могла возникнуть несколько раньше, чем эффективная структура, выполняющая ее, что соответствует представлениям о ходе морфологической эволюции.
Рис. 3.
Особенности мандибул рецентных и вымерших меловых муравьев: а – использование базальных зубцов для переноса яиц и личинок муравьями с длинной челюстью Harpegnathos sp.; б – прорисовка челюсти в профиль с характерным расположением базального зубца мелового муравья Haidomyrmex zigrasi; в – голова Ceratomyrmex ellenbergeri (AntWeb: IGRBU002) с вентрально-латерального ракурса. АЗМ, БЗМ – апикальный и базальный зубец мандибул. Масштабная линейка: 1 мм.

Дополнительные зубцы на мандибулах появляются в разных линиях перепончатокрылых. Например, одиночные пчелы-листорезы Megachile, пчелы-каменщицы Chalicodoma (Megachilidae), Vespa, Vespula (Vespidae) имеют мандибулы с несколькими небольшими зубцами, что связано, по-видимому, со сложным гнездостроительным поведением, и могут также успешно удерживать и расчленять жертву. Лептаниллоидные КМС (примитивные мандибулы с тремя–пятью зубцами) муравьев выглядят несколько иначе и больше подходят для удержания жертвы, а не для постройки гнезда, поэтому вопрос происхождения многозубцовых челюстей у предков муравьев требует дополнительного исследования. Однако, как представляется, изобретение трехзубых (и более) мандибул с развитой мускулатурой и особенной в сравнении с другими насекомыми подвижностью челюсти (Richter et al., 2020) явилось одной из ключевых адаптаций, позволившей кроновым муравьям занять доминирующие позиции в сообществах. Г.М. Длусский и Е.Б. Федосеева (1988) показали, что типы и возможные пути эволюции формы челюстей у муравьев могут быть связаны с образом жизни вида и наличием выраженного полиэтизма и полиморфизма, при этом механизм работы челюстей способен значительно модифицироваться. Так, виды с примитивным социальным устройством являются хищниками со специализированными челюстями (удерживающая КМС, система капканного типа), а у муравьев-кочевников специализированные особи – солдаты – имеют гладкие мандибулы в виде крюков, в то время как простые рабочие особи имеют лептаниллоидные мандибулы, и т.д. Именно сочетание новой формы мандибул и увеличение челюстной мускулатуры говорит о лучшем, более эффективном контроле за движениями, что хорошо укладывается в картину эволюции совершенствования манипуляций на фоне описанных выше перестроек в анатомии и морфологии антенн (подведение к мандибулам, концентрация обонятельных рецепторов в вершинных члениках). Муравьи способны к точным движениям даже очень большими челюстями-капканами. Так, например, длинные челюсти Odontomachus sp. совершают одно из самых быстрых движений в мире животных – схлопываются, ловя и убивая жертву, однако этими же челюстями рабочие способны на очень аккуратные манипуляции – бережно переносить, перекладывать яйца и молодых личинок в своем гнезде (Just, Gronenberg, 1999). Исключительное значение и выраженный вектор эволюции, направленный на совершенствование манипуляторных способностей мандибул у кроновых муравьев, подтверждают результаты исследований Гроненберга (Gronenberg, 1996; Gronenberg et al., 1997; Just, Gronenberg, 1999; Paul, Gronenberg, 2002, и др.). В серии работ им показано, насколько сложно устроена кранио-мандибулярная мышечная система муравьев: изменения длины мышц, соотношения разных типов мышечных волокон обуславливают модификации мандибул и обеспечивают тонкую настройку функционирования этих структур. Им же показано, что для усиления контроля за движениями мандибул у муравьев значительно развит подглоточный нервный узел, в отличие от других перепончатокрылых. Поэтому следует рассматривать строение мандибул (зубчатость) и наличие (и развитие) разнообразных мандибулярных мышц как одно из важных условий формирования социальности муравьев. Мышцы меняют форму головы, усиливая работу челюстей, при этом челюсти могут быть небольшими (рис. 4б, в). Иная картина наблюдается у стволовых муравьев (рис. 4г, д).
Рис. 4.
Соотношения размеров и особенности габитуса рецентных и меловых вымерших муравьев: а – зависимость между длиной головы и длиной тела у стволовых и рецентных муравьев; б–г – контуры головы с дорсальной стороны и тела в профиль: б – Atta laevigata (CASENT0922055), в – Anochetus sp. (CASENT0010781), г – Aquilomyrmex huangi (NIGP171999), д – Ceratomyrmex ellenbergeri (NIGP164022, NIGP164022). БЗМ – базальный зубец мандибул. Масштабная линейка: 1 мм, кроме б (тело) – 2 мм.
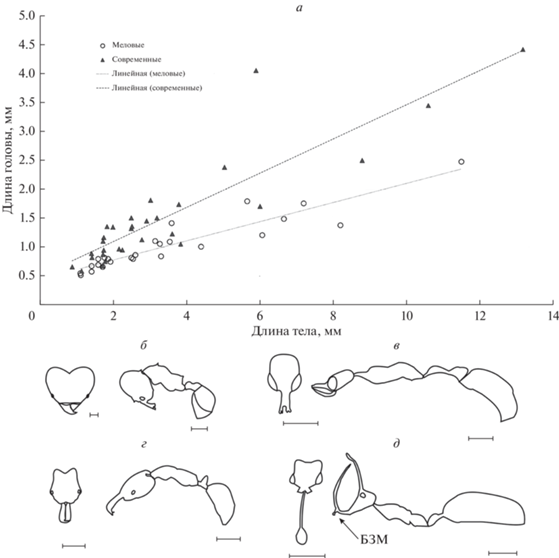
Уникальное разнообразие верхних челюстей муравьев из бирманского янтаря, как было неоднократно показано, выходит за рамки существующего морфопространства рецентных муравьев и вызывает интерес не только со стороны морфологии, но и с точки зрения экологических (этологических, биоценотических) предпосылок возникновения (Barden, Grimaldi, 2016; Barden et al., 2020; Cao et al., 2020b; Lattke, Melo, 2020, и др.). Строение головной капсулы и удивительных загнутых челюстей представителей Haidomyrmecinae говорит об ином, чем у современных муравьев, механизме работы их кранио-мандибулярной системы (рис. 1а, 3в, 4г, д). Барден с коллегами на основе внешней морфологии и уникальной находки Ceratomyrmex ellenbergeri с пойманной жертвой, нимфой Caputoraptor elegans, пришли к заключению, что мандибулы этих представителей двигались в вертикальной плоскости (Barden et al., 2020). Недавно обнаруженный и еще не описанный Colotrechninae sp., представитель Chalcidoidea, демонстрирует потрясающее внешнее сходство с меловыми Haidomyrmecinae структур головы (лобные выросты, наличие удлиненных щетинок вблизи выростов), строения мандибул (удлиненные загнутые вверх) и их взаимного расположения (Kamp et al., 2022). Изучение единственного экземпляра показало наличие только одного, а именно переднего, мыщелка мандибул, что позволяет челюстям двигаться в разных плоскостях – вертикальные движения (удерживание предметов между головной капсулой и мандибулами), а также горизонтальные движения (манипуляции между мандибулами). Все исследованные представители надсемейства также имеют одномыщелковое сочленение. Авторы исследования связывают такое устройство сочленения мандибул с эволюционной подвижностью и поразительным видовым разнообразием группы Chalcidoidea. Строение самих челюстей – наличие дополнительного зубца у вершины мандибул, развитая жевательная поверхность у базальной части мандибул, а также образ жизни хальцид говорят лишь о поверхностном сходстве с меловыми Haidomyrmecinae. Однако изучение биологии этого нового насекомого, характера движений мандибул в совокупности со сравнительным анализом способов сочленения мандибул и работы КМС у вымерших и рецентных муравьев сулят прекрасные перспективы для выяснения особенностей биологии Haidomyrmecinae. Латтке и Мело (Lattke, Melo, 2020) также обратили внимание на сходство формы головы Haidomyrmecinae с некоторыми паразитоидными стебельчатобрюхими перепончатокрылыми (Tyrannoscelio, Stentorceps, Nanocthulhu). Недавно открытые неотропические Tyrannoscelio к тому же имеют мощные, длинные с несколькими зубцами мандибулы, которые могут двигаться в вертикальной и несколько наклонной плоскости, как предполагается, с целью раскапывания грунта (Masner et al., 2007).
Приведенные факты существования современных представителей перепончатокрылых с модифицированной КМС аналогично (по крайней мере, внешне) наблюдаемой у адских муравьев, говорят о возможности подобных перестроек КМС у разных перепончатокрылых, а следовательно, не являются уникальным явлением для вымерших групп муравьев. Наиболее вероятно, что движение челюстей Haidomyrmecinae было не строго в вертикальной или горизонтальной плоскостях, а вентрально-латеральное, поскольку разводить в стороны челюсти необходимо, чтобы работать базальными зубцами, об этом может свидетельствовать и расхождение вершин апикальных зубцов у видов с наиболее длинными челюстями (см. рис. 3в), т.е. чтобы вершины мандибул не мешали друг другу при раскрытии челюстей. Причем некоторые особенности челюстей стволовых таксонов муравьев свидетельствуют в пользу того, что эти движения характерны не только для Haidomyrmecinae, но и для представителей Zigrasimeciinae и Sphecomyrminae, по крайней мере Gerontoformica. Стоит упомянуть, что морфологическая общность, которая прослеживается в строении этих стволовых групп муравьев, делает систему филогенетических отношений, где все три вымерших подсемейства предполагаются монофилетической ветвью, предложенную в свое время Длусским (Длусский, Федосеева, 1988; Dlussky, 1996) и позже поддержанную в работе Борисенко (Borysenko, 2017), актуальной. Предрасположенность к сходному направлению эволюции КМС у представителей этих стволовых таксонов заложена, как представляется, несколькими морфологическими особенностями стволовых муравьев, а именно, двузубыми мандибулами и слабой, несовершенной КМС. Двузубые мандибулы перепончатокрылых фиксируют жертву и не позволяют ей вертеться вокруг оси в момент нанесения удара жалом. Этого достаточно для летающих хищников, даже охотящихся на крупных жертв – жертва после ужаления неподвижна и во время транспортировки по воздуху зафиксирована (такое поведение можно наблюдать у Amophila, например). Но нелетающему социальному хищнику требуется донести до гнезда по субстрату добычу, которую в пути еще могут отобрать конкуренты. Решение, которое реализуют сфекомирмины и другие стволовые таксоны – это прижать жертву к головной капсуле (лоб, наличник), в отличие от рецентных муравьев, которые зажимают предметы между мандибулами. Именно по этой причине у некоторых меловых формикоидов с увеличением размеров добычи вершинный зубец удлиняется, лобное пространство увеличивается и армируется – жертва помещается не между челюстями, а между головой и челюстями. Так, анализ разнообразия ротовых придатков десятка видов Haidomyrmecinae выявил параллельное и независимое возникновение загнутых удлиненных мандибул и клипеальных выростов, “рогов”, у разных родов в этом подсемействе, а также установил строгую корреляцию между развитием мандибул и размером клипеуса, которая отсутствует у современных муравьев (Barden et al., 2020). Вершинный зубец мандибул увеличивается, а базальный остается ближе к основанию мандибул и ротовому отверстию. В некоторых случаях базальный зубец претерпевает некоторые модификации. Очевидно, что базальный зубец использовался для более точных манипуляций – возможно, манипуляции с расплодом, разделки добычи в гнезде или при уходе за гнездом (см. рис. 1а, 3б, в, 4д). Таким образом, большие челюсти нужны в большей степени не как орудия убийства, а в качестве средства зафиксировать жертву для удара жалом и затем донести добычу до гнезда. Современные муравьи имеют мощные челюсти и мощную мускулатуру, отражающуюся на размере и форме головной капсулы (рис. 4б, в), второе преимущество современных муравьев – это коллективная охота, когда и защиту добычи, и ее транспортировку могут осуществлять очень маленькие особи с небольшими челюстями вне зависимости от размера добычи (рис. 5). Челюсти адских муравьев, несмотря на длину, как правило, не выглядят мощными, а форма головной капсулы не отражает увеличение объема мускулатуры (как у современных муравьев, в отличие от головных выростов – рогов – размер головной капсулы остается относительно маленьким (рис. 4). Хрупкость челюстей адских муравьев также отметили Латтке и Мело (Lattke, Melo, 2020), в отличие от толстых жестких мандибул Tyrannoscelio. Предлагаемая здесь концепция челюстей предполагает, что зазубренный край, щетинки и волоски на головных выростах требуются для фиксации жертвы и ее контроля. При этом щетинки и зубцы имеются и у длиннорогих и длинночелюстных хайдомирмециин (Ceratomyrmex), и у представителей сфекомирмин среднего размера с небольшими мандибулами (Gerontoformica), и у самых мелких с крохотными мандибулами представителей стволовых групп (Zigrasimecia) (рис. 1б, г). В отличие от стволовых муравьев, у которых челюсть остается двузубой и увеличение размеров челюсти происходит за счет удлинения только вершинного зубца, челюсти современных муравьев увеличиваются по всей длине и зубцы распределены также по всей длине, за счет чего становятся более мощными (рис. 1а, ж, м, н, 3в, 4д).
Рис. 5.
Коллективная транспортировка мелкими рецентными муравьями крупной добычи включает несколько этапов: обнаружение добычи (жертвы), мобилизация муравьев из гнезда к добыче (убийство жертвы), охрана добычи, непосредственно совместная транспортировка и разделка добычи.

Исходя из приведенных аргументов, я предполагаю не идеальной версию челюстей-капканов, высказанную еще при описании первого представителя Haidomyrmecinae (H. cerberus) (Dlussky, 1996), поскольку для их реализации нужны мощные мускулы, тем более если предполагается пронзание жертвы. Гипотеза питания гемолимфой (Barden et al., 2017) видится малообоснованной. Во-первых, чтобы питаться гемолимфой не нужны длинные и тем более загнутые челюсти (см. рис. 1а, 3б), достаточно проколоть или прокусить жертву острым коротким “инструментом” (а современные муравьи в этих целях прекрасно используют мандибулы любой формы (Mystrium camillae, Adetomyrma venatrix, Amblyopone silvestrii и др.), во-вторых, довольно сложно представить процесс снятия жертвы с этих “сабель” и их последующую чистку, и третий аргумент – питание жидкой пищей предполагает ее передачу другим членам семьи, что с такими челюстями довольно сложно, а в представленной здесь концепции не могло быть характерно для примитивных в социальном отношении стволовых таксонов муравьев. Также стоит учитывать, что питание жидкой пищей предполагает перенос ее значительных количеств в брюшке, которое должно быть растягивающимся, поэтому было бы интересно оценить эту характеристику у инклюзов. Более правдоподобно, на мой взгляд, использование относительно коротких и прочных мандибул для фиксации и умерщвления жертвы (в том числе и ее прокалывание), а также разделка и питание добычи наподобие современных представителей Myrmoteras, например (многократное прокалывание и потребление измельченной субстанции) (Moffett, 1986). Питание жидкой пищей в виде экссудатов растений и пади, по-видимому, также могло быть распространено среди стволовых таксонов в качестве дополнительной подкормки, как это делают некоторые понероморфы, не использующие оральный трофаллаксис, но питающиеся “для себя в пути” или использующие (слабоэффективную) технику переноса жидкости между мандибулами (Paul, Roces, 2003).
В этом же ключе можно рассматривать и строение уникального околоротового вооружения зигразимециин: щетинки, хитиновые щеточки не являются свидетельством уникального способа охоты (или жертв) этих муравьев, а только способ удержать мягкие тела мелких беспозвоночных, которые, по-видимому, могли составлять диету мельчайших муравьев, длина тела которых около 2 мм, а также других мягких беспозвоночных в случае более крупных видов муравьев. Авторы описания Zigrasimecia hoelldobleri и Protozigrasimecia chauli также считают мелких беспозвоночных наиболее вероятной их добычей (Cao et al., 2020b). Наличие жала и мощный рельеф головной капсулы у такого мелкого насекомого скорее свидетельствует в пользу хищничества, чем питания жидкой пищей, как предполагают некоторые авторы. В случае зигразимециин очень удачно сопоставление механизма работы мандибул и клипеуса с работой верхних и нижних челюстей рыб, поскольку плоские мандибулы с разных сторон тела по форме края комплементарны и способны плотно прилегать друг к другу, образуя единую плоскость.
Кроновые таксоны пошли по другому пути – манипуляции предметами только между мандибулами, не привлекая головную капсулу, и добились успеха, варьируя размеры, форму, число зубцов мандибул, с одной стороны, и объем и группы мышц кранио-мандибулярной системы, с другой.
Появление у некоторых кроновых групп кислой железы с возможностью распыления кислоты Уилсон и Холлдоблер также связывали со сменой диеты (типов жертв?), но связь между диетой (сменой типа жертв) и этой способностью не охарактеризована (Wilson, Hölldobler, 2005). Представляется, что умение распылять кислоту может быть востребовано только при скоординированных коллективных действиях, одиночному охотнику эффективнее иметь жало. Хотя замечательная работа Смита (Smith, 2019) продемонстрировала преимущества кислотной атаки Formica archboldi против жертвы – мощного и сильного одиночного охотника Odontomachus brunneus с челюстями-капканами, все же атака кислотой является хорошей оборонительной стратегией для защиты пищевых ресурсов и гнезда у высокосоциальных муравьев: и как ядовитый агент, и как сигнал тревоги (Яковлев, 2010). Возможно, что появление кислой железы и способности распылять секрет связано с социальностью в большей степени, чем с диетой. Об этом говорит тот факт, что не только подсемейства долиходерины и формицины обладают такой способностью, но именно высокосоциальные представители Myrmicinae, такие как Crematogaster, также приобрели ее.
Ориктоценоз бирманского янтаря как модель процесса зарождения современных мирмекокомплексов. Принцип Гибсона. Этолого-экологическая гипотеза возникновения кроновых групп муравьев и их эволюционного успеха
Несомненно, что биоразнообразие палеобиоценозов бирмита очень велико. Можно говорить, что современные биоценозы этой территории прямые “потомки” меловых. Тем не менее таксономический состав муравьев из бирмита и в сходных современных экосистемах этого региона на уровне подсемейств и родовом уровне разный. Каковы причины изменения таксономического состава? Смена флоры голосеменных несомненно важный фактор, но сам по себе он не объясняет кардинальной смены стволовых таксонов на кроновые – как циклы оледенения и термальные оптимумы (а с ними и изменение флористического состава биоценозов) в кайнозое приводили лишь к смене преобладающих групп, но не к изменению морфологической “конструкции” Formicidae. Для объяснения высказываемой здесь гипотезы, я прибегла к введению “принципа Гибсона”, как краткой формулировки известной в морфологической эволюции, эволюции биоценозов, эволюции социальности (Treanore et al., 2021) (а скорее всего, и общей черте эволюции на всех ее уровнях организации: молекулярная эволюция, эволюция онтогенеза, макроэволюция) тенденции формирования чего-то нового не “сразу” и не “постепенно”, а мозаично, в ходе перебора комбинаций элементарных единиц “конструкции”. В эволюционной истории биоты хорошо известны примеры параллельной морфологической эволюции в разных (сестринских) филогенетических ветвях: например, признаков, характерных для птиц – “орнитизация”, млекопитающих – “маммализация”, артропод – “артроподизация”. Эффект влияния определенных условий биотических связей и общей генетической (онтогенетической) среды у филогенетически (а следовательно, конструктивно) близких организмов приводит к возникновению сходной направленности эволюции. В свою очередь, новые приспособления изменяют биотические взаимодействия, т.е. саму среду, в которой протекает эволюция, делая ее более приемлемой для таксонов, аккумулирующих весь комплекс адаптаций. Известное высказывание американо-канадского писателя-фантаста Уильяма Гибсона: “Будущее уже наступило. Просто оно еще неравномерно распределено”, как нельзя лучше характеризует эти эволюционные феномены. Согласно принципу Гибсона, предлагаю гипотезу зарождения и формирования современной биоценотической роли муравьев в условиях пищевой (экологической) специализации стволовых таксонов муравьев и возникновения комплекса ключевых адаптаций кроновых таксонов муравьев на примере палеоценозов Мьянмы. Будучи активной, разнообразной группой, стволовые таксоны муравьев “создали” адаптивное пространство, поделенное внутри себя на экологические субниши, не пуская других активных членистоногих хищников. Можно предположить в соответствии с принципом Гибсона, что стволовые таксоны муравьев на протяжении мела демонстрировали процесс “формикоидизации”: различные характеристики морфологической конструкции и социального устройства в разных сочетаниях. Однако комплекс ключевых адаптаций – возможность коллективного поведения, эффективной коммуникации, координации действий на уровне семьи, строение кранио-мандибулярной системы и антенн – в результате взаимосвязанных морфологических изменений и поведенческих паттернов в полной мере проявился именно у кроновых групп муравьев, что дало возможность последним стать генералистами, но при этом и более эффективными хищниками, чем муравьи стволовых таксонов. Все это дало конкурентные преимущества над муравьями-специалистами стволовых групп. Действительно, пищевая специализация у современных муравьев есть: а) у некоторых таксонов с примитивным социальным устройством, с небольшими семьями (где часто сохраняются тенденции к увеличению относительного размера челюстей, часто те самые обитатели подстилки и верхних слоев почвы – мирмицины, понерины); б) в специфических условиях среды с резким ограничением ярусности и ресурсов, например, пустыни (дифференциация по абсолютным размерам рабочих особей между видами); в) сформировавшаяся гораздо позже в тропических лесах с преобладанием мортмассы, а именно, у специалистов-грибоводов. Доминирующие же в современных экосистемах таксоны муравьев представляют собой виды с большими семьями (развитой социальной организацией, системой коммуникации, охраняемой территорией) с широким пищевым спектром, который включает содержание выделяющих падь насекомых (развитые формы трофаллаксиса) и коллективное не специализированное по жертве хищничество. Скорее всего, ни один из перечисленных пунктов не могут себе позволить муравьи с примитивной социальной организацией. Габитус эффективного наземного быстрого нелетающего хищника-герпетобионта (дендробионта) и социальное устройство способствовали автокаталитическому процессу совершенствования новой жизненной формы. В этот момент, видимо, происходит радиация кроновых таксонов по Г.М. Длусскому, т.е. приспособление новой формы к разным ярусам с вытеснением стволовых таксонов. Несмотря на специализацию, муравьи стволовых таксонов не могут удержать позиций, поскольку, как было показано, совершенные социальные навыки способствуют более эффективному удержанию пищевых ресурсов (т.е. их монополизации) как в сообществе современных муравьев, так и в целом у перепончатокрылых (Путятина, 2011; Захаров, 2015; I’Anson Price et al., 2021). Так, например, “на способность семьи питаться c крупного источника пищи влияют: эффективность поиска пищи; эффективность мобилизации; количество особей, мобилизуемых на пищу, и агрессивность вида в борьбе за кормушку” (Путятина, 2011), а эти характеристики, в свою очередь, отражают уровень социальных (коммуникативных) внутрисемейных навыков, но не размеры челюстей. Таким образом, понероморфы не были оттеснены с главных позиций, как предполагает гипотеза преемственности, а всегда занимали то же место (там, где возникли), что и сейчас, где ресурсная база позволяет существовать небольшим семьям социальных хищников (иногда специализированным) с одиночным типом фуражировки с небольшой долей углеводов в диете – геобионты, стратобионты и герпетобионты в богатом (лесном) биоценозе теплого климата.
Исходя из высказанных логических предпосылок и морфологического анализа, этолого-экологическая гипотеза заключается в следующем. Представители стволовых таксонов муравьев обладали менее совершенной коммуникативной способностью, менее эффективной КМС и зрительной пространственной ориентацией в большей степени, чем обонятельной, что блокировало развитие социальности, основанной на запаховых стимулах (развитие коммуникативных навыков, увеличение размера семьи, полиэтизм и полиморфизм). По причине более слабой коммуникативной организации их экологическая роль хищников среди насекомых (членистоногих) в условиях обилия и разнообразия ресурсов приводит к адаптивной радиации путем пищевой специализации, что является обычной тенденцией в эволюции среди насекомых (в том числе у одиночных перпончатокрылых), и, в частности, у современных муравьев с примитивной социальной организацией. Пищевая специализация в свою очередь на фоне бегающей, а не летающей, жизненной формы со слабо развитой коммуникативной способностью и специфической двузубой кранио-мандибулярной системой, отсутствием развитого кастового устройства семьи обуславливает адаптивную морфологическую эволюцию видов: разнообразие и относительные размеры челюстей, размеры особей. Комплекс ключевых адаптаций кроновых групп – возможность сложной коммуникации и координации действий, морфологические особенности кранио-мандибулярной системы и антенн – возникает с усилением роли обонятельных анализаторов на основе бегающего, хорошо ориентирующегося в трехмерном пространстве социального насекомого-герпетобионта и приводит ее обладателей к созданию эффективных неспециализированных хищников, получивших возможность контролировать ресурсную базу и, благодаря трофаллаксису, использовать и перераспределять в семье новый ресурс – богатую углеводами жидкую пищу (падь Hemiptera, нектар). В созданном стволовыми таксонами муравьев адаптивном пространстве поделенные специалистами по размерам и типам жертв экологические ниши по-новому “форматируются” представителями кроновых групп – возникает система соподчинения, понимаемая у современных муравьев под доминированием (виды-доминанты, субдоминанты, инфлюенты), где тип и размеры добычи на видовом уровне определяются не размером челюстей, а численностью семьи (Kaczmarek, 1953; Резникова, 1980; Захаров, 1991, 1994, 2015). Однако благодаря совершенной КМС и полиэтизму (полиморфизму) в условиях эффективного распределения пищи и разделения функций внутри семьи челюсти муравьев могут быть модифицированы под конкретные задачи даже внутри семьи (семейный полиморфизм: рабочие и солдаты).
Таким образом, представляется, что смена мирмекофауны стволовых таксонов на современную происходила не вследствие смены диеты (из-за последствий замещения голосеменных покрытосеменными растениями), как предполагается в “гипотезе династической преемственности”, а по причине формирования новой прогрессивной группы муравьев. Изменение диеты (в частности, использование жидкой пищи), в свою очередь, было следствием морфологической и этологической эволюции кроновых таксонов. Поскольку, согласно принципу Гибсона, среда была “подготовлена” мозаичным распределением признаков и характеристик среди специализированных стволовых таксонов муравьев к появлению комплекса признаков, реализованного у кроновых муравьев, менее совершенные в этом пространстве стволовые таксоны не смогли выдержать конкуренции.
Список литературы
Длусский Г.М., 1983. Новое семейство позднемеловых перепончатокрылых – “промежуточное звено” между муравьями и сколиоидами // Палеонтол. журн. № 3. С. 65–73.
Длусский Г.М., 1987. Новые Formicoidea (Hymenoptera) позднего мела // Палеонтол. журн. Т. 21. № 1. С. 131–135.
Длусский Г.М., Расницын А.П., 2007. Палеонтологическая летопись и этапы эволюции муравьев // Успехи соврем. биологии. Т. 127. № 2. С. 118–134.
Длусский Г.М., Федосеева Е.Б., 1988. Происхождение и ранние этапы эволюции муравьев // Меловой биоценотический кризис и эволюция насекомых. М.: Наука. С. 70–144.
Жерихин В.В., 2003. Избранные труды по палеоэкологии и филоценогенетике. М.: КМК. 542 с.
Захаров А.А., 1991. Организация сообществ муравьев. М.: Наука. 278 с.
Захаров А.А., 1994. Структура поселений муравьев островов Тонга и Западное Самоа // Животное население островов Юго-Западной Океании. М.: Наука. С. 93–142.
Захаров А.А., 2015. Муравьи лесных сообществ, их жизнь и роль в лесу. М.: КМК. 404 с.
Путятина Т.С., 2011. Поведение муравьев разных видов при совместной фуражировке // Зоол. журн. Т. 90. № 2. С. 174–183.
Расницын А.П., 2016. Разнообразие насекомых в палеозое и в мелу // Сб. тр. Зоол. музея МГУ. Т. 54. С. 441–455.
Резникова Ж.И., 1980. Межвидовая иерархия у муравьев // Зоол. журн. Т. 59. № 8. С. 1168–1176.
Федосеева Е.Б., 2001 Морфофункциональные аспекты топографии головной капсулы Aculeata (Hymenoptera) // Журн. общ. биологии. Т. 62. № 2. С. 157–170.
Яковлев И.К., 2010. Этологические аспекты функциональной специализации в семьях рыжих лесных муравьев (Hymenoptera: Formicidae) // Тр. Рус. энтомол. о-ва. Т. 80. № 4. С. 180–187.
Barden P., Grimaldi D.A., 2016. Adaptive radiation in socially advanced stem-group ants from the Cretaceous // Curr. Biol. V. 26. № 4. P. 515–521. https://doi.org/10.1016/j.cub.2015.12.060
Barden P., Herhold H.W., Grimaldi D.A., 2017. A new genus of hell ants from the Cretaceous (Hymenoptera: Formicidae: Haidomyrmecini) with a novel head structure // Syst. Entomol. V. 42. P. 837–846. https://doi.org/10.1111/syen.12253
Barden P., Perrichot V., Wang B., 2020. Specialized predation drives aberrant morphological integration and diversity in the earliest ants // Curr. Biol. V. 30. № 19. P. 3818–3824. e4. https://doi.org/10.1016/j.cub.2020.06.106
Borysenko L., 2017. Description of a new genus of primitive ants from Canadian amber, with the study of relationships between stem- and crown-group ants (Hymenoptera: Formicidae) // Insecta Mundi. Art. 0570. P. 1–57.
Boudinot B.E., Perrichot V., Chaul J.C.M., 2020. Camelosphecia gen. nov., lost ant-wasp intermediates from the mid-Cretaceous (Hymenoptera, Formicoidea) // ZooKeys. V. 1005. P. 21–55. https://doi.org/10.3897/zookeys.1005.57629
Cao H., Boudinot B.E., Shih C., Ren D., Gao T., 2020a. Cretaceous ants shed new light on the origins of worker polymorphism // Sci. China Life Sci. V. 63. № 7. P. 1085–1088. https://doi.org/10.1007/s11427-019-1617-4
Cao H., Boudinot B.E., Wang Z., Miao X., Shih C. et al., 2020b. Two new iron maiden ants from Burmese amber (Hymenoptera: Formicidae: Zigrasimeciini) // Myrmecol. News. V. 30. P. 161–173. https://doi.org/10.25849/myrmecol.news_030:161
Dlussky G.M., 1996. Ants (Hymenoptera: Formicidae) of Burmese amber // Paleontol. J. V. 30. № 4. P. 449–454.
Dlussky G.M., 1999. New ants (Hymenoptera: Formicidae) from Canadian amber // Paleontol. J. V. 33. № 4. P. 409–412.
Dlussky G.M., Brothers D.J., Rasnitsyn A.P., 2004. The first Late Cretaceous ants (Hymenoptera: Formicidae) from southern Africa, with comments on the origin of the Myrmicinae // Insect Syst. Evol. V. 35. № 1. P. 1–13. https://doi.org/10.1163/187631204788964727
Engel M.S., Grimaldi D.A., 2005. Primitive new ants in Cretaceous amber from Myanmar, New Jersey, and Canada (Hymenoptera: Formicidae) // Am. Mus. Novit. V. 3485. P. 1–23. https://doi.org/10.1206/0003-0082(2005)485[0001:PNAICA]2.0.CO;2
Euzébio D.E., Martins G.F., Fernandes-Salomão T.M., 2013. Morphological and morphometric studies of the antennal sensilla from two populations of Atta robusta (Borgmeier 1939) (Hymenoptera: Formicidae) // Braz. J. Biol. V. 73. № 3. P. 663–668. https://doi.org/10.1590/S1519-69842013000300026
Grimaldi D., Agosti D., 2000. A formicine in New Jersey Cretaceous amber (Hymenoptera: Formicidae) and early evolution of the ants // Proc. Natl Acad. Sci. USA. V. 97. P. 13678–13683. https://doi.org/10.1073/pnas.240452097
Grob R., Tritscher C., Grübel K., Stigloher C., Groh C. et al., 2021. Johnston’s organ and its central projections in Cataglyphis desert ants // J. Comp. Neurol. V. 529. P. 2138–2155. https://doi.org/10.1002/cne.25077
Gronenberg W., 1996. The trap-jaw mechanism in the dacetine ants Daceton armigerum and Strumigenys sp. // J. Exp. Biol. V. 199. № 9. P. 2021–2033.
Gronenberg W., 2008. Structure and function of ant (Hymenoptera: Formicidae) brains: Strength in numbers // Myrmecol. News. V. 11. P. 25–36.
Gronenberg W., Hölldobler B., 1999. Morphologic representation of visual and antennal information in the ant brain // J. Comp. Neurol. V. 412. P. 229–240.
Gronenberg W., Paul J., Just S., Hölldobler B., 1997. Mandible muscle fibers in ants: fast or powerful? // Cell Tissue Res. V. 289. № 2. P. 347–361.
Guo S., Kim J., 2007. Molecular evolution of Drosophila odorant receptor genes // Mol. Biol. Evol. V. 24. № 5. P. 1198–1207. https://doi.org/10.1093/molbev/msm038
Hashimoto Y., 1990. Unique features of sensilla on the antennae of Formicidae (Hymenoptera) // Appl. Entomol. Zool. V. 25. № 4. P. 491–501. https://doi.org/10.1303/aez.25.491
Hölldobler B., Wilson E.O., 1990. The Ants. Cambridge, MA: Harvard Univ. Press. 732 p.
Just S., Gronenberg W., 1999. The control of mandible movements in the ant Odontomachus // J. Insect Physiol. V. 45. № 3. P. 231–240. https://doi.org/10.1016/S0022-1910(98)00118-8
I’Anson Price R., Segers F., Berger A., Nascimento F.S., Grüter C., 2021. An exploration of the relationship between recruitment communication and foraging in stingless bees // Curr. Zool. V. 67. № 5. P. 551–560. https://doi.org/10.1093/cz/zoab043
Kaczmarek W., 1953. Badania nad zespolami mrowek lesnych // Ekol. Polska. V. 1. № 2. P. 69–96.
LaPolla J.S., Dlussky G.M., Perrichot V., 2013. Ants and the fossil record // Annu. Rev. Entomol. V. 58. P. 609–630.
Lattke J.E., Melo G.A.R., 2020. New haidomyrmecine ants (Hymenoptera: Formicidae) from mid-Cretaceous amber of northern Myanmar // Cretac. Res. V. 114. https://doi.org/10.1016/j.cretres.2020.104502
Masner L., Johnson N.F., Arias-Penna N.M., 2007. Tyrannoscelio, a new genus of neotropical Scelionidae (Hymenoptera: Platygastroidea) with description of two new species // Am. Mus. Novit. V. 3551. P. 1–8. https://doi.org/10.1206/0003-0082(2007)3551[1:TANGON]2.0.CO;2
McKellar R.C., Glasier J.R.N., Engel M.S., 2013. New ants (Hymenoptera: Formicidae: Dolichoderinae) from Canadian Late Cretaceous amber // Bull. Geosci. V. 88. P. 583–594. https://doi.org/10.3140/bull.geosci.1425
Moffett M.W., 1986. Trap-jaw predation and other observations on two species of Myrmoteras (Hymenoptera: Formicidae) // Insectes Soc. V. 33. P. 85–99.
Morgan D.E., 2009. Trail pheromones of ants // Physiol. Entomol. V. 34. P. 1–17. https://doi.org/10.1111/j.1365-3032.2008.00658.x
Nakanishi A., Nishino H., Watanabe H., Yokohari F., Nishikawa M., 2009. Sex-specific antennal sensory system in the ant Camponotus japonicus: structure and distribution of sensilla on the flagellum // Cell Tissue Res. V. 338. P. 79–97. https://doi.org/10.1007/s00441-009-0863-1
Paul J., Gronenberg W., 2002. Motor control of the mandible closer muscle in ants // J. Insect Physiol. V. 48. № 2. P. 255–267. https://doi.org/10.1016/s0022-1910(01)00171-8
Paul J., Roces F., 2003. Fluid intake rates in ants correlate with their feeding habits // J. Insect Physiol. V. 49. № 4. P. 347–357. https://doi.org/10.1016/s0022-1910(03)00019-2
Radchenko A.G., Perkovsky E.E., 2021. Wheeler’s dilemma revisited: First Oecophylla–Lasius syninclusion and other ants syninclusions in the Bitterfeld amber (late Eocene) // Invertebr. Zool. V. 18. № 1. P. 47–65.
Richter A., Garcia F.H., Keller R.A., Billen J., Economo E.P., Beutel R.G., 2020. Comparative analysis of worker head anatomy of Formica and Brachyponera (Hymenoptera: Formicidae) // Arthropod Syst. Phylogeny. V. 78. № 1. P. 133–170. https://doi.org/10.26049/ASP78-1-2020-06
Ross A.J., 2021. Burmese (Myanmar) amber taxa, on-line supplement, v. 2021.1. 27 p. http://www.nms.ac.uk/explore/stories/natural-world/ burmese-amber/
Smith A.A., 2019. Prey specialization and chemical mimicry between Formica archboldi and Odontomachus ants // Insectes Soc. V. 66. P. 211–222. https://doi.org/10.1007/s00040-018-0675-y
Treanore E., Derstine N., Amsalem E., 2021. What can mechanisms underlying derived traits tell us about the evolution of social behavior? // Ann. Entomol. Soc. Am. V. 114. № 5. P. 547–561. https://doi.org/10.1093/aesa/saaa033
Trible W., Olivos-Cisneros L., McKenzie S.K., Saragosti J., Chang N.-Ch., et al., 2017. orco mutagenesis causes loss of antennal lobe glomeruli and impaired social behavior in ants // Cell. V. 170. № 4. P. 727–735. https://doi.org/10.1016/j.cell.2017.07.001
Kamp T., van de, Mikó I., Staniczek A.H., Eggs B., Bajerlein D. et al., 2022. Evolution of flexible biting in hyperdiverse parasitoid wasps // Proc. R. Soc. B. V. 289. https://doi.org/10.1098/rspb.2021.2086
Vršanský P., Bechly G., Zhang Q., Jarzembowski E.A., Mlynský T., et al., 2018. Batesian insect-insect mimicry-related explosive radiation of ancient alienopterid cockroaches // Biologia. V. 73. P. 987–1006. https://doi.org/10.2478/s11756-018-0117-3
Ward P.S., 2000. Broad-scale patterns of diversity in leaf litter ant communities // Ants: Standard Methods for Measuring and Monitoring Biodiversity. Washington: Smithsonian Institution. P. 99–121.
Wilson E.O., 1985. Ants from the Cretaceous and Eocene amber of North America // Psyche. V. 92. № 2–3. P. 205–216.
Wilson E.O., Hölldobler B., 2005. The rise of the ants: A phylogenetic and ecological explanation // Proc. Natl Acad. Sci. V. 102. № 21. P. 7411–7414. https://doi.org/10.1073/pnas.0502264102
Wilson E.O., Carpenter F.M., Brown W.L., Jr., 1967. The first Mesozoic ants // Science. V. 157. P. 1038–1040. https://doi.org/10.1126/science.157.3792.1038
Yan H., Opachaloemphan C., Mancini G., Yang H., Gallitto M. et al., 2017. An engineered orco mutation produces aberrant social behavior and defective neural development in ants // Cell. V. 170. № 4. P. 736–747. https://doi.org/10.1016/j.cell.2017.06.051
Zhang Q., Rasnitsyn A.P., Wang B., Zhang H., 2018. Hymenoptera (wasps, bees and ants) in mid-Cretaceous Burmese amber: A review of the fauna // Proc. Geol. Assoc. V. 129. № 6. P. 736–747. https://doi.org/10.1016/j.pgeola.2018.06.004
Zheng D., Chang S.C., Perrichot V., Dutta S., Rudra A. et al., 2018. A Late Cretaceous amber biota from central Myanmar // Nat. Commun. V. 9. https://doi.org/10.1038/s41467-018-05650-2
Zhou X., Slone J.D., Rokas A., Berger S.L., Liebig J. et al., 2012. Phylogenetic and transcriptomic analysis of chemosensory receptors in a pair of divergent ant species reveals sex-specific signatures of odor coding // PLoS Genet. V. 8. https://doi.org/10.1371/journal.pgen.1002930
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии