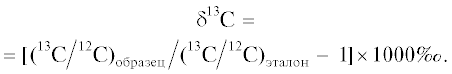Журнал общей биологии, 2022, T. 83, № 2, стр. 106-126
Сам-фотосинтез (Crassulacean acid metabolism) у сосудистых эпифитов
Н. М. Орлов 1, *, В. А. Викторова 1, А. К. Еськов 1, 2
1 Главный ботанический сад им. Н.В. Цицина РАН
127276 Москва, Ботаническая ул., 4, Россия
2 Московский государственный университет им. М.В. Ломоносова, биологический факультет,
кафедра экологии и географии растений
119234 Москва, Ленинские горы, 1, стр. 12, Россия
* E-mail: nikolas.orloff@gmail.com
Поступила в редакцию 19.10.2021
После доработки 22.12.2021
Принята к публикации 10.01.2022
- EDN: OJCZJJ
- DOI: 10.31857/S0044459622020051
Аннотация
В обзоре обобщены и систематизированы результаты существующих экспериментальных исследований наличия САМ (Crassulacean acid metabolism) у сосудистых эпифитов Южной и Центральной Америки, Юго-Восточной Азии и Австралии. Эта группа растений, несмотря на свой разнообразный таксономический состав, проявляет общие черты в распределении значений изотопной подписи углерода (δ13С), что связано с широким распространением вариантов САМ среди ее представителей. На основе анализа литературных данных нами собрано около 2000 значений δ13С сосудистых эпифитов. Опираясь на богатый опыт исследования отдельных флор и таксонов эпифитов, мы пробуем дать доступную на сегодняшний день глобальную картину распространения САМ среди эпифитов.
Изотопный состав углерода растений служит хорошим диагностическим признаком типа фотосинтеза. Это связано с серьезными отличиями изотопной подписи углерода у С3-растений, с одной стороны, и С4 и САМ – с другой. Известно, что многим наземным (Bone et al., 2015) и эпифитным (Silvera et al., 2005, 2009; Qiu et al., 2015) орхидеям, а также эпифитам других семейств (Griffiths, Smith, 1983; Winter et al., 1983; Medina, 1996; Zotz, Ziegler, 1997; Zotz, 2004; Зитте и др., 2008; Silvera et al., 2010b; Silvera, Lasso, 2016) свойственен САМ-фотосинтез (Crassulacean acid metabolism – кислотный метаболизм толстянковых). В эволюционном смысле САМ явился очень удобным механизмом для эпифитов на пути ксероморфоза для освоения экстремальных местообитаний. Наиболее хорошо изучен изoтопный состав углерода сосудистых эпифитов Нового Света (Mooney et al., 1989; Zotz, Ziegler, 1997; Holtum et al., 2004; Silvera et al., 2005, 2010a; Wester et al., 2011; Torres-Morales et al., 2020; Oliveira et al., 2021), а также Австралии и Новой Гвинеи (Winter et al., 1983; Earnshaw et al., 1987; Holtum et al., 2016). Работы на эту тему широко охватывают такие богатые эпифитами семейства, как Orchidaceae (Silvera et al., 2009, 2010b) и Bromeliaceae (Crayn et al., 2004, 2015).
Сосудистые эпифиты представляют собой группу растений, произрастающих на другом растении (форофите) без паразитирования на нем и без прямой связи с почвой. Данная группа довольно разнообразна по своему таксономическому составу. В нее входят как цветковые растения, так и папоротники, плауновидные и голосеменные. Всего более 31000 видов из 79 семейств относят к сосудистым эпифитам и полуэпифитам, что составляет примерно 10% всего биоразнообразия сосудистых растений (Zotz et al., 2021). Разнообразие видового состава сосудистых эпифитов неоднородно распределено по тропическим областям. Наиболее богаты эпифитами флоры Южной и Центральной Америки и Юго-Восточной Азии. Африка, напротив, относительно беднее по разнообразию и численности сосудистых эпифитов (Benzing, 1990; Zapfack, Engwald, 2008). На пять основных мировых центров биоразнообразия сосудистых растений, выделяемых Бартлоттом c соавт. (Barthlott et al., 2005), приходится также наибольшее разнообразие эпифитной флоры, где ее вклад может доходить до 39% (Taylor et al., 2021). Большинство центров биоразнообразия сосудистых растений характеризуется широким спектром абиотических факторов среды, таких как рельеф, почвы, геологическое строение и климат, а также принадлежит к лесным биомам (Mutke et al., 2011). Наибольшее видовое разнообразие эпифитов наблюдается на высотах около 1000 м над ур. м. (Cardelus et al., 2005). Все вышеперечисленное говорит о том, что эпифиты составляют очень важный, но одновременно и очень уязвимый блок тропических экосистем (Leao et al., 2014). Недавно показано, что эпифиты вносят непропорционально большой вклад в большинстве центров разнообразия растений и играют важную роль в создании глобального градиента широтного разнообразия растений (Taylor et al., 2021). Непонятно, как именно тип фотосинтеза у эпифитов влияет на их уязвимость вследствие изменения климата и роста содержания СО2 в атмосфере. Предполагалось, что, возможно, повышение содержания СО2 сделает более эффективными механизмы водопользования у эпифитов (что связано с наличием САМ). Но в целом однозначного доказательства положительного влияния повышенного содержания СО2 на эпифиты найдено не было (Raveh et al., 1995; Li et al., 2002; Monteiro et al., 2009; Zotz et al., 2010). Таким образом, осмысление природных факторов уязвимости эпифитов как очень масштабной группы биоразнообразия сосудистых растений невозможно без данных о наличии тех или иных вариантов фотосинтеза у них. Изотопный состав углерода сосудистых эпифитов тесно связан с их метаболизмом, однако общие тенденции в распределении типов фотосинтеза у эпифитов еще недостаточно изучены. В данном обзоре мы поставили целью обобщить имеющиеся литературные данные об изотопном составе углерода сосудистых эпифитов различных такcономических групп и географических регионов и описать его характерные особенности.
ТЕРМИНОЛОГИЯ И МЕТОДЫ
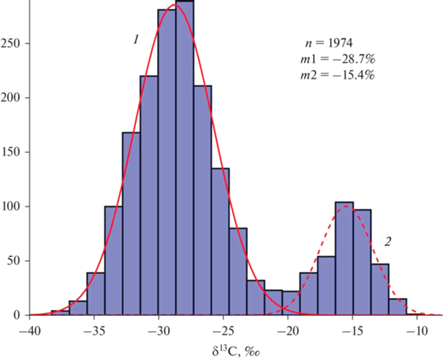
В природной среде соотношение стабильных изотопов углерода 12С и 13С может варьировать в пределах десятых долей процента, поэтому в мировой практике получил широкое распространение относительный показатель изотопной подписи углерода (δ13С), означающий отклонение отношения 13С/12С в образце от международного эталона, выраженный в промилле:
В качестве международного эталона для углерода используется vPDB, эквивалент кальцита белемнита из формации Peedee в Южной Каролине (США). В природном углероде значение δ13С может изменяться в пределах около 100‰ (Dawson et al., 2002), но в живых организмах этот диапазон, как правило, меньше. Точность измерения концентрации изотопов в массовых анализах обычно составляет 0.1–0.3‰. Применительно к живым организмам показатель δ13С может служить нескольким целям – быть интегрирующим критерием оценки интенсивности экологических и физиологических процессов или быть индикатором движения вещества в живых системах (Тиунов, 2007). Изотопная подпись углерода растений в первую очередь тесно связана с типом фотосинтеза и может использоваться в качестве одного из индикаторов активного пути фиксации углерода.
Фотосинтезирующие автотрофы в большинстве экосистем являются первичными продуцентами. Углерод в их тканях содержит меньше стабильного изотопа 13C по сравнению с СО2 окружающего воздуха. За последние несколько десятилетий значения δ13С углекислого газа атмосферы неуклонно понижаются и составляют на сегодняшний день примерно –8.5‰ (https://scrippsco2.ucsd.edu/). Процесс дискриминирования тяжелого изотопа углерода сосудистыми растениями можно разделить на несколько составляющих. Согласно гипотезе Фаркуара с соавт. (Farquhar et al., 1982), часть тяжелого изотопа углерода фракционируется еще на стадии поглощения в устьичной полости, благодаря более интенсивной диффузии легкого 12СО2, это значение может составлять до 4.4‰. Далее, фотосинтетическая фиксация углерода включает несколько реакций фракционирования с кинетическими изотопными эффектами, предпочтение в которых отдается молекулам СО2 с более легким изотопом 12С. Основной вклад во фракционирование углерода в этих реакциях вносят два фермента: рибулозо-1,5-бисфосфаткарбоксилаза-оксигеназа, или Рубиско, и фосфоенолпируваткарбоксилаза, или ФЕП-карбоксилаза. Рубиско принимает ключевое участие во всех путях фотосинтеза. Фракционирование изотопов углерода только за счет активности Рубиско оценивается примерно в –29‰ (Roeske, O’Leary, 1984; Guy et al., 1993; McNevin et al., 2007), тогда как ФЕП-карбоксилаза, активно участвующая в первичной фиксации СО2 при С4 (цикл Хетча–Слэка–Карпилова) и САМ-фотосинтезе, имеет свойства, менее дискриминирующие в отношении изотопов углерода. Согласно модели Фаркуара (Farquhar, 1983), величина такой дискриминации составляет 2.2‰. Также на степень дискриминации 13С при С3 (цикл Кальвина), С4 и особенно САМ-путях обратно влияет степень исчерпания запасенного растением СО2. Таким образом, для тканей сосудистых растений, использующих тот или иной вариант биохимических путей фиксации углерода, характерна своя изотопная подпись. Для растений с С3-фотосинтезом отмечен диапазон изменения δ13С в пределах примерно от –37 до –20‰. Более высокие значения характерны для тканей растений с С4-фотосинтезом, примерно от –16 до –10‰. Для растений с CAM-фотосинтезом приблизительные значения δ13С равны от –23 до –10‰. Подавляющее число видов сосудистых растений используют С3-тип фотосинтеза, благодаря чему по изотопному составу углерода их можно отличить от С4 и большинства САМ-растений.
Хотя САМ- и С4-фотосинтез имеют общие черты, очевидные фенотипические и экологические различия между группами С4- и САМ-растений заставляют рассматривать эти пути фиксации углерода как очень разные экологические адаптации (Edwards, Ogburn, 2012). Cреди группы сосудистых эпифитов С4-тип фотосинтеза не был зафиксирован ни у одного представителя, а САМ-фотосинтез, наоборот, очень широко распространен. Таким образом, при исключении С4-пути фиксации углерода в группе сосудистых эпифитов значения δ13С на большой выборке могут быть представлены в виде непрерывного градиента между крайними величинами, характерными для С3- и САМ-типов фотосинтеза.
Выделяют несколько типов или вариантов САМ-фотосинтеза, основываясь на типе устьичной проводимости растений (Kerbauy et al., 2012). При классическом варианте САМ-фотосинтеза устьица закрыты в дневное время, активный газообмен растения с окружающей средой и значительное накопление органических кислот происходит ночью, когда устьица открыты. В классическом варианте значения δ13С смещены в положительную сторону. Однако возможны и другие варианты. При втором варианте (в англоязычной литературе он называется “CAM-cycling”) устьица открыты только в дневное время. При этом степень накопления органических кислот в тканях растения ночью существенно меньше, чем в классическом варианте, и во многом осуществляется за счет дыхательной активности тканей (Kerbauy et al., 2012). Постоянный газообмен в дневное время и меньший фонд запасенного СО2 сказываются на увеличенной дискриминации 13С в тканях растения. Следующий, третий вариант, в англоязычной литературе носит название “CAM-idling”. Этот тип САМ-фотосинтеза, проявляющийся как реакция на стрессовые условия пересыхания, характеризуется закрытыми устьицами как днем, так и ночью и незначительным накоплением органических кислот в ночное время, осуществляемым за счет диффузии. При этом варианте дискриминация 13С в клетках растения значительно меньше, а показатель δ13С в этом случае будет иметь наибольшие значения.
Разнообразие вариантов САМ-фотосинтеза отражается на изотопной подписи углерода сосудистых эпифитов. По этому показателю их условно разделяют на две группы: слабый САМ (“Weak CAM”) и сильный САМ (“Strong CAM”). Значения δ13С для слабого САМ находятся преимущественно в так называемой зоне Винтера–Холтума (“Winter–Holtum zone”) между –23 и –19‰ (Males, 2018). Для сильного САМ эти же значения будут находиться в пределах примерно от –19 до –10‰. Виды с облигатным САМ-фотосинтезом демонстрируют высокую степень концентрации органических кислот ночью, а также ночную фазу фиксации СО2 даже при оптимальных условиях окружающей среды, что смещает их показатель изотопной подписи углерода в сторону более положительных значений, характерных для сильного САМ. Виды с факультативным типом САМ-фотосинтеза (С3-САМ) представляют собой растения, способные реализовать С3-фотосинтез и переключаться на САМ-путь при определенных факторах, таких как нехватка воды, резкое изменение освещенности и некоторые другие. У представителей видов как с облигатным, так и с факультативным САМ-фотосинтезом для молодых растений и молодых тканей зрелого растения характерен исключительно С3-путь.
Исходя из величин δ13С, к сильному САМ относят виды с облигатным вариантом и “CAM-idling”, а также факультативные С3-САМ при индуцированном внешними факторами САМ-пути. Такими факторами могут выступать обезвоживание, низкая влажность воздуха, длина светового дня, интенсивность освещения, дефицит элементов минерального питания (ЭМП) и другие факторы, приводящие к увеличению дефицита влаги в корнях или листьях (Niechayev et al., 2019). Индукция САМ этими факторами обычно быстрая и обратимая, что является ярким примером экологической пластичности (Kerbauy et al., 2012).
Помимо типа метаболизма, существенной причиной, определяющей состав изотопов углерода в тканях растения, является концентрация 13С в ассимилированном растением углекислом газе. Она может меняться в зависимости от внешних факторов. Известен так называемый эффект лесного полога (“canopy effect”), возникающий в плотном лесном древостое (Merwe, Medina, 1991; Brooks et al., 1997). Он проявляется в обеднении тяжелым изотопом 13С растений нижнего яруса и вызывает градиент значений δ13С листьев от поверхности к лесному пологу. Это явление объясняется комплексом причин, главными из которых являются увеличение с высотой интенсивности процесса фотосинтеза из-за отсутствия затенения и фиксация обедненного тяжелым изотопом СО2, выделяемого в процессе дыхания из лесной подстилки и почвы (Merwe, Medina, 1991).
В некоторых случаях изменение изотопного состава углерода в тканях эпифитов может быть объяснено мутуалистическими отношениями с беспозвоночными, в частности с муравьями. Как показали исследования подобных отношений между CAM-эпифитом Dischidia major (Apocynaceae) и муравьями р. Philidris, до 39% используемого эпифитом углерода может поступать от связанных с муравьями источников (Treseder et al., 1995). В результате жизнедеятельности муравьев, поселяющихся в видоизменных мешкообразных листьях D. major и питающихся в основном С3-растениями, углекислый газ внутри этих листьев эпифита становится более обогащенным легким изотопом 12С. Величина δ13С листьев, внутри которых муравьи поселяются, существенно ниже незаселенных и зависит от степени использования листьев муравьями.
ФРАКЦИОНИРОВАНИЕ ИЗОТОПОВ УГЛЕРОДА И СВЯЗЬ С САМ
Нехватка воды сильно ограничивает вегетативный рост и является основным лимитирующим абиогенным фактором для эпифитов (Zotz, Hietz, 2001). В ходе эволюции большинство сосудистых эпифитов выработали те или иные адаптации к запасанию влаги и более эффективному ее использованию. Одной из универсальных адаптаций для регуляции водного баланса в стрессовых условиях недостатка влаги является САМ-фотосинтез. Благодаря ночной стадии фиксации СО2, растения с САМ намного меньше теряют влагу по сравнению с С3- или С4-растениями (Herrera, 2009). Потери воды при транспирации у САМ-растений от четырех до десяти раз меньше, чем у С3-растений (Drennan, Nobel, 2000). Повышенное распространение вариантов САМ-фотосинтеза прослеживается у многих эпифитов. На примере сем. Orchidaceae удалось показать эволюционную связь САМ и эпифитного образа жизни (Silvera et al., 2009).
Считается, что САМ тесно связан с суккулентностью, которая часто наблюдается у представителей семейств Crassulaceae и Orchidaceae. Большая толщина листа обеспечивает им более высокую возможность накопления органических кислот. Несмотря на то, что суккулентность и САМ обычно совпадают, некоторые эпифиты являются исключением из этого правила (Silvera et al., 2005). Скорее всего, наличие САМ и, следовательно, смещение изотопного состава углерода в сторону более тяжелого 13С зависят больше не от толщины листа, а от толщины хлоренхимы (Zotz, Ziegler, 1997).
Для эпифитов можно выделить несколько закономерностей градиентного распределения САМ. Первая – увеличение процента САМ-видов с уменьшением уровня выпадения осадков. Это значение меняется от 25% в дождевых тропических лесах Новой Гвинеи и Австралии до 100% в сухих лесах Мексики (Zotz, Hietz, 2001). Вторая – уменьшение числа САМ-видов с высотой произрастания над уровнем моря. Эта корреляция вызвана в том числе уменьшением высоты лесного полога с ростом высоты произрастания. Лесной полог на участках, находящихся на высоте более 2000 м над ур. м., обычно ниже, что сокращает доступную для колонизации эпифитов среду обитания (Silvera et al., 2009). И наконец, по высоте стволов в сомкнутом низинном лесу доля эпифитов с САМ увеличивается от 7% в средней части полога до 50% на открытых участках вершин деревьев (Zotz, Ziegler, 1997; Silvera, Lasso, 2016). Следует принимать во внимание тот факт, что подобные закономерности выявлены прежде всего на примере эпифитных флор Нового Света и могут отличаться в других регионах.
Варьирование изотопной подписи углерода δ13С у разных таксономических групп сосудистых эпифитов формирует два кластера значений (рис. 1). Больший по объему кластер сформирован преимущественно С3-видами со значениями δ13С около –28‰, а в меньший входят представители видов с сильным САМ со значениями примерно –16‰ (Kerbauy et al., 2012). Между двумя кластерами находится некоторое число переходных значений, которые представляют собой виды либо со слабым, либо с факультативным типом САМ (Silvera et al., 2009). Более детальные исследования показывают, что для некоторых таксономических групп число переходных значений может быть значительно и позволяет даже выделить третий, меньший по объему кластер, находящийся в зоне Винтера–Холтума, и в таком случае можно говорить о мультимодальном распределении (Messerschmid et al., 2021). Поэтому изотопной подписи может быть недостаточно для определения видов со слабым или факультативным типом САМ-фотосинтеза (Pierce et al., 2002; Silvera et al., 2005, 2009, 2010a, b; Winter et al., 2008). В таком случае необходимым условием для обнаружения САМ-типа фотосинтеза может послужить суточное изменение титрируемой кислотности в тканях растения (Silvera et al., 2005) (Приложение А). Наиболее богаты эпифитами три группы сосудистых растений – это семейства Orchidaceae и Bromeliaceae, а также многочисленные сосудистые споровые растения, из которых самый богатый – порядок Polypodiales. Ниже мы отдельно остановимся на этих трех таксонах.
Рис. 1.
Изотопный состав углерода в δ13С сосудистых эпифитов на основе литературных данных. Даны значения как для САМ, так и для С3-растений. По горизонтальной оси отложено число родов, по вертикальной – соответсвующие величины δ13С.
Эпифитные Orchidaceae
Самое богатое эпифитами и одно из крупнейших семейств сосудистых растений – сем. Orchidaceae. Оно насчитывает более 27000 видов (Zotz, 2013). Считается, что около 72% видов орхидей являются эпифитами (Benzing, 1990; Gravendeel et al., 2004). Ареал большинства из них ограничен регионами с тропическим климатом. Полог тропических лесов богат представителями Orchidaceae. Оно занимает первое место по количеству видов с САМ, благодаря чему δ13С эпифитных орхидей носит характерное бимодальное распределение (Silvera et al., 2009). По различным оценкам, от трети до половины видов орхидных могут так или иначе использовать САМ-фотосинтез, в том числе благодаря огромному числу эпифитных видов из подсемейства Epidendroideae, наиболее богатого САМ (Kerbauy et al., 2012).
Базальным состоянием для орхидных, по всей видимости, является С3-фотосинтез (Silvera et al., 2010b) и наземный образ жизни (Givnish et al., 2016). Исходя из результатов филогенетических исследований предполагается, что последний общий предок всех орхидных существовал на территории Австралии около 112 млн лет назад. Затем, вероятно, порядка 90 млн лет назад предок части современных орхидных попал через Антарктиду в Южную Америку, где примерно в палеоцене – начале эоцена (Ramirez et al., 2007; Givnish et al., 2016) возникло подсемейство Epidendroideae, которое затем дало всплеск эволюционной радиации. Предполагается, что САМ-фотосинтез возникал у орхидных не менее 10 раз, также было несколько обратных переходов с САМ на С3. Показана значительная положительная корреляция между наличием САМ-фотосинтеза у орхидных и эпифитизмом (Silvera et al., 2009).
Как минимум две гипотезы описывают эволюционный переход с С3 на САМ. Первая гипотеза состоит в том, что САМ является результатом дупликации множества семейств генов, аналогично происхождению С4-фотосинтеза (Wang et al., 2009; Christin et al., 2013). Вторая предполагает, что САМ – это результат адаптации регуляции экспрессии генов, и что не существует корреляций между возникновением САМ и дупликацией генов (Zhang et al., 2016). Последняя гипотеза подтверждается тем, что ферменты, необходимые для работы САМ, присутствуют у всех растений, включая те, которые осуществляют исключительно С3-фотосинтез, и различия между обоими путями фотосинтеза связаны в основном с экспрессией этих ферментов (Silvera et al., 2010b).
Некоторые морфологические комплексы признаков эпифитных Orchidaceae могут характеризовать возможное смещение значений изотопной подписи углерода. Показано, что орхидеи с тонкими листьями обычно имеют более отрицательные значения δ13С в листьях, характерные для С3, тогда как аналогичные значения для орхидеи с толстыми листьями смещены в сторону менее отрицательных (Winter et al., 1983; Earnshaw et al., 1987; Zotz, Ziegler, 1997; Silvera et al., 2005; Motomura et al., 2008). Наблюдения показывают, что большинство видов и гибридов с суккулентными листьями проявляют ритмы активности, типичные для САМ – ночное открытие устьиц и увеличение кислотности в клетках. Кроме того, у САМ-орхидей могут встречаться другие адаптации для сохранения влаги, такие как толстая кутикула, большие и вакуолизированные клетки для накопления органических кислот, уменьшенные размеры и частота устьиц. У некоторых видов устьица расположены исключительно на внутренней стороне листьев. Способность листьев САМ-растений накапливать органические кислоты в ночное время увеличивается по мере их распускания и достигает максимума у зрелых листьев. Примерно 40% тропических видов орхидей имеют тот или иной вариант САМ в листьях (Silvera et al., 2010b), что, по-видимому, может служить причиной выделения третьего промежуточного кластера значений δ13С у некоторых групп эпифитных Orchidaceae (Messerschmid et al., 2021). Однако варианты фотосинтеза, протекающие в других органах, таких как псевдобульбы и корни, исследованы не столь подробно.
Как правило, псевдобульба лишена устьиц и заполнена водозапасающими клетками. Такая структура служит орхидеям прежде всего для запасания воды и ЭМП. Но в части клеток псевдобудьб есть хлоропласты, что указывает на способность к фотосинтетической активности. В действительности такой фактор, как нехватка воды, может индуцировать экспрессию САМ в отдельных органах растения, в том числе в псевдобульбах. При этом разные органы одного и того же растения могут иметь разные фотосинтетические пути, С3 или САМ (Rodrigues et al., 2013). Однако герметичность покровов большинства псевдобульб не позволяет им проводить фиксацию СО2 из воздуха напрямую. Источником СО2 в этом случае может служить дыхательная активность (Kerbauy et al., 2012), а также мезофилл не суккулентных листьев, соединенный с псевдобульбой аэренхимой (Rodrigues et al., 2013). В таком случае псевдобульбы могут играть значительную роль в осуществлении САМ-пути и способствовать сдвигу изотопного состава углерода в сторону более тяжелого изотопа.
Корни эпифитных орхидей также могут выполнять фотосинтезирующую функцию благодаря хлоропластам в клетках коры, а значит, и влиять на смещение изотопного состава углерода в растении. Особенно велико значение корневой системы у безлистных орхидей, поскольку их корни, помимо функции всасывания, играют основную роль в ассимиляции углерода. Эти две функции конфликтуют друг с другом, так как увлажненный веламен корней делает труднодоступным атмосферный СО2 для растения (Cockburn et al., 1985). Ввиду этого, слой веламена безлистных орхидей обычно более тонкий (Winter et al., 1985). У орхидей с листьями не выявлено САМ в корнях (Kerbauy et al., 2012), в то время как для безлистных орхидей этот тип метаболизма в корнях, по-видимому, более обычен (Cockburn et al., 1985; Winter et al., 1985). Несмотря на отсутствие устьиц, безлистные эпифитные орхидеи могут поддерживать внутреннюю концентрацию СО2 на атмосферном уровне, для такого варианта был предложен термин “безустьичный”, или “астоматный”, САМ (Cockburn et al., 1985). Еще одним преимуществом САМ может быть рециркуляция СО2, образующегося при дыхании тканей растения и эндофитов (Kerbauy et al., 2012).
Эпифитные Bromeliaceae
Следующее по разнообразию и числу эпифитных видов семейство цветковых растений – Bromeliaceae. Оно широко распространено в Центральной и Южной Америке и насчитывает более 3000 видов, больше половины из которых эпифиты (Zotz, 2013). Представители семейства занимают множество экологических ниш в разных климатических условиях, от туманных тропических плоскогорий и влажных туманных лесов до холодных высокогорий и засушливых пустынь.
Сравнение изотопного состава углерода многих представителей Bromeliaceae отражает широкое распространение САМ-фотосинтеза в семействе. Около 50% Bromeliaceae используют САМ-путь, а изотопная подпись углерода эпифитных видов этого семейства показывает характерное бимодальное распределение (Crayn et al., 2015). По-видимому, у Bromeliaceae САМ также возникал независимо несколько раз. Обнаружено пять таких переходов с С3 на САМ, однако прямой корреляции эпифитизма с возникновением САМ, подобной Orchidaceae, показать не удалось (Crayn et al., 2004, 2015). Более того, САМ скорее обычен среди наземных видов бромелиевых, нежели у эпифитных (Quezada, Gianoli, 2011). Возможно, это является закономерным следствием уникальной морфологии многих бромелиевых: во-первых, это розеточная форма листьев, перекрытие из которых создает специфическую структуру (резервуар), способную удерживать и накапливать воду и органические вещества; во-вторых, трихомы на поверхности листьев, позволяющие быстро поглощать воду и ЭМП и заменяющие аналогичные функции корней.
На основе данных по филогении, откалиброванных по ископаемым находкам, предполагается, что последний общий предок всех Bromeliaceae существовал, по-видимому, на территории Гвианского плоскогорья на высотах около 1000 м над ур. м. примерно 100 млн лет назад (Givnish et al., 2011, 2014) и был наземным С3-мезофитом, адаптированным к влажным и бедным ЭМП местообитаниям (Crayn et al., 2004). Почти все случаи перехода к эпифитизму восходят к двум источникам. Первый – расселение предков подсемейства Tillandsioideae с территории Гвианского нагорья в Анды 16.9–15.2 млн лет назад. Второй произошел, скорее всего, около 5.9 млн лет назад на юге атлантического побережья Бразилии и связан с представителями подсемейства Bromelioideae (Givnish et al., 2014). В этом же исследовании показана положительная корреляция между переходом к эпифитному образу жизни и несколькими факторами, такими, как начальное наличие резервуара из листьев, способность семян зацепиться за поверхность и наличие влажных и богатых ЭМП сред обитания. Широкое распространение САМ-фотосинтеза у эпифитных бромелиевых во влажных и часто затененных местах может объясняться преимуществом рециркуляции СО2, образующегося при дыхании, когда газообмен между атмосферой и листьями блокируется увлажненными трихомами (Pierce et al., 2002; Freschi et al., 2009).
В целом, изотопный состав углерода эпифитных Bromeliaceae имеет ту же тенденцию к бимодальности, как и у Orchidaceae (рис. 1). Наличие резервуара из листьев у некоторых эпифитных бромелий, запасающего воду и ЭМП, может быть причиной отсутствия положительной корреляции между САМ и эпифитизмом у Bromeliaceae (Crayn et al., 2004, 2015).
Эпифитные Polypodiales
Среди эпифитов много папоротников. Большая часть эпифитных папоротников принадлежит к порядку Polypodiales, который является второй по величине группой сосудистых эпифитов, насчитывающей более 2200 видов (Zotz, 2013). Эпифитные папоротники широко распространены во всех тропических и субтропических областях, но наибольшего видового разнообразия они достигают в дождевых лесах Австралии, Новой Зеландии и Юго-Восточной Азии, где могут составлять от 36 до 72% эпифитной флоры (Benzing, 1990).
Эпифитный образ жизни накладывает на папоротники те же ограничения, что и на цветковые растения, прежде всего, это уменьшение доступности воды и ЭМП, однако наличие САМ было зафиксировано у немногочисленных представителей нескольких эпифитных родов папоротников (Carter, Martin, 1994; Holtum, Winter, 1999; Martin et al., 2005; Rut et al., 2008; Minardi et al., 2014), среди которых отдельно выделяется богатый САМ-видами р. Pyrrosia (Winter et al., 1983; Kluge et al., 1989; Rut et al., 2008; Chiang et al., 2013). Относительно небольшое распространение САМ среди папоротников резко отличается от его представленности в эпифитных семействах цветковых растений.
Причины низких значений δ13С Polypodiales связаны с относительно малой распространенностью САМ у папоротников и еще требуют дальнейшего изучения. Как показывает сравнительный анализ генов эпифитного папоротника Asplenium nidus и его ближайшего наземного родственника A. komarovii, положительному отбору при переходе от наземного к эпифитному образу жизни подвергаются гены, связанные с устойчивостью к нехватке воды, фотосинтезом, развитием листьев и корневой системы (Zhang et al., 2019). Хотя эпифитный образ жизни появился у некоторых птеридофитов, по-видимому, еще в палеозое, происхождение большинства современных эпифитных Polypodiales следует отнести к мезозою и кайнозою, так как серьезные структурные перемены, произошедшие на рубеже эр, предоставили новые многочисленные возможности для эволюции современных птеридофитов (Dubuisson et al., 2009; Carvalho et al., 2021).
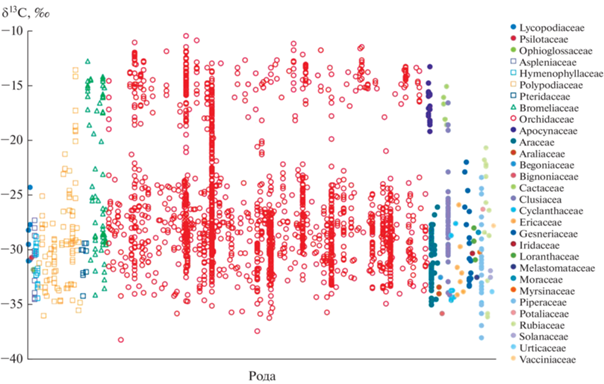
ЗАКЛЮЧЕНИЕ
В обзоре проанализировано около 2000 значений δ13С (Winter et al., 1983; Sternberg et al., 1984; Sipes, Ting, 1985; Guralnick et al., 1986; Earnshaw et al., 1987; Kluge et al., 1989; Benzing, 1990; Treseder et al., 1995; Winter, Smith, 1996; Zotz, Ziegler, 1997; Holtum, Winter, 1999; Crayn et al., 2004; Holtum et al., 2004, 2016; Zotz, 2004; Silvera et al., 2005; Wester et al., 2011; Torres-Morales et al., 2020; Oliveira et al., 2021), относящихся к сосудистым эпифитам из 30 семейств (рис. 1), отдельно собраны значения δ13С для эпифитов с САМ-типом фотосинтеза (Приложение А). Из анализа полученных данных изотопный состав углерода сосудистых эпифитов можно описать бимодальным распределением значений δ13С с максимумами, характерными для С3 (–28.7‰) и САМ (–15.4‰) типов фотосинтеза (рис. 2). При этом большая часть значений δ13С относится к группе С3-растений (около 80%). Наличие этих двух хорошо идентифицируемых пиков в изотопной подписи углерода позволяет широко применять метод изотопного анализа для оценки вариантов фотосинтеза у эпифитов (особенно учитывая отсутствие среди них С4 как дублирующих подписи САМ). Опираясь на многочисленные работы, посвященные изотопному составу сосудистых эпифитов Южной и Центральной Америки, а также Австралии, можно сделать вывод о том, что δ13С сосудистых эпифитов является информативным показателем, характеризующим разнообразие типов фотосинтеза у эпифитов (Holtum, Winter, 1999; Silvera et al., 2005, 2009, 2010b; Motomura et al., 2008; Kerbauy et al., 2012; Crayn et al., 2015), доступность воды в пологе леса (Zotz, Ziegler, 1997; Drennan, Nobel, 2000; Zotz, Hietz, 2001) и структуру эпифитного сообщества (Zotz, Ziegler, 1997; Barthlott et al., 2001; Kerbauy et al., 2012; Silvera, Lasso, 2016). Однако в других регионах детали распределения значений δ13С могут быть отличными ввиду различного таксономического состава эпифитных сообществ. Остается неисcледованным обнаруженный нами эффект высоких значений δ13С у затененных эпифитных орхидных (растущих в самом нижнем ярусе на высоте человеческого роста), который не может быть объяснен влиянием микогетеротрофии (Eskov et al., 2020). Этот феномен нарушает устоявшиеся воззрения на градиентное распределение САМ вдоль высоты полога леса, при котором САМ-эпифиты в нижней части стволов должны отсутствовать (Zotz, Ziegler, 1997; Silvera, Lasso, 2016). Требует дальнейшего исследования описанный эффект отсутствия привычных значений δ13С при совокупности других признаков, указывающих на САМ (Silvera et al., 2005). И наконец, интригует описанное наличие разных типов фотосинтеза в разных вегетативных органах эпифитов (Rodrigues et al., 2013). Остается также неясным, как именно увеличение СО2 вследствие антропогенных выбросов влияет на эпифиты с САМ и С3 (Raveh et al., 1995; Li et al., 2002; Monteiro et al., 2009; Zotz et al., 2010). Эти факты требуют более пристального изучения, так как эпифиты тропических регионов Азии недостаточно полно представлены в современных исследованиях и могут изменить существующие воззрения на роль САМ у сосудистых эпифитов.
Рис. 2.
Гистограмма, иллюстрирующая бимодальное распределение значений δ13С сосудистых эпифитов (n = 1974), собранных на основе литературных данных. Гауссовы кривые 1 и 2 с максимумами m1 = –28.7‰ и m2 = –15.4‰ отражают двухкомпонентную статистическую модель, полученную с помощью анализа смешанной модели (mixture model analysis).
Приложение А Таблица
1. Список сосудистых эпифитов с САМ-фотосинтезом. Семейства выделены жирным шрифтом, рода подчеркнуты. Рядом с семействами указано число эпифитных родов с подтвержденным САМ из общего числа эпифитных родов. Указанные характеристики листьев растений (для безлистных видов – других фотоситезирующих органов): δ13С – изотопная подпись углерода (для видов, представленных в нескольких исследованиях, изотопная подпись взята из последней по дате работы), DH+ – отмеченное наличие суточного изменения титрируемой кислотности
| Таксон | δ13С, ‰ | DH+ | Источник |
|---|---|---|---|
| Pteridaceae 1/13 | |||
| Pyrrosia Mirb. | |||
| P. adnascens (Sw.) Ching | –25.7 | + | Kluge et al., 1989 |
| P. confluens (R.Br.) Ching | –19.2 | + | Winter et al., 1983 |
| P. longifolia (Burm.f.) Morton | –14.0 | + | Winter et al., 1983; Kluge et al., 1989 |
| P. piloselloides (L.) M.G.Price | –16.4 | + | Kluge et al., 1989 |
| Apocynaceae 2/15 | |||
| Dischidia R.Br. | |||
| D. imbricata Steud. | –15.6 | Earnshaw et al., 1987 | |
| D. major (Vahl) Merr. | –16.0 | Winter et al., 1983; Holtum et al., 2016 | |
| D. nummularia R.Br. | –17.6 | Winter et al., 1983 | |
| D. ovata Benth. | –14.8 | Winter et al., 1983 | |
| Hoya R.Br. | |||
| H. anulata Schltr. | –13.3 | Holtum et al., 2016 | |
| H. australis R.Br. ex J.Traill | –18.4 | Winter et al., 1983 | |
| H. macgillivrayi F.M.Bailey | –18.2 | Holtum et al., 2016 | |
| H. verticillata (Vahl) G.Don | –13.2 | Winter et al., 1983; Holtum et al., 2016 | |
| Bromeliaceae 8/34 | |||
| Aechmea Ruiz & Pav. | |||
| A. angustifolia Poepp. & Endl. | –16.0 | Wester et al., 2011 | |
| A. bromeliifolia (Rudge) Baker | –15.5 | Oliveira et al., 2021 | |
| A. haltonii H.Luther | –12.8 | Crayn et al., 2004 | |
| A. pubescens Baker | –15.2 | Zotz, Ziegler, 1997; Wester et al., 2011 | |
| A. setigera Mart. ex Schult. | –15.0 | Zotz, Ziegler, 1997 | |
| A. tillandsioides (Mart.) Baker | –17.2 | Zotz, Ziegler, 1997 | |
| Araeococcus Brongn. | |||
| A. pectinatus L.B.Sm. | –18.6 | Crayn et al., 2004 | |
| Billbergia Thunb. | |||
| B. porteana Brong. ex Beer | –14.5 | Oliveira et al., 2021 | |
| Edmundoa Leme | |||
| E. perplexa (L.B.Sm.) Leme | –19.4 | Crayn et al., 2004 | |
| Guzmania Ruiz & Pav. | |||
| G. monostachia (L.) Rusby ex Mez | –28.8 | + | Guralnick et al., 1986; Zotz, Ziegler, 1997; Crayn et al., 2004; Wester et al., 2011 |
| Lymania R.Read | |||
| L. alvimii (L.B.Sm. & Read) Read | –17.3 | Crayn et al., 2004 | |
| Neoregelia L.B.Sm. | |||
| N. pineliana (Lem.) L.B.Sm. | –16.6 | Crayn et al., 2004 | |
| Tillandsia L. | |||
| T. bulbosa Hook. | –15.0 | Zotz, Ziegler, 1997; Wester et al., 2011 | |
| T. elongata H.B.K. | –15.8 | Zotz, Ziegler, 1997 | |
| T. espinosae L.B.Sm. | –15.2 | Crayn et al., 2004 | |
| T. fasciculata Sw. | –14.2 | Zotz, Ziegler, 1997 | |
| T. festucoides Brongn. ex Mez | –14.4 | Wester et al., 2011 | |
| T. pruinosa Sw. | –17.4 | Wester et al., 2011 | |
| T. subulifera Mez | –14.6 | Zotz, Ziegler, 1997 | |
| T. tenuifolia L. | –16.1 | Oliveira et al., 2021 | |
| Cactaceae* 13/13 | |||
| Epiphyllum Haw. | |||
| E. phyllanthus (L.) Haw. | –16.7 | Zotz, Ziegler, 1997; Wester et al., 2011 | |
| Rhipsalis Gaertn. | |||
| R. cassytha Gaertn., Fruct. & Sem R. baccifera (J.S.Muell.) Stearn |
–15.1 –18.6 |
Zotz, Ziegler, 1997 Wester et al., 2011 |
|
| Selenicereus Britton & Rose | |||
| S. monacanthus (Lem.) D.R.Hunt | –11.6 | Winter, Smith, 1996 | |
| Clusiaceae 1/2 | |||
| Clusia L. | |||
| C. rosea Jacq. | –17.9 | Benzing, 1990 | |
| C. flava Jacq. | –16.6 | Holtum et al., 2004 | |
| C. uvitana Pittier | –18.6 | Holtum et al., 2004 | |
| Gesneriaceae 1/31 | |||
| Codonanthopsis Mansf. | |||
| C. crassifolia (H.Focke) Chautems & Mat.Perret | –24.6 | + | Guralnick et al., 1986; Winter, Smith, 1996 |
| Orchidaceae 67/559 | |||
| Acianthera Scheidw. | |||
| A. adeodata P.Ortíz, O.Pérez & E.Parra | –14.6 | Torres-Morales et al., 2020 | |
| A. agathophylla (Rchb.f.) Pridgeon & M.W.Chase | –17.2 | Torres-Morales et al., 2020 | |
| A. boliviana (Rchb.f.) Pridgeon & M.W.Chase | –14.6 | Torres-Morales et al., 2020 | |
| A. casapensis (Lindl.) Pridgeon & M.W.Chase | –18.1 | Torres-Morales et al., 2020 | |
| A. ellipsophylla (L.O.Williams) Pridgeon & M.W.Chase | –19.0 | Wester et al., 2011 | |
| A. miqueliana (H.Focke) Pridgeon & M.W.Chase | –16.1 | Torres-Morales et al., 2020 | |
| A. sicaria (Lindl.) Pridgeon & M.W.Chase | –27.9 | Torres-Morales et al., 2020 | |
| Anathallis Barb.Rodr. | |||
| A. barbulata (Lindl.) Pridgeon & M.W.Chase | –21.0 | + | Silvera et al., 2005 |
| Aspasia Lindl. | |||
| A. epidendroides Lindl. | –27.9 | + | Silvera et al., 2005 |
| Brassavola R.Br. | |||
| B. acaulis Lindl. & Paxton | –15.1 | + | Silvera et al., 2005 |
| B. nodosa (L.) Lindl. | –13.9 | + | Zotz, Ziegler, 1997; Silvera et al., 2005; Torres-Morales et al., 2020 |
| Brassia R.Br. | |||
| B. arcuigera Rchb.f. | –30.5 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| B. caudata (L.) Lindl. | –27.0 | + | Silvera et al., 2005 |
| B. gireoudiana Rchb.f. & Warsz. | –21.3 | + | Silvera et al., 2005 |
| Bryobium Lindl. | |||
| B.irukandjianum (St.Cloud) M.A.Clem. & D.L.Jones | –19.8 | Winter et al., 1983 | |
| Bulbophyllum Thouars | |||
| B. baileyi F.Muell. | –16.8 | Winter et al., 1983 | |
| B. bowkettiae F.M. Bailey | –17.0 | Winter et al., 1983 | |
| B. gadgarrense Rupp | –15.7 | Holtum et al., 2016 | |
| B. globuliforme Nicholls | –11.1 | Holtum et al., 2016 | |
| B. gracillimum (Rolfe) Rolfe | –12.6 | Holtum et al., 2016 | |
| B. longiflorum Thouars | –12.7 | Holtum et al., 2016 | |
| B. macphersonii Rupp | –15.2 | Winter et al., 1983; Holtum et al., 2016 | |
| B. macranthum Lindl. | –15.1 | + | Silvera et al., 2005 |
| B. minutissimum F.Muell. | –12.3 | Winter et al., 1983; Holtum et al., 2016 | |
| B. schillerianum Rchb.f. | –12.4 | Winter et al., 1983 | |
| B. setigerum Lindl. | –17.9 | Torres-Morales et al., 2020 | |
| B. shepherdii (F.Muell.) Rchb.f. | –13.0 | + | Winter et al., 1983 |
| B. sladeanum A.D.Hawkes | –15.2 | Holtum et al., 2016 | |
| B. wadsworthii Dockrill | –18.6 | Holtum et al., 2016 | |
| B. windsorense B.Gray & D.L. Jones | –18.2 | Holtum et al., 2016 | |
| Campylocentrum Benth. | |||
| C. brenesii Schltr. | –15.2 | Torres-Morales et al., 2020 | |
| C. micranthum (Lindl.) Maury | –14.1 | Zotz, Ziegler, 1997; Torres-Morales et al., 2020 | |
| C. neglectum (Rchb.f. & Warm.) Cogn. | –16.9 | Oliveira et al., 2021 | |
| C. pachyrrhizum (Reichb.f.) Rolfe | –14.0 | Zotz, Ziegler, 1997 | |
| C. panamense Ames | –14.9 | Torres-Morales et al., 2020 | |
| Cattleya Lindl. | |||
| C. dowiana Bateman & Rchb.f. | –12.9 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| C. mendelii Dombrain | –12.8 | Torres-Morales et al., 2020 | |
| C. patinii Cogn. | –15.4 | Zotz, Ziegler, 1997 | |
| C. quadricolor Lindl. | –14.6 | Torres-Morales et al., 2020 | |
| C. trianae Linden & Rchb.f | –13.6 | Torres-Morales et al., 2020 | |
| C. violacea (Kunth) Rolf | –16.0 | Torres-Morales et al., 2020 | |
| C. warscewiczii Rchb.f. | –12.8 | Torres-Morales et al., 2020 | |
| Chiloschista Lindl. | |||
| C. phyllorhiza (F.Muell.) Schltr. | –16.0 | + | Winter et al., 1983; Benzing, 1990; Winter, Smith, 1996; Holtum et al., 2016 |
| Cischweinfia Dressler & N.H.Williams | |||
| C. pusilla (C.Schweinf.) Dressler & N.H.Williams | –27.3 | + | Silvera et al., 2005 |
| Coelogyne Lindl. | |||
| C. ovalis Lindl. | –25.8 | + | Silvera et al., 2005 |
| Comparettia Poepp. & Endl. | |||
| C. falcata Poepp. & Endl. | –15.0 | Torres-Morales et al., 2020 | |
| C. macroplectron Rchb.f. & Triana | –11.9 | Torres-Morales et al., 2020 | |
| C. ottonis (Klotzsch) M.W.Chase & N.H.Williams | –15.5 | Torres-Morales et al., 2020 | |
| Coryanthes Hook. | |||
| C. hunteriana Schltr. | –26.3 | + | Silvera et al., 2005 |
| Cymbidium Sw. | |||
| C. canaliculatum R.Br. | –17.4 | Winter et al., 1983; Holtum et al., 2016 | |
| Dendrobium Sw. | |||
| D. aemulum R.Br. | –13.4 | Holtum et al., 2016 | |
| D. antennatum Lindl. | –13.5 | Winter et al., 1983; Holtum et al., 2016 | |
| D. aphyllum (Roxb.) C.E.C. Fisch. | –13.9 | Holtum et al., 2016 | |
| D. bifalce Lindl. | –18.1 | Winter et al., 1983 | |
| D. bigibbum Lindl. | –14.3 | Winter et al., 1983; Holtum et al., 2016 | |
| D. bowmanii Benth. | –13.5 | Holtum et al., 2016 | |
| D. brevicaudum D.L.Jones & M.A.Clem. | –10.9 | Holtum et al., 2016 | |
| D. cacatua M.A.Clem. & D.L.Jones | –16.6 | Holtum et al., 2016 | |
| D. callitrophilum B.Gray & D.L. Jones | –11.5 | Holtum et al., 2016 | |
| D. canaliculatum R.Br. | –12.0 | Winter et al., 1983; Holtum et al., 2016 | |
| D. comptonii Rendle | –19.5 | Holtum et al., 2016 | |
| D. convexum (Blume) Lindl. | –13.0 | Winter et al., 1983 | |
| D. cucumerinum MacLeay ex Lindl. | –12.9 | Winter et al., 1983; Holtum et al., 2016 | |
| D. x delicatum (F.M.Bailey) F.M. Bailey | –16.7 | Holtum et al., 2016 | |
| D. dicuphum F.Muell. | –14.1 | Winter et al., 1983; Holtum et al., 2016 | |
| D. discolor Lindl. | –15.4 | Winter et al., 1983; Holtum et al., 2016 | |
| D. funiforme Blume | –14.9 | Winter et al., 1983; Holtum et al., 2016 | |
| D. gracilicaule F.Muell. | –25.2 | Winter et al., 1983; Holtum et al., 2016 | |
| D. x gracillimum (Rupp) Leaney | –17.8 | Holtum et al., 2016 | |
| D. johannis Rchb.f. | –13.8 | Winter et al., 1983; Holtum et al., 2016 | |
| D. lichenastrum (F.Muell.) Kraenzl. | –17.3 | Winter et al., 1983; Holtum et al., 2016 | |
| D. linguiforme Sw. | –11.9 | + | Winter et al., 1983; Holtum et al., 2016 |
| D. litorale Schltr. | –12.5 | Holtum et al., 2016 | |
| D. luteocilium Rupp | –18.7 | Winter et al., 1983 | |
| D. maidenianum Schltr. | –14.3 | Winter et al., 1983; Holtum et al., 2016 | |
| D. mortii F.Muell. | –16.6 | Holtum et al., 2016 | |
| D. nindii W.Hill | –13.5 | Winter et al., 1983 | |
| D. prenticei (F.Muell.) Nicholls | –15.6 | Holtum et al., 2016 | |
| D. pugioniforme A.Cunn. ex Lindl. | –13.9 | + | Winter et al., 1983; Holtum et al., 2016 |
| D. racemosum (Nicholls) Clemesha & Dockrill | –14.5 | Winter et al., 1983; Holtum et al., 2016 | |
| D. rigidum R.Br. | –15.0 | Winter et al., 1983; Holtum et al., 2016 | |
| D. schoeninum Lindl. | –14.7 | + | Winter et al., 1983 |
| D. speciosum Sm. | –14.5 | Winter, Smith, 1996 | |
| D. x superbiens Rchb.f. | –13.8 | Holtum et al., 2016 | |
| D. teretifolium R.Br. | –15.9 | + | Winter et al., 1983; Holtum et al., 2016 |
| D. tetragonum A.Cunn. | –18.2 | Winter et al., 1983; Holtum et al., 2016 | |
| D. toressae (F.M. Bailey) Dockrill | –16.6 | Winter et al., 1983; Holtum et al., 2016 | |
| D. wassellii S.T.Blake | –13.1 | Winter et al., 1983 | |
| Didymoplexis Griff. | |||
| D. pallens Griff. | –17.2 | Holtum et al., 2016 | |
| Dimerandra Schltr. | |||
| D. emarginata (G.Mey.) Hoehne | –27.7 | + | Winter, Smith, 1996; Torres-Morales et al., 2020 |
| Elleanthus C.Presl | |||
| E. capitatus (Poepp. & Endl.) Rchb.f. | –27.3 | Torres-Morales et al., 2020 | |
| E. jimenezii (Schltr.) C.Schweinf. | –18.0 | Torres-Morales et al., 2020 | |
| Encyclia Hook. | |||
| E. aspera Schltr. | –13.4 | Torres-Morales et al., 2020 | |
| E. betancourtiana Carnevali & I.Ramírez | –16.2 | Torres-Morales et al., 2020 | |
| E. ceratistes Schltr. | –15.2 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| E. chloroleuca (Hook.) Neumann | –14.5 | + | Silvera et al., 2005 |
| E. cordigera (Kunth) Dressler | –16.7 | + | Silvera et al., 2005 |
| E. leucantha Schltr. | –14.8 | Torres-Morales et al., 2020 | |
| E. mooreana (Rolfe) Schltr. | –16.2 | + | Silvera et al., 2005 |
| E. profusa (Rolfe) Dressler & G.E.Pollard | –15.7 | Torres-Morales et al., 2020 | |
| E. stellata (Lindl.) Schltr. | –18.0 | + | Silvera et al., 2005 |
| Epidendrum L. | |||
| E. anceps Jacq. | –18.3 | Zotz, Ziegler, 1997; Torres-Morales et al., 2020 | |
| E. barbeyanum Kraenzl. | –20.9 | Torres-Morales et al., 2020 | |
| E. bispathulatum Hágsater, O.Pérez & E.Santiago | –13.7 | Torres-Morales et al., 2020 | |
| E. bracteolatum C.Presl | –17.0 | Torres-Morales et al., 2020 | |
| E. calanthum Rchb.f. & Warsz. | –16.5 | Torres-Morales et al., 2020 | |
| E. campaccii Hágsater & L.Sánchez | –18.8 | Oliveira et al., 2021 | |
| E. ciliare L. | –18.9 | + | Silvera et al., 2005 |
| E. coronatum Ruiz & Pav. | –19.2 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| E. cristatum Ruiz & Pav. | –18.2 | Torres-Morales et al., 2020 | |
| E. difforme Jacq. | –14.4 | + | Zotz, Ziegler, 1997; Zotz, 2004; Silvera et al., 2005 |
| E. flexuosum G.Mey | –14.6 | Torres-Morales et al., 2020 | |
| E. igneum Hágsater | –19.4 | Torres-Morales et al., 2020 | |
| E. imatophyllum Lindl. | –14.6 | Torres-Morales et al., 2020 | |
| E. jamiesonis Rchb.f. | –13.8 | Torres-Morales et al., 2020 | |
| E. littorale Hágsater & Dodson | –19.8 | Torres-Morales et al., 2020 | |
| E. lockhartioides Schltr. | –15.7 | + | Silvera et al., 2005 |
| E. luckei I.Bock | –17.8 | Torres-Morales et al., 2020 | |
| E. macroclinium Hágsater | –20.4 | Wester et al., 2011 | |
| E. mutisii Hágsater | –19.5 | Torres-Morales et al., 2020 | |
| E. nocturnum Jacq. | –27.8 | + | Zotz, Ziegler, 1997; Torres-Morales et al., 2020; Holthum, Winter, 1999 |
| E. oerstedii Rchb.f. | –18.1 | + | Silvera et al., 2005 |
| E. peperomia Rchb.f. | –15.6 | Torres-Morales et al., 2020 | |
| E. prostratum (Lindl.) Cogn | –18.7 | Torres-Morales et al., 2020 | |
| E. ptochicum Hágsater | –13.0 | Torres-Morales et al., 2020 | |
| E. rigidum Jacq. | –18.6 | Zotz, Ziegler, 1997 | |
| E. ruizianum Steud. | –15.5 | Torres-Morales et al., 2020 | |
| E. schistochilum Schltr. | –16.7 | Torres-Morales et al., 2020 | |
| E. schlechterianum Ames | –15.0 | + | Zotz, Ziegler, 1997; Zotz, 2004; Silvera et al., 2005; |
| E. sculptum Reichb.f. | –18.7 | Zotz, Ziegler, 1997 | |
| E. stamfordianum Bateman | –17.4 | + | Silvera et al., 2005 |
| E. strobiliferum Rchb.f. | –17.3 | Torres-Morales et al., 2020 | |
| Eriopsis Lindl. | |||
| E. rutidobulbon Hook. | –24.8 | + | Silvera et al., 2005 |
| Erycina Lindl. | |||
| E. pusilla (L.) N.H.Williams & M.W.Chase | –13.8 | + | Silvera et al., 2005 |
| Guarianthe Dressler & W.E.Higgins | |||
| G. hennisiana (Rolfe) Van den Berg | –16.1 | + | Silvera et al., 2005 |
| Ionopsis Kunth | |||
| I. satyrioides (Sw.) Rchb.f. | –30.3 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| I. utricularioides (Sw.) Lindl. | –15.8 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| Jacquiniella Schltr. | |||
| J. pedunculata Dressler | –14.9 | Zotz, 2004 | |
| J. teretifolia (Sw.) Britton | –17.9 | Torres-Morales et al., 2020 | |
| Laelia Lindl. | |||
| L. lueddemanii (Prill.) (Prill.) L.O.Williams | –13.9 | Torres-Morales et al., 2020 | |
| L. marginata (Lindl.) L.O.Williams | –17.2 | Torres-Morales et al., 2020 | |
| L. undulata (Lindl.) L.O.Williams | –15.4 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| Lockhartia Hook. | |||
| L. acuta (Lindl.) Reichb.f. | –20.3 | + | Zotz, Ziegler, 1997; Silvera et al., 2005 |
| L. parthenoglossa Rchb.f. | –28.3 | + | Zotz, 2004; Silvera et al., 2005 |
| Luisia Gaudich. | |||
| L. teretifolia Gaudich. | –15.2 | Winter et al., 1983; Earnshaw et al., 1987 | |
| Maxillaria Ruiz & Pav. | |||
| M. crassifolia (Lindl.) Reichb.f. | –13.4 | Zotz, Ziegler, 1997 | |
| M. discolor (Lodd. ex Lindl.) Rchb. | –32.3 | + | Silvera et al., 2005; Wester et al., 2011 |
| M. endresii Rchb.f. | –23.5 | + | Silvera et al., 2005 |
| M. equitans (Schltr.) Garay | –14.9 | Torres-Morales et al., 2020 | |
| M. fulgens (Rchb.f.) L.O.Williams | –28.4 | + | Silvera et al., 2005; Wester et al., 2011 |
| M. ringens Rchb.f. | –35.7 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| M. valenzuelana (A.Rich.) Nash | –14.7 | Wester et al., 2011 | |
| Meiracyllium Rchb.f. | |||
| M. trinasutum Rchb.f. | –13.1 | Torres-Morales et al., 2020 | |
| Micropera Lindl. | |||
| M. fasciculata (Lindl.) Garay | –12.7 | Winter et al., 1983 | |
| Mobilabium Rupp | |||
| M. hamatum Rupp | –16.1 | Winter et al., 1983; Earnshaw et al., 1987 | |
| Mormodes Lindl. | |||
| M. fractiflexa Rchb.f. | –22.2 | + | Silvera et al., 2005 |
| M. lancilabris Pabst | –24.2 | + | Silvera et al., 2005 |
| Notylia Lindl. | |||
| N. albida Klotzsch | –11.2 | + | Zotz, 2004; Silvera et al., 2005; Torres-Morales et al., 2020 |
| N. barkeri Lindl. | –11.8 | + | Silvera et al., 2005 |
| N. incurva Lindl. | –12.8 | Torres-Morales et al., 2020 | |
| N. pentachne Reichb.f. | –14.1 | + | Zotz, Ziegler, 1997; Silvera et al., 2005 |
| Oberonia Lindl. | |||
| O. complanata (A.Cunn.) M.A.Clem. & D.L.Jones | –18.2 | Winter et al., 1983 | |
| Oncidium Sw. | |||
| O. ampliatum Lindl. | –15.3 | Zotz, Ziegler, 1997 | |
| O. bracteatum Warsz. & Rchb.f. | –24.0 | + | Silvera et al., 2005 |
| O. fuscatum Rchb.f. | –24.6 | + | Silvera et al., 2005 |
| O. isthmi Schltr. | –26.9 | + | Silvera et al., 2005 |
| O. panamense Schltr. | –26.2 | + | Silvera et al., 2005 |
| O. stipitatum Lindl. in Benth. | –14.5 | Zotz, Ziegler, 1997 | |
| Ornithocephalus Hook. | |||
| O. bicornis Lindl. in Benth. | –13.2 | + | Zotz, Ziegler, 1997; Silvera et al., 2005; Torres-Morales et al., 2020 |
| O. cochleariformis C.Schweinf. | –14.9 | + | Silvera et al., 2005 |
| O. escobarianus (Garay) Toscano & Dressler | –13.4 | Torres-Morales et al., 2020 | |
| O. poweliii Schlechter | –13.9 | Zotz, Ziegler, 1997; Zotz, 2004 | |
| O. urceilabris (P.Ortiz & R.Escobar) Toscano & Dressler | –16.4 | Torres-Morales et al., 2020 | |
| Pabstiella Brieger & Senghas | |||
| P. aryter (Luer) F.Barros | –14.7 | Torres-Morales et al., 2020 | |
| Phalaenopsis Blume | |||
| P. amabilis (L.) Blume | –14.1 | Winter et al., 1983; Earnshaw et al., 1987; Rut et al., 2008 | |
| Pholidota Lindl. | |||
| P. imbricata Hook. | –11.8 | Winter et al., 1983; Rut et al., 2008 | |
| Plectorrhiza Dockrill | |||
| P. tridentata (Lindl.) Dockrill | –15.3 | Winter et al., 1983 | |
| Plectrophora H.Focke | |||
| P. alata (Rolfe) Garay | –13.4 | Torres-Morales et al., 2020 | |
| Pleurothallis R.Br. | |||
| P. leucantha Schltr. | –16.1 | + | Silvera et al., 2005 |
| P. verecunda Schlechter | –14.0 | Zotz, Ziegler, 1997 | |
| Pomatocalpa Breda | |||
| P. macphersonii (F.Muell.) T.E.Hunt | –16.3 | Winter et al., 1983 | |
| Prosthechea Knowles & Westc. | |||
| P. aemula (Lindl.) W.E.Higgins | –28.4 | + | Silvera et al., 2005 |
| P. chacaoensis (Rchb.f.) W.E.Higgins | –30.9 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| P. chimborazoensis (Schltr.) W.E.Higgins | –30.4 | + | Silvera et al., 2005 |
| Psychopsis Raf. | |||
| P. papilio (Lindl.) H.G.Jones | –14.9 | Torres-Morales et al., 2020 | |
| Pterostemma Kraenzl. | |||
| P. antioquiense F.Lehm. & Kraenzl. | –16.9 | Torres-Morales et al., 2020 | |
| Rhinerrhiza Rupp | |||
| R. divitiflora (F.Muell. ex Benth.) Rupp | –14.2 | Winter et al., 1983 | |
| Robiquetia Gaudich. | |||
| R. gracilistipes (Schltr.) J.J.Sm. | –11.7 | Winter et al., 1983; Earnshaw et al., 1987 | |
| R. wassellii Dockrill | –13.9 | Winter et al., 1983 | |
| Rodriguezia Ruiz & Pav. | |||
| R. compacta Schltr. | –13.2 | + | Silvera et al., 2005 |
| R. granadensis Rchb.f. | –12.7 | Torres-Morales et al., 2020 | |
| R. lanceolata R. & P. | –13.2 | + | Zotz, Ziegler, 1997; Silvera et al., 2005; Torres-Morales et al., 2020 |
| R. venusta Rchb.f | –13.8 | Torres-Morales et al., 2020 | |
| Rossioglossum (Schltr.) Garay & G.C.Kenn. | |||
| R. ampliatum (Lindl.) M.W.Chase & N.H.Williams | –28.4 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| Saccolabiopsis J.J.Sm. | |||
| S. armitii (F.Muell.) Dockrill | –15.2 | Winter et al., 1983 | |
| Sarcochilus R.Br. | |||
| S. falcatus R.Br. | –14.9 | Winter et al., 1983 | |
| S. hillii (F.Muell.) F. Muell. | –13.8 | Winter et al., 1983 | |
| S. moorei (Rchb.f.) Schltr. | –15.3 | Winter et al., 1983 | |
| Scaphyglottis Poepp. & Endl. | |||
| S. imbricata (Lindl.) Dressler | –27.0 | + | Silvera et al., 2005 |
| Schoenorchis Reinw. ex Blume | |||
| S. micrantha Reinw. ex Blume | –14.6 | Winter et al., 1983 | |
| Solenidium Lindl. | |||
| S. racemosum Lindl. | –17.9 | Torres-Morales et al., 2020 | |
| Taeniophyllum Blume | |||
| T. malianum Schltr. | –15.8 | Winter et al., 1983 | |
| Thrixspermum Lour. | |||
| T. congestum (F.M.Bailey) Dockrill | –14.9 | Winter et al., 1983 | |
| Trachoma Garay | |||
| T. papuanum (Schltr.) M.A.Clem., J.J.Wood & D.L.Jones | –15.2 |
Winter et al., 1983 |
|
| T. rhopalorrachis (Rchb. f.) Garay | –13.3 | Winter et al., 1983 | |
| Trichocentrum Poepp. & Endl. | |||
| T. capistratum Linden & Rchb.f. | –13.4 | + | Zotz, 2004; Silvera et al., 2005 |
| T. carthagenense (Jacq.) M.W.Chase & N.H.Williams | –15.0 | + | Silvera et al., 2005; Torres-Morales et al., 2020 |
| T. cebolleta (Jacq.) M.W.Chase & N.H.Williams | –13.8 | Torres-Morales et al., 2020 | |
| T. helicanthum (Kraenzl.) J.M.H.Shaw | –13.3 | + | Silvera et al., 2005 |
| T. nudum (Bateman ex Lindl.) M.W.Chase & N.H.Williams | –14.5 | + | Silvera et al., 2005 |
| T. pulchrum Poepp. & Endl. | –13.6 | Torres-Morales et al., 2020 | |
| Trichoglottis Blume | |||
| T. australiensis Dockrill | –14.1 | Holtum et al., 2016 | |
| Trichopilia Lindl. | |||
| T. maculata Rchb.f. | –25.5 | + | Silvera et al., 2005 |
| Trizeuxis Lindl. | |||
| T. falcata Lindl. | –13.4 | Torres-Morales et al., 2020 | |
| Vanda Jones ex R.Br. | |||
| V. hindsii Lindl. | –14.7 | Winter et al., 1983; Earnshaw et al., 1987 | |
| Vanilla Plum. ex Mill. | |||
| V. columbiana Rolfe | –15.2 | Torres-Morales et al., 2020 | |
| V. fragrans (Salisb.) Ames | –13.7 | Zotz, Ziegler, 1997 | |
| Piperaceae 1/3 | |||
| Peperomia Ruiz & Pav. | |||
| P. camptotricha Miq. | –27.7 | + | Sternberg et al., 1984; Sipes, Ting, 1985; |
| Rubiaceae 2/30 | |||
| Hydnophytum Jack | |||
| H. moseleyanum Becc. | –17.7 | Winter et al., 1983; Holtum et al., 2016 | |
| Myrmecodia Jack | |||
| M. beccarii Hook.f. | –20.7 | + | Winter et al., 1983 |
Список литературы
Зитте П., Вайлер Э.В., Кадерайт Й.В., Брезински А., Кёрнер К., 2008. Ботаника. Т. 2. Физиология растений / Под ред. Чуба В.В. М.: Академия. 496 с.
Тиунов А.В., 2007 Стабильные изотопы углерода и азота в почвенно-экологических исследованиях // Изв. РАН. Сер. Биол. № 4. С. 475–489.
Barthlott W., Schmit-Neuerburg V., Nieder J., Engwald S., 2001 Diversity and abundance of vascular epiphytes: A comparison of secondary vegetation and primary montane rain forest in the Venezuelan Andes // Plant Ecol. V. 152. № 2. P. 145–156.
Barthlott W., Mutke J., Rafiqpoor M.D., Kier G., Holger K., 2005. Global centers of vascular plant diversity // Nova Acta Leopoldina. V. 92. № 342. P. 61– 83.
Benzing D.H., 1990. Vascular Epiphytes: General Biology and Related Biota. Cambridge: Cambridge Univ. Press. 354 p.
Bone R.E., Smith J.A., Arrigo N., Buerki S., 2015. A macro-ecological perspective on crassulacean acid metabolism (CAM) photosynthesis evolution in Afro-Madagascan drylands: Eulophiinae orchids as a case study // New Phytol. V. 208. P. 469–481.
Brooks R., Flanagan L., Varney G., Ehleringer J., 1997. Vertical gradients in photosynthetic gas exchange characteristics and refixation of respired CO2 within boreal forest canopies // Tree Physiol. V. 17. № 1. P. 1–12.
Cardelus C., Colwell R., Watkins J., 2005. Vascular epiphyte distribution patterns: Explaining the mid-elevation richness peak // J. Ecol. V. 94. № 1. P. 144–156.
Carter P., Martin C., 1994. The occurrence of Crassulacean acid metabolism among epiphytes in a high-rainfall region of Costa Rica // Selbyana. V. 15. № 2. P. 104–106.
Carvalho M., Jaramillo C., Parra F. et al., 2021. Extinction at the end-Cretaceous and the origin of modern Neotropical rainforests // Science. V. 372. № 6537. P. 63–68.
Chiang J., Lin T., Luo Y. et al., 2013. Relationships among rainfall, leaf hydrenchyma, and Crassulacean acid metabolism in Pyrrosia lanceolata (L.) Fraw. (Polypodiaceae) in central Taiwan // Flora. V. 208. № 5–6. P. 343–350.
Christin P., Osborne C., Chatelet D. et al., 2013. Anatomical enablers and the evolution of C4 photosynthesis // Proc. Natl Acad. Sci. V. 110. № 4. P. 1381–1386.
Cockburn W., Goh C., Avadhani P., 1985. Photosynthetic carbon assimilation in a shootless orchid, Chiloschista usneoides (DON) LDL: A variant on crassulacean acid metabolism // Plant Physiol. V. 77. № 1. P. 83–86.
Crayn D., Winter K., Smith A., 2004. Multiple origins of crassulacean acid metabolism and the epiphytic habit in the Neotropical family Bromeliaceae // Proc. Natl Acad. Sci. V. 101. № 10. P. 3703–3708.
Crayn D., Winter K., Nargar K., Smith A., 2015. Photosynthetic pathways in Bromeliaceae: Phylogenetic and ecological significance of CAM and C3 based on carbon isotope ratios for 1893 species // Bot. J. Linn. Soc. V. 178. № 2. P. 169–221.
Dawson T., Mambelli S., Plamboeck A. et al., 2002. Stable isotopes in plant ecology // Annu. Rev. Ecol. Syst. V. 33. № 1. P. 507–559.
Drennan M., Nobel S., 2000. Responses of CAM species to increasing atmospheric CO2 concentrations // Plant Cell Environ. V. 23. № 8. P. 767–781.
Dubuisson J., Hennequin S., Schneider H., 2009. Epiphytism in ferns: diversity and history // C. R. Biologies. V. 332. P. 120–128.
Earnshaw M.J., Winter K., Ziegler H. et al., 1987. Altitudinal changes in the incidence of crassulacean acid metabolism in vascular epiphytes and related life forms in Pa-pua New Guinea // Oecologia. V. 73. № 4. P. 566–572.
Edwards E., Ogburn R.M., 2012. Angiosperm responses to a low-CO2 world: CAM and C4 photosynthesis as parallel evolutionary trajectories // Int. J. Plant Sci. V. 173. № 6. P. 724–733.
Eskov A.K., Voronina E.Yu., Tedersoo L. et al., 2020. Orchid epiphytes do not receive organic substances from living trees through fungi // Mycorrhiza. V. 30. P. 697–704.
Farquhar G., 1983. On the nature of carbon isotope discrimination in C4 species // Aust. J. Plant Physiol. V. 10. № 2. P. 205–226.
Farquhar G., O’Leary M., Berry J., 1982. On the relationship between carbon isotope discrimination and the intercellular carbon dioxide concentration in leaves // Aust. J. Plant Physiol. V. 9. P. 121–137.
Freschi L., Takahashi C., Cambui C. et al., 2009. Specific leaf areas of the tank bromeliad Guzmania monostachia perform distinct functions in response to water shortage // J. Plant Physiol. V. 167. № 7. P. 526–533.
Givnish T., Barfuss M., Ee B. et al., 2011. Phylogeny, adaptive radiation, and historical biogeography in Bromeliaceae: Insights from an eight-locus plastid phylogeny // Am. J. Bot. V. 98. № 5. P. 872–895.
Givnish T., Barfuss M., Ee B. et al., 2014. Adaptive radiation, correlated and contingent evolution, and net species diversification in Bromeliaceae // Mol. Phylogenet. Evol. V. 71. № 1. P. 55–78.
Givnish T., Spalink D., Ames M. et al., 2016. Orchid historical biogeography, diversification, Antarctica and the paradox of orchid dispersal // J. Biogeogr. V. 43. № 10. P. 1905–1916.
Gravendeel B., Smithson A., Slik F., Schuiteman A., 2004. Epiphytism and pollinator specialization: drivers for orchid diversity? // Philos. Trans. R. Soc. Lond. B. Biol. Sci. V. 359. № 1450. P. 1523–1535.
Griffiths H., Smith J.A.C., 1983. Photosynthetic pathways in the Bromeliaceae of Trinidad: Relations between life-forms, habitat preference and the occurrence of CAM // Oecologia. V. 60. P. 176–184.
Guralnick L.J., Ting I.P., Lord E.M., 1986. Crassulacean acid metabolism in the Gesneriaceae // Am. J. Bot. V. 73. № 3. P. 336–345.
Guy R., Fogel M., Berry J., 1993. Photosynthetic fractionation of the stable isotopes of oxygen and carbon // Plant Physiol. V. 101. № 1. P. 37–47.
Herrera A., 2009. Crassulacean acid metabolism and fitness under water deficit stress: If not for carbon gain, what is facultative CAM good for? // Ann. Bot. V. 103. № 4. P. 645–653.
Holtum J., Winter K., 1999. Degrees of crassulacean acid metabolism in tropical epiphytic and lithophytic ferns // Funct. Plant Biol. V. 26. № 8. P. 749–757.
Holtum J., Aranda J., Virgo A. et al., 2004. δ13C values and crassulacean acid metabolism in Clusia species from Panama // Trees. V. 18. P. 658–668.
Holtum J., Hancock L., Edwards E. et al., 2016. Australia lacks stem succulents but is it depauperate in plants with crassulacean acid metabolism (CAM)? // Curr. Opin. Plant Biol. V. 31. P. 109–117.
Kerbauy G., Takahashi C., Matiz A. et al., 2012. Crassulacean acid metabolism in epiphytic orchids: current knowledge, future perspectives // Applied Photosynthesis / Ed. Najafpour M. Rijeka: IntechOpen. P. 81–104.
Kluge M., Avadhani P.N., Goh C.J., 1989. Gas exchange and water relations in epiphytic tropical ferns // Vascular Plants as Epiphytes / Ed. Lüttge U. Berlin: Springer-Verlag. P. 87–109.
Leao T.C.C., Fonseca C.R., Peres C.A., Tabarelli M., 2014. Predicting extinction risk of Brazilian Atlantic forest angiosperms // Conserv. Biol. V. 28. P. 1349–1359.
Li C.R., Gan L.J., Xia K., Zhou X., Hew C.S., 2002. Responses of carboxylating enzymes, sucrose metabolizing enzymes and plant hormones in a tropical epiphytic CAM orchid to CO2 enrichment // Plant Cell. Environ. V. 25. P. 369–377.
Males J., 2018. Concerted anatomical change associated with CAM in the Bromeliaceae // Funct. Plant Biol. V. 45. № 7. P. 681–695.
Martin S., Davis R., Protti P., Martin C., 2005. The occurrence of crassulacean acid metabolism in epiphytic ferns, with an emphasis on the Vittariaceae // Int. J. Plant Sci. V. 166. № 4. P. 623–630.
McNevin D., Badger M., Whitney S. et al., 2007. Differences in carbon isotope discrimination of three variants of D‑ribulose-1,5-bisphosphate carboxylase/oxygenase reflect differences in their catalytic mechanisms // J. Biol. Chem. V. 282. № 49. P. 36068–36076.
Medina E., 1996. CAM and C4 plants in the humid tropics // Tropical Forest Plant Ecophysiology / Eds Mulkey S.S., Chazdon R.L., Smith A.P. Boston: Springer. P. 56–88.
Merwe N., Medina E., 1991. The canopy effect, carbon isotope ratios and foodwebs in Amazonia // J. Archaeol. Sci. V. 18. № 3. P. 249–259.
Messerschmid T., Wehling J., Bobon N. et al., 2021. Carbon isotope composition of plant photosynthetic tissues reflects a Crassulacean Acid Metabolism (CAM) continuum in the majority of CAM lineages // Perspect. Plant Ecol. Evol. Syst. V. 51. https://doi.org/10.1016/j.ppees.2021.125619
Minardi B.D., Voytena A., Santos M., Randi A., 2014. Water stress and abscisic acid treatments induce the CAM pathway in the epiphytic fern Vittaria lineata (L.) Smith // Photosynthetica. V. 52. № 3. P. 404–412.
Monteiro J.A.F., Zotz G., Körner C., 2009. Tropical epiphytes in a CO2-rich atmosphere // Acta Oecol. V. 35. P. 60–68.
Mooney H., Bullock S., Ehleringer J., 1989. Carbon isotope ratios of plants of a tropical dry forest in Mexico // Funct. Ecol. V. 3. № 2. P. 137–142.
Motomura H., Yukawa T., Ueno O., Kagawa A., 2008. The occurrence of Crassulacean acid metabolism in Cymbidium (Orchidaceae) and its ecological and evolutionary implications // J. Plant Res. V. 121. № 2. P. 163–177.
Mutke J., Sommer J., Kreft H. et al., 2011. Vascular plant diversity in a changing world: Global centres and biome-specific patterns // Biodiversity Hotspots / Eds Zachos F., Habel J. Berlin: Springer. P. 83–96.
Niechayev N., Pereira P., Cushman J., 2019. Understanding trait diversity associated with crassulacean acid metabolism (CAM) // Curr. Opin. Plant Biol. V. 49. P. 74–85.
Oliveira R., Zotz G., Wanek W., Franco A., 2021. Leaf trait co-variation and trade-offs in gallery forest C3 and CAM epiphytes // Biotropica. V. 53. № 2. https://doi.org/10.1111/btp.12895
Pierce S., Winter K., Griffiths H., 2002. Carbon isotope ratio and the extent of daily CAM use by Bromeliaceae // New Phytol. V. 156. № 1. P. 75–83.
Qiu S., Sultana S., Liu Z.D., Yin L.Y., Wang C.Y., 2015. Identification of obligate C3 photosynthesis in Dendrobium // Photosynthetica. V. 53. № 2. P. 168–176.
Quezada I., Gianoli E., 2011. Crassulacean acid metabolism photosynthesis in Bromeliaceae: An evolutionary key innovation // Biol. J. Linn. Soc. V. 104. № 2. P. 480–486.
Ramirez S., Gravendeel B., Singer R. et al., 2007. Dating the origin of the Orchidaceae from a fossil orchid with its pollinator // Nature. V. 448. № 7157. P. 1042–1045.
Raveh E., Gersani M., Nobel P.S., 1995. CO2 uptake and fluorescence responses for a shade-tolerant cactus Hylocereus undatus under current and doubled CO2 concentrations // Physiol. Plant. V. 93. P. 505–511.
Rodrigues M., Matiz A., Bertinatto C. et al., 2013. Spatial patterns of photosynthesis in thin- and thick-leaved epiphytic orchids: Unravelling C3-CAM plasticity in an organ-compartmented way // Ann. Bot. V. 112. № 1. P. 17–29.
Roeske C., O’Leary M., 1984. Carbon isotope effects on the enzyme-catalyzed carboxylation of ribulose bisphosphate // Biochemistry. V. 23. P. 6275–6284.
Rut G., Krupa J., Miszalski Z. et al., 2008. Crassulacean acid metabolism in the epiphytic fern Platycerium bifurcatum // Photosynthetica. V. 46. № 1. P. 156–160.
Silvera K., Lasso E., 2016. Ecophysiology and crassulacean acid metabolism of tropical epiphytes // Tropical Tree Physiology / Eds Goldstein G., Santiago L. Cham: Springer. P. 25–43.
Silvera K., Santiago L., Winter K., 2005. Distribution of crassulacean acid metabolism in orchids of Panama: Evidence of selection for weak and strong modes // Funct. Plant Biol. V. 32. № 5. P. 397–407.
Silvera K., Santiago L., Cushman J., Winter K., 2009. Crassulacean acid metabolism and epiphytism linked to adaptive radiations in the Orchidaceae // Plant Physiol. V. 149. № 4. P. 1838–1847.
Silvera K., Santiago L., Cushman J., Winter K., 2010a. The incidence of Crassulacean acid metabolism in the Orchidaceae derived from carbon isotope ratios: a checklist of the flora of Panama and Costa Rica // Bot. J. Linn. Soc. V. 163. № 2. P. 194–222.
Silvera K., Neubig K., Whitten M., Williams N., et al., 2010b. Evolution along the crassulacean acid metabolism continuum // Funct. Plant Biol. V. 37. № 11. P. 995–1010.
Sipes D.L., Ting I.P., 1985. Crassulacean acid metabolism and crassulacean acid metabolism modifications in Peperomia camptotricha // Plant Physiol. V. 77. № 1. P. 59–63.
Sternberg L.O., Deniro M.J., Ting I.P., 1984. Carbon, hydrogen, and oxygen isotope ratios of cellulose from plants having intermediary photosynthetic modes // Plant Physiol. V. 74. № 1. P. 104–107.
Taylor A., Zotz G., Weigelt P. et al., 2021. Vascular epiphytes contribute disproportionately to global centres of plant diversity // bioRxiv. https://doi.org/10.1101/2021.05.21.445115
Torres-Morales G., Lasso E., Silvera K. et al., 2020. Occurrence of crassulacean acid metabolism in Colombian orchids determined by leaf carbon isotope ratios // Bot. J. Linn. Soc. V. 193. № 4. P. 431–477.
Treseder K., Davidson D., Ehleringer J., 1995. Absorption of ant-provided carbon dioxide and nitrogen by a tropical epiphyte // Nature. V. 375. P. 137–139.
Wang X., Gowik U., Tang H. et al., 2009. Comparative genomic analysis of C4 photosynthetic pathway evolution in grasses // Genome Biol. V. 10. № 6. https://doi.org/10.1186/gb-2009-10-6-r68
Wester S., Mendieta-Leiva G., Nauheimer L. et al., 2011. Physiological diversity and biogeography of vascular epiphytes at Río Changuinola, Panama // Flora. V. 206. № 1. P. 66–79.
Winter K., Smith A., 1996. Crassulacean Acid Metabolism. Berlin: Springer-Verlag. 449 p.
Winter K., Garcia M., Holtum J., 2008. On the nature of facultative and constitutive CAM: Environmental and developmental control of CAM expression during early growth of Clusia, Kalanchoe, and Opuntia // J. Exp. Bot. V. 59. № 7. P. 1829–1840.
Winter K., Wallace B., Stocker G., Roksandic Z., 1983. Crassulacean acid metabolism in Australian vascular epiphytes and some related species // Oecologia. V. 57. № 1. P. 129–141.
Winter K., Medina E., Garcia V., Mayoral M.A., Muniz R., 1985. Crassulacean acid metabolism in roots of a leafless orchid Camplocentrum tyrridion Garay & Dunsterv. // J. Plant Physiol. V. 118. P. 73–78.
Zapfack L., Engwald S., 2008. Biodiversity and spatial distribution of vascular epiphytes in two biotopes of the Cameroonian semi-deciduous rain forest // Plant Ecol. V. 195. № 1. P. 117–130.
Zhang J., Liu L., Shu J. et al., 2019. Transcriptomic evidence of adaptive evolution of the epiphytic fern Asplenium nidus // Int. J. Genomics. V. 2019. https://doi.org/10.1155/2019/1429316
Zhang L., Chen F., Zhang G.Q. et al., 2016. Origin and mechanism of crassulacean acid metabolism in orchids as implied by comparative transcriptomics and genomics of the carbon fixation pathway // Plant J. V. 86. № 2. P. 175–185.
Zotz G., 2004. How prevalent is crassulacean acid metabolism among vascular epiphytes? // Oecologia. V. 138. № 2. P. 184–192.
Zotz G., 2013. The systematic distribution of vascular epiphytes – a critical update // Bot. J. Linn. Soc. V. 171. P. 453–481.
Zotz G., Hietz P., 2001. The ecophysiology of vascular epiphytes: Current knowledge, open questions // J. Exp. Bot. V. 52. № 364. P. 2067–2078.
Zotz G., Ziegler H., 1997. The occurrence of crassulacean acid metabolism among vascular epiphytes from Central Panama // New Phytol. V. 137. P. 223–229.
Zotz G., Bogusch W., Hietz P., Ketteler N., 2010. Growth of epiphytic bromeliads in a changing world: the effect of elevated CO2 and varying water and nutrient supply // Acta Oecol. V. 36. P. 659–665.
Zotz G., Weigelt P., Kessler M., Kreft H., Taylor A., 2021. EpiList 1.0: A global checklist of vascular epiphytes // Ecology. V. 102. № 6. https://doi.org/10.1002/ecy.3326
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии