Журнал общей биологии, 2022, T. 83, № 2, стр. 127-137
Функциональные признаки листьев растений важны для формирования состава альпийских растительных сообществ
В. Г. Онипченко 1, 2, *, К. В. Дудова 1, Д. М. Гулов 3, А. А. Ахметжанова 1, Д. К. Текеев 2, Т. Г. Елумеева 1
1 Московский государственный университет им. М.В. Ломоносова
119991 Москва, Ленинские горы, 1, Россия
2 Тебердинский национальный парк
369210 Теберда,
пер. Бадукский, 1, Карачаево-Черкесская Республика, Россия
3 Институт биологии УФИЦ РАН
450054 Уфа, пр. Октября, 69, Республика Башкортостан, Россия
* E-mail: vonipchenko@mail.ru
Поступила в редакцию 15.02.2022
После доработки 28.02.2022
Принята к публикации 01.03.2022
- EDN: RKCIDC
- DOI: 10.31857/S004445962202004X
Аннотация
Изучение состава и структуры сообществ организмов, предусматривающее анализ их функциональных признаков, приобрело особую популярность в последние десятилетия. Функциональный подход получил широкое распространение, но редко применяется для решения двух связанных вопросов: 1) насколько виды, входящие в состав сообщества, отличаются по средним значениям тех или иных функциональных признаков от случайных выборок (с таким же числом видов) местной флоры; 2) насколько средние значения функциональных признаков видов в сообществе отличаются от средневзвешенных (по участию видов), или иными словами, насколько значения этих признаков выше или ниже у доминантов по сравнению со всеми остальными видами. Задача настоящей работы – ответ на эти вопросы на примере альпийских сообществ Северо-Западного Кавказа. Изучены функциональные признаки листьев в альпийских фитоценозах четырех типов, занимающих максимальные площади в альпийском поясе Северо-Западного Кавказа: альпийские лишайниковые пустоши (АЛП), пестроовсяницевые луга (ПЛ), гераниево-копеечниковые луга (ГКЛ) и альпийские ковры (АК). Листья растений АЛП в водонасыщенном состоянии имели значимо меньшую массу и удельную листовую поверхность (УЛП), но большее содержание сухого вещества по сравнению с наборами видов “случайных” сообществ. У доминантов этого сообщества более мелкие листья с большим содержанием сухого вещества и меньшей УЛП. Листья растений ПЛ имели более низкую площадь и массу в водонасыщенном состоянии, но более высокую – в сухом, а доминанты – более высокую массу листа в сухом состоянии и содержание сухого вещества в листе, но меньшую площадь и УЛП. Для растений более продуктивных ГКЛ характерны более крупные листья и большее содержание сухого вещества по сравнению с видами из “случайных” выборок. Только три размерных признака (площадь, масса водонасыщенного и сухого листа) были значимо выше у доминантов ГКЛ по сравнению с другими видами этого сообщества. Растения АК, развивающиеся в условиях позднего схода снега и ограниченного вегетационного периода, имели более мелкие листья с повышенным содержанием сухого вещества и УЛП. У доминантов этих сообществ, напротив, более крупные листья по сравнению с другими видами этого сообщества. Полученные результаты подтверждают определяющую роль стресс-толерантности для формирования сообществ малоснежных местообитаний и доминирования в них (АЛП, ПЛ), значительную роль более крупнолистных видов конкурентной стратегии в более продуктивных ГКЛ и относительно большую роль рудеральности в формировании АК.
Изучение состава и структуры сообществ организмов с позиций анализа их функциональных признаков приобрело особую популярность в последние десятилетия (Garnier et al., 2016). Под функциональными признаками обычно понимают любые признаки организмов, прямо или косвенно влияющие на их приспособленность (fitness – способность организма передавать свой генетический материал потомкам, в экологии обычно выражаемая в числе потомков, например, семенной продукции – Fisher, 1930) (Garnier et al., 2016). Лафлин с соавторами (Laughlin et al., 2020) полагают, что соединение функциональных признаков напрямую с популяционной скоростью роста является фундаментальным шагом к предсказанию популяционной динамики и состава сообществ.
Согласно Лаворель с соавторами (Lavorel et al., 2007), используемые функциональные признаки должны отвечать следующим требованиям: 1) они должны быть связаны с функциями растения, 2) относительно легко измеряться, 3) быть измеримыми согласно стандартным протоколам для широкого спектра растений и условий среды, 4) позволять устанавливать порядок (иерархию статусов) между видами, однозначно связанный с условиями среды. Обычно рассматриваются три относительно независимые группы признаков: 1) непосредственно связанные с поглощением ресурсов, 2) размеры растений и 3) способность к половому размножению (Westoby, 1998; Westoby et al., 2002). Функциональные признаки могут в значительной степени определять состав микробиома растений, т.е. обитающих в их тканях микроорганизмов, например, состав сообществ грибов арбускулярной микоризы (Chagnon et al., 2015).
Изучение функциональных признаков имеет много различных направлений, связанных: 1) с показателями функционального разнообразия сообществ (Garnier et al., 2016); 2) с экологическими факторами и их градиентами (Butterfield, Suding, 2013; Price et al., 2014; Shipley et al., 2017); 3) с оценкой филогенетического сигнала (степени филогенетического консерватизма) отдельных признаков (Swenson, 2014); 4) с ролью функциональных признаков в подборе видов, образующих сообщества, а также c ролью этих признаков в доминировании и конкурентоспособности видов в конкретных условиях (Kunstler et al., 2016; Aiello-Lammens et al., 2017). Последний подход, на наш взгляд, наиболее интересен, поскольку помогает приблизиться к решению важнейшей задачи экологии – выявлению механизмов формирования природных сообществ (Дудова и др., 2019; Онипченко и др., 2020). Однако он не очень распространен, так как требует весьма трудоемких исследований функциональных признаков, в нашем случае растений, для большого числа видов, образующих локальную флору, т.е. имеющих потенциальную возможность войти в состав анализируемого сообщества. Анализ индивидуальных функциональных признаков весьма важен, так как они часто лучше индицируют изменения условий среды по сравнению с индексами, основанными на многих признаках. Отдельные признаки хорошо соответствовали положению ксерофитных сообществ Калифорнии на градиентах абсолютной высоты и плотности почвы, а также были связаны с экосистемными функциями (Butterfield, Suding, 2013).
Обширные базы данных функциональных признаков охватывают многие наземные растительные сообщества, включая тундровые (Bjorkman et al., 2018; Thomas et al., 2019), но доля изученных высокогорных видов относительно мала в связи с высоким флористическим разнообразием альпийских областей (Onipchenko, Semenova, 1995). Кроме того, для выявления роли функциональных признаков в формировании сообществ необходимо иметь детальные данные по составу растительных сообществ с оценкой участия отдельных видов, например, по надземной биомассе. Наша работа посвящена применению именно этого подхода.
Согласно классическим взглядам Грайма (Grime, 2001), важнейшие факторы формирования растительных сообществ и эволюции экологических стратегий растений – это стресс и нарушения. Под стрессом понимаются любые факторы, ограничивающие фотосинтетическую продукцию растений до ее формирования (например, бедность почвы элементами минерального питания, низкие температуры, недостаток света и т.п.). Нарушения – это разрушение или изъятие произведенной растениями биомассы, которое может также повышать популяционную смертность (Grime, 2001). При разном сочетании этих факторов формируются три стратегии: стресс-толеранты, рудералы, конкуренты (Grime, 2001), впервые описанные Л.Г. Раменским (1935) под названиями “патиенты”, “эксплеренты”, “виоленты”. Длительное время отнесение растений к разным типам стратегий основывалось на анализе многих признаков (Onipchenko et al., 1998) или было экспертно-качественным (Работнов, 1985; Миркин, Наумова, 1998). В последние десятилетия появился ряд работ, позволяющих количественно оценить вклад различных стратегий, в том числе на базе анализа функциональных признаков (Pierce et al., 2013; Verheijen et al., 2016). Наиболее популярным здесь выступает метод, базирующийся на сравнении трех признаков листьев: сухой и водонасыщенной массы и площади листовой пластинки (Pierce et al., 2017). Эти три первичных признака имеют очень важное значение для функционирования растений, они позволяют рассчитывать и важные производные признаки, такие как удельная листовая поверхность (поверхность 1 г сухой массы листа; УЛП) или содержание сухого вещества в листе. Однако возможная роль этих признаков для формирования растительных сообществ, особенно в высокогорьях, остается малоизученной (Komac et al., 2015).
Проведено значительное число исследований, связывающих функциональные признаки растений со свойствами растительных сообществ. Так, для территории Нидерландов изучена связь распространения видов с 12 функциональными признаками растений по 43 типам наземной растительности. Функциональный состав объясняет до 80% флористических различий на базе семи функциональных признаков, что показывает их важную роль в формировании состава растительных сообществ. Почти все изученные признаки значимо отличались между сообществами (Douma et al., 2012). Для лугов Германии показано (Pfestorf et al., 2013), что функциональные признаки растений (УЛП, содержание сухого вещества, высота вылета семян, распределение листьев и начало цветения) на уровне средневзвешенных величин для сообществ хорошо отражают интенсивность землепользования, часто лучше, чем показатели разнообразия.
Изменения по топографическому градиенту и переходам леса в чапарраль в Калифорнии указывают на то, что средневзвешенные показатели связаны преимущественно со сменой видов, в то время как роль внутривидовой изменчивости функциональных признаков не очень значительна (Cornwell, Ackerly, 2009).
Для финбоша в Южной Африке была изучена связь факторов среды и функциональных признаков растений. По этим признакам хорошо различали сообщества разных классов растительности, которые были связаны с различным пожарным режимом (Aiello-Lammens et al., 2017).
Для оценки влияния абиотических факторов среды большое значение имеет учет не только средних значений признаков, но и их разброса внутри сообщества. По мнению Денелль с соавторами (Denelle et al., 2019), виды, обитающие в условиях, отклоняющихся от оптимальных значений функциональных признаков, имеют меньшее участие в составе сообществ. Средневзвешенные в сообществе значения признака и его дисперсия должны описывать оптимум и интенсивность работы экологического фильтра соответственно. Региональные границы значения признаков с большей вероятностью будут достигаться в сообществах на концах экологического градиента. Авторы назвали это явление эффектом пограничного значения признаков на градиенте (“trait-gradient boundary effect”). Конвергенция значений функциональных признаков листьев при экстремальных значениях факторов среды отражает скорее влияние этого эффекта, чем более сильного средового фильтра (Denelle et al., 2019).
Функциональные признаки оказывают большое влияние на конкурентоспособность растений, что было показано, например, при анализе огромного фактического материала по деревьям (3 млн деревьев на 140 000 площадках по всему миру), для которых были исследованы три функциональных признака (УЛП, плотность древесины и максимальная высота). Быстрый рост во всех биомах отрицательно коррелировал с плотностью древесины и положительно с УЛП. Низкая плотность древесины была связана с низкой устойчивостью к конкуренции и меньшим конкурентным влиянием на соседей (Kunstler et al., 2016). В Скандинавии исследованы функциональные признаки растений, колонизирующих морены отступающего ледника Almajallojekna. В сравнении с видами локального пула, эффективные колонизаторы шире распространены, имеют мелкие семена, чаще представлены видами из семейств Saxifragaceae, Salicaceae, Asteraceae (Franzen et al., 2019).
Для анализа изменения признаков по градиентам среды также рекомендуется использовать средневзвешенные оценки. Выделяют несколько типов градиентов: непрямой градиент (факторы среды, не влияющие прямо на растения – высота и широта местности, уклон и т.п.), ресурсный, прямой (нересурсные факторы, прямо влияющие на рост – например, температура, рН и т.п.), градиент нарушений (Garnier et al., 2016). Изменение средних и средневзвешенных значений функциональных признаков по градиентам среды различается. В исследовании Гарнье и соавторов (Garnier et al., 2016) была обобщена реакция различных функциональных признаков растений травяных сообществ на изменение ведущих факторов среды – доступность света и элементов минерального питания, сукцессионный статус и интенсивность выпаса.
Функциональные признаки доминирующих видов имеют большее значение для многих свойств растительных сообществ, включая, например, их продукцию (Cadotte, 2017). В эксперименте, проведенном китайскими исследователями (Luo et al., 2020), было показано, что биомасса сообществ сильнее зависит от средневзвешенных величин функциональных признаков (решающее влияние доминантов), чем от видового богатства или функциональной несхожести видов. Гипотеза Грайма (Grime, 1998) предполагает, что признаки доминирующих видов определяют свойства экосистем. С другой стороны, гипотеза комплементарности (Tilman, 2001; Petchey, Gaston, 2006) оговаривает, что именно присутствие разнообразных видов, использующих условия среды комплементарным способом, влияет на функционирование экосистем. По аналогии с относительной скоростью роста Гарнье с соавторами (Garnier et al., 2004) вводят понятие удельной первичной продукции экосистем (УППЭ) как отношение прироста биомассы к имеющейся биомассе. Средняя удельная скорость роста для всех видов положительно связана с УППЭ. Первичная продукция положительно связана со средневзвешенной по сообществу площадью листьев на субальпийских лугах Французских Альп (Gross et al., 2008). На альпийских лугах надземная продукция положительно связана с высотой растений и отрицательно – с содержанием сухого вещества в листьях (Quetier et al., 2007). В подтверждение гипотезы комплементарности установлены связи разнообразия со свойствами экосистем. Так, Шерер-Лоренцен (Scherer-Lorenzen, 2008) показал положительное влияние функционального разнообразия на скорость разложения опада. Однако в целом разнообразие объясняет относительно небольшую долю варьирования признаков экосистем. В целом гипотеза доминирования работает лучше, чем гипотеза комплементарности. Так, для дождевых лесов Южной Америки Финеган с соавторами (Finegan et al., 2015) показали, что многие средневзвешенные признаки значимо скоррелированы с надземной биомассой (УЛП, содержание азота в листьях, высота растений и др.), в то время как значимых корреляций с индексами функционального разнообразия не отмечено.
Признаки фотосинтезирующих органов (листьев и аналогичных им структур), такие как площадь, масса, УЛП или содержание сухого вещества, играют важную роль в жизни растений в сообществах, так как от них зависит интенсивность фотосинтеза, а следовательно, продукция, относительная скорость роста и конкурентоспособность растений. По этим признакам происходит дифференциация экологических ниш в растительном сообществе (Wagg et al., 2017). Наряду с высотой растений, УЛП является важнейшим признаком дифференциации травяных сообществ в Европе, поскольку определяет первую ось варьирования (вклад 23%) и отражает градиент между быстро растущими и медленно растущими видами растений (Ladouceur et al., 2019). УЛП также отражает влияние экологических факторов, связанных с зональностью и вертикальной поясностью в горах. Средневзвешенные для сообществ величины УЛП и ее варьирование снижаются при увеличении широты местности (свидетельство абиотического фильтра) (Hulshof et al., 2013). Средневзвешенные значения площади листа снижаются, содержание сухого вещества и азота в листе повышаeтся с увеличением абсолютной высоты в высокогорьях Новой Зеландии, в то время как значимых изменений по этому градиенту не отмечено у УЛП и содержания и фосфора (Kichenin et al., 2013). В тропических лесах Китая УЛП являлась хорошим индикатором ряда экологических факторов, таких как содержание в почве воды, ее рН, содержание общего фосфора, общего и доступного растениям азота в почве (Jiang et al., 2015). Несмотря на высокую экологическую пластичность и значительную внутривидовую вариабельность признаков листьев, в лесных сообществах 79% изменчивости размеров листа приходится на видовой уровень (Messier et al., 2017). Интересно отметить, что такой функциональный признак, как содержание сухого вещества в водонасыщенном листе, имел наибольшее влияние на популяционную стабильность (меньшее колебание биомассы по годам) в луговом сообществе в Чехии (Majekova et al., 2014), что было связано с низким содержанием воды у наиболее стабильных видов консервативной (стресс-толерантной) стратегии.
На основании анализа большого числа публикаций можно сделать вывод о широком использовании функционального подхода для анализа сообществ, но редком его применении для решения двух связанных вопросов: 1) насколько виды, входящие в состав сообщества, отличаются по средним значениям тех или иных функциональных признаков от случайных выборок (с таким же числом видов) местной флоры; 2) насколько средние значения функциональных признаков видов в сообществе отличаются от средневзвешенных (по участию видов), или, иными словами, насколько эти признаки лучше или хуже выражены у доминантов по сравнению со всеми остальными видами (Онипченко и др., 2020). Задача настоящей работы – ответ на эти вопросы на примере альпийских сообществ Северо-Западного Кавказа.
МАТЕРИАЛЫ И МЕТОДЫ
Функциональные признаки изучали в альпийских фитоценозах четырех типов, занимающих максимальные площади в альпийском поясе Северо-Западного Кавказа: альпийские лишайниковые пустоши (АЛП), пестроовсяницевые луга (ПЛ), гераниево-копеечниковые луга (ГКЛ) и альпийские ковры (АК). Их более детальное описание приводится в ряде публикаций (Onipchenko, 2002; Elumeeva et al., 2015). Альпийские пустоши занимают наветренные гребни и склоны. В этих сообществах доминируют Vaccinium vitis-idaea L., Festuca ovina L., Carex sempervirens Vill., C. umbrosa Host, Trifolium polyphyllum C.A.Mey., Antennaria dioica (L.) Gaertn., Campanula tridentata Schreb. (номенклатура дана по списку видов Тебердинского заповедника – Онипченко и др., 2011). Проективное покрытие сосудистых растений составляет около 30–40%, а лишайников – 35–50% (Онипченко, 1985). Пестроовсяницевые луга занимают склоны южной экспозиции. Доминантом в этих сообществах является Festuca varia Haenke. Проективное покрытие составляет 70–90%. Гераниево-копеечниковые луга занимают нижние части склонов различных аспектов и являются наиболее высокопродуктивными альпийскими сообществами (Онипченко, 1990). Доминантами являются два вида: Hedysarum caucasicum M.Bieb. и Geranium gymnocaulon DC. Альпийские ковры формируются в западинах и характеризуются большим снегонакоплением (3–4 м) и коротким вегетационным сезоном. Доминанты – Sibbaldia procumbens L., Minuartia aizoides (Boiss.) Bornm. и Taraxacum stevenii (Spreng.) DC. Исследования проводили на территории ФГБУ “Тебердинский государственный природный биосферный заповедник”.
Участие видов оценивали по их надземной биомассе. Использовали данные, полученные в результате исследований прошлых лет (Онипченко, 1990). В каждом из четырех альпийских сообществ были взяты укосы на пробных площадках размером 25 × 25 см (0.0625 м2). На альпийских пустошах взято 104 укоса, в других типах сообществ – по 92. Укосы были разобраны по видам и высушены перед взвешиванием не менее 8 ч при температуре 80–105°С. Отбор укосов проводили в середине и конце августа после пика цветения. В надземную биомассу включали как зеленые части растений, так и ветошь текущего года (Онипченко, 1990).
Для измерения изучаемых функциональных признаков собирали по 10 хорошо развитых, неповрежденных листьев срединной формации внутри одной популяции для каждого вида. Для растений высотой менее 5 см собирали целые побеги, отбор листьев проводили в лаборатории. Сбор материала и его дальнейшую обработку осуществляли согласно международным протоколам исследований (Cornelissen et al., 2003; Pérez-Harguindeguy et al., 2013). С момента сбора до момента обработки листья хранили в охлажденных контейнерах, затем помещали в лабораторный холодильник. Перед помещением в холодильник обновляли срезы на черешках или побегах, помещали в воду, накрывали полиэтиленовыми пакетами и оставляли на 6–8 ч в холодильнике (+4°C) для насыщения листьев водой.
Листья в водонасыщенном состоянии обсушивали бумажным полотенцем и взвешивали на аналитических весах (точность до 0.1 мг) для получения массы листа в водонасыщенном состоянии. Затем размещали взвешенные листья на листе бумаги и сканировали с разрешением 300 dpi для листьев среднего и крупного размера и 600 dpi для мелких листьев длиной по средней жилке менее 1.5 см. В дальнейшем по полученным изображениям рассчитывали площадь листа. Отсканированные листья помещали в бумажные конверты и высушивали не менее 24 ч в сушильном шкафу при температуре 80°С. После этого взвешивали повторно каждый лист для получения массы сухого листа.
На основании данных по массе обводненного и высушенного листа, а также сканированных изображений рассчитывали такие признаки, как обводненность листьев, их площадь и удельную листовую поверхность. Обводненность листьев рассчитывали в процентах по формуле:
Для вычисления площади оценивали площадь листа в пикселях, а затем переводили ее в см2 по формуле:
Статистическую обработку данных проводили в среде R version 3.6.3 (2020-02-29) (RStud Version 1.1.463). Базовую обработку массива данных осуществляли с помощью пакетов base (R Core Team, 2020), dplyr (Wickham et al., 2021), plyr (Wickham, 2011). Расчет средних и средневзвешенных значений проводили в специализированном пакете FD (Laliberté et al., 2014). Расчет средних и средневзвешенных значений каждого признака проводили для пробных площадей отбора биомассы. Затем полученные значения усредняли для получения средних значений для сообщества в целом.
Для рандомизации данных случайным образом (функция sample пакета base (R Core Team, 2020)) выбирали значения функциональных признаков видов из общего пула, содержащего 197 видов (база для функциональных признаков высокогорных растений Тебердинского заповедника). Биомассу, число видов внутри фитоценоза и другие параметры оставляли те же, что были показаны для естественных сообществ. Проводили 1000 итераций по тому же алгоритму, что и для “реальных” сообществ, затем усредняли полученные значения. Сравнение средних проводили с помощью непараметрического теста Краскела–Уоллеса, а также апостериорного теста Тьюки (пакет stats (R Core Team, 2020)). Полученные данные визуализировали с помощью пакета ggplot2 (Wickham, 2016). Эти методы основаны на результатах исследований Борджи с соавторами (Borgy et al., 2017), установивших, что точность оценки средневзвешенных показателей мало зависит от повторности измерений внутри вида, но сильно зависит от участия (покрытия) растений, для которых имеются измерения функциональных признаков.
РЕЗУЛЬТАТЫ
В большинстве случаев получены как значимые различия средних значений функциональных признаков листьев между видами в составе сообществ по сравнению со “случайными” выборками видов из альпийской флоры заповедника (рис. 1), так и существенная связь доминирования в изучаемых сообществах с рассматриваемыми признаками (отличия средних и средневзвешенных значений внутри сообщества – рис. 2).
Рис. 1.
Сравнение средних значений функциональных признаков для наблюдаемых в природе и модельных растительных сообществ. Функциональные признаки: а – масса обводненного листа, г; б – масса сухого листа, г; в – содержание сухого вещества, г; г – площадь листа, см2; д – удельная листовая поверхность, см2/г. Латинскими буквами (a, b, c, d, e, f, g, h) указана значимость отличий между разными выборками, значимо не отличающиеся величины указаны одинаковыми буквами. Темно-серым цветом показаны значения для модельных сообществ (М), светло-серым цветом – для наблюдаемых в природе (Н). АЛП – альпийские лишайниковые пустоши, ПЛ – пестроовсяницевые луга, ГКЛ – гераниево-копеечниковые луга, АК – альпийские ковры.
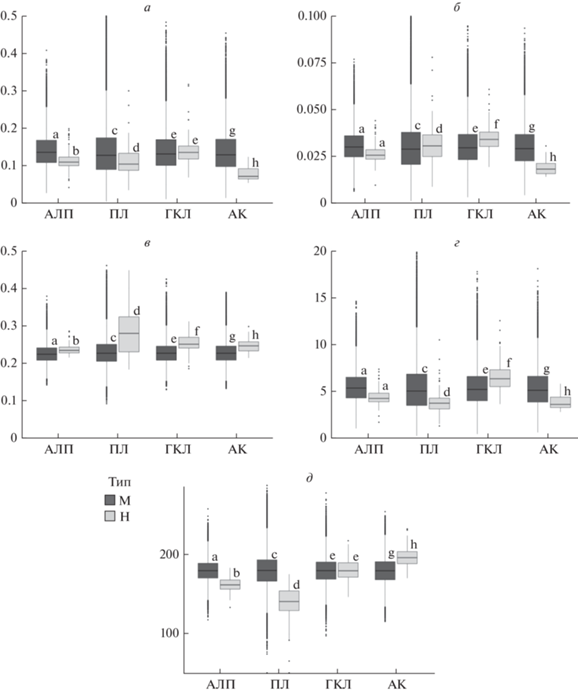
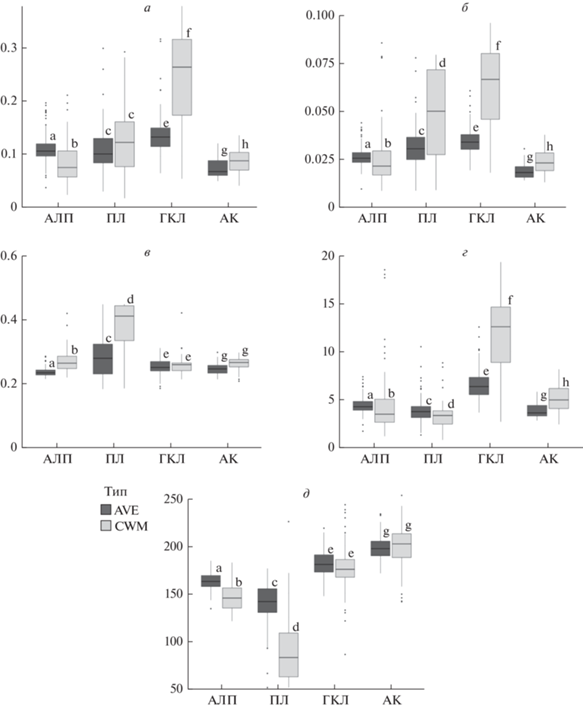
Рис. 2.
Сравнение средних и средневзвешенных значений функциональных признаков для четырех альпийских фитоценозов. Функциональные признаки: а – масса обводненного листа, г; б – масса сухого листа, г; в – содержание сухого вещества, г; г – площадь листа, см2; д – удельная листовая поверхность, см2/г. Латинскими буквами (a, b, c, d, e, f, g, h) указана значимость отличий между разными выборками. Темно-серым цветом показаны средние значения по выборкам (AVE), светло-серым цветом – средневзвешенные значения (CWM). АЛП – альпийские лишайниковые пустоши, ПЛ – пестроовсяницевые луга, ГКЛ – гераниево-копеечниковые луга, АК – альпийские ковры.
Рассмотрим полученные результаты по отдельным сообществам.
Листья альпийских растений, входящих в состав низкопродуктивных альпийских лишайниковых пустошей (АЛП), в водонасыщенном состоянии имели значимо меньшую массу и УЛП, но большее содержание сухого вещества по сравнению с наборами видов “случайных” сообществ. По сравнению с остальными видами, доминанты этого сообщества имели более мелкие листья (как по массе, так и по площади) с большим содержанием сухого вещества и меньшей УЛП (рис. 1, 2).
Листья растений пестроовсяницевых лугов (ПЛ) имели меньшую площадь и массу в водонасыщенном состоянии, но большую – в сухом, что обуславливает и пониженные значения УЛП, и повышенное содержание сухого вещества. Доминирующие виды этого сообщества (в первую очередь Festuca varia) имели более высокую массу листа в сухом состоянии и большее содержание сухого вещества в листе, но меньшую площадь и УЛП (рис. 1, 2).
Растения относительно высокопродуктивных гераниево-копеечниковых лугов (ГКЛ) имели более крупные листья (по площади и сухой массе) и большее содержание сухого вещества по сравнению с видами из “случайных” выборок. В то же время они не различались по массе водонасыщенного листа и УЛП, таким образом, эти показатели не являются важными при подборе видов, образующих ГКЛ. Только три размерных признака (площадь, масса водонасыщенного и сухого листа) были значимо выше у доминантов ГКЛ по сравнению с другими видами этого сообщества, УЛП и содержание сухого вещества не имели здесь значимых различий (рис. 1, 2).
Растения альпийских ковров (АК), развивающиеся в условиях позднего схода снега и ограниченного вегетационного периода, имеют более мелкие листья (по массе и площади) по сравнению со “случайной” выборкой из альпийской флоры. У них также повышены содержание сухого вещества и УЛП. Доминанты этих сообществ, напротив, имеют более крупные листья (по массе и площади) по сравнению с другими видами этого сообщества. Содержание сухого вещества и УЛП у доминирующих видов альпийских ковров значимо не отличаются от остальных видов (рис. 1, 2).
ОБСУЖДЕНИЕ
Основной результат нашего исследования свидетельствует о том, что функциональные признаки листьев растений важны как для возможности произрастания видов в составе альпийских сообществ, так и для доминирования в них. Отбор видов, входящих в состав сообществ, происходит в зависимости от соответствия их признаков как абиотическим, так и биотическим факторам. Можно предположить, что общий состав больше зависит от внешних экологических факторов, в то время как доминирование больше связано с биотическими взаимодействиями, такими как конкуренция или благоприятствование. Важнейшим внешним фактором в альпийском поясе выступает длина вегетационного периода. Аналогично нашим данным, для горно-луговых сообществ во Франции показано (Borgy et al., 2017), что функциональные параметры листьев значимо меняются по градиенту длительности вегетационного периода, связанного с ограничением температурного или водного режима. Средневзвешенные величины в локальных сообществах являются ключевыми для корректной оценки связи с параметрами среды, но связь между функциональными признаками сообществ и длительностью вегетационного периода ослабевает при увеличении богатства почвы элементами минерального питания (Borgy et al., 2017).
Наши предыдущие исследования (Onipchenko et al., 2020) показали, что внутривидовое варьирование функциональных признаков листьев альпийских растений не во всех случаях совпадает по направлению с таковым для средневзвешенных значений этих признаков в сообществах. Например, внутривидовые изменения УЛП и содержания сухого вещества больше соответствовали положению сообществ, в которых произрастают изучаемые виды, на градиенте снежности, чем средневзвешенным показателям этих сообществ. Напротив, размерные характеристики листьев (масса и площадь) внутри видов изменялись в соответствии со средневзвешенными оценками, а не положением на экологическом градиенте мощности снежного покрова. Это свидетельствует о том, что участие (доминирование) видов в составе сообществ важно для значений функциональных признаков (они могут увеличивать свое значение при переходе вида от “подчиненного” к доминирующему положению) (Onipchenko et al., 2020).
В целом размерные признаки растений обычно связаны с продукцией и богатством почвы, что было показано, например, для лугов Эстонии, приуроченных к карбонатным породам (Price et al., 2017). Это подтверждается и нашими наблюдениями, где на более высокопродуктивных лугах (ГКЛ) как в среднем все виды имели более крупные листья по сравнению с другими видами, произрастающими в альпийском поясе, так и доминанты имели более крупные листья по сравнению с другими видами этого сообщества. Но далеко не во всех изученных сообществах параметры листьев являются важными для доминирования растений. Например, для прибрежных песчаных пустынь Бразилии с открытой кустарниковой растительностью было показано, что доминирование не зависит от рассматриваемыx признаков листьев (УЛП, площадь листа и содержание сухого вещества) (Rosado, Mattos, 2017).
Ранее нами в сравнительном аспекте были проанализированы экологические стратегии (в системе CSR стратегий Грайма) растений рассматриваемых альпийских сообществ (Онипченко и др., 2020). Было показано, что на фоне общего преобладания стресс-толерантной стратегии у альпийских растений во всех сообществах (особенно на АЛП и ПЛ) на более продуктивных ГКЛ лучше выражена конкурентная стратегия, а на АК с коротким вегетационным периодом – рудеральная. Результаты анализа отдельных функциональных признаков листьев, полученные в настоящей работе, хорошо согласуются с этими закономерностями. Рассмотрим эти закономерности на основании полученных в данной работе результатов.
Растения стресс-толерантной стратегии характеризуются относительно мелкими листьями, низкой УЛП и высоким содержанием сухого вещества (Pierce et al., 2017). Этими признаками в большей степени обладают растения, как входящие в состав АЛП и ПЛ, так и доминирующие в них. Эти данные подтверждают высокую роль признаков стресс-толерантности в формировании этих сообществ и доминировании в них. В обоих сообществах (но особенно на ПЛ) невысока роль конкуренции (Onipchenko et al., 2009), а “стрессовость” АЛП обусловлена бедностью почвы элементами минерального питания из-за промерзания почвы в связи с отсутствием или малой мощностью снежного покрова (Onipchenko, 1994).
Растения относительно высокопродуктивных ГКЛ имели не только более крупные листья (признак сильных конкурентов (Pierce et al., 2017)), но и высокое содержание сухого вещества (признак стресс-толерантности) по сравнению с видами из “случайных” выборок. Размерные признаки (площадь, масса водонасыщенного и сухого листа) были значимо выше у доминантов ГКЛ по сравнению с другими видами этого сообщества, что подтверждает сильную выраженность конкурентной стратегии у доминантов более продуктивных альпийских лугов.
Растения АК имели более мелкие листья (по массе и площади) по сравнению со “случайной” выборкой из альпийской флоры. У них также повышены содержание сухого вещества и УЛП. Эти показатели говорят как о выраженности стресс-толерантности (мелкие листья, повышенное содержание сухого вещества), так и рудеральности (мелкие листья, высокая УЛП – показатель более интенсивного фотосинтеза). У доминантов этого сообщества более крупные листья (по массе и площади) свидетельствуют о лучшей выраженности черт конкурентов.
Список литературы
Дудова К.В., Атабаллыев Г.Г., Ахметжанова А.А., Гулов Д.М., Дудов С.В. и др., 2019. Высота как функциональный признак альпийских растений // Бюлл. МОИП. Отд. биол. Т. 124. № 1. С. 33–46.
Миркин Б.М., Наумова Л.Г., 1998. Наука о растительности. Уфа: Гилем. 413 с.
Онипченко В.Г., 1985. Структура, фитомасса и продуктивность альпийских лишайниковых пустошей // Бюлл. МОИП. Отд. биол. Т. 90. № 1. С. 59–66.
Онипченко В.Г., 1990. Фитомасса альпийских сообществ северо-западного Кавказа // Бюлл. МОИП. Отд. биол. Т. 95. № 6. С. 52–62.
Онипченко В.Г., Зернов А.С., Воробьева Ф.М., 2011. Сосудистые растения Тебердинского заповедника. М.: МаксПресс. 144 с.
Онипченко В.Г., Дудова К.В., Ахметжанова А.А., Хомутовский М.И., Джатдоева Т.М. и др., 2020. Какие стратегии растений способствуют их доминированию в альпийских сообществах? // Журн. общ. биологии. Т. 81. № 2. С. 37–46.
Работнов Т.А., 1985. О типах стратегии растений // Экология. № 3. С. 3–12.
Раменский Л.Г., 1935. О принципиальных установках, основных понятиях и терминах производственной типологии земель, геоботаники и экологии // Сов. ботаника. № 4. С. 25–40.
Aiello-Lammens M.E., Slingsby J.A., Merow C., Mollmann H.K., Euston-Brown D. et al., 2017. Processes of community assembly in an environmentally heterogeneous, high biodiversity region // Ecography. V. 40. № 4. P. 561–576.
Bjorkman A.D., Myers-Smith I.H., Elmendorf S.C., Normand S., Thomas H.J.D. et al., 2018. Tundra Trait Team: A database of plant traits spanning the tundra biome // Glob. Ecol. Biogeogr. V. 27. № 12. P. 1402–1411.
Borgy B., Violle C., Choler P., Garnier E., Kattge J. et al., 2017. Sensitivity of community-level trait-environment relationships to data representativeness // Glob. Ecol. Biogeogr. V. 26. № 6. P. 729–739.
Butterfield B.J., Suding K.N., 2013. Single-trait functional indices outperform multi-trait indices in linking environmental gradients and ecosystem services in a complex landscape // J. Ecol. V. 101. № 1. P. 9–17.
Cadotte M.W., 2017. Functional traits explain ecosystem function through opposing mechanisms // Ecol. Lett. V. 20. № 8. P. 989–996.
Chagnon P.-L., Bradley R.L., Klironomos J.N., 2015. Trait-based partner selection drives mycorrhizal network assembly // Oikos. V. 124. № 12. P. 1609–1616.
Cornelissen J.H.C., Lavorel S., Garnier E., Diaz S., Buchmann N. et al., 2003. A handbook of protocols for standardised and easy measurements of plant functional traits worldwide // Aust. J. Bot. V. 51. № 4. P. 335–380.
Cornwell W.K., Ackerly D.D., 2009. Community assembly and shifts in plant trait distributions across an environmental gradient in coastal California // Ecol. Monogr. V. 79. № 1. P. 109–126.
Denelle P., Violle C., Munoz F., 2019. Distinguishing the signatures of local environmental filtering and regional trait range limits in the study of trait-environment relationships // Oikos. V. 128. № 7. P. 960–971.
Douma J.C., Aerts R., Witte J.P.M., Bekker R.M., Kunzmann D. et al., 2012. A combination of functionally different plant traits provides a means to quantitatively predict a broad range of species assemblages in NW Europe // Ecography. V. 35. № 4. P. 364–373.
Elumeeva T.G., Onipchenko V.G., Rovnaia E.N., Wu Y., Werger M.J.A., 2015. Alpine plant communities of Tibet and Caucasus: in quest of functional convergence // Botanica Pacifica. V. 4. № 1. P. 1–10.
Finegan B., Peña-Claros M., Oliveira A., de, Ascarrunz N., Bret-Harte M.S. et al., 2015. Does functional trait diversity predict aboveground biomass and productivity of tropical forests? Testing three alternative hypotheses // J. Ecol. V. 103. № 1. P. 191–201.
Fisher R.A., 1930. The Genetical Theory of Natural Selection. 1st ed. Oxford: Clarendon. 308 p.
Franzen M., Dieker P., Schrader J., Helm A., 2019. Rapid plant colonization of the forelands of a vanishing glacier is strongly associated with species traits // Arct. Antarct. Alp. Res. V. 51. № 1. P. 366–378.
Garnier E., Navas M.L., Grigulis K., 2016. Plant Functional Diversity. Oxford: Oxford Univ. Press. 249 p.
Garnier E., Cortez J., Billès G., Navas M.-L., Roumet C., et al., 2004. Plant functional markers capture ecosystem properties during secondary succession // Ecology. V. 85. № 9. Р. 2630–2637.
Grime J.P., 1998. Benefits of plant diversity to ecosystems: immediate, filter, and founder effects // J. Ecol. V. 86. № 6. P. 902–910.
Grime J.P., 2001. Plant Strategies, Vegetation Processes, and Ecosystem Properties. 2nd ed. Chichester: John Wiley and Sons. 417 p.
Gross N., Robson T.M., Lavorel S., Albert C., Le Bagousse-Pinguet Y., Guillemin R., 2008. Plant response traits me-diate the effects of subalpine grasslands on soil moisture // New Phytol. V. 180. P. 652–662.
Hulshof C.M., Violle C., Spasojevic M.J., McGill B., Damschen E. et al., 2013. Intra-specific and inter-specific variation in specific leaf area reveal the importance of abiotic and biotic drivers of species diversity across elevation and latitude // J. Veg. Sci. V. 24. № 5. P. 921–931.
Jiang Y., Zang R., Lu X., Huang Y., Ding Y. et al., 2015. Effects of soil and microclimatic conditions on the community-level plant functional traits across different tropical forest types // Plant Soil. V. 390. № 1–2. P. 351–367.
Kichenin E., Wardle D.A., Peltzer D.A., Morse C.W., Freschet G.T., 2013. Contrasting effects of plant inter- and intraspecific variation on community-level trait measures along an environmental gradients // Funct. Ecol. V. 27. № 5. P. 1254–1261.
Komac B., Pladevall C., Penuelas J., Conesa J.V., Domenech M., 2015. Variations in functional diversity in snowbed plant communities determining snowbed continuity // Plant Ecol. V. 216. № 9. P. 1257–1274.
Kunstler G., Falster D., Coomes D.A., Hui F., Kooyman R.M. et al., 2016. Plant functional traits have globally consistent effects on competition // Nature. V. 529. № 7585. P. 204–207.
Ladouceur E., Bonomi C., Bruelheide H., Klimesova J., Burrascano S. et al., 2019. The functional trait spectrum of European temperate grasslands // J. Veg. Sci. V. 30. № 5. P. 777–788.
Laliberté E., Legendre P., Shipley B., 2014. FD: measuring functional diversity from multiple traits, and other tools for functional ecology. R package version 1.0-12. https://cran.r-project.org/web/packages/FD/index.html
Laughlin D.C., Gremer J.R., Adler P.B., Mitchell R.M., Moore M.M., 2020. The net effect of functional traits on fitness // Trends Ecol. Evol. V. 35. № 11. P. 1037–1047.
Lavorel S., Díaz S., Cornelissen J.H.C., Garnier E., Harrison S.P. et al., 2007. Plant functional types: Are we getting any closer to the Holy Grail? // Terrestrial Ecosystems in a Changing World. Berlin: Springer-Verlag. P. 149–164.
Luo S., Schmid B., Wagg C., Chen Y., Jiang B. et al., 2020. Community-wide trait means and variations affect biomass in a biodiversity experiment with tree seedlings // Oikos. V. 129. № 6. P. 799–810.
Majekova M., Bello F., de, Dolezal J., Leps J., 2014. Plant functional traits as determinants of population stability // Ecology. V. 95. № 9. P. 2369–2374.
Messier J., McGill B.J., Enquist B.J., Lechowicz M.J., 2017. Trait variation and integration across scales: Is the leaf economic spectrum present at local scales? // Ecography. V. 40. № 6. P. 685–697.
Onipchenko V.G., 1994. The structure and dynamics of alpine plant communities in the Teberda Reserve, the Northwestern Caucasus // Oecologia Montana. V. 3. № 1. P. 40–50.
Onipchenko V.G., 2002. Alpine Vegetation of the Teberda Reserve, the Northwestern Caucasus. Zurich: Geobotanischen Institutes der ETH, Stiftung Rubel. 168 p.
Onipchenko V.G., Semenova G.V., 1995. Comparative analysis of the floristic richness of alpine communities in the Caucasus and the Central Alps // J. Veg. Sci. V. 6. № 2. P. 299–304.
Onipchenko V.G., Semenova G.V., Maarel E., van der, 1998. Population strategies in severe environments: Alpine plants in the northwestern Caucasus // J. Veg. Sci. V. 9. № 1. P. 27–40.
Onipchenko V.G., Blinnikov M.S., Gerasimova M.A., Volkova E.V., Cornelissen J.H.C., 2009. Experimental comparison of competition and facilitation in alpine communities varying in productivity // J. Veg. Sci. V. 20. № 4. P. 718–727.
Onipchenko V.G., Rozhin A.O., Smirnov V.E., Akhmetzhanova A.A., Elumeeva T.G. et al., 2020. Do patterns of intra-specific variability and community weighted-means of leaf traits correspond? An example from alpine plants // Botanica Pacifica. V. 9. № 1. P. 53–61.
Pérez-Harguindeguy N., Diaz S., Garnier E., Lavorel S., Poorter H. et al., 2013. New handbook for standardized measurement of plant functional traits worldwide // Aust. J. Bot. V. 61. № 3. P. 167–234.
Petchey O.L., Gaston K.J., 2006. Functional diversity: back to basics and looking forward // Ecol. Lett. V. 9. P. 741–758.
Pfestorf H., Weiss L., Müller J., Boch S., Socher S.A. et al., 2013. Community mean traits as additional indicators to monitor effects of land-use intensity on grassland plant diversity // Perspect. Plant Ecol. Evol. Syst. V. 15. № 1. P. 1–11.
Pierce S., Brusa G., Vagge I., Cerabolini B.E.L., 2013. Allocating CSR plant functional types: The use of leaf economics and size traits to classify woody and herbaceous vascular plants // Funct. Ecol. V. 27. № 4. P. 1002–1010.
Pierce S., Negreiros D., Cerabolini B.E.L., Kattge J., Diaz S. et al., 2017. A global method for calculating plant CSR ecological strategies applied across biomes world-wide // Funct. Ecol. V. 31. № 2. P. 444–457.
Price J.N., Gazol A., Tamme R., Hiiesalu I., Partel M., 2014. The functional assembly of experimental grasslands in relation to fertility and resource heterogeneity // Funct. Ecol. V. 28. № 2. P. 509–519.
Price J., Tamme R., Gazol A., Bello F., de, Takkis K. et al., 2017. Within-community environmental variability drives trait variability in species-rich grasslands // J. Veg. Sci. V. 28. № 2. P. 303–312.
Quétier F., Thébault A., Lavorel S., 2007. Plant traits in a state and transition framework as markers of ecosystem response to land-use change // Ecol. Monogr. V. 77. P. 33–52.
R Core Team, 2020. The R Foundation for Statistical Computing. https://www.R-project.org/
Rosado B.H.P., Mattos E.A., de, 2017. On the relative importance of CSR ecological strategies and integrative traits to explain species dominance at local scales // Funct. Ecol. V. 31. № 10. P. 1969–1974.
Scherer-Lorenzen M., 2008. Functional diversity affects decomposition processes in experimental grasslands // Funct. Ecol. V. 22. P. 547–555.
Shipley B., Belluau M., Kühn I., Soudzilovskaia N.A., Bahn M. et al., 2017. Predicting habitat affinities of plant species using commonly measured functional traits // J. Veg. Sci. V. 28. № 5. P. 1082–1095.
Swenson N.G., 2014. Phylogenetic imputation of plant functional trait databases // Ecography. V. 37. № 2. P. 105–110.
Thomas H.J.D., Myers-Smith I.H., Bjorkman A.D., Elmendorf S.C., Blok D. et al., 2019. Traditional plant functional groups explain variation in economic but not size-related traits across the tundra biome // Glob. Ecol. Biogeogr. V. 28. № 2. P. 78–95.
Tilman D., 2001. Functional diversity // Encyclopedia of Biodiversity. V. 3 / Ed. Levin S.A. San Diego: Academic Press. Р. 109–120.
Verheijen L.M., Aerts R., Bönisch G., Kattge J., Bodegom P.M., van, 2016. Variation in trait trade-offs allows differentiation among predefined plant functional types: Implications for predictive ecology // New Phytol. V. 209. № 2. P. 563–575.
Wagg C., Ebeling A., Roscher C., Ravenek J., Bachmann D. et al., 2017. Functional trait dissimilarity drives both species complementarity and competitive disparity // Funct. Ecol. V. 31. № 12. P. 2320–2329.
Westoby M., 1998. A leaf-height-seed (LHS) plant ecology strategy scheme // Plant Soil. V. 199. № 2. P. 213–227.
Westoby M., Falster D.S., Moles A.T., Vesk P.A., Wright I.J., 2002. Plant ecological strategies: Some leading dimensions of variation between species // Annu. Rev. Ecol. Syst. V. 33. P. 125–159.
Wickham H., 2011. The split-apply-combine strategy for data analysis // J. Stat. Softw. V. 40. № 1. P. 1–29.
Wickham H., 2016. ggplot2: Elegant Graphics for Data Analysis. N.-Y.: Springer-Verlag. 268 p.
Wickham H., François R., Henry L., Müller K., 2021. dplyr: A Grammar of Data Manipulation. R package version 1.0.7. https://CRAN.R-project.org/package=dplyr
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


