Журнал общей биологии, 2022, T. 83, № 2, стр. 83-105
Влияние потребления пищи на функционирование пульсаторно-реверсивной распределительной системы у гидроидов – идиографический подход
Н. Н. Марфенин 1, *, В. С. Дементьев 1, 2
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет,
кафедра зоологии беспозвоночных
119234 Москва,
Ленинские горы, Россия
2 Национальный исследовательский университет “Высшая школа экономики”, факультет биологии и биотехнологии
101000 Москва, Мясницкая ул., 20, Россия
* E-mail: marf47@mail.ru
Поступила в редакцию 01.01.2022
После доработки 14.01.2022
Принята к публикации 17.01.2022
- EDN: KAHECT
- DOI: 10.31857/S0044459622020038
Аннотация
На примере колониального гидроида Dynamena pumila (L., 1758) (Leptothecata, Sertulariidae) изучена реакция пульсаторно-реверсивной распределительной системы на кормление. В основе исследования углубленный индивидуальный анализ перемещения гидроплазмы в столоне у трех близких по строению небольших колоний D. pumila, которые содержались в одинаковых условиях. Методом дозированного кормления колонии получали свежевылупившихся науплиев Artemia salina в трех вариантах: а) проксимальный крупный материнский побег, от которого выросла колония; б) два дистальных дочерних побега вблизи верхушки роста столона; в) три средних дочерних побега. Сразу после кормления в течение 90 мин ежеминутно регистрировали направление гидроплазматических течений (ГПТ) во всех модулях столона колонии, отмечая только направление и насыщенность пищевыми частицами. Затем сразу же методом цейтраферной микровидеосъемки регистрировали ГПТ в ближайшем к материнскому побегу модуле столона в течение 1.5–2 ч. Повторяли исследование на тех же колониях спустя 20–28 ч после кормления. Установлено, что у всех колоний после кормления увеличиваются протяженность и продолжительность ГПТ, максимальная скорость ГПТ, объем перенесенной гидроплазмы каждым ГПТ и суммарно за единицу времени, при этом сокращается продолжительность фаз покоя. Полученные результаты свидетельствуют об увеличении интенсивности интеграции колонии после получения ограниченного количества пищи. Одновременно подтверждена гипотеза о недостаточности пульсаций отдельного побега для обеспечения трансколониальных ГПТ. Методом ежеминутного сканирования ГПТ по модулям столона установлено, что перемещение частиц пищи по колонии от одного ее конца до противоположного обеспечивается не только за счет пульсаций побегов, получивших пищу, но и всех остальных побегов. Описанный механизм функционирования ГПТ действует и при отсутствии пищи, хотя объемы перемещаемой гидроплазмы при этом меньше. Идиографический подход позволил выявить индивидуальные различия по каждому параметру и обнаружить количественные расхождения по результатам в зависимости от места получения пищи в колонии. Простое усреднение скрывало эти различия, которые могут быть существенны для понимания многофакторной зависимости функционирования распределительной системы в модульном организме, отличающeмся неопределенностью сочетания множества равнозначных процессов, например, пульсаций гидрантов.
Пульсаторно-реверсивная11, или обратимая, распределительная система редко встречается в животном мире (Марфенин, 2016). Она свойственна многим гидроидам. Жидкость (гидроплазма), заполняющая общую полость колониального организма, в такой распределительной системе движется под воздействием поперечных сокращений гидрантов и ценосарка с изменяющейся скоростью попеременно в двух противоположных направлениях внутри ценосаркальной трубки: то к верхушке столона или побега, то от них. В такой распределительной системе нет единообразия, хотя общие закономерности все же существуют (Марфенин, 1985а).
Тем не менее неупорядоченное, на первый взгляд, перемещение гидроплазмы сочетается с эффективностью выполнения основной функции распределительной системы – транспорта пищи из мест ее получения к местам наибольшего роста разветвленного тела модульного организма (Косевич, 1991; Бурыкин, 2010, 2013, 2015; Марфенин, Дементьев, 2017, 2019, 2020).
Этот путь от гидрантов, захвативших пищу, к верхушкам роста столонов и побегов может быть весьма разнообразным как по продолжительности и протяженности, так и по траектории движения: с заходом в промежуточные ответвления трубковидного ценосарка или напрямую. Места захвата пищи и первичного ее переваривания также варьируют чрезвычайно. В модульном организме многие органы полимеризованы и расположены в различных частях разветвленного тела, как у колониальных гидроидов.
Колониальные гидроиды имеют множество ротовых отверстий, поэтому поступление пищи у них в значительной мере случайно по местоположению. Сами гидранты менее всего нуждаются в пище. У многих видов гидроидов сформированные гидранты не растут. Они функционируют от нескольких дней до двух недель, после чего деградируют (Марфенин, 1993а, б). В гидрантах пища подвергается частичному перевариванию, когда жертва распадается на части – агрегаты клеток. При регулярных сжатиях гидрантов полупереваренная пища выдавливается в общую полость ценосарка разветвленного модульного организма. Однако до мест, более всего нуждающихся в пище, оказывается значительное расстояние и путь с множеством ответвлений.
Рост гидроидов ограничен локальными зонами, хотя пролиферация клеток происходит по всему ценосарку (Suddith, 1974; Марфенин и др., 1999). Преобладает рост в верхушках побегов и столонов (Kühn, 1909; Марфенин, Дементьев, 2018а). При избытке пищи к росту добавляется ветвление, т.е. образование новых зон роста в определенных местах побегов и столонов. Рост осуществляется за счет клеточной пролиферации. Часть клеток может мигрировать в зоны роста из соседних участков, часть клеток образуется непосредственно в зонах роста (Braverman, 1969; Beloussov et al., 1972; Косевич, 1999; Марфенин и др., 1999). В любом случае именно локальные зоны роста и прилегающие к ним участки тела более всего нуждаются в пище (Marfenin, Dementyev, 2017). Неравномерность распределения зон роста в модульном организме позволяет считать, что и потребность в пище неравномерна в различных частях колониального организма (Марфенин, 1993а, б). Транспортировка пищи от зон наиболее интенсивного питания к зонам роста осуществляется за счет перемещения гидроплазмы внутри ценосарка. Это достигается двумя разными способами.
У одних гидроидов полость ценосарка подразделена тонким мезентерием на два продольных канала, по которым гидроплазма движется за счет работы жгутиков гастродермы в двух противоположных направлениях (Марфенин, 1985б). В такой распределительной системе перемещение гидроплазмы равномерное и непрерывное (Parrin et al., 2010).
У других гидроидов, к которым относится объект нашего исследования, канал ценосарка не подразделен на продольные субканалы, и полость ценосарка сплошная. Гидроплазма у таких гидроидов приводится в движение за счет пульсаций гидрантов и ценосарка. Гидроплазма перемещается попеременно то в одном направлении, то в противоположном благодаря пульсациям тела. Целенаправленное перемещение пищи на значительные расстояния в такой пульсаторной распределительной системе представляется невероятным. Однако непосредственные наблюдения за перемещением частиц пищи в полупрозрачном ценосарке колониальных гидроидов, подходящих для таких исследований, показали, что пища каким-то образом переносится вдоль всего столона от проксимального его конца до дистального (Марфенин, Дементьев, 2019).
Способ такого протяженного переноса частиц в гидроплазме был описан нами ранее (Марфенин, 1985а, 1988). По нашим наблюдениям, активна только фаза сжатия, тогда как расширение пассивно. Гидроплазма, заключенная в гастроваскулярной полости, перемещается внутри колониального организма гидроидов, когда одни части сжимаются, а другие в это же время релаксируют. В результате происходит перемещение гидроплазмы продольно по каналу ценосарка на некоторое расстояние. Впоследствии выяснилось, что отдельные пульсаторы не могут обеспечить перемещение частиц пищи вдоль всей колонии (Марфенин, Дементьев, 2017).
Протяженное течение гидроплазмы складывается из цепочки коротких. Каждое короткое (локальное) течение возникает при условии, что на одном конце трубчатого тела происходит сжатие ценосарка, а на другом конце одновременно происходит расширение ценосарка и гидрантов, которые к этому времени прошли цикл сжатия и находятся на завершающей стадии релаксации. Таким образом, на одном конце локального гидроплазматического течения (ГПТ) некий пульсатор сжимается, а на другом конце расширяется под напором поступающего короткого течения. В ответ на растяжение ценосарка и гидрантов эти пульсаторы тут же начинают сжиматься. Гидроплазма в пределах локального ГПТ начинает двигаться в обратном направлении, но не туда, откуда она пришла, поскольку первый пульсатор еще находится в стадии активного сжатия, и расслабление в нем пока не наступило. Гидроплазма теперь продвигается по столону дальше от места поступления пищи к следующим разветвлениям, т.е. к следующим основаниям побегов или гидрантов. Если ценосарк очередного побега (или тело очередного гидранта) в это время находится в фазе расслабления, то ГПТ возможно, и цикл поступательного перемещения гидроплазмы повторяется. И так далее вплоть до конца столона, т.е. до зоны роста (Марфенин, 1985а, 1988; Марфенин, Дементьев, 2017). Это правило перемещения гидроплазмы не является строгим, а может выполняться со значительными вариациями, например, с пропусками мест разветвления. Такая неопределенность характерна для модульной организации децентрализованных организмов.
Представляя в целом механизм функционирования пульсаторной распределительной системы, мы тем не менее до сих пор не знали существенных подробностей относительно степени эквифинальности и эффективности транспорта пищи в зависимости от места поступления пищи в колонию и способности распределительной системы оставаться активной в промежутках между питанием, т.е. после того, как пища была усвоена.
Цель представляемого нами исследования состояла в определении вариабельности функционирования распределительной системы при трех вариантах кормления, различающихся местоположением поступления пищи по отношению к верхушке роста столона, а именно:
• всю пищу получил только материнский побег, от которого вырос столон и маленькие дочерние побеги;
• материнский побег пищу не получил, а ее получили дочерние побеги, расположенные на равном удалении от материнского побега и верхушки столона;
• пищу получили дочерние побеги, расположенные дальше от материнского побега и ближе к верхушке столона.
Контролем считали состояние тех же колоний, но после того, как они не получали пищу более двадцати часов.
Рабочая гипотеза состояла в том, что при любом варианте поступления пищи в небольшую колонию все побеги будут участвовать в перемещении гидроплазмы, а эффективность функционирования распределительной системы будет мало зависеть от расположения гидрантов. Кроме того, мы предположили, что эффективность транспорта частиц повышается при питании и ослабляется по мере усвоения полученной пищи.
Мы рассчитывали получить ответы на следующие вопросы:
1) Происходит ли увеличение скорости и протяженности ГПТ после получения пищи?
2) Изменяется ли объем гидроплазмы, переносимой как за один цикл однонаправленного ГПТ, так и за единицу времени после получения пищи?
3) Изменяется ли продолжительность одного ГПТ после получения пищи?
4) Как различается ритмичность пульсаций ГПТ сразу после получения пищи и спустя значительное время?
5) Насколько велики различия в реакции колоний на кормление, и если различия существенны, то насколько они обусловлены местом поступления корма в колониальный организм?
Несмотря на увеличение числа публикаций по гидроидам в последние десятилетия (Di Camillo et al., 2017), изучение механизмов функционирования распределительной системы, к сожалению, все еще не привлекает должного внимания в силу большой трудоемкости исследований и отсутствия доступных и легких методов анализа перемещения гидроплазмы в колонии, хотя первые исследования в этой области были выполнены давно (Hale, 1960; Fulton, 1963; Wyttenbach, 1973).
МАТЕРИАЛ И МЕТОДЫ
Объект исследования – колониальный гидроид Dynamena pumila (L., 1758) (Sertulariidae, Leptothecata), обитающий в Северной Европе на мелководье морей. В Белом море D. pumila, как правило, встречается вдоль нижней границы литорали, обрастая слоевища водорослей и камни. Этот вид часто используется в лабораторных исследованиях (Марфенин, Дементьев, 2018а, б; Dementyev, Marfenin, 2021). D. pumila – высокоорганизованный колониальный гидроид, обладающий двурядным строго супротивным расположением гидротек на побегах и прямолинейным ростом столонов. Боковые ветви побегов устроены так же, как и ствол, и все лежат в плоскости ствола. Боковые столоны отходят от материнского только под основаниями побегов. Новые побеги формируются только на верхушках столонов.
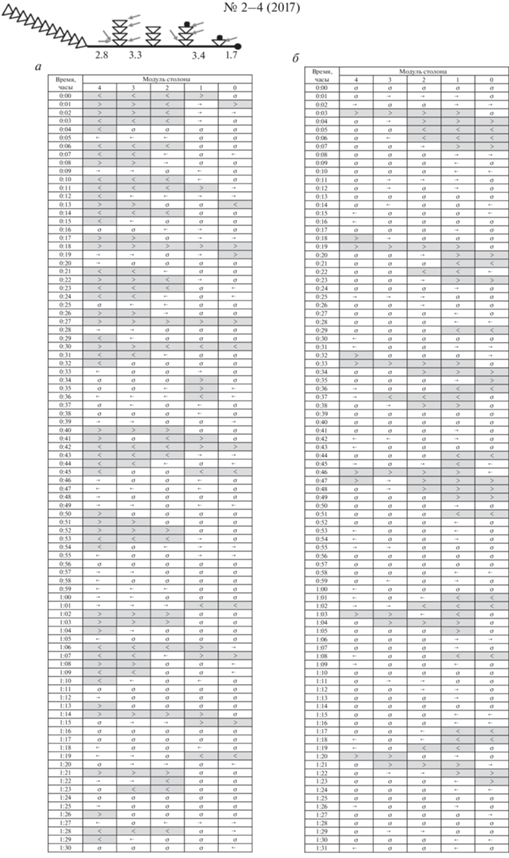
Модульная организация проявляется в регулярности строения побегов и столонов. Модулем побега называется пара гидротек с участком ствола между ними, а модулем столона его участок между соседними побегами. Нумерацию побегов мы проводим в дистальном направлении, присваивая материнскому (первичному) побегу номер 1, а нумерацию модулей столонов и побегов проводим в проксимальном направлении, т.е. от верхушки роста. Смысл противоположно направленной нумерации в том, что побеги нумеруются в порядке их образования, а модули столонов в порядке старения – чем дальше модуль от верхушки столона, тем в большей мере отличается гистологически от только что образованного за верхушкой, что сказывается на его пропульсаторной активности и других свойствах.
Для исследования колонии с примерно одинаковыми морфологическими показателями были выращены на стеклах. Первичные (материнские) побеги были взяты в конце июня 2017 г. из колоний D. pumila на Еремеевском пороге Ругозeрской губы Кандалакшского залива Белого моря вблизи Беломорской биостанции МГУ им. М.В. Ломоносова. Растущие побеги подходящего размера – не менее 10 пар гидрантов – были взяты из близко расположенных на одном субстрате колоний. Каждый побег прикрепляли на предметное стекло обычной ниткой по разработанной ранее методике (Fulton, 1960). При благоприятных условиях содержания через несколько дней в основании отсеченного первичного побега образовывалась верхушка столона, которая росла по поверхности стекла, приклеиваясь к нему. Формирующийся столон, а затем и все побеги на нем были крепко сцеплены с ровным стеклом, что позволяло изучать перемещения частиц в гастроваскулярной полости столона под микроскопом на просвет.
Колонии на стеклах содержали в аквариуме с натуральной беломорской водой, которую меняли дважды в неделю. Кормили гидроидов ежедневно свежевылупившимися науплиями Artemia salina (L., 1758). Воду в аквариуме постоянно аэрировали с помощью микрокомпрессоров с распылителями пузырьков воздуха для поддержания постоянного перемешивания воды. Температура автоматически поддерживалась на уровне 15–16°С при помощи бытового проточного холодильника.
Из всех колоний были выбраны три наиболее сходные по строению: длине столона, числу побегов, наличию верхушек роста у молодых побегов (табл. 1).
Таблица 1.
Основные морфологические характеристики трех колоний Dynamena pumila, использованных в исследовании
| Колония | Число побегов в колонии | Длина столона, мм | Число верхушек роста | Число пар гидрантов в колонии | Число пар гидрантов в первом побеге | Число полученных науплиев |
|---|---|---|---|---|---|---|
| № 2–7 (2017) | 5 | 15.4 | 3 | 40 | 23 | 12 |
| № 2–4 (2017) | 5 | 14.6 | 3 | 22 | 11 | 9 |
| № С–6 (2017) | 6 | 15.0 | 4 | 29 | 13 | 8 |
Кормление осуществляли дозированно: при помощи пипетки определенным гидрантам по одному науплиусу A. salina. Места кормления и число полученных науплиев указаны стрелками ниже на соответствующих схемах. Число науплиев приведено также для каждой колонии в табл. 1.
Гидранты, захватившие добычу, активно пульсируют, а затем выдавливают полупереваренную пищу в канал ценосарка побега или столона, откуда она попадает в другие гидранты, находящиеся в это время в фазе релаксации (Марфенин, Летунов, 1980). Поступление пищи стимулирует ответные сжатия гидрантов. Пища вначале циркулирует внутри побега, а затем при поперечном сжатии ценосарка ствола выходит в столон ГПТ (Марфенин, Дементьев, 2020).
ГПТ в столоне подразделены нами на несколько групп в зависимости от направления и количества переносимых частиц.
(+)ГПТ направлены к верхушке роста столона, т.е. дистально. (‒)ГПТ распространяются в противоположном направлении ‒ от верхушки столона к материнскому побегу, т.е. проксимально.
Среди (+)ГПТ мы выделяем мощные, так называемые магистральные ГПТ, переносящие большой объем гидроплазмы, и обозначаем их на иллюстрациях как “>”. Среди (‒)ГПТ также выделяем мощные, так называемые компенсаторные ГПТ и обозначаем их как “<”. Остальные ГПТ обозначаем обычными стрелками (→ и ←).
Перед съемкой составляли схемы колоний методом картирования (Марфенин, 1980).
Последовательность проведения экспериментов следующая.
Вначале изучали перемещение частиц в столоне под бинокуляром, поминутно в течение 1.5 ч регистрируя состояние частиц в гидроплазме последовательно в каждом модуле столона. Результаты заносили в подготовленную матрицу, различая направление ГПТ и насыщенность ГПТ частицами в двух градациях: разреженно (← или →) и концентрированно (< или >). Отсутствие поступательного движения обозначали символом “σ”. По числу последовательных модулей столона с толстыми однонаправленными стрелками определяли протяженность неразрывного ГПТ. Продолжительности совокупного (или генерального) ГПТ определяли по числу минут, во время которых в колонии отмечали однонаправленное перемещение частиц в столоне.
Анализируя результаты сканирования, можно определить число побегов, участвующих в продвижении гидроплазмы по столону. Для этого надо посчитать для каждого побега число случаев за 90 мин (1.5 ч наблюдений), когда состояние гидроплазмы в модулях столона слева и справа от него отличались. Например, “σ←”, или “> σ”, или “>←” и т.д. Такие отличие косвенно свидетельствуют о поступлении части гидроплазмы в побег или из него в столон. Ограниченность этой простой методики в том, что и при одинаковых значках слева и справа от побега (например: ←← или >>) нельзя исключить возможности захода части гдроплазмы в побег или выхода из него. Но даже при указанных ограничениях методика оказалась удачной и достаточно объективной.
После завершения визуального сканирования состояния гидроплазмы в столоне колонии, т.е. через 1.5 ч, сразу же переходили к цейтраферной микровидеосъемке под микроскопом ближайшего к первичному побегу модуля столона. Выбирали наиболее прозрачный участок, который обычно находился в середине модуля. Съемку проводили видеокамерой Arecont-AV3100, установленной на микроскопе МБИ-1 под увеличением ×100 в цейтраферном режиме 4 кадра/с. Съемка продолжалась 1.5–2 ч.
Во время регистрации под бинокуляром и под микроскопом колонии оставались в непроточной термостатируемой кювете водоизмещением 0.25 л.
При обработке цейтраферного материала проводили измерения на экране компьютера двух показателей: величины просвета столона и изменения положения частиц в гидроплазме за стандартный интервал 1 с, что соответствует четырем кадрам. Шаг измерений можно выбирать любой, но предыдущие наши исследования показали, что оптимальным для небольших колоний D. pumila является шаг 30 с (Марфенин, Дементьев, 2018а, б).
Используя два первичных показателя можно высчитать еще несколько, а именно: скорость ГПТ, протяженность локального ГПТ22, продолжительность ГПТ, объем ГПТ, период ГПТ (о показателях см. Дементьев, Марфенин, 2018, 2019, 2021).
После кормления колонии сначала регистрировали ГПТ в ближайшем к материнскому побегу модуле столона (четвертом или пятом от верхушки столона), что продолжалось 1.5–2 ч. Видеосъемку в остальных модулях проводили позже, поэтому будет корректно ограничиться анализом результатов в участке столона вблизи материнского побега. Там можно зарегистрировать влияние кормления на ГПТ, так как полупереваренная пища выдавливается гидрантами в полость ценосарка через 0.3–1 ч после получения ими корма.
Для изучения влияния приема пищи на функционирование распределительной системы плохо подходит обычная методология групповых исследований, когда достоверность результатов проверяется по степени единообразия ответной реакции на воздействие всех организмов, включенных в выборку. При усреднении результатов по любому показателю теряется главная особенность распределительной системы пульсаторного типа, а именно ее вариативность, являющаяся отличительной особенностью модульной организации.
Поэтому мы использовали методику индивидуального, или “адресного”, изучения выбранного объекта – колониального гидроида D. pumila. Под адресным изучением мы подразумеваем регистрацию изменений, происходящих в каждом объекте отдельно от остальных в процессе нормальной жизнедеятельности или эксперимента. Такой подход давно применяется в научных исследованиях и имеет различные названия, например, индивидуальное исследование, лонгитюдное исследование или идиографический подход33 (Conner et al., 2009; Hamaker, Dolan, 2009). Внимание к особенностям морфологии и биологии каждого индивида полностью соответствует таким особенностям модульной организации, как морфологическая пластичность и вариабельность функционирования распределительной системы пульсаторного типа.
РЕЗУЛЬТАТЫ
Усредненный подход
Усредненные результаты регистрации гидроплазматических течений (ГПТ) в колониях при цейтраферной микровидеосъемке представлены в табл. 2.
Таблица 2.
Усредненные показатели ГПТ совместно для колоний № 2–7 (2017), 2–4 (2017), C–6 (2017) в сравнении (после голодания и после кормления), по результатам цейтраферной микровидеорегистрации в ближайшем к первичному побегу модуле столона (отклонение от среднего значения ±SE)
| № | Название показателя ГПТ | Усредненные значения | |
|---|---|---|---|
| после 20–28 ч голодания | после кормления | ||
| 1 | Эпизоды (2017) | 157, 170, 182 | 158, 164, 176 |
| 2 | Период Р(+)HF, мин | 14.6 ± 1.1 | 14.9 ± 1.2 |
| 3 | Максимальная скорость А(+)HF, мкм/с | 18.8 ± 1.4 | 55.4 ± 8.7 |
| 4 | Продолжительность Т(+)HF, мин | 2.0 ± 0.3 | 3.4 ± 0.5 |
| 5 | Протяженность Z(+)HF, мкм | 2900 ± 340 | 6353 ± 444 |
| 6 | Объем V(+)HF, мкм3 | 1 534 128 ± 208 358 | 8 219 462 ± 1 046 729 |
| 7 | Средняя скорость ${{\bar {v}}_{{m( + )HF}}}$, мкм/с | 17.54 ± 1.23 | 20.32 ± 1.01 |
| 8 | Доля покоя (0)HF%, % | 46 | 40 |
| 9 | Доля (+)ГПТ (+)HF%, % | 31 | 38 |
| 10 | Доля (–)ГПТ (–)HF%, % | 23 | 22 |
При сравнении (+)ГПТ колоний в ближайшем к первичному побегу модуле столона в двух состояниях (голодном и накормленном) установлено, что:
− средние значения периода Р(+)HF образования мощных (+)ГПТ, направленных к верхушке столона остаются неизменными;
− но максимальная скорость (амплитуда) А(+)HF, а также продолжительность Т(+)HF (рис. 1) и объем V(+)HF (рис. 2) существенно выше после кормления.
Рис. 1.
Средние значения периода (+)ГПТ Р(+)HF, максимальной скорости А(+)HF и продолжительности Т(+)HF у трех колоний D. pumila в голодном и накормленном состояниях. Отклонение от средних величин ±SE.

Рис. 2.
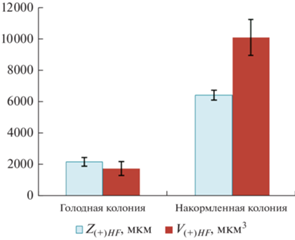
Средние значения протяженности Z(+)HF и объема V(+)HF (+)ГПТ у трех колоний D. pumila в голодном и накормленном состояниях.
Различия средних величин A(+)HF, Z(+)HF и V(+)HF у колоний в голодном и накормленном состояниях достоверны (p < 0.001). Различие по продолжительности ГПТ Т(+)HF достоверно на уровне p < 0.05. Средние значения периодов мощных ГПТ у голодных и накормленных колоний не различаются.
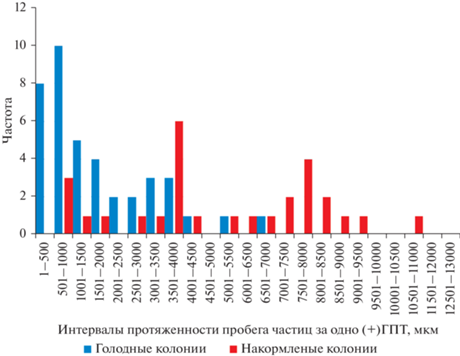
Вариационные ряды протяженности переноса частиц за одно (+)ГПТ позволяют выделить группы течений, превышающих по протяженности длину одного или двух модулей (рис. 3). После получения пищи значительная часть (+)ГПТ оказывается способна перенести частицы пищи на расстояние, превышающее длину одного модуля столона.
Идиографический (индивидуальный) анализ
Ниже, дополнительно к представленным усредненным результатам, приведен анализ системы ГПТ идиографически, т.е. по каждой колонии отдельно. Это позволяет оценить величину возможной вариабельности реакции колониального организма на кормление.
Колония № 2–7 (2017) (рис. 4)
Рис. 4.
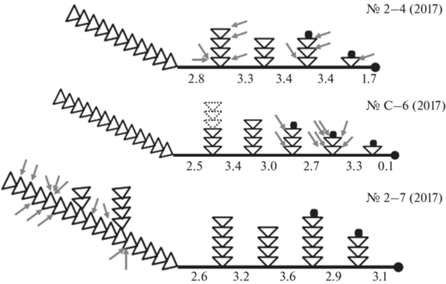
Схемы исследованных колоний и мест дозированного кормления. Треугольник – модуль побега, включающий пару гидрантов и участок ценосарка побега между ними. Черные точки – растущие верхушки побегов и столона; остальные побеги во время эксперимента не росли. Числа – длина каждого модуля столона, мм. Стрелки – места захвата гидрантами каждого науплиуса A. salina.
В колонии № 2–7 (2017) пищу получил только материнский побег. Пространственное распределение ГПТ после кормления и спустя сутки представлено на рис. 5.
Рис. 5.
Схема ГПТ в колонии № 2–7 (2017): а – после завершения кормления, б – после голодания. Всего к началу эксперимента было получено 12 науплиев материнским побегом. Обозначения: крупные (< или >) и тонкие стрелки (← или →) указывают наличие и направление ГПТ в каждом модуле с интервалом в 1 мин в течение 1.5 ч; знак “σ” обозначает отсутствие однонаправленного перемещения гидроплазмы.
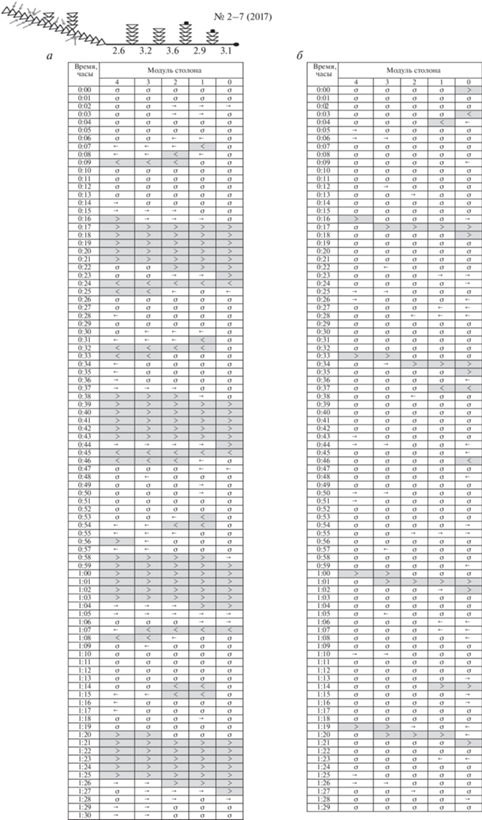
В течение полутора часов сканирования после кормления было зарегистрировано четыре мощных однонаправленных (+)ГПТ, исходящих из накормленного материнского побега и достигающих верхушки роста столона на противоположном его конце. Длина столона 15.4 мм. После окончания такого магистрального (+)ГПТ сразу начиналось обратно направленное компенсаторное (−)ГПТ. Оно разворачивалось от верхушки столона и постепенно достигало первичного побега колонии. Далее в описании мы сосредоточимся на магистральных ГПТ.
Продолжительность магистральных ГПТ составлялa обычно 6 мин в пределах ближайшего к первичному побегу модуля и 7–8 мин в целом, т.е. от момента начала ГПТ до его завершения (исчерпания по всему пути).
(+)ГПТ могут одновременно проходить через весь столон, т.е. при одном акте сканирования от материнского побега до верхушки столона во всех модулях столона гидроплазма движется в одном направлении. Таких “пронизывающих” всю колонию (+)ГПТ за 90 сканирований было отмечено 20 (рис. 5), но они сгруппированы в четыре мощных (+)ГПТ.
(+)ГПТ ритмичны и возникают каждые 22 мин. Мы определяем период, ориентируясь на моменты начала ГПТ.
Через сутки после кормления (+)ГПТ становятся значительно слабее (рис. 5) Они менее продолжительны, хотя все равно проходят через всю колонию. Только теперь магистральное ГПТ продолжается не 6–7 мин, а лишь 2 мин.
Регулярность (+)ГПТ сохраняется, но не так строго, как после кормления. Интервалы между ГПТ составляли 18, 27 и 19 мин последовательно.
Из всех вариантов ГПТ при голодании в колонии № 2–7 (2017) более всего коротких (+)ГПТ, направленных дистально (на рис. 6 их 31). Остальных (+)ГПТ, различающихся по протяженности, примерно поровну. В том числе и наиболее протяженных, охватывающих всю длину столона.
Рис. 6.
Число зарегистрированных за 1.5 ч пространственного сканирования ГПТ различной мощности и направления по модулям столона в исследованных колониях через 30 мин после кормления. Обозначения: > – магистральные ГПТ, насыщенные частицами; < – компенсаторные ГПТ, насыщенные частицами; → – дистально направленные ГПТ, не насыщенные частицами; ← – проксимально направленные ГПТ, не насыщенные частицами; σ – отсутствие направленного перемещения частиц.
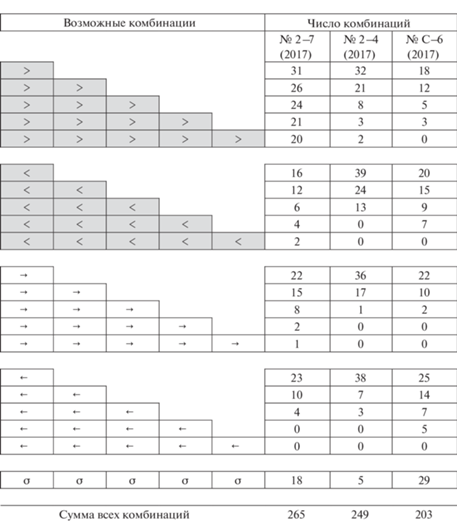
Значительно меньше мощных компенсаторных (‒)ГПТ (<): всего два за 90 мин (рис. 6). Слабое (+)ГПТ, проходящее одновременно по всей колонии, только одно, а идущих через всю колонии слабых (‒)ГПТ не обнаружено вовсе.
Сумма всех комбинаций превышает 90 проходов визуального учета ГПТ, потому что одновременно в столоне может быть не одно, а несколько ГПТ (см. рис. 5).
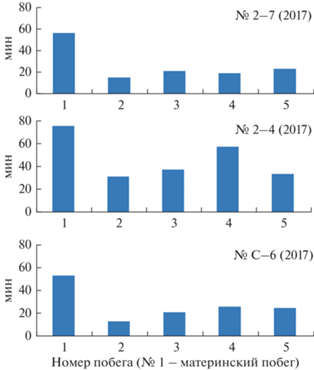
Не только первичный побег, но и все остальные участвуют в перемещении гидроплазмы, принимая или выжимая ее. Иными словами, гидроплазма при движении по столону заходит в промежуточные побеги и выходит из них. Степень участия всех побегов в этом процессе отражена на рис. 7. Первичный побег в 2.5–3 раза активнее остальных. Остальные побеги примерно одинаковы по своей активности.
Рис. 7.
Сравнение побегов по участию в перемещении гидроплазмы в исследованных колониях за шаг регистрации (длительностью 1 мин).
Регистрация ГПТ методом цейтраферной микровидеосъемки в одном месте (в ближайшем к материнскому побегу модуле столона) позволяет дополнить полученные результаты (табл. 3).
Таблица 3.
Показатели мощных ГПТ, исходящих из материнского побега (+)ГПТ и входящих в него (–)ГПТ, в сравнении: после кормления и после голодания (очередность столбиков с данными по каждой колонии отражает последовательность опыта)
| № | Название показателя ГПТ | № 2–7 (2017) | № 2–4 (2017) | № C–6 (2017) | |||
|---|---|---|---|---|---|---|---|
| после кормления | после 24 ч голодания | после 20 ч голодания | после кормления | после кормления | после 28 ч голодания | ||
| 1 | Эпизод (2017) | 176 | 182 | 157 | 158 | 164 | 170 |
| 2 | Период (+)ГПТ P(+) HF, мин | 22.50 ± 1.38 | 22.60 ± 1.78 | 12.75 ± 1.29 | 10.71 ± 0.47 | 17.50 ± 0.22 | 13.56 ± 0.82 |
| 3 | Амплитуда (+)ГПТ A(+) HF, мкм/с | 20.32 ± 1.11 | 17.54 ± 1.35 | 21.11 ± 2.80 | 81.61 ± 13.04 | 35.40 ± 6.80 | 20.57 ± 3.04 |
| 4 | Продолжительность (+)ГПТ T(+) HF, мин | 9.1 ± 0.3 | 5.4 ± 0.9 | 1.42 ± 0.42 | 2.75 ± 0.24 | 3.07 ± 0.13 | 1.44 ± 0.28 |
| 5 | Протяженность (+)ГПТ Z(+) HF, мкм | 7 433 ± 267 | 3 278 ± 600 | 1 556 ± 246 | 7 733 ± 729 | 3 984.60 ± 467.57 | 1503 ± 401 |
| 6 | Средний объем (+) ГПТ V(+) HF, мкм3 | 7 459 616 ± 646 083 | 2 928 547 ± 574 749 | 839 403 ± 242 231 | 14 439 517 ± 1 291 200 | 4 571 254 ± 599 392 | 1 753 765 ± 482 360 |
| 7 | Суммарный объем (+)ГПТ за час, мкм3 | 18 832 940 | 13 322 541 | 7 099 710 | 98 357 032 | 16 551 095 | 9 971 889 |
| 8 | Средняя скорость (+)ГПТ ${{\bar {v}}_{{m( + )HF}}}$, мкм/с | 13.6 ± 0.2 | 13.6 ± 0.3 | 14.5 ± 0.7 | 39.9 ± 3.2 | 21.4 ± 1.7 | 19.4 ± 1.2 |
| 9 | Максимальная скорость (+)ГПТ, мкм/с | 24.4 | 26.4 | 30.6 | 185.8 | 73.8 | 32.7 |
| 10 | Средний объем (–) ГПТ V(‒) HF, мкм3 | (‒) 2 738 316 ± 376 251 | (‒) 2 191 910 ± 412 307 | (‒) 2 127 884 ± 401 406 | (‒) 12 446 053 ± 1 558 667 | (‒) 3 749 683 ± 772 405 | (‒) 2 234 723 ± 314 640 |
| 11 | Суммарный объем (–)ГПТ за час, мкм3 | (‒) 11 976 283 | (‒) 10 152 537 | (‒) 8 988 943 | (‒) 89 062 520 | (‒) 15 901 428 | (‒) 12 217 062 |
| 12 | Средняя скорость (‒)ГПТ ${{\bar {v}}_{{m( - )HF}}}$, мкм/с | (‒) 17.7 ± 1.3 | (‒) 15.4 ± 0.9 | (‒) 12.8 ± 0.5 | (‒) 38.3 ± 2.7 | (‒) 25.2 ± 2.3 | (‒) 17.8 ± 1.2 |
| 13 | Максимальная скорость (‒)ГПТ, мкм/с | (‒) 59.9 | (‒) 41.8 | (‒) 36.2 | (‒) 148.9 | (‒) 75.9 | (‒) 34.8 |
| 14 | Доля покоя (0)ГПТ (0)HF%, % | 40 | 46 | 55 | 25 | 64 | 69 |
| 15 | Доля (+)ГПТ (+)HF%, % | 38 | 31 | 18 | 37 | 18 | 13 |
| 16 | Доля (–)ГПТ (–)HF%, % | 22 | 23 | 27 | 39 | 18 | 18 |
| 17 | Средний просвет модуля столона D, мкм | 35.69 ± 0.23 | 36.84 ± 0.19 | 30.43 ± 0.24 | 56.07 ± 0.47 | 33.58 ± 0.26 | 40.03 ± 0.32 |
Протяженность ГПТ (ZHF). Средняя протяженность (+)ГПТ после кормления и спустя сутки различается вдвое. После кормления среднее (+)ГПТ покрывает расстояние в 7.4 мм, т.е. более двух модулей столона (рис. 4), а спустя сутки только 3.3 мм – чуть более одного модуля столоны. Разница достоверна (р < 0.001). Эти величины существенно меньше установленных при визуальном сканировании распределения ГПТ по всему столону колонии № 2–7 (2017), а именно 15.4 мм. Однако протяженность обратно направленных (‒)ГПТ после кормления не отличается от состояния голодания (табл. 3).
Продолжительность ГПТ (THF). После кормления (+)ГПТ более продолжительны (9.1 мин), чем спустя 24 ч (5.4 мин), различие достоверно (p < 0.01), хотя продолжительность компенсаторных (‒)ГПТ до и после кормления не различается (табл. 3). При сравнении кривых скоростей ГПТ у накормленных и голодных колоний (рис. 8) видно, что сплошные протяженные “волны” накормленных колоний при голодании “разваливаются” на ряд непродолжительных “волн”, переходящих одна в другую.
Рис. 8.
Динамика скоростей ГПТ в ближайшем к материнскому побегу модуле столона в течение 2 ч у каждой из трех изученных колоний. Выше оси X ‒ (+)ГПТ, ниже ‒ (‒)ГПТ. По левой оси Y ‒ ГПТ вскоре после кормления, по правой оси Y ‒ ГПТ спустя 20–28 ч после кормления.
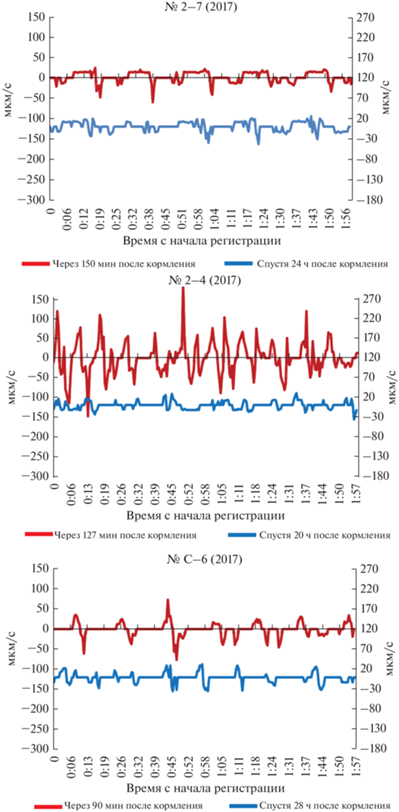
Рис. 9.
Схема ГПТ в колонии № 2–4 (2017): а – после завершения кормления, б – после голодания. Всего к началу эксперимента было получено девять науплиев тремя дочерними побегами. Обозначения как на рис. 5.
Объем ГПТ (VHF). Средний объем одного (+)ГПТ после кормления в 2.5 раза больше, чем после суточного голодания. Максимальные объемы ГПТ среди зарегистрированных после кормления и спустя сутки отличаются от средних примерно так же − в 2.2 раза (соответственно: 9.7 и 4.4 млн мкм3). В то же время компенсаторные (‒)ГПТ фактически одинаковы по объему при голодании и после кормления (табл. 3).
Скорость ГПТ (AHF) и период (PHF). В колонии № 2–7 (2017) амплитуда как магистральных (+)ГПТ, так и компенсаторных (‒)ГПТ незначительно увеличивается после кормления. Период пульсаций течений как (+)ГПТ, так и (‒)ГПТ был одним и тем же после кормления и после голодания (табл. 3).
Соотношение фаз покоя (+)ГПТ и (‒)ГПТ оказалось сходным после кормления и спустя сутки. Тем не менее фаза покоя после кормления несколько сокращается, а фаза (+)ГПТ увеличивается.
На рис. 8 представлены графики изменения скорости ГПТ в ближайшем к первичному побегу модуле столона в течение 2 ч у каждой из трех изученных колоний. Вид графиков позволяет выделить дополнительные особенности функционирования распределительной системы в каждой из сравниваемых колоний.
Для № 2–7 (2017) характерны продолжительные максимумы (+)ГПТ в виде плато на графике. Противоположно направленные (−)ГПТ отличаются высокой максимальной скоростью в сочетании с непродолжительностью. Эта особенность, отмеченная при стационарной микровидеосъемке, полностью соответствует данным визуального пространственного сканирования распределения ГПТ по колонии (рис. 5). Кроме того, графики скоростей ГПТ после кормления и во время голодания различаются количеством промежуточных пиков. При голодании выявляется множество непродолжительных ГПТ с небольшой максимальной скоростью, а основные (+)ГПТ и (−)ГПТ состоят из серии пиков (рис. 8). В меньшей мере серия пиков проявляется и на графике ГПТ после кормления. На видео это выглядит как начинающееся течение, останавливающееся и затем снова продолжающееся.
Колония № 2–4 (2017) (рис. 4)
В начале опыта после 20 ч голодания проведена стационарная цейтраферная микровидеосъемка ценосарка ближайшего к материнскому побегу модуля столона (четвертый модуль) в течение 2 ч. Затем девять свежевылупившихся науплиев A. salina были распределены в колонии между тремя дочерними побегами из четырех. Материнский побег не получил пищу. Исследуем функционирование распределительной системы при равномерном усвоении корма за пределами материнского побега.
Пространственное распределение ГПТ после кормления и спустя сутки представлено на рис. 9. В течение 1.5 ч зарегистрировано только три полноценных продолжительных (+)ГПТ, прошедших от материнского побега до верхушки столона, а кроме них еще четыре (+)ГПТ, распространившихся только на три модуля, ближайших к материнскому побегу.
Картина (+)ГПТ существенно отличается от колонии № 2–7 (2017), в которой всю пищу получил только материнский побег. Если там (+)ГПТ не только регулярны, но и продолжительны (6–8 мин), то в колонии № 2–4 (2017) (+)ГПТ после кормления продолжаются 2–3 мин, а в пределах четвертого модуля – только 2 мин.
Зато в колонии № 2–4 (2017) много коротких ГПТ, охватывающих только один или два моду-ля – их 214 (рис. 9) по сравнению со 155 в колонии № 2–7 (2017). Также в колонии № 2–4 (2017) много случаев расхождения или схождения ГПТ, т.е. выхода ГПТ из основания промежуточного побега в два противоположных направления (<>, ←→) или входа ГПТ в промежуточный побег из двух противоположных направлений одновременно (><, →←), что отражает активность побегов в перемещении гидроплазмы по столону колонии (рис. 6, 7).
Наиболее активен четвертый побег44, хотя он получил и не наибольшее число науплиев, но находится почти на середине пути до верхушки столона. Побег № 3, не получивший пищи, “работает” так же, как и получившие пищу (например, побег № 2). Верхушечный комплекс (верхушка роста столона и нулевой модуль) “работает” наравне с обычными побегами № 2, 3 и 5. Материнский первичный побег (№ 1) принимает самое активное участие в перемещении гидроплазмы, судя по данным регистрации ГПТ в четвертом модуле столона, хотя он не получил пищи.
Из всех вариантов ГПТ в колонии № 2–4 (2017) в течение 90 мин более всего оказалось коротких ГПТ, направленных как к верхушке столона, так и к материнскому побегу, причем как сильных, так и слабых (рис. 6). Протяженных ГПТ мало – всего пять магистральных (+)ГПТ, охватывающих четыре (3 ГПТ) или пять (2 ГПТ) модулей столона. Противоположно направленных протяженных (‒)ГПТ за 90 мин наблюдений не обнаружено вовсе.
В колонии № 2–4 (2017) все побеги (№ 2, 3, 4) активнее участвуют в перемещении гидроплазмы по сравнению с рассмотренной выше колонией № 2–7 (2017) (рис. 7). Следовательно, в колонии № 2–4 (2017) молодые побеги играют большую роль в системе ГПТ, чем в колонии № 2–7 (2017).
Результаты цейтраферной микровидеосъемки в ближайшем к материнскому побегу модуле столона позволяют дополнить полученные результаты (табл. 3, рис. 8).
Протяженность ГПТ (ZHF). Средняя протяженность (+)ГПТ после кормления и спустя сутки различается вдвое, т.е. так же, как и в колонии № 2–7 (2017). Однако значения этого показателя у колонии № 2–4 (2017) примерно в 2 раза меньше, чем у № 2–7 (2017). Иными словами, материнский побег в колонии № 2–4 (2017) после кормления средних побегов играет важную роль в перемещении гидроплазмы по колонии. Протяженности (+)ГПТ в среднем хватает на покрытие всей длины четвертого модуля, что необходимо для обеспечения дальнейшего транспорта частиц пищи в гидроплазме далее по столону за счет следующих побегов. Иная ситуация во время голодания: средней протяженности ГПТ, исходящих из материнского побега, может быть недостаточно для продолжения перемещения гидроплазмы далее по столону. Это наблюдается в трех случаях в матрице распределения стрелочек ГПТ (рис. 9б).
Продолжительность ГПТ (THF). После кормления (+)ГПТ почти в 2 раза более продолжительны (2.7 мин), чем после 20 ч голодания (1.4 мин), но при этом почти в 2.5 раза меньше, чем у колонии № 2–7 (2017). Поэтому и доля суммарной продолжительности ГПТ значительно меньше, а доля покоя в 1.5 раза больше, чем в первой колонии.
Соотношение фаз покоя (+)ГПТ и (‒)ГПТ после кормления и спустя сутки мало изменилось, и по этим показателям обе колонии сходны.
Скорость ГПТ (AHF). В колонии № 2–4 (2017) скорость ГПТ после кормления (81.6 мкм/с) значимо выше (табл. 3), чем спустя сутки голодания (21.1 мкм/с). На графике видно, что наряду с одинаковыми по амплитуде ГПТ при голодании оказывается больше ГПТ с меньшей амплитудой (рис. 8). Это относится как к (+)ГПТ, так и к (‒)ГПТ. Таким образом, различие по средним величинам скорости ГПТ между двумя колониями № 2–4 (2017) и 2–7 (2017) не в полной мере отражает истинное положение дел.
Период (+)ГПТ (PHF) недостоверно меньше (p > 0.05) после кормления по сравнению с голоданием. Этот результат соответствует полученному ранее при усреднении данных трех колоний (рис. 1).
Объем ГПТ (VHF). Средний объем одного (+)ГПТ после кормления (14.4 млн мкм3) намного (в 18 раз) больше, чем после суточного голодания (0.8 млн мкм3), а максимальный – в 13 раз, т.е. средние значения различаются сильнее, чем максимальные. При этом суммарный объем гидроплазмы, перемещенной из первичного побега через четвертый модуль столона за два часа регистрации, почти в 14 раз больше после кормления по сравнению с фазой голодания колонии (рис. 8).
Для колонии № 2–4 (2017) характерны непродолжительные (+)ГПТ и (‒)ГПТ с большими максимальными скоростями (рис. 8, табл. 3). На графиках ГПТ много пиков, не как у колонии № 2–7 (2017), что характерно как для (+)ГПТ, так и для (‒)ГПТ. На видео течения выглядят сплошными, без пауз, стремительно набирающими большую скорость. Сразу после этого скорость ГПТ начинает снижаться, т.е. ГПТ прекращается постепенно, но быстро. Промежуточных пиков на графиках (ГПТ на видео) при голодании больше, чем после кормления (рис. 8).
Колония № C–6 (2017) (рис. 4)
Пищу получили два дочерних побега, расположенные вблизи верхушки роста столона.
Колония № C–6 (2017) включает шесть побегов и шесть модулей столона. Однако нулевого модуля фактически нет, так как его длина составляет всего 0.1 мм, т.е. это место целиком занято верхушкой столона. Столон, видимо, рос очень медленно, так как за это время сформировался маленький побег № 6, включающий одну пару гидрантов и верхушку роста побега. В связи с этой особенностью строения колонии № C–6 (2017) мы в описаниях ниже не упоминаем нулевой модуль столона, поскольку на момент регистрации он находился в самом начале формирования.
Пространственное распределение ГПТ после кормления и спустя 28 ч представлено на рис. 10. За 1.5 ч было отмечено пять мощных ГПТ в колонии № C–6 (2017) после кормления. Четыре из пяти ГПТ были компенсаторными (−)ГПТ. Они начинались не от нулевого модуля столона за его верхушкой, а от третьего, второго, первого модулей. Все мощные (−)ГПТ достигали материнского (первичного) побега. Сразу после этого наблюдалось встречное (+)ГПТ из первичного побега. Следовательно, даже при получении пищи вблизи дистальной зоны роста колонии поддерживается связь с материнским побегом, и ГПТ проходят через весь столон колонии.
Рис. 10.
Схема ГПТ в колонии № C–6 (2017): а – после завершения кормления, б – после голодания. Всего к началу эксперимента было получено восемь науплиев двумя дочерними побегами, расположенными вблизи верхушки роста столона. Обозначения как на рис. 5.
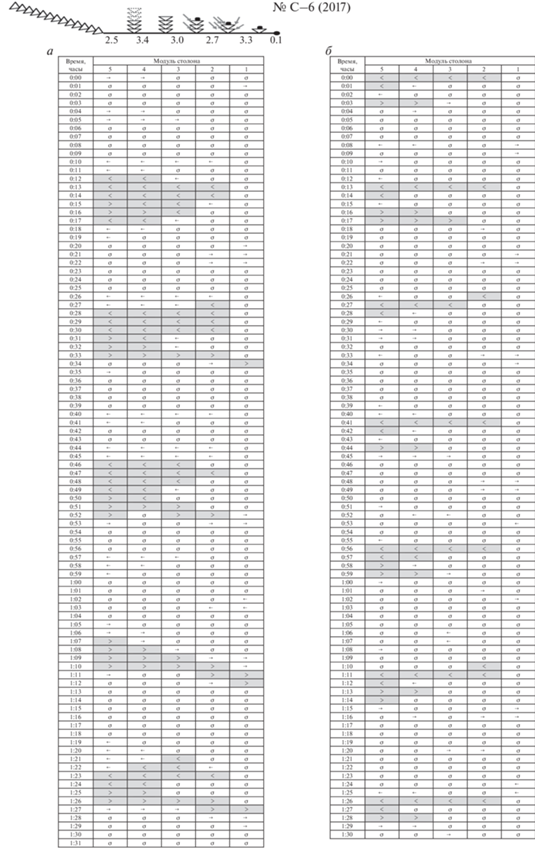
В одном случае из пяти мощное (+)ГПТ сразу начиналось в первичном побеге и распространялось в дистальном направлении по столону вплоть до его верхушки, не вызвав ответного (−)ГПТ в противоположном направлении. Такое магистральное ГПТ по сути является компенсаторным, т.е. возвращающим гидроплазму в места ее временного дефицита.
Через 28 ч после кормления система ГПТ в колонии № C–6 (2017) не изменилась, хотя ГПТ стали менее продолжительными. Зарегистрировано семь мощных ГПТ, а не пять, как после кормления. Все ГПТ начинались из первого модуля (вблизи верхушки столона) и были направлены к материнскому (первичному) побегу, которого достигали за 1–2 мин.
Сразу же после завершения (−)ГПТ начиналось (+)ГПТ из материнского побега, которое не достигало верхушки столона, а завершалось в третьем или четвертом побегах.
ГПТ ритмичны как после кормления, так и спустя 28 ч.
Инициатором ГПТ был в основном побег № 5, получивший больше всего пищи.
Ни после кормления, ни спустя 28 ч нет ГПТ, пронизывающих всю колонию в течение одной минуты. Однако мощные ГПТ все же весьма протяженны и охватывают одновременно от двух до четырех модулей столона. Тем не менее в колонии больше всего коротких ГПТ (рис. 6, 10).
Анализ активности побегов по поддержанию ГПТ показал, что даже при кормлении молодых побегов вблизи верхушки столона самым активным в генерации ГПТ все равно оказывается материнский (первичный) побег: он примерно в 2 раза активнее дистальных побегов, получивших пищу (рис. 7).
Цейтраферная микровидеосъемка была проведена в пятом модуле столона – ближайшем к материнскому побегу (табл. 3, рис. 8). В колонии № C–6 (2017) сначала была проведена съемка колонии до получения пищи, а затем через 90 мин после кормления.
Протяженность ГПТ (ZHF). Средняя протяженность (+)ГПТ до кормления составляла 1.5 мм, что не позволяет фронту (+)ГПТ достичь основания следующего побега. Учитывая вариации (+)ГПТ (рис. 8), можно предположить, что самые мощные по протяженности (+)ГПТ в период голодания проходили целиком один модуль столона, а в некоторых случаях и два. После кормления средняя протяженность (+)ГПТ увеличилась в два с лишним раза и составила 3.9 мм. Этого достаточно, чтобы фронт (+)ГПТ, выходящего из первичного побега, преодолел два модуля столона и прошел под основанием побега № 3. Следовательно, первичный побег полноценно участвует в создании протяженных ГПТ после кормления, хотя пищу получил не он сам, а два небольших дочерних побега, удаленных от него.
Продолжительность ГПТ (THF). После кормления продолжительность (+)ГПТ (3 мин) в 2 раза больше, чем в состоянии голодания (1.4 мин), но при этом почти в 3 раза меньше, чем у колонии № 2–7 (2017). В предшествующий кормлению период голодания доля суммарной продолжительности ГПТ значительно меньше, а доля покоя больше, чем в колонии № 2–7 (2017).
Соотношение фаз покоя (+)ГПТ и (–)ГПТ в период голодания и после кормления различается незначительно.
Скорость ГПТ (AHF). В колонии № C–6 (2017) амплитуда ГПТ после кормления значительно возрастает, почти в 2 раза. Если в голодном состоянии скорость (+)ГПТ в этой колонии не отличается от двух других, то после кормления (+)ГПТ становится намного выше: почти в 2 раза выше, чем в колонии № 2–7 (2017), но существенно ниже по сравнению с № 2–4 (2017).
Период (+)ГПТ (PHF) вырос (т.е. ГПТ стали реже) после кормления по сравнению с голоданием (табл. 3, рис. 8).
Объем ГПТ (VHF). Средний объем (+)ГПТ после кормления возрос почти в 3 раза, а суммарный за время регистрации – почти в 2 раза. Столь значительные изменения в объеме переносимой гидроплазмы можно объяснить сочетанием реакции двух показателей на прием пищи, а именно: 1) скорости ГПТ, 2) продолжительности каждого течения гидроплазмы. Все это свидетельствует о значительном увеличении внутреннего гидростатического давления в распределительной системе колонии № C–6 (2017).
Для этой колонии характерны учащенные (+)ГПТ и (‒)ГПТ с быстрым нарастанием и последующим спадом скорости течения (т.е. без “плато” на графике) и значительно сокращенной фазой покоя после кормления (табл. 3, рис. 8). После голодания в течение суток ГПТ становятся слабее по максимальной скорости (амплитуде на графике), а фазы покоя увеличиваются. Промежуточных пиков на графике ГПТ (рис. 8) немного, однако они сказались на учащении ГПТ. На видео течения выглядят как стремительно ускоряющиеся, а сразу после достижения максимума замедляющиеся.
Таким образом, ключевые особенности колонии № C–6 (2017) – это учащенные ГПТ и высокая средняя скорость ГПТ (табл. 3, рис. 8), производными которых являются большой объем ГПТ и низкая их продолжительность.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В отличие от других факторов окружающей среды, воздействующих на весь организм в целом (например, температуры и солeности), прием пищи у колониальных гидроидов может быть ограничен отдельными гидрантами. Места поступления пищи могут быть расположены в самых различных побегах колониального организма. Поэтому и реакция распределительной системы гидроидов на прием пищи, казалось бы, вполне может быть различной, не ограниченной лишь количеством пищи и временем суток или регулярностью питания, как у унитарных организмов, обладающих одним “ротовым отверстием”. У колониальных гидроидов “ротовых отверстий” много, а путь поступления пищу в организм неопределенен (Bumann, Buss, 2008). Это обстоятельство лежит в основе дополнительной вариабельности реакции распределительной системы колониальных гидроидов на получение пищи.
В то же время, вне зависимости от места поступления корма в колониальный организм, пища должна быть доставлена к зонам роста, расположенным обычно вблизи верхушек роста столонов и побегов. Это было показано разными методами: как непосредственными наблюдениями за пищевыми частицами (Косевич, 1991; Бурыкин, 1992, 1993а, б; Марфенин, 1993а), так и с помощью флуоресцентных молекул (Buss et al., 2015) или изотопов (Rees et al., 1970) при радиоавтографическом исследовании перемещения меченой пищи.
Эквифинальность распределительной системы – одна из важнейших особенностей модульной организации. Мы попытались исследовать этот феномен на трех натурных моделях – трех почти одинаковых небольших колониях D. pumila. В одной колонии – № 2–7 (2017) – всю пищу получил самый большой материнский (первичный) побег, от которого берет начало модельная колония. В другой колонии – № C–6 (2017) – пищу получили два молодых дочерних побега, ближних к верхушке роста столона. В третьей колонии – № 2–4 (2017) – корм был распределен среди трех средних дочерних побегов, расположенных между материнским побегом и верхушкой столона.
Ограничение исследования только тремя колониями D. pumila позволило легко обнаружить как общие, так и индивидуальные особенности реакции распределительной системы каждой колонии на получение гидроидом пищи. Если бы исследование было проведено на трех выборках, а результаты подвергнуты статистической обработке, то из всех индивидуальных особенностей реакции распределительной системы на локальное воздействие удалось бы выявить только наименее вариабельные.
Одинаковые реакции системы ГПТ на кормление у трех колоний отчетливо проявляются в результатах усреднения данных (рис. 1 и 2). Даже минимальной выборки оказалось достаточно для того, чтобы с высокой степенью значимости установить, что после кормления через 90–150 мин: 1) увеличивается средняя скорость ГПТ, 2) средняя протяженность и 3) средняя продолжительность ГПТ. При этом период возникновения (+)ГПТ в среднем оставался неизменным.
Среднее значение протяженности ГПТ, выходящих из материнского побега, оказалось у голодных колоний 2900 ± 340 мкм, и у них же, но получивших пищу – 6353 ± 444 мкм (табл. 2). Длина прилежащего к материнскому побегу модуля столона у трех колоний варьировала от 2.5 до 2.8 мм. Таким образом, даже в голодной колонии исходящее из материнского побега (+)ГПТ может достичь следующего побега, а после кормления дистанция переноса частиц за время одного цикла (+)ГПТ достаточна, чтобы частицы вблизи фронта течения прошли дальше основания третьего побега55.
Однако этих результатов все же недостаточно для ответа на основной вопрос – насколько увеличивает кормление интеграцию колонии, т.е. способствует ли кормление доставке пищевых частиц от самых больших побегов с наибольшим числом гидрантов через всю колонию к зонам роста у верхушек столонов. Необходимо судить о дальности переноса частиц за один цикл ГПТ не только по средним значениям, но по максимальным, превышающим средние. Отчасти эта информация содержится в показателях отклонения от среднего, т.е. в ±SD и ±SE. Однако более полную картину дают вариационные ряды (Марфенин, Дементьев, 2020). Так и в нашем примере с тремя колониями вариационный ряд протяженности ГПТ позволяет определить (рис. 3), что максимальное расстояние перемещения частиц к верхушке столона за один акт (+)ГПТ не превышает 10 мм, т.е. меньше, чем расстояние от первичного побега до верхушки столона (табл. 1).
На схемах пространственного распределения ГПТ по столонам (рис. 5, 9, 10) отчетливо проявляется ритмичность протяженных ГПТ: как магистральных, т.е. продвигающихся к верхушке столона, так и компенсаторных, направленных в противоположную сторону. На фоне покоя (когда не было ГПТ, а частицы в гидроплазме либо крутились на месте, либо вовсе не двигались) возникают то разрозненные неупорядоченные перемещения частиц в ценосарке столона на расстояние, редко превышающее два модуля, то однонаправленные продолжительные, а потому и протяженные ГПТ.
На схемах, составленных по результатам визуального сканирования (рис. 5, 9, 10), видно, что такие ГПТ возникают не по всему столону одновременно, а последовательно, как будто ГПТ распространяется от одного конца колонии до противоположного. Итоговая протяженность ГПТ оказывается значительной, по сути, равной длине всего столона колонии. Обращает на себя внимание ритмичность возникновения и перемещения таких мощных течений гидроплазмы (табл. 3), как будто они порождены одним источником, одним генератором.
При цейтраферной регистрации ГПТ стационарно, т.е. в одном месте, хорошо видна смена состояний покоя и начала поступательного перемещения взвешенных в гидроплазме частиц по ценосарку столона. Отмечая время начала и окончания перемещения частиц в поле зрения микроскопа, а также скорость перемещения частиц покадрово, можно рассчитать протяженность ГПТ, прошедшего перед глазами исследователя. Средние расчетные величины протяженности ГПТ представлены в табл. 2. Для трех колоний совместно эта средняя величина не превышает 6353 ± 444 мкм (6.3 ± 0.4 мм) после получения пищи, в то время как протяженность столонов в этих колониях вдвое больше (14.6–15.4 мм) (рис. 4). Следовательно, выходящие из материнских побегов у всех трех колоний (+)ГПТ не могут достичь верхушек столонов без участия промежуточных побегов.
Принимая во внимание оба факта: с одной стороны, тотальную протяженность (+)ГПТ, определенную при визуальном сканировании колоний, и с другой стороны, ограниченную протяженность ГПТ, регистрируемых стационарно методом видеосъемки, − мы приходим к выводу, что наблюдаемое при визуальном сканировании сплошное ГПТ, на самом деле, должно состоять из цепочки локальных. Это предположение уже было сделано ранее, как авторами (Марфенин, 1988, 2016; Марфенин, Дементьев, 2017, 2019), так и другими исследователями независимо (Бурыкин, 2013, 2015). Цепочка или “эстафета” локальных ГПТ способна однонаправленно транспортировать частицы пищи на бóльшие расстояния, чем каждое “звено цепочки” локальных ГПТ. Промежуточные побеги оказываются вовлеченными в перемещение частиц пищи. Это оказалось очевидным после обработки данных сканирования состояния гидроплазмы в каждом модуле столона. Направленные навстречу друг другу локальные ГПТ в двух смежных модулях означали перемещение гидроплазмы в побег, так же, как ГПТ в одном модуле в сторону основания побега и отсутствие движение гидроплазмы в следующем модуле. Таким простым способом была определена активность промежуточных побегов в генерации локальных ГПТ, складывающихся в цепочку однонаправленного мощного течения к верхушке столона или в противоположном направлении. Результаты, представленные на рис. 7, впервые дают представление о том, что все побеги оказываются вовлеченными в процесс перемещения гидроплазмы вне зависимости от того, получили ли они пищу или нет. Возможно, само присутствие пищи в полости колонии инициирует пульсации гидрантов (Dudgeon et al., 1999).
По нашим данным, протяженные (или “эстафетные”) ГПТ возникают ритмично с неким периодом – как после кормления, так и после многочасового голодания. Это означает, что функционирование пульсаторно-реверсивной распределительной системы не определяется только наличием пищи в колонии. Пульсации гидрантов и участков ценосарка, прилегающих к верхушкам роста столонов и побегов, продолжаются и в отсутствие пищи. Есть основания считать, что и удаленные от верхушек роста участки ценосарка стволов вблизи оснований побегов также пульсируют как после кормления, так и в периоды голодания (Марфенин, Дементьев, 2020). Мы полагаем, что именно с пульсацией ценосарка нижних частей побегов связана ритмичность (+)ГПТ.
Уточнив некоторые особенности функционирования пульсаторно-реверсивной распределительной системы, вернемся к вопросам, сформулированным в начале нашей статьи, используя идиографический подход, т.е. рассматривая колонии индивидуально.
1. После получения пищи у всех трех колоний протяженность ГПТ (ZHF) стала в 2−3.5 раза больше, чем в период многочасовой паузы в приеме пищи (табл. 3). Следовательно, кормление способствует транспортировке пищевых частиц на бóльшие расстояния, повышая таким способом физиологическую интеграцию колониального организма. Этот эффект в исследованных колониях при трех пространственных вариантах получения пищи проявился неодинаково. У двух колоний данные по протяженности ГПТ почти совпадают (табл. 3), а у третьей колонии − № C–6 (2017) – (+)ГПТ были в 2 раза менее протяженны по сравнению с двумя другими после кормления. В ней корм получили гидранты двух дочерних побегов вблизи верхушки столона. Удаленность накормленных побегов от материнского сказалась на ослаблении ГПТ в проксимальной части колонии.
2. После получения пищи увеличивается объем гидроплазмы (VHF), переносимой как за один цикл однонаправленного ГПТ, так и за более продолжительный период (в нашем случае за 90 мин) после получения пищи (табл. 3). Это увеличение достоверно с высокой степенью значимости в каждой из трех колоний. Однако после кормления кратность увеличения среднего объема переносимой (+)ГПТ гидроплазмы у одной (№ 2–4 (2017)) из колоний стала значительно больше (в 11 раз), чем у двух других (в 2–4 раза). Это следует из сопоставления данных по среднему объему магистральных ГПТ после кормления и после суток голодания у каждой колонии индивидуально (табл. 3). В колонии № C–6 (2017) корм получили два побега возле верхушки столона. Они образовали своеобразный “диполь” с материнским побегом, перегоняя в него избыток гидроплазмы и принимая затем встречный (обратный) поток. Это было зарегистрировано при визуальном сканировании системы ГПТ под бинокуляром (рис. 10). На рис. 10 видно, что мощные ГПТ начинаются после паузы не от материнского побега, а от дистальных дочерних побегов, т.е. это компенсаторные (‒)ГПТ. В свою очередь, (+)ГПТ возникают без паузы сразу после завершения (‒)ГПТ и начинаются от материнского побега, т.е. являются почти моментальной реакцией на расширение ценосарка побега. В другой колонии (№ 2–7 (2017)), в которой корм получил только материнский побег, последовательность мощных ГПТ оказалась обратной по сравнению с колонией № C–6 (2017). Мощные (+)ГПТ начинались после затишья от первичного побега, а сразу после их завершения от дистальных побегов, расположенных вблизи верхушки столона, следовали обратные (‒)ГПТ (рис. 5). В третьей колонии – № 2–4 (2017) – примерно такое же количество корма получили не два, а три дочерних побега, расположенных в средней части столона. Система ГПТ в этой колонии отличается от двух других, в которых формируются мощные ритмичные ГПТ, пронизывающие всю колонию. В колонии № 2–4 (2017) система ГПТ представлена локальными короткими течениями, исходящими и входящими в дочерние побеги, т.е. велика инициативная роль этих побегов в перемещении гидроплазмы с частичками пищи (рис. 7, 9), а избыточный объем гидроплазмы в значительной мере перераспределяется между дочерними побегами. Многократное увеличение объемов гидроплазмы из материнского побега после кормления колонии № 2–4 (2017) можно объяснить большим притоком гидроплазмы с пищей из близко расположенных дочерних побегов в материнский. Однако в случае кормления только материнского побега (колонии № 2–7 (2017)) исходящий объем гидроплазмы существенно меньше, чем при кормлении трех дочерних побегов (№ 2–4 (2017)). Этот результат, на первый взгляд, кажется странным. На самом деле он подтверждает гипотезу о самостоятельном значении пульсаций ценосарка побега (Марфенин, Дементьев, 2020). В ответ на поступление избыточного количества гидроплазмы из столона ценосарк реагирует моментальным сжатием и выдавливанием встречного магистрального потока. В альтернативном варианте, когда сам материнский побег оказался накормленным (колония № 2–7 (2017)), значительная часть пищи, полученная его гидрантами, оказалась задержанной на время в гидрантах и цено-сарке крупного побега. В результате магистральное (+)ГПТ оказалось такого же суммарного объема, как и в случае дозированного кормления удаленных дочерних побегов в колонии № C–6 (2017).
3. Суммарный объем ГПТ зависит не только от его продолжительности, но также от скорости ГПТ и величины просвета ценосарка. Средняя скорость (+)ГПТ (${{\bar {v}}_{{mHF}}}$) в ближайшем к материнскому побегу модуле в двух колониях не зависела от получения пищи, но в колонии № 2–4 (2017) возросла после кормления в три раза, а пиковое (максимальное) значение – в пять с лишним раз (табл. 3). Примечательно, что столь значительное изменение скорости (+)ГПТ произошло в колонии, в которой корм потребили средние побеги, причем более всех получил ближайший к материнскому дочерний побег. Выходя из этих дочерних побегов, избыток гидроплазмы с частицами пищи мог в основном двигаться только в сторону материнского побега, так как он обладал значительно бо́льшим объемом, чем дистальный короткий побег и участок столона. В результате сформировался диполь – две “помпы”, работающие в противофазе: материнский побег и ближайшая к нему группа дочерних побегов, получивших пищу.
4. Величина среднего просвета ценосарка (D) в ближайшем к материнскому побегу модуле столона после кормления достоверно возрастает. Это отмечено у всех трех колоний, но в разной мере (табл. 3). Такой результат ожидаем, поскольку после кормления общий объем гидроплазмы в колонии возрастает на величину объема пищи. Однако количественно интерпретировать эти данные мы не имеем права, так как при повторной съемке в том же модуле мы не могли провести ее точно в том же месте и в той же оптической плоскости, от чего зависит абсолютное значение просвета трубки ценосарка. Тем не менее стоит обратить внимание на то, что в колонии № 2–4 (2017) величина просвета после кормления увеличилась почти в 2 раза. Связано ли это с повышенной суммарной пропульсаторной активностью трех побегов, получивших пищу, остается только догадываться.
5. Средняя продолжительность ГПТ (THF) после получения пищи у всех трех колоний в 1.5–2 раза больше, чем при голодании. У колонии № 2–7 (2017) продолжительность (+)ГПТ примерно в 3 раза больше, чем у остальных, как после кормления, так и в процессе голодания. Именно у этой колонии всю пищу получил большой и разветвленный материнский побег, который и стал продуцировать продолжительные (+)ГПТ (рис. 5). Их скорость меньше, чем в двух других колониях в аналогичном модуле столона. По суммарному объему перемещенной гидроплазмы колония № 2–7 (2017) также не лидирует среди остальных. Значение увеличенной продолжительности (+)ГПТ в ином. Пока существует избыточное давление со стороны материнского побега локальные ГПТ, выходящие из промежуточных побегов, могут направляться только в сторону верхушки столона. За счет большой продолжительности исходящего из материнского побега (+)ГПТ обеспечивается однонаправленность цепочки локальных ГПТ, ориентированных дистально. При голодании продолжительность исходящих из материнского побега мощных (+)ГПТ не изменяется, но теперь магистральные течения не сплошные, а состоят из нескольких, переходящих одно в другое. При голодании видно, что исходящее ГПТ состоит из нескольких последовательных токов, т.е. генерируется несколькими пульсаторами. У остальных двух колоний последовательное сжатие пульсаторов не наблюдается, но и максимальные скорости больше. Возможно, это означает синхронизацию нескольких пульсаторов, что и приводит к увеличению скорости ГПТ и уменьшению продолжительности течения. В колонии № 2–4 (2017) за счет большей скорости при меньшей продолжительности ГПТ происходит перенос значительно большего объема гидроплазмы, чем в двух других колониях. Следовательно, пространственная локализация кормления может сказываться на результирующей интенсивности дальнего переноса пищи, а значит, и на интеграции колонии.
6. Ритмичность ГПТ (PHF) по обобщенным данным не изменяется после кормления. Однако при рассмотрении трех колоний раздельно оказывалось, что у двух из них ритм пульсаций действительно не зависел от кормления, а у колонии № C–6 (2017) сразу после кормления период возрос (ГПТ стали реже) почти на четверть по сравнению с голодающим состоянием (табл. 3). При сравнении трех колоний между собой оказывается, что период (+)ГПТ у них не одинаковый. Он может быть как 10–12 мин (у колонии № 2–4 (2017)), так и 22 мин (у колонии № 2–7 (2017)), хотя условия содержания и проведения опытов были у всех колоний одинаковыми. Причины ритмики ГПТ до сих пор не установлены. Весьма вероятно, что период определяется не одним пульсатором, а взаимодействием нескольких пульсаторов. Это относится, прежде всего, к взаимодействию гидрантов в пределах побега, от чего зависит итоговое поперечное сжатие ценосарка ствола этого побега, приводящее к формированию исходящего из него в столон (+)ГПТ (Марфенин, Дементьев, 2017, 2019, 2020).
7. Фаза покоя (0)HF% в перемещении гидроплазмы уменьшается после кормления в каждой из трех колоний. У двух из них незначительно (табл. 3), но у колонии № 2–4 (2017) фаза покоя увеличилась в 1.5 раза. Это как раз та колония, в которой пищу получили средние короткие побеги. Взаимодействие между ними было столь неупорядоченным, что фаза покоя сократилась существенно. Для сравнения в той же колонии в голодном состоянии фаза покоя по продолжительности соответствует двум другим колониям. Примечательно, что в колонии № C–6 (2017) подобного сбоя в системе ГПТ после кормления не было, хотя пищу получили два коротких побега вблизи верхушки столона.
Идиографический подход позволил обнаружить важные индивидуальные особенности у каждой из изученных колоний, на основании которых можно сделать обобщенные выводы о функционировании распределительной системы.
ВЫВОДЫ
1. Установлено, что ритмичные перемещения гидроплазмы в столонах колонии D. pumila происходят как непосредственно после кормления, так и спустя значительное время – вплоть до суток и более.
2. У всех колоний после дозированного кормления увеличиваются протяженность и продолжительность гидроплазматических течений (ГПТ), максимальная скорость ГПТ, объем перенесенной гидроплазмы каждым ГПТ и суммарно за единицу времени, при этом сокращается продолжительность фаз покоя.
3. Полученные результаты свидетельствуют об увеличении интенсивности интеграции колонии после получения ограниченного количества пищи, поскольку возрастает доставка пищевых частиц с одного конца колонии до противоположного.
4. Подтверждена гипотеза о недостаточности пульсаций отдельного побега для обеспечения трансколониальных ГПТ. Установлено, что перемещение частиц пищи на значительные расстояния в столоне обеспечивается не только за счет пульсаций побегов, получивших пищу, но и всех остальных побегов.
5. Описанный механизм функционирования ГПТ действует и в отсутствии пищи, хотя объемы перемещаемой гидроплазмы при этом меньше.
6. Все описанные результаты достоверны на уровне значимости p < 0.05, p < 0.01, p < 0.001 соответственно для различных указанных выше параметров.
7. Идиографический подход позволил выявить индивидуальные различия по каждому параметру и обнаружить количественные расхождения по результатам в зависимости от места получения пищи в колонии. Ниже приведены примеры основных различий.
• При получении пищи только крупным материнским побегом ГПТ наиболее продолжительны, но их скорость меньше, чем при других вариантах кормления.
• При кормлении дистальной группы побегов средняя скорость в столоне у основания материнского побега выше, чем при кормлении самого материнского побега, а продолжительность и объем перенесенной гидроплазмы меньше.
• При кормлении средних побегов, расположенных ближе к материнскому, у его основания в столоне скорость и объем перенесенной гидроплазмы гораздо больше, чем в двух других вариантах кормления колоний.
• Вероятно, место кормления и количество получивших пищу побегов существенно влияют на формирование протяженного перемещения пищи по столону за счет различной степени согласованности пульсаторной активности промежуточных побегов в цепочке их взаимодействия.
• Материнский побег при всех вариантах кормления играет ведущую роль в функционировании распределительной системы пульсаторно-реверсивного типа.
• Простое усреднение скрывало эти различия, которые могут быть существенны для понимания многофакторной зависимости функционирования распределительной системы в модульном организме, отличающемся неопределенностью сочетания множества равнозначных процессов, например, пульсаций гидрантов.
ФИНАНСИРОВАНИЕИсследование выполнено в рамках научного проекта государственного задания МГУ № 121032300118-0 и частично поддержано в настоящее время грантом Российского научного фонда № 22-24-00209.
Список литературы
Бурыкин Ю.Б., 1992. Рост колоний Dynamena pumila (L.) (Hydrozoa, Sertulariidae) при избыточном питании // Науч. докл. высш. школы. Биол. науки. Вып. 7. С. 37–44.
Бурыкин Ю.Б., 1993а. Зависимость роста и строения колонии Dynamena pumila (L.) (Hydrozoa, Sertulariidae) от путей проникновения в нее пищи // Вестн. МГУ. Сер. 16. Биол. Вып. 1. С. 38–46.
Бурыкин Ю.Б., 1993б. Взаимосвязь в росте разных частей колонии Dynamena pumila (L.) (Hydrozoa, Sertulariidae) при различном количестве пищи // Журн. общ. биологии. Т. 54. № 6. С. 722–738.
Бурыкин Ю.Б., 2010. Основы функционирования распределительной системы колониальных гидроидов // Онтогенез. Т. 41. № 4. С. 300–311.
Бурыкин Ю.Б., 2013. Эстафетный способ перемещения гидроплазмы в колониях гидроидных полипов // Онтогенез. Т. 44. № 2. С. 115–125.
Бурыкин Ю.Б., 2015. Функционирование распределительной системы у колониального гидроида Dynamena pumila (L., 1758) // Вестн. МГУ. Сер. 16. Биол. Вып. 3. С. 44–48.
Дементьев В.С., Марфенин Н.Н., 2018. Влияние опреснения на рост, пульсации ценосарка и перемещение гидроплазмы у колониального гидроида Dynamena pumila (L., 1758) // Журн. общ. биологии. Т. 79. № 5. С. 376–392. https://doi.org/10.1134/S0044459618050044
Дементьев В.С., Марфенин Н.Н., 2019. Воздействие температуры на рост, пульсации ценосарка и перемещение гидроплазмы у колониального гидроида Dynamena pumila (L., 1758) // Журн. общ. биологии. Т. 80. № 1. С. 22–42. https://doi.org/10.1134/S0044459619010032
Дементьев В.С., Марфенин Н.Н., 2021. Эффективность распределительной системы гидроида Dynamena pumila (L., 1758) при различных абиотических воздействиях // Журн. общ. биологии. Т. 82. № 5. С. 323–336. https://doi.org/10.31857/S0044459621050031
Косевич И.А., 1991. Сравнение функционирования верхушек роста побегов и столонов в колонии Obelia loveni (Allm.) (Hydrozoa, Campanulariidae) // Вестн. МГУ. Сер. 16. Биол. № 2. С. 44–52.
Косевич И.А., 1999. Миграции клеток в процессе роста колонии гидроидов // Журн. общ. биологии. Т. 60. № 1. С. 91–98.
Марфенин Н.Н., 1980. Метод картирования пространственной организации колониальных Hydrozoa и его значение при изучении частей колонии // Теоретическое и практическое значение кишечнополостных. Л.: ЗИН АН СССР. С. 66–69.
Марфенин Н.Н., 1985а. Морфофункциональный анализ организации моноподиальных колоний гидроидов с терминально расположенными зооидами на примере Tubularia larynx Ell. et Sol. // Изв. АН СССР. Сер. Биол. № 2. С. 238–247.
Марфенин Н.Н., 1985б. Функционирование распределительной системы пульсаторно-перистальтического типа у колониальных гидроидов // Журн. общ. биологии. Т. 46. № 2. С. 153–164.
Марфенин Н.Н., 1988. Функционирование распределительной системы в колонии у колониальных гидроидов: новый метод и факты // Губки и книдарии. Современное состояние и перспективы исследований. Л.: ЗИН АН СССР. С. 103–111.
Марфенин Н.Н., 1993а. Феномен колониальности. М.: Изд-во МГУ. 237 с.
Марфенин Н.Н., 1993б. Функциональная морфология колониальных гидроидов. СПб.: ЗИН РАН. 151 с.
Марфенин Н.Н., 2016. Децентрализованный организм на примере колониальных гидроидов // Биосфера. Т. 8. № 3. С. 315–337.
Марфенин Н.Н., Дементьев В.С., 2017. Парадокс протяженных течений гидроплазмы в колониальном гидроиде Dynamena pumila (Linnaeus, 1758) // Журн. общ. биологии. Т. 78. № 4. С. 3–20.
Марфенин Н.Н., Дементьев В.С., 2018а. Продольные пульсации столона у колониального гидроида Dynamena pumila (Linnaeus, 1758) // Журн. общ. биологии. Т. 79. № 2. С. 85–96.
Марфенин Н.Н., Дементьев В.С., 2018б. Рост, пульсации ценосарка и перемещение гидроплазмы у колониального гидроида Dynamena pumila (L., 1758) в проточной и непроточной кюветах // Журн. общ. биологии. Т. 79. № 2. С. 97–107.
Марфенин Н.Н., Дементьев В.С., 2019. К вопросу о протяженности гидроплазматических течений у колониального гидроида Dynamena pumila (L., 1758) // Журн. общ. биологии. Т. 80. № 5. С. 348–363. https://doi.org/10.1134/S0044459619050051
Марфенин Н.Н., Дементьев В.С., 2020. Побеги как генераторы гидроплазматических течений в колониальном гидроиде Dynamena pumila (L., 1758) // Журн. общ. биологии. Т. 81. № 6. С. 421–443. https://doi.org/10.31857/S0044459620060032
Марфенин Н.Н., Летунов В.Н., 1980. Некоторые особенности пищевого поведения зимних колоний Dynamena pumila при различных температурных режимах // Биол. науки. № 1. С. 51–56.
Марфенин Н.Н., Бурыкин Ю.Б., Остроумова Т.В., 1999. Организменная регуляция сбалансированного роста гидроидной колонии Gonothyraea loveni (Allm.) // Журн. общ. биологии. Т. 60. № 1. С. 80–90.
Beloussov V.L., Badenko A.L., Katchurin L.A., Kurilo F.L., 1972. Cell movements in morphogenesis of hydroid polyps // J. Embryol. Exp. Morphol. V. 27. P. 317–337.
Braverman M.H., 1969. Studies on hydroid differentiation. IV. Cell movements in Podocoryne carnea hydranths // Growth. V. 33. P. 99–111.
Bumann D., Buss L.W., 2008. Nutritional physiology and colony form in Podocoryna carnea (Cnidaria: Hydrozoa) // Invert. Biol. V. 127. P. 368–380.
Buss L.W., Anderson C.P., Perry E.K., Buss E.D., Bolton E.W., 2015. Nutrient distribution and absorption in the colonial hydroid Podocoryna carnea is sequentially diffusive and directional // PLoS One. V. 10. № 9. P. 1–36. https://doi.org/10.1371/journal.pone.0136814
Conner T.S., Tennen H., Fleeson W., Barrett L.F., 2009. Experience sampling methods: A modern idiographic approach to personality research // Soc. Personal. Psychol. Compass. V. 3. № 3. P. 292–313. https://doi.org/10.1111/j.1751-9004.2009.00170.x
Dementyev V.S., Marfenin N.N., 2021. Effect of air exposure on the growth and distribution system in the colonial hydroid Dynamena pumila (L., 1758) // Invert. Zool. V. 18. № 2. P. 69–79. https://doi.org/10.15298/invertzool.18.2.01
Di Camillo C.G., Bavestrello G., Cerrano C., Gravili C., Piraino S. et al., 2017. Hydroids (Cnidaria, Hydrozoa): A neglected component of animal forests // Marine Animal Forests / Eds Rossi S., Bramanti L., Gori A., Orejas C. Cham: Springer. P. 397–427.
Dudgeon S.R., Wagner A., Vaisnys J.R., Buss J.W., 1999. Dynamics of gastrovascular circulation in the hydrozoan Podocoryne carnea: the one-polyp case // Biol. Bull. V. 196. P. 1–17.
Fulton C., 1960. Culture of a colonial hydroid under controlled conditions // Science. V. 132. P. 473–474.
Fulton C., 1963. Rhytmic movements in Cordylophora // J. Cell. Comp. Physiol. V. 61. № 1. P. 39–51.
Hale L.J., 1960. Contractility and hydroplasmic movements in the hydroid Clytia johnstoni // Quart. J. Microscop. Sci. V. 101. Pt 3. P. 339–350.
Hamaker E.L., Dolan C.V., 2009. Idiographic data analysis: Quantitative methods ‒ from simple to advanced // Dynamic Process Methodology in the Social and Developmental Sciences / Eds Valsiner J., Molenaar P.C.M., Lyra N. N.-Y.: Springer-Verlag. P. 191–216. https://doi.org/10.1007/978-0-387-95922-1_9
Kühn A., 1909. Sprosswachstum und Polypenknospung bei den Thecaphoren. Studien zur Ontogenese und Phylogenese der Hydroiden // Zool. Jahrb. Abt. Anat. Ontog. Tiere. T. 28. Bd. 2. S. 378–476.
Marfenin N.N., Dementyev V.S., 2017. Functional morphology of hydrozoan stolons: stolonal growth, contractility, and hydroplasmic movement in Gonothyraea loveni (Allman, 1859) // Mar. Biol. Res. V. 13. № 5. P. 521–537. https://doi.org/10.1080/17451000.2016.1276292
Parrin A.P., Netherton S.E., Bross L.S., McFadden C.S., Blackstone N.W., 2010. Circulation of fluids in the gastrovascular system of a stoloniferan octocoral // Biol. Bull. V. 219. P. 112–121.
Rees J., Davis L.V., Lenhoff H.M., 1970. Paths and rates of food distribution in the colonial hydroid Pennaria // Comp. Biochem. Physiol. V. 34. P. 309–316.
Suddith R.L., 1974. Cell proliferation in the terminal regione of the internodes and stolons of the colonial hydroid Campanularia flexuosa // Amer. Zool. V. 14. № 2. P. 745–755.
Wyttenbach C.R., 1973. The role of hydroplasmic pressure in stolonic growth movement in the hydroid, Bougainvillia // J. Exp. Zool. V. 186. P. 79–90.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии