Журнал общей биологии, 2021, T. 82, № 5, стр. 382-388
Фрактальный характер формирования системы тилакоидов цианобактерий
В. В. Галицкий *
Институт физико-химических и биологических проблем почвоведения,
Пущинский научный центр биологических исследований РАН
142290 Московская обл., Пущино, Институтская ул., 2, Россия
* E-mail: galvv@rambler.ru
Поступила в редакцию 08.12.2020
После доработки 17.04.2021
Принята к публикации 10.06.2021
Аннотация
Особенности зависимости фрактального параметра μ(Ng, ng) множества точек от числа групп (Ng) и точек в группе (ng) могли стимулировать образование тилакоидов, несущих фотосистемы PSI и PSII, в процессе эволюции цианобактерий. Если количества групп Ng увеличивалось при фиксированном количестве точек ng (2–3, димеры, тримеры) на группу, то виртуальный общий размер H ~ (Ngng)1/μ фотосинтетического аппарата цианобактерий мог стать во много раз больше, чем ограниченный размер самой бактерии. Обсуждаются опубликованные экспериментальные данные, подтверждающие справедливость этого вывода.
В работах В.В. Галицкого (Галицкий, 2016; Galitskii, 2016) показано, что распространение модели динамики зеленой биомассы B дерева по фрактальному параметру μ, связывающему биомассу и размер H кроны дерева
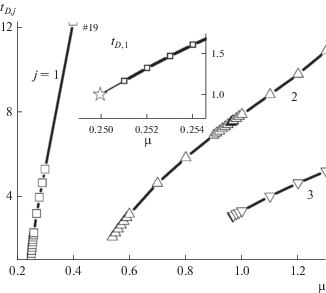
в диапазоне μ (0, 1) демонстрирует наличие ветвей первых трех порядков в этом диапазоне, соответствующем фотосинтезирующей биомассе в виде точечного множества (рис. 1). Этот удивительный на первый взгляд вывод может, однако, рассматриваться как очередное подтверждение эндосимбиотической теории появления и эволюции организмов (Маргелис, 1983) и, в частности, растений. Такое заключение следует из того факта, что размеры хозяина эндосимбиоза и его симбионтов различаются не менее чем на три порядка, т.е. симбионты могут рассматриваться как математические точки, а такая система, вообще говоря, соответствующая фрактальному диапазону μ (0, 1), и может являться объектом исследования методами фрактальной геометрии (Федер, 1991).Рис. 1.
Зависимость времен tD,j(μ) жизни j-ветвей “протоели” в диапазоне μ (0, 1). На врезке в увеличенном масштабе для 1-ветви штриховая линия указывает на значение μ в этом диапазоне, при котором появляется “ветвь” 1-го порядка (по: Галицкий, 2016).
О ФРАКТАЛЬНЫХ СВОЙСТВАХ РАСТУЩЕГО МНОЖЕСТВА ТОЧЕК
Рассмотрение геометрических свойств таких точечных множеств (Галицкий, 2016; Galitskii, 2016) показало, что они могут определять характер морфологической эволюции биологических организмов. Из ряда свойств точечных множеств наиболее важное для дальнейшего – радикально различное поведение функции µ(log2Np) в зависимости от того, как устроено растущее групповое множество (рис. 2).
Рис. 2.
Двумерные изображения трехмерных зависимостей μ(Ng, ng) для групповых размещений математических точек (по: Галицкий, 2018). Два типа траекторий: спадающие траектории μ для фиксированных значений ng, fix (тонкие сплошные линии, маленькие пустые кружки) и растущие траектории для фиксированных величин Ng, fix (тонкие пунктирные линии), – которые соответственно проходят через те же точки с ординатами μ(Ng, ng) и целыми абциссами log2(Ng ng/2). Два примера эволюции фрактального параметра для размещений фотосинтезирующих точек в ходе эволюции от цианобактерий до проторастения, состоящие из элементов двух типов траекторий (толстая сплошная линия и тонкая штриховая линия с большими пустыми квадратами). Обе начинаются в различных местах траектории ng, fix = 2 и идут различными путями к μ = 1. Значения μ при ☆ (μ#19 = 0.24966 и μ#31 = 0.27281, см. ☆ на рис. 1 для #19 как пример получения этих значений) соответствуют двум группам натурных данных о продолжительностях жизни ветвей всех порядков ели (Цельникер, 1994) и их модельной интерпретации (Галицкий, 2012). T2 = log2(Np/2), где Np = = Ng ng, fix или Ng, fixng есть эволюционное эрзац-“время”, измеряемое числом удвоений Np вдоль траектории. T2 не является временем эволюции.
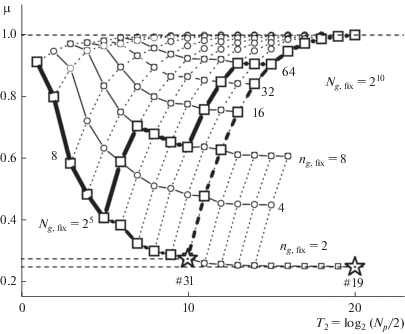
Если при увеличении суммарного количества точек Np число точек в группе не меняется и рост Np = Ngng происходит за счет роста числа групп Ng, то µ уменьшается, стремясь к некоторому значению µ(ng, fix). При ng, fix = 2 это значение равно µ(ng, fix) ≈ ≈ 0.25 и с увеличением ng, fix соответствующее предельное значение тоже увеличивается. Если же при увеличении суммарного количества точек Np число групп Ng не меняется и рост Np происходит за счет роста числа ng точек в группе, то µ растет от величины, достигнутой вдоль предыдущей траектории первого типа, стремясь к 1. Эти два типа траекторий могут сменять друг друга в ходе морфологической эволюции соответственно имеющимся интенсивности и качеству освещения. На рис. 2 представлены два примера возможных траекторий фрактального параметра в ходе эволюции от цианобактерий до прото-растения, состоящие из элементов двух типов траекторий – толстая сплошная линия и тонкая штриховая линия с большими пустыми квадратами. Обе начинаются в различных местах траектории ng, fix = 2 и идут различными путями к μ = 1. Одна из них может быть интерпретирована как вариант с несколькими переменами в режиме освещенности в ходе эволюции и демонстрирует возможность регрессионных этапов эволюции (уменьшения μ), если, например, спектр света сместился в диапазон более коротких волн, а хозяин эндосимбиоза не смог при этом обеспечить транспорт растущего количества углеводов.
Далее мы рассмотрим следствие этого модельного представления о причине и фрактальных особенностях эволюции аппарата фотосинтеза проторастительного организма на стадии фиксированного числа фотосинтезирующих “точек” в группах, которая могла играть важную роль, по крайней мере, в изменении его внутренней морфологии соответственно интенсивности и спектральным особенностям освещения.
Уместно сделать два замечания общего характера. Во-первых, приведенное выше формальное обсуждение фрактальных свойств растущего множества групп точек, размещенных в пространстве, исходит только из соотношения размеров (≥103) всего множества и отдельной реальной “точки” и того, что, согласно фрактальной геометрии, пространственный размер H множества элементов, аддитивно вкладывающих некие результаты своего функционирования в соответствующую функцию всего множества, связан с количеством Np элементов множества степенным соотношением
где μ – фрактальный параметр (Федер, 1991). Формальный характер этого соотношения при указанных условиях позволяет применять его к объектам разной природы и происхождения. Во-вторых, согласно Б. Мандельброту (1988), “фрактал – структура, состоящая из частей, в каком-то смысле подобных целому” (Федер, 1991, с. 19), и это существенно для исследований фотосинтеза на всех уровнях его организации. В частности, этому определению удовлетворяет ряд множеств: листья растений, хлоропласты в листьях, фотосистемы PSI и PSII в тилакоидах цианобактерий и гранах хлоропластов.ОБ ОГРАНИЧЕНИИ РОСТА РАЗМЕРА АППАРАТА ФОТОСИНТЕЗА
В связи с предельной простотой фрактальной модели эндосимбиоза, представленной выше, очевидное наличие двух вариантов поведения модели требует обсуждения с точки зрения возможных причин и вариантов поведения реального биологического объекта – фотосинтезирующего эндосимбиоза. Для разграничения этих двух вариантов в случае эндосимбиоза, по-видимому, достаточно предположить, что первый (с фиксацией числа ng фотосинтезирующих “точек” в группе) реализуется, пока для увеличения ng хозяин эндосимбиоза не имеет необходимых условий, например, не создаст необходимой инфраструктуры (Галицкий, 2016). Очевидно, что исходно хозяин не имеет всего необходимого для увеличения ng, fix, и поскольку он заинтересован в дополнительной энергии от симбионтов, происходит по мере возможности экстенсивный рост числа Np за счет увеличения числа групп Ng. Однако, как видно из рис. 2, такое увеличение не происходит даром – оно сопровождается ростом размера фотосинтезирующего аппарата пропорционально $N_{p}^{{1/\mu }}$, где μ можно определить по соответствующей ng, fix-кривой (рис. 2). Так, при ng, fix = 2 (толстая линия) и не слишком малом числе групп, например Ng ≈ 1000, параметр μ ≈ 0.25, и это значит, что при удвоении числа точек размер аппарата фотосинтеза должен увеличиться в 16 раз. Если хозяин, размеры которого неизменны, не может вместить такой аппарат, то возникает необходимость эволюционных изменений хозяина и симбионтов. Как будет показано ниже, такие изменения могли, по-видимому, начаться еще до морфологического и функционального оформления гран в хлоропластах из бывших цианобактерий путем появления, увеличения числа и объединения в прообразы стеков уже имевшихся к тому времени в цианобактериях тилакоидов, несущих собственно “точки” – фотосистемы PSI и PSII. Граны уже могли появиться после включения предков нынешних цианобактерий в эндосимбиозы, получив форму трехмерного стека тилакоидов, обвитого объединяющей их спиральной ламеллярной мембраной, функции и конкретная форма которой являются предметом продолжительной дискуссии (Mustárdy, Garab, 2003; Bussi et al., 2019).
ТИЛАКОИДЫ ВОЗНИКЛИ ИЗ-ЗА ОГРАНИЧЕННОСТИ РАЗМЕРА ЦИАНОБАКТЕРИЙ
Вышесказанное представляет собой минимальную модель эндосимбиотического появления проторастения (Галицкий, 2016), описывающую морфологический аспект процесса, в котором участвовали две стороны – предки цианобактерий и хозяина-амебы (Nozaki, 2005) – уже прошедшие, вообще говоря, определенные этапы эволюции. Для цианобактерий, уже ставших симбионтами, эти этапы располагаются в диапазоне (0, 1) параметра μ (рис. 2; Galitskii, 2018) и, как видно из дальнейшего, по-видимому, соответствуют величинам ng, fix существенно бóльшим, чем 2, и значениям μ, близким к 1.
Можно предположить, что ограничение размера было важным и для предка цианобактерий, когда в начале кислородной эры при слабом и, видимо, более длинноволновом свете биосинтез переходил на кислородную траекторию, бактерии тем или иным способом обзаводились фотосинтезирующими компартментами (прототип фотосистемы PSI) и размещали их на внутренней стороне цитоплазматической мембраны (например, редкий современный вид цианобактерий Gloeobacter violaceus sp. PCC 7421, не имеющих тилакоидов) (Bernat et al., 2012; Montejano et al., 2018; Mechela et al., 2019). С ростом числа фотосинтезирующих элементов увеличивалось поступление энергии. Когда согласно (2) для растущего аппарата фотосинтеза не стало хватать места на внутренней стороне цитоплазматической мембраны, решение этой проблемы, по-видимому, было морфологическим: внутренняя сторона мембраны – слой, содержащий фотосистемы, – был преобразован путем “впячивания” (инвагинации; Mullineaux, 1999; Mechela et al., 2019) (рис. 3а) растущего участка, несущего избыточные для плазматической мембраны фотосинтезирующие элементы, в специальный компартмент – прототилакоид, ныне контактирующий (соединяющийся) с исходной мембраной в центре биогенеза (Stengel et al., 2012; Heinz et al., 2016) или зоне конвергенции мембран (Rast et al., 2019). Компартмент-тилакоид был расположен и располагается у современных цианобактерий на периферии клетки вблизи плазматической мембраны (Mareš еt al., 2019), используя таким образом максимально возможную площадь для размещения фотосинтетического аппарата.
Рис. 3.
a – двумерная схема начала появления тилакоида путем выделения через некий мостик части внутреннего слоя плазматической мембраны цианобактерии, содержащего фотосинтезирующие элементы предка современных цианобактерий, не имеющего (или потерявшего в ходе эволюции) тилакоидов, подобно современной цианобактерии Gloeobacter violaceus sp. PCC 7421 (по: Mechela et al., 2019, Fig. 2(d)(i)). б – схема участков мембраны в зоне конвергенции тилакоидов (по: Rast et al., 2019, Fig. 6a ). OM – наружная мембрана; PM – плазматическая мембрана; PM-facing – тилакоидные мембраны, обращенные к PM; TM-facing – тилакоидные мембраны, обращенные к другим тилакоидам; Cyt-facing – тилакоидные мембраны, обращенные к цитозолю; CM – конвергентные мембраны и область тилапса (прямоугольник со штрих-контуром).
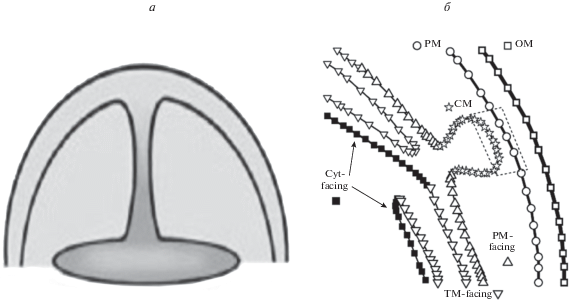
Механизм, который может приводить к такому “впячиванию”, не известен в целом, но некоторые его детали можно достаточно обоснованно предположить. Так, фрактальный рост аппарата фотосинтеза, исходно состоящего из небольшого числа, например, димеров, представляющих собой группу из двух мономеров, с ростом числа групп в ходе работы центра биогенеза должен идти по траектории уменьшения параметра μ (рис. 2, ng, fix = 2). При достаточно малом его значении и ограниченном размере бактерии внутренняя поверхность мембраны будет полностью заполнена. Если центр биогенеза продолжает работу, то должен возникнуть конфликт из-за попытки размещения фотосистемы на уже занятой территории. Конфликт, как видно, разрешился эволюционным путем – появлением тилакоида. Можно предположить, что “впячивание” произошло в результате деформации внутренней границы цитоплазматической мембраны, исходно имеющей локальную форму, близкую к шарообразной (схема математического описания такой ситуации представлена Л.Д. Ландау и Е.М. Лифшицем (1965)). При этом существенно, что в ходе деформации граница мембраны должна локально круто изгибаться, что наблюдается в реальности.
В работе Раста с соавторами (Rast et al., 2019) методом криоэлектронной томографии получена 3D-модель пространственного расположения тилакоидной и цитоплазматической мембран бактерии Synechocystis. Модель показывает наличие слияния кончиков нескольких тилакоидов с образованием субструктуры, названной “конвергентной мембраной”. Эта мембрана имеет высокую кривизну и на отдельных участках входит в тесный контакт с плазматической мембраной, в связи с чем авторы, желая подчеркнуть определенное соответствие с синапсом, назвали этот контакт “thylapse”. Как можно видеть из рис. 3, высокая локальная кривизна имеет существенное значение для образования тилакоидов. В процессе образования тилакоидов для изгибания тилакоидных мембран используется семейство белков CURT1 (A–D), обнаруженных недавно в некоторых современных цианобактериях и в хлоропластах Arabidopsis thaliana (Armbruster et al., 2013; Heinz et al., 2016). Эти белки локализуются на границах граны, вызывая изгиб мембраны и определяя тем самым архитектуру тилакоидной сети. Предполагается, что они могли участвовать в изгибании стромальной стороны цитоплазматической мембраны при появлении первого тилакоида и используются и теперь в цианобактериях и хлоропластах. Это косвенно подтверждает предположение о роли ограниченности размера цианобактерий в начале процесса формирования системы их тилакоидов.
О ГРУППОВЫХ РАЗМЕЩЕНИЯХ ФОТОСИСТЕМ НА ТИЛАКОИДАХ ЦИАНОБАКТЕРИЙ
Фотосинтезирующими компартментами цианобактерий, как и их потомков – растений – являются фотосистемы PSI и PSII, а их движущую фотосинтезирующую силу составляют тримеры, димеры и мономеры со светособирающими комплексами-антеннами, которые собирают фотоны и преобразуют их энергию в энергию углеводов. Сравнение размеров цианобактерий (≈1 мкм) и мономера (≈10 нм) показывает, что “точечное” приближение возможно. В отличие от цианобактериального эндосимбиоза, для которого можно предполагать свободное размещение в группе, мультимеры имеют не только фиксированное число “точек” в минимальных группах димера и тримера, но, по-видимому, и достаточно жесткое их взаимное размещение в группе.
Первые цианобактерии, участвовавшие в кислородном фотосинтезе и свободно жившие, подобно Gloeobacter, не имели тилакоидов и размещали фотосистемы на внутренней поверхности плазматической мембраны, т.е. формально для них мы можем использовать ту же фрактальную модель растущей фотосинтезирующей системы и, следовательно, ожидать размещения фотосинтезирующих элементов по две-три точки на группу.
В работе Каселла с соавторами (Casella et al., 2017, Fig. 1E, F) приведены удивительные по детальности визуализации нативного размещения фотосистем PSI и PSII в тилакоидных мембранах цианобактерии Synechococcus elongatus PCC 7942, полученные c применением атомно-силовой микроскопии высокого разрешения (AFM). Эти изображения, по крайней мере рис. 4а, по-видимому, показывают, что этот результат моделирования (парное, димерное размещение “точек” в группах по ng, fix = 2) может по крайней мере для PSII соответствовать реальности – каждый овал (димер PSII) везде находится рядом в паре со вторым овалом и многие пары соседствуют со второй парой. Поэтому параметр ng, fix спадающих зависимостей μ(Np, ng, fix) для этого изображения можно считать равным ng, fix = 22, если считать “точкой” мономер, а значение ng, fix = 21 соотносить с димером. Тогда из рис. 4а, согласно модели (рис. 2; Galitskii, 2018), следует, что предки бактерии S. elongatus по меньшей мере однажды могли испытывать изменение эволюционной траектории μ(Np) и вполне возможно, что это было связано с применением белка CURT1.
Рис. 4.
a – AFM топография высокого разрешения просветной поверхности тилакоидных мембран цианобактерии Synechococcus elongatus PCC 7942 в жидком растворе (по: Casella et al., 2017, Fig. 1F). Отдельные димеры представляют собой комплексы PSII (штрих-овалы) на основании выступов комплексов на просветной поверхности мембраны. Белые звездочки указывают на возможное расположение тримеров PSI – выступы на стромальной стороне мембраны. б – AFM топография домена тилакоидной мембраны, содержащая массивы тримерных комплексов тилакоидной мембраны из Thermosynechococcus elongates (по: MacGregor-Chatwin et al., 2017, Fig. 1A). Это изображение нативной мембранной организации показывает упорядоченные массивы макромолекул, состоящие исключительно из PSI, идентифицированные по их характерной тримерной форме. Другие четыре участка мембраны показали, что PSI перемежается с белковыми комплексами, идентифицированными как PSII.
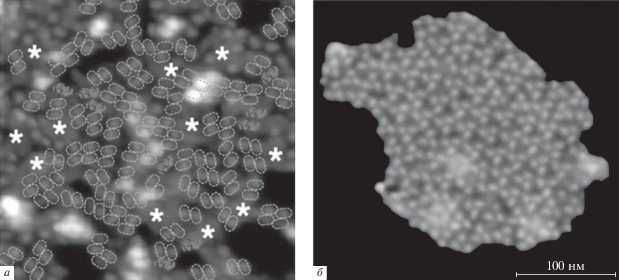
В статье Макгрегора-Чатвина с соавторами (MacGregor-Chatwin et al., 2017) подобная техника AFM микроскопии была использована для исследования особенностей размещения фотосистем PSI (и PSII) на тилакоидах трех видов цианобактерий – Thermosynechococcus elongatus, Synechococcus sp. PCC 7002 и Synechocystis sp. PCC 6803. Показано наличие больших плотно упакованных доменов, состоящих только из фотосистем PSI (в шестиугольной схеме упаковки тримеров) и демонстрирующих наличие дальнего порядка (рис. 4б), а также PSI-доменов с примесью фотосистем PSII. Было выполнено структурное моделирование мембранного моно-PSI-ландшафта и переноса возбуждения через соседние мономеры PSI; вывод: основная роль схемы упаковки тримеров, по-видимому, заключается в максимизации эффективности упаковки комплексов PSI на мембране, а не в содействии передаче энергии между тримерами. Последнее можно трактовать как возможное свидетельство того, что при появлении тримерной PSI площадь мембраны была дефицитной и ее форма была близка к шарообразной. Тримерная система точек более эффективно использует площадь мембраны (μ ≈ 0.37) и, соответственно, энергию света, что было важно в условиях архейской Земли с атмосферой, обогащенной углеводородными компонентами и со слабым молодым Солнцем (Arney et al., 2016).
Димерная PSII, видимо, морфологически более эффективная для “палочковой” формы бактерий, использует излучение с меньшими длинами волн, более чувствительна к недостатку площади мембраны (μ ≈ 0.25). По данным Макгрегора-Чатвина с соавторами (MacGregor-Chatwin et al., 2017) для исследованных трех видов цианобактерий наблюдаемое соотношение тримеры/димеры равно Ng, 3/Ng, 2 = 4. Оценка для приведенной в этой работе численности тримеров Ng, 3 = 96 с использованием для димера значения µ2 ≈ 0.24966 (рис. 2) и вычисленного для тримера с использованием ньютоновской интерполяции значения µ3 ≈ 0.36539 дает
и, соответственно, Ng, 3/Ng, 2 ≈ 4.008. Эта оценка сделана в предположении, что фотосинтезирующие димеры и тримеры независимо занимают одну и ту же площадь внутренней мембраны цианобактерии (величины μ2 и μ3 вычислялись по отдельности). Такое предположение достаточно реально, поскольку димеры и тримеры эффективно располагаются на разных поверхностях плазматической мембраны цианобактерии S. elongatus PCC 7942: PSII примерно на 4 нм выступает на просветной стороне (Casella et al., 2017), а PSI – примерно на 3.2 нм на стромальной (MacGregor-Chatwin et al., 2017).ЗАКЛЮЧЕНИЕ
Ряд опубликованных в 2013–2019 гг. экспериментальных работ по морфологии и геномике цианобактерий, выполненных с использованием новейших достижений научной техники и технологии, подтверждают некоторые из представленных ранее модельных результатов или, по крайней мере, не противоречат им. Начальные этапы возникновения и эволюции аппарата фотосинтеза проходили в плоских групповых размещениях на внутренней стороне плазматической мембраны по 2–3 мономера на группу (димеры, тримеры) путем увеличения числа Ng групп и соответствующих уменьшения фрактального параметра μ до ≈ 0.25–0.37 и увеличения продукции фотосинтеза. Это давало бактериям возможность, хотя и не вполне эффективно, использовать фотосинтез, пока создавалась трехмерная тилакоидная структура с растущим μ. Начальные минимальные группы и фрактальные свойства точечных множеств согласованно вынуждали цианобактерии, размеры которых ограничены, искать конструктивные способы размещения растущего числа групп. В результате этих поисков предки цианобактерий нашли способ преодолеть ограниченность собственных размеров и, искривляя внутреннюю поверхность цитоплазматической мембраны, начали создавать дополнительные поверхности для размещения фотосинтезирующих элементов – тилакоиды. Для достижения нужной при этом высокой кривизны требовались специальные белки. Такие белки CURT1 недавно были найдены у современных растений и цианобактерий (Armbruster et al., 2013) и в тилакоидах современных цианобактерий уже имеются группы из двух димеров (рис. 4а) и упорядоченные массивы (Ng ng = 96 × 3 “точек”) тримеров (рис. 4б), т.е. вместе с появлением тилакоидов происходит укрупнение групп и увеличение μ → 1.
С другой стороны, экспериментальные данные позволили уточнить наши представления (Галицкий, 2016) о соответствии некоторых модельных результатов реальному ходу начальных этапов эволюции фотосинтезирующих организмов. Так, по-видимому, эндосимбиотическое возникновение собственно проторастения шло по траекториям эволюции µ, проходящим вблизи µ = 1.0 (рис. 2), с участием симбионтов-цианобактерий, уже прошедших заметный путь эволюции и имевших некоторое количество тилакоидов в качестве исходных элементов для образования гран (стеков из тилакоидов) в современных хлоропластах. Соответственно, траектории, проходящие вблизи µ ≈ 0.25, должны быть оставлены для начала эволюции цианобактерий с небольшим количеством групп мультимеров (димеры, тримеры и т.п.).
В данной работе использовано весьма упрощенное представление фотосинтетического аппарата: мономеры фотосистем PSI и PSII считаются морфологически одинаковыми и принимаются равноценными “фотосинтезирующими элементами”, поскольку в оксигенном фотосинтезе превращение световой энергии в химическую происходит с непосредственным участием последовательно функционирующих фотосистемы I и фотосистемы II, которые, располагаясь на разных сторонах одной мембраны тилакоида цианобактерии (см. (3)) и выполняя разные функции, совместно решают общую задачу (Карапетян, 2001; Caffarri et al., 2014; Goldschmidt-Clermont, Bassi, 2015; Ризниченко, Рубин, 2020). В процессе фотосинтеза на разных его этапах участвуют и другие белки тилакоида (интегральный цитохром-b6f-комплекс, подвижные переносчики пластохинон и пластоцианин, а также и АТФ-синтаза). Интегральные белки имеют определенное пространственное распределение, соответствующее их роли в физиологических процессах, электростатическим свойствам и т.д.
Как видно из предыдущего рассмотрения возможной причины образования тилакоидов в ходе эволюции аппарата фотосинтеза цианобактерий, фрактальный параметр µ в выражении (2), который связывает количество Np “точек”, участвующих в процессе фотосинтеза, с размером H системы точек, не зависит (по крайней мере непосредственно) от физических и биологических характеристик аппарата фотосинтеза или его элементов, которые определяют его функционирование в онтогенетическом масштабе времени. Иными словами, в данном случае учет фрактальности объекта дает возможность естественным образом несколько редуцировать весьма громоздкую полную модель объекта (Устинин и др., 2013), получив при этом довольно хорошее согласие с экспериментальными данными о внутренней морфологии цианобактерий. С подобной особенностью, в частности, связано широкое применение методов фрактальной геометрии в исследованиях систем весьма различной природы, состоящих из множества размещенных в пространстве однотипных элементов, аддитивно вкладывающих в общую функцию системы, что собственно и характерно для фотосинтеза цианобактерии.
Автор признателен анонимному рецензенту и научному редактору Д.О. Логофету за тщательное прочтение текста и полезные замечания.
Список литературы
Галицкий В.В., 2012. Динамика биомассы ветвей высших порядков дерева. Модельный анализ // Журн. общ. биологии. Т. 73. № 6. С. 442–452.
Галицкий В.В., 2016. Траектории эволюции в пространстве параметров секционной модели кроны ели. Появление “проторастения” // Журн. общ. биологии. Т. 77. № 6. С. 409–422.
Карапетян Н.В., 2001. Фотосистема 1 цианобактерий: организация и функции // Успехи биол. химии. Т. 41. С. 39–76.
Ландау Л.Д., Лифшиц Е.М., 1965. Теория упругости. М.: Наука. 202 с.
Мандельброт Б., 1988. Самоаффинные фрактальные множества // Фракталы в физике / Под ред. Пьетронеро Л., Тозатти Э. М.: Мир. 672 с.
Маргелис Л., 1983. Роль симбиоза в эволюции клетки. М.: Мир. 352 с.
Ризниченко Г.Ю., Рубин А.Б., 2020. Вопросы математического моделирования в биологии. Ч. 1. Динамические модели первичных процессов фотосинтеза // Успехи соврем. биологии. Т. 140. № 4. С. 315–332.
Устинин Д.М., Коваленко И.Б., Ризниченко Г.Ю., Рубин А.Б., 2013. Сопряжение различных методов компьютерного моделирования в комплексной модели фотосинтетической мембраны // Компьютерные исследования и моделирование. Т. 5. № 1. С. 65–81.
Федер Е., 1991. Фракталы. М.: Мир. 260 с.
Цельникер Ю.Л., 1994. Структура кроны ели // Лесоведение. № 4. С. 35–44.
Armbruster U., Labs M., Pribil M., Viola S., Xu W. et al., 2013. Arabidopsis CURVATURE THYLAKOID1 proteins modify thylakoid architecture by inducing membrane curvature // Plant Cell. V. 25. № 7. P. 2661–2678.
Arney G., Domagal-Goldman S.D., Meadows V.S., Wolf E.T., Schwieterman E. et al., 2016. The pale orange dot: the spectrum and habitability of hazy Archean Earth // Astrobiology. V. 16. № 11. P. 873–899.
Bernat G., Schreiber U., Sendtko E., Stadnichuk I.N., Rexroth S. et al., 2012. Unique properties vs. common themes: The atypical cyanobacterium Gloeobacter violaceus PCC 7421 is capable of state transitions and blue-light-induced fluorescence quenching // Plant Cell Physiol. V. 53. № 3. P. 528–542.
Bussi Y., Shimoni E., Weiner A., Kapon R., Charuvi D. et al., 2019. Fundamental helical geometry consolidates the plant photosynthetic membrane // PNAS. V. 116. № 44. P. 22366–22375.
Caffarri S., Tibiletti T., Jennings R.C., Santabarbara S., 2014. A comparison between plant photosystem I and photosystem II architecture and functioning // Curr. Protein Pept. Sci. V. 15. P. 296–331.
Casella S., Huang F., Mason D., Zhao G., Johnson G.N. et al., 2017. Dissecting the native architecture and dynamics of cyanobacterial photosynthetic machinery // Mol. Plant. V. 10. P. 1434–1448.
Galitskii V.V., 2016. Initial growth deceleration as an immanent property of plants // Paleontol. J. V. 50. № 13. P. 77–87.
Galitskii V.V., 2018. Fractal features of proto-plant’s origin and their possible consequences // bioRxiv. https://doi.org/10.1101/083543
Goldschmidt-Clermont M.P., Bassi R., 2015. Sharing light between two photosystems: mechanism of state transitions // Curr. Opin. Plant Biol. V. 25. P. 71–78.
Heinz S., Rast A., Shao L., Gutu A., Gügel I.L. et al., 2016. Thylakoid membrane architecture in Synechocystis depends on CurT, a homolog of the granal CURVATURE THYLAKOID1 proteins // Plant Cell. V. 28. P. 2238–2260.
MacGregor-Chatwin C., Sener M., Barnett S.F.H., Hitchcock A., Barnhart-Dailey M.C. et al., 2017. Lateral segregation of photosystem I in cyanobacterial thylakoids // Plant Cell. V. 29. P. 1119–1136.
Mareš J., Strunecký O., Bucinská L., Wiedermannová J., 2019. Evolutionary patterns of thylakoid architecture in cyanobacteria // Front. Microbiol. V. 10. Art. 277. https://doi.org/10.3389/fmicb.2019.00277
Mechela A., Schwenkert S., Soll J., 2019. A brief history of thylakoid biogenesis // Open Biol. V. 9. P. 180–237.
Montejano G., Becerra‑Absalon I., Gold‑Morgan M., Osorio‑Santos K., 2018. Gloeobacter violaceus: primitive reproductive scheme and its significance // Plant Syst. Evol. V. 304. P. 1221–1229.
Mullineaux C.W., 1999. The thylakoid membranes of cyanobacteria: structure, dynamics and function // Aust. J. Plant Physiol. V. 26. P. 671–677.
Mustárdy L., Garab G., 2003. Granum revisited. A three-dimensional model – where things fall into place // Trends Plant Sci. V. 8. P. 117–122.
Nozaki H., 2005. A new scenario of plastid evolution: Plastid primary endosymbiosis before the divergence of the “Plantae,” emended // J. Plant Res. V. 118. P. 247–255.
Rast A., Schaffer M., Albert A., Wan W., Pfeffer S. et al., 2019. Biogenic regions of cyanobacterial thylakoids form contact sites with the plasma membrane // Nat. Plants. V. 5. P. 436–446.
Stengel A., Gugel I.L., Hilger D., Rengstl B., Jung H., Nickelsen J., 2012. Initial steps of photosystem II de novo assembly and preloading with manganese take place in biogenesis centers in Synechocystis // Plant Cell. V. 24. P. 660–675.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


