Журнал общей биологии, 2021, T. 82, № 5, стр. 389-400
3D-биопринтинг микроокружения опухоли: последние достижения
С. В. Тимофеева 1, *, Т. В. Шамова 1, А. О. Ситковская 1
1 Национальный медицинский исследовательский центр онкологии МЗ РФ
344037 Ростов-на-Дону, Ул. 14-я линия, 63, Россия
* E-mail: timofeeva.sophia@gmail.com
Поступила в редакцию 27.04.2021
После доработки 03.06.2021
Принята к публикации 21.06.2021
Аннотация
Достижения в области клеточной и молекулярной биологии привели к развитию персонализированной медицины, направленной на адаптацию методов диагностики и лечения для каждого конкретного пациента. Одним из таких достижений считается 3D-биопринтинг. Методы 3D-биопринтинга позволяют воссоздать микроокружение опухоли (tumor microenvironment, TME) пациента, максимально точно отражая ключевые этапы распространения рака, такие как инвазия, интравазация и ангиогенез. В качестве биочернил для 3D-печати используют разные типы клеток в зависимости от опухоли. В основном исследования в данной области концентрируются на нескольких направлениях: оптимизация биочернил и конструкций, выбор между использованием иммортализованных или первичных клеточных линий для печати и тестирование противоопухолевых агентов в 2D- и 3D-моделях различных злокачественных опухолей. Таким образом, разработка 3D-моделей TME создает условия для оптимизации стратегии лечения опухоли in vitro. В настоящем обзоре описаны уже существующие 3D-модели TME различных нозологий и перспективы их использования в онкологии.
На фоне растущего интереса к использованию иммунотерапии для лечения онкологических больных становится крайне важно оценить возможность формирования идентичной пациенту модели опухоли с имитацией иммунного профиля и ее микроокружения (tumor microenvironment, ТМЕ) (Олейник и др., 2020).
Опухоль включает несколько типов клеток, каждый из которых играет определенную роль в развитии и скорости прогрессирования заболевания, а также в прогнозе и исходе лечения. Опухоль каждого конкретного пациента уникальна за счет гетерогенности клеток, набора молекулярно-генетических маркеров, а также собственного спектра продуцируемых биологических веществ и состава рецепторов (Скворцова и др., 2014).
Недавние исследования показали, что различные типы клеток, обнаруженные в ТМЕ, важны для модуляции биологии опухоли, а также для реакции на лекарственные соединения (Jeffries et al., 2020). Основной проблемой при разработке потенциальных противоопухолевых препаратов и методов лечения является несоответствие эффективности кандидатов in vitro и in vivo (Vanderburgh et al., 2017). В отличие от монослойных культур клеток на плоских поверхностях, которые не способны воспроизвести характеристики естественного TME, сфероиды имитируют нативные ткани, повторяя их архитектонику, спектр растворимых веществ, экспрессию ряда рецепторов, сложные взаимодействия клеток между собой, а также внеклеточный матрикс (ВКМ) (Просекина и др., 2019; Межевова и др., 2020а). Таким образом, создание опухолевых 3D-моделей позволяет решить проблему пространственного расположения гетерогенных клеток в культуре, а также имитировать естественное поведение TME in vivo как на фенотипическом, так и на генетическом уровнях (Meng et al., 2019).
В настоящем обзоре рассмотрены последние достижения в области 3D-биопринтинга TME и перспективы их использования в онкологии.
TME
Микроокружение опухоли характеризуется двунаправленной связью между множеством клеточных и неклеточных компонентов, оказывая влияние на развитие и прогрессирование рака (Jin M., Jin W., 2020). TME представляет собой строму с клетками различного типа: ангиогенные сосудистые, инфильтрирующие иммунные, эндотелиальные, стромальные клетки, сопутствующие белки внеклеточного матрикса и внеклеточные сигнальные молекулы (хемокины, цитокины, факторы роста, метаболические регуляторы) (Altorki et al., 2019; Олейник и др., 2020).
Ангиогенез является одним из основных факторов прогрессирования и метастазирования опухоли (Hanahan, Weinberg, 2011) (рис. 1). Вследствие структурных и функциональных изменений свойств сосудистой сети внутри опухоли появляются участки гипоксии. Гипоксия в опухоли может повлиять на экспрессию генов опухолевых клеток, тем самым увеличивая выживаемость клеток и их устойчивость к апоптозу (Trédan et al., 2007). Процесс ангиогенеза регулируется рядом факторов роста, таких как фактор роста тромбоцитов (PDGF), фактор роста фибробластов (FGF), трансформирующий фактор роста α (TGF-α) и фактор роста эндотелия сосудов (VEGF) (Fukumura et al., 1998).
Рис. 1.
Схема взаимодействия TME и стромальных клеток опухоли, а также распространение опухолевых клеток и интравазация в кровеносные сосуды. 1 – секреция ВКМ; 2 – рекрутирование провоспалительных клеток; 3 – ангиогенез; 4 – циркулирующие опухолевые клетки; 5 – диссеминирование опухолевых клеток. CAF – опухоль-ассоциированные фибробласты.
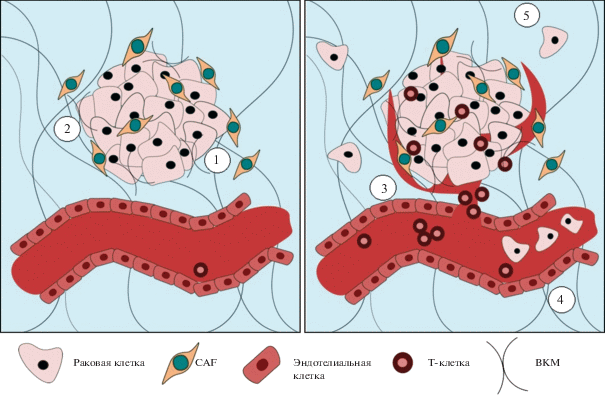
Известно, что состав и функции иммунных клеток в TME значительно различаются между разными типами злокачественных опухолей. Метаболические изменения и недостаток питательных веществ меняют фенотип и функции T-лимфоцитов в пределах TME (Zhang et al., 2017). Исследователи сходятся во мнении, что T-клетки в TME находятся в состоянии анергии, т.е. гипореактивности с нарушенной пролиферацией и секрецией интерлейкина-2 (IL-2) (Jiang et al., 2015). Недостаток глюкозы в TME может стать одной из причин подобного состояния. Поскольку основной метаболической программой опухолевых клеток является гликолиз, опухолевые клетки захватывают больший процент глюкозы из TME, вследствие чего Т-клетки лишаются энергетического субстрата. Таким образом, Т-клетки полностью не активируются, и поэтому уменьшается их экспансия и дифференцировка, что приводит к снижению эффекторных функций Т-клеток в TME (Chang et al., 2013). Выделяют еще несколько основных причин нарушения функций Т-клеток в TME: отсутствие распознавания Т-клеточными рецепторами, потеря способности к клональной экспансии антигенспецифических Т-клеток (Töpfer et al., 2011), подавление иммунной активации опухолевыми ингибиторами костимуляции (Pardoll, 2012) и др. (Gajewski, 2007).
В свою очередь, иммунные клетки тесно взаимодействуют со стромальными, включая опухоль-ассоциированные фибробласты (ОАФ) (Lakins et al., 2018). Фибробласты составляют значительную часть стромальных элементов злокачественных опухолей. В покоящемся состоянии фибробласты не обладают активированным фенотипом и продуцируют компоненты ВКМ (коллаген, гликозаминогликаны и гликопротеины), которые необходимы в случае ремоделирования тканей, например, при формировании фиброза. Активация ОАФ происходит за счет факторов микроокружения, таких как трансформирующий фактор роста β (TGF-β), bFGF. ОАФ продуцируют сигнальные белки (фактор роста гепатоцитов (HGF), а также гормоны и цитокины), способствуя усилению пролиферации опухолевых клеток (Avnet et al., 2019). Кроме того, ОАФ экспрессируют факторы ангиогенеза, такие как VEGF и PDGF. Потенциальными источниками ОАФ могут быть активированные факторами роста мезенхимальные стволовые клетки из костного мозга или эпителиальные/эндотелиальные клетки, которые приобретают свойства мезенхимальных клеток через эпителиально-мезенхимальный переход/эндотелиально-мезенхимальный переход (ЭМП/ЭндМП) (Anderberg et al., 2009). ОАФ продуцируют матриксные металлопротеиназы (ММП), которые оказывают влияние на ангиогенез и метастазирование клеток, способствуя инвазии опухолевых клеток (Kalluri, Zeisberg, 2006). ОАФ не подвержены апоптозу, и их активация необратима.
Подвидом активированных фибробластов являются миофибробласты. Миофибробласты обладают комбинированными свойствами фибробластов и гладкомышечных клеток (Arneth, 2019). Миофибробласты, в отличие от фибробластов, характеризуются экспрессией гладкомышечного актина-α (α-SMA) в ответ на стимуляцию TGF-β и PDGF и при онкогенезе (Choi et al., 2018). Миофибробласты продуцируют стромальный фактор роста-1 (SDF-1), который усиливает рост опухоли и метастазирование через рецептор CXCR4. Помимо этого, миофибробласты секретируют компоненты, которые стимулируют инвазию опухолевых клеток – инсулиноподобный фактор роста 1 (IGF-1), HGF, VEGF, IL-6 (Affo et al., 2017).
Эндотелиальные клетки локализуются в лимфатических и кровеносных сосудах и формируют сосудистую сеть опухоли. Пролиферация эндотелиальных клеток может быть инициирована VEGF или bFGF (Hanahan, Weinberg, 2011).
Одной из субпопуляций опухолевых клеток являются опухолевые стволовые клетки (ОСК), которые взаимодействуют с TME посредством активации сигнальных каскадов Notch-1 и PI3K (Mao et al., 2013; McAndrews et al., 2015). ОСК способствуют выработке фактора, индуцируемого гипоксией 1-альфа (HIF-1α), VEGF и проангиогенных факторов и могут оставаться жизнеспособными в условиях гипоксии благодаря ОАФ и ЭМП (Chang et al., 2008; Lam, 2013). Кроме того, данный тип опухолевых клеток способен проникать в базальные мембраны и мигрировать в отдаленные органы и ткани, где образуют метастатические очаги. В то же время одной из основных функций ОАФ являются секреции экзосом, которые стимулируют миграцию клеток. Экзосомы представляют собой везикулы, просвет которых заполнен различными клеточными белками (HRAS, KRAS, BCR-ABL, miR125b, miR130b, miR155), а также цитокинами и хемокинами (Boyiadzis, Whiteside, 2017), а на мембране присутствуют рецепторы, выполняющие различные функции.
Мезенхимальные стволовые клетки (МСК) представляют собой негематопоэтические мультипотентные стволовые клетки, которые дифференцируются в мезодермальные линии, такие как остеоциты, адипоциты, хондроциты, а также эктодермальные (нейроциты) и энтодермальные линии (гепатоциты). МСК экспрессируют поверхностные маркеры CD29, CD44, CD73, CD90, CD105 и обладают иммуномодулирующими свойствами. МСК взаимодействуют с опухолевыми клетками посредством иммунных рецепторов и секреции цитокинов (Ullah et al., 2015).
Немаловажным аспектом в формировании специфичного иммунного профиля TME является мутационная нагрузка опухоли. Особенности мутационной нагрузки индуцируют фенотипические, функциональные и эпигенетические изменения в клетках. Известно, что эпигенетические изменения генов, связанных с клеточным циклом, инактивацией p53 и нарушениями в системе репарации ДНК, приводят к гиперметилированию иммунных клеток. При исследовании рака легкого среди лимфоцитов у больных были обнаружены клетки с аномальным метилированием генов, в том числе p53. Вероятно, что внутри опухолевых участков происходит сложное сигнальное взаимодействие между опухолевыми, иммунными и стромальными клетками, которое влияет на возникновение аберрантных эпигенетических событий.
В настоящее время становится все более очевидным, что фактический состав TME, а также то, какое влияние он оказывает на развитие и прогрессирование рака, может варьировать в зависимости от пациента и типа рака. Поэтому целесообразно использовать первичные клеточные линии для создания опухолевых 3D-моделей (Межевова и др., 2020б; Шамова и др., 2020).
МЕТОДЫ 3D-БИОПРИНТИНГА
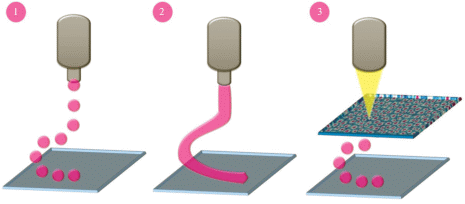
Существует три базовых метода биопринтинга: струйный, лазерный и печать на основе экструзии; для каждого из них используют специальные биочернила (рис. 2).
Независимо от источника, биочернила должны обеспечивать жизнеспособность клеток в заданной структуре, а также обладать подходящими механическими свойствами для биопечати и сохранения формы объекта (Masaeli, Marquette, 2020). Наиболее распространенным способом построения трехмерных тканей является использование гидрогелей в качестве материалов для каркасов. Гидрогели обеспечивают опорную структуру для клеток во время 3D-культивирования.
Преимуществами струйных биопринтеров являются невысокая стоимость приборов и способность одновременно печатать несколькими типами клеток. Однако данный метод ограничен выбором материала, для него подходят лишь гидрогели с низкой вязкостью. Дополнительными минусами метода являются неоднородность струи, а также непостоянная концентрация клеток в струе (Zeming et al., 2020). Электрогидродинамическая струйная (E-jet) печать – это новый метод печати с высоким разрешением, позволяющий точно контролировать геометрические характеристики изготовляемых каркасов с использованием широкого диапазона материалов (Ahn et al., 2011; Visser et al., 2015). E-jet печать позволяет создавать детали размером от микро- до нанометров за счет индукции тонкой струи печатного материала с помощью электрического поля. Диаметр такой струи намного меньше диаметра сопла (Visser et al., 2015). Таким образом, электрогидродинамическая струйная печать подходит для создания структур очень мелкого масштаба (Liu et al., 2017).
Лазерный биопринтинг позволяет печатать с высоким разрешением разные типы клеток без загрязнения дозатора биочернилами за счет бесконтактного нанесения. Тем не менее жизнеспособность клеток при использовании данного метода печати снижена из-за возможных повреждений клеток лазерным лучом или контаминации металлом во время печати (Zhang et al., 2017).
Биопринтинг на основе экструзии позволяет создавать трехмерные структуры слой за слоем путем непрерывного распыления гидрогелей посредством механического или воздушного давления в место нанесения отдельных капель. Этот метод используют для разных типов клеток и материалов, поэтому область его применения шире по сравнению с другими методами. Для данного метода используют либо химически сшиваемые биочернила, либо биочернила, способные к термическому гелеобразованию при комнатной температуре. Чаще всего используют гидрогели высокой вязкости из биосовместимых полимеров с высокой плотностью клеток, которые позволяют сохранять их жизнеспособность на 90% (Munaz et al., 2016).
Благодаря стремительному развитию технологии 3D-биопринтинга за последнее десятилетие был разработан ряд новых методов. Метод стереолитографической 3D-печати создает трехмерные тканевые конструкции послойно. 3D-модель преобразуется в стопку нарезанных 2D-изображений. Каждое 2D-изображение в стопке представляет собой поперечное сечение 3D-модели в указанной плоскости сверху. Преимущество данного метода заключается в возможности масштабирования и быстрой печати очень сложных каркасов. В отличие от печати на основе экструзии, где биоматериал подвергается термическому воздействию, при стереолитографической 3D-печати используют фотосшиваемые биочернила, таким образом, раствор биочернил полимеризуется под действием света (Gu et al., 2020).
В Университете Сага в Японии был разработан метод Кензана, суть которого заключается в создании микроокружения без каркасов на основе матрицы микроигл “Кензан” и вставки клеточных сфероидов. Метод Кензана обеспечивает пространственную организацию сфероидов с использованием микроигл в качестве временной опоры. Сфероиды сливаются в клеточные агрегаты и секретируют внеклеточный матрикс, иглы втягиваются, что приводит к образованию тканевой структуры без каркасов (Murata et al., 2020).
Новый подход к моделированию гетерогенной микросреды опухоли объединяет принципы микрофлюидики и 3D-биопринтинга с методами совместного культивирования. Такой подход повышает эффективность использования 3D-моделей опухолей in vitro для изучения механизмов патогенеза и скрининга препаратов. Поток жидкости вводят через микрофлюидные системы, которые воспроизводят динамическое микроокружение опухоли. Интерстициальный поток в опухолевой ткани и вокруг нее влияет на механическое микроокружение, моделируя рост опухолевых клеток и метастазирование (Mazzocchi et al., 2019).
Также существует метод 3D-печати, основанный на точном позиционировании клеточных сфероидов с помощью аспирации. Метод позволяет без каркасов создавать многослойные конструкции, которые имитируют структуру нативной ткани (Ayan et al., 2020).
ПРИМЕНЕНИЕ ОПУХОЛЕВЫХ 3D-МОДЕЛЕЙ
Интеграция сосудистых сетей в состав опухолевых 3D-моделей является одним из основных преимуществ 3D-биопринтинга по сравнению с применением 2D-культур опухолевых клеток. Сосудистые сети играют ключевую роль в транспортировке питательных веществ и кислорода к клеткам опухоли in vivo, тем самым способствуя прогрессированию рака (Jabłońska-Trypuć et al., 2016). В данном разделе подробно описывается прогресс, достигнутый на моделях in vitro различных типов опухолей, созданных с помощью биопечати.
Рак молочной железы
Рак молочной железы (РМЖ) является одним из самых распространенных видов инвазивного рака. По причине гетерогенности РМЖ наличие даже небольшой популяции ОСК с высокой вероятностью приводит к рецидиву заболевания (Thorat, Balasubramanian, 2020). Поэтому для оптимальной тактики лечения пациентов с РМЖ следует также определять состав TME (Dias et al., 2019).
В 2016 г. при помощи стереолитографической 3D-печати был создан биомиметический костный матрикс, состоящий из остеобластов или МСК, инкапсулированных в гидрогель на основе метакрилат-желатина с нанокристаллическим гидроксиапатитом (Zhou et al., 2016). Данная 3D-модель была направлена на изучение взаимодействия между клетками РМЖ и МСК. В результате совместного культивирования клеток РМЖ и МСК усиливалась пролиферация клеток РМЖ, подавляя пролиферацию МСК. Кроме того, клетки РМЖ только в присутствии МСК демонстрировали повышенную секрецию VEGF. Таким образом, в данной работе был изучен метастатический потенциал клеток РМЖ в присутствии МСК.
Лангер с соавторами (Langer et al., 2019) использовали биопринтер Novogen MMX Bioprinter (Organovo Inc., США) для создания модели, включающей опухолевый и стромальный компартменты. 3D-модель РМЖ состояла из нескольких типов клеток, включая эстроген-положительную (ER+) линию клеток MCF-7, первичные фибробласты молочной железы человека (HMF) и эндотелиальные клетки пупочной вены человека (HUVEC). Клетки для каждого компартмента смешивали и ресуспендировали в гидрогеле при 37°C до конечной концентрации 1.5–2.0 × 108 клеток/мл. Биочернила состояли из альгинатсодержащего гидрогеля (1% альгината натрия Pronova UP LVG NovaMatrix (Норвегия) и 6% желатина Millipore Sigma) в натрий-фосфатном буфере (PBS). Важно отметить, что на основе полученной 3D-модели РМЖ были смоделированы процессы инвазии и миграции опухолевых клеток в TME. В стромальный компартмент ткани вместе с HMF и HUVEC добавляли первичные подкожные преадипоциты человека, так как известно, что взаимодействие опухолевых клеток РМЖ с адипоцитами усиливает инвазию и устойчивость к лекарственной терапии (Dirat et al., 2011). Помимо этого, аналогично в стромальный компартмент были добавлены предшественники МСК, зрелые клетки которых, по данным литературных источников, секретируют хемокины, цитокины, факторы роста и белки ВКМ, что приводит к усилению пролиферации и миграции опухолевых клеток (Zhu et al., 2006; Djouad et al., 2007; Karnoub et al., 2007; Shi et al., 2017). Данная модель гетероцеллюлярной опухоли позволила воспроизвести различные характеристики неопластических тканей, а также исследовать клеточные ответы во время манипуляций с TME.
Недавно была разработана 3D-модель с использованием культуры клеток РМЖ (21PT) и стволовых клеток, полученных из жировой ткани (adipose-derived stem cells, ADSC) (Wang et al., 2018с). В качестве противоопухолевого агента применяли доксорубицин. Для печати использовали 3D-биопринтер (Bioplotter, Envision TEC) и два типа фото-сшиваемых биочернил на основе функционализированной метакрилатом гиалуроновой кислоты и метакрилат-желатина (все Sigma). 3D-модель представляла собой диск, в центре которого располагались клетки 21PT, а по краям – ADSC. Для имитации разной степени ожирения увеличивали или уменьшали слой ADSC. Данная модель позволила установить прямую зависимость между толщиной слоя ADSC и устойчивостью клеток РМЖ к доксорубицину.
Стоит отметить, что опухолевые клетки РМЖ в 3D-моделях показали более высокую устойчивость к химиотерапевтическим препаратам по сравнению с клетками в 2D-культурах (Zhu et al., 2016). Также эти исследования подтверждают возможность создания достоверной 3D-модели РМЖ с помощью трехмерной биопечати.
Рак кожи
По данным Всемирной организации здравоохранения, меланома составляет <5% всех случаев рака кожи, но представляет собой наиболее агрессивный подтип, на который приходится порядка 80% летальных исходов, и число случаев быстро растет (Siegel et al., 2020). Меланома возникает в результате злокачественной трансформации меланоцитов, которые представляют собой естественные пигментированные клетки эпидермиса для защиты митотически активных кератиноцитов от повреждений, вызванных УФ-лучами.
Для 3D-биопечати опухолевой модели меланомы в 2019 г. Шмидт с соавторами (Schmidt et al., 2019) использовали биопринтер на основе пневматической экструзии Cellink (Cellink, Швеция) и две клеточные линии меланомы, меченные флюорофорами – Mel Im GFP и MV3dc. Перед печатью суспензии клеток смешивали в соотношении 1 : 11 с разными гидрогелями на основе альгината (Cellink Bioink, Cellink RGD, GelXA или GelXA Laminink+ – все от Cellink) до конечной концентрации 105 клеток/мл и вносили в картриджи (Cellink). Трехслойные решетки размером 1 × 2 см печатали на покровных стеклах в соответствии с протоколами производителя и сшивали с помощью полимеризующего агента (Cellink), содержащего 50 мМ CaCl. Для печати с матригелем клетки смешивали в соотношении 1 : 11 с охлажденным раствором Matrigel (Corning) до конечной концентрации 105 клеток/мл и переносили в картридж. После полимеризации все конструкции покрывали соответствующей культуральной средой и инкубировали при 37°C во влажной среде с содержанием 8% CO2. В результате была продемонстрирована пригодность всех протестированных биоматериалов для биопечати клеток меланомы. Жизнеспособность напечатанных клеток оценивалась в течение 14 суток культивирования. В матригеле клетки были способны пролиферировать, мигрировать внутри геля и образовывать плотные сети по всей конструкции. При этом в гидрогелях на основе альгината клетки оставались жизнеспособными, но не пролиферировали (Schmidt et al., 2019).
Рак легкого
Рак легкого – это глобальная проблема общемирового здравоохранения, ежегодно регистрируется около 1.3 млн новых случаев. Основное внимание в исследованиях рака легкого было уделено внутренним свойствам опухолевых клеток (Владимирова и др., 2012), однако недавно Ламбрехтс с соавторами (Lambrechts et al., 2018) идентифицировали 52 подтипа стромальных клеток, включая новые субпопуляции в типах клеток, которые до сих пор считались однородными, а также факторы транскрипции, лежащие в основе их гетерогенности. Моделирование межклеточных взаимодействий между стромой и опухолевыми клетками способствовало определению прогностической и патофизиологической роли TME при раке легкого.
Исследование Вана и соавторов (Wang et al., 2018d) было направлено на разработку трехмерной модели рака легкого и оценку возможности ее применения в биомедицинских целях с использованием культур клеток A549 и 95-D в качестве таргетных. Клетки равномерно распределялись в напечатанном гидрогеле на основе альгината и желатина, сохраняя свою жизнеспособность. Вместе с тем была проведена предварительная оценка биологических свойств напечатанных клеток, в основном на способность к инвазии и миграции клеток, с использованием скретч-теста и анализа экспрессии генов ММП2 и ММП9. Результаты показали, что экспрессия генов ММП2 и ММП9 в клетках A549 была выше, чем в 95-D. Это подтверждает, что на генетическом уровне TME неравномерно оказывает влияние на разные типы клеток в пределах одной нозологии (Wang et al., 2018d).
Таким образом, способность моделировать взаимодействия между клетками и внеклеточным матриксом в TME in vitro может помочь в прогнозировании прогрессирования опухоли и оценке эффективности ее лечения.
Колоректальный рак
Колоректальный рак (КРР) характеризуется дезорганизацией и хаотичным образованием тканей. TME этой опухоли представляет собой сложный промежуточный ВКМ, содержащий множество стромальных клеток, включая фибробласты и эндотелиальные клетки (Kuipers et al., 2013; Lorenzon et al., 2016). Традиционным 2D-культурам не хватает разнообразия внутренней пространственной организации, типов клеток и TME для исследований межклеточных взаимодействий между компонентами стромы и опухолевыми клетками КРР (Lee et al., 2017; Филиппова и др., 2020). Поэтому была разработана 3D-модель КРР на основе каркасов из поликапролактона (PCL) при помощи системы 3D E-jet печати (Liu et al., 2017; Tan et al., 2017). В данной работе использовали клеточные линии: колоректальный рак (HCT116), HUVEC, фибробласты легкого человека (HELF). Для получения TME-ассоциированных клеток нормальные стромальные клетки HELF и HUVEC были активированы и трансформированы в ОАФ и эпителиальные клетки тимуса (TEC). Для образования ВКМ HCT116, ОАФ и TEC сокультивировали в течение 7 суток в пропорции 5 : 1 : 1 на стерильных каркасах (1 × 106 клеток/мл) в чашках Петри в среде DMEM с добавлением 10% эмбриональной бычей сыворотки (FBS), после чего анализировали путем секвенирования РНК. В качестве контроля использовали клетки, культивированные в коллаген-альгинатном гидрогеле. В результате экспрессия ММП2 в ОАФ и Ki67 в HCT116 в 3D-модели была выше, чем в 2D-модели, что позволяет предположить, что опухолевые клетки, выращенные в трехмерной среде, имеют более высокую скорость пролиферации.
Таким образом, каркасы коллаген-PCL, напечатанные на 3D-принтере, обеспечивали многофункциональную поддержку клеток, способствуя их физиологическим функциям, таким как рост, адгезия, стволовость, преваскуляризация и ремоделирование матрикса. Благодаря использованию активированных стромальных клеток стало возможным генерировать TME, которое имитировало TME in vivo, при правильном восстановлении физиологической передачи сигналов опухоли (Chen et al., 2020).
Рак печени
Гепатоцеллюлярная карцинома (ГЦК) – одна из наиболее распространенных злокачественных форм рака (Sabaila et al., 2015). 3D-модель гепатокарциномы была изготовлена Ma с соавторами (Ma et al., 2016) с помощью двухэтапного метода стереолитографической биопечати. В этой 3D-модели был создан паттерн децеллюляризованного внеклеточного матрикса (дВКМ) печени в виде гексагональной дольчатой структуры из клеток-предшественников печени (HPC) и эндотелиальных клеток человека из индуцированных плюрипотентных стволовых клеток (iPSC). Производные HPC в трехмерной культуре демонстрировали дифференциальную экспрессию генов, связанную с секрецией специфичных для печени белков, таких как транстиретин, ядерный фактор гепатоцитов 4α, альбумин, соответствующих различным стадиям созревания клеток внутри конструкций. Клетки в 3D-конструкциях также демонстрировали повышенный уровень базального цитохрома P450, что указывало на созревание взрослых гепатоцитов и индукцию рифампицином определенных подтипов этой ферментной системы. Таким образом, результаты свидетельствовали о разработке физиологически релевантной конструкции.
В исследовании Колески с соавторами (Kolesky et al., 2014) использовали устройство для печати с несколькими соплами: Pluronic F127 (трехблочный сополимер поли(этиленоксид)–поли(пропиленоксид)–поли(этиленоксид)) печатался с использованием одного сопла, второе сопло использовалось для биопечати клеточной линии гепатоцеллюлярной карциномы (HepG2), а третье – для HUVEC в гидрогеле. Таким образом, была разработана масштабируемая платформа для создания инженерных тканевых конструкций, содержащих сосудистые каналы и несколько типов клеток внутри ВКМ из биочернил на основе метакрилат-желатина (Kolesky et al., 2014).
Рак яичников и шейки матки
Рак яичников и шейки матки – наиболее злокачественные опухоли репродуктивной системы. Рак яичников обычно не выявляется на ранних стадиях и чаще всего диагностируется после распространения опухоли на другие органы (Watters et al., 2018). Рак яичников представляет собой гетерогенную систему, поэтому в 2D-модели невозможно точно воссоздать микроокружение данной опухоли. В связи с этим была разработана модель опухоли на субстрате Matrigel путем совместного биопринтинга клеток рака яичников (OVCAR-5) и фибробластов легких человека (MRC-5) (Xu et al., 2011). Авторы наблюдали изменение образования клеточных конгломератов OVCAR-5 в модели сокультивирования, а также в модели, в которой сохранялось определенное расстояние между OVCAR-5 и MRC-5. Эти 3D-модели продемонстрировали разную чувствительность к совместной фотодинамической терапии с бензорфирином и введением карбоплатина (Datta et al., 2020).
В другой работе (Zhao et al., 2014) исследовали влияние паклитаксела на клетки карциномы шейки матки (HeLa), инкапсулированные в смеси фибриногена, альгината и желатина и напечатанные методом последовательной экструзии. По сравнению с 2D, в 3D-модели наблюдали различия в показателях пролиферации, экспрессии ММП и маркеров химиорезистентности к паклитакселу. Помимо этого, наблюдалось формирование 3D-сфероидов, вероятно, из-за усиленных межклеточных взаимодействий.
Глиобластома
Среди нейроэпителиальных опухолей глиобластома (ГБМ) является наиболее агрессивной опухолью, с медианой выживаемости не более 15 месяцев (Omuro, DeAngelis, 2013). На сегодняшний день результат лечения глиобластомы остается неудовлетворительным, устойчивость раковых клеток к лекарственным препаратам является основной причиной рецидива ГБМ. В связи с этим существует необходимость разработки 3D-модели in vitro, подходящей для исследования лекарственной устойчивости клеток ГБМ.
В работе Дая с соавторами (Dai et al., 2016) при помощи биопечати была создана трехмерная модель стволовых клеток глиомы с использованием пористого гидрогеля, имитирующего внеклеточный матрикс. В результате были получены скаффолды, представляющие собой пористые сетки круглой или квадратной формы. Для печати скаффолдов использовали биочернила на основе желатина, альгината натрия и фибриногена в соотношении 2 : 1 : 1 и линию стволовых клеток глиомы (SU3) (Wan et al., 2012; Dai et al., 2015). Выживаемость SU3 составила 86.92%, сразу после биопринтинга наблюдалась активная пролиферация клеток. В течение периода культивирования SU3 в составе скаффолдов не только сохранили присущие им характеристики опухолевых стволовых клеток, но также продемонстрировали потенциал к дальнейшей клеточной дифференцировке. Результаты определения чувствительности к лекарственной терапии показали, что 3D-модель глиобластомы более устойчива к темозоломиду (TMZ), по сравнению с 2D-моделями, при концентрациях TMZ 400–1600 мкг/мл. Темозоломид – новый тип алкилирующего агента и наиболее часто используемый химиотерапевтический препарат для лечения ГБМ (Karachi et al., 2018).
В недавнем исследовании Вана с соавторами (Wang et al., 2018а) с целью изучения опухолевого ангиогенеза была разработана 3D-модель методом экструзионного биопринтинга в виде гидрогелевых каркасов, засеянных стволовыми клетками глиомы линии GSC23. В данном эксперименте смешивали фибриноген с желатином и альгинатом, что обеспечило хорошую биоактивность и механическую прочность напечатанных каркасов. Взаимосвязанные микропоры внутри каркасов имитировали сосудистую сеть, что усиливало обмен питательных веществ, кислорода и метаболических отходов в модели. Примечательно, что в 3D-модели увеличилось количество межклеточных взаимодействий и улучшились паракринные и аутокринные функции клеток.
В другом эксперименте Вана с соавторами (Wang et al., 2018b) методом коаксиальной экструзионной биопечати были сконструированы гидрогелевые микроволокна. Гидрогелевые микроволокна состояли из оболочки и сердцевины. Для печати оболочки использовали биочернила из альгината натрия без клеток (вариант U) или смешанные со стволовыми клетками глиомы GSC23 (вариант G/U). Сердцевина микроволокон в обоих вариантах состояла из клеток глиомы линии U118. В этом исследовании с увеличением времени культивирования клетки как в G/U, так и в U-микроволокнах сохраняли высокую скорость пролиферации (Murphy, Atala, 2014). Клетки U118 росли в виде сфероидов, которые впоследствии соединялись друг с другом до тех пор, пока не образовывали волокнообразные клеточные агрегаты. Уникальное микроокружение на стыке оболочки и сердцевины усиливало взаимодействие между клетками, а также между клетками и ВКМ (Zhao et al., 2014). Результаты показали, что экспрессия ММП9 и О6-метилгуанин-ДНК-метилтрансферазы (MGMT) была увеличена в микроволокнах G/U по сравнению с микроволокнами U, что указывало на повышенную лекарственную устойчивость клеток U118, культивируемых в микроволокнах G/U по сравнению с микроволокнами U. Кроме того, G/U-микроволокна показали более высокую устойчивость к TMZ. Это еще раз продемонстрировало, что микроволокна G/U, созданные при помощи коаксиальной экструзионной биопечати, являются предпочтительной платформой для имитации TME глиомы, а также для разработки и скрининга противоопухолевых препаратов.
В 2019 г. группой ученых из Канады (Lee et al., 2019) была создана модель ГБМ на основе фибрина с целью определения характеристик клеток и скрининга химиотерапевтических препаратов. Для печати использовали 3D-биопринтер Aspect Biosystems RX1, работающий на основе микрофлюидной технологии (Bsoul et al., 2016), и биочернила из альгината, генипина фибрина и клеток глиобластомы (U87MG). В результате в течение 12 суток после печати был отмечен высокий уровень жизнеспособности клеток линии U87MG в составе напечатанных структур. Кроме того, клетки спонтанно образовывали сфероиды и экспрессировали маркеры стволовых клеток (CD133 и DCX). Для перепрограммирования клеток ГБМ в ранние нейроны напечатанные каркасы с клетками обрабатывали смесью, состоящей из 10 мкМ форсколина, 10 мкМ ISX9, 3 мкМ CHIR99021, 2 мкМ I-BET 151 и 5 мкМ DAPT (FICBD). Клетки в составе 3D-модели показали значительную устойчивость к воздействию FICBD по сравнению с клетками 2D-модели, что свидетельствует о большей релевантности 3D-модели для скрининга лекарственных препаратов.
Недавно был разработан метод децеллюляризации для реконструкции внеклеточного матрикса in vitro, который получил название “децеллюляризованный внеклеточный матрикс” (дВКМ) (Kuznetsova et al., 2018). дВКМ имитирует естественный ВКМ, позволяя изучать поведение клеток при их взаимодействии с молекулами ВКМ. Фактически дВКМ использовался в исследованиях глиобластомы с целью определения новых перспектив в исследованиях рака (Yi et al., 2019).
Таким образом, трехмерные модели глиомы представляют собой новый альтернативный инструмент для изучения глиомагенеза, биологии стволовых клеток глиомы, лекарственной устойчивости, чувствительности к противоопухолевым препаратам in vitro и васкуляризации опухоли.
ПРОТИВООПУХОЛЕВЫЕ ПРЕПАРАТЫ И ТЕРАПЕВТИЧЕСКИЙ СКРИНИНГ
Опухолевые клетки часто создают иммуносупрессивное микроокружение, которое подавляет эффекторные функции противоопухолевых иммунных клеток. Однако многие ключевые особенности взаимодействия между опухолью и иммунными клетками и то, как эти взаимодействия влияют на рост опухоли, плохо изучены (Fridman et al., 2013). Использование 3D-моделей опухоли обеспечивает многообещающую платформу для скрининга противоопухолевых терапевтических агентов. Успех в разработке противоопухолевых соединений на протяжении десятилетий был низким, так, более 95% лекарств-кандидатов не выходили на рынок (May, 2018).
Несколько лет назад командой ученых из Китая и США (Wang et al., 2018c) была разработана 3D-модель HER2-позитивного РМЖ из клеток первичной линии 21PT. 3D-модель была встроена в матрицу МСК, полученных из жировой ткани (ADMSC), ее использовали для изучения реакции клеток HER2-позитивного РМЖ на доксорубицин и лекарственную устойчивость. В то же время коллективом ученых из Университета Иллинойса (Grolman et al., 2015) была разработана 3D-модель методом совместной экструзии биопечати. 3D-модель использовали для изучения взаимодействий между клетками РМЖ, инкапсулированными в пептид-конъюгированные альгинатные волокна, и макрофагами внутри каналов. Кроме того, исследовали эффект после воздействия противоопухолевых препаратов.
ПЕРСПЕКТИВЫ
Несмотря на то, что технология трехмерного биопринтинга в области воссоздания архитектоники и микроокружения опухолей развивается быстрыми темпами, на данный момент актуальной остается проблема подбора биочернил. Выбор подходящих биочернил является одним из наиболее важных этапов в имитации микроокружения опухоли. Отсутствие универсальных биочернил и разница в плотности посева клеток затрудняют оценку корреляции результатов (Hospodiuk et al., 2017). Другой проблемой в воссоздании TME является использование иммортализованных клеточных линий, которые подвергаются многочисленным пассажам. Первичные клетки, полученные от пациентов, сохраняют гетерогенную среду опухоли и являются более подходящим инструментом в разработке трехмерных моделей для скрининга персонализированных терапевтических агентов (Langer et al., 2019). Тем не менее биочернила для первичных клеточных линий еще не стандартизированы.
Другой не менее важной проблемой считается создание развитой сосудистой сети, так как опухоли in vivo включают большое количество сильно разветвленных капиллярных сетей, способствующих их росту (Augustine et al., 2021). Создание конструкций с хорошо развитой сосудистой сетью особенно важно при биопечати моделей глиобластомы – опухоли, характеризующейся выраженным ангиогенезом. Сообщалось, что субпопуляция глиальных стволовых клеток в опухоли способна трансдифференцироваться в эндотелиальные клетки, тем самым вызывая ангиогенез (Wang et al., 2010). Поэтому использование полученных от пациентов опухолевых клеток может создать идентичную пациенту сосудистую сеть в напечатанной модели при наличии адекватного микроокружения опухоли. Тем не менее методы васкуляризации опухолевых моделей все еще нуждаются в дальнейшем исследовании и оптимизации для конкретных типов опухолей. С другой стороны, в среде опухоли человека in vivo клеточная секреция ферментов, гормонов, цитокинов или других агентов может влиять на микросреду растущей опухоли. Следовательно, все эти клеточные и молекулярные факторы необходимо учитывать при создании и биопринтинге опухолевых конструкций (Augustine et al., 2021).
ЗАКЛЮЧЕНИЕ
В многочисленных исследованиях подчеркнута исключительная важность взаимодействия клеток опухоли и ее стромы в прогрессировании, метастазировании опухоли и ее устойчивости к противоопухолевой терапии. Следовательно, понимание этого взаимодействия необходимо для разработки более эффективных методов лечения.
Внедрение технологии 3D-биопринтинга произвело революцию в персонализированной медицине за счет моделирования TME опухолей in vitro с использованием первичных опухолевых клеток пациентов. Кроме того, 3D-модели TME позволили глубже понять ключевые молекулярные и клеточные пути канцерогенеза.
Таким образом, 3D-модели TME представляют собой новый альтернативный инструмент для скрининга противоопухолевых препаратов и оптимизации стратегии лечения онкологических больных.
Список литературы
Владимирова Л.Ю., Кит О.И., Шолохова Е.А., 2012. Роль гистологического и молекулярного анализа в выборе метода лечения немелкоклеточного рака легкого поздних стадий // Фарматека. № 8(241). С. 9–22.
Межевова И.В., Ситковская А.О., Кит О.И., 2020а. Первичные культуры опухолевых клеток: современные методы получения и поддержания in vitro // Южно-Рос. онкол. журн. Т. 1. № 3. С. 36–49.
Межевова И.В., Шамова Т.В., Ситковская А.О., Шевченко А.Н., Швырев Д.А. и др., 2020б. Опыт создания первичной культуры рака предстательной железы in vitro // Соврем. проблемы науки и образования. № 5. С. 91.
Олейник Е.К., Шибаев М.И., Игнатьев К.С., Олейник В.М., Жулай Г.А., 2020. Микроокружение опухоли: формирование иммунного профиля // Мед. иммунология. Т. 22. № 2. С. 207–220. https://doi.org/10.15789/1563-0625-TMT-1909
Просекина Е.А., Данилова А.Б., Нехаева Т.Л., Балдуева И.А., 2019. Создание трёхмерных клеточных моделей для решения практических и теоретических проблем современной онкологии // Вопр. онкологии. Т. 65. № 5. С. 629–637.
Скворцова В.В., Полуконова Н.В., Бучарская А.Б., 2014. Выращивание культур опухолей в 3D-формате для исследования их ответа на лекарственное воздействие // Бюл. мед. интернет-конф. Т. 4. № 1. С. 18–20.
Филиппова С.Ю., Ситковская А.О., Бондаренко Е.С., Новикова И.А., Харагезов Д.А. и др., 2021. Опыт применения инкапсуляции в альгинат для исследования влияния EGF и FGF2 на пролиферацию клеток колоректального рака в условиях пониженной адгезии in vitro // Цитология. Т. 63. № 2. С. 184–192.
Шамова Т.В., Ситковская А.О., Росторгуев Э.Е., Кузнецова Н.С., Кавицкий С.Э., 2020. Получение первичных клеточных линий глиальных опухолей // Пермский мед. журн. Т. 37. № 5. С. 79–89.
Affo S., Yu L.X., Schwabe R.F., 2017. The role of cancer-associated fibroblasts and fibrosis in liver cancer // Annu. Rev. Pathol. V. 12. P. 153–186. https://doi.org/10.1146/annurev-pathol-052016-100322
Ahn B.Y., Walker S.B., Slimmer S.C., Russo A., Gupta A. et al., 2011. Planar and three-dimensional printing of conductive inks // J. Vis. Exp. V. 58. Art. e3189. https://doi.org/10.3791/3189
Altorki N.K., Markowitz G.J., Gao D., Port J.L., Saxena A. et al., 2019. The lung microenvironment: An important regulator of tumour growth and metastasis // Nat. Rev. Cancer. V. 19. № 1. P. 9–31. https://doi.org/10.1038/s41568-018-0081-9
Anderberg C., Li H., Fredriksson L., Andrae J., Betsholtz C. et al., 2009. Paracrine signaling by platelet-derived growth factor-CC promotes tumor growth by recruitment of cancer-associated fibroblasts // Cancer Res. V. 69. № 1. P. 369–378. https://doi.org/10.1158/0008-5472.CAN-08-2724
Arneth B., 2019. Tumor microenvironment // Medicina (Kaunas). V. 56. № 1. Art. 15. https://doi.org/10.3390/medicina56010015
Augustine R., Kalva S.N., Ahmad R., Zahid A.A., Hasan S. et al., 2021. 3D Bioprinted cancer models: Revolutionizing personalized cancer therapy // Transl. Oncol. V. 14. № 4. Art. 101015. https://doi.org/10.1016/j.tranon.2021.101015
Avnet S., Lemma S., Cortini M., Di Pompo G., Perut F., Baldini N., 2019. Pre-clinical models for studying the interaction between mesenchymal stromal cells and cancer cells and the induction of stemness // Front. Oncol. V. 9. Art. 305. https://doi.org/10.3389/fonc.2019.00305
Ayan B., Wu Y., Karuppagounder V., Kamal F., Ozbolat I.T., 2020. Aspiration-assisted bioprinting of the osteochondral interface // Sci. Rep. V. 10. № 4. Art. 13148. https://doi.org/10.1038/s41598-020-69960-6
Boyiadzis M., Whiteside T.L., 2017. The emerging roles of tumor-derived exosomes in hematological malignancies // Leukemia. V. 31. № 6. P. 1259–1268. https://doi.org/10.1038/leu.2017.91
Bsoul A., Pan S., Cretu E., Stoeberac B., Walusa K., 2016. Design, microfabrication, and characterization of a moulded PDMS/SU-8 inkjet dispenser for a Lab-on-a-Printer platform technology with disposable microfluidic chip // Lab Chip. V. 16. P. 3351–3361. https://doi.org/10.1039/C6LC00636A
Chang S.F., Chang C.A., Lee D.Y., Lee P.L., Yeh Y.M. et al., 2008. Tumor cell cycle arrest induced by shear stress: Roles of integrins and Smad // Proc. Natl. Acad. Sci. USA. V. 105. № 10. P. 3927–3932. https://doi.org/10.1073/pnas.0712353105
Chang C.H., Curtis J.D., Maggi L.B., Jr., Faubert B., Villarino A.V. et al., 2013. Posttranscriptional control of T cell effector function by aerobic glycolysis // Cell. V. 153. № 6. P. 1239–1251. https://doi.org/10.1016/j.cell.2013.05.016
Chen H., Cheng Y., Wang X., Wang J., Shi X. et al., 2020. 3D printed in vitro tumor tissue model of colorectal cancer // Theranostics. V. 10. № 26. P. 12127–12143. https://doi.org/10.7150/thno.52450
Choi J., Gyamfi J., Jang H., Koo J.S., 2018. The role of tumor-associated macrophage in breast cancer biology // Histol. Histopathol. V. 33. № 2. P. 133–145. https://doi.org/10.14670/HH-11-916
Dai X., Ma C., Lan Q., Xu T., 2016. 3D bioprinted glioma stem cells for brain tumor model and applications of drug susceptibility // Biofabrication. V. 8. № 4. Art. 045005. https://doi.org/10.1088/1758-5090/8/4/045005
Dai X., Chen H., Chen Y., Wu J., Wang H. et al., 2015. Malignant transformation of host stromal fibroblasts derived from the bone marrow traced in a dual-color fluorescence xenograft tumor model // Oncol. Rep. V. 34. № 6. P. 2997–3006. https://doi.org/10.3892/or.2015.4281
Datta P., Dey M., Ataie Z., Unutmaz D., Ozbolat I.T., 2020. 3D bioprinting for reconstituting the cancer microenvironment // NPJ Precis. Oncol. V. 4. Art. 18. https://doi.org/10.1038/s41698-020-0121-2
Dias A.S., Almeida C.R., Helguero L.A., Duarte I.F., 2019. Metabolic crosstalk in the breast cancer microenvironment // Eur. J. Cancer. V. 121. P. 154–171. https://doi.org/10.1016/j.ejca.2019.09.002
Dirat B., Bochet L., Dabek M., Daviaud D., Dauvillier S. et al., 2011. Cancer-associated adipocytes exhibit an activated phenotype and contribute to breast cancer invasion // Cancer Res. V. 71. № 7. P. 2455–2465. https://doi.org/10.1158/0008-5472.CAN-10-3323
Djouad F., Charbonnier L.M., Bouffi C., Louis-Plence P., Bony C. et al., 2007. Mesenchymal stem cells inhibit the differentiation of dendritic cells through an interleukin-6-dependent mechanism // Stem Cells. V. 25. № 8. P. 2025–2032. https://doi.org/10.1634/stemcells.2006-0548
Fridman W.-H., Dieu-Nosjean M.-C., Pagès F., Cremer I., Damotte D. et al., 2013. The immune microenvironment of human tumors: General significance and clinical impact // Cancer Microenviron. V. 6. P. 117–122. https://doi.org/10.1007/s12307-012-0124-9
Fukumura D., Xavier R., Sugiura T., Chen Y., Park E.C. et al., 1998. Tumor induction of VEGF promoter activity in stromal cells // Cell. V. 94. № 6. P. 715–725. https://doi.org/10.1016/s0092-8674(00)81731-6
Gajewski T.F., 2007. On the TRAIL toward death receptor-based cancer therapeutics // J. Clin. Oncol. V. 25. № 11. P. 1305–1307. https://doi.org/10.1200/JCO.2006.09.9804
Grolman J.M., Zhang D., Smith A.M., Moore J.S., Kilian K.A., 2015. Rapid 3D extrusion of synthetic tumor microenvironments // Adv. Mater. V. 27. № 37. P. 5512–5517. https://doi.org/10.1002/adma.201501729
Gu Z., Fu J., Lin H., He Y., 2020. Development of 3D bioprinting: From printing methods to biomedical applications // Asian J. Pharm. Sci. V. 15. № 5. P. 529–557. https://doi.org/10.1016/j.ajps.2019.11.003
Hanahan D., Weinberg R.A., 2011. Hallmarks of cancer: the next generation // Cell. V. 144. № 5. P. 646–674. https://doi.org/10.1016/j.cell.2011.02.013
Hospodiuk M., Dey M., Sosnoski D., Ozbolat I.T., 2017. The bioink: A comprehensive review on bioprintable materials // Biotechnol. Adv. V. 35. № 2. P. 217–239. https://doi.org/10.1016/j.biotechadv.2016.12.006
Jabłońska-Trypuć A., Matejczyk M., Rosochacki S., 2016. Matrix metalloproteinases (MMPs), the main extracellular matrix (ECM) enzymes in collagen degradation, as a target for anticancer drugs // J. Enzyme Inhib. Med. Chem. V. 31. P. 177–183. https://doi.org/10.3109/14756366.2016.1161620
Jeffries G.D.M., Xu S., Lobovkina T., Kirejev V., Tusseau F. et al., 2020. 3D micro-organisation printing of mammalian cells to generate biological tissues // Sci. Rep. V. 10. Art. 19529. https://doi.org/10.1038/s41598-020-74191-w
Jiang Y., Li Y., Zhu B., 2015. T-cell exhaustion in the tumor microenvironment // Cell Death Dis. V. 6. Art. e1792. https://doi.org/10.1038/cddis.2015.162
Jin M.Z., Jin W.L., 2020. The updated landscape of tumor microenvironment and drug repurposing // Signal Transduct. Target. Ther. V. 5. Art. 166.
Kalluri R., Zeisberg M., 2006. Fibroblasts in cancer // Nat. Rev. Cancer. V. 6. № 5. P. 392–401. https://doi.org/10.1038/nrc1877
Karachi A., Dastmalchi F., Mitchell D., Rahman M., 2018. Temozolomide for immunomodulation in the treatment of glioblastoma // Neuro Oncol. V. 20. № 12. P. 1566–1572. https://doi.org/10.1093/neuonc/noy072
Karnoub A.E., Dash A.B., Vo A.P., Sullivan A., Brooks M.W. et al., 2007. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis // Nature. V. 449. № 7162. P. 557–563. https://doi.org/10.1038/nature06188
Kolesky D.B., Truby R.L., Gladman A.S., Busbee T.A., Homan K.A., Lewis J.A., 2014. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs // Adv. Mater. V. 26. № 19. P. 3124–3130. https://doi.org/10.1002/adma.201305506
Kuipers E.J., Rösch T., Bretthauer M., 2013. Colorectal cancer screening–optimizing current strategies and new directions // Nat. Rev. Clin. Oncol. V. 10. № 3. P. 130–142. https://doi.org/10.1038/nrclinonc.2013.12
Kuznetsova E., Nimiritsky P., Grigorieva O., Sagaradze G., Rodionov S. et al., 2018. Decellularized extracellular matrix of human mesenchymal stromal cells as a novel biomaterial for regenerative medicine // Hum. Gene Ther. V. 29. № 12. P. A75. https://doi.org/10.1089/hum.2018.29077.abstracts
Lakins M.A., Ghorani E., Munir H., Martins C.P., Shields J.D., 2018. Cancer-associated fibroblasts induce antigen-specific deletion of CD8+ T Cells to protect tumour cells // Nat. Commun. V. 9. Art. 948. https://doi.org/10.1038/s41467-018-03347-0
Lam P.Y.P., 2013. Biological effects of cancer-secreted factors on human mesenchymal stem cells // Stem Cell Res. Ther. V. 4. № 6. Art. 138. https://doi.org/10.1186/scrt349
Lambrechts D., Wauters E., Boeckx B., Aibar S., Nittner D. et al., 2018. Phenotype molding of stromal cells in the lung tumor microenvironment // Nat. Med. V. 24. P. 1277–1289. https://doi.org/10.1038/s41591-018-0096-5
Langer E.M., Allen-Petersen B.L., King S., Kendsersky N.D., Turnidge M.A. et al., 2019. Modeling tumor phenotypes in vitro with three-dimensional bioprinting // Cell Rep. V. 26. № 3. P. 608–623. https://doi.org/10.1016/j.celrep.2018.12.090
Lee S.I., Ko Y., Park J.B., 2017. Evaluation of the osteogenic differentiation of gingiva-derived stem cells grown on culture plates or in stem cell spheroids: Comparison of two- and three-dimensional cultures // Exp. Ther. Med. V. 14. № 3. P. 2434–2438.
Lee C., Abelseth E., Vega L., de la, Willerth S.M., 2019. Bioprinting a novel glioblastoma tumor model using a fibrin-based bioink for drug screening // Mater. Today Chem. V. 12. P. 78–84. https://doi.org/10.1016/j.mtchem.2018.12.005
Liu T., Huang R., Zhong J., Yang Y., Tan Z., Tan W., 2017. Control of cell proliferation in E-jet 3D-printed scaffolds for tissue engineering applications: the influence of the cell alignment angle // J. Mater. Chem. B. V. 5. № 20. P. 3728–3738.
Lorenzon L., Bini F., Balducci G., Ferri M., Salvi P.F., Marinozzi F., 2016. Laparoscopic versus robotic-assisted colectomy and rectal resection: A systematic review and meta-analysis // Int. J. Colorectal Dis. V. 31. № 2. P. 161–173. https://doi.org/10.1007/s00384-015-2394-4
Ma X., Qu X., Zhu W., Li Y.-S., Yuan S. et al., 2016. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting // Proc. Natl. Acad. Sci. USA. V. 113. № 8. P. 2206–2211. https://doi.org/10.1073/pnas.1524510113
Mao P., Joshi K., Li J., Kim S.H., Li P. et al., 2013. Mesenchymal glioma stem cells are maintained by activated glycolytic metabolism involving aldehyde dehydrogenase 1A3 // Proc. Natl. Acad. Sci. USA. V. 110. № 21. P. 8644–8649. https://doi.org/10.1073/pnas.1221478110
May M., 2018. Cancer research with a human touch // Nature. V. 556. № 7700. P. 259–261. https://doi.org/10.1038/d41586-018-04161-w
Masaeli E., Marquette C., 2020. Direct-write bioprinting approach to construct multilayer cellular tissues // Front. Bioeng. Biotechnol. V. 7. Art. 478. https://doi.org/10.3389/fbioe.2019.00478
Mazzocchi A., Soker S., Skardal A., 2019. 3D bioprinting for high-throughput screening: drug screening, disease modeling, and precision medicine applications // Appl. Phys. Rev. V. 6. Art. 011302.
McAndrews K.M., Yi J., McGrail D.J., Dawson M.R., 2015. Enhanced adhesion of stromal cells to invasive cancer cells regulated by cadherin 11 // ACS Chem. Biol. V. 10. № 8. P. 1932–1938. https://doi.org/10.1021/acschembio.5b00353
Meng F., Meyer C.M., Joung D., Vallera D.A., McAlpine M.C., Panoskaltsis-Mortari A., 2019. 3D bioprinted in vitro metastatic models via reconstruction of tumor microenvironments // Adv. Mater. V. 31. № 10. Art. e1806899. https://doi.org/10.1002/adma.201806899
Munaz A., Vadivelu R.K., John J.St., Barton M., Kamble H., Nguyen N.-T., 2016. Three-dimensional printing of biological matters // J. Sci. Adv. Mater. Dev. V. 1. № 1. P. 1–17. https://doi.org/10.1016/j.jsamd.2016.04.001
Murata D., Arai K., Nakayama K., 2020. Scaffold-free bio-3D printing using spheroids as “bio-inks” for tissue (re-) construction and drug response tests // Adv. Healthc. Mater. V. 9. Art. 1901831. https://doi.org/10.1002/adhm.201901831
Murphy S., Atala A., 2014. 3D bioprinting of tissues and organs // Nat. Biotechnol. V. 32. P. 773–785. https://doi.org/10.1038/nbt.2958
Omuro A., DeAngelis L.M., 2013. Glioblastoma and other malignant gliomas: A clinical review // JAMA. V. 17. P. 1842–1850. https://doi.org/10.1001/jama.2013.280319
Pardoll D.M., 2012. The blockade of immune checkpoints in cancer immunotherapy // Rev. Cancer. № 12. P. 252–264. https://doi.org/10.1038/nrc3239
Sabaila A., Fauconnier A., Huchon C., 2015. Chimiothérapie intrapéritonéale pressurisée en aérosol (CIPPA): une nouvelle voie d’administration dans les carcinoses péritonéales d’origine ovarienne [Pressurized intraperitoneal aerosol chemotherapy (PIPAC): A new way of administration in peritoneal carcinomatosis of ovarian cancer] // Gynecol. Obstet. Fertil. V. 43. № 1. P. 66–67. https://doi.org/10.1016/j.gyobfe.2014.11.012
Schmidt S.K., Schmid R., Arkudas A., Kengelbach-Weigand A., Bosserhoff A.K., 2019. Tumor cells develop defined cellular phenotypes after 3D-bioprinting in different bioinks // Cells. V. 8. № 10. Art. 1295. https://doi.org/10.3390/cells8101295
Shi Y., Inoue H., Wu J.C., Yamanaka S., 2017. Induced pluripotent stem cell technology: a decade of progress // Nat. Rev. Drug Discov. V. 16. № 2. P. 115–130. https://doi.org/10.1038/nrd.2016.245
Siegel R.L., Miller K.D., Jemal A., 2020. Cancer statistics, 2020 // CA Cancer J. Clin. V. 70. № 1. P. 7–30. https://doi.org/10.3322/caac.21590
Tan Z.K., Liu T., Zhong J.C., Yang Y.K., Tan W.H., 2017. Control of cell growth on 3D-printed cell culture platforms for tissue engineering // J. Biomed. Mater. Res. A. V. 105. № 12. P. 3281–3292.
Thorat M.A., Balasubramanian R., 2020. Breast cancer prevention in high-risk women // Best Pract. Res. Clin. Obstet. Gynaecol. V. 65. P. 18–31. https://doi.org/10.1016/j.bpobgyn.2019.11.006
Töpfer K., Kempe S., Müller N., Schmitz M., Bachmann M. et al., 2011. Tumor evasion from T cell surveillance // J. Biomed. Biotechnol. V. 2011. Art. 918471. https://doi.org/10.1155/2011/918471
Trédan O., Galmarini C.M., Patel K., Tannock I.F., 2007. Drug resistance and the solid tumor microenvironment // J. Natl. Cancer Inst. V. 99. № 19. P. 1441–1454. https://doi.org/10.1093/jnci/djm135
Ullah I., Subbarao R.B., Rho G.J., 2015. Human mesenchymal stem cells – current trends and future prospective // Biosci. Rep. V. 35. № 2. Art. e00191. https://doi.org/10.1042/BSR20150025
Vanderburgh J., Sterling J.A., Guelcher S.A., 2017. 3D printing of tissue engineered constructs for in vitro modeling of disease progression and drug screening // Ann. Biomed. Eng. V. 45. № 1. P. 164–179.
Visser C.W., Pohl R., Sun C., Römer G.W., Huis in 't Veld B., Lohse D., 2015. Toward 3D printing of pure metals by laser-induced forward transfer // Adv. Mater. V. 27. № 27. P. 4087–4092. https://doi.org/10.1002/adma.201501058
Wan Y., Fei X.F., Wang Z.M., Jiang D.Y., Chen H.C. et al., 2012. Expression of miR-125b in the new, highly invasive glioma stem cell and progenitor cell line SU3 // Chin. J. Cancer. V. 31. № 4. P. 207–214. https://doi.org/10.5732/cjc.011.10336
Wang R., Chadalavada K., Wilshire J., Kowalik U., Hovinga K.E. et al., 2010. Glioblastoma stem-like cells give rise to tumour endothelium // Nature. V. 468. № 73. P. 829–833. https://doi.org/10.1038/nature09624
Wang X., Li X., Dai X., Zhang X., Zhang J. et al., 2018a. Bioprinting of glioma stem cells improves their endotheliogenic potential // Colloids Surf. B. Biointerfaces. V. 171. P. 629–637. https://doi.org/10.1016/j.colsurfb.2018.08.006
Wang X., Li X., Dai X., Zhang X., Zhang J., et al., 2018b. Coaxial extrusion bioprinted shell-core hydrogel microfibers mimic glioma microenvironment and enhance the drug resistance of cancer cells // Colloids Surf. B. Biointerfaces. V. 171. P. 291–299. https://doi.org/10.1016/j.colsurfb.2018.07.042
Wang Y., Shi W., Kuss M., Mirza S., Qi D. et al., 2018c. 3D bioprinting of breast cancer models for drug resistance study // ACS Biomater. Sci. Eng. V. 4. № 12. P. 4401–4411. https://doi.org/10.1021/acsbiomaterials.8b01277
Wang H., Zhang X., Vidaurre I., Cai R., Sha W., Schally A.V., 2018d. Inhibition of experimental small-cell and non-small-cell lung cancers by novel antagonists of growth hormone-releasing hormone // Int. J. Cancer. V. 142. № 11. P. 2394–2404. https://doi.org/10.1002/ijc.31308
Watters K.M., Bajwa P., Kenny H.A., 2018. Organotypic 3D models of the ovarian cancer tumor microenvironment // Cancers (Basel). V. 10. № 8. Art. 265. https://doi.org/10.3390/cancers10080265
Xu F., Celli J., Rizvi I., Moon S., Hasan T., Demirci U., 2011. A three-dimensional in vitro ovarian cancer coculture model using a high-throughput cell patterning platform // Biotechnol. J. V. 6. № 2. P. 204–212. https://doi.org/10.1002/biot.201000340
Yi H.G., Jeong Y.H., Kim Y., Choi Y.J., Moon H.E. et al., 2019. A bioprinted human-glioblastoma-on-a-chip for the identification of patient-specific responses to chemoradiotherapy // Nat. Biomed. Eng. V. 3. № 7. P. 509–519. https://doi.org/10.1038/s41551-019-0363-x
Zeming K.K., Sato Y., Yin L., Huang N.J., Wong L.H. et al., 2020. Microfluidic label-free bioprocessing of human reticulocytes from erythroid culture // Lab Chip. V. 20. № 18. P. 3445–3460. https://doi.org/10.1039/c9lc01128e
Zhang Z., Wang B., Hui D., Qiu J., Wang S., 2017. 3D bioprinting of soft materials-based regenerative vascular structures and tissues // Compos. B. Eng. V. 123. P. 279–291. https://doi.org/10.1016/j.compositesb.2017.05.011
Zhao Y., Yao R., Ouyang L., Ding H., Zhang T. et al., 2014. Three-dimensional printing of Hela cells for cervical tumor model in vitro // Biofabrication. V. 6. № 3. Art. 035001. https://doi.org/10.1088/1758-5082/6/3/035001
Zhou X., Zhu W., Nowicki M., Miao S., Cui H. et al., 2016. 3D bioprinting a cell-laden bone matrix for breast cancer metastasis study // ACS Appl. Mater. Interfaces. V. 8. № 44. P. 30017–30026. https://doi.org/10.1021/acsami.6b10673
Zhu H., Mitsuhashi N., Klein A., Barsky L.W., Weinberg K. et al., 2006. The role of the hyaluronan receptor CD44 in mesenchymal stem cell migration in the extracellular matrix // Stem Cells. V. 24. № 4. P. 928–935. https://doi.org/10.1634/stemcells.2005-0186
Zhu W., Holmes B., Glazer R.I., Zhang L.G., 2016. 3D printed nanocomposite matrix for the study of breast cancer bone metastasis // Nanomedicine. V. 12. № 1. P. 69–79. https://doi.org/10.1016/j.nano.2015.09.010
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии