Журнал общей биологии, 2021, T. 82, № 5, стр. 337-367
Сосудистые эпифиты – растения, порвавшие с землей
А. К. Еськов 1, 2, *, Г. Л. Коломейцева 2
1 Московский государственный университет им. М.В. Ломоносова, биологический факультет
119234 Москва, Ленинские горы, 1, стр. 12, Россия
2 Главный ботанический сад им. Н.В. Цицина РАН
127276 Москва, Ботаническая ул., 4, Россия
* E-mail: A.K.Eskov@yandex.ru
Поступила в редакцию 09.06.2021
После доработки 21.06.2021
Принята к публикации 28.06.2021
Аннотация
В обзоре, первом на русском языке, затронуты вопросы экологического и ботанического феномена эпифитизма сосудистых растений. Обсуждается проблема происхождения эпифитизма, его экологических границ и современного понимания экоморфологических особенностей эпифитов. Рассмотрены различные подходы к классификации эпифитов, включая авторские, обсуждается соотношение современной англоязычной терминологии и традиционной для русскоязычной литературы. Обсуждены наиболее дискуссионные проблемы в понимании феномена эпифитизма в мировой литературе. Рассмотрены механизмы существования растений, порвавших с наземными источниками минерального питания и воды. Изложена проблематика и степень изученности САМ (crassulacean acid metabolism) у эпифитов в контексте их ксероморфоза. Рассмотрен механизм и функциональная роль образования подвешенных почв. Отражены существующие теории и дискуссионные проблемы минерального питания эпифитов, в частности азотного питания. Обобщены различные биологические аспекты освоения крон: диаспорология, строение эпифитных сообществ и экосистемная роль эпифитов.
Эпифиты (от греч. ἐπι – “на” и φυτόν – “растение”) – это организмы, которые произрастают на других растениях, используя последние только в качестве опоры и субстрата, при этом не являясь паразитами. В самом широком смысле эпифитами являются многие организмы: бактерии, грибы, водоросли, лишайники, мхи и сосудистые растения. В русскоязычной научной литературе этот термин употребляется чрезвычайно широко. Например, поиск в Google Scholar на словосочетание “эпифитные микроорганизмы” выдает более 2000 результатов (русскоязычные статьи и употребление словосочетания в статьях). Термин “эпифит” широко употребляется даже применительно к подводным объектам (напр., Виноградова, 1989). Однако, говоря об эпифитах как о жизненной форме, как правило, имеют в виду сосудистые растения, произрастающие на стволах и ветвях деревьев. Это связано с тем, что они, в основной своей массе, гомойогидрические растения с приспособлениями для эпифитного образа жизни (в отличие от пойкилогидрических бессосудистых эпифитных мхов и лишайников). Именно в этом контексте мы будем говорить о феномене эпифитизма в рамках этой статьи. В ряде случаев (довольно редких) можно говорить о гиперэпифитах (эпифитах, произрастающих на других эпифитах) или о произрастании сосудистых растений как эпифиллов11 (т.е. растущих на листьях других растений).
Данный обзор преследует несколько целей. Во-первых, познакомить русскоязычных ботаников с состоянием проблемы изучения сосудистых эпифитов, ведь традиционно все, что касается тропических экосистем, остается по большей части вне поля внимания отечественной науки. Во-вторых, мы постарались подчеркнуть и выделить те существенные черты (от физиологических до популяционных), которые отличают сосудистые эпифиты от наших северных растений. В-третьих, мы ставили своей целью систематизировать многочисленную литературу о сосудистых эпифитах в контексте эволюционной схемы, в рамках которой эпифиты стали уникальным биологическим объектом, когда впечатляющее биоразнообразие было достигнуто в очень узких экологических рамках. Эти рамки могут быть сведены к трем экологическим “вызовам” обитания на стволе дерева: (1) баланс факторов увлажнения и освещенности; (2) строго лимитированное минеральное питание; (3) закрепление растений и их диаспор в кронах деревьев.
Все эпифиты для освоения эпифитных местообитаний должны были решить эти проблемы, преобразуя не только свой габитус, но и систему воспроизведения и прорастания (рис. 1). Таким образом, структура данной работы идет вслед за этой схемой: мы рассматриваем сначала сам феномен эпифитизма (включая проблему классификации эпифитов), переходим к их экофизиологии и минеральному питанию и заканчиваем проблемой расселения в кронах, структурой эпифитных сообществ и их экосистемной ролью. На большее мы не претендовали, так как полноценный обзор современной литературы обо всех аспектах биологии эпифитов возможен только в рамках обширной монографии.
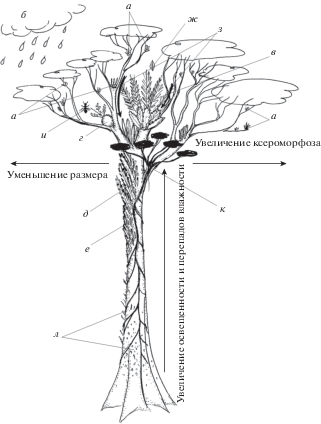
Рис. 1.
Схема основных экофизиологических и биоморфологических адаптаций эпифитов при освоении вертикальных местообитаний. Снизу вверх дерева растет увеличение освещенности и перепадов влажности (как сезонных, так и суточных). От центра к периферии кроны уменьшаются размеры эпифитов и растет их ксероморфоз. На тонких краевых ветках доминируют небольшие суккулентые эпифиты с САМ (а), основным источником их минерального питания являются атмосферные депозиты (б). Ближе к центру кроны располагаются аккумулятивные эпифиты: гнездовые (в) – накапливающие подвешенные почвы, мирмекофильные (г), скобочные (д) и куртинообразующие (е). Минеральное питание аккумулятивных эпифитов намного богаче, благодаря опаду (ж), смывам по стволам и с крон (з), мутуализму с муравьями (и) и другими консортными организмами. Наконец, полуэпифиты (к) имеют в той или иной степени связь с землей и получают часть минерального питания и воды из почвы. В нижней части стволов располагаются сциофильные эпифиты (л), наименее приспособленные к длительному пересыханию и колебаниям влажности воздуха.
1. ЭКОМОРФОЛОГИЯ И ПРОБЛЕМЫ ГРАНИЦЫ ЭПИФИТИЗМА
1.1. Жизненная форма или экогруппа? Масштабность и распространение
В начале XIX в. эпифиты были определены как растения, произрастающие на других растениях, “не получая от них питание” (Brisseau-Mirbel, 1815). Исторически эпифиты рассматривались как отдельная жизненная форма. Этот взгляд предложен еще Гумбольтом, выделившим отдельную форму эпифитов – “форму орхидей” (Горышина, 1979). По Раункиеру (Raunkiaer, 1934), эпифиты являются жизненной формой, входящей в группу фанерофитов. Другой крайне распространенный в русскоязычной литературе подход, характерный для отечественной школы биоморфологии (классификация И.Г. Серебрякова, 1964 г.), предполагает разделение жизненных форм на кустарники, кустарнички, травы и т.п., но он не оставляет места для эпифитов как для особой категории жизненных форм.
До недавнего времени насчитывалось около 27 600 видов сосудистых эпифитов из 73 семейств и 913 родов, что составляет 9% от всех видов сосудистых растений (Zotz, 2013a). Однако публикация первого полного списка сосудистых эпифитов показала существенно большее их число: 28 227 цветковых и 3084 споровых видов (Zotz et al., 2021a). Основная часть сосудистых эпифитов приходится на папоротники и однодольные, особенно на семейства Orchidaceae, Bromeliaceae, Araceae (Zotz, 2013a). Небольшое число эпифитов и полуэпифитов приходится на двудольные растения, в том числе из семейств Ericaceae, Gesneriaceae, Piperaceae (Krömer, Gradstein, 2016). Традиционное пренебрежение сосудистыми эпифитами в отечественной научной литературе можно объяснить и тем фактом, что они почти полностью отсутствуют на территории исторической России (включая Российскую империю и СССР). Большая часть биоразнообразия эпифитов сосредоточена в тропических и субтропических областях земли (Benzing, 1990; Zotz, 2016). Однако сосудистые эпифиты широко распространены и в умеренных областях южного полушария с океаническим климатом (Кэмпбел, 1948; Вальтер, 1974). Например, эпифитная флора характерна для Новой Зеландии (включая эпифитные орхидные) и для Южного Чили (вальдивийский лес) (Zotz, 2005). Предполагается, что лимитирующим фактором для распространения сосудистых эпифитов являются границы распространения устойчивых отрицательных температур зимой (Nieder, Barthlott, 2001). Так, единственный представитель сосудистых эпифитов в умеренной зоне Центральной Европы – Polypodium vulgare (Ричардс, 1961; Вальтер, 1968), который в южных частях Европы и на Черноморском побережье Кавказа (колхидский лес) сменяется близким видом P. cambricum (Берг, 1952). Эти два вида являются настоящими эпифитами, никогда не становясь наземными. P. vulgare в северных частях своего ареала становится литофитом (Фомин, 1934). Однако такой взгляд игнорирует обилие эпифитной формы P. vulgare во влажных горных лесах Альп (Stäger, 1908; Wilmanns, 1968). Плотность его сообществ достигает 300 экз./га, а высота произрастания на форофитах – до 14 м, причем в этих лесах бывают длительные периоды зимних морозов (Zotz, 2002; Zotz, List, 2003). Помимо обилия в горных лесах на севере Альп, P. vulgare также регулярно встречается как эпифит в более мягком климате Южной Европы, например, в Италии (Beguinot, Traverso, 1905), на Корсике (Fliche, 1902) или влажных лесах Северной Португалии (Schimper, 1888). В Великобритании, на Азорских и Канарских островах появляются эпифитные таксоны папоротников семейств Hymenophyllaceae или Grammitidaceae (Rübel, 1912; Tansley, 1939; Page, 1977; Bennert et al., 1992).
В целом, однако, эпифиты редки во всех этих флорах. Например, на Канарских островах эпифиты составляют лишь 0.2% от общего числа видов (Kunkel, 1993). В то время как юг Северной Евразии отделен от возможного флористического влияния тропической Центральной Африки Сахарой, а от тропиков Юго-Восточной Азии – огромными массивами Гималаев и Памира, Северная Америка более доступна для расселения крупных тропических родов эпифитов (Gentry, Dodson, 1987). Например, представитель крупного эпифитного неотропического рода, Tillandsia usneoides, заходит далеко на север, достигая 36° с.ш. (Garth, 1964). В целом же умеренные регионы Северного полушария намного беднее эпифитами, чем Южного (Zotz, 2005). При изменении широтного или высотного градиента в сторону похолодания в эпифитных сообществах растет доля споровых растений (Zotz, 2005). Однако проблема водоснабжения или низких температур не может быть признана единственной причиной крайне скудного присутствия эпифитов на большей части Голарктики (Zotz, 2005). Ряд видов наземных цветковых растений Европы достаточно часто становится в подходящих условиях факультативными эпифитами. Так, Л.С. Берг (1952) указывает для колхидского леса факультативный эпифитизм Оxalis villosa, а для гирканского леса – Сardamine hirsuta, Geranium robertianum и ту же О. villosa. Целенаправленные исследования феномена случайного эпифитизма у северных растений показывают его впечатляющие масштабы: так, в условиях Центральной Европы (горы Гарц, Германия) выявлено 100 видов случайных эпифитов из 39 семейств, при этом они наблюдались на четверти исследованных деревьев (Hoeber et al., 2019).
Между факультативностью и облигатностью эпифитов граница не очевидна. В более поздних работах был предложен ряд критериев для решения проблемы разной степени вовлеченности растений в эпифитный образ жизни (Benzing, 1990; Ibisch, 1996; Burns, 2010). Например, Ибиш (Ibisch, 1996) выделял “облигатные” эпифиты (более 95% всех представителей вида в определенном регионе растут как эпифиты), “случайные” эпифиты (более 95% представителей вида растут на земле) и “факультативные” эпифиты (процент эпифитов распределен между этими двумя полярными вариантами). Однако практическое применение подобного подхода оказалось неосуществимо из-за сложности подробного подсчета. Таким образом, о степени эпифитизма многих видов мы можем только гадать. Кроме того, обычна ситуация, когда один и тот же вид растет как эпифит и как наземное растение в разных типах леса (Gomes-da-Silva, Costa, 2011; Kirby, 2014).
Другой стороной проблемы границ эпифитизма является утрата связи с почвой у полуэпифитов. Одни авторы различают первичные и вторичные полуэпифиты, предполагая, что первичные полуэпифиты проходят стадию эпифитизма до установления контакта корней с почвой, а вторичные полуэпифиты прорастают на земле, но в процессе развития утрачивают связь с почвой из-за отмирания нижней, проксимальной части побега (Kress, 1986; Putz, Holbrook, 1986; Vargas, Andel, 2005). Однако изучение нескольких видов Philodendron и Monstera, которые обычно считаются вторичными полуэпифитами (Croat, 1978; Williams-Linera, Lawton, 1995), показало, что у всех взрослых растений присутствует связь корней с почвой (Zotz, 2016). Было предложено отказаться от использования термина “вторичный полуэпифит” (secondary hemiepiphyte) (Zotz, 2013b) в пользу термина “кочевая лоза” (nomadic vine), предложенного Моффеттом (Moffett, 2000). Консенсусным на сегодняшний момент является использование термина “полуэпифит” исключительно для первичных полуэпифитов (Zotz et al., 2021b). Эти растения начинают свою жизнь в виде эпифитных молодых особей, а затем устанавливают контакт корнями с почвой, а в некоторых случаях (как у фикусов-душителей) даже развиваются в полноценные деревья. Применение этого определения не должно находиться в контексте “полуэпифитной” фазы. Скорее, термин “полуэпифит” описывает конкретный тип онтогенеза или программы роста (Moffett, 2000), который включает ювенильную эпифитную фазу, за которой следует наземная фаза с укоренением в почве. Более того, этот термин не зависит от конкретной жизненной формы: гемиэпифиты могут быть древовидными, кустарниковидными, лианами, травянистыми растениями. В целом эпифиты вместе с полуэпифитами рассматриваются в группе структурно зависимых растений (structurally dependent plants): лиан, “кочующих лоз”, полупаразитов (Zotz, 2016). Таким образом, можно сказать, что эпифиты являются одной из эволюционных стратегий для освоения небольшими растениями полога и крон лесных экосистем.
1.2. Классификации эпифитов
Попытки классифицировать морфологические структуры травянистых многолетников, а именно к ним можно в основной массе отнести эпифиты, в отечественной литературе предпринимались неоднократно (Голубев, 1958; Серебряков, Серебрякова, 1965; Любарский, 1973; Смирнова, 1990; Татаренко, 1996; Нухимовский, 1997, 2002; Коломейцева, 2003, 2006; Мазуренко, Хохряков, 2010, и др.). Одни из этих систем преследовали узко специфические цели (например, сделать обработку какой-либо систематической группы растений или разработать методику флористических описаний), другие пытались решить глобальные филогенетические задачи или создать единую биоморфологическую систему в рамках одного сем. Orchidaceae (Смирнова, 1990). Существует множество признаков, по которым можно охарактеризовать биоморфы растительных организмов, но в зависимости от целей исследований обычно анализируется только часть признаков. Попытки проанализировать и включить в систему все известные морфологические признаки, как правило, приводили к созданию громоздких и трудно прочитываемых систем (Нухимовский, 1997, 2002). Однако эпифиты, как правило, ускользали от зрения отечественных ботаников ввиду сосредоточенности последних на территории бывшей СССР.
Европейская и, в особенности, англоязычная наука намного дальше продвинулась в этом вопросе. В связи с тем, что тропические сосудистые эпифиты морфологически довольно своеобразны, их еще в XIX в. пытались классифицировать в соответствии с экологией и биоморфологией (Schimper, 1888). Описанные в этой работе типы эпифитов (протоэпифиты, гнездовые и скобочные эпифиты, резервуарные эпифиты, полуэпифиты) переходили из сводки в сводку (Ричардс, 1961), так и не получив четких дефиниций с точки зрения более современных взглядов на экоморфологию и экофизиологию растений. В основном проблема этой классификации обнажается при проведении границы между эпифитами и биоморфами наземных и водных растений.
Первой серьезной попыткой вписать эпифиты в биоморфологический контекст на современном уровне следует, по-видимому, считать вышеупомянутою классификацию Раункиера (Raunkiaer, 1934). Однако невозможно избежать некоторой курьезности, применяя в отношении эпифитов методики, основанные на учете небольшого числа признаков. Так, например, согласно общепринятому принципу выделения жизненных форм по Раункиеру, эпифиты следует отнести к фанерофитам. Отнесение к фанерофитам эпифитных трав – довольно парадоксальная, но вполне оправданная мера. Поскольку автор концепции конкретно не пояснил, что фанерофиты непременно должны играть роль средообразователей и сами поднимать свои почки возобновления высоко над землей, мы вправе причислить большую часть эпифитов именно к фанерофитам. При этом основанные на ранних европейских нарративах традиционные взгляды российских морфологов (занимающихся изучением травянистых растений умеренного климата) на средообразующую, защитную и опорную функцию горизонтально расположенного субстрата, как на единственно возможный вариант, не работают в случае с эпифитами, которые растут в условиях недостатка влаги, сильной солнечной радиации, вертикальных олиготрофных субстратов.
По нашему мнению, к изучению морфологии тропических эпифитов необходимо подходить шире, опираясь на более свободную трактовку средообразующей роли климатических и эдафических факторов в условиях тропического климата. Проблема соотношения отечественного морфологического мышления и принятого в англоязычной литературе подхода проиллюстрирована на рис. 2. При формально-морфологическом подходе останется отнести все гигантское разнообразие эпифитов к трем–четырем моделям и этим ограничиться. Но и в англоязычной литературе существует мнение, что определяющей характеристикой эпифитов является их образ жизни, и что эпифиты должны быть отнесены к различным жизненным формам, например, кустарникам, лианам или травам (Mori et al., 2002). Для современного прагматичного взгляда характерно понимание эпифитов как единого экологического феномена, что отображено, по крайней мере, в важнейших монографиях по их биологии (Benzing, 1990; Zotz, 2016).
Рис. 2.
Один из самых известных “классических” эпифитов Старого Света Asplenium nidus. В зависимости от биоморфологического подхода это может быть моноподиальный корневищный травянистый многолетник (российская морфологическая школа), гнездовой эпифит (“epiphytes with bird-nest”; Zotz, 2016, и др.), эпифит “мусорной корзины” (“trash-basket epiphyte”; Benzing, 1990). Южный Вьетнам, н.п. Бидуп Нуй-Ба.

В кронах деревьев неизменными остаются такие биоморфологические характеристики, как способ ветвления, характер основной оси (наличие или отсутствие корневища), но при этом становятся почти бесконечными варианты их видоизменений на пути адаптивной эволюции. Такие признаки, как метаморфы побегов (стеблей и/или листьев) и корней, могут быть как гомологичными, так и аналогичными у разных таксономических групп и отражать общие адаптации к получению, рациональному использованию и сохранению воды. Обычно последний критерий рассматривают как базовый адаптивный отклик растения на условия освещенности и увлажнения. Поэтому традиционно выделяют два основных экологических типа эпифитов: гелиофиты (солнечные эпифиты) и сциофиты (теневые эпифиты) (напр., Pittendrigh, 1948). Согласно представлениям Бензинга (Benzing, 1986a, b), определяющим фактором в заселении полога дерева эпифитами является степень доступности влаги – постоянная или временная. Йоханссон (Johansson, 1975) рассмотрел возможную корреляцию между двумя группами экологических факторов и распределением эпифитных орхидей вдоль больших ветвей дерева-хозяина. Согласно его модели, в первую группу факторов входят относительная влажность воздуха, структура и влажность коры дерева, а также наличие на ней питательного слоя (гумуса). Во вторую группу факторов входят освещенность, температура воздуха и сила ветра. По направлению от ствола к концам ветвей влияние первой группы факторов ослабевает, а второй – усиливается, и наоборот. Эта модель показывает, что граница между различными группами эпифитов хотя и видна на морфологическом уровне, но может отсутствовать на экологическом (или, по крайней мере, не очевидна). Аккумулирование и сохранение воды являются основными абиотическими факторами роста эпифитных видов, в то время как наличие элементов минерального питания (ЭМП) и солнечное излучение остаются второстепенными (Zotz et al., 2001; Laube, Zotz, 2003). Этот вывод подтверждается и исследованиями, в которых эпифиты сравниваются напрямую с растениями, независимыми от дефицита влаги – полупаразитами: показано, что свет преимущественно определяет распространение омел, а влажность – эпифитов (Taylor, Burns, 2016).
У большинства эпифитов есть адаптивные структуры, такие как псевдобульбы (Orchidaceae), веламен воздушных корней (Orchidaceae, Araceae), а также трихомы листьев (Bromeliaceae), которые помогают поглощать и рационально использовать воду (Benzing, Sheemann, 1978). Кроме того, стебли и столоны могут становиться дополнительными фотосинтезирующими и сберегающими воду органами (Rodrigues et al., 2013).
Учитывая вышесказанное, мы пришли к мнению, что экоморфологическая классификация в первую очередь должна отражать именно те адаптивные особенности вегетативного тела растений, которые помогают им переживать дефицит влаги в естественных местообитаниях, а выбор основных признаков для экологической классификации эпифитов склоняется в пользу пары ксерофильность/гигрофильность, а не гелиофильность/сциофильность. Ксерофильность связана со способностью растений переносить атмосферную и субстратную засуху, используя особый тип метаболизма (САМ-фотосинтез), видоизменения побегов и корней, сезонное отмирание органов во время периода покоя, и в конечном итоге осваивать олиготрофные местообитания в кронах (рис. 1, 3).
Рис. 3.
Биоморфологическое разнообразие эпифитов. Листовые суккулентные эпифиты: a – небольшая моноподиальная орхидея (резерват Данум Вэлли, Сабах, Борнео), б – Bulbophyllum semiteretifolium (слева) и B. pinicolum (справа) (н.п. Бидуп Нуй-Ба, Вьетнам); эпифитные лианы: в – Hoya merrillii (оранжерея ГБС РАН); “атмосферные” эпифиты: г – Tillandsia sp. (Коста-Рика, с разрешения О. Тюкаева), д – проростки Tillandsia sp., самосев на рабице (оранжереи ГБС РАН), е – трихомы на листьях Tillandsia recurvata (оранжереи ГБС РАН); корнефотосинтезирующие безлиственные эпифиты: ж – Taeniophyllum pusillum (оранжереи ГБС РАН); “накипные” эпифиты: з – Eria spirodela (оранжереи ГБС РАН); “скобочные” эпифиты: и – Aglaomorpha brooksii (резерват Данум Вэлли, Сабах, Борнео); “гнездовые” эпифиты: к – Microsorum punctatum (н.п. Кат-Тьен, Вьетнам); куртинообразующие эпифиты: л – Pleurothallis sp. (оранжереи ГБС РАН); стеблевые мирмекофиты: м – Myrmecophila sinuosa, н – Hydnophytum formicarium (н.п. Бако, Саравак, Борнео); факультативный полуэпифит: о – Medinilla sp. (н.п. Кинабалу, Сабах, Борнео); полуэпифитная лиана: п – Freycinetia sp. (н.п. Кинабалу, Сабах, Борнео); сциофильные эпифиты: р – орхидея Podochilus sp. растет вперемежку с пойкилогидрическим папоротником из сем. Hymenophyllaceae (н.п. Фу-Куок, Вьетнам), с – в горном моховом лесу эпифитные Hymenophyllaceae не нуждаются в затенении (н.п. Кинабалу, Сабах, Борнео).

На сегодняшний день в англоязычной литературе имеется несколько классификационных схем эпифитов, приведенных в монографии Бензинга (Benzing, 1990), а также в других работах, которые вошли почти без изменения в один из последних крупных обзоров биологии эпифитов Зотца (Zotz, 2016):
I. По отношению к форофиту (дереву-хозяину):
1. Случайные
2. Факультативные
3. Облигатные эпифиты
4. Полуэпифиты
4.1. Душители
4.2. Недушители
5. “Кочевые лозы” (только когда показано, что они независимы от земли)
II. По характеру роста:
1. Деревья
2. Кустарники
3. Травянистые растения
3.1. Клубневые
3.1.1. Запасающие, деревянистые или травянистые
3.1.2. Мирмекофильные, в основном травянистые
3.2. Сильно ползучие: деревянистые или травянистые
3.3. Слабо ползучие: в основном травянистые
3.4. Розеточные: травянистые
3.5. Корневой/листовой “клубок”: травянистые
3.6. “Гнездовые” эпифиты: травянистые
III. По требованию к увлажнению:
1. Пойкилогидрические (количество воды в тканях зависит от уровня влажности среды)
2. Гомойогидрические (способные поддерживать в тканях относительно постоянное содержание воды)
2.1. Гигрофиты
2.2. Мезофиты
2.3. Ксерофиты
2.3.1. Засухоустойчивые
2.3.2. “Избегатели” засухи
2.4. Суккуленты
IV. По требованию к освещению (по: Pittendrigh, 1948):
1. Гелиофильные (солнцелюбивые)
2. Промежуточные
3. Сциофильные (теневыносливые)
V. По трофической зависимости от форофита:
1. Относительно независимые от форофита
1.1. Атмосферные эпифиты
1.2. Обитатели тонких ветвей и коры
1.3. Эпифиты, образующие “подвешенные” почвы или привлекающие муравьиные колонии
2. Использующие опад форофита и стекающую по стволу воду
2.1. Гумусовые эпифиты
2.1.1. Мелкие гумусовые формы
2.1.2. Глубокие гумусовые формы
2.2. “Скобочные” эпифиты
Как видно, существующие классификации однофакторны, фактически предложены разные классификации для разных целей (Benzing, 1990; Zotz, 2016), без попыток свести их воедино. Вместе с тем любое биологическое явление обладает внутренним единством, и чем подробнее классификация отображает различные аспекты биологии, тем она полнее. Наиболее совершенной явилась бы иерархическая классификация, способная отразить как экологические “вызовы”, стоящие перед эпифитами, так и экофизиологические “ответы” на эти вызовы, выраженные в конкретных экоморфологических моделях. Это заставило нас ранее предложить такую синтетическую классификацию, которая была призвана типизировать эпифиты по экоморфологическим особенностям и трофическим связям, и вместе с тем показать все разнообразие приспособлений эпифитов к жизни в кроне дерева (Еськов, 2012, 2018). Мы применили трехуровневую иерархию, разделив изначально все эпифитные растения на типы гелиофитов и сциофитов – уровень, отражающий первый базовый “вызов” эпифитизма. Ко второму уровню мы отнесли подтипы, как набор основных адаптивных схем в ходе эволюционного ответа на освоение крон в условиях лимитированного увлажнения и минерального питания. И наконец, третьим уровнем классификации явились конкретные морфологические схемы реализации таких адаптивных схем – экобиоморфы (табл. 1, рис. 3).
Таблица 1.
Классификация сосудистых эпифитов с примерами (по: Еськов, 2012)
| Экологический тип | Экофизиологический подтип | Экобиоморфологическая модель (экобиоморфа) | Типичные представители |
|---|---|---|---|
| Гелиофиты | Ксерофильные эпифиты | Листовые суккулентные эпифиты | Cattleya Lindl. sp. nonn., |
| Vanda Jones ex R.Br. sp. nonn. (Orchidaceae) | |||
| Эпифитные лианы | Vanilla Mill. sp. nonn. (Orchidaceae), | ||
| Hoya R.Br. sp. nonn. (Asclepiadaceae) | |||
| Редуктокормофитные ксерофильные эпифиты* (редуктокормофиты) |
“Атмосферные” эпифиты | Tillandsia usneoides L. (Bromeliaceae) и множество других представителей этого рода | |
| Корнефотосинтезирующие, безлиственные эпифиты | Chiloschista Lindl., | ||
| Taeniophyllum Blume (Orchidaceae) |
|||
| Стеблевые суккулентные эпифиты | Rhipsalis Gaertn. (Cactaceae) |
||
| “Накипные” эпифиты | Drymoda Lindl., | ||
| Eria spirodela Aver. (Orchidaceae) | |||
| Аккумулятивные эпифиты | “Скобочные” эпифиты | Platycerium Desv. (Polypodiaceae), | |
| Bulbophyllum beccarii Rchb. (Orchidaceae) | |||
| “Гнездовые” эпифиты | Asplenium australasicum Hook. (Aspleniaceae) | ||
| “Гнездовые” эпифиты с отрицательным геотропизмом корней | Cymbidium finlaysonianum Wall. ex Lindl., | ||
| Catasetum Rich. ex Kunth sp. nonn. (Orchidaceae) | |||
| Стеблевые мирмекофилы | Myrmecodia Jack. (Rubiaceae), |
||
| Lecanopteris Reinw. (Polypodiaceae) | |||
| Лиственные мирмекофилы | Dischidia R.Br. sp. nonn. (Asclepiadaceae) | ||
| Куртинообразующие эпифиты | Bulbophyllum Thouars. sp. nonn., | ||
| Pleurothallis R.Br. (Orchidaceae) | |||
| “Резервуарные” эпифиты | Большинство представителей сем. Bromeliaceae Juss. | ||
| Пограничная форма | Кустарниковые (вплоть до небольших деревьев) эпифиты, с различными клубневыми органами (или без них)** | Эпифитные Ericaceae, Melastomataceae, Araliaceae. Возможно, все или большинство являются факультативными полуэпифитами (Zotz et al., 2021b) |
|
| Полуэпифиты | “Душители” | Ficus L. sp. nonn. (Moraceae) | |
| Гелиофиты | Полуэпифитные лианы | Monstera Adans. sp. nonn. Philodendron Schott sp. nonn. (Araceae) |
|
| Сциофиты | Гомойогидрические мезофильные и полуксерофильные эпифиты | “Розеточные” эпифиты*** | Vittaria Sm. sp. nonn. (Vittariaceae) |
| Куртинообразующие эпифиты | Barbosella Schltr. sp. nonn. (Orchidaceae), | ||
| Microgramma C.Presl sp. nonn. (Polypodiaceae) | |||
| Пойкилогидрические эпифиты | Куртинообразующие эпифиты | Большинство представителей сем. Hymenophyllaceae Link |
Примечание. sp. nonn. – некоторые представители рода (лат.); род или семейство без указания видов дается в случае принадлежности большинства их таксонов к данной модели; полное название вида дается в случае принадлежности только единичных представителей рода к модели. * Смысл названия в упрощении побега, редукция одних органов приводит к сосредоточению различных функций в других (как то: всасывание, фотосинтез и запасание), данный термин не имеет аналогов в англоязычной литературе. ** Данная группа выделяется нами в рамках этой статьи по итогам дисскуссии, вылившейся в публикацию Zotz et al., 2021b. *** В данном случае термин употребляется в чисто физиономическом смысле, аналог термина “rosulate epiphytes” по существующим классификациям (Benzing, 1990; Zotz, 2016).
Интересна (и редка для отечественной ботаники) классификация эпифитов, предложенная недавно Н.М. Державиной (2019). Выделенные автором морфофункциональные типы отображают приспособления сосудистых эпифитов разных жизненных форм к условиям обитания в пологе тропического леса. В пределах морфофункциональных типов (факультативные эпифиты, облигатные эпифиты, гемиэпифиты) выделены морфологические группы и подгруппы по особенностям минерального питания и водоснабжения. Основным недостатком этой классификации, по нашему мнению, является сосредоточение на папоротниках (которые являются меньшинством среди эпифитов) и некоторая терминологическая вольность. Так, автор употребляет термин “факультативные” эпифиты в том смысле, в котором мы употребляем “сциофильные” (“теневые”) эпифиты, а не в значении случайного или необязательного эпифитизма. Кроме того, непонятно отнесение к эпифитам полупаразитов из семейств Loranthaceae и Viscaceae. По нашим данным, маловероятно наличие у эпифитов и опосредованного паразитизма через грибы (Eskov et al., 2020), тем более странно рассматривать классические полупаразиты как эпифиты. Несмотря на то, что исторически такой взгляд имел место (напр., Benzing, 1990; Assede et al., 2012), сегодня он скорее может рассматриваться как анахронизм (Zotz, 2016).
2. ЭКОФИЗИОЛОГИЯ И МИНЕРАЛЬНОЕ ПИТАНИЕ
2.1. Ассимиляция углерода и его изотопный состав
Известно, что многим наземным (Bone et al., 2015) и эпифитным (Silvera et al., 2005, 2009; Qiu et al., 2015, и др.) орхидеям, а также эпифитам других семейств (Griffiths, Smith, 1983; Winter et al., 1983; Medina, 1996; Zotz, Ziegler, 1997; Zotz, 2004; Зитте и др., 2008; Silvera et al., 2010; Silvera, Lasso, 2016, и др.) свойственен САМ-фотосинтез (crassulacean acid metabolism – кислотный метаболизм толстянковых). В эволюционном смысле САМ явился очень удобным механизмом для эпифитов на пути ксероморфоза для освоения наиболее экстремальных местообитаний.
Разница изотопного состава углерода между С3-растениями (к которым принадлежат множество хорошо знакомых нам бореальных растений) и С4- или САМ-растениями существенна (Martin et al., 1990, 1992; Diels et al., 2004) и может отличаться на 10‰ и более (Тиунов, 2007). Теоретически максимальный показатель δ13С (доля отклонения от стандарта составляющего 0) у САМ-растений 12‰ (Зитте и др., 2007). Низкая дискриминация 13С у САМ-растений связана с сильным сужением устьиц во время усвоения СО2 (Зитте и др., 2007) – механизм, препятствующий потерям воды. Таким образом, δ13С служит очень хорошим и точным маркером того или иного пути фотосинтеза в исследуемом материале (Зитте и др., 2007; Тиунов, 2007).
Прямая связь сужения устьиц и сниженной дискриминации 13С говорит о том, что растения, проявляющие этот эффект, находятся в условиях острого дефицита влаги (Зитте и др., 2007). Для эпифитов это должны быть так называемые эпифиты крон или гелиофильные эпифиты, находящиеся в тех частях крон форофитов, которые испытывают регулярные существенные суточные перепады влажности (Johansson, 1974, 1975, 1978; Sugden, 1981; Benzing, 1981, 1986a, b, 1987; Jacome et al., 2004, и др.). И в самом деле, доля эпифитов с САМ растет снизу вверх по высоте дерева (Silvera, Lasso, 2016) и уменьшается по мере продвижения в горы (Hietz et al., 1999).
Вопрос связи САМ-фотосинтеза с экологической пластичностью в пограничных условиях (например, при затенении) мало изучен у эпифитов. Деацидификация (процесс высвобождения СО2 из яблочной кислоты) зависит от облучения, дальний красный свет этот процесс стимулирует (Barrow et al., 1982). Изучение влияния краткосрочного и долгосрочного влияния затенения на эпифитное бромеливое (Aechmea) с САМ показало при краткосрочном ограничении света неприспособленность (гибель хлоренхимы, изменение содержания яблочной кислоты, баланса СО2), а при долгосрочном — более успешную приспособляемость (Ceusters et al., 2011).
Модель распределения типа фотосинтеза внутри группы с большой долей эпифитов хорошо изучена на бромелиевых. Для определения САМ- и С3-фотосинтеза был сделан изотопный анализ углерода в тканях 1893 видов бромелиевых (57% от общего числа видов) из 57 родов. У 1074 видов (57%) значение δ13С типичное для С3-фотосинтеза (дневная фиксация С), тогда как у 819 видов (43%) показана ночная фиксация углерода и САМ-фотосинтез. По высотному распределению наибольшее число С3-бромелий было обнаружено на средней высоте от 500 до 1500 м над ур. м., тогда как частота встречаемости САМ-видов монотонно уменьшалась с увеличением высоты (Crayn et al., 2004, 2015).
Обсуждается также облигатный и факультативный характер САМ у эпифитов и его связь с жизненными формами и местообитанием. Виды с облигатным САМ имели значение 10–20‰, облигатным С3 – 23–35‰ δ13С. Наиболее ксерофитные виды (атмосферные бромелиевые) все имели САМ-фотосинтез и произрастали в более сухих условиях, резервуарные бромелии имели широкое географическое распространение, они включали факультативные С3-виды и факультативные САМ. Теневыносливые бромелии, растущие при высокой влажности воздуха, все были С3 (Griffiths, Smith, 1983). У орхидей на примере 18 эпифитных, литофитных и наземных видов р. Cymbidium были обнаружены три категории фотосинтетической активности: сильный САМ, слабый САМ и С3. САМ обнаружен у эпифитных и литофитных видов, у наземных видов – всегда С3, независимо от их местообитаний. Авторы делают вывод, что слабый САМ – наследованный признак у цимбидиумов, а сильный САМ и С3 появились последовательно в ходе эволюции рода (Motomura et al., 2008).
САМ не всегда является необходимым условием для освоения эпифитных местообитаний. Одно из главных семейств эпифитов (Araceae) имеет единственный вид с САМ и то среди наземных представителей (Zamioculcas zamiifolia) (Holtum et al., 2007). Генетические причины САМ мало понятны, во многом они остаются “черным ящиком” (Lüttge, 1989). Таким образом, не известно почему, например, у группы близкородственных видов, среди которой превалируют С3-растения, встречаются виды с САМ (Tsen, Holtum, 2012). Не всегда очевидны и экологические причины этого (Silvera et al., 2010). САМ может переключаться на С3 внутри одного вида эпифита, нося факультативный характер, в зависимости от условий произрастаний (Qiu et al., 2015). При этом САМ и С4 не совместимы и не имеют взаимных переходов (Sage, 2002). Хотя имеются единичные данные, что это не так и возможен факультативный САМ у С4-растений (Winter, Holtum, 2017).
Интригующим моментом является недавно обнаруженное различие типов фотосинтеза у разных вегетативных органов эпифитов. Так, показано, что у Cattleya walkeriana в сочных, суккулентных листьях имеется САМ, а в корнях и псевдобульбах – нет; Oncidium же сорта “Aloha”, обладающий тонкими листьями, имел САМ в корнях и псевдобульбах, но не в листьях (Rodrigues et al., 2013). Это говорит о том, что разные вегетативные органы эпифита самодостаточны в гораздо большей степени, чем у наземного растения, органы которого строго функциональны и соответственно взаимосвязаны. Функциональная диверсификация органов у эпифитов возможно является причиной редукции некоторых из них в процессе эволюции. Она заходит намного дальше, чем у наземных суккулентов, например, кактусов или молочаев. Так, экобиоморфологический тип эпифитных орхидей, именуемый в англоязычной литературе “shootless”, имеет полностью редуцированные листья, превратившиеся в катафиллы и седячий уплощенный побег. Таким образом, все фотосинтетические функции берут на себя воздушные корни (Benzing, 1996). Эти фотосинтезирующие корни (рис. 3ж), являющиеся единственным “зеленым” органом (хотя на вид они и не выглядят так) у shootless, также используют тип фотосинтеза, являющегося вариантом САМ, несмотря на отсутствие устьичного аппарата (Cockburn et al., 1985; Winter et al., 1985). Такие корни более успешно сопротивляются высыханию при более тонком (в две клетки толщиной) веламене (Benzing et al., 1983). Тонкий веламен является, по-видимому, необходимым условием газообмена при фотосинтезе в корнях.
2.2. Рост
Общая связь процессов роста и фотосинтеза растений является одной из фундаментальных проблем современной биологии (Зитте и др., 2007). Рост с экологической точки зрения – это процесс инвестиции и перераспределения ассимилятов. Так, показано, что сухая масса корней и листьев с возрастом падает у эпифитной орхидеи Dimerandra emarginata, а масса стеблей (видоизменных в псевдобульбы) растет (Zotz, 1998; Zotz et al., 2001), что говорит об экологической стратегии инвестирования в запасающие органы. Кроме того, концентрации азота в сухой массе ниже у эпифитов, чем у наземных растений (Schulze et al., 1994; Roderick et al., 2000). Это, однако, не обязательно является признаком недостатка ЭМП, а может быть свидетельством иной модели азотного питания у эпифитов, связанной с медленным ростом (Stuntz, Zotz, 2001). Таким образом, из всего вышеизложенного становится понятно, что рост эпифитов должен иметь ряд особенностей, связанных со спецификой их экофизиологии.
Мы изучили рост воздушных корней 20 видов эпифитов и полуэпифитов ex situ из 8 семейств (Orchidaceae, Bromeliaceae, Araceae, Cactaceae, Moraceae, Rubiaceae, Asclepiadaceae, Zingiberaceae) (Еськов, 2018). Было показано следующее:
1) у воздушных корней цветковых эпифитов вместо четко выраженной апикальной меристемы выявлена единая зона роста, которая характеризуется отсутствием у меристемы явной границы и продолжающимися митотическими делениями в зонах коровой паренхимы и ризодермы на протяжении значительной части зоны растяжения (рис. 4), длина зоны растяжения прямо пропорциональна скорости роста;
2) скорость роста воздушного корня, его длина и толщина коррелируют со следующими функциональными параметрами цветковых эпифитов: положительно – с удельной листовой поверхностью живых листьев, отрицательно – с удельной длиной корней, содержанием и изотопным составом азота и углерода в листьях и корнях.
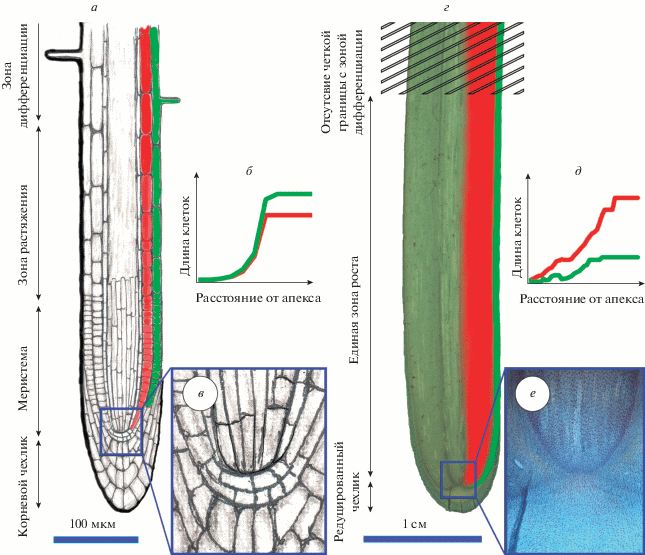
Рис. 4.
Разница в организации процессов роста подземных корней (на примере Arabidopsis) и воздушных корней эпифитов и полуэпифитов (на примере Monstera). Подземный корень (а) обычно относительно тонкий (≤1 мм), имеет хорошо развитый корневой чехлик и четко локализованные зоны меристемы, удлинения и дифференциации, что диагностируется по появлению корневых волосков; средняя длина клетки экспоненциально увеличивается на границе меристемы и зоны растяжения (б), длина клеток ризодермы больше, чем длина клеток коры; в – меристема закрытого типа. У воздушного корня (г), который намного толще подземного корня (≥1 мм), редуцированный корневой чехлик, меристема и зона растяжения сливаются в комбинированную зону роста, которая не имеет четкой границы с зоной дифференциации, корень в зоне дифференциации (волоски не развиваются); средняя длина клетки линейно растет на большой площади (д), в то время как рост может сопровождаться клеточными делениями, длина завершивших рост клеток коры больше, чем клеток ризодермы; е – меристема открытого типа.
Это свидетельствует о том, что эпифиты с САМ (диагностируемым повышенным содержанием 13С) имеют низкую потребность в азоте и медленнее растут (Еськов, 2018).
2.3. Подвешенные почвы и симбиотические связи
2.3.1. Что такое подвешенные почвы? Эволюция эпифитов шла не только в направлении строгого ксероморфоза, возможна и альтернативная стратегия, когда эпифит выступает как своего рода эдификатор в кронах леса. В рамках реализации этой стратегии вокруг корневой системы эпифитов образуются особые почвоподобные субстраты – подвешенные почвы. Образование таких подвешенных почв подчиняется несколько иным закономерностям, чем процессы “нормального” почвообразования в тропических условиях. Подвешенные почвы относятся к категории органических почв или почвоподобных образований, хотя им не уделяется должного внимания ни в одной классификации почв России и мира.
Недооценена роль подвешенных почв в круговороте органических веществ и биофильных элементов. Для некоторых почв, в частности органогенных, Ю.С. Толчельников (1985) ввел термин “вырожденное почвообразование”, при котором, в частности, непропорционально уменьшается роль того или иного фактора почвообразования (в данном случае почвообразующей породы), что исключает возможность их функционирования как почв в экосистеме. К подобным функционально почвоподобным телам относят и зоогенные почвы, все более активно изучаемые в последнее время (Абакумов, 2014). Однако имеются лишь единичные работы, воспринимающие зоогенные почвы как функциональный блок экосистем (напр., Frouz, Jílková, 2008). Существует также понятие о почве как элементе “экосистемы одного растения” (Чертов, 1983), но собственно подвешенные почвы, сопровождающие эпифитную колонизацию в тропиках, остаются малоизученными.
Подвешенные почвы определяются как органические субстраты и растительные остатки, задержанные в эпифитных сообществах, которые не прошли полную стадию детритизации и не превратились в гумус наземных почв (Shaw, 2013). Детритизация является одним из важных процессов функционирования лесных экосистем, обеспечивающим круговорот веществ. Скорость разложения органических веществ часто находится в зависимости от климатических условий (температуры и количества осадков) (Trofymow, Moore, 2002), биологической доступности разлагающегося материала и состава сообществ редуцентов. Данный процесс начинается со старения листьев, листопада и осаждения опада в лесной подстилке (Hempfling et al., 1991). Однако если эта последовательность нарушается, органическое вещество не попадает в подстилку сразу, а накапливается на поверхности препятствий. Такие почвы могут долгое время существовать в форме неразложившегося органического вещества, удерживаемого в кронах различными видами эпифитов.
Подвешенные почвы в лесном пологе испытывают бóльшие перепады температур и влажности, чем в лесной подстилке (Bohlman et al., 1995), и скорость разложения органического вещества в пологе по сравнению с подстилкой может быть иной (Lindo, Winchester, 2006, 2007). Так, по анализу разложения целлюлозных дисков экспериментально был показан более медленный распад органического вещества в условиях “воздушных почв”, чем на земле (Nadkarni, 1986). В подвешенных почвах присутствует и почвенная фауна, например, клещи (Lindo, Winchester, 2007) и ногохвостки (Shaw, 2015). Процесс заселения кроны деревьев нелетающей фауной изучен плохо, но предположительно включает в себя миграцию по коре дерева (Shaw, 2015).
Таким образом, подвешенные почвы являются интересным объектом изучения не только из-за нетрадиционного процесса почвообразования, но и вследствие того, что представляют собой важный фактор сохранения биоразнообразия “эпифитной фауны”. Видовое богатство и видовой состав муравьев зависят от размера эпифита и наличия подвешенной почвы (DaRocha et al., 2015). Отмечено, что биомасса обитателей подвешенных почв в 20 раз превышает таковую в наиболее обитаемом почвенном горизонте (Сергеева и др., 1989). В нескольких “гнездах” одного только вида Asplenium nidus, собранных из трех местообитаний во Вьетнаме, найдено 150 видов беспозвоночных (Сергеева и др., 1997).
В ходе наших исследований было выявлено, что подвешенные почвы характеризуются малым содержанием ароматических соединений (Abakumov et al., 2018; Rodina et al., 2020). Согласно термодинамической концепции гумификации (Schnitzer, 1978), происходит термодинамический отбор гуминовых веществ на основе отбора устойчивых ароматических колец, сопряженных с карбоксилами, а алифатическая периферия незначительно уменьшается за счет минерализации. Полученные нами результаты соответствуют данной концепции: доля ароматических веществ в составе структурных соединений гуминовых кислот выше, чем в валовом органическом веществе. Таким образом, можно сделать вывод, что в подвешенных почвах происходят процессы гумификации. Это важное наблюдение, показывающее, что, хотя существование подвешенной почвы лимитировано временем жизни самого форофита, это почва в буквальном смысле этого слова, где происходят процессы гумификации, схожие с настоящими, наземными почвами (Abakumov et al., 2018; Rodina et al., 2020).
2.3.2. Механизмы накопления подвешенных почв. Для эпифитов характерны разные способы образования подвешенных почв. У ряда эпифитов почвы формируются под самой куртиной. Очень часто в куртине эпифита поселяются муравьи, играющие важную роль в генезисе подвешенной почвы (DaRocha et al., 2015). В случае “гнездового” эпифитизма улавливание опада осуществляется воронкой листьев, а разрастание корней, формирующее вокруг корневой системы мощный почвенный ком, визуально напоминает птичье гнездо.
“Скобочные” эпифиты используют похожий механизм, образуя с помощью специализированных листьев-скобок воронки для сбора опада и дождевой воды (Benzing, 1990; Zotz, 2016). У р. Drynaria роль “скобок” выполняют стерильные цельные жесткие вайи особой морфологии, живые ткани которых рано отмирают, но сами вайи сохраняются на растении многие годы. Масса корневого кома у “скобочных” эпифитов меньше, чем у “гнездовых”. Так, измеренная масса “гнезда” (субстрат + корни) для Asplenium nidus в конце сухого сезона составляла 5099 г, а листьев 958 г; для “скобочного” эпифита Drynaria laurentii при общей массе 938 г масса корней и перегноя составляла всего 222 г (Вальтер, 1968). В целом гнездовые эпифиты способны накапливать до 30–40 кг органического субстрата на экземпляр, а в рамках сообщества – до 277.9 кг/га (Pocs, 1976). Последняя оценка, скорее всего, сильно занижена.
В ненарушенном лесу число гнездовых эпифитов может достигать 600 экз./га при средней массе “гнезда” 3–5 кг (Зонн, Ли Чан-Квей, 1958). Большая масса подвешенных почв очень серьезно меняет режим водоснабжения эпифитов. Влагоемкость у “гнездовых” эпифитов, в зависимости от морфологии и специфики “гнездового” кома, колеблется от 45.4 до 334.9% по отношению к их сухой массе (Pocs, 1976). Даже в сухой сезон влажность эпифитных субстратов в 2.5 раза выше влажности верхнего почвенного горизонта (Сергеева и др., 1989) и близка к 80%. Это связано с перехватыванием капельного конденсата, оседающего ночью в кроне и практически не достигающего земли (Панфилов, 1961).
В ряде случаев гнездовые эпифиты образуют специальные придаточные (или боковые у придаточных) корни с отрицательным геотропизмом, выполняющие роль “щетки”, в которой застревает опад (рис. 5). В англоязычной литературе эти корни именуются “impoundment” – “корни-улавливатели” (Benzing, 1996). Ранее эти корни были отмечены у орхидных родов Catasetum (Benzing, 1996), Ansellia и Graphorkis (Johansson, 1974). По нашим наблюдениям, они характерны также для других родов орхидей трибы Cymbidieae: Cymbidium, Acriopsis, Stanhopea, Gongora, Cycnoches, Grammatophyllum (Orchidaceae) и некоторых других. Среди иных семейств они есть у ряда представителей р. Anthurium (Araceae).
Рис. 5.
Агеотропные корни: a – небольшая куртина орхидеи Acriopsis indica с хорошо развитой “щеткой” агравиотропных корней (н.п. Бако, Саравак, Борнео), б – эпифитная орхидея Grammatophyllum speciosum (оранжереи ГБС РАН), в – ароидный эпифит Anthurium crassinervium (оранжерея ГБС РАН).

Гнездовые эпифиты с этими корнями, а также другими приспособлениями для удержания воды и опада, получили в англоязычной литературе устойчивое наименование “мусорной корзины” (trash-basket) (Benzing, 1990). Морфология корневой системы “гнезда” у представителей двух различных семейств схожа, что позволяет рассматривать это явление как проявление конвергенции. Физиологическая же причина отрицательного геотропизма в данном случае малопонятна. Тем не менее в литературе встречаются данные, указывающие на зависимость образования таких корней от уровня освещения (Werckmeister, 1971). В ходе наших исследований мы выяснили, что агеотропные воздушные корни-улавливатели обычно лишены меристемы, имеют ярко выраженный детерминированный рост и обладают особой механической прочностью за счет видоизменения клеток стели (Еськов и др., 2017). С точки зрения функциональной роли можно сказать, что данное приспособление является примером адаптивной эволюции, благодаря которой растительный организм в ходе онтогенеза формирует среду, облегчающую его существование. Таким образом, характер роста воздушного корня напрямую связан с его эдификаторной ролью, если для данного вида эпифита характерно депонирование органического вещества в виде подвешенных почв.
2.3.3. Колонизация муравьями. Ряд таксономических групп эпифитов является высокоспециализированными мирмекофитами (Janzen, 1974; Davidson, Epstein, 1989; Benzing, 1990; Gibernau et al., 2007; Zotz, 2016). Таковы, например, представители подтрибы Hydnophytinae, семейства мареновые (Rubiaceae), включающей пять родов (Chomicki, Renner, 2017), распространенных в Юго-Восточной Азии и Австралазии. Для этих растений характерны каудесоподобные домации (полые образования мирмекофильных растений, предназначенные для поселения муравьев), образованные путем разрастания гипокотиля. Это явление не специфично и происходит вне зависимости от наличия или отсутствия муравьиной колонизации. Показано, что неспецифичность симбиоза с муравьями является для группы исходной, хотя и утрачивалась в ходе эволюции 12 раз (Chomicki, Renner, 2017). При этом 13 раз возникший (включая существующий) мутуализм с муравьями ограничивается почти полностью родом Philidris (Chomicki et al., 2017).
Также облигатными мирмекофитами являются эпифитные папоротники из семейства Polypodiaceae родов Solanopteris (Forel, 1904; Gómez, 1974, 1977), Lecanopteris (Gay, 1991, 1993a, b; Gay, Hensen, 1992; Haufler et al., 2003) и одного представителя рода Polypodium (Koptur et al., 1998). Домациями в таком случае служат расширенные полые корневища, или клубнеподобные образования корневого происхождения. В ряде случаев домацием выступает, судя по всему, сама куртина, как это было показано для эпифитного папоротника Antrophyum lanceolatum (Vittariaceae) (Watkins et al., 2008).
Вопрос, зачем именно нужен консортизм с муравьями эпифитам, сложен. Совершенно очевидно, что для части эпифитов важна мирмекохория при расселении и завоевании эпифитных местообитаний (Janzen, 1974). В ряде случаев муравьи, обитающие в эпифите, могут быть неплохой защитой растению. Так, если для мирмекофитов Старого Света обычны консорты из сравнительно безобидных представителей р. Philidris (Chomicki et al., 2017), то для Америки часто характерно поселение в эпифитах р. Azteca, яростных защитников растения-хозяина (Gómez, 1974). Для тропических лесов о. Борнео показано, что удаление муравьев-консортов вида Crematogaster difformis резко увеличило повреждаемость фитофагами не только эпифитов, но и форофитов, на которых последние растут (Tanaka et al., 2009).
Но самая очевидная причина симбиоза – трофическая. Муравьи тропических экосистем в целом могут влиять на азотное питание древесных растений, среди которых обитают (Pinkalski et al., 2015). Помимо “традиционных” источников азота, мирмекофильные эпифиты могут получать его из продуктов жизнедеятельности муравьев. Это было, в частности, доказано применением меченого азота в продуктах, которыми кормили муравьев, и который по истечении определенного времени оказывался в мирмекофильных эпифитах (Gay, 1993a). Для эпифитного р. Squamellaria (Rubiaceae) отмечен случай “истинного фермерства” муравьев. Они не только защищают хозяина, но и откладывают экскременты исключительно на выросты стенок полостей-домаций, в которых обитают муравьи. Эти выросты обладают гиперадсорбционными свойствами для соединений азота. Эта адаптация является итогом длительной совместной эволюции муравьев и эпифитов (Chomicki, Renner, 2019). Муравьи, как и прочие животные, имеют отличный от растений изотопный состав азота (Vanderklift, Ponsard, 2003), что позволяет зачастую точно установить факт получения азота эпифитом от консорта. Таким образом, изотопный состав азота эпифита отражает трофическое влияние “животного” консортизма. Например, было изучено влияние лягушки (Scinax hayii) на минеральное питание танковой бромелии Vriesea bituminosa, в которой эта лягушка днем находит себе убежище. Показано, что бромелии с живущими в них лягушками имели более высокие значения 15N, чем без них (в полевом эксперименте). В условиях оранжереи получены сходные результаты (Romero et al., 2010). Похожего эффекта можно ожидать и для мирмекофильных эпифитов, что и было показано на Dischidia major (Asclepiadaceae), у которой 29% азота оказалось “муравьиного” происхождения. Интересно отметить, что 39% углерода это растение, домациями которого служат сами зеленые листья, имеющие мешковидные полости, также получает от дыхания муравьев (Treseder et al., 1995). В ходе наших исследований получены данные, которые позволяют говорить о влиянии муравьиной колонизации эпифитов на минеральное питание деревьев-хозяев (рис. 6). В данном случае не форофит через опад формирует подвешенную почву, а эпифитный ком, благодаря муравьиной колонизации, влияет на азотное питание форофита и его органическое вещество, во многом зоогенной природы (Еськов и др., 2017).
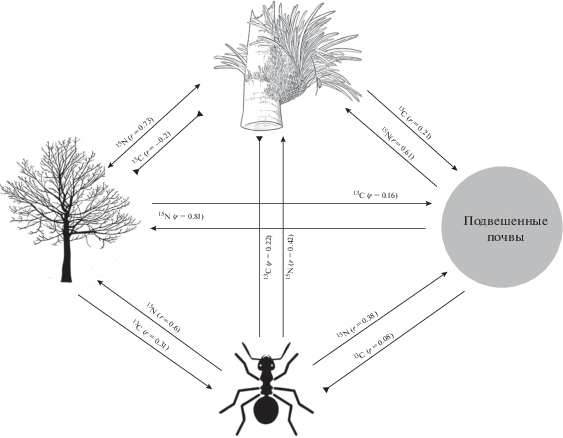
Рис. 6.
Схема движения энергии и азота в эпифитном сообществе. Указан характер влияния различных компонентов системы друг на друга: стрелка – высокая степень корреляции, обратная стрелка – отрицательная или очень слабая корреляция. Видно, что муравьи-консорты эпифитов оказывают существенное влияние на систему, включая форофиты (по: Еськов и др., 2017).
2.4. Минеральное питание эпифитов
2.4.1. Замена функциональной роли корней в минеральном питании. Минеральное питание эпифитов остается малоисследованной областью (Clarkson et al., 1986; Benzing, 1990). Функциональная роль воздушных корней в минеральном питании эпифитов обсуждается и не очевидна (Benzing, Renfrow, 1974; Antibus, Lesica, 1990; Benzing, 1990, 1996; Alien et al., 1993). Наиболее полно особенности минерального питания эпифитов изучены для тропиков Нового Света, в частности, для бромелиевых. Прямое участие листьев бромелиевых в минеральном питании и поглощении ионов было показано авторадиографией меченных тритием аминокислот через листовые трихомы (Benzing et al., 1976). Бромелиевые получают элементы минерального питания (ЭМП) из дождя, тумана, пыли, путем выщелачивания или разложения опада форофитов, а также из остатков животных (Benzing, 1990; Bermudes, Benzing, 1991; Romero et al., 2010). Это происходит благодаря наличию у бромелиевых особой биоморфологической модели: розеток, или “танков”, в которых происходит аккумуляция воды, опада и, возможно, поселение животных (Benzing, 1990, 2000; Romero et al., 2010).
Розеточные бромеливые имеют толстые кутикулы листьев, высокий устьичный контроль, локализованы в верхней части крон и благодаря этому успешно противостоят высокой степени инсоляции и высыханию (Reyes-Garcia et al., 2008). Виды с большими резервуарами выдерживают длительные периоды засухи. Накопленная вода может высохнуть через одну–две недели (Zotz, Thomas, 1999), и поэтому резервуарные бромелиевые полагаются на способность переключаться с C3- на CAM-фотосинтез, чтобы пережить эти периоды нехватки воды (Benzing, 2000). Наличие ЭМП, как правило, менее важно, чем доступность воды (Laube, Zotz, 2003), но может быть лимитирующим фактором при наличии воды.
2.4.2. Есть ли трофическая связь между форофитом и эпифитом? Экспериментальные данные о возможной трофической связи между форофитами и эпифитами противоречивы. В горных лесах ЭМП менее доступны, чем в низинах леса (Grubb, 1977). Однако исследования ЭМП вдоль высотного градиента в Коста-Рике не показали связи между химизмом листьев эпифитов и высотой для любой из изученных эпифитных групп, которые включали папоротники, орхидеи и бромелии (Cardelús, Mack, 2010), т.е. не показывали связи в трофизме между эпифитами и форофитами. С другой стороны, многолетние опыты внесения минеральных подкормок в “эльфийском” лесу Пуэрто-Рико показали, что добавление ЭМП в почву стимулирует рост деревьев (Walker et al., 1996) и увеличивает содержание ЭМП в лиственных породах (Yang et al., 2007), что, в свою очередь, повлияло на рост эпифитов на этих деревьях. Эпифитные бромелии, произрастающие на подкормленных деревьях, четко реагировали на ЭМП: увеличением темпа роста, образования плодов и продолжительности жизни (Lasso, Ackerman, 2013).
Эти исследования (см. также Benner, Vitousek, 2007; Boelter et al., 2014) предполагают, что эпифиты ограничены в минеральном питании, и что между форофитами и эпифитами существует трофическая связь. Эта связь может быть особенно актуальной для бромелиевых, поскольку их биоморфолия позволяет улавливать опад с форофита. Однако эпифиты с другими механизмами сбора ЭМП могут быть не связаны с их деревом (Cardelús, Mack, 2010).
Биомасса эпифитов может быть сравнима с таковой у лиственных деревьев (Nadkarni, 1984; Hofstede et al., 1993), вследствие чего эпифиты могут играть важную роль в циклах ЭМП в облачных лесах (Coxson, Nadkarni, 1995). Это было подтверждено в многолетних исследованиях полога леса и экосистемы в Монтеверде, Коста-Рика (Nadkarni et al., 2000a, b). Показано, что эпифиты и сопровождающее их отмершее органическое вещество влияют на циклы ЭМП в лесу Монтеверде за счет их высокой биомассы (Nadkarni et al., 2000b), высокой способности несосудистых эпифитов к поглощению атмосферного ${\text{NO}}_{3}^{ - }$ и ${\text{NH}}_{4}^{ + }$ (Clark et al., 1998), вклада эпифитов в общий опад (Nadkarni, Matelson, 1992), а также медленные темпы разложения эпифитов, упавших на почву (Matelson et al., 1993).
Хотя эти исследования показывают, что эпифиты воздействуют на содержание азота в тропических облачных лесах, взаимодействия между циклами питания эпифитов и форофитов остаются неясными. Наши исследования показали, что в двух из трех местообитаний Южного Вьетнама изотопный состав азота эпифитов и форофитов значимо скоррелирован, что говорит о взаимной трофической связи (рис. 7) (Eskov et al., 2019).
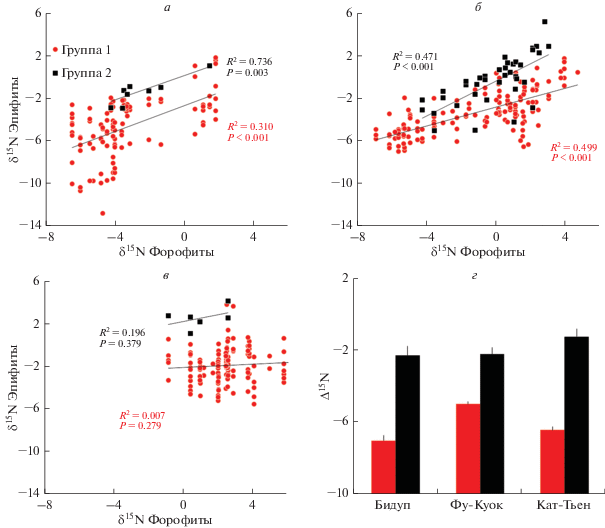
Рис. 7.
Корреляция между значениями δ15N типичных эпифитов (группа 1) и растений крон (полуэпифиты, полупаразиты), имеющих доступ к автохтонному азоту (группа 2), и значениями δ15N форофитов в трех изученных средах обитания: Бидуп (a), Фу-Куок (б) и Кат-Тьен (в). Средние нормализованные по почве значения Δ15N (+ 1 SE) для групп 1 и 2 в трех местах обитания приведены внизу справа (г). Во всех местах обитания разница между средними значениями Δ15N в группах 1 и 2 была достоверной (P < 0.01, тест HSD) (по: Eskov et al., 2019).
2.4.3. Азотное питание эпифитов. За последние десятилетия методы изотопной экологии стали важными инструментами для экофизиологии и изучения экосистем (Ehleringer et al., 1993; Högberg, 1997; Griffiths, 1998). Резкий естественный градиент изотопного состава “животного” и “растительного” азота позволяет понять возможные пути его миграции в эпифитном сообществе и его источники. В классическом исследовании Хайтса с соавторами (Hietz et al., 2002) выяснили, что эпифиты на небольших ветвях без подвешенной почвы имели более низкие концентрации N в листьях и пониженный δ15N, чем наземные растения, в силу того, что первые получают большую долю N непосредственно от дождя (содержащего обедненный тяжелым изотопом азот). У эпифитов было меньше δ15N (–3.9 ± 2.3‰), чем у форофитов (–1.1 ± 1.6‰), а подвешенные почвы имели более низкие значения (0.7 ± 1.2‰), чем наземные (3.8 ± 0.7‰). Авторы делают вывод, что азотный цикл, по-видимому, в значительной степени отделен от цикла дерева-хозяина.
В дополнение к азоту осадков, разлагающейся органики и экскрементов животных, некоторые виды эпифитов могут иметь доступ к атмосферному N2, фиксированному микроорганизмами, живущими на листьях (Brighigna et al., 1992), или живущих как симбионты в корнях (Dighe et al., 1986). Прямой перенос азота, фиксируемый свободноживущими эпифиллами – цианеями, был обнаружен для наземного растения (Bentley, Carpenter, 1984). Это также может быть важным источником для некоторых эпифитов, растущих в ярусах крон, благоприятных для обитания азотфиксирующих свободноживущих и симбионтных цианобактерий (Forman, 1975).
В корнях эпифитов встречаются микоризы разных типов, важные для усвоения ЭМП (Bermudes, Benzing, 1989; Janos, 1993). Стюарт с соавторами (Stewart et al., 1995), основываясь на значении δ15N и общей концентрации азота, выделили две группы эпифитов: одну – с низким общим азотом и низким содержанием 15N, другую – с более высоким общим значением азота и δ15N. Это говорит как минимум о двух основных источниках азота для эпифитов.
2.4.4. Остальные ЭМП и микроэлементы. Сосудистые эпифиты низменных тропических лесов ограничены ЭМП, в основном фосфором, а иногда азотом, или фосфором и азотом одновременно (Zotz, Richter, 2006; Zotz, Asshoff, 2010; Wanek, Zotz, 2011). В горном лесу наблюдается резкое увеличение численности и видового богатства эпифитов при внесении фосфора в течение 15 лет, но этого не наблюдается при внесении азота или других ЭМП (Benner, Vitousek, 2007). Исследования бромелиевых также указывают на лимитирующий характер содержания фосфора для роста и развития эпифитов (Zotz, Richter, 2006; Lasso, Ackerman, 2013). Накопление P, Zn, Al, Fe, Na в ткани листьев Werauhia sintenissi, растущей на участках, удобряемых регулярно в течение 10 лет макро- и микро-ЭМП (Lasso, Ackerman, 2013), предполагает потребление и хранение не только фосфора, как сообщалось ранее для Vriesea sanguinolenta (Wanek, Zotz, 2011), но также и других ЭМП.
В лесах, растущих на ультраосновных породах (Новая Каледония), богатых тяжелыми металлами и микроэлементами, не наблюдается накопления их в эпифитах (Morat et al., 1984). Гораздо более очевидно поступление их из атмосферы во время дождей: K, Ca, Mg, Na для резервуарных бромелий (Benzing, 1990), и даже улавливание таких ионов, как Zn, Pb, Cd, Cu, Ni, Cr, Sn, V, атмосферными бромелиями (Shacklette, Connor, 1973; Schrimpff, 1984), что позволяет использовать их как индикатор атмосферных загрязнений.
3. ДИАСПОРОЛОГИЯ, СТРУКТУРА СООБЩЕСТВ И ЭКОСИСТЕМНАЯ РОЛЬ
3.1. Структура эпифитных сообществ
Структурность эпифитных сообществ – это, пожалуй, первое, что бросается в глаза при наблюдении эпифитов тропических местообитаний, поэтому совершенно неудивительно, что этой теме посвящена обширная литература, тем не менее степень изученности вопроса далека от завершенности. Эпифиты являются структурно зависимыми растениями, а среда их обитания трехмерна, будучи пространством древесных крон, в освоении которой роль играют не только отношения с форофитом (Hietz, 1997), но также климат и топография (Rees et al., 2001). Следовательно, можно ожидать, что процессы, формирующие эпифитные сообщества, будут по своей природе отличны от процессов формирования самого леса (Watkins et al., 2006).
Доступные результаты исследований с несосудистыми эпифитами (например, мхами или лишайниками) также могут иметь ограниченную применимость к сосудистым эпифитам (Ellis, 2012). Так, лишайники и мхи в лесах с умеренным климатом ведут себя как “почвопокровные” метапопуляции (Snäll et al., 2005), и это подразумевает, что локальные отмирания обычно происходят из-за повреждения куртин (т.е. падения деревьев; Löbel et al., 2006). Напротив, немногие данные, доступные для сосудистых эпифитов, указывают на очень разную динамику, при которой отмирания происходят часто не из-за падения деревьев или ветвей (Laube, Zotz, 2007).
В ботанической литературе было неоднократно описано зонирование эпифитных сообществ в зависимости от места произрастания растений в кронах деревьев (Johansson, 1974, 1975, 1978; Sugden, 1981; Benzing, 1981, 1986a, b, 1987), а также их видовой состав (Sugden, Robins, 1979; Ter Steege, Cornelissen, 1989). В последнее время исследователи стали уделять внимание изучению закономерностей видового богатства (Krömer et al., 2005; Cardelús et al., 2006). Хотя это полезно в нескольких контекстах: например, при анализе изменений разнообразия по градиентам высоты или в контексте сохранения, сравнивая растительность эпифитов в нарушенных и ненарушенных лесах (Wolf, Flamenco-S, 2003; Köster et al., 2009), но потенциал такого подхода для понимания пространственно-временных изменений в структуре эпифитных сообществ ограничен (Mendieta-Leiva, Zotz, 2015).
Основной массив исследований, посвященных структуре эпифитных сообществ, оперирует масштабами всего форофита (Bennett, 1986; Gottsberger, Morawetz, 1993; Carlsen, 2000; Annaselvam, Parthasarathy, 2001; Arévalo, Betancourt, 2006; Cascante-Marín et al., 2006; Goode, Allen, 2008; Hirata et al., 2009; Aguirre et al., 2010; Adhikari et al., 2012a, b, и многие другие). Гораздо реже рассматриваются отдельно эпифиты различных зон дерева, например, ствола и кроны (Rudolph et al., 1998; Rosenberger, Williams, 1999; Pos, Sleegers, 2010).
Масштаб исследований эпифитных сообществ самый разный: от 3–5 видов (Winkler, Hietz, 2001; Winkler et al., 2007, 2009) до 336 видов (Kluge, Kessler, 2011) и от 127 отдельных экземпляров, вовлеченных в исследования (Adhikari et al., 2012a, b), до 39 735 (Linares-Palomino et al., 2009). Динамической стороне трансформации структуры эпифитных сообществ во времени посвящено сравнительно немного исследований (напр., Bennett, 1986; Rosenberger, Williams, 1999; Schmit-Neuerburg, 2002; Laube, Zotz, 2007; Winkler et al., 2007, 2009; Goode, Allen, 2008; Werner, 2011). Временные диапазоны составляют от 4 месяцев (Goode, Allen, 2008) до 8 лет (Laube, Zotz, 2007).
Трехмерное распределение сосудистых эпифитов объединяет различные градиенты экологической неоднородности (Stein et al., 2014) и таким образом предлагает несколько вариантов масштабирования при исследованиях. Такими могут быть: 1) зоны дерева, либо ветви, крона или ствол (Mehltreter et al., 2005; Irume et al., 2013, и др.); 2) отдельное дерево (Nieder et al., 2000; Irume et al., 2013, и др.) и 3) стационарная площадка (Linares-Palomino et al., 2009, и др.). Эти экологические масштабы определяются различными внешними факторами или организационными задачами. Например, при изучении видоспецифичности эпифитов и форофитов требуются исследования в масштабах стационарных площадок (Vergara-Torres et al., 2010).
Таким образом, число исследований эпифитных сообществ довольно велико. В недавней попытке формализировать изучение этой темы обнаружено в общей сложности 318 исследований, из которых только 26% описывают как видовой состав, так и видовое разнообразие, т.е. в полной мере можно говорить о структуре эпифитных сообществ (Mendieta-Leiva, Zotz, 2015). Однако даже эти исследования настолько разнородны, что не пригодны для метаанализа. В связи с этим авторы предлагают стандартизировать изучение эпифитных сообществ, беря за единицу выборки форофит, а само сообщество принимать как комплекс сосудистых эпифитов (vascular epiphytes assamblages – VEAs) (Mendieta-Leiva, Zotz, 2015).
Наши исследования эпифитных сообществ лесов Вьетнама показали, что представители различных семейств сильно отличаются своей чувствительностью к нарушениям. Наиболее уязвимы виды орхидей – будучи доминирующей группой в эпифитном сообществе первичного леса, они почти полностью выпадают при антропогенном воздействии. Увеличение видового разнообразия эпифитов в менее нарушенных лесах происходит прежде всего за счет видов “нижних” ярусов и напрямую зависит от ярусности формации. Снижение числа ярусов формации приводит к выпадению видов “нижних” синузий (Еськов, 2013). Этот вывод подтверждается и при изучении эпифитных сообществ искусственных лесопосадок, в которых папоротниковые эпифиты доминируют над орхидными (Еськов и др., 2020).
3.2. Диаспорология эпифитов
Распространение и расселение эпифитных растений имеет ряд особенностей, связанных с проблемами их прикрепления к субстратам высоко над землей и, соответственно, транспорта диаспор эпифитов к этим субстратам. Как мы обозначили выше, это один из базовых экологических вызовов, стоящих на пути эпифитизма. Эволюция диаспор у эпифитов довольно однообразна и идет по двум направлениям: 1) уменьшение семени для распространения ветром при аэрохории, 2) образование сочных небольших и ярких ягод при различных видах зоохории, в подавляющем большинстве осуществляемой птицами или муравьями. В целом эти тенденции были положены в основу классификации Шимпера (Schimper, 1888), который выделил три группы диаспор: 1) “пылевидные” (у орхидей и папоротников), 2) другие аэрохорические семена с различными типами придатков (например, у Bromeliaceae – Tillandsioideae) и 3) зоохорические диаспоры (например, у Cyclanthaceae, Araceae, Gesneriaceae, Cactaceae). Эта классификация остается актуальной до сего дня и в целом не пересматривалась.
У семян орхидных наблюдается корреляция между образом жизни, размером и формой семян. Для 18 видов р. Paphiopedilum (Orchidaceae) было весьма наглядно показано, что размер и отношение длины к ширине семени уменьшаются при переходе от наземных форм к литофитным, и затем к эпифитным (Коломейцева и др., 2012).
У бромелиевых также наблюдается зависимость строения плодов и семян от экологии вида. Так, у наземного ананаса развивается большое сочное соплодие, и распространение семян идет через эндозоохорных агентов среди наземных животных. Крупные “резервуарные” бромеливые, растущие в развилках деревьев, часто имеют сочные ягоды и, по всей видимости, распространяются птицами, поедающими их. Наиболее специализированными эпифитами из бромелиевых являются представители р. Tillandsia, мелкие семена которых, распространяющиеся воздушным путем, имеют характерные волосовидные выросты тесты и при перепадах влажности воздуха совершают винтовые гигроскопические движения. Благодаря этому, семя весьма цепко прикрепляется к самым, казалось бы, неподходящим субстратам, где и прорастает (рис. 3д). Это не только очень тонкие ветви верхушек деревьев, где обычно эпифиты не встречаются, но и линии электропередач, что часто удивляет многих путешественников по Южной Америке.
Диаспорология эпифитных представителей семейства кактусовых также имеет ряд особенностей. Так, при проращивании большого числа семян эпифитных кактусов было отмечено, что зародышевый корень сразу после появления из оболочки семени обильно обрастает корневыми волосками и прекращает свой рост. При этом первых митотических делений апикальной меристемы на таких корнях обнаружено не было. Лишь по истечении пяти–семи дней у проростков стали появляться адвентивные корни. Видимо, это обусловлено необходимостью проростков как можно более прочно закрепиться на эпифитном субстрате после прорастания (Панкин, 2005).
Семена цветковых эпифитов весьма мелкие, достигая рекордных значений у орхидей, у которых носят столь редуцированный характер, что в естественных условиях совершенно не способны прорастать вне симбиотических связей с грибами. В целом для диаспорологии цветковых эпифитов характерно почти полное отсутствие фактических данных о способности к рассеиванию семян (Zotz, 2016).
Менее понятна диаспорология споровых сосудистых эпифитов. Также мы наблюдали в природе (Южный Вьетнам), что упавшие экземпляры Drynaria quercifolia не гибнут, а продолжают расти наземно, в условиях саванноподобного редколесья, но никогда не размножаются на земле самостоятельно. Ювенильные экземпляры спорофита Platycerium grande в том же редколесье встречались на стволах деревьев на высоте не выше одного метра и никогда не наблюдались на поверхности земли. Таким образом, может иметь место облигатность типичных споровых эпифитов, но сами причины и механизм селективного прорастания спор пока не ясен. Сравнивая же морфологию спор и гаметофитов эпифитных папоротников, очень трудно выявить какую-либо четкую тенденцию, предполагающую облигатный эпифитизм. На приведенных ниже примерах видно, насколько затруднительно выявить связь между эпифитным образом жизни и морфологией спор и заростков.
Для р. Ophioglossum (Ophioglossaceae) описаны заростки эпифитных видов O. pendulum и O. palmatum, которые чаще всего имеют вытянутую форму, но могут быть и относительно бесформенными. Они, как правило, очень хрупкие, мясистые, имеют микоризу и не содержат хлорофилла. Их споры, как и у прочих представителей семейства, прорастают строго в темноте (Арнаутова, 2008), что делает не совсем понятным механизм их распространения в природе. Споры другого эпифитного сем. Vittariaceae зачастую прорастают в спорангиях. Их заростки имеют необычную лентовидную форму и многочисленные органы вегетативного размножения – геммы (Арнаутова, 2008). Кроме того, заростки р. Vittaria способны долго жить независимо. По гаметофиту был описан вид V. appalachiana, спорофит которого неизвестен (Farrar, Mickel, 1991). Тут прослеживаются параллели с другим обширным эпифитным семейством – Hymenophyllaceae, заростки которого также имеют необычную лентовидную или нитевидную форму и нередко образуют эндомикоризу. Они могут жить независимо на протяжении длительного периода. В процессе изучения таких автономных гаметофитов было описано два новых вида, спорофиты которых не найдены: Trichomanes intricatum и Hymenophyllum tayloriae (Арнаутова, 2008).
У полностью эпифитных родов сем. Polypodiaceae, таких как Platycerium и Pyrrosia, наблюдается опушение заростков многоклеточными волосками сложной формы, что тоже можно рассматривать как приспособление для выживания в строго эпифитных условиях. Важно и то, что часто споры эпифитных папоротников содержат хлорофилл и маслянистые включения, вследствие чего быстро теряют всхожесть из-за полного отсутствия у таких спор периода покоя (Арнаутова, 2008). Ряд споровых сосудистых эпифитов обладает интересными механизмами вегетативного размножения. Так, эпифитные представители р. Huperzia (Lycopodiaceae), попадая на подходящий субстрат (например, покрытую мхом ветку), способны образовывать выводковые почки на свешивающихся вниз спорофиллоносных частях побега. Диаспорология споровых эпифитов, несомненно, требует дополнительных исследований.
Надо отметить, что проблематика диаспорологии эпифитов не исчерпывается только изучением морфологии их диаспор и стратегий расселения, но должна опираться на более глубокое понимание биотических связей “форофит–эпифит”, которые, помимо высказанных несколько десятилетий назад соображений по поводу текстуры коры и видоспецифичности, до последнего времени были недостаточно очевидны. Не менее важным для расселения эпифитов оказался также возраст и размер дерева-хозяина (Zotz, Vollrath, 2003). Например, было показано, что с увеличением расстояния между деревьями Brosimum alicastrum (Moraceae) увеличиваются и генетические отличия у исследуемых экземпляров, что, в свою очередь, влияет на сообщество эпифитов, а также беспозвоночных, живущих на стволе и в опаде. Вполне возможно, что в данном случае лимитирующим фактором для расселения диаспор и успешного прорастания являются более тонкие связи, например, присутствие нужных штаммов эндофитных грибов, химический состав стекающей по стволу воды с вторичными метаболитами растения-хозяина, толщина мохового и лишайникового покрова ствола (Zytynska et al., 2011).
3.3. Экосистемная роль эпифитов
Из всего вышеизложенного становится понятно, что эпифиты вносят существенный вклад в экосистему. Но какого рода этот вклад и насколько он масштабен? Только сравнительно недавно было начато осмысление экосистемной роли эпифитов (рис. 8). Было предложено считать саму живую биомассу плюс разлагающуюся в эпифитах органику и подвешенные почвы в целом как эпифитный материал (epiphytic material – ЕМ) (Gotsch et al., 2016). Похожий подход использовали при исследовании эпифитов в горном субтропическом лесу в Китае, где авторы для эпифитных сообществ вместе с сопровождающей его косной органикой используют термин “органическое вещество крон” (canopy organic matter – СОМ) (Chen et al., 2010). Авторы оценили депонированные в СОМ ЭМП (N = 37.9 ± 9.0; P = 1.97 ± 0.47; K = = 9.6 ± 2.3; Ca = 9.6 ± 2.3; Mg = 2.64 ± 0.63 и Na = = 0.25 ± 0.06 кг/га) при общей массе СОМ 2261 ± ± 537 кг/га, в которой преобладали мохообразные (73.6%) и подвешенные почвы (13.9%) (Chen et al., 2010).
Рис. 8.
Экосистемная роль эпифитов (для каждого утверждения приведены работы, где рассматрены это явление или тенденция). a – эпифиты могут образовывать сплошной ковер на скелетных ветвях, который регулирует потоки воды по стволу и уменьшает поверхностный сток и вымывание элементов минерального питания из почвы (Gotsch et al., 2015). “Гнeзда” самой большой эпифитной орхидеи (б) Grammatophyllum speciosum (резерват Данум Вэлли, Сабах, Борнео) и огромного папоротника (в) Platycerium coronarium (н.п. Кат-Тьен, Вьетнам) способствуют накоплению в кронах не очень богатого эпифитами низинного леса больших массивов органического вещества (Зонн, Ли Чан-Квей, 1958). г – полуэпифиты-душители из р. Ficus (н.п. Кат-Тьен, Вьетнам) способны серьезно физиономически и флористически менять низинные леса (Федоров, 1959). д – в горных моховых облачных лесах основой эпифитных сообществ становятся моховые подушки (н.п. Кинабалу, Сабах, Борнео), вокруг которых накапливаются огромные массивы эпифитного материала (Hofstede et al., 1993). е – в олиготрофных условиях саваноподобной формации керангас (н.п. Бако, Саравак, Борнео), мирмекофильные эпифиты, возможно, играют для сообщества экосистемную роль как поставщики зоогенного азота (Еськов, Дубовиков, 2015). ж – в то время как большая часть эпифитов в антропоценозах вымирает (Turner et al., 1994; Leao et al., 2014), некоторые эпифиты способны процветать даже в тропических городах (г. Кучинг, Саравак, Борнео).

Фукциональное разделение сосудистых и бессосудистых растений при изучении экосистемной роли эпифитов не целесообразно, и последние должны учитываться, по меньшей мере, в тех лесах, где они имеют явную средообразующую роль: например, в горных моховых или в субтропических и умеренных лесах. Так, при изучении азотофиксации ассоциированных с мохообразными цианобактерий в Британской Колумбии было выяснено, что через эпифитные мхи привносится в экосистему существенно большее количество азота (0.76 кг/га в год), чем через наземные (0.26 кг/га в год) (Lindo, Whiteley, 2011). Другой особенностью эпифитных мохообразных является то, что они могут поглощать азот как в органической, так и в неорганической форме (Song et al., 2016), что делает их важным компонентом удержания азота в биосистеме, препятствующим его вымыванию.
Похожие результаты характерны и для тропических местообитаний. Так, во влажных тропических лесах Коста-Рики применение метки по 15N показало, что ${\text{NO}}_{3}^{ - }$, ${\text{NH}}_{4}^{ + }$ осаждаются ЕМ крон в меньшей степени, чем растворенный органический азот, который почти полностью поглощался в кронах. Наибольшее количество поглощенного 15N было найдено в эпифитных мохообразных (16.4%), хотя наибольшая доля биомассы ЕМ состояла из сосудистых эпифитов (Umana, Wanek, 2010).
Для понимания масштабности экосистемной роли эпифитов самым важным критерием является количественное определение ЕМ. Самая низкая оценка (0.5 кг/га) была зарегистрирована для 8-летнего подроста в субтропическом облачном лесу на Канарских островах (Patiño et al., 2009); самая большая масса (44 000 кг/га) была зарегистрирована для горных лесов в Колумбии (Hofstede et al., 1993). Рост массы ЕМ происходит с течением времени экспоненциально: так, на Канарских островах 0.5 кг/га ЕМ в 8-летнем лесу увеличилось до 205 кг/га после 25 лет восстановления. В промежуток между 25–60 годами масса ЕМ продолжала расти экспоненциально (от 205 до 1253 кг/га) (Patiño et al., 2009). В горном дождевом лесу Монтеверде, Коста-Рика, биомасса ЕМ в 40-летнем вторичном лесу была 200 кг/га, тогда как ЕМ в старовозрастном лесу на два порядка выше и составляла 33100 кг/га (Nadkarni et al., 2004). Исследована масса эпифитов (растения + гумус в пологе) в лесах Северного Таиланда. Она значительно варьировала от 80 г/м2 для разреженных мохообразных до 5882 г/м2 для ковров орхидных. С увеличением размеров дерева масса эпифитов увеличивается в целом на дерево с 73 до 481 кг, возрастает доля сосудистых эпифитов и подвешенных почв, в то время как биомасса мохообразных снижается (Nakanishi et al., 2016).
Масштабное накопление ЕМ дает возможность массового удержания в кронах больших объемов воды. Например, в Коста-Рике мхи в горном лесу способны впитывать воду на 400% от их сухого веса (Holscher et al., 2004; Köhler et al., 2007), а неотропический мох Octoblepharum pulvinatum имеет влагоемкость 7000% от его сухой массы (Wagner et al., 2014). На уровне всего древостоя оцененные значения депонированной воды в ЕМ составляли от 0.81 мм в тропическом горном лесу Коста-Рики (Holscher et al., 2004) до 5 мм в моховом облачном лесу в Танзании (Pocs, 1976). При этом участие мхов в депонировании осадков достаточно скромное (6%) из-за их обычно высокой насыщенности влагой (Holscher et al., 2004). Мхи также быстрее теряют депонированную влагу: в течение 3-дневного периода без осадков максимальная потеря воды составила 251% от сухого веса для мохообразных и 117% для подвешенных почв (Kоhler et al., 2007).
Источники ЭМП в ЕМ могут быть автохтонными (перехваченный опад деревьев и т.п.) или аллохтонными (ионы, полученные извне экосистемы, например, через дождь или туман). С точки зрения экосистемной функции, важно различать эти два источника. Если эпифиты получают все свои ЭМП из автохтонных источников, тогда они просто участвуют в цикле ЭМП от почвы к деревьям и не увеличивают общий пул ЭМП (Gotsch et al., 2016). С другой стороны, депонирование ЭМП, полученных извне экосистемы, потенциально увеличило бы общий вклад ЭМП в экосистему (Nadkarni, Matelson, 1992). Способность EМ к удержанию ЭМП весьма велика: было исследовано поглощение неорганического азота четырьмя компонентами крон: 1) эпифитными мохообразными, 2) ЕМ (небольшие сосудистые эпифиты, перехваченный опад и подвешенные почвы), 3) крупная листва сосудистых эпифитов и 4) листва форофитов. Эксперименты показали, что ${\text{NO}}_{3}^{ - }$ сильнее поглощались эпифитными мохообразными, но не листвой крупных сосудистых растений. Поглощение ${\text{NH}}_{4}^{ + }$ эпифитными мохообразными и ЕМ был несколько ниже и отражал внутреннюю цикличность ${\text{NH}}_{4}^{ + }$ в кронах. Авторы исследования определили, что EМ депонируют 33–67% неорганического азота, растворенного в атмосферных осадках (Clark et al., 2005). ЭМП из EM становятся доступными для деревьев, когда EM падают из крон на почву, когда ЭМП выщелачивается при дождях и в случае врастания адвентивных корней форофитов в подвешенные почвы (Gotsch et al., 2016).
И наконец, многочисленные организмы филлосферы (печеночники, мхи, лишайники, бактерии, грибы и другие микроорганизмы), которые мы напрямую не включаем в эпифитное сообщество, но которые можно отнести вместе с эпифитами к подвешенной биоте, оказывают существенное влияние на фотосинтетическую стратегию, гидравлику, поглощение ресурсов, температуру листа, защитные и многие другие свойства. Они влияют на массу семени, устьичную проводимость, длительность жизни листьев (Jones, Dangl, 2006; Lambers et al., 2008; Friesen et al., 2011; Sawinski et al., 2013; Kembel et al., 2014). Снижение фотосинтеза за счет затенения эпифилльными мохообразными может компенсироваться большим поступлением ассоциативно фиксированного азота. Продуцированный фитопатогенами цитокинин может увеличивать длительность жизни листа. Листовые бактерии и грибные эндофиты могут усиливать поступление воды с поверхности растения в его ткани. Организмы филлосферы могут синтезировать вещества, меняющие смачиваемость листа и проницаемость кутикулы (Schreiber et al., 2005; Beattie, 2011; Ritpitakphong et al., 2016). В целом эпифитные и эндофитные организмы листа изменяют многие свойства растений-хозяев (Rosado et al., 2018).
ЗАКЛЮЧЕНИЕ
Итак, на основе анализа существующей на сегодняшний день литературы по экологии эпифитов можно сделать следующее заключение. Эпифиты представляют собой масштабный феномен, свойственный в основном тропическим местообитаниям. Однако многие аспекты их биологии остаются недоиследованными. Определенный дисбаланс как в таксономическом составе, так и в географическом распространении предполагает довольно строгие эволюционные рамки, которые позволили только некоторым семействам и в определенных условиях освоить кроны деревьев. Вместе с тем пограничные условия эпифитного образа жизни намного шире, чем считалось ранее. Вертикально-пространственная структура эпифитных сообществ остается также малоисследованной, хотя этой теме посвящена довольно обширная литература. Вертикальная стратификация эпифитов непосредственно связана как с их экоморфологией, так и с экофизиологией.
Одним из адаптивных путей эпифитизма является ксероморфоз всего организма, в частности, образования особых корней, способных расти в воздушной среде – воздушных корней. Для более светолюбивых эпифитов характерен САМ, судя по всему, позволяющий им переносить сильные перепады влажности и мощную инсоляцию на вершинах крон. Разнесенность стадий дыхания и усвоения углерода во времени, постоянный дефицит влаги, а также скудость ЭМП, очевидно, должны приводить к низкой скорости роста корня у эпифитов с САМ, что, в свою очередь, должно выражаться в другой схеме “инвестирования” углерода и азота в корни, как базовой функции процесса роста по сравнению с наземными растениями. Функциональная морфология эпифитов в целом, можно сказать, находится в зачаточном состоянии.
Другой стороной освоения эпифитных местообитаний является “облегчение жизни” с помощью ряда адаптаций, например, образования подвешенных почв или консорций с животными, в частности с муравьями. Азотное питание древесных растений тропических экосистем может быть связано с присутствием муравьев, а эпифиты могут получать до трети азота из продуктов их жизнедеятельности. Многим наземным и эпифитным орхидеям, а также эпифитам других семейств свойственен САМ-фотосинтез. Разница изотопного состава углерода между С3-растениями (к которым принадлежат форофиты) и С4- или САМ-растениями, а также “животного” и “растительного” азота, позволяет понять возможные пути миграции органического вещества в эпифитном сообществе: от его источника до формирования подвешенной почвы в комах гнездовых эпифитов. Подобные исследования по изотопной экологии эпифитов немногочисленны и касаются Неотропических областей. Хотя отличия эпифитов Старого и Нового Света существенны, в cвязи с полным отсутствием в первом биоморфологического аналога бромелиевых.
Перспективы и актуальность изучения эпифитов многоразличны. С одной стороны, почти отсутствует цельная палеоботаническая картина происхождения эпифитов (Zotz, 2016), что ставит вопрос о причинах происхождения их впечатляющего разнообразия. Эпифиты вносят непропорционально большой вклад в большинстве глобальных центров разнообразия растений и играют важную роль в создании глобального градиента широтного разнообразия растений (Taylor et al., 2021). Это делает их крайне уязвимой группой, ведь, будучи структурно зависимыми растениями, они целиком и полностью зависят от лесов произрастания. А 60% тропических лесов еще 20 лет назад были признаны деградировавшими (ITTO, 2002). Судя по многочисленным исследованиям, эпифиты служат хорошим диагностическим критерием состояния лесов, как наиболее уязвимая экогруппа (напр., Leao et al., 2014). На примере семейства бромелиевых было показано, какую огромную роль в экосистемных услугах (ecosystem services) могут играть эпифиты (Ladino et al., 2019). Кроме того, в связи с изменением климата и увеличением антропогенных выбросов не понятно как это скажется на эпифитах. Предполагалось, что, возможно, повышение содержания СО2 сделает более эффективными механизмы водопользования у эпифитов (иными словами увеличивает их ксерофильность). Но в целом однозначного доказательства положительного влияния повышенного содержания СО2 на эпифиты найдено не было (Raveh et al., 1995; Li et al., 2002; Monteiro et al., 2009; Zotz et al., 2010).
Анализ литературы показывает, что вокруг эпифитов происходит депонирование впечатляющего массива органического вещества в кронах леса. Нами высказана мысль, что подвешенные почвы выполняют ту же функциональную роль, что и лесная подстилка в лесах более высоких широт, которая в тропических лесах отсутствует (Eskov et al., 2021). Таким образом, эпифитные сообщества (да и в целом подвешенная биота) являются не только существенным источником биоразнообразия тропических лесов, но и недооцененным депозитарием органического вещества, структурированного вокруг эпифитов. Правильная и исчерпывающая оценка этой роли еще ждет своего изучения и, возможно, изменит наши взгляды на углеродный баланс тропических лесов. А это, в свою очередь, изменит взгляд на эпифиты как на приятную и красивую, но, в общем-то, не обязательную группу растений, на осмысление их в качестве важнейшего функционального блока тропических экосистем.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-14-50223 и в рамках ГЗ ГБС РАН № 118021490111-5 на базе УНУ “Фондовая оранжерея”.
Список литературы
Абакумов Е.В., 2014. Зоогенный педогенез как основной почвообразовательный процесс в Антарктиде // Русс. орнитол. журн. Т. 23. № 972. С. 576–584.
Арнаутова Е.М., 2008. Гаметофиты равноспоровых папоротников. СПб.: Изд-во СПбГУ. 456 с.
Берг Л.С., 1952. Географические зоны Советского Союза. Т. 2. М.: Географгиз. 510 с.
Вальтер Г., 1968. Растительность земного шара: эколого-физиологическая характеристика. Т. 1. Тропические и субтропические зоны. М.: Прогресс. 551 с.
Вальтер Г., 1974. Растительность земного шара: эколого-физиологическая характеристика. Т. 2. Леса умеренной зоны. М.: Прогресс. 423 с.
Виноградова К.Л., 1989. Эпифитизм водорослей: уточнение терминологии // Бот. журн. Т. 74. № 9. С. 1291–1293.
Голубев В.Н., 1958. О короткокорневищных растениях // Бюлл. МОИП. Отд. биол. Т. 63. № 3. С. 97–103.
Горышина Т.К., 1979. Экология растений. М.: Высш. Шк. 368 с.
Державина Н.М., 2019. Опыт синтетического подхода к экологической классификации сосудистых эпифитов // Сиб. экол. журн. Т. 26. № 5. С. 526–537.
Еськов А.К., 2012. Экофизиологическая классификация сосудистых эпифитов как теоретическая предпосылка формирования коллекций и сообществ эпифитных растений в условиях оранжерейной культуры // Естественные и технические науки. № 4. С. 93–98.
Еськов А.К., 2013. Эпифитные сообщества древесных формаций Южного Вьетнама: анализ видового состава и строения синузий в зависимости от степени антропогенного влияния // Журн. общ. биологии. Т. 74. № 5. С. 386–398.
Еськов А.К., 2018. Рост и функциональная роль воздушных корней цветковых эпифитов. Дис. … канд. биол. наук. М.: ГБС РАН. 133 с.
Еськов А.К., Дубовиков Д.А., 2015. Сообщество мирмекофильных эпифитов формации керангас острова Борнео // Бюлл. МОИП. Отд. биол. Т. 120. № 4. С. 60–69.
Еськов А.К., Прилепский Н.Г., Антипина В.А., Абакумов Е.В., Nguyen Van Thinh, 2020. Формирование эпифитных сообществ в искусственных лесных посадках Южного Вьетнама // Экология. № 3. С. 171–180.
Еськов А.К., Абакумов Е.В., Тиунов А.В., Кузнецова О.В., Дубовиков Д.А. и др., 2017. Агеотропные воздушные корни-улавливатели гнездовых эпифитов и их роль в формировании подвешенных почв // Журн. общ. биологии. Т. 78. № 3. С. 54–68.
Зитте П., Вайлер Э.В., Кадерайт Й.В., Брезински А., Кёрнер К., 2007. Ботаника. Т. 4. Экология / Под ред. Еленевского А.Г., Павлова В.Н. М.: Академия. 248 с.
Зитте П., Вайлер Э.В., Кадерайт Й.В., Брезински А., Кёрнер К., 2008. Ботаника. Т. 2. Физиология растений / Под ред. Чуба В.В. М.: Академия. 496 с.
Зонн С.В., Ли Чан-Квей, 1958. Некоторые вопросы генезиса и классификации тропических почв Китая // Почвоведение. № 6. С. 58–69.
Коломейцева Г.Л., 2003. Морфологические типы орхидных // Бюлл. Гл. бот. сада. Вып. 185. С. 112–137.
Коломейцева Г.Л., 2006. Морфо-экологические особенности адаптации тропических орхидных при интродукции. Дис. … докт. биол. наук. М.: ГБС РАН. 377 с.
Коломейцева Г.Л., Антипина В.А., Широков А.И., Хомутовский М.И., Бабоша А.В., Рябченко А.С., 2012. Семена орхидей: развитие, структура, прорастание. М.: Геос. 352 с.
Кэмпбел Д.Х., 1948. Ботанические ландшафты земного шара. М.: Изд-во иностр. лит. 434 с.
Любарский Е.Л., 1973. О биоморфологической границе между длиннокорневищными и короткокорневищными растениями // Экология. № 2. С. 94–95.
Мазуренко М.Т., Хохряков А.П., 2010. Некоторые понятия биоморфологии // Бюлл. БСИ ДВО РАН. № 5. С. 106–116.
Нухимовский Е.Л., 1997. Основы биоморфологии семенных растений. T. I. Теория организации биоморф. М.: Недра. 630 с.
Нухимовский Е.Л., 2002. Основы биоморфологии семенных растений. Т. II. Габитус и формы роста в организации биоморф. М.: Оверлей. 859 с.
Панкин В.Х., 2005. Кариологический анализ некоторых представителей эпифитных кактусов (Cactaceae Juss.) // Бюлл. Гл. бот. сада. Вып. 189. С. 136–150.
Панфилов Д.В., 1961. Насекомые в тропических лесах Южного Китая. М.: Изд-во МГУ. 147 с.
Ричардс П.В., 1961. Тропический дождевой лес. М.: Изд-во иностр. лит. 447 с.
Сергеева Т.К., Компанцев А.В., Компанцева Т.В., Второва В.Н., 1997. Разнообразие биоты “подвешенных” почв в тропических лесах Вьетнама (на примере папоротника Asplenium nidus L.) // Сб. работ “Тропцентр-98”. Кн. 1. Биологическое разнообразие и современное состояние тропических экосистем Вьетнама. Москва-Ханой: Тропический Центр. С. 261–279.
Сергеева Т.К., Холопова Л.Б., Нгуен Три Тьен, Нгуен Шунг Ту, 1989. Животное население и свойства “подвешенных почв” тропического эпифита Asplenium nidus L. // Экология. № 5. С. 29–40.
Серебряков И.Г., 1964. Жизненные формы высших растений и их изучение // Полевая геоботаника. Т. 3. М.; Л.: Наука. С. 146–205.
Серебряков И.Г., Серебрякова Т.И., 1965. О двух типах формирования корневищ у травянистых многолетников // Бюл. МОИП. Отд. биол. Т. 70. № 2. С. 67–81.
Смирнова Е.С., 1990. Морфология побеговых систем орхидных. М.: Наука. 208 с.
Татаренко И.В., 1996. Орхидные России: жизненные формы, биология, вопросы охраны. М.: Аргус. 208 с.
Тиунов А.В., 2007. Стабильные изотопы углерода и азота в почвенно-экологических исследованиях // Изв. РАН. Сер. Биол. Т. 4. С. 475–489.
Толчельников Ю.С., 1985. О сущности понятия “почва” // Вестн. МГУ. Сер. 17. Почвоведение. № 3. С. 52–58.
Федоров А.А., 1959. Древесные эпифиты и фикусы-удушители в тропических лесах Китая // Бот. журн. Т. 44. № 10. С. 1409–1424.
Фомин А.В., 1934. Род Многоножка – Polypodium L. // Флора СССР. Т. I / Под ред. Ильина М.М. Л.: Изд-во АН СССР. С. 84–86.
Чертов О.Г., 1983. Математическая модель экосистемы одного растения // Журн. общ. биологии. Т. 44. № 3. С. 406–414.
Abakumov E.V., Rodina O.A., Eskov A.K., 2018. Humification and humic acid composition of suspended soil in oligotrophous environments in South Vietnam // Appl. Environ. Soil Sci. V. 2018. Art. 1026237.
Adhikari Y.P., Fischer A., Fischer H.S., 2012a. Micro-site conditions of epiphytic orchids in a human impact gradient in Kathmandu valley, Nepal // J. Mt. Sci. V. 9. P. 331–342.
Adhikari Y.P., Fischer H.S., Fischer A., 2012b. Host tree utilization by epiphytic orchids in different land-use intensities in Kathmandu Valley, Nepal // Plant Ecol. V. 213. P. 1393–1412.
Aguirre A., Guevara R., García M., López J.C., 2010. Fate of epiphytes on phorophytes with different architectural characteristics along the perturbation gradient of Sabal mexicana forests in Veracruz, Mexico // J. Veg. Sci. V. 21. P. 6–15.
Alien M.R., Rincon E., Alien E.B. et al., 1993. Observations of canopy bromeliad roots compared with plants rooted in soils of a seasonal tropical forest, Chamela, Jalisco, Mexico // Mycorrhiza. V. 4. P. 27–28.
Annaselvam J., Parthasarathy N., 2001. Diversity and distribution of herbaceous vascular epiphytes in a tropical evergreen forest at Varagalaiar, Western Ghats, India // Biodivers. Conserv. V. 10. P. 317–329.
Antibus K.A., Lesica P., 1990. Root surface acid phosphatase activities of vascular epiphytes of a Costa Rican rain forest // Plant Soil. V. 128. P. 233–240.
Arévalo R., Betancourt J., 2006. Vertical distribution of vascular epiphytes in four forest types of the Serrania de Chiribiquete, Colombian Guayana // Selbyana. V. 27. P. 175–185.
Assede E.P.S., Adomou A.C., Sinsin B., 2012. Magnoliophyta, Biosphere Reserve of Pendjari, Atacora Province, Benin // Check List. V. 8. P. 642–661.
Barrow S.R., Cockburn W., 1982. Effects of light quantity and quality on the decarboxylation of malic acid in crassulacean acid metabolism photosynthesis // Plant Physiol. V. 69. P. 568–571.
Beattie G.A., 2011. Water relations in the interaction of foliar bacterial pathogens with plants // Ann. Rev. Phytopathol. V. 49. P. 533–555.
Beguinot A., Traverso G.B., 1905. Richerche intorno alle ’arboricole’ della flora italiana // Nuovo Giorn. Bot. Ital. V. 12. P. 495–589.
Benner J.W., Vitousek P.M., 2007. Development of a diverse epiphyte community in response to phosphorus fertilization // Ecol. Lett. V. 10. P. 628–636.
Bennert H.W., Giers A., Güldenpfenning S., Herbik A., Katheder A., 1992. Some new observations on the fern flora of the Azores // Fern Gaz. V. 14. P. 146–148.
Bennett B.C., 1986. Patchiness, diversity, and abundance relationships of vascular epiphytes // Selbyana. V. 9. P. 70–75.
Bentley B.L., Carpenter E.J., 1984. Direct transfer of newly fixed nitrogen from free-living epiphyllous microorganisms to their host plant // Oecologia. V. 63. P. 52–56.
Benzing D.H., 1981. Bark surfaces and the origin and maintenance of diversity among angiosperm epiphytes: a hypothesis // Selbyana. V. 5. P. 248–255.
Benzing D.H., 1986a. Origins of orchid diversity: Emphasis on floral biology leads to misconceptions // Lindleyana. V. 1. № 2. P. 73–89.
Benzing D.H., 1986b. The vegetative basis of vascular epiphytism // Selbyana. V. 9. P. 23–43.
Benzing D.H., 1987. Vascular epiphytism: Taxonomic participation and adaptive diversity // Ann. Missouri Bot. Gard. V. 74. P. 183–204.
Benzing D.H., 1990. Vascular Epiphytes: General Biology and Related Biota. Cambridge: Cambridge Univ. Press. 354 p.
Benzing D.H., 1996. Aerial roots and their environments // Plant Roots: The Hidden Half / Eds Waisel Y., Eshel A., Kafkafi U. N.Y.: Marcel Dekker. P. 875–894.
Benzing D.H., 2000. Bromeliaceae: Profile of an Adaptive Radiation. Cambridge: Cambridge Univ. Press. 710 p.
Benzing D.H., Renfrow A., 1974. The mineral nutrition of Bromeliaceae // Bot. Gaz. V. 135. P. 281–288.
Benzing D.H., Sheemann J., 1978. Nutritional piracy and host decline: A new perspective on the epiphyte-host relationship // Selbyana. V. 2. P. 133–148.
Benzing D.H., Henderson K., Kessel B., Sulak J., 1976. The absorptive capacities of bromeliad trichomes // Am. J. Bot. V. 63. P. 1009–1014.
Benzing D.H., Friedman W.E., Peterson G., Renfrew A., 1983. Shoodessness, velamentous roots, and the pre-eminence of Orchidaceae in the epiphytic biotope // Am. J. Bot. V. 70. P. 121–133.
Bermudes D., Benzing D.H., 1989. Fungi in neotropical epiphyte roots // Biosystems. V. 23. P. 65–74.
Bermudes D., Benzing D.H., 1991. Nitrogen fixation in association with Ecuadorean bromeliads // J. Trop. Ecol. V. 7. P. 531–538.
Boelter C.R., Dambros C.S., Nascimento H.E.M., Zartman C.E., 2014. A tangled web in tropical tree-tops: Effects of edaphic variation, neighbourhood phorophyte composition and bark characteristics on epiphytes in a central Amazonian forest // J. Veg. Sci. V. 25. P. 1090–1099.
Bohlman S.A., Matelson T.J., Nadkarni N.M., 1995. Moisture and temperature patterns of canopy humus and forest floor soil of amontane cloud forest, Costa Rica // Biotropica. V. 27. P. 13–19.
Bone R.E., Smith J.A., Arrigo N., Buerki S., 2015. A macro-ecological perspective on crassulacean acid metabolism (CAM) photosynthesis evolution in Afro-Madagascan drylands: Eulophiinae orchids as a case stud // New Phytol. V. 208. P. 469–481.
Brighigna L., Montini P., Favilli F., Carabez Trejo A., 1992. Role of the nitrogen-fixing bacterial microflora in the epiphytism of Tillandsia (Bromeliaceae) // Am. J. Bot. V. 79. P. 723–727.
Brisseau-Mirbel C.F., 1815. Élémens de physiologie végétale et de botanique. Partie 2. Paris: Magimel. 470 p.
Burns K.C., 2010. How arboreal are epiphytes? A null model for Benzing’s classifications // N. Z. J. Bot. V. 48. № 3–4. P. 185–191.
Cardelús C.L., Mack M.C., 2010. The nutrient status of epiphytes and their host trees along an elevational gradient in Costa Rica // Plant Ecol. V. 207. P. 25–37.
Cardelús C.L., Colwell R.K., Watkins J.E., 2006. Vascular epiphyte distribution patterns: Explaining the mid-elevation richness peak // J. Ecol. V. 94. P. 144–156.
Carlsen M., 2000. Structure and diversity of the vascular epiphyte community in the overstory of a tropical rain forest in Surumoni, Amazonas State, Venezuela // Selbyana. V. 21. P. 7–10.
Cascante-Marín A., Wolf J.H.D., Oostermeijer J.G.B., Nijs J.C.M., den, Sanahuja O., Durán-Apuy A., 2006. Epiphytic bromeliad communities in secondary and mature forest in a tropical premontane area // Basic Appl. Ecol. V. 7. P. 520–532.
Ceusters J., Borland A.M., Godts C., Londers E., Croonenborgs S. et al., 2011. Crassulacean acid metabolism under severe light limitation: A matter of plasticity in the shadows? // J. Exp. Bot. V. 62. P. 283–291.
Chen L., Liu W., Wang G., 2010. Estimation of epiphytic biomass and nutrient pools in the subtropical montane cloud forest in the Ailao Mountains, south-western China // Ecol. Res. V. 25. № 2. P. 315–325.
Chomicki G., Renner S.S., 2017. Partner abundance controls mutualism stability and the pace of morphological change over geologic time // Proc. Natl. Acad. Sci. V. 114. № 15. P. 3951–3956.
Chomicki G., Renner S.S., 2019. Farming by ants remodels nutrient uptake in epiphytes // New Phytol. V. 223. № 4. P. 2011–2023.
Chomicki G., Janda M., Renner S.S., 2017. The assembly of ant-farmed gardens: Mutualism specialization following host broadening // Proc. Roy. Soc. B. Biol. Sci. V. 284. № 1850. Art. 20161759.
Clark K., Nadkarni N., Gholz H., 2005. Retention of inorganic nitrogen by epiphytic bryophytes in a tropical montane forest // Biotropica. V. 37. P. 328–336.
Clark K.L., Nadkarni N.M., Schaefer D., Gholz H.L., 1998. Atmospheric deposition and net retention of ions by the canopy in a tropical montane forest, Monteverde, Costa Rica // J. Trop. Ecol. V. 14. P. 27–45.
Clarkson D.T., Kiniper P.J.C., Luttge U., 1986. Mineral nutrition: Sources of nutrients for land plants from outside the pedosphere // Progress in Botany. V. 48 / Eds Behnke H.D., Esser K., Kubitzki K., Runge M., Ziegler H. Berlin; Heidelberg: Springer. P. 80–96.
Cockburn W., Goh C.J., Avadhani P.N., 1985. Photosynthetic carbon assimilation in a shootless orchid, Chiloschista usneoides (DON) LDL: A variant on crassulacean acid metabolism // Plant Physiol. V. 77. № 1. P. 83–86.
Coxson D., Nadkarni N.M., 1995. Ecological roles of epiphytes in nutrient cycles of forest ecosystems // Forest Canopies / Eds Lowman M., Nadkarni N. San Diego: Academic Press. P. 495–543.
Crayn D.M., Winter K., Smith J.A.C., 2004. Multiple origins of crassulacean acid metabolism and the epiphytic habit in the Neotropical family Bromeliaceae // Proc. Natl. Acad. Sci. V. 101. P. 3703–3708.
Crayn D.M., Winter K., Schulte K., Smith J.A.C., 2015. Photosynthetic pathways in Bromeliaceae: Phylogenetic and ecological significance of CAM and C3 based on carbon isotope ratios for 1893 species // Bot. J. Linn. Soc. V. 178. P. 169–221.
Croat T.B., 1978. Flora of Barro Colorado Island. Stanford: Stanford Univ. Press. 956 p.
DaRocha W.D., Ribeiro S.P., Neves F.S., Fernandes G.W., Leponce M., Delabie J.H.C., 2015. How does bromeliad distribution structure the arboreal ant assemblage (Hymenoptera: Formicidae) on a single tree in a Brazilian Atlantic forest agroecosystem? // Myrmecol. News. V. 21. P. 83–92.
Davidson D.W., Epstein W.W., 1989. Epiphytic associations with ants // Vascular Plants as Epiphytes / Ed. Lüttge U. Berlin: Springer Verlag. P. 200–233.
Diels J., Vanlauwe B., Meersch M.K., van der, et al., 2004. Long-term soil organic carbon dynamics in a subhumid tropical climate: 13C data in mixed C3/C4 cropping and modeling with ROTHC // Soil Biol. Biochem. V. 36. P. 1739–1750.
Dighe S., Raval M., Shah A.K., 1986. Detection of nitrogen-fixing ability in an epiphytic orchid Vanda testacea (Linde) Reichb. F. // Proc. Indian Natl. Sci. Acad. V. 52. P. 515–517.
Ehleringer J.R., Hall A.E., Farquahr G.D., 1993. Stable Isotopes and Plant-Water Relations. San Diego: Academic Press. 555 p.
Ellis C.J., 2012. Lichen epiphyte diversity: A species, community and trait-based review // Perspect. Plant Ecol. Evol. Syst. V. 14. P. 131–152.
Eskov A.K., Zverev A.O., Abakumov E.V., 2021. Microbiomes in suspended soils of vascular epiphytes differ from terrestrial soil microbiomes and from each other // Microorganisms. V. 9. № 5. Art. 1033.
Eskov A.K., Onipchenko V.G., Prilepsky N.G., Abakumov E.V., Kolomeitseva G.L. et al., 2019. Dependence of epiphytic community on autochthonous and allochthonous sources of nitrogen in three forest habitats of southern Vietnam // Plant Soil. V. 443. № 1–2. P. 565–574.
Eskov A.K., Voronina E.Yu., Tedersoo L., Tiunov A.V., Manh V. et al., 2020. Orchid epiphytes do not receive organic substances from living trees through fungi // Mycorrhiza. V. 30. P. 697–704.
Farrar D.R., Mickel J.T., 1991. Vittaria appalachiana: A name for the “Appalachian gametophyte” // Am. Fern J. V. 81. P. 69–75.
Fliche M.P., 1902. Note sur l’epiphytisme du Polypodium vulgare L. // Bull. Soc. Bot. France. V. 49. № 1. P. 53–64.
Forel A., 1904. In und mit Pflanzen lebende Ameisen aus dem Amazonas-Gebiet und aus Peru, gesammelt von Herrn E. Ule // Zool. Jahrb. Abt. Syst. V. 20. P. 679–707.
Forman R.T.T., 1975. Canopy lichens with blue-green algae: A nitrogen source in a Colombian rain forest // Ecology. V. 56. P. 1176–1184.
Friesen M.L., Porter S.S., Stark S.C., Wettberg E.J., Sachs J.L., Martinez-Romero E., 2011. Microbially mediated plant functional traits // Annu. Rev. Ecol. Evol. Syst. V. 42. P. 23–46.
Frouz J., Jílková V., 2008. The effect of ants on soil properties and processes (Hymenoptera: Formicidae) // Myrmecol. News. V. 1. P. 191–199.
Garth R.E., 1964. The ecology of Spanish moss (Tillandsia usneoides): its growth and distribution // Ecology. V. 45. № 3. P. 470−481.
Gay H., 1991. Ant-houses in the fern genus Lecanopteris Reinw. (Polypodiaceae) – The rhizome morphology and architecture of L. sarcopus Teijsm. and Binned. and L. darnaedii Hennipman // Bot. J. Linn. Soc. V. 106. P. 199–208.
Gay H., 1993a. Animal-fed plants – An investigation into the uptake of ant-derived nutrients by the far-eastern epiphytic fern Lecanopteris Reinw. (Polypodiaceae) // Biol. J. Linn. Soc. V. 50. P. 221–233.
Gay H., 1993b. Rhizome structure and evolution in the ant-associated epiphytic fern Lecanopteris Reinw. (Polypodiaceae) // Bot. J. Linn. Soc. V. 113. P. 135–160.
Gay H., Hensen R., 1992. Ant specificity and behaviour in mutualisms with epiphytes: The case of Lecanopteris (Polypodiaceae) // Biol. J. Linn. Soc. V. 47. P. 261–284.
Gentry A.H., Dodson C.H., 1987. Diversity and biogeography of neotropical vascular epiphytes // Ann. Missouri Bot. Gard. V. 74. № 2. P. 205–233.
Gibernau M., Orivel J., Delabie J., Barabé D., Dejean A., 2007. An asymmetrical relationship between an arboreal ponerine ant and a trash-basket epiphyte (Araceae) // Biol. J. Linn. Soc. V. 91. № 3. P. 341–346.
Gomes-da-Silva J., Costa A.F., da, 2011. Taxonomic revision of Vriesea corcovadensis group (Bromeliaceae: Tillandsioideae) with description of two new species // Syst. Bot. V. 36. № 2. P. 291–309.
Gómez L.D., 1974. Biology of the potato-fern Solanopteris brunei // Brenesia. V. 4. P. 37–61.
Gómez L.D., 1977. The Azteca ants of Solanopteris brunei // Am. Fern J. V. 67. P. 31.
Goode L.K., Allen M.F., 2008. The impacts of Hurricane Wilma on the epiphytes of El Edén Ecological Reserve, Quintana Roo, Mexico // J. Torrey Bot. Soc. V. 135. P. 377–387.
Gotsch S.G., Nadkarni N., Amici A., 2016. The functional roles of epiphytes and arboreal soils in tropical montane cloud forests // J. Trop. Ecol. V. 32. № 5. P. 455–468.
Gotsch S.G., Nadkarni N., Darby A., Glunk A., Dix M. et al., 2015. Life in the treetops: Ecophysiological strategies of canopy epiphytes in a tropical montane cloud forest // Ecol. Monogr. V. 85. № 3. P. 393–412.
Gottsberger G., Morawetz W., 1993. Development and distribution of the epiphytic flora in an Amazonian savanna in Brazil // Flora. V. 188. P. 145–151.
Griffiths H., 1998. Stable Isotopes: The Integration of Biological, Ecological and Geochemical Processes. Oxford: BIOS Scientific Publishers. 438 p.
Griffiths H., Smith J.A.C., 1983. Photosynthetic pathways in the Bromeliaceae of Trinidad: Relations between life-forms, habitat preference and the occurrence of CAM // Oecologia. V. 60. P. 176–184.
Grubb P.J., 1977. Control of forest growth and distribution on wet tropical mountains // Annu. Rev. Ecol. Syst. V. 8. P. 83–107.
Haufler C.H., Grammer W.A., Hennipman E., Ranker T.A., Smith A.R., Schneider H., 2003. Systematics of the ant-fern genus Lecanopteris (Polypodiacee): Testing phylogenetic hypotheses with DNA sequences // Syst. Bot. V. 28. P. 217–227.
Hempfling R., Simmleit N., Schulten H.R., 1991. Characterization and chemodynamics of plant constituents during maturation, senescence and humus genesis in spruce ecosystems // Biogeochemistry. V. 13. P. 27–60.
Hietz P., 1997. Population dynamics of epiphytes in a Mexican humid montane forest // J. Ecol. V. 85. P. 767–775.
Hietz P., Wanek W., Popp M., 1999. Stable isotopic composition of carbon and nitrogen and nitrogen content in vascular epiphytes along an altitudinal transect // Plant Cell Environ. V. 22. P. 1435–1443.
Hietz P., Wanek W., Wania R., Nadkarni N.M., 2002. Nitrogen-15 natural abundance in a montane cloud forest canopy as an indicator of nitrogen cycling and epiphyte nutrition // Oecologia. V. 131. P. 350–355.
Hirata A., Kamijo T., Saito S., 2009. Host trait preferences and distribution of vascular epiphytes in a warm-temperate forest // Plant Ecol. V. 201. P. 247–254.
Hoeber V., Weichgrebe T., Zotz G., 2019. Accidental epiphytism in the Harz Mountains, Central Europe // J. Veg. Sci. V. 30. № 4. P. 765–775.
Hoelscher D., Köhler L., Dijk A.I., van, Bruijnzeel L.S., 2004. The importance of epiphytes to total rainfall interception by a tropical montane rain forest in Costa Rica // J. Hydrol. V. 292. P. 308–322.
Hofstede R.G.M., Wolf J.H.D., Benzing D.H., 1993. Epiphytic biomass and nutrient status of a Colombian upper montane rain forest // Selbyana. V. 14. P. 37–45.
Högberg P., 1997. Tansley review No. 95. 15N natural abundance in soil-plant systems // New Phytol. V. 137. P. 179–203.
Holtum J.A.M., Winter K., Weeks M.A., Sexton T.R., 2007. Crassulacean acid metabolism of the ZZ plant, Zamioculcas zamiifolia (Araceae) // Am. J. Bot. V. 94. P. 1670–1676.
Ibisch P.L., 1996. Neotropische Epiphytendiversitat: das Beispiel Bolivien. Wiehl: Martina Galunder-Verlag. 357 p.
International Tropical Timber Organization (ITTO), 2002. ITTO Guidelines for the restoration, management and rehabilitation of degraded and secondary tropical forests. Yokohama: ITTO. 84 p.
Irume M.V., Morais M.D.L.D.C., Zartman C.E., Amaral I.L.D., 2013. Floristic composition and community structure of epiphytic angiosperms in a terra firme forest in central Amazonia // Acta Bot. Bras. V. 27. P. 378–393.
Jacome J., Galeano G., Amaya M., Mora M., 2004. Vertical distribution of epiphytic and hemiepiphytic Araceae in a tropical rain forest in Chocó, Colombia // Selbyana. V. 25. P. 118–125.
Janos D.P., 1993. Vesicular-arbuscular mycorrhizae of epiphytes // Mycorrhiza. V. 4. P. 1–4.
Janzen D.H., 1974. Epiphytic myrmecophytes in Sarawak: Mutualism through the feeding of plants by ants // Biotropica. V. 6. № 4. P. 237–259.
Johansson D.R., 1974. Ecology of vascular epiphytes in West African rain forest / Acta Phytogeogr. Suec. V. 59. Uppsala: Svenska växtgeografiska sällskapet. 129 p.
Johansson D.R., 1975. Ecology of epiphytic orchids in West African rain forests // Amer. Orchid Soc. Bull. V. 44. № 2. P. 125–136.
Johansson D.R., 1978. A method to register the distribution of epiphytes on the host tree // Amer. Orchid Soc. Bull. V. 47. № 10. P. 901–904.
Jones J.D.G., Dangl J.L., 2006. The plant immune system // Nature. V. 444. P. 323–329.
Kembel S.W., O’Connor T.K., Arnold H.K., Hubbell S.P., Wright S.J., Green J.L., 2014. Relationships between phyllosphere bacterial communities and plant functional traits in a neotropical forest // Proc. Natl. Acad. Sci. USA. V. 111. P. 13715–13720.
Kirby C., 2014. Field Guide to New Zealand‘s Epiphytes, Vines & Mistletoes. Hamilton: Environmental Research Institute, Univ. of Waikato. 261 p.
Kluge J., Kessler M., 2011. Influence of niche characteristics and forest type on fern species richness, abundance and plant size along an elevational gradient in Costa Rica // Plant Ecol. V. 212. P. 1109–1121.
Koptur S., Rico-Gray V., Palacios-Rios M., 1998. Ant protection of the nectaried fern Polypodium plebeium in central Mexico // Am. J. Bot. V. 85. P. 736–739.
Köhler L., Tobón C., Frumau K.A., Bruijnzeel L.S., 2007. Biomass and water storage dynamics of epiphytes in old-growth and secondary montane cloud forest stands in Costa Rica // Plant Ecol. V. 193. № 2. P. 171–184.
Köster N., Friedrich K., Nieder J., Barthlott W., 2009. Conservation of epiphyte diversity in an Andean landscape transformed by human land use // Conserv. Biol. V. 23. P. 911–919.
Kress W.J., 1986. A symposium: The biology of tropical epiphytes // Selbyana. V. 9. P. 1–22.
Krömer T., Gradstein S.R., 2016. Vascular epiphytes // Core Standardized Methods for Rapid Biological Field Assessment / Ed. Larsen T.H. Arlington: Conservation International. P. 25–36.
Krömer T., Kessler M., Gradstein S.R., Acebey A., 2005. Diversity patterns of vascular epiphytes along an elevational gradient in the Andes // J. Biogeogr. V. 32. P. 1799–1809.
Kunkel G., 1993. Die Kanarischen Inseln und ihre Pflanzenwelt. Stuttgart; Jena; N.Y.: Gustav Fischer Verlag. 239 S.
Ladino G., Bautista F.O., Varón J.E., Jerabkova L., Kratina P., 2019. Ecosystem services provided by bromeliad plants: A systematic review // Ecol. Evol. V. 9. P. 7360–7373.
Lambers H., Chapin III F.S., Pons T., 2008. Plant Physiological Ecology. N.-Y.: Springer-Verlag. 604 p.
Lasso E., Ackerman J., 2013. Nutrient limitation restricts growth and reproductive output in a tropical montane cloud forest bromeliad: Findings from a long-term forest fertilization experiment // Oecologia. V. 171. P. 165–174.
Laube S., Zotz G., 2003. Which abiotic factors limit vegetative growth in a vascular epiphyte? // Funct. Ecol. V. 17. P. 598–604.
Laube S., Zotz G., 2007. A metapopulation approach to the analysis of long-term changes in the epiphyte vegetation on the host tree Annona glabra // J. Veg. Sci. V. 18. P. 613–624.
Leao T.C.C., Fonseca C.R., Peres C.A., Tabarelli M., 2014. Predicting extinction risk of Brazilian Atlantic forest angiosperms // Conserv. Biol. V. 28. P. 1349–1359.
Li C.R., Gan L.J., Xia K., Zhou X., Hew C.S., 2002. Responses of carboxylating enzymes, sucrose metabolizing enzymes and plant hormones in a tropical epiphytic CAM orchid to CO2 enrichment // Plant Cell. Environ. V. 25. P. 369–377.
Linares-Palomino R., Cardona V., Hennig E.I., Hensen I., Hoffmann D. et al., 2009. Non-woody life-form contribution to vascular plant species richness in a tropical American forest // Plant Ecol. V. 201. P. 87–99.
Lindo Z., Whiteley J.A., 2011. Old trees contribute bio-available nitrogen through canopy bryophytes // Plant Soil. V. 342. № 1–2. P. 141–148.
Lindo Z., Winchester N.N., 2006. A comparison of microarthropod assemblages with emphasis on oribatid mites in canopy suspended soils and forest floors associated with ancient western redcedar trees // Pedobiologia. V. 50. P. 31–41.
Lindo Z., Winchester N.N., 2007. Oribatid mite communities and foliar litter decomposition in canopy suspended soils and forest floor habitats of western redcedar forests, Vancouver Island, Canada // Soil Biol. Biochem. V. 39. P. 2957–2966.
Löbel S., Snäll T., Rydin H., 2006. Metapopulation processes in epiphytes inferred from patterns of regional distribution and local abundance in fragmented forest landscapes // J. Ecol. V. 94. P. 856–868.
Lüttge U., 1989. Vascular Plants as Epiphytes: Evolution and Ecophysiology. Berlin: Springer-Verlag. 270 p.
Martin A., Balesdent J., Mariotti A., 1992. Earthworm diet related to soil organic matter dynamics through 13C measurements // Oecologia. V. 91. P. 23–29.
Martin A., Mariotti A., Balesdent J. et al., 1990. Estimate of organic matter turnover rate in a savanna soil by 13C natural abundance measurements // Soil Biol. Biochem. V. 22. P. 517–523.
Matelson T.J., Nadkarni N.M., Longino J.T., 1993. Longevity of fallen epiphytes in a neotropical montane forest // Ecology. V. 74. P. 265–269.
Medina E., 1996. CAM and C4 plants in the humid tropics // Tropical Forest Plant Ecophysiology / Eds Mulkey S.S., Chazdon R.L., Smith A.P. Boston: Springer. P. 56–88.
Mehltreter K., Flores-Palacios A., García-Franco J.G., 2005. Host preferences of low-trunk vascular epiphytes in a cloud forest of Veracruz, Mexico // J. Trop. Ecol. V. 21. № 6. P. 651–660.
Mendieta-Leiva G., Zotz G., 2015. A conceptual framework for the analysis of vascular epiphyte assemblages // Perspect. Plant Ecol. Evol. Syst. V. 17. № 6. P. 510–521.
Moffett M.W., 2000. What’s “up”? A critical look at the basic terms of canopy biology // Biotropica. V. 32. № 4. P. 569–596.
Monteiro J.A.F., Zotz G., Körner C., 2009. Tropical epiphytes in a CO2-rich atmosphere // Acta Oecol. V. 35. P. 60–68.
Morat P., Veillon J.M., MacKee H.S., 1984. Floristic relationships of New Caledonian rain forest phanerogams // Biogeography of the Tropical Pacific / Eds Radovsky F.J., Raven P.H., Sohmer S.H. Honolulu: Bernice P. Bishop Museum. P. 71–128.
Mori S.A., Hecklau E.F., Kirchgessner T., 2002. Life form, habitat, and nutritional mode of the flowering plants of central French Guiana // J. Torrey Bot. Soc. P. 331–345.
Motomura H., Yukawa T., Ueno O., Kagawa A., 2008. The occurrence of crassulacean acid metabolism in Cymbidium (Orchidaceae) and its ecological and evolutionary implications // J. Plant Res. V. 121. P. 163–177.
Nadkarni N.M., 1984. Epiphyte biomass and nutrient capital of a neotropical elfin forest // Biotropica. V. 16. P. 249–256.
Nadkarni N.M., 1986. The nutritional effects of epiphytes on host trees with special reference to alteration of recipitation chemistry // Selbyana. V. 9. P. 44–51.
Nadkarni N.M., Matelson T.J., 1992. Biomass and nutrient dynamics of epiphytic litterfall in a neotropical montane forest, Costa Rica // Biotropica. V. 24. P. 24–30.
Nadkarni N.M., Cobb A.R., Solano R., 2000a. Interception and retention of macroscopic bryophyte fragments by branch substrates in a tropical cloud forest: An experimental and demographic approach // Oecologia. V. 122. P. 60–65.
Nadkarni N.M., Schaefer D., Matelson T.J., Solano R., 2004. Biomass and nutrient pools of canopy and terrestrial components in a primary and a secondary montane cloud forest, Costa Rica // For. Ecol. Manag. V. 198. № 1. P. 223–236.
Nadkarni N.M., Lawton R.O., Clark K.L., Matelson T.J., Schaefer D.S., 2000b. Ecosystem ecology and forest dynamics // Monteverde: Ecology and Conservation of a Tropical Cloud Forest / Eds Nadkarni N., Wheelwright N. N.Y.: Oxford Univ. Press. P. 303–350.
Nakanishi A., Sungpalee W., Sri-Ngernyuang K., Kanzaki M., 2016. Large variations in composition and spatial distribution of epiphyte biomass on large trees in a tropical montane forest of northern Thailand // Plant Ecol. V. 217. № 9. P. 1157–1169.
Nieder J., Barthlott W., 2001. Epiphytes and their role in the tropical forest canopy // Epiphytes and Canopy Fauna of the Otonga Rain Forest (Ecuador). Results of the Bonn-Quito Epiphyte Project, funded by the Volkswagen Foundation. Norderstedt: Books on Demand GmbH. P. 23–86.
Nieder J., Engwald S., Klawun M., Barthlott W., 2000. Spatial distribution of vascular epiphytes (including hemiepiphytes) in a lowland Amazonian rain forest (Surumoni crane plot) of southern Venezuela // Biotropica. V. 32. P. 385–396.
Page C.N., 1977. An ecological survey of the ferns of the Canary Islands // Fern Gaz. V. 11. № 5. P. 297–312.
Patiño J., González-Mancebo J.M., Fernández-Palacios J.M., Arévalo J.R., Bermúde A., 2009. Short-term effects of clear-cutting on the biomass and richness of epiphytic bryophytes in managed subtropical cloud forests // Ann. For. Sci. V. 66. № 6. P. 1–13.
Pinkalski C., Damgaard C., Jensen K.V., Peng R., Offenberg J., 2015. Quantification of ant manure deposition in a tropical agroecosystem: Implications for host plant nitrogen acquisition // Ecosystems. V. 18. P. 1373–1382.
Pittendrigh C.S., 1948. The bromeliad–Anopheles–malaria complex in Trinidad. I – The bromeliad flora // Evolution. V. 2. № 1. P. 58–89.
Pocs T., 1976. The role of the epiphytic vegetation in the water balance and humus production of the rain forests of the Uluguru Mountains, East Africa // Boissiera. V. 24. P. 499–505.
Pos E.T., Sleegers A.D.M., 2010. Distribuição vertical e ecologia de epífitas vasculares em uma floresta tropical do Brasil // Bol. Mus. Para. Emílio Goeldi Ciênc. Nat. V. 5. № 3. P. 335–344.
Putz F.E., Holbrook N.M., 1986. Notes on the natural history of hemiepiphytes // Selbyana. V. 9. P. 61–69.
Qiu S., Sultana S., Liu Z.D., Yin L.Y., Wang C.Y., 2015. Identification of obligate C3 photosynthesis in Dendrobium // Photosynthetica. V. 53. № 2. P. 168–176.
Raunkiaer C., 1934. The Life Forms of Plants and Statistical Plant Geography. Oxford: Clatrendon. 632 p.
Raveh E., Gersani M., Nobel P.S., 1995. CO2 uptake and fluorescence responses for a shade-tolerant cactus Hylocereus undatus under current and doubled CO2 concentrations // Physiol. Plant. V. 93. P. 505–511.
Rees M., Condit R., Crawley M., Pacala S., Tilman D., 2001. Long-term studies of vegetation dynamics // Science. V. 293. № 5530. P. 650–655.
Reyes-Garcia C., Mejia-Chang M., Jones G.D., Griffiths H., 2008. Water vapour isotopic exchange by epiphytic bromeliads in tropical dry forests reflects niche differentiation and climatic signals // Plant Cell Environ. V. 31. P. 828–841.
Ritpitakphong U., Falquet L., Vimoltust A., Berger A., Metraux J.P., L’Haridon F., 2016. The microbiome of the leaf surface of Arabidopsis protects against a fungal pathogen // New Phytol. V. 210. P. 1033–1043.
Roderick M.L., Berry S.L., Noble I.R., 2000. A framework for understanding the relationship between environment and vegetation based on the surface area to volume ratio of leaves // Funct. Ecol. V. 14. № 4. P. 423–437.
Rodina O.A., Abakumov E.V., Eskov A.K., Prilepskiy N.G., 2020. Humic substances formation as a result of biogenic-abiogenic interactions in epiphytic structures of the South Vietnam tropical forest // Processes and Phenomena on the Boundary Between Biogenic and Abiogenic Nature. Lecture Notes in Earth System Sciences / Eds Frank-Kamenetskaya O., Vlasov D., Panova E., Lessovaia S. Cham: Springer. P. 417–434.
Rodrigues M.A., Matiz A., Cruz A.B., Matsumura A.T., Takahashi C.A. et al., 2013. Spatial patterns of photosynthesis in thin-and thick-leaved epiphytic orchids: Unravelling C3–CAM plasticity in an organ-compartmented way // Ann. Bot. V. 112. № 1. P. 17–29.
Romero G.Q., Nomura F., Gonçalves A.Z., Dias N.Y.N., Mercier H. et al., 2010. Nitrogen fluxes from treefrogs to tank epiphytic bromeliads: An isotopic and physiological approach // Oecologia. V. 162. P. 941–949.
Rosado B.H., Almeida L.C., Alves L.F., Lambais M.R., Oliveira R.S., 2018. The importance of phyllosphere on plant functional ecology: A phyllo trait manifesto // New Phytol. V. 219. № 4. P. 1145–1149.
Rosenberger T., Williams K., 1999. Responses of vascular epiphytes to branch-fall gap formation in Clusia trees in montane rainforest // Selbyana. V. 20. P. 49–58.
Rübel E.A., 1912. The international phytogeographical excursion in the British Isles. V. The Killarney woods // New Phytol. V. 11. № 2. P. 54−57.
Rudolph D., Rauer G., Nieder J., Barthlott W., 1998. Distributional patterns of epiphytes in the canopy and phorophyte characteristics in a western Andean rainforest in Ecuador // Selbyana. V. 19. P. 27–33.
Sage R.F., 2002. Are crassulacean acid metabolism and C4 photosynthesis incompatible? // Funct. Plant Biol. V. 29. № 6. P. 775–785.
Sawinski K., Mersmann S., Robatzek S., Beohmer M., 2013. Guarding the green: Pathways to stomatal immunity // Mol. Plant Microbe Interact. V. 26. P. 626–632.
Schimper A.F.W., 1888. Die Epiphytische Vegetation Amerikas. Jena: G. Fischer. 160 p.
Schmit-Neuerburg V., 2002. Dynamics of Vascular Epiphyte Vegetation in the Venezuelan Lowland Rain Forest of the Surumoni Crane Project. PhD diss. Bonn: Botanical Institute, Univ. of Bonn. 280 p.
Schnitzer M., 1978. Humic substances: chemistry and reactions // Dev. Soil Sci. V. 8. P. 1–64.
Schreiber L., Krimm U., Knoll D., Sayed M., Auling G., Krop-penstedt R.M., 2005. Plant–microbe interactions: Identification of epiphytic bacteria and their ability to alter leaf surface permeability // New Phytol. V. 166. P. 589–594.
Schrimpff E., 1984. Air pollution patterns in two cities of Colombia, SA according to trace substances content of an epiphyte (Tillandsia recurvata L.) // Water Air Soil Pollut. V. 21. № 1. P. 279–315.
Schulze E.D., Kelliher F.M., Körner C., Lloyd J., Leuning R., 1994. Relationships among maximum stomatal conductance, ecosystem surface conductance, carbon assimilation rate, and plant nitrogen nutrition: A global ecology scaling exercise // Annu. Rev. Ecol. Syst. V. 25. P. 629–660.
Shacklette H.T., Connor J.J., 1973. Airborne Chemical Elements in Spanish Moss / Geol. Survey Prof. Paper 574-E. Washington: U.S. Government Printing Office. 46 p.
Shaw P., 2013. The use of inert pads to study Collembola of suspended soils // Soil Org. V. 85. № 1. P. 69–74.
Shaw P., 2015. How high do Collembola climb? Studies of vertical migration in arboreal Collembola // Soil Org. V. 87. № 3. P. 229–235.
Silvera K., Lasso E., 2016. Ecophysiology and Crassulacean acid metabolism of tropical epiphytes // Tropical Tree Physiology / Eds Goldstein G., Santiago L. Cham: Springer. P. 25–43.
Silvera K., Santiago L.S., Winter K., 2005. Distribution of crassulacean acid metabolism in orchids of Panama: Evidence of selection for weak and strong modes // Funct. Plant Biol. V. 32. P. 397–407.
Silvera K., Santiago L.S., Cushman J.C., Winter K., 2009. Crassulacean acid metabolism and epiphytism linked to adaptive radiations in the Orchidaceae // Plant Physiol. V. 149. P. 1838–1847.
Silvera K., Neubig K.M., Whitten W.M., Williams N.H., Winter K., Cushman J.C., 2010. Evolution along the crassulacean acid metabolism continuum // Funct. Plant Biol. V. 37. P. 995–1010.
Snäll T., Ehrlén J., Rydin H., 2005. Colonization–extinction dynamics of an epiphyte metapopulation in a dynamic landscape // Ecology. V. 86. P. 106–115.
Song L., Lu H.-Z., Xu X.-L., Li S., Shi X.-M. et al., 2016. Organic nitrogen uptake is a significant contributor to nitrogen economy of subtropical epiphytic bryophytes // Sci. Rep. V. 6. Art. 30408.
Stäger R., 1908. Beitrag zur schweizerischen ‘Epiphytenflora’ // Mitt. Naturforsch. Ges. Bern. V. 1667. P. 17–90.
Stein A., Gerstner K., Kreft H., 2014. Environmental heterogeneity as a universal driver of species richness across taxa, biomes and spatial scales // Ecol. Lett. V. 17. P. 866–880.
Stewart G.R., Schmidt S., Handley L.L., Turnbull M.H., Erskine P.D., Joly C.A., 1995. 15N natural abundance of vascular rainforest epiphytes: Implications for nitrogen source and acquisition // Plant Cell Environ. V. 18. № 1. P. 85–90.
Stuntz S., Zotz G., 2001. Photosynthesis in vascular epiphytes – a survey of 27 species of diverse taxonomic origin // Flora. V. 196. P. 132–141.
Sugden A.M., 1981. Aspects of the ecology of vascular epiphytes in the Colombian cloud forests. II. Habitat preferences of Bromeliaceae in the Serrania de Macuira // Selbyana. V. 5. № 3–4. P. 264–273.
Sugden A.M., Robins R.J., 1979. Aspects of the ecology of vascular epiphytes in Colombian cloud forests. I. The distribution of the epiphytic flora // Biotropica. V. 11. P. 173–188.
Tanaka H.O., Inui Y., Itioka T., 2009. Anti-herbivore effects of an ant species, Crematogaster difformis, inhabiting myrmecophytic epiphytes in the canopy of a tropical lowland rainforest in Borneo // Ecol. Res. V. 24. № 6. P. 1393–1397.
Tansley H.G., 1939. The British Islands and Their Vegetation. Cambridge: Cambridge Univ. Press. 474 p.
Taylor A., Burns K., 2016. Radial distributions of air plants: A comparison between epiphytes and mistletoes // Ecology. V. 97. № 4. P. 819–825.
Taylor A., Zotz G., Weigelt P., Cai L., Karger D., Kreft H., 2021. Vascular epiphytes contribute disproportionately to global centres of plant diversity // bioRxiv. https://doi.org/10.1101/2021.05.21.445115
Ter Steege H., Cornelissen J.H.C., 1989. Distribution and ecology of vascular epiphytes in lowland rain forest of Guyana // Biotropica. V. 21. P. 331–339.
Treseder K.K., Davidson D.W., Ehleringer J.R., 1995. Absorption of ant provided carbon dioxide and nitrogen by a tropical epiphyte // Nature. V. 375. № 6527. P. 137–139.
Trofymow J.A., Moore T.R., 2002. Rates of litter decomposition after six years in Canadian forests: Influence of litter quality and climate // Can. J. For. Res. V. 32. P. 789–804.
Tsen E.W.J., Holtum J.A.M., 2012. Crassulacean acid metabolism (CAM) in an epiphytic ant-plant, Myrmecodia beccarii Hook.f. (Rubiaceae) // Photosynth. Res. V. 113. № 1. P. 311–320.
Turner I.M., Tan H.T.W., Wee Y.C., Ibrahim A.B., Chew P.T., Corlett R.T., 1994. A study of plant species extinction in Singapore: Lessons for the conservation of tropical biodiversity // Conserv. Biol. V. 8. P. 705–712.
Umana N.H.N., Wanek W., 2010. Large canopy exchange fluxes of inorganic and organic nitrogen and preferential retention of nitrogen by epiphytes in a tropical lowland rainforest // Ecosystems. V. 13. № 3. P. 367–381.
Vanderklift M.A., Ponsard S., 2003. Sources of variation in consumer-diet δ15N enrichment: A meta-analysis // Oecologia. V. 136. P. 169–182.
Vargas M.P.B., Andel T., van, 2005. The use of hemiepiphytes as craft fibres by indigenous communities in the Colombian Amazon // Ethnobot. Res. Appl. V. 3. P. 243–260.
Vergara-Torres C.A., Pacheco-Álvarez M.C., Flores-Palacios A., 2010. Host preference and host limitation of vascular epiphytes in a tropical dry forest of central Mexico // J. Trop. Ecol. V. 26. P. 563–570.
Wagner S., Bader M.Y., Zotz G., 2014. Physiological ecology of tropical bryophytes // Photosynthesis in Bryophytes and Early Land Plants / Eds Hanson D.T., Rice S.K. Dordrecht: Springer. Р. 269–289.
Walker L.R., Zimmerman J.K., Lodge D.J., Guzman-Grajales S., 1996. An altitudinal comparison of growth and species composition in hurricane-damaged forests in Puerto Rico // J. Ecol. V. 84. P. 877–889.
Wanek W., Zotz G., 2011. Are vascular epiphytes nitrogen or phosphorus limited? A study of plant 15N fractionation and foliar N : P stoichiometry with the tank bromeliad Vriesea sanguinolenta // New Phytol. V. 192. P. 462–470.
Watkins J.E., Jr., Cardelús C.L., Mack M.C., 2008. Ants mediate nitrogen relations of an epiphytic fern // New Phytol. V. 180. № 1. P. 5–8.
Watkins J.E., Cardelús C.L., Colwell R.K., Moran R.C., 2006. Species richness and distribution of ferns along an elevational gradient in Costa Rica // Am. J. Bot. V. 93. P. 73–83.
Werckmeister P., 1971. Light induction of geotropism, and the control of proliferation and growthof Cymbidium in tissue culture // Bot. Gaz. V. 132. № 4. P. 346–350.
Werner F.A., 2011. Reduced growth and survival of vascular epiphytes on isolated remnant trees in a recent tropical montane forest clear-cut // Basic Appl. Ecol. V. 12. P. 172–181.
Williams-Linera G., Lawton R.O., 1995. Ecology of hemiepiphytes in forest canopies // Forest Canopies. 1st ed. / Eds Lowman M.D., Nadkarni N.M. San Diego: Academic Press. P. 255–283.
Wilmanns O., 1968. Die Farnpflanzen Zentraleuropas. Heidelberg: Quelle and Meyer. 295 S.
Winkler M., Hietz P., 2001. Population structure of three epiphytic orchids (Lycaste aromatica, Jacquiniella leucomelana and J. teretifolia) in a Mexican humid montane forest // Selbyana. V. 22. P. 27–33.
Winkler M., Hülber K., Hietz P., 2007. Population dynamics of epiphytic bromeliads: life strategies and the role of host branches // Basic Appl. Ecol. V. 8. P. 183–196.
Winkler M., Hülber K., Hietz P., 2009. Population dynamics of epiphytic orchids in a metapopulation context // Ann. Bot. V. 104. P. 995–1004.
Winter K., Holtum J.A., 2017. Facultative crassulacean acid metabolism (CAM) in four small C3 and C4 leaf-succulents // Aust. J. Bot. V. 65. № 2. P. 103–108.
Winter K., Wallace B.J., Stocker G.C., Roksandic Z., 1983. Crassulacean acid metabolism in Australian vascular epiphytes and some related species // Oecologia. V. 57. № 1. P. 129–141.
Winter K., Medina E., Garcia V., Mayoral M.A., Muniz R., 1985. Crassulacean acid metabolism in roots of a leafless orchid Camplocentrum tyrridion Garay & Dunsterv. // J. Plant Physiol. V. 118. P. 73–78.
Wolf J.H.D., Flamenco-S A., 2003. Patterns in species richness and distribution of vascular epiphytes in Chiapas, Mexico // J. Biogeogr. V. 30. P. 1689–1707.
Yang X., Warren M., Zou X., 2007. Fertilization responses of soil litter fauna and litter quantity, quality, and turnover in low and high elevation forests of Puerto Rico // Appl. Soil Ecol. V. 37. P. 63–71.
Zotz G., 1998. Demography of the epiphytic orchid, Dimerandra emarginata // J. Trop. Ecol. V. 14. № 6. P. 725–741.
Zotz G., 2002. Gefässepiphyten in temperaten Wäldern // Bauhinia. V. 16. P. 13−22.
Zotz G., 2004. How prevalent is crassulacean acid metabolism among vascular epiphytes? // Oecologia. V. 138. P. 184–192.
Zotz G., 2005. Vascular epiphytes in the temperate zones – a review // Plant Ecol. V. 176. P. 173–183.
Zotz G., 2013a. The systematic distribution of vascular epiphytes – a critical update // Bot. J. Linn. Soc. V. 171. P. 453–481.
Zotz G., 2013b. ‘Hemiepiphyte’: a confusing term and its history // Ann. Bot. V. 111. № 6. P. 1015–1020.
Zotz G., 2016. Plants on Plants: The Biology of Vascular Epiphytes. Heidelberg; Berlin: Springer. 281 p.
Zotz G., Asshoff R., 2010. Growth in epiphytic bromeliads: Response to the relative supply of phosphorus and nitrogen // Plant Biol. (Stuttg). V. 12. P. 108–113.
Zotz G., List C., 2003. Zufallsepiphyten – Pflanzen auf dem Weg nach oben? // Bauhinia. V. 17. P. 25−37.
Zotz G., Richter A., 2006. Changes in carbohydrate and nutrient contents throughout a reproductive cycle indicate that phosphorus is a limiting nutrient in the epiphytic bromeliad, Werauhia sanguinolenta // Ann. Bot. V. 97. P. 745–754.
Zotz G., Thomas V., 1999. How much water is in the tank? Model calculations for two epiphytic bromeliads // Ann. Bot. V. 83. P. 183–192.
Zotz G., Vollrath B., 2003. The epiphyte vegetation of the palm Socratea exorrhiza – correlations with tree size, tree age and bryophyte cover // J. Trop. Ecol. V. 19. P. 81–90.
Zotz G., Ziegler H., 1997. The occurrence of crassulacean acid metabolism among vascular epiphytes from Central Panama // New Phytol. V. 137. P. 223–229.
Zotz G., Hietz P., Schmidt G., 2001. Small plants, large plants: The importance of plant size for the physiological ecology of vascular epiphytes // J. Exp. Bot. V. 52. № 363. P. 2051–2056.
Zotz G., Bogusch W., Hietz P., Ketteler N., 2010. Growth of epiphytic bromeliads in a changing world: the effect of elevated CO2 and varying water and nutrient supply // Acta Oecol. V. 36. P. 659–665.
Zotz G., Weigelt P., Kessler M., Kreft H., Taylor A., 2021a. EpiList 1.0: a global checklist of vascular epiphytes // Ecology. V. 102. № 6. Art. e03326.
Zotz G., Almeda F., Bautista-Bello A.P., Eskov A.K., Giraldo-Cañas D. et al., 2021b. Hemiepiphytes revisited // Perspect. Plant Ecol. Evol. Syst. V. 51. Art. 125620. https://doi.org/10.1016/j.ppees.2021.125620
Zytynska S.E., Fay M.F., Penney D., Preziosi R.F., 2011. Genetic variation in a tropical tree species influences the associated epiphytic plant and invertebrate communities in a complex forest ecosystem // Phil. Trans. Roy. Soc. B. Biol. Sci. V. 366. P. 1329–1336.
Дополнительные материалы отсутствуют.
Инструменты
Журнал общей биологии


