Журнал неорганической химии, 2023, T. 68, № 1, стр. 10-16
Ионоселективный мембранный электрод для определения октагидротриборат-аниона
А. В. Копытин a, Е. С. Турышев a, *, М. Ш. Мадраимов b, А. С. Кубасов a, К. Ю. Жижин a, Л. К. Шпигун a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: tyrishev@gmail.com
Поступила в редакцию 12.08.2022
После доработки 25.08.2022
Принята к публикации 27.09.2022
- EDN: GWLWQG
- DOI: 10.31857/S0044457X22601432
Аннотация
Разработан ионоселективный электрод (ИСЭ) на основе пластифицированной поливинилхлоридной мембраны, химически допированной октагидротриборатом тетрадециламмония ([(С10H21)4N+]$[{{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }]$). Показано, что электрод обладает обратимым потенциометрическим откликом по отношению к октагидротриборат-анионам в присутствии ряда других неорганических анионов. Исследовано влияние концентрации электродно-активного вещества и природы пластификатора в фазе мембраны на электрохимические характеристики изготовленного сенсора. Найден оптимальный состав ионочувствительной мембраны. Установлено, что разработанный сенсор обеспечивает широкий диапазон определяемых концентраций ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ (1 × 10–7–1 × 10–2) и низкий предел их обнаружения (10–7.3 М). Новый ИСЭ может быть рекомендован для прямого потенциометрического детектирования свободных октагидротриборат-анионов в технологических водных растворах.
ВВЕДЕНИЕ
Бороводороды интенсивно изучаются на протяжении многих лет [1–5]. В семействе боргидридных соединений октагидротриборат-анион $\left( {{{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }} \right)$ занимает промежуточное положение и представляет особый научно-практический интерес, поскольку широко используется для получения высших полиэдрических бороводородов, а также является ключевым интермедиатом при дегидрировании многих боргидридов [6–11]. Однако несмотря на то, что ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ достаточно хорошо исследован, его количественное определение в водных растворах изучено мало [12, 13]. Эффективным подходом к решению этой задачи представляется применение мембранного ионоселективного электрода (ИСЭ), обратимого к ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }.$ Следует отметить, что в настоящее время ИСЭ на основе полимерных мембран, являясь важной разновидностью потенциометрических сенсоров, успешно применяются для экспрессного контроля содержания различных ионов в природных и технологических растворах [14–17]. Это объясняется в первую очередь их замечательной доступностью с точки зрения простоты аппаратурного оформления и низкой стоимости анализа, а также тем, что они практически не оказывают никакого воздействия на анализируемый раствор.
Цель работы – создание ИСЭ на основе октагидротрибората тетрадециламмония ([(С10H21)4N+]$[{{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }]$), введенного в пластифицированную поливинилхлоридную мембрану (ПВХ-мембрана), и изучение возможности его использования для потенциометрического определения активности (концентрации) свободных ионов ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ в водных растворах. Аналитический сигнал ИСЭ, регистрируемый в условиях, близких к нулевому току, и соответствующий измерению величины электродвижущей силы (э. д. с. = ∆Е = ЕИСЭ – ЕЭС) электрохимической системы, позволит обеспечить экспрессное детектирование ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ в широком концентрационном диапазоне и относительную простоту интерпретации полученных результатов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты и растворы. В качестве исходных использовали реактивы марки “ч. д. а.” или “х. ч.”: 2-нитрофенилоктиловый эфир (о-НФОЭ), дибутилфталат (ДБФ), трис(2-этилгексил)фосфат (ТЭГФ), бис(1-бутилпентил)адипат (ББПА), а также бромид тетрадециламмония, поливинилхлорид (ПВХ, high molecular weight. Selectophore, Fluka), хлористый метилен (CH2Cl2) и свежеперегнанный тетрагидрофуран (ТГФ). Соль октагидротрибората цезия Сs[B3H8] была синтезирована и идентифицирована в лаборатории химии легких элементов и кластеров ИОНХ РАН [18, 19]. Исходный раствор Сs[В3Н8] (0.1 M) готовили путем растворения точной навески препарата Сs[В3Н8] (1.734 г) в 100 мл деионизированной воды. Остальные рабочие растворы ((0.01–1) × 10–8 М) были приготовлены путем последовательного разбавления исходного.
Получение электродно-активного вещества (ЭАВ). Октагидротриборат тетрадециламмония получали методом жидкостной ионообменной экстракции:
С этой целью 20 мл 0.01 М раствора бромида тетрадециламмония в СН2Сl2 смешивали с 25 мл 0.01 М водного раствора октагидротрибората цезия. Органическую фазу отделяли в делительной воронке и промывали 100 мл воды. Степень замещения бромид-ионов в исходной соли определяли, контролируя их содержание в водной фазе с помощью бромид-ИСЭ с твердой мембраной на основе смеси сульфида и бромида серебра. После двухкратной экстракции регистрировали количественное замещение бромид-ионов анионами ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ в органической фазе. Полученную органическую фазу переносили в чашку Петри. После удаления хлористого метилена при комнатной температуре получили порошок белого цвета – октагидротриборат тетрадециламмония [(С10H21)4N][B3H8], который использовали в качестве ЭАВ. Химичеcкий состав порошка был подтвержден с помощью элементного химического анализа, методами ИК- и 11В ЯМР-спектроскопии (рис. 1, 2).
Рис. 2.
ЯМР-спектры, характеризующие образец октагидротрибората тетрадециламмония: 11В ЯМР (а), 11В-{1H} ЯМР (б), 1H ЯМР (в), 13С ЯМР (г).

Так, полосы поглощения при 1390 и 1470 см–1 были отнесены к деформационным колебаниям С–Н метильных и метиленовых групп, а интенсивная полоса поглощения при 720 см–1 – к колебаниям углеродных цепей типа [–CH2–]n при n > 4 (рис. 1). Полоса поглощения при 910 см–1 характерна для аниона ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ [19]. Регистрируемый в спектрах 11В ЯМР мультиплет с химическим сдвигом δ = –29.0 свидетельствует о наличии бора в октагидротриборат-анионе (рис. 2а).
Изготовление ИСЭ с пластифицированными ПВХ-мембранами. Для получения пластифицированных ПВХ-мембран использовали ранее разработанную методику [20]. Точную навеску ЭАВ сначала растворяли в пластификаторе, а затем смешивали с заранее приготовленным раствором ПВХ в ТГФ. Полученную смесь тщательно перемешивали и переносили в стеклянное кольцо с внутренним диаметром 28 мм, расположенное на гладкой стеклянной поверхности. Сверху кольцо накрывали 5 мм слоем фильтровальной бумаги, которую придавливали свинцовым грузом (для равномерного испарения ТГФ с поверхности). После испарения ТГФ в термостате при 32°С в течение 48 ч мембрану выдерживали под вакуумом в течение 60 мин. В итоге получали прозрачную полимерную пленку со средней толщиной ~0.3 мм. Далее из нее вырезали диски диаметром 9.5 мм, которые помещали в стандартный корпус фирмы электрода Philips IS 561. Перед работой изготовленный сенсор выдерживали в 1 × 10–4 M растворе Cs[B3H8] в течение 15–30 мин.
Методы анализа и аппаратура. Потенциометрические измерения проводили с помощью рН–ионоанализатора Radelkis ОР-300, используя гальваническую цепь следующего вида:
В качестве внутреннего раствора сравнения использовали 1 × 10–3 М раствор перхлората калия, выбранный с учетом достаточно низкой энергии гидратации перхлорат-аниона. Внешним электродом сравнения служил хлорсеребряный электрод Radelkis ОР-0820. Электродную функцию регистрировали в диапазоне 1 × 10–8–1 × 10–1 M с использованием свежеприготовленных растворов Cs[B3H8], начиная с растворов с меньшей концентрацией аниона. Электродный потенциал фиксировали как среднеарифметическое трех значений, различающихся не более чем на 0.5 мВ. Исследуемые растворы перемешивали при помощи магнитной мешалки. Температура в процессе измерений составляла 25 ± 1°С.
Элементный анализ ЭАВ на содержание углерода и водорода выполняли на автоматическом газоанализаторе CHNS_3 FA 1108 Elemental Analyser (Carlo Erba). ИК-спектры получали на ИК-Фурье-спектрометре ИНФРАЛЮМ ФТ-02 в диапазоне 400–4000 см–1. Образцы готовили диспергированием исследуемого вещества в вазелиновом или фторированном масле Fluorolube. Спектры ЯМР 1Н, 11B, 13C растворов [(С10H21)4N][B3H8] в DMSO-d6 записывали на импульсном Фурье-спектрометре Bruker MSL-300 (ФРГ) на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан и эфират трехфтористого бора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследования прошлых лет показали, что перспективным путем создания мембранных ИСЭ с анионной функцией является использование электродно-активных веществ с предсказуемыми ионообменными свойствами. Для определения активности (концентрации) неорганических анионов в жидких средах наибольшее распространение получили электроды на основе мембран, допированных ЭАВ с заряженными активными центрами (ионные ассоциаты с крупными органическими катионами, способные в той или иной степени диссоциировать в фазе мембраны) [21–23]. В частности, ионные ассоциаты высших четвертичных аммониевых оснований с различной стерической доступностью обменного центра хорошо зарекомендовали себя в качестве ЭАВ в анион-селективных электродах [24–26]. В связи с этим нами был изготовлен ИСЭ с ПВХ-мембраной, содержащей ассоциат октагидротриборат-аниона с тетрадециламмонием ([(С10H21)4N][B3H8]), и изучено его поведение в водных растворах соли Сs[В3Н8].
Классическая полимерная мембрана ИСЭ представляет собой трехкомпонентную композицию: ЭАВ–пластификатор–полимерная матрица, свойства которой в значительной степени зависят от природы и соотношения мембранообразующих компонентов. При этом электроаналитические параметры сенсоров на основе ионных ассоциатов существенно зависят как от содержания ЭАВ, так и от природы пластификатора в фазе мембраны. Селективность потенциометрического отклика таких сенсоров, как правило, определяется энергией гидратации (сольватации) определяемого аниона и специфичностью его взаимодействия с центром связывания [27]. Поэтому основное внимание при разработке нового ИСЭ нами было уделено вопросу оптимизации состава ионочувствительной ПВХ-мембраны.
Выбор концентрации ЭАВ. В результате изучения зависимости потенциометрического отклика изготовленных ИСЭ на основе ПВХ-мембраны, пластифицированной ДБФ и содержащей разные количества [(С10H21)4N][B3H8], было установлено, что сенсор, содержащий в фазе мембраны 0.8 мас. % ЭАВ, показывает наилучшие результаты по отношению к иону ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ (табл. 1).
Таблица 1.
Зависимость потенциометрических характеристик ИСЭ, полученных в растворах Cs[B3H8], от концентрационного содержания ЭАВ в фазе мембраны
| Состав мембраны, мас. % | cмин, М | s, мВ/декада | Линейный концентрационный диапазон отклика, М | Дрейф потенциала, мВ/ч | ||
|---|---|---|---|---|---|---|
| ЭАВ | ПВХ | ДБФ | ||||
| 0.5 | 29.0 | 70.5 | ~9 × 10–8 | 59.0 | 1 × 10–7–1 × 10–2 | ±2–4 |
| 0.8 | 29.0 | 70.2 | 5 × 10–8 | 57.9 | 8 × 10–8–1 × 10–2 | ±0.2 |
| 1.0 | 29.0 | 70.0 | 3 × 10–7 | 55.4 | 5 × 10–7–1 × 10–2 | ±0.1 |
При увеличении содержания ЭАВ в полимерной композиции наблюдали ухудшение нижнего предела обнаружения (смин) октагидротриборат-иона в растворе, что можно объяснить ростом активности потенциалопределяющего аниона в поверхностном мембранном слое относительно водного раствора. При уменьшении содержания ЭАВ в полимерной композиции наблюдали нестабильность регистрируемого потенциала. Последнее, вероятно, связано с уменьшением ионообменных центров в фазе мембраны.
Зависимость отклика электрода от природы пластификатора. Другим важным параметром, который следует учитывать для достижения наилучших характеристик ионочувствительных сенсоров, является природа пластификатора, используемого в составе мембраны. Пластификатор, составляющий, как правило, >60% массового состава мембраны, служит растворителем мембранообразующих соединений, определяет степень ассоциации образующихся ионных пар и обеспечивает ее диэлектрические и механические свойства [28–30]. В качестве пластификаторов нами были изучены ДБФ, о-НФОЭ, ББПА и ТЭГФ, различающиеся природой активных групп, длиной радикала и величинами диэлектрической проницаемости. При сравнении использовали соотношение мембранных компонентов, соответствующих следующему составу мембранной фазы (мас. %): ЭАВ – 0.8, пластификатор – 70.2, ПВХ – 29.0. Результаты, полученные при изучении влияния природы пластификатора на потенциометрический отклик по отношению к ионам ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - },$ представлены на рис. 3 и суммированы в табл. 2.
Рис. 3.
Электродные функции ИСЭ на основе ПВХ-мембран, содержащих [(С10H21)4N]+[B3H8]– и различные пластификаторы, в разбавленных растворах Cs[B3H8]. Пластификаторы: 1 – о-НФОЭ; 2 – ДБФ; 3 – ТЭГФ; 4 – ББПА.
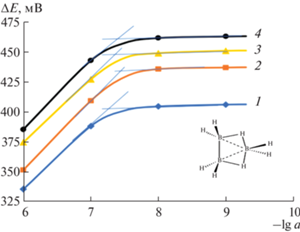
Таблица 2.
Характеристики потенциометрического отклика изученных ИСЭ в зависимости от природы пластификатора в фазе мембраны
| Пластификатор | Уравнение регрессии | Диапазон линейности, M | смин, М |
|---|---|---|---|
| ДБФ | ΔE = 57.92 lg а + 4.79 (R2 = 0.9997) |
1 × 10–2–8 × 10–8 | 10–7.3 |
| ББПА | ΔE = 58.81 lg а + 33.04 (R2 = 0.9999) |
1 × 10–2–9 × 10–8 | 10–7.2 |
| о-НФОЭ | ΔE = 52.54 lg а + 21.12 (R2 = 0.9983) |
1 × 10–2–1 ×1 0–7 | 10–7.0 |
| ТЭГФ | ΔE = 54.19 lgа + 49.43 (R2 = 0.9992) |
1 × 10–2–1 × 10–7 | 10–7.1 |
Согласно полученным экспериментальным данным, все изготовленные сенсоры показали практически одинаковый диапазон линейности электродной функции. Однако угловой коэффициент (крутизна S) и диапазон выполнения электродной функции в области разбавленных растворов Cs[B3H8] оказались зависимыми от природы пластификатора. Наилучшие результаты с точки зрения крутизны электродной функции продемонстрировали сенсоры, содержащие ДБФ (${{{{\varepsilon }}}_{{{\gamma }}}}$ = 6.4) и ББПА (${{{{\varepsilon }}}_{{{\gamma }}}}$ = 5.3). Напротив, сенсоры, изготовленные с использованием более полярных пластификаторов, таких как ТЭГФ (${{{{\varepsilon }}}_{{{\gamma }}}}$ = 9.9) и о-НФОЭ (${{{{\varepsilon }}}_{{{\gamma }}}}$ = 21.0), показали субнернстовский наклон. Наименьшее значение нижнего предела обнаружения ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ было установлено для ИСЭ на основе ДБФ, наибольшее – на основе о-НФОЭ. Очевидно, что при замене пластификатора происходит изменение степени ассоциации ионной пары [(С10H21)4N]+[B3H8]– в мембранной фазе и активности (свободной концентрации) ионов ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }$ на границе раздела фаз мембрана/раствор.
На рис. 4 представлена диаграмма, характеризующая коэффициенты потенциометрической селективности, рассчитанные для изученных мембранных систем с наилучшими электродными характеристиками методом смешанных растворов [31]. Видно, что исследуемые электроды проявляют избирательность по отношению к ${{{\text{B}}}_{{\text{3}}}}{\text{H}}_{8}^{ - }.$ При этом порядок изменения ${\text{lg}}K_{{i,j}}^{{{\text{пот}}}}$ соответствует известной шкале экстрагируемости неорганических анионов четвертичными аммониевыми основаниями, начиная с липофильного ${\text{ClO}}_{4}^{ - }$ и заканчивая гидрофильным ${\text{SO}}_{4}^{{2 - }}$ [32].
Рис. 4.
Коэффициенты потенциометрической селективности ИСЭ на основе ПВХ-мембран, пластифицированных ДБФ (синий) и ББПА (красный).

Зависимость потенциометрического отклика от рН исследуемого водного раствора. Для оценки рабочего рН-диапазона изготовленного сенсора с оптимальным составом мембраны, пластифицированной ДБФ, была получена зависимость электродного потенциала в 1 × 10–3 М растворах Cs[B3H8] в интервале рH от 2 до 9. Из рис. 5 видно, что потенциометрический отклик сенсора практически не зависит от рН исследуемого раствора при рН 4.8–7.5.
Рис. 5.
Зависимость потенциометрического отклика ИСЭ с мембраной на основе ДБФ от рН водного раствора, содержащего 1 × 10–3 М Cs[B3H8].

Это подтверждает известные данные о том, что водные растворы солей октагидротриборат-ионов обладают достаточно высокой стабильностью [33]. Однако при 4.5 ≤ рН ≥ 7.8 наблюдается некоторый рост электродного потенциала, свидетельствующий об уменьшении свободной концентрации ${{{\text{В}}}_{{\text{3}}}}{\text{Н}}_{8}^{ - }$ в щелочной и кислой среде.
На основании полученных данных можно заключить, что разработанный ИСЭ с пластифицированной ПВХ-мембраной, содержащей [(С10H21)4N][B3H8] в качестве ЭАВ, характеризуется высокой чувствительностью и селективностью по отношению к ${{{\text{В}}}_{{\text{3}}}}{\text{Н}}_{8}^{ - }$ в присутствии ряда неорганических анионов в широком интервале рН водного раствора. Разработанный электрод может быть рекомендован для экспресс-анализа технологических водных растворов.
Список литературы
Stock A. The Hydrides of Boron and Silicon. Cornell University Press, 1933.
Bykov A.Y., Zhizhin K.Y., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2014. V. 59. № 13. P. 1539. https://doi.org/10.1134/S0036023614130026
Hagemann H. // Molecules. 2021. V. 26. № 24. P. 7425. https://doi.org/10.3390/molecules26247425
Kubasov A.S., Novikov I.V., Starodubets P.A. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 7. P. 984. https://doi.org/10.1134/S0036023622070130
Avdeeva V.V., Kubasov A.S., Korolenko S.E. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 5. P. 628. https://doi.org/10.1134/S0036023622050023
Титов Л.В. // Журн. неорган. химии. 2003. V. 48. № 10. P. 1613.
Goedde D.M., Windler G.K., Girolami G.S. // Inorg. Chem. 2007. V. 46. № 7. P. 2814. https://doi.org/10.1021/ic0621300
Pylypko S., Zadick A., Chatenet M. et al. // J. Power Sources. 2015. V. 286. P. 10. https://doi.org/10.1016/j.jpowsour.2015.03.143
Fu H., Wang X., Shao Y. et al. // Int. J. Hydrogen Energy. 2016. V. 41. № 1. P. 384. https://doi.org/10.1016/j.ijhydene.2015.10.081
Moury R., Gigante A., Remhof A. et al. // Dalton Trans. 2020. V. 49. № 35. P. 12168. https://doi.org/10.1039/D0DT02170A
Gigante A., Leick N., Lipton A.S. et al. // ACS Appl. Energy Mater. 2021. V. 4. № 4. P. 3737. https://doi.org/10.1021/acsaem.1c00159
Суровцев Е.Л., Хаин Е.С., Шевченко Ю.Н. // Журн. аналит. химии. 1980. V. 35. № 7. P. 1439.
Копытин А.В., Жижин К.Ю., Быков А.Ю. Мембрана ионоселективного электрода для определения октагидротриборатного аниона. Пат. RU2621888C1, 2017.
Buck R.P. // Theory and principles of membrane electrodes. Ion-Selective Electrodes Anal. Chem. 1978. P. 1
Bakker E., Pretsch E. // Angew. Chem.Int. Ed. 2007. V. 46. № 30. P. 5660. https://doi.org/10.1002/anie.200605068
Zdrachek E., Bakker E. // Anal. Chem. 2019. V. 91. № 1. P. 2. https://doi.org/10.1021/acs.analchem.8b04681
Craggs A., Moody D.J., Thomas J.D.R. // J. Chem. Educ. 1974. V. 51. № 8. P. 541.
Bykov A.Y., Razgonyaeva G.A., Mal’tseva N.N. et al. // Russ. J. Inorg. Chem. 2012. V. 57. № 4. P. 471. https://doi.org/10.1134/S0036023612040055
Bykov A.Y., Mal’tseva N.N., Generalova N.B. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 11. P. 1321. https://doi.org/10.1134/S003602361311003X
Turyshev E.S., Kopytin A.V., Zhizhin K.Y. et al. // Talanta. 2022. V. 241. P. 123239. https://doi.org/10.1016/j.talanta.2022.123239
Coetzee C.J., Freiser H. // Chem. 1969. V. 41. № 8. P. 1128.
Kopytin A.V., Zhizhin K.Y., Urusov Y.I. et al. // J. Anal. Chem. 2011. V. 66. № 7. P. 666. https://doi.org/10.1134/S1061934811070070
Kopytin A.V., Zhizhin K.Y., Urusov Y.I. et al. // J. Anal. Chem. 2012. V. 67. № 2. P. 168. https://doi.org/10.1134/S1061934812020074
Wegmann D., Weiss H., Ammann D. et al. // Mikrochim. Acta. 1984. V. 84. № 1–2. P. 1. https://doi.org/10.1007/BF01204153
Матвейчук Ю.В., Рахманько Е.М., Окаев Е.Б. Ионоселективные электроды на основе высших четвертичных аммониевых солей, обратимые к двухзарядным неорганическим анионам. Минск, 2018.
Matveichuk Y.V. // Anal. Chem. Lett. 2018. V. 8. № 4. P. 428.
Schaller U., Bakker E., Pretsch E. // Anal. Chem. 1995. V. 67. № 18. P. 3123. https://doi.org/10.1021/ac00114a005
Бережковская О.М., Макарова Е.Д., Матерова Е.А. // Вестн. ЛГУ. 1986. № 4. P. 65.
Смирнова А.Л., Грекович А.Л., Матерова Е.А. // Электрохимия. 1987. V. 10. P. 1187.
Kopytin A.V., German K.E., Zhizhin K.Y. et al. // Sens. Actuators, B: Chem. 2020. V. 310. P. 127853. https://doi.org/10.1016/j.snb.2020.127853
Buck R.P., Lindner E. // Pure Appl. Chem. 1994. V. 66. № 12. P. 2527. https://doi.org/10.1351/pac199466122527
Szigeti Z., Vigassy T., Bakker E. et al. // Electroanalysis. 2006. V. 18. № 13–14. P. 1254. https://doi.org/10.1002/elan.200603539
Huang Z., Chen X., Yisgedu T. et al. // Inorg. Chem. 2011. V. 50. № 8. P. 3738. https://doi.org/10.1021/ic2000987
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии



