Журнал неорганической химии, 2022, T. 67, № 8, стр. 1058-1069
Исследование спин-кроссовера в комплексах железа(II) с 2,6-бис(4,5-диметил-1H-имидазол-2-ил)пиридином и клозо-боратными анионами
А. Д. Иванова a, Л. Г. Лавренова a, *, Е. В. Коротаев a, С. В. Трубина a, А. Я. Тихонов b, В. В. Кривенцов c, С. А. Петров d, К. Ю. Жижин e, Н. Т. Кузнецов e
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
b Новосибирский институт органической химии им. Н.Н. Ворожцова СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 9, Россия
c Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 5, Россия
d Институт химии твердого тела и механохимии СО РАН
630128 Новосибирск, ул. Кутателадзе, 18, Россия
e Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: ludm@niic.nsc.ru
Поступила в редакцию 11.01.2022
После доработки 15.01.2022
Принята к публикации 25.01.2022
- EDN: FAVFWD
- DOI: 10.31857/S0044457X22080177
Аннотация
Синтезированы новые координационные соединения железа(II) с 2,6-бис(4,5-диметил-1Н-имидазол-2-ил)пиридином (L) и клозо-борат(2-)-анионами состава [FeL2]B10H10 ⋅ 2H2O, [FeL2]B12H12 ⋅ H2O. Соединения идентифицированы и исследованы методами CHN-анализа, электронной (спектроскопии диффузного отражения), ИК-, мессбауэровской и EXAFS-спектроскопии, РФА, статической магнитной восприимчивости. Структура координационного узла комплексов [FeL2]B10H10 ⋅ 2H2O и [FeL2]B12H12 ⋅ H2O получена в процессе моделирования спектров EXAFS. Лиганд координируется к иону железа(II) тридентатно-циклическим способом двумя атомами азота циклов имидазола и атомом азота пиридина, координационный узел – FeN6. Изучение зависимости магнитной восприимчивости от температуры в диапазоне 80–500 K показало, что в полученных соединениях проявляется высокотемпературный спин-кроссовер 1А1 ↔ 5Т2.
ВВЕДЕНИЕ
Явление спин-кроссовера (СКО) неизменно привлекает внимание исследователей и интенсивно изучается [1–9]. СКО наблюдается в комплексах металлов с электронной конфигурацией 3d4–3d7 преимущественно в октаэдрическом или псевдооктаэдрическом окружении лигандов. Под влиянием внешних условий (температуры, давления, облучения светом определенной длины волны и других факторов) спиновая мультиплетность центрального атома может изменяться. Соединения с СКО обладают способностью к существованию в двух состояниях с достаточно продолжительным временем жизни: низкоспиновом (НС) и высокоспиновом (ВС). Это служит предпосылкой для их использования в качестве элементной базы электронных устройств [3, 10–15]. Комплексы железа(II) с полиазотсодержащими гетероциклическими лигандами являются перспективным классом соединений, обладающих такими свойствами. При определенной силе поля лиганда в них наблюдается СКО 1А1 ↔ 5Т2. Новосибирской группой ранее были синтезированы и исследованы представительные ряды комплексов железа(II) с двумя классами полиазотистых лигандов: 1,2,4-триазолами [16–19] и трис(пиразол-1-ил)метанами [4, 9]. Получена серия соединений железа(II) с 1,2,4-триазолом и его 4-замещенными производными и различными внешнесферными анионами. Необходимо отметить, что интерес к 1,2,4-триазолам в качестве лигандов среди исследователей, занимающихся спин-кроссовером, не ослабевает на протяжении ряда лет. Совсем недавно были опубликованы две работы, в которых сообщается о новом, довольно неожиданном применении комплексов, синтезированных в нашей группе [20, 21]. В статье [20] описан новый подход к развитию 4D-печати, основанный на применении нанокомпозитов, обладающих СКО. Создание 4D-принтера заключается в применении умных, реагирующих на изменение внешних условий материалов, которые позволяют изменять форму и/или функциональность 3D-печатного объекта. Чтобы отличить эти объекты от статических 3D-печатных структур, использовали термин 4D-печать, где четвертое измерение относится ко времени. Для достижения этой цели в качестве комплекса, обладающего СКО, авторами был выбран и успешно применен синтезированный нами ранее комплекс железа(II) c 4-амино-1,2,4-триазолом состава Fe(NH2trz)3SO4 [18]. Работа [21] посвящена поиску зависимости чувствительности взрывчатых веществ, обладающих СКО, от состояния центрального атома. Авторами был исследован полученный нами ранее комплекс перхлората железа(II) с незамещенным 1,2,4-триазолом состава Fe(Htrz)3(ClO4)2 [16, 19], в котором проявляется СКО. Исследование взаимосвязи между характеристиками спин-кроссовера и чувствительностью комплекса к внешним воздействиям – удару, трению и т.д. показало, что наблюдается корреляция между НС- или ВС-формой комплекса и его чувствительностью. Обнаружено, что Fe(Htrz)3(ClO4)2 в НС-форме имеет более низкую чувствительность к удару по сравнению с ВС-формой этого комплекса. Авторы ожидают, что соединения, обладающие СКО и чувствительностью к внешним воздействиям, станут новым классом переключаемых взрывчатых веществ.
В настоящее время мы занимаемся синтезом и исследованием комплексов Fe(II) с 2,6-бис(имидазол-2-ил)пиридинами. Нами и другими авторами были получены и изучены комплексы Fe(II) с 2,6-бис(бензимидазол-2-ил)пиридином и различными внешнесферными анионами [22–26], которые обладают спин-кроссовером. Наряду с лигандами данного класса проводится изучение СКО в комплексах железа(II) c 2,6-бис(пиразол-1-ил)пиридином и его производными [27–29]. В продолжение наших исследований мы получили комплексы ряда солей железа(II) c новым синтезированным нами лигандом – 2,6-бис(4,5-диметил-1Н-имидазол-2-ил)пиридином (L) [30], в которых наблюдается СКО 1А1 ↔ 5Т2. В данной работе мы синтезировали и изучили комплексы железа(II) с L и клозо-борат(2-)-ионами состава [FeL2]B10H10 ⋅ 2H2O и [FeL2]B12H12 ⋅ H2O.
Соединения, содержащие кластерные анионы бора, перспективны для создания цитотоксических препаратов и препаратов для нейтронозахватной терапии опухолей [31–35]. Изучение полученных нами ранее комплексов железа(II) с рядом полиазотистых лигандов, содержащих в качестве внешнесферных анионов ${{{\text{B}}}_{{10}}}{\text{H}}_{{10}}^{{2 - }}$ и ${{{\text{B}}}_{{12}}}{\text{H}}_{{12}}^{{2 - }}$ [26, 36, 37], показало, что в них наблюдается спин-кроссовер. Представлялось целесообразным продолжить исследования в этом направлении.
2,6-Бис(4,5-диметил-1Н-имидазол-2-ил)пиридин (L)
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для синтеза использовали FeSO4 ⋅ 7H2O фирмы AcrosOrganics, аскорбиновую кислоту “мед.”, этанол “ректификат”. K2B10H10 ⋅ 2H2O и K2B12H12 получали по методике [38]. Все реагенты использовали без дополнительной очистки. 2,6-Бис(4,5-диметил-1Н-имидазол-2-ил)пиридин (L) синтезировали по методике [30], его спектральные характеристики соответствуют приведенным в литературе.
Синтез комплексов [FeL2]B10H10⋅ 2H2O (1 · 2H2O), [FeL2]B12H12⋅ H2O (2 · H2O). Навеску 0.07 г (0.25 ммоль) соли FeSO4 ⋅ 7H2O растворяли в 6 мл дистиллированной воды, подкисленной 0.05 г аскорбиновой кислоты. К полученному раствору при перемешивании прибавляли соли клозо-боратов: 0.09 г (0.4 ммоль) K2B10H10 ⋅ 2H2O или 0.09 г (0.4 ммоль) K2B12H12 в 5 мл воды. Затем медленно при перемешивании к каждому из полученных растворов прибавляли нагретый раствор 0.15 г (0.54 ммоль) L в 5 мл этанола. Сразу после смешивания растворов выпадали бордовые осадки, которые перемешивали на магнитной мешалке в течение 5 ч. Осадки отфильтровывали, промывали по два раза 1 мл воды и 1 мл этанола, высушивали на воздухе. Выход соединений 1 и 2 составил 93 и 95% соответственно.
| C | H | N | |
| Найдено, %: | 48.9; | 6.3; | 18.4. |
| Для C30H48B10FeN10O2 | |||
| вычислено, %: | 48.4; | 6.5; | 18.8. |
| Найдено, %: | 46.9; | 6.5; | 17.8. |
| Для C30H50B12FeN10O2 | |||
| вычислено, %: | 46.9; | 6.6; | 18.2. |
Элементный анализ лиганда и комплексов на C, H, N проводили на приборе Euro EA 3000 фирмы EuroVector (Италия).
Дифрактометрическое исследование поликристаллических соединений выполнено на дифрактометре Shimadzu XRD 7000 (излучение CuKα, Ni-фильтр, сцинтилляционный детектор) при комнатной температуре.
Рентгеновские спектры поглощения в области Fe K-края (150 до края–800 эВ выше края поглощения) получены на 8 канале накопителя ВЭПП-3 СЦСТИ (Сибирский центр синхротронного и терагерцового излучения) ИЯФ СО РАН [39]. Спектры получены в стандартном режиме на пропускание с использованием ионизационных камер, заполненных смесями газов Ar/He (мониторирующий детектор) и Xe (финальный детектор). В качестве входного кристалла монохроматора использовали прорезной монокристалл Si(111). Энергия накопительного кольца во время измерений составляла 2 ГэВ при значении тока 70–140 мА. Для проведения измерений образцы смешивали с порошковой целлюлозой в качестве наполнителя и прессовали в таблетки. Количество образца рассчитывали таким образом, чтобы скачок поглощения составлял величину Δμx = 0.8–1.0 на Fe K-крае. Для измерения спектров поглощения при повышенной температуре для комплексов в ВС-состоянии образцы помещали в трубчатую печь, открытую с концов. Температуру в середине печи, где находился образец, поддерживали с помощью терморегулятора ТЕРМОДАТ 10К на уровне 420 ± 5 K.
ИК-спектры поглощения комплексов снимали на ИК-фурье-спектрометрах Scimitar FTS 2000 в области 4000–400 см–1 и Vertex 80 области 400–100 см–1. Образцы готовили в виде суспензий в вазелиновом и фторированном масле и полиэтилене. ИК-спектры лиганда регистрировали в таблетках KBr на спектрометре Bruker Vector-22, УФ-видимый спектр лиганда получали с использованием спектрофотометра Hewlett-Packard HP 8453.
Спектры ЯМР 1Н и 13С лиганда записывали на спектрометре Bruker AV-300 при 300 и 75 МГц соответственно. Химические сдвиги определяли относительно сигналов остаточного растворителя (ДМСО-d6: 2.50 м.д. для ядер 1Н и 39.5 м.д. для ядер 13С), температуры плавления – на приборе Mettler Toledo FP-900.
Спектры диффузного отражения Кубелки–Мунка регистрировали на сканирующем спектрофотометре UV-3101 РС фирмы Shimadzu при комнатной температуре.
Статическую магнитную восприимчивость образцов измеряли методом Фарадея в интервале температур 80–520 K. Температурную стабилизацию образца с точностью 1 K во время измерения осуществляли с помощью ПИД-регулятора DTB9696 фирмы Delta Electronics. Скорость нагрева и охлаждения образцов составляла ~2–3 град./мин. Напряженность внешнего магнитного поля 7.3 кЭ при проведении исследований поддерживали с точностью стабилизации ~2%. Для исследования синтезированных соединений, содержащих кристаллизационную воду, образцы запаивали с атмосферным воздухом в кварцевые ампулы. Для исследования дегидратированных комплексов исходные соединения помещали в открытые кварцевые ампулы, вакуумировали до остаточного давления в измерительной ячейке установки 10–2 мм рт. ст., затем создавали инертную атмосферу гелия при давлении 5 мм рт. ст. Температуры прямого (Тс↑) и обратного (Тс↓) переходов определяли исходя из условия d2µэф/dT2 = 0. Значения эффективного магнитного момента вычисляли по формуле μэф = ${{\left( {8\chi _{{\text{M}}}^{'}T} \right)}^{{{1 \mathord{\left/ {\vphantom {1 2}} \right. \kern-0em} 2}}}},$ где $\chi _{{\text{M}}}^{'}$ – молярная магнитная восприимчивость, исправленная на диамагнетизм атомов по схеме Паскаля.
Мессбауэровские спектры комплексов измеряли при комнатной температуре на спектрометре NP-610 с источником 57Co (Rh). В результате обработки спектров находили изомерный сдвиг δ (относительно α-Fe) и квадрупольное расщепление ε.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Соединения [FeL2]B10H10 ⋅ 2H2O и [FeL2]B12H12 ⋅ ⋅ H2O получали из водно-этанольных растворов при концентрации соли железа(II) ~0.1 моль/л и стехиометрическом соотношении Fe : L. В качестве восстановителя и слабоподкисляющего реагента к раствору железа(II) добавляли аскорбиновую кислоту. Синтез проводили в две стадии. На первой стадии получали раствор клозо-боратов железа(II) из водного раствора FeSO4 с использованием полуторакратного избытка солей K2B10H10 ⋅ 2H2O или K2B12H12. На второй стадии к полученным растворам добавляли раствор лиганда в этаноле. Комплексы получали с высоким выходом (>90%).
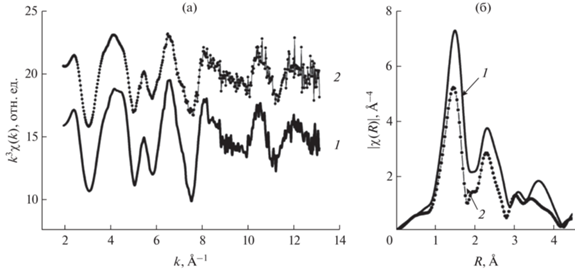
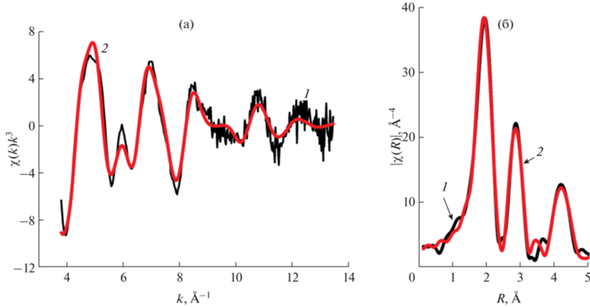
Параметры микроструктуры комплексов (состав и строение ближайших сфер окружения вокруг атома железа) получены на основании данных EXAFS-спектроскопии. Выделение осциллирующей части спектра поглощения (EXAFS-функции) из общего спектра проводили в программе VIPER 10.17 [40]. Функции радиального распределения вокруг атома железа получены преобразованием Фурье домноженных (взвешенных) на k3 EXAFS-функций в диапазоне волновых чисел Δk = 2.0–13.0 Å−1 (рис. 1).
Рис. 1.
Экспериментальные χ(k)k3 EXAFS-спектры в области Fe K-края поглощения (а) и функции радиального распределения без учета фазового сдвига (б) для исследуемых комплексов: [FeL2]B10H10 · 2H2O – сплошная линия, [FeL2]B12H12 · H2O – пунктирная линия.
В качестве исходной модели для расчета спектров комплексов в низкоспиновом состоянии использовали структуру комплекса с 2,6-бис(бензимидазол-2-ил)пиридином вследствие схожести структур координационного узла иона железа(II) с этим и исследуемым в данной работе лигандом (2,6-бис(4,5-диметил-1H-имидазол-2-ил)пиридином) и предположение, что к иону железа(II) координируются два лиганда по тридентатно-циклическому типу. Моделирование локального окружения вокруг атома железа (межатомные расстояния Ri, координаты атомов, углы) проводили в программе EXCURVE 98 [41] для целой молекулы в приближении многократного рассеяния без учета атомов водорода, CH3-групп и анионов, так как они оказывают слабое влияние на форму EXAFS-спектра вследствие структурной удаленности от центрального атома железа. Это позволило снизить количество варьируемых параметров в процессе моделирования. Процедура моделирования была проведена в диапазоне волновых векторов Δk = 3.0–12 Å–1 со взвешивающим коэффициентом w = k3 и значением фактора амплитудного подавления S02 = 1.0. Структура координационного узла и данные о локальном окружении атома железа, полученные при моделировании спектров EXAFS, приведены на рис. 2 и в табл. 1 соответственно.
Рис. 2.
Общий вид структуры координационного узла, полученный в процессе моделирования EXAFS-спектров комплексов [FeL2]A2, где A = ${{{\text{B}}}_{{10}}}{\text{H}}_{{10}}^{{2 - }}$ и ${{{\text{B}}}_{{12}}}{\text{H}}_{{12}}^{{2 - }}.$
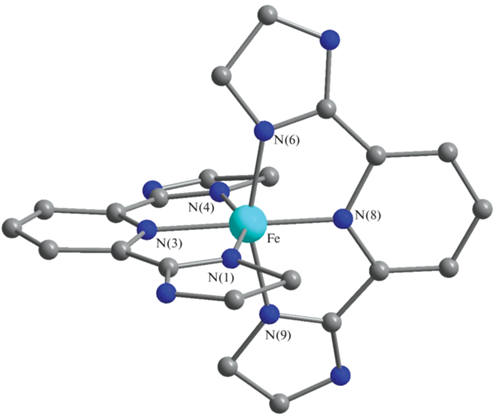
Таблица 1.
Структура координационного узла комплексов [FeL2]B10H10 · 2H2O и [FeL2]B12H12 · H2O по данным EXAFS. Ri – межатомные расстояния, $2\sigma _{i}^{2}$ – фактор Дебая–Валлера, Fi – индекс, характеризующий статистическую ошибку подгонки
| Связь | Ri, Å | Углы | ω, град | ||
|---|---|---|---|---|---|
| 1 · 2H2O | 2 · H2O | 1 · 2H2O | 2 · H2O | ||
| Fe(1)–N(1) | 1.96 | 1.96 | N(1)Fe(1)N(8) | 106 | 104 |
| Fe(1)–N(3) | 1.98 | 1.82 | N(1)Fe(1)N(6) | 93.7 | 92.7 |
| Fe(1)–N(4) | 1.95 | 1.95 | N(1)Fe(1)N(9) | 94.5 | 94.6 |
| Fe(1)–N(6) | 1.94 | 1.95 | N(1)Fe(1)N(3) | 75.9 | 80.2 |
| Fe(1)–N(8) | 1.87 | 1.95 | N(3)Fe(1)N(9) | 101 | 100 |
| Fe(1)–N(9) | 1.96 | 1.96 | N(3)Fe(1)N(4) | 78.0 | 83.4 |
| 2σ2 (Fe–N), Å2 | 0.011 | 0.015 | Fi(a) | 1.6 | 2.1 |
Примечание. Точность определения параметров из данных EXAFS: межатомные расстояния и углы ± 1% (для ближайшей сферы окружения). a${{F}_{i}} = \sum\nolimits_i^N {w_{i}^{2}} {{\left( {\chi _{i}^{{{\text{exp}}}}\left( k \right) - \chi _{i}^{{th}}\left( k \right)} \right)}^{2}},$ ${{w}_{i}} = \frac{{k_{i}^{n}}}{{\sum\nolimits_i^N {k_{i}^{n}} \left| {\chi _{j}^{{{\text{exp}}}}\left( k \right)} \right|}}.$
На рис. 3 представлены (для сравнения) экспериментальный и модельный спектры комплекса [FeL2]B10H10 · 2H2O в НС-состоянии.
Рис. 3.
Сравнение экспериментального (1) и модельного (2) EXAFS-спектров (а) и функций радиального распределения (б) для комплекса [FeL2]B10H10 · 2H2O в НС-состоянии.
Измерения спектров поглощения для комплексов в высокоспиновом состоянии удалось выполнить только для комплекса [FeL2]B12H12 · ⋅ H2O с более низкой температурой перехода. На рис. 4 приведены XANES-спектры в области Fe K-края поглощения и первые производные для комплекса в НС- и ВС-состоянии.
Рис. 4.
XANES-спектры в области Fe K-края (а) и первые производные (б) для комплекса [FeL2]B12H12 · H2O в НС- (300 K, кривая 1) и ВС- (420 K, кривая 2) состояниях.
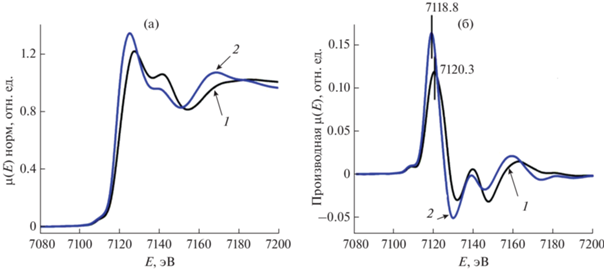
Как видно из рис. 4, при нагреве комплекса до 420 K наблюдается сдвиг края поглощения в область меньших энергий на 1.5 эВ, обусловленный сдвигом незанятых состояний и увеличением межатомных расстояний от центрального атома железа до соседних атомов (Fe–N) [37, 42]. Это происходит вследствие того, что сила кристаллического поля лиганда в низкоспиновом состоянии комплекса выше, чем в высокоспиновом.
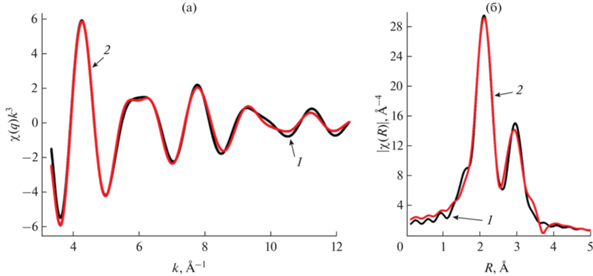
Для комплекса [FeL2]B12H12 · H2O в ВС-состоянии моделирование EXAFS-спектра проведено в однократном приближении для фильтрованного в реальном пространстве спектра (ΔR = 1.0–3.2 Å). Координационные числа ближайших сфер окружения вокруг атома железа фиксированы в соответствии с октаэдрической структурой координационного узла комплекса, полученного в процессе моделирования EXAFS спектра комплекса в НС-состоянии в приближении многократного рассеяния. Усредненные данные локальной структуры вокруг атома железа для комплекса [FeL2]B12H12 · ⋅ H2O в НС- и ВС-состоянии приведены в табл. 2, а сравнение модельных и экспериментальных спектров для данного комплекса в ВС-состоянии показано на рис. 5.
Таблица 2.
Структура локального окружения атома железа для комплекса [FeL2]B12H12 · H2O в НС- и ВС-состоянии по данным EXAFS
| Соединение | Ц.А. (Fe)–рассеиватель | Ni | НС | ВС | ||||
|---|---|---|---|---|---|---|---|---|
| Ri, Å | 2σi2, Å2 | Fi | Ri, Å | 2σi2, Å2 | Fi | |||
| [FeL2]B12H12 · H2O (1 ⋅ H2O) |
Fe–N | 6 | 1.95 | 0.011 | 2.1 | 2.17 | 0.016 | 1.2 |
| Fe–C | 8 | 2.80 | 0.013 | 3.00 | 0.020 | |||
| Fe–C | 4 | 3.19 | 3.46 | |||||
Рис. 5.
Сравнение экспериментального (1) и модельного (2) EXAFS-спектров (а) и функций радиального распределения (б) для комплекса [FeL2]B12H12 · H2O в ВС-состоянии.
В табл. 3 приведены основные колебательные частоты L и комплексов 1, 2. В спектрах комплексов в области 3600–3500 см–1 регистрируются полосы валентных колебаний O–H. В спектре L в интервале 3460–3200 см–1 расположены широкие слаборазрешенные полосы валентных колебаний NH-групп, которые включены в водородные связи. В спектрах комплексов полосы ν(NH) заметно смещаются (3250 (1) и 3291 см–1 (2)) по сравнению со спектром L и становятся более четкими, что, вероятно, связано с ослаблением водородных связей при комплексообразовании. В области 3200–2800 см–1 наблюдаются полосы ν(CH) и ν(CH3), а в диапазоне 2480–2430 см–1 – полосы валентных колебаний B–H. Число и положение полос валентных и деформационных колебаний колец в спектрах комплексов 1, 2 изменяются по сравнению со спектром L, что свидетельствует о координации атомов азота гетероциклов к железу(II). Это подтверждается и данными спектров 1, 2 в дальней области, где проявляются валентные колебания металл–лиганд. Здесь обнаруживаются отсутствующие в спектре лиганда полосы при 294 и 295 см–1, которые принадлежат валентным колебаниям Fe–N (табл. 3).
Таблица 3.
Основные колебательные частоты (см–1) в спектрах L и комплексов
| Соединение | Отнесение | ||
|---|---|---|---|
| L | [FeL2]B10H10 · ⋅ 2H2O | [FeL2]B12H12 · ⋅ H2O | |
| 3515 | 3599 3568 3542 |
ν(H2O) | |
| 3455 3215 |
3250 | 3291 | ν(N–H) |
| 3172 3107 3040 |
2955 | 3098 3066 |
ν(C–H) |
| 2919 2862 |
2924 2857 |
2922 2855 |
ν(CH3) |
| 2470 | 2480 2464 2431 |
ν(B–H) | |
| 1589 1567 1523 |
1598 1583 1528 |
1603 1587 1536 1526 |
Rкольца |
| 294 | 295 | ν(M–N) | |
В СДО комплексов 1 · 2H2O и 2 · H2O присутствуют полосы поглощения, которые относятся к переходам 1А1 → 1Т2 и 1А1 → 1Т1 в сильном октаэдрическом поле лигандов. В спектрах обоих комплексов отсутствует полоса 5Т2 → 5Е, относящаяся к высокоспиновому состоянию железа(II). Вследствие этого расчет параметров расщепления мы проводили по разности частот поглощения 1А1 → → 1Т2 и 1А1 → 1Т1 [43]. Значения В рассчитывали по формуле: 16B = [ν(1А1 → 1Т2) – ν(1А1 → 1Т1)]. Для вычисления значений C и ΔНС, приведенных в табл. 4, использовали следующие приближения: νНС = ΔНС – C + 86B2/ΔНС; С = 4.41В [44, 45]. Полученные данные близки к рассчитанным значениям ΔНС для полученных нами ранее низкоспиновых комплексов железа(II) с 2,6-бис(бензимидазол-2-ил)пиридином и рядом внешнесферных анионов [25, 26]. Это свидетельствует о том, что 2,6-бис(4,5-диметил-1Н-имидазол-2-ил)пиридин является лигандом сильного поля. Рассчитанные величины параметров расщепления соответствуют неравенству, которое является условием проявления спин-кроссовера [44]: 19 000 ≤ ΔНС ≤ ≤ 22 000 см–1.
Таблица 4.
Параметры спектров диффузного отражения комплексов и значения B, C, ΔНС
| Комплекс | λ(1А1→1Т2) | λ(1А1→1Т1) | ν(1А1→1Т2) – ν(1А1→1Т1) |
B | C | ΔНС |
|---|---|---|---|---|---|---|
| [FeL2]B10H10 · 2H2O | 405 | 519 | 5423 | 161.8 | 713.5 | 1.92 × 104 |
| [FeL2]B12H12 · H2O | 450 | 524 | 3138 | 155.6 | 686.2 | 1.92 × 104 |
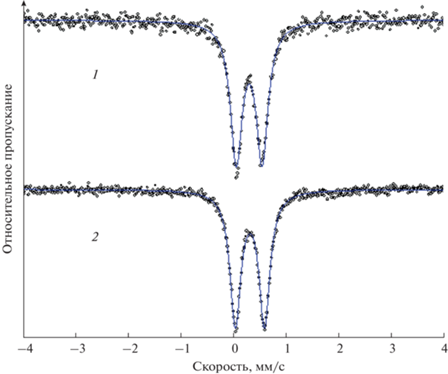
Мессбауэровские спектры обоих комплексов представляют собой квадрупольные дублеты (рис. 6, табл. 5), параметры которых соответствуют НС-состоянию железа.
Таблица 5.
Параметры мессбауэровских спектров комплексов
| Соединение | δ, мм/с | ε, мм/с | Γ, мм/с |
|---|---|---|---|
| [FeL2]B10H10 ⋅ 2H2O | 0.296 | 0.49 | 0.27 |
| [FeL2]B12H12 ⋅ H2O | 0.311 | 0.55 | 0.25 |
При сравнении параметров низкоспиновых дублетов с аналогичными параметрами соединений Fe(II) с 2,6-бис(бензимидазол-2-ил)пиридином, которые были изучены нами ранее [26], следует отметить увеличение и химических сдвигов, и величин квадрупольных расщеплений. Можно предположить, что увеличение химических сдвигов связано с увеличением плотности 3d-электронов железа из-за большей электронной плотности на атомах азота, координирующихся к Fe(II), в случае комплексов с 2,6-бис(4,5-диметил-1H-имидазол-2-ил)пиридином. Увеличение значений квадрупольных расщеплений, по-видимому, обусловлено увеличением градиента электрического поля на ядрах железа из-за уменьшения расстояния от внешнесферных анионов до железа(II), связанного с уменьшением размера лиганда.
Температурные зависимости χT исследуемых комплексов и их дегидратированных аналогов представлены на рис. 7, 8. Спин-кроссовер наблюдается как для синтезированной фазы комплекса [FeL2]B10H10 ⋅ 2H2O, так и для его дегидрата. Величина χT [FeL2]B10H10 ⋅ 2H2O в эмпирически подобранном температурном диапазоне стабильности комплекса достигает значения ~1.53 K см3/моль. Комплекс полностью не переходит в высокоспиновое состояние (χTтеор = 3 K см3/моль) при нагреве до 520 K. Кристаллизационная вода существенно не сказывается на достигаемых в рассматриваемом температурном диапазоне величинах χT. Вместе с тем остаточная величина χT в низкоспиновом состоянии для дегидратированного комплекса увеличивается до 0.21 K см3/моль по сравнению с 0.1 K см3/моль для исходного [FeL2]B10H10 ⋅ 2H2O. Остаточное значение χT ≠ 0 может быть обусловлено наличием температурно-независимого парамагнетизма либо частичным “размораживанием” орбитального момента. Несмотря на неполный спин-кроссовер, в изученном температурном диапазоне выполняется условие d2(µэф(T))/dT2 = 0, что позволяет определить температуры переходов (рис. 7в, 7г). Температуры прямого (Тс↑) и обратного (Тс↓) переходов для [FeL2]B10H10 ⋅ 2H2O представлены в табл. 6. Видно, что температуры перехода при дегидратации несколько снижаются, в то время как гистерезис существенно не изменяется. Таким образом, дегидратация комплекса [FeL2]B10H10 ⋅ ⋅ 2H2O наиболее существенно сказывается на температуре прямого и обратного переходов.
Рис. 7.
Температурные зависимости χT(T) (а, б) и d2(µэф(T))/dT2 (в, г) для комплексов [FeL2]B10H10 ⋅ 2H2O (а, в) и [FeL2]B10H10 (б, г).
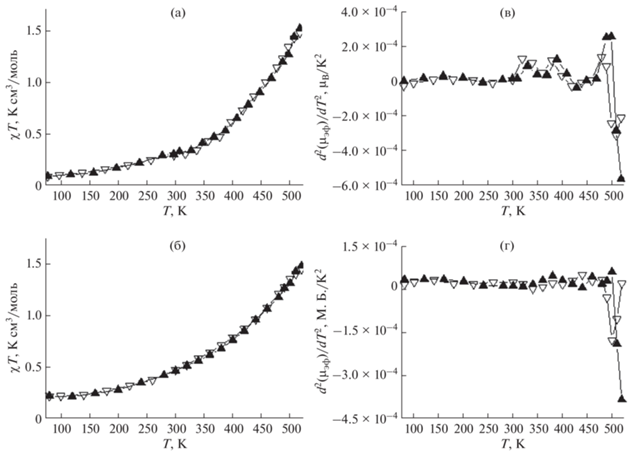
Рис. 8.
Температурные зависимости χT (T) (а, б) и d2(µэф(T))/dT2 (в, г) для комплексов [FeL2]B12H12 ⋅ H2O (а, в) и [FeL2]B12H12 (б, г).
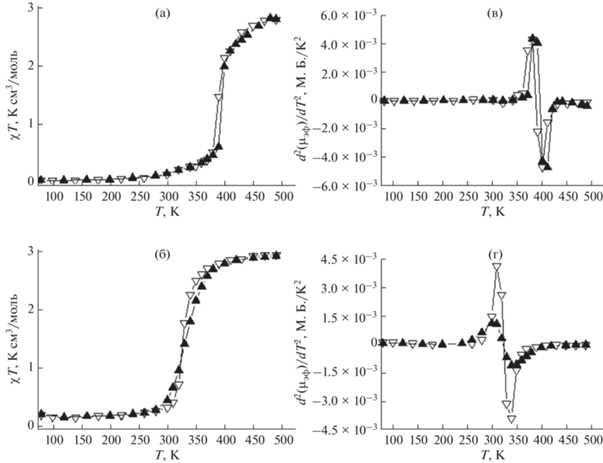
Таблица 6.
Характеристики спин-кроссовера в исследуемых комплексах
| Соединение | Tc↑, K | Tc↓, K | ΔTc, K |
|---|---|---|---|
| [FeL2]B10H10 ⋅ 2H2O | 505 | 492 | 13 |
| [FeL2]B10H10 | 502 | 488 | 14 |
| [FeL2]B12H12 ⋅ H2O | 395 | 387 | 8 |
| [FeL2]B12H12 | 325 | 325 | 0 |
В отличие от предыдущих комплексов, для [FeL2]B12H12 ⋅ H2O и [FeL2]B12H12 наблюдается полный спин-кроссовер (рис. 8). Следует отметить, что по сравнению с предыдущей парой комплексов наблюдаемые температуры прямого СКО (Tc↑) ниже на 110–177 K (табл. 6). Величина χT для данных комплексов в высокоспиновом состоянии составляет 2.88 K см3/моль, что близко к теоретическому значению 3.0 K см3/моль для Fe(II) в высокоспиновом состоянии и согласуется с экспериментальными величинами 2.76–3.92 K см3/моль для комплексов переходных металлов с конфигурацией 3d6 [46]. В низкоспиновом состоянии величина остаточного магнитного момента составляет 0.03 K см3/моль для [FeL2]B12H12 ⋅ H2O и 0.18 K см3/моль для [FeL2]B12H12. Таким образом, наличие кристаллизационной воды, как и в случае [FeL2]B10H10 ⋅ ⋅ 2H2O и [FeL2]B10H10, обусловливает более низкие величины остаточного магнитного момента. Для комплекса [FeL2]B12H12 ⋅ H2O на кривой зависимости χT(Т) можно отметить наличие гистерезиса (8°, табл. 6). При переходе к дегидратированному комплексу [FeL2]B12H12 наблюдается снижение температуры перехода, а гистерезис на кривой отсутствует. Таким образом, кристаллизационная вода для [FeL2]B12H12 ⋅ H2O и [FeL2]B12H12 оказывает более существенное влияние на параметры спин-кроссовера, чем в случае предыдущей пары комплексов.
ЗАКЛЮЧЕНИЕ
Синтезированы новые комплексы клозо-боратов железа(II) c 2,6-бис(4,5-диметил-1Н-имидазол-2-ил)пиридином состава [FeL2]B10H10 ⋅ 2H2O и [FeL2]B12H12 ⋅ H2O. Показано, что и исходные соединения, и их дегидратированные аналоги обладают термоиндуцированным спин-кроссовером 1А1 ↔ 5Т2. Следует отметить, что замена аниона ${{{\text{B}}}_{{{\text{10}}}}}{\text{H}}_{{10}}^{{2 - }}$ на ${{{\text{B}}}_{{{\text{12}}}}}{\text{H}}_{{12}}^{{2 - }}$ в составе дегидратированных комплексов приводит к изменению значения температуры прямого СКО (Tc↑) на 177 K. Сравнение выполнено для дегидратов комплексов с целью исключения влияния сольватных молекул воды. Кроме того, отметим общую тенденцию к снижению температур прямого и обратного переходов и увеличению остаточного магнитного момента при удалении кристаллизационной воды для комплексов [FeL2]B10H10 ⋅ 2H2O и [FeL2]B12H12 ⋅ H2O.
Список литературы
Spin Crossover in Transition Metal Compounds I–III / Eds. Gutlich P., Goodwin H. Springer, 2004. P. 233.
Halcrow M.A. Spin-Crossover Materials Properties and Applications / Wiley&Sons, 2013. 562 p.
Kahn O., Krober J., Jay C. // Adv. Mater.1992. V. 4. P. 718. https://doi.org/10.1002/adma.19920041103
Shakirova O.G., Lavrenova L.G. // Crystals. 2020. V. 10. P. 843. https://doi.org/10.3390/cryst10090843
Shatruk M., Phan H., Chrisostomo B.A., Suleimenova A. // Coord. Chem. Rev. 2015. V. 289. P. 62. https://doi.org/10.1016/j.ccr.2014.09.018
Feltham H.L.C., Barltrop A.S., Brooker S. // Coord. Chem. Rev. 2017. V. 344. P. 26. https://doi.org/10.1016/j.ccr.2016.10.006
Scott H.S., Staniland R.W., Kruger P.E. // Coord. Chem. Rev. 2018. V. 362. P. 24. https://doi.org/10.1016/j.ccr.2018.02.001
Melnikova E.K., Aleshin D.Yu., Nikovskiy I.A. et al. // Crystals. 2020. V. 10. № 9. P. 793. https://doi.org/10.3390/cryst10090793
Lavrenova L.G. // Russ. Chem. Bull. Int. Ed. 2018. V. 67. № 7. P. 1142. https://doi.org/10.1007/s11172-018-2195-3
Gamez P., Costa J.S., Quesada M., Aromi G. // Dalton Trans. 2009. P. 7845. https://doi.org/10.1039/B908208E
Hayami S., Holmes S.M., Halcrow M.A. // J. Mater. Chem. C. 2015. V. 3. P. 7775. https://doi.org/10.1039/C5TC90128F
Matsuda M., Isozaki H., Tajima H. // Chem. Lett. 2008. V. 37. № 3. P. 374. https://doi.org/10.1246/cl.2008.374
Muller R.N., Elst V., Laurent S. // J. Am. Chem. Soc. 2003. V. 125. P. 8405. https://doi.org/10.1021/ja0349599
Letard J.-F., Daro N., Aymonier C. et al. EP Pat. 2391631, 2011.
Bousseksou A., Vieu C., Letard J.-F. et al. EU Pat. 1430552, 2004.
Lavrenova L.G., Larionov S.V. // Russ. J. Coord. Chem. 1998. V. 24. № 6. P. 379.
Lavrenova L.G., Shakirova O.G. // Eur. J. Inorg. Chem. 2013. P. 670. https://doi.org/10.1002/ejic.201200980
Lavrenova L.G., Shakirova O.G., Ikorskii V.N. et al. // Russ. J. Coord. Chem. 2003. V. 29. № 1. C. 22. https://doi.org/10.1023/A:1021834715674
Лавренова Л.Г., Икорский В.Н., Варнек В.А. и др. // Коорд. химия. 1990. Т. 16. № 5. С. 654.
Piedrahita-Bello M., Angulo-Cervera J.E., Courson R. et al. // J. Mater. Chem C. 2020. V. 8. P. 6001. https://doi.org/10.1039/D0TC01532F
Nguyen T.D., Veauthier J.M., Angles-Tamayo G.F. et al. // JACS. 2020. V. 142. P. 4842. https://doi.org/10.1021/jacs.9b13835
Boča M., Jameson R.F., Linert W. // Coord. Chem. Rev. 2011. V. 255. P. 290. https://doi.org/10.1016/j.ccr.2010.09.010
Boča R., Baran P., Boča M. et al. // Inorg. Chim. Acta. 1998. V. 278. P. 190. https://doi.org/10.1016/S0020-1693(98)00023-1
Lavrenova L.G., Dyukova I.I., Korotaev E.V. et al. // Russ. J. Inorg. Chem. 2020. T. 65. № 1. C. 30. https://doi.org/10.1134/S0036023620010106
Ivanova A.D., Korotaev E.V., Komarov V.Yu. et al. // New J. Chem. 2020. V. 44. P. 5834. https://doi.org/10.1039/D0NJ00474J
Ivanova A.D., Lavrenova L.G., Korotaev E.V. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 11. P. 1687. https://doi.org/10.1134/S0036023620110078
Cook L.J.K., Mohammed R., Sherborne G. et al. // Coord. Chem. Rev. 2015. V. 289. P. 2. https://doi.org/10.1016/j.ccr.2014.08.006
Pavlov A.A., Aleshin D.Yu., Nikolskiy I.A. et al. // Eur. J. Inorg. Chem. 2019. № 23. P. 2819. https://doi.org/10.1002/ejic.201900432
García-López V., Palacios-Corella M., Gironés-Pérez V. et al. // Inorg. Chem. 2019. V. 58. P. 12199. https://doi.org/10.1021/acs.inorgchem.9b01526
Ivanova A.D., Korotaev E.V., Komarov V.Yu. et al. // Inorg. Chim. Acta. 2022. V. 532. P. 120746. https://doi.org/10.1016/j.ica.2021.120746
Сиваев И.Б., Брегадзе В.И., Кузнецов Н.Т. // Изв. Академии наук. Сер. хим. 2002. № 8. С. 1256.
Hawthorne M.F. // Molecular Medicine Today. 1998. V. 4. № 4. P. 174. https://doi.org/10.1016/S1357-4310(98)01226-X
Zhu Y., Lin Y., Zhu Y.Z. et al. // J. Nanomaterials. 2010. V. 2010. Art. 409320. https://doi.org/10.1155/2010/409320
Спрышкова Р.А. Биологические основы нейтронно-захватной терапии на Боре-10: Экспериментальное исследование. Дис. … д-ра биол. наук. М., 1999.
Hawthorne M.F. // Angew. Chem. Int. Ed. Eng. 1993. V. 32. P. 950. https://doi.org/10.1002/anie.199309501
Bushuev M.B., Lavrenova L.G., Shvedenkov Yu.G. et al. // Russ. J. Coord. Chem. 2008. V. 34. № 3. P. 190. https://doi.org/10.1134/S107032840803007X
Shakirova O.G., Daletskii V.A., Lavrenova L.G. et al. // Russ. J. Inorg. Chem. 2013. V. 58. № 6. P. 650. https://doi.org/10.1134/S0036023613060211
Miller H.C., Muetterties E.L. // Inorg. Synth. 1967. V. 10. P. 81.
Piminov P.A., Baranov G.N., Bogomyakov A.V. et al. // Physics Procedia. 2016. V. 84. P. 19. https://doi.org/10.1016/j.phpro.2016.11.005
Klementiev K.V. // J. Phys. D: Appl. Phys. 2001. V. 34. P. 209. https://doi.org/10.1088/0022-3727/34/2/309
Binsted N., Campbell J.W., Gurman S.J., Stephenson P.C. SERC Daresbury Laboratory Report, 1991.
Vlasenko V.G., Kubrin S.P., Garnovskii D.A. et al. // Chem. Phys. Lett. 2020. V. 739. P. 136970. https://doi.org/10.1016/j.cplett.2019.136970
Ливер Э. Электронная спектроскопия неорганических соединений. М.: Мир, 1987.
Hauser A. // Top Curr. Chem. 2004. V. 233. P. 49. https://doi.org/10.1007/b13528
Sugano S., Tanabe Y., Kamimura H. Multiplets of transition – metal ions in crystals. N.Y.–London: Academic Press Pure and Applied Physics, 1970. 331 p.
Rakitin Yu.V., Kalinnikov V.T. Modern magnetochemistry. St. Petersburg: Nauka, 1994.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии