Журнал неорганической химии, 2022, T. 67, № 8, стр. 1070-1079
Самопроизвольная изомеризация [trans-B20H18]2– → [iso-B20H18]2– в ходе комплексообразования кобальта(II) c фенантролином
В. В. Авдеева a, *, А. С. Кубасов a, С. Е. Короленко a, Л. В. Гоева a, Е. А. Малинина a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 13.12.2021
После доработки 31.12.2021
Принята к публикации 11.01.2022
- EDN: KJHVEO
- DOI: 10.31857/S0044457X22080025
Аннотация
В работе изучена реакция комплексообразования кобальта(II) с 1,10-фенантролином (Phen) в присутствии аниона [trans-B20H18]2–. При соотношении Co : Phen = 1 : 2 в ацетонитриле в течение нескольких часов образуется биядерный комплекс кобальта(II) с мостиковыми атомами хлора и кластерным анионом бора в качестве противоиона [(Phen)2Co(µ-Cl)2Co(Phen)2][trans-B20H18]. Однако при медленной кристаллизации (в течение месяца) наблюдается самопроизвольная изомеризация [trans-B20H18]2– в [iso-B20H18]2–. Методом РСА установлено, что в кристалле конечного соединения [(Phen)2Co(µ-Cl)2Co(Phen)2][trans-B20H18]1/3[iso-B20H18]2/3 впервые наблюдается сокристаллизация обеих изомерных форм октадекагидроэйкозаборатного аниона. Наличие iso-формы кластерного аниона также подтверждается данными ИК-спектроскопии: в спектре продукта появляется полоса валентных колебаний мостиковых групп ВНВ при 1773 см–1, которые отсутствуют в trans-форме борного кластера.
ВВЕДЕНИЕ
Координационная химия полиэдрических кластерных анионов бора [BnHn]2– (n = 6–12) [1–5] является предметом многолетних исследований. С позиции принципа “жестких” и “мягких” кислот и оснований, сформулированного Пирсоном, кластерные анионы бора можно отнести к мягким основаниям, что объясняет получение большого числа комплексов с металлами, являющимися мягкими кислотами (медь(I), серебро(I), свинец(II), кадмий(II)), в которых они входят во внутреннюю координационную сферу металла [6–10]. В то же время с металлами, которые относятся к промежуточным кислотам Пирсона (цинк(II), железо(II), кобальт(II), никель(II) и др.), кластерные анионы бора играют роль противоионов [11–13], а в случае некоторых металлов, являющихся жесткими кислотами Пирсона (железо(III), кобальт(III) и др.), клозо-бороводородные анионы, как правило, участвуют в окислительно-восстановительных реакциях, снижая степень окисления металла [11].
Кластерные анионы бора обладают трехмерной ароматичностью и делокализованной электронной плотностью [14, 15], что позволяет замещать концевые атомы водорода на различные функциональные группы [16–20]. Замещенные производные кластерных анионов бора также способны образовывать комплексы с атомами металлов, действуя как лиганды внутренней сферы (за счет координации B–H-групп атомом металла или за счет координации функциональной группы введенного заместителя) или как противоионы [21–24].
Макрополиэдрический димерный кластерный анион бора [trans-B20H18]2– легко образуется при мягком окислении клозо-декаборатного аниона в присутствии солей железа(III) или церия(IV) в водном растворе [25–28] или электрохимическом окислении [29]. Координационная способность димерного кластера менее изучена по сравнению с кластерами бора [BnHn]2– (n = 10, 12). Для него получен ряд смешаннолигандных комплексов серебра с Ph3P и комплексов свинца(II) с Bipy, которые содержат координированный кластерный анион бора [30–32]. Кроме того, известны структуры трис-хелатных комплексов марганца(II), железа(II), кобальта(II) и никеля(II) [MnL3][trans-B20H18] (L = = Bipy, Phen) [33–35] и комплекса железа(II) с циклопентадиенильным лигандом [CpFe(Cp-CH2-NMe2Et)]2[trans-В20Н18] [36]; во всех указанных соединениях кластер бора находится во внешней сфере металла.
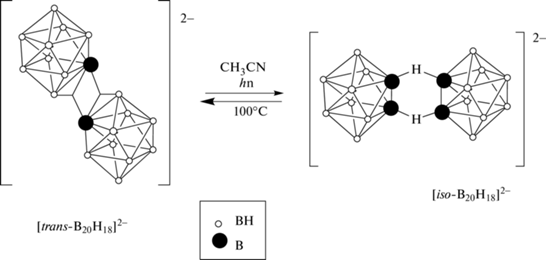
Известно, что в растворе солей аниона [trans-B20H18]2– в ацетонитриле под действием УФ-облучения кластерный анион бора переходит в изо-изомер [iso-B20H18]2–, а при нагревании раствора происходит обратный процесс [37–41]:
Схема 1 .
В работе [42] показано, что процесс изомеризации [trans-B20H18]2– → [iso-B20H18]2– может протекать и без УФ-облучения: медленная (~1 мес.) кристаллизация комплекса [Ag2(Ph3P)6[trans-B20H18]] из ДМФА приводит к образованию изомерного комплекса [Ag2(Ph3P)6[iso-B20H18]].
Твердофазная обратимая изомеризация [trans-B20H18]2– ↔ [iso-B20H18]2–обнаружена в кристаллах комплексов серебра(I) с трифенилфосфином и свинца(II) с 2,2'-бипиридином [30, 31].
В настоящей работе исследована реакция комплексообразования хлорида кобальта(II) с 1,10-фенантролином в ацетонитриле в присутствии аниона [trans-B20H18]2–, обнаружена возможность самопроизвольного протекания процесса изомеризации [trans-B20H18]2– → [iso-B20H18]2– в отсутствие УФ-облучения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реакции проводили на воздухе. Ацетонитрил (чистый для ВЭЖХ), безводный CoCl2 (98.0%) и безводный Phen (98%) (Sigma-Aldrich) использовали без дополнительной очистки. (Et3NH)2[B10H10] синтезировали из декаборана-14 по известной методике [43]. (Et3NH)2[trans-B20H18] получали мягким окислением клозо-декаборатного аниона водным раствором FeCl3 по методике [25].
Синтез [(Phen)2Co(µ-Cl)2Co(Phen)2][trans-B20H18] (1). CoCl2 (1.2 ммоль) растворяли в ацетонитриле (15 мл), добавляли раствор (Et3NH)2[trans-B20H18] (1.2 ммоль) в ацетонитриле (10 мл) и к полученному раствору прибавляли двукратный избыток Phen (3.6 ммоль) в том же растворителе (10 мл). Реакционный раствор приобретал розовый цвет, и начинали образовываться кристаллы соответствующего цвета. Через 5 ч окрашенные кристаллы отфильтровывали и сушили на воздухе. Выход 77%.
| H | C | N | В | |
| Найдено, %: | 4.35; | 50.26; | 9.71; | 18.2. |
| Для C48H50N8Co2B20Cl2 | ||||
| вычислено, %: | 4.41; | 50.40; | 9.80; | 18.9. |
ИК-спектр, см–1: ν(BH) 2525, 2493; ν(Phen) 1614, 1582, 1447, 1390, 1347, 1330, 1242, 1157, 1005, 872, 725, 690; π(CH) 845, 732.
Синтез [(Phen)2Co(µ-Cl)2Co(Phen)2][trans-B20H18]1/3[iso-B20H18]2/3 (2). Реакцию проводили аналогично вышеописанной методике, но полученный раствор герметично закрывали для предотвращения улетучивания растворителя и оставляли в темноте. Кристаллы розового цвета начинали образовываться в течение 2–3 нед. Спустя месяц кристаллы отфильтровывали и высушивали на воздухе. Выход 63%. Кристалл 2 · CH3CN отбирали непосредственно из реакционного раствора.
| H | C | N | В | |
| Найдено, %: | 4.30 | 0.31; | 9.63; | 18.7. |
| Для C48H50N8Co2B20Cl2 | ||||
| вычислено, %: | 4.41; | 50.40; | 9.80; | 18.9. |
ИК-спектр, см–1: ν(BH) 2530, 2495, ν(BH)ВНВ 1773; ν(Phen) 1615, 1582, 1449, 1391, 1347, 1328, 1245, 1155, 1008, 872, 725, 691; π(CH) 845, 732.
Элементный анализ проводили на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Определение содержания бора и кобальта методом ICP MS выполнено на атомно-эмиссионном спектрометре с индуктивно связанной плазмой iCAP 6300 Duo. Для проведения анализа образцы высушивали до постоянной массы.
ИК-спектры записывали на ИК-фурье-спектрофотометре Инфралюм ФТ-02 (НПФ АП “Люмекс” Россия); суспензия в вазелиновом масле (Aldrich), пластинки NaCl, область 4000–400 см–1, разрешение 1 см–1.
Рентгенофазовый анализ проводили на рентгеновском дифрактометре Bruker D8 Advance в ЦКП ИОНХ РАН в CuKα-излучении в низкофоновых кюветах с подложкой из ориентированного монокристалла кремния в интервале углов 2θ 5°–80° с шагом 0.01125°. Для получения дифрактограмм образцы тщательно истирали в агатовой ступке.
РСА. Наборы дифракционных отражений получены в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker SMART APEX2. Структура расшифрована прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы катионов и атомы бора уточнены в анизотропном приближении, неводородные атомы растворителя – в изотропном приближении. Все атомы водорода уточнены по модели наездника с тепловыми параметрами Uизо = 1.2Uэкв (Uизо) соответствующего неводородного атома (1.5Uизо для СН3-групп).
При сборе и обработке массива отражений использовали программы APEX2, SAINT и SADABS [44]. Структура расшифрована и уточнена с помощью программ комплекса OLEX2 [45].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структуры 2·2 CH3CN приведены в табл. 1. Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2127924).
Таблица 1.
Основные кристаллографические данные, параметры эксперимента и уточнения структуры
| Параметр | 2 ⋅ CH3CN |
|---|---|
| Брутто-формула | C50H53B20Cl2Co2N9 |
| M | 1184.97 |
| T, K | 150.15 |
| Пр. гр., Z | C2/c |
| a, Å | 15.735(2) |
| b, Å | 14.614(2) |
| c, Å | 24.551(3) |
| α, град | 90 |
| β, град | 93.866(2) |
| γ, град | 90 |
| V, Å3 | 5632.7(13) |
| Z | 4 |
| Dx, г/см3 | 1.397 |
| µMo, мм–1 | 0.731 |
| Излучение | MoKα (λ = 0.71073) |
| F(000) | 2416.0 |
| Интервал углов θ, град | 3.808–48.284 |
| Число отражений: измеренных независимых (N) [Rint] c I > 2σ(I) (No) |
21 135 4509 [0.1017] 0.0807 |
| R1, wR2 по No | 0.0474, 0.0896 |
| R1, wR2 по N | 0.0978, 0.1073 |
| GOOF | 0.996 |
| Δρmax /Δρmin, э/Å3 | 1.097/–0.801 |
Анализ поверхности Хиршфельда был выполнен с использованием программы Crystal Explorer 17.5 [46]. Донорно-акцепторные пары визуализировали с использованием стандартного (высокого) разрешения поверхности и dnorm: поверхности отображаются в фиксированной цветовой шкале от –0.640 (красный) до 0.986 (голубой) a.e.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
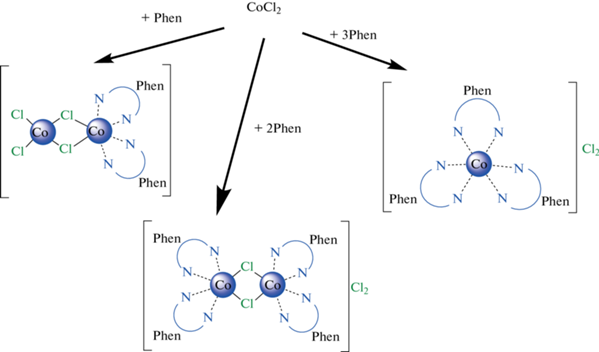
При изучении реакции комплексообразования хлорида кобальта(II) с 1,10-фенантролином (Phen) было обнаружено, что при трехкратном избытке лиганда образуется трис-хелатный желтый комплекс [Co(Phen)3]Cl2, двукратный избыток лиганда приводит к образованию симметричного биядерного комплекса [(Phen)2Co(µ-Cl)2Co(Phen)2]Cl2 розового цвета, а при эквимольном соотношении реагентов образуется асимметричный комплекс [Cl2Co(µ-Cl)2Co(Phen)2] [46] голубого цвета (cхема 2).
Схема 2 .
При проведении реакции комплексообразования кобальта(II) в присутствии кластерных анионов бора [B10H10]2–, [B12H12]2– и [B10Cl10]2– установлено, что симметричный биядерный комплекс образуется только в случае декахлор-клозо-декаборатного аниона [(Phen)2Co(µ-Cl)2Co(Phen)2][B10Cl10], тогда как в случае двух других кластерных анионов бора из реакционного раствора выпадают трис-хелатные комплексы [Co(Phen)3][An] (An = = [B10H10]2– или [B12H12]2–) [47].
В настоящей работе установлено, что проведение аналогичной реакции в присутствии октадекагидроэйкозаборатного аниона также приводит к стабилизации биядерного комплекса кобальта и выведению его из реакционного раствора, что может быть объяснено большим объемом аниона:
(1)
$\begin{gathered} {\text{CoC}}{{{\text{l}}}_{{\text{2}}}}{\text{ + 2Phen + }}{{\left[ {trans{\text{ - }}{{{\text{B}}}_{{{\text{20}}}}}{{{\text{H}}}_{{{\text{18}}}}}} \right]}^{{{\text{2--}}}}} \to \\ \to \,\,\left[ {{{{\left( {{\text{Phen}}} \right)}}_{{\text{2}}}}{\text{Co}}{{{\left( {{{\mu - Cl}}} \right)}}_{{\text{2}}}}{\text{Co}}{{{\left( {{\text{Phen}}} \right)}}_{{\text{2}}}}} \right]\left[ {trans{\text{ - }}{{{\text{B}}}_{{{\text{20}}}}}{{{\text{H}}}_{{{\text{18}}}}}} \right]{\text{.}} \\ \end{gathered} $Полученное соединение 1 идентифицировано при помощи ИК-спектроскопии и элементного анализа. Кроме того, цвет соединения (розовый) соответствует окраске биядерных комплексов с противоионами Cl– и [B10Cl10]2– [47]. В ИК-спектре соединения наблюдается полоса валентных колебаний связей ВН с максимумами около 2500 см–1, а также полный набор колебаний координированных молекул Phen в области 1600–700 см–1.
Ранее при изучении реакции комплексообразования серебра(I) с Ph3P было обнаружено, что анион [trans-B20H18]2– самопроизвольно переходит в изо-форму с течением времени. При взаимодействии [Ag(Ph3P)3NO3] с анионом [trans-B20H18]2– в ДМФА из концентрированных растворов образуется комплекс [Ag2(Ph3P)6[trans-B20H18]], а в случае медленной (~1 мес.) кристаллизации из разбавленного раствора в ДМФА конечным продуктом является комплекс [Ag2(Ph3P)6[iso-B20H18]], в котором наблюдается полная конверсия транс-формы эйкозаборатного аниона в изо-форму.
В настоящей работе были созданы условия, при которых реагенты находились длительное время в растворенном виде в ацетонитриле. Для этого реакционный раствор герметично закрывали и оставляли в темном месте. Через месяц полученные кристаллы отфильтровывали и изучали методами элементного анализа, ИК-спектроскопии и РСА.
По данным элементного анализа, кристаллы отвечают той же формуле [(Phen)2Co(µ‑Cl)2Co(Phen)2][B20H18], однако в ИК-спектре наблюдается появление новой полосы при 1773 см–1, что указывает на появление связи ВНВ в составе соединения, которая наблюдается в анионе [iso-B20H18]2–. Согласно данным РФА, соединения изоструктурны.
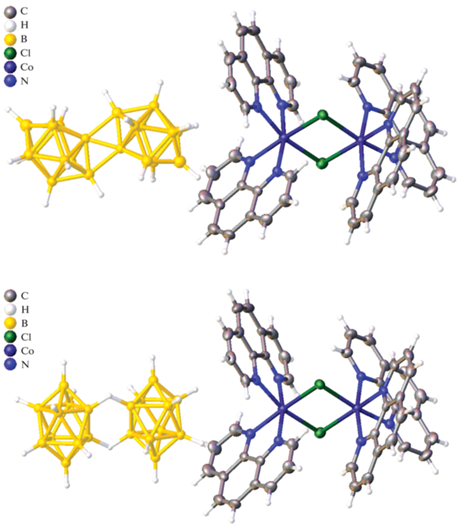
Кристаллы соединения 2 ⋅ CH3CN построены из комплексных анионов [trans-B20H18]2– и [iso-B20H18]2– в соотношении 1 : 2, биядерных катионов [(Phen)2Co(µ-Cl)2Co(Phen)2]2+ и сольватных молекул растворителя. Окружение металла искаженно-октаэдрическое. Длина связи B–B в анионах согласуется с таковой в ранее описанных структурах [30] (рис. 1). В моноклинных ячейках комплекса 2 · CH3CN анионы расположены в центре инверсии, а катионы – на оси второго порядка. Катионы и анионы образуют катионно-анионные слои, параллельные плоскости bc (рис. 2).
Рис. 1.
Строение комплекса 2 ⋅ CH3CN. Анионы [trans-B20H18]2– и [iso-B20H18]2– сокристаллизованы в соотношении 1 : 2.
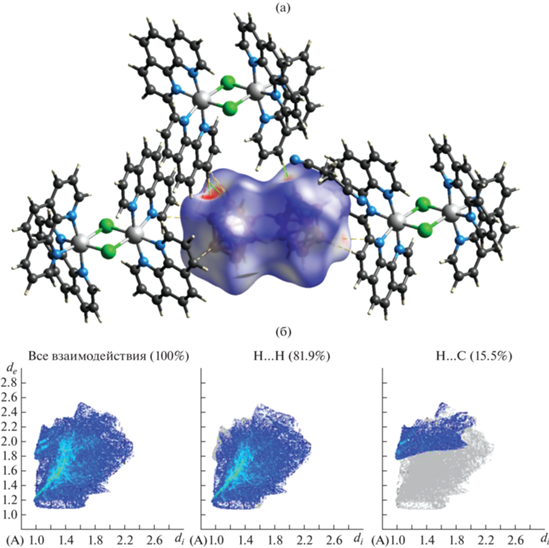
Межмолекулярные взаимодействия между анионами [B20H18]2– и окружающими молекулами растворителя и катионами исследованы методом анализа поверхности Хиршфельда аниона [47–50]. Данный инструмент дает хорошее визуальное представление о наличии межмолекулярных контактов в кристаллах и их длине. При этом изомерные кластерные анионы бора [trans-B20H18]2– и [iso-B20H18]2– исследовали раздельно с построением поверхности для каждого бороводородного аниона.
Анализ поверхности Хиршфельда анионов в полученных комплексах показывает, что наиболее сильные нековалентные взаимодействия образуются между атомами водорода CH- и CH3-групп и ребрами или гранями клозо-боратного аниона (рис. 3 и 4). Красными пятнами на поверхности Хиршфельда аниона показаны контакты CH…B, длина которых меньше суммы ван-дер-вальсовых радиусов атомов (3.02 Å для суммы B + H). Вероятно, это связано с тем, что электронная плотность в указанных соединениях локализована по борному остову.
Рис. 3.
dnorm поверхность Хиршфельда для аниона [trans-B20H18]2– (а) и 2D-развертка поверхности Хиршфельда аниона, а также границы H…H и H…С/С…H контактов (б).
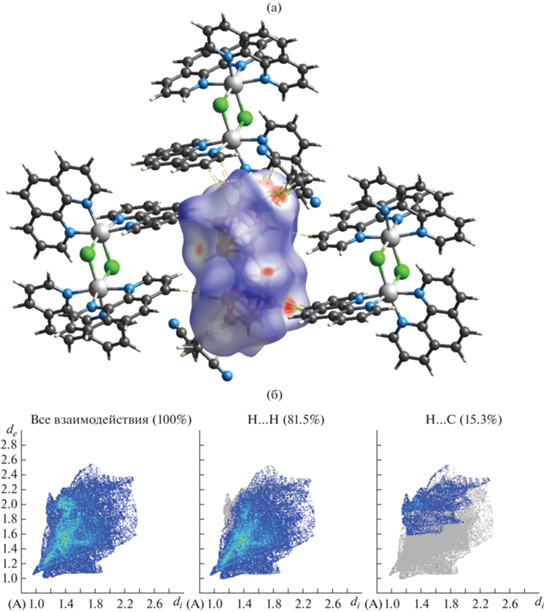
Рис. 4.
dnorm поверхность Хиршфельда для аниона [iso-B20H18]2– (а) и 2D-развертка поверхности Хиршфельда аниона, а также границы H…H и H…С/С…H контактов (б).
Отметим, что в клозо-декаборатном анионе, согласно расчетным данным, отрицательные заряды (метод NBO и NPA) делокализованы по атомам бора (~ –0.2e на атоме бора), в то время как на атомах водорода заряд чуть больше 0 (~ +0.05e) [48–51].
Анализ 2D-развертки поверхности Хиршфельда анионов [B20H18]2– показывает, что на контакты BH…HC анионов приходится 81.5–92.4% поверхности аниона, остальные 7.6–15.3% отвечают контактам (B)H…C (рис. 3 и 4). Интересно, что соотношение контактов BH…HC и (B)H…C для двух изомерных форм аниона практически одинаковое в обоих случаях.
Изучение координационной химии кобальта(II) с органическими анионами расширяет представление о многообразии структур моноядерных, биядерных и полимерных комплексов кобальта, что открывает новые возможности для синтеза координационных полимеров, MOF и соединений с заданными свойствами [52–56].
ЗАКЛЮЧЕНИЕ
Таким образом, в работе изучено комплексообразование хлорида кобальта(II) с 1,10-фенантролином в присутствии октадекагидро-эйкозаборатного аниона [trans-B20H18]2– и обнаружена самопроизвольная изомеризация аниона [trans-B20H18]2– в [iso-В20Н18]2–, при этом, по данным РСА, оба изомерных кластерных аниона бора сокристаллизуются в одном кристалле.
Список литературы
Muetterties E.L., Knoth W.H. Polyhedral Boranes. N.Y.: Dekker, 1968.
Greenwood N.N., Earnshaw A. Chemistry of the Elements, 2nd ed. Butterworth-Heinemann, 1997.
Boron Science: New Technologies and Applications / Ed. Hosmane N.S., CRC Press, 2012.
Sivaev I.B., Bregadze V.I. Polyhedral Boron Hydrides in Use: Current Status and Perspectives. Hauppauge: Nova Science Publishers, 2009. 85 p.
Sivaev I.B. // Chem. Heterocycl. Comp. 2017. V. 53. P. 638. https://doi.org/10.1007/s10593-017-2106-9
Avdeeva V.V., Malinina E.A., Sivaev I.B. et al. // Crystals. 2016. V. 6. P. 60. https://doi.org/10.3390/cryst6050060
Malinina E.A., Korolenko S.E., Kubasov A.S. et al. // Polyhedron. 2020. V. 184. P. 11456. https://doi.org/10.1016/j.poly.2020.114566
Korolenko S.E., Malinina E.A., Avdeeva V.V. et al. // Polyhedron. 2021. V. 194. P. 114902. https://doi.org/10.1016/j.poly.2020.114902
Avdeeva V.V., Malinina E.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. P. 335. https://doi.org/10.1134/S003602362003002X
Korolenko S.E., Kubasov A.S., Goeva L.V. et al. // Inorg. Chim. Acta. 2021. V. 527. P. 120587. https://doi.org/10.1016/j.ica.2021.120587
Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 514. https://doi.org/10.1134/S0036023620040026
Malinina E.A., Avdeeva V.V., Korolenko S.E. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1343. https://doi.org/10.1134/S0036023620090119
Malinina E.A., Vologzhanina A.V., Avdeeva V.V. et al. // Polyhedron. 2020. V. 183. P. 114540. https://doi.org/10.1016/j.poly.2020.114540
King B.R. // Chem. Rev. 2001. V. 101. P. 1119. https://doi.org/10.1021/cr000442t
Chen Z., King R.B. // Chem. Rev. 2005. V. 105. P. 3613. https://doi.org/10.1021/cr0300892
Sivaev I.B., Russ. J. Inorg. Chem. 2021. V. 66. P. 1289. https://doi.org/10.1134/S0036023621090151
Nelyubin A.V., Klyukin I.N., Zhdanov A.P. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 139. https://doi.org/10.1134/S0036023621020133
Shmal’ko A.V., Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1726. https://doi.org/10.1134/S0036023619140067
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2089. https://doi.org/10.1134/S0036023610140019
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. P. 1149. https://doi.org/10.1135/cccc2010054
Avdeeva V.V., Buzanov G.A., Malinina E.A., Kuznetsov N.T. // Crystals. 2020. V. 10. P. 389. https://doi.org/10.3390/cryst10050389
Avdeeva V.V., Vologzhanina A.V., Ugolkova E.A. et al. // J. Solid State Chem. 2021. V. 296. P. 121989. https://doi.org/10.1016/j.jssc.2021.121989
Matveev E.Yu., Novikov I.V., Kubasov A.S. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 187. https://doi.org/10.1134/S0036023621020121
Malinina E.A., Korolenko S.E., Zhdanov A.P. et al. // J. Cluster Sci. 2020. V. 32. P. 755. https://doi.org/10.1007/s10876-020-01840-5
Chamberland B.L., Muetterties E.L. // Inorg. Chem. 1964. V. 3. P. 1450. https://doi.org/10.1021/ic50020a025
Hawthorne M.F., Pilling R.L. // J. Am. Chem. Soc. 1966. V. 88. P. 3873. https://doi.org/10.1021/ja00968a044
Hawthorne M.F., Shelly K., Li F. // Chem. Commun. 2002. P. 547. https://doi.org/10.1039/B110076A
Curtis Z.B., Young C., Dickerson R. et al. // Inorg. Chem. 1974. V. 13. P. 1760. https://doi.org/10.1021/ic50137a046
Voinova V.V., Klyukin I.N., Novikov A.S. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 295. https://doi.org/10.1134/S0036023621030190
Avdeeva V.V., Buzin M.I., Dmitrienko A.O. et al. // Chem. Eur. J. 2017. V. 23. P. 16819. https://doi.org/10.1002/chem.201703285
Avdeeva V.V., Buzin M.I., Malinina E.A. et al. // Cryst-EngComm. 2015. V. 17. P. 8870. https://doi.org/10.1039/C5CE00859J
Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // J. Struct. Chem. 2019. V. 60. P. 692. https://doi.org/10.1134/S0022476619050020
Ilʹinchik E.A., Polyanskaya T.M., Drozdova M.K. et al. // Russ. J. Gen. Chem. 2005. V. 75. P. 1545. https://doi.org/10.1007/s11176-005-0464-y
Avdeeva V.V., Malinina E.A., Goeva L.V., Kuznetsov N.T. // Dokl. Chem. 2017. V. 474. P. 141. https://doi.org/10.1134/S0012500817060052
Avdeeva V.V., Kubasov A.S., Korolenko S.E. et al. // Polyhedron. 2022. V. 217. P. 115740.https://doi.org/10.1016/j.poly.2022.115740
Sirivardane U., Chu S.S.C., Hosmane N.S. et al. // Acta Crystallogr., Sect. C. 1989. V. 45. P. 333. https://doi.org/10.1107/S0108270188010716
Kaczmarczyk A., Dobrott R.D., Lipscomb W.N. // Proc. Nat. Acad. Sci. USA. 1962. V. 48. P. 729.
Hawthorne M.F., Pilling R.L., Stokely P.F., Garrett P.M. // J. Am. Chem. Soc. 1963. V. 85. P. 3704.
Curtis Z.B., Young C., Dickerson R., Kaczmarczyk A. // Inorg. Chem. 1974. V. 13. P. 1760.
Li F., Shelly K., Knobler C.B., Hawthorne M.F. // Angew. Chem., Int. Ed. 1998. V. 37. P. 1865.
Francés-Monerris A., Tuñón I., Monari A. // J. Phys. Chem. Lett. 2019. V. 10. P. 6202. https://doi.org/10.1021/acs.jpclett.9b02760
Firsova E.O., Avdeeva V.V., Privalov V.I. et al. // Dokl. Chem. 2015. V. 465. P. 291. https://doi.org/10.1134/S0012500815120046
Miller H.C., Miller N.E., Muetterties E.L. // J. Am. Chem. Soc. 1963. V. 85. P. 3885. https://doi.org/10.1021/ja00906a033
Sheldrick G.M. // Acta Crystallogr., Sect. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Turner M.J., McKinnon J.J., Wolff S.K. et al. // CrystalExplorer 17.5. University of Western Australia, Perth, Australia, 2017.
Avdeeva V.V., Vologzhanina A.V., Goeva L.V. et al. // Inorg. Chim. Acta. 2015. V. 428. P. 154. https://doi.org/10.1016/j.ica.2014.12.029
McKinnon J.J., Jayatilaka D., Spackman M.A. // Chem. Commun. 2007. P. 3814.
Klyukin I.N., Novikov A.S., Zhdanov A.P. et al. // Polyhedron. 2020. V. 187. P. 114682. https://doi.org/10.1016/j.poly.2020.114682
Kubasov A.S., Turyshev E.S., Novikov I.V. et al. // Polyhedron. 2021. V. 206. P. 115347. https://doi.org/10.1016/j.poly.2021.115347
Kubasov A.S., Golubev A.V., Bukov A.Yu. et al. // J. Mol. Struct. 2021. V. 1241. P. 120591. https://doi.org/10.1016/j.molstruc.2021.130591
Li Y.P., Li G.L., Xin L.Y. et al. // Russ. J. Gen. Chem. 2021. V. 91. P. 1397. https://doi.org/10.1134/S1070363221070197
Dorovskikh S.I., Stabnikov P.A., Zelenina L.N. et al. // Russ. J. Gen. Chem. 2021. V. 91. P. 1977. https://doi.org/10.1134/S107036322110008X
Gubina N.V., Markarian A.A., Kolokolov D.S. et al. // Russ. J. Gen. Chem. 2021. V. 91. P. 2118. https://doi.org/10.1134/S1070363221100224
Zherebtsova M.M., Bogachev N.A., Skripkin M.Y. et al. // Russ. J. Gen. Chem. 2021. V. 91. P. 1794. https://doi.org/10.1134/S1070363221090206
Uvarova M.A., Nefedov S.E. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1660. https://doi.org/10.1134/S0036023621110218
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии