Журнал неорганической химии, 2022, T. 67, № 8, стр. 1050-1057
Синтез, структура и магнитные свойства дитопных ферроценилборатных трис-пиридиноксиматных псевдоклатрохелатов железа, кобальта и никеля(II)
С. А. Белова a, b, А. С. Белов a, b, Н. Н. Ефимов a, А. А. Павлов b, Ю. В. Нелюбина b, В. В. Новиков b, Я. З. Волошин a, b, *
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: voloshin@ineos.ac.ru
Поступила в редакцию 01.12.2021
После доработки 28.12.2021
Принята к публикации 30.12.2021
- EDN: OASCXL
- DOI: 10.31857/S0044457X22080037
Аннотация
Трис-пиридиноксиматные псевдоклатрохелаты железа, никеля и кобальта(II) с апикальным ферроценильным заместителем были получены с приемлемым выходом (50–70%) в кипящем этаноле темплатной конденсацией 2-ацетилпиридиноксима с ферроценилбороновой кислотой на соответствующем ионе М2+ как матрице. Состав и строение выделенных в виде ионных ассоциатов с перхлорат-анионом новых дитопных соединений были установлены с помощью элементного анализа, электронной спектроскопии поглощения, MALDI-TOF масс-спектрометрии и ЯМР-спектроскопии. По данным магнетометрии, псевдоклатрохелат железа(II) является диамагнитным соединением, тогда как температурные зависимости магнитной восприимчивости комплексов никеля и кобальта(II) характерны для высокоспиновых систем с S = 1 и 3/2 соответственно. В псевдоклатрохелатах железа и никеля(II), по данным рентгеноструктурного анализа, длины связей Ni–N (2.15–2.17 Å) характерны для высокоспиновых комплексов Ni2+, тогда как в его аналоге, содержащем Fe(II), они незначительно превышают 2 Å, что указывает на низкоспиновое состояние иона Fe2+.
ВВЕДЕНИЕ
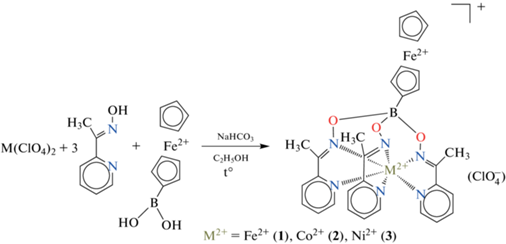
Инкапсулирование иона металла внутри полости жесткого трехмерного лиганда определяет целый ряд интересных физических и химических свойств полученных клеточных комплексов этого катиона [1], а именно: необычно высокую химическую устойчивость комплекса в различных средах и в разных степенях окисления его металлоцентра, включая стабилизацию необычных низких [1, 2] или редких высоких [3–6] окислительных состояний, неклассические проявления эффекта Яна–Теллера в этих (псевдо)макробициклических соединениях, температурные спиновые переходы и т.д. Для клатрохелатов [1] и псевдоклатрохелатов кобальта(II) [7] ранее была обнаружена медленная магнитная релаксация в отсутствие внешнего магнитного поля, т.е. они проявляют [8–16] свойства мономолекулярных магнитов, в ряде случаев характеризующихся исключительно высокими (для комплексов кобальта(II)) барьерами перемагничивания. Магнитные свойства комплексов металлов этого типа в значительной степени зависят от ряда факторов, включая их электронное и пространственное (химическое) строение, природу донорных атомов и геометрию координационного полиэдра, наличие собственного ядерного магнитного момента у инкапсулированного иона металла и окружающих его ядер и даже от гораздо менее очевидного влияния супрамолекулярной организации [1] и полиморфизма [9] их кристаллов. Все вышеперечисленные факторы определяют возможность использования соединений этого типа для создания молекулярных магнитных материалов и устройств. В связи с этим значительный фундаментальный и практический интерес представляет направленный дизайн новых политопных (многоцентровых) молекулярных (псевдо)клеточных комплексов d-металлов с медленной магнитной релаксацией и способностью к внешнему переключению степени взаимодействия между их магнитно- и редокс-активными металлоцентрами. Так, биядерные псевдоклатрохелатные комплексы могут быть получены сшивкой 3d-металлсодержащими кислотами Льюиса, в частности, ферроценилбороновой кислотой. Предполагалось, что магнитное взаимодействие между металлоцентрами полученной гибридной молекулы можно регулировать путем селективного окисления или восстановления редокс-активного фрагмента, который включен в апикальный заместитель при клатрохелатном остове. Поэтому нами были получены новые ферроценилборатные трис-пиридиноксиматные псевдоклатрохелаты железа, кобальта и никеля(II), методом РСА определена кристаллическая и молекулярная структура комплексов железа и никеля(II), а методом магнитометрии изучены их магнитные свойства.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы и методы
В работе использовали коммерческие реагенты (Sigma-Aldrich) FeCl2 ⋅ 4H2O, Ni(ClO4)2 ⋅ 6H2O, NaHCO3, NaClO4 · H2O, гидроксиламин гидрохлорид, 2-ацетилпиридин, ферроценилбороновую кислоту {FсB(OH)2}, сорбенты и органические растворители без дополнительной очистки. Co(ClO4)2 · 6H2O получали согласно [17]. 2-Ацетилпиридиноксим (AcPyOxH) был получен по методике [18].
Элементный анализ (C, H, N) выполняли на микроанализаторе Carlo Erba (модель 1106). Содержание железа определяли спектрофотометрически. Содержание кобальта и никеля устанавливали методом рентгеновской флуоресценции. Все эти определения были выполнены в Лаборатории микроанализа ИНЭОС РАН.
Масс-спектры MALDI-TOF в положительной и отрицательной областях регистрировали на масс-спектрометре MALDI-TOF-MS BrukerAutoflex II (BrukerDaltonics) в режиме reflecto-mol. Ионизацию вызывали УФ-лазером с длиной волны 337 нм. Образцы помещали на стальную пластину, в качестве матрицы использовали 2,5-дигидроксибензойную кислоту. Точность измерений составляла 0.1%.
Спектры 1H и 13C{1H} ЯМР растворов в CD2Cl2 и CD3CN регистрировали на спектрометрах Bruker Avance 600 и Varian Inova 400. Измерения проводили относительно остаточных сигналов этих растворителей: CD2Cl2 (1H 5.32 м.д., 13C 54.00 м.д.), CD3CN (1H 1.94 м.д., 13C 1.32 м.д.). Обработку данных осуществляли с использованием программы Mestrenova 12.0.0.
Электронные спектры поглощения (ЭСП) растворов комплексов в ацетонитриле и хлористом метилене регистрировали в диапазонах 190–1000 и 230–1000 нм соответственно на спектрофотометре Agilent Cary 60. Индивидуальные гауссовы компоненты этих спектров рассчитывали с помощью программы Fityk [19].
Магнитные измерения проводили на магнитометре Quantum Design PPMS-9. Мелкодисперсный порошкообразный образец соответствующего комплекса суспендировали в органическом масле и герметично запечатывали в полиэтиленовый пакетик. Статическую магнитную восприимчивость измеряли в диапазоне температур 3–300 K во внешнем магнитном поле 5 кЭ. Учитывали диамагнитную поправку пакетика и масла; диамагнитный вклад этого комплекса оценивали с использованием констант Паскаля [20]. Намагниченность образца измеряли при напряженности внешнего магнитного поля в диапазоне 0–5 Тл при температурах 2, 4 и 6 K. Измерения динамической магнитной восприимчивости проводили в диапазонах частот 10–100, 100–1000 и 1000–10 000 Гц в переменных магнитных полях амплитудой 5, 3 и 1 Э соответственно. Измерения выполняли как в нулевом, так и в магнитном поле напряженностью 1 кЭ в диапазоне температур 2–16 K.
Синтез комплексов
[Fe(AcPyOx)3(BFc)](ClO4) (1). 2-Ацетилпиридиноксим (0.27 г, 1.98 ммоль), NaClO4 · H2O (0.46 г, 3.3 ммоль), NaHCO3 (0.28 г, 3.3 ммоль) и ферроценилбороновую кислоту (0.17 г, 0.73 ммоль) растворяли/суспендировали в этаноле (3 мл) в атмосфере аргона. Реакционную смесь перемешивали 5 мин и добавляли FeCl2 · 4H2O (0.13 г, 0.66 ммоль) и этанол (4 мл). Полученную смесь кипятили в течение 30 мин, выпавший темно-красный осадок отфильтровывали, промывали этанолом (12 мл, в 3 порции), диэтиловым эфиром (10 мл, в 2 порции) и гексаном (5 мл). Продукт экстрагировали хлористым метиленом (20 мл, в 4 порции), отфильтрованный экстракт упарили досуха, твердый остаток высушивали в вакууме. Выход 0.36 г (72%).
| C | H | N | Fe | |
| Найдено, %: | 48.95; | 3.87; | 11.18; | 14.75. |
| Для C31H30N6O7BClFe2 | ||||
| вычислено, %: | 49.17; | 3.97; | 11.10; | 14.81. |
Масс-спектр (MALDI-TOF), m/z: 657 [M–${\text{ClO}}_{4}^{ - }$]+. 1H ЯМР (CD2Cl2, δ, м.д.): 2.66 (с, 9Н, CH3), 4.25–4.48 (м, 9Н, Fc), 7.00 (д, 3Н, 6-Py), 7.48 (т, 3Н, 5-Py), 7.93 (д, 3Н, 3-Py), 8.05 (т, 3Н, 4-Py). 13C{1H} ЯМР (CD2Cl2, δ, м.д.): 13.69 (с, CH3), 69.65, 70.54, 73.12 (все уш. с, Fc), 124.96 (с, 3-Py), 126.13 (с, 5-Py), 138.39 (с, 4-Py), 153.36 (с, 6-Py), 158.59 (с, 2-Py), 160.32 (с, C=N). ЭСП (CH3CN), λmax, нм (ε × × 10–3, моль–1 л см–1): 200 (80), 226 (12), 249 (23), 278 (7.3), 290 (14), 299 (7.4), 358 (4.7), 431 (2.3), 463 (5.2), 484 (3.8), 519 (15).
[Co(AcPyOx)3(BFc)](ClO4) (2). 2-Ацетилпиридиноксим (0.27 г, 1.98 ммоль), NaClO4 · H2O (0.18 г, 1.3 ммоль), NaHCO3 (0.28 г, 3.3 ммоль) и ферроценилбороновую кислоту (0.17 г, 0.73 ммоль) растворяли/суспендировали в этаноле (3 мл) в атмосфере аргона. Реакционную смесь перемешивали 5 мин и добавляли Co(ClO4)2 · 6H2O (0.24 г, 0.66 ммоль) и этанол (4 мл). Полученную смесь кипятили в течение 40 мин, выпавший светло-коричневый осадок отфильтровывали, промывали этанолом (30 мл, в 6 порций), диэтиловым эфиром (10 мл, в 2 порции) и гексаном (5 мл). Продукт экстрагировали хлористым метиленом (20 мл, в 4 порции), отфильтрованный экстракт упаривали досуха, твердый остаток высушивали в вакууме. Выход 0.26 г (52%).
| C | H | N | Fe | Co | |
| Найдено, %: | 48.79; | 3.88; | 10.97; | 7.25; | 7.60. |
| Для C31H30N6O7BClCoFe | |||||
| вычислено, %: | 48.98; | 3.95; | 11.06; | 7.37; | 7.77. |
Масс-спектр (MALDI-TOF), m/z: 660 [M–${\text{ClO}}_{4}^{ - }$]+. 1H ЯМР (CD2Cl2, δ, м.д.): –2.78 (уш. с, 3Н, 3-Py), 2.53 (уш. с, 9Н, CH3), 14.62 (уш. с, 3Н, 4-Py), 24.87 (уш. с, 5Н, Cp (незамещ.)), 27.20 (уш. с, 2Н, β-Cp), 56.67 (уш. с, 2Н, α-Cp), 80.35 (уш. с, 3Н, 5-Py), 397.23 (уш. с, 3Н, 6-Py). ЭСП (CH3CN), λmax, нм (ε × 10–3, моль–1 л см–1): 201 (48), 221 (25), 249 (8.6), 262 (2.7), 277 (15), 341 (5.3), 415 (0.6), 426 (0.8).
[Ni(AcPyOx)3(BFc)](ClO4) (3). 2-Ацетилпиридиноксим (0.28 г, 2.0 ммоль), ферроценилбороновую кислоту (0.15 г, 0.64 ммоль), NaClO4 · H2O (0.08 г, 0.58 ммоль) и NaHCO3 (0.1 г, 1.17 ммоль) растворяли/суспендировали в этаноле (5 мл) в атмосфере аргона. Реакционную смесь перемешивали 5 мин и прибавляли Ni(ClO4)2 ⋅ 6H2O (0.21 г, 0.58 ммоль) и этанол (5 мл). Полученную смесь кипятили при перемешивании в течение 1 ч. Выпавший ярко-оранжевый осадок отфильтровывали, промывали этанолом (10 мл, в 2 порции), диэтиловым эфиром (14 мл, в 2 порции) и гексаном (7 мл). Продукт экстрагировали хлористым метиленом (9 мл, в 3 порции), отфильтрованный экстракт упаривали досуха и твердый остаток высушивали в вакууме. Выход 0.28 г (64%).
| C | H | N | Fe | Ni | |
| Найдено, %: | 48.94; | 3.84; | 10.95; | 7.50; | 7.60. |
| Для C31H30N6O7BClFeNi | |||||
| вычислено, %: | 48.98; | 3.95; | 11.06; | 7.37; | 7.77. |
Масс-спектр (MALDI-TOF), m/z: 659 [M–${\text{ClO}}_{4}^{ - }$]+. 1H ЯМР (CD2Cl2, δ, м.д.): –24.00 (уш. с, 9Н, CH3), 3.72 (уш. м, 9Н, Fc), 15.46 (уш. с, 3Н, 4-Py), 44.13 (уш. с, 3Н, 5-Py), 59.23 (уш. с, 3Н, 3-Py), 137.32 (уш. с, 3Н, 6-Py). ЭСП (CH2Cl2), λmax, нм (ε × × 10–3, моль–1 л см–1): 252 (21), 263 (2.6), 288 (13), 312 (11), 353 (0.8), 381 (0.7), 776 (0.011), 828 (0.008), 898 (0.016).
Рентгеновская дифракция
Рентгеноструктурное исследование монокристаллов [Fe(AcPyOx)3(BFc)](ClO4) · 2CHCl3 (1 · 2CHCl3) и [Ni(AcPyOx)3(BFc)](ClO4) · 2CH2Cl2 (2 · 2CH2Cl2), полученных медленным упариванием растворов соответствующих псевдоклатрохелатов в смесях хлороформ–гептан и хлористый метилен–гексан соответственно, проводили на дифрактометре Bruker APEX2 DUO CCD (MoKα-излучение, графитовый монохроматор, ω-сканирование). Структуры расшифрованы с использованием программы ShelXT [21] и уточнены в полноматричном МНК с помощью программы Olex2 [22] в анизотропном приближении по $F_{{hkl}}^{2}$. Положения атомов водорода рассчитаны геометрически и уточнены в изотропном приближении по модели “наездника”. Основные кристаллографические данные и параметры уточнения представлены в табл. 1. Структурные данные для этих комплексов депонированы в Кембриджском банке структурных данных (CCDC № 2124333–2124334; http://www.ccdc.cam.ac.uk/).
Таблица 1.
Основные кристаллографические данные и параметры уточнения комплексов 1 · 2CHCl3 и 3 · 2CH2Cl2
| Параметр | 1 · 2CHCl3 | 3 · 2CH2Cl2 |
|---|---|---|
| Брутто-формула | C33H32BCl7Fe2N6O7 | C33H34BCl5FeN6NiO7 |
| М | 995.30 | 1699.51 |
| T, K | 120 | 120 |
| Кристаллическая система | Моноклинная | Моноклинная |
| Пр. гр. | P21/n | P21/c |
| Z | 4 | 4 |
| Z' | 1 | 1 |
| a, Å | 10.3980(13) | 10.524(3) |
| b, Å | 12.4045(16) | 17.089(5) |
| c, Å | 30.434(4) | 21.029(5) |
| α, град | 90 | 90 |
| β, град | 91.910(3) | 99.186(6) |
| γ, град | 90 | 90 |
| V, Å3 | 3923.3(9) | 3733.4(18) |
| ρвыч, г/см3 | 1.687 | 1.653 |
| μ, см–1 | 12.72 | 13.07 |
| F(000) | 2016 | 1896 |
| 2θmax, град | 54 | 54 |
| Число измеренных отражений | 32 634 | 26 283 |
| Число независимых отражений | 8565 | 8153 |
| Число отражений с I > 3σ(I) | 5801 | 4975 |
| Количество уточняемых параметров | 507 | 490 |
| R1 | 0.0650 | 0.0640 |
| wR2 | 0.1351 | 0.1824 |
| GOF | 1.053 | 0.997 |
| Остаточная электронная плотность (eÅ–3) (dmax/dmin) | 0.840/–0.821 | 1.268/–0.883 |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Трис-пиридиноксиматные псевдоклатрохелаты железа, никеля и кобальта(II) 1–3 с апикальным ферроценильным заместителем при сшивающем атоме бора были получены с приемлемым выходом (50–70%) по схеме 1 в кипящем этаноле в качестве растворителя темплатной конденсацией 2-ацетилпиридиноксима с ферроценилбороновой кислотой на соответствующем ионе М2+ как матрице. NaHCO3 прибавляли для нейтрализации выделяющихся ионов H+, а перхлорат-анион был выбран в качестве противоиона, поскольку он образует устойчивые ионные ассоциаты с крупными полуклатрохелатными катионами.
Состав и строение полученных новых дитопных соединений установлены с помощью элементного анализа, ЭСП, MALDI-TOF масс-спектрометрии и ЯМР-спектроскопии; их магнитные характеристики определены методом, описанным в Экспериментальной части.
В катионной области MALDI-TOF масс-спектров полученных ферроценилборатных трис-пиридиноксиматов 3d-металлов наблюдаются интенсивные пики соответствующих псевдоклатрохелатных катионов [M–${\text{ClO}}_{4}^{ - }$]+, характерные для ионных ассоциатов этого типа [23]. Экспериментально обнаруженное изотопное распределение в этих пиках хорошо согласуется с их теоретически рассчитанными моделями.
Число, положение и мультиплетность сигналов в 1H и 13C{1H} ЯМР-спектрах растворов полученных соединений, а также соотношение интегральных интенсивностей сигналов в спектрах 1H ЯМР подтвердили состав и симметрию их молекул. В спектрах диамагнитного комплекса железа(II) наблюдаются характеристические сигналы метильной группы и гетероциклического фрагмента хелатирующего лигандного синтона, а также характеристические сигналы апикального ферроценильного заместителя при атоме бора. Комплексы кобальта и никеля(II) с этим же псевдоинкапсулирующим лигандом являются высокоспиновыми парамагнитными соединениями, что следует из больших величин химических сдвигов сигналов лигандных протонов в их 1H ЯМР-спектрах (до почти 400 м.д. в случае соединений кобальта(II)). В последнем случае, по данным [11], преобладает псевдоконтакный вклад в величины химических сдвигов, который также оказывает влияние на положение сигналов протонов апикального ферроценильного заместителя (вызывает смещение этих сигналов в область слабых полей и значительное увеличение разницы между положениями сигналов протонов в его Ср-циклах). Соответствующие смещения химических сдвигов δ1Н увеличиваются для протонов тех групп, которые находятся ближе к инкапсулированному парамагнитному металлоцентру Со2+. В спектре 1Н ЯМР комплекса никеля(II) 3, напротив, превалирующим является контактный вклад [11], который оказывает влияние в основном на сигналы протонов хелатирующего лигандного синтона, практически не влияя при этом на сигналы протонов апикальной группы. Действительно, сигналы протонов ферроценильного заместителя в этом спектре имеют вид неразрешенного мультиплета, который незначительно (на ~0.6 м.д.) смещен в область сильных полей по сравнению с таковыми в спектре 1H ЯМР его диамагнитного Fe(II)-содержащего псевдоклатрохелатного аналога.
Разложение ЭСП раствора диамагнитного комплекса 1 в ацетонитриле (рис. 1а) позволило выделить в его видимой области три менее интенсивные (ε ∼ 2–5 × 103 моль–1 л см–1) полосы в диапазоне 430–485 нм, а также более интенсивную (ε ∼ 1.5 × 104 моль–1 л см–1) полосу около 520 нм. Все эти полосы были отнесены в [24] к полосам переноса заряда (ППЗ) металл–лиганд Fed → Lπ*. Большая серия полос, наблюдающаяся в УФ-области этого спектра, отнесена к π–π*-переходам как в хелатирующих пиридиноксиматных лигандных фрагментах, так и в ферроценильном заместителе при сшивающем атоме бора. Характерные для производных ферроцена [24] низкоинтенсивные (ε ∼ 30–150 моль–1 л см–1) полосы d–d-переходов в видимом диапазоне в области 350–450 нм маскируются вышеупомянутыми интенсивными ППЗ металл–лиганд. В спектре исходной ферроценилбороновой кислоты (рис. 1г) интенсивные (ε ∼ 3–30 × × 103 моль–1 л см–1) полосы ППЗ и малоинтенсивные (ε ∼ 30–120 моль–1 л см–1) полосы d–d-переходов наблюдаются в области 200–240 и при ~410 и 450 нм соответственно.
Рис. 1.
Разложение ЭСП ацетонитрильных растворов комплексов железа 1 (а), кобальта 2 (б), никеля(II) 3 (в) и исходной ферроценилбороновой кислоты (г) на их гауссовы компоненты. На вставках приведены фрагменты этих спектров в ближнем УФ-, видимом и ближнем ИК-диапазонах (г и в соответственно).
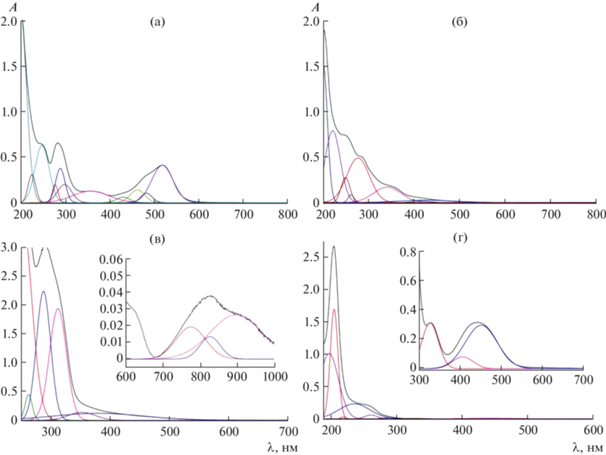
ЭСП его Со(II)-содержащего аналога 2 (рис. 1б), образованного тем же ферроценилсодержащим инкапсулирующим лигандом, содержит в УФ-области аналогичные лиганд-центрированные полосы, в то время как в видимой области обнаружены две значительно менее интенсивные (ε ∼ 6–8 × 102 моль–1 л см–1) полосы при 415 и 426 нм соответственно, отнесенные к d–d-переходам в апикальном ферроценильном заместителе. ЭСП их Ni(II)-содержащего аналога 3, помимо вышеупомянутых высокоинтенсивных лиганд-центрированных полос, содержит также низкоинтенсивные (ε ∼ 8–16 моль–1 л см–1) широкие полосы в области 770–900 нм, отнесенные к полосам d–d-переходов для гексакоординирующего иона Ni2+ [24, 25].
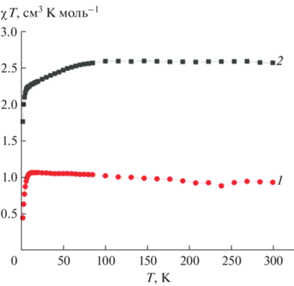
Вышеописанное спиновое состояние полученных псевдоклатрохелатов 3d-металлов было подтверждено данными магнитометрических экспериментов. Комплекс железа(II) 2 является диамагнитным соединением во всем исследованном диапазоне температур 3–300 K. Температурная зависимость магнитной восприимчивости для высокоспинового комплекса никеля(II) 3 с электронной конфигурацией d8 (рис. 2, кривая 1) свидетельствует о постоянстве величины χT = = 1.0 см3 K моль–1 до 10 K, что соответствует чисто спиновому значению, ожидаемому для системы с электронным спином S = 1. Уменьшение величины χT при температурах ниже 10 K связано, по-видимому, с эффектом насыщения под влиянием внешнего магнитного поля (эффект Зеемана) на заселенности квантовых магнитных уровней инкапсулированного иона Ni2+. Напротив, в случае высокоспинового псевдоклатрохелата кобальта(II) 2 с электронной конфигурацией d7 величины χT при температурах выше 100 K находятся в пределах 2.5–2.6 см3 K моль–1 (рис. 2, кривая 2), что выше чисто спиновой величины 1.87 см3 K моль–1 для системы с электронным спином S = 3/2. Это свидетельствует о наличии спин-орбитального взаимодействия в случае комплекса 2: уменьшение величины χT ниже 100 K обычно объясняется влиянием расщепления в нулевом поле, которое является следствием вышеупомянутого спин-орбитального взаимодействия кристаллического поля лигандов. Такие магнитные зависимости характерны для высокоспиновых псевдоклатрохелатов кобальта(II) этого типа с высокой магнитной анизотропией [11]. С другой стороны, ранее [26] было показано решающее влияние электростатического поля, обусловленного ферроценом, на увеличение магнитной анизотропии и, как следствие, эффективного энергетического барьера перемагничивания ферроценоилацетоната диспрозия.
Это также согласуется с данными рентгеноструктурного анализа трис-пиридиноксиматных псевдоклатрохелатов железа и никеля(II) (рис. 3). Их монокристаллы, полученные медленным упариванием растворов в смесях хлороформ–гептан и хлористый метилен–гексан, содержат две сольватные молекулы соответствующего хлорсодержащего органического растворителя на одну формульную единицу комплекса, т.е. являются кристаллосольватами состава 1 · 2CHCl3 и 3 · 2CH2Cl2.
Рис. 3.
Общий вид псевдоклатрохелатных катионов [Fe(AcPyOx)3(BFc)]+ (M = Fe2+) и [Ni(AcPyOx)3(BFc)]+ (M = Ni2+). Атомы водорода не показаны для ясности, а остальные атомы представлены в виде эллипсоидов тепловых колебаний (p = = 50%).
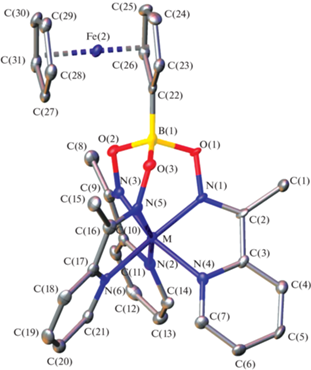
По результатам проведенного для них рентгенодифракционного исследования, ионы Fe2+ и Ni2+, инкапсулированные одним и тем же псевдомакробициклическим лигандом, при 120 K находятся в разных спиновых состояниях, что однозначно следует из анализа геометрических параметров соответствующих MIIN6-координационных полиэдров (табл. 2). Длины связей Ni–N (2.15–2.17 Å) иона никеля(II) с шестью донорными атомами азота трех хелатирующих пиридиноксиматных синтонов в псевдоклатрохелатном катионе [Ni(AcPyOx)3(BFc)]+ характерны для высокоспиновых комплексов этого иона с азотсодержащими гетероциклическими лигандами [27], тогда как в катионе [Fe(AcPyOx)3(BFc)]+ они незначительно превышают 2 Å, что указывает на низкоспиновое состояние иона Fe2+ [28–30]. Кроме того, их MIIN6-координационные полиэдры имеют геометрию, близкую к промежуточной между тригональной призмой (ТП, угол искажения φ = 0°) и тригональной антипризмой (ТАП, φ = 60°), однако степень этого искажения зависит от природы инкапсулированного иона металла. Его геометрия в катионе [Fe(AcPyOx)3(BFc)]+ ближе к ТАП, как и ожидалось для низкоспинового иона железа(II), тогда как в катионе [Ni(AcPyOx)3(BFc)]+ она ближе к ТП; соответствующие углы искажения φ составляют 35.3(2)° и 27.3(2)° соответственно (табл. 1). Для более надежного описания такого ТП–ТАП искажения удобно использовать так называемые “меры симметрии” [31]. Чем меньше величина “меры симметрии”, соответствующей выбранному идеальному многограннику, такому как ТП или ТАП, тем точнее координационный полиэдр может быть описан этим многогранником. Величины таких “мер симметрии”, оцененные на основе рентгенодифракционных данных для комплексов 1 · 2CHCl3 и 3 · 2CH2Cl2 с использованием программы Shape 2.1 [29] (табл. 2), позволяют описать геометрию координационного полиэдра FeN6 в псевдоклатрохелате железа(II) как искаженную ТП, а полиэдра NiN6 в его никель(II)-содержащем аналоге как искаженную ТАП.
Таблица 2.
Основные геометрические параметры псевдоклатрохелатных катионов [Fe(AcPyOx)3(BFc)]+ и [Ni(AcPyOx)3(BFc)]+
| Параметр | [Fe(AcPyOx)3(BFc)]+ | [Ni(AcPyOx)3(BFc)]+ |
|---|---|---|
| M–N, Å | 1.890(4)–2.003(4) | 2.151(7)–2.169(7) |
| φ, града | 35.3(2) | 27.3(2) |
| h, Åб | 2.247(3) | 2.417(3) |
| S(ТП)в | 7.908 | 4.729 |
| S(ТАП)в | 2.469 | 5.277 |
Схема 1.
ЗАКЛЮЧЕНИЕ
Таким образом, нами получены первые ферроценилборатные трис-пиридиноксиматные псевдоклатрохелаты железа, кобальта и никеля(II) и методом РСА установлена кристаллическая и молекулярная структура комплексов железа и никеля(II) этого типа. Их спиновые состояния и температурные зависимости магнитных свойств изучены с использованием метода магнитометрии.
Список литературы
Волошин Я.З., Белая И.Г., Кремер Р. Клеточные комплексы металлов: клатрохелаты возвращаются. М.: Граница, 2019.
Voloshin Y.Z., Novikov V.V., Nelyubina Y.V. et al. // Chem. Commun. 2018. V. 54. P. 3436.
Tomyn S., Shylin S.I., Bykov D. et al. // Nat. Commun. 2017. V. 8. P. 14099.
Shylin S.I., Pavliuk M.V., D’Amario L. et al. // Chem. Commun. 2019. V. 55. P. 3335.
Shylin S.I., Pavliuk M.V., D’Amario L. et al. // Faraday Discuss. 2019. V. 215. P. 162.
Shylin S.I., Pogrebetsky J.L., Husak A.O. et al. // Chem. Commun. 2021. V. 57. P. 11060.
Varzatskii O.A., Penkova L.V., Kats (Menkach) S.V. et al. // Inorg. Chem. 2014. V. 53. P. 3062.
Novikov V.V., Pavlov A.A., Nelyubina Y.V. et al. // J. Am. Chem. Soc. 2015. V. 137. P. 9792.
Pavlov A.A., Nelyubina Y.V., Kats S.V. et al. // J. Phys. Chem. Lett. 2016. V. 7. P. 4111.
Dudkin S.V., Belov A.S., Nelyubina Y.V. et al. // New J. Chem. 2017. V. 41. P. 3251.
Pavlov A.A., Savkina S.A., Belov A.S. et al. // Inorg. Chem. 2017. V. 56. P. 6943.
Varzatskii O.A., Kats S.V., Pavlov A.A. et al. // Inorg. Chim. Acta. 2018. V. 471. P. 413.
Pavlov A.A., Savkina S.A., Belov A.S. et al. // ACS Omega. 2018. V. 3. P. 4941.
Pavlov A.A., Aleshin D.Y., Savkina S.A. et al. // ChemPhysChem. 2019. V. 20. P. 1001.
Алешин Д.Ю., Павлов А.А., Белова С.А. и др. // Журн. неорган. химии. 2019. Т. 64. № 12. С. 1288. https://doi.org/10.1134/S0044457X1912002X
Belov A.S., Voloshin Y.Z., Pavlov A.A. et al. // Inorg. Chem. 2020. V. 59. P. 5845.
Hynes M.J., O’Shea M.T. // Dalton Trans. 1983. № 2. P. 331.
Aakeröy C.B., Sinha A.S., Epa K.N. et al. // Chem. Commun. 2012. V. 48. № 92. P. 11289.
Wojdyr M. // J. Appl. Crystallogr. 2010. V. 43. P. 1126.
Bain G.A., Berry J.F. // J. Chem. Educ. 2008. V. 85. № 4. P. 532.
Sheldrick G.M. // Acta Crystallogr., Sect. A. 2008. V. 64. P. 112.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Кац С.В., Севериновская О.В., Варзацкий О.А. и др. // Макрогетероциклы. 2015. Т. 8. № 3. С. 314.
Lever A.B.P. Inorganic Electronic Spectroscopy. Amsterdam: Elsevier, 1984.
Дудкин С.В., Савкина С.А., Белов А.С. и др. // Макрогетероциклы. 2018. Т. 11. С. 418.
Koroteev P.S., Dobrokhotova Z.V., Ilyukhin A.B. et al. // Dalton Trans. 2016. V. 45. P. 6405.
Ohtsu H., Tanaka K. // Inorg. Chem. 2004. V. 43. № 9. P. 3024.
Halcrow M.A. Spin-Crossover Materials: Properties and Applications. Chichester, United Kingdom: John Wiley & Sons Ltd., 2013.
Асаченко А.Ф., Топчий М.А., Зелинский Г.Е. и др. // Журн. неорган. химии. 2020. Т. 65. № 10. С. 1308. https://doi.org/10.31857/S0044457X20100025
Pomadchik A.L., Belov A.S., Lebed E.G. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. P. 1503. https://doi.org/10.1134/S0036023620100162
Alvarez S. // Chem. Rev. 2015. V. 115. P. 13447.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии