Журнал неорганической химии, 2022, T. 67, № 8, стр. 1108-1115
Синтез комплексов золота(I) C 10-(арил)феноксарсинами
М. Ф. Галимова a, *, А. Б. Добрынин a, Э. И. Мусина a, Р. Р. Мусин b, А. А. Карасик a
a Институт органической и физической химии им. А.Е. Арбузова ФИЦ Казанский научный центр РАН
420088 Казань, ул. Академика Арбузова, 8, Россия
b Казанский национальный исследовательский технологический университет
420015 Казань, ул. К. Маркса, 68, Россия
* E-mail: milya1949@mail.ru
Поступила в редакцию 14.03.2022
После доработки 18.03.2022
Принята к публикации 18.03.2022
- EDN: ISUMUW
- DOI: 10.31857/S0044457X22080128
Аннотация
Взаимодействием 10-(арил)феноксарсиновых лигандов с хлоро(тетрагидротиофен)золотом(I) в эквимолярном соотношении синтезирована серия димерных комплексов золота(I) состава L2Au2Cl2. Структура комплексов 4–6 подтверждена комплексом физико-химических методов анализа. Кристаллическая структура комплекса 4 подтверждена данными рентгеноструктурного анализа. Рассчитаны углы Толмана известных третичных арсиновых лигандов и полученных в данной работе лигандов в комплексах золота. Показано, что димерная структура комплексов формируется за счет аурофильного взаимодействия между двумя мономерами, при этом значительную роль играет величина угла Толмана феноксарсинового лиганда, которая в димерных комплексах составляет в среднем 147°.
ВВЕДЕНИЕ
Химия золота в настоящее время является одной из стремительно развивающихся областей науки, которая охватывает как синтетические аспекты, так и прикладные, включая применение комплексов золота в создании новых материалов [1, 2], биологии [3–5], медицине [5, 6], в гетерогенном и гомогенном катализе [7–10], о чем свидетельствует множество обзоров. Особое внимание при этом уделяется супрамолекулярной химии золота(I), главным образом, из-за наличия взаимодействий золото–золото, которые некоторые из комплексов проявляют в твердом состоянии [11]. Эти дисперсионные взаимодействия (называемые “аурофильными”) могут быть как внутри-, так и межмолекулярными. Расстояния золото–золото, наблюдаемые в соединениях, демонстрирующих аурофильные взаимодействия, находятся в интервале от 2.47 (расстояние, наблюдаемое для молекулы Au2 в газообразном состоянии) до 3.60 Å (сумма ван-дер-ваальсовых радиусов). Прочность аурофильных взаимодействий выше, чем для обычных ван-дер-ваальсовых связей (21–46 кДж моль–1), и сопоставима с водородной связью [12]. В химии фосфиновых комплексов золота(I) аурофильные взаимодействия, как правило, проявляются в формировании димеров, где две мономерные единицы [XAuL] (с атомом золота в линейной геометрии) связаны друг с другом. Эти взаимодействия часто наблюдаются для триалкилфосфинов с малыми коническими углами и отсутствуют в соединениях с объемными лигандами, например, в комплексах на основе триизопропилфосфина или трифенилфосфина (конический угол лиганда составляет 145°). В то же время не всегда наличие объемных арильных заместителей в фосфинах препятствует реализации аурофильных взаимодействий, в частности, для комплекса золота с P(Тоl-п)3 наблюдается аурофильное взаимодействие, расстояние Au⋯Au составляет 3.375 Å, несмотря на конический угол 145°. По-видимому, наличие аурофильных взаимодействий также сильно зависит от кристаллической упаковки и вклада других слабых взаимодействий [13].
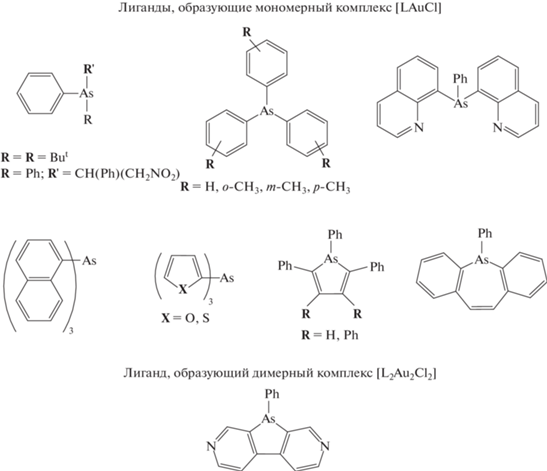
По сравнению с фосфиновыми лигандами комплексообразующие свойства мышьякорганических соединений по отношению к иону Au(I) исследованы значительно слабее [5]. Согласно теории Пирсона, арсиновые лиганды являются более мягкими основаниями по сравнению с фосфиновыми лигандами, что должно способствовать образованию димерных комплексов золота(I). Однако, согласно данным рентгеноструктурного анализа, большинство известных комплексов золота c третичными арсиновыми лигандами (трифениларсин [14], трис(п-толиларсин) [5], трис(м-толиларсин) [5], трис(o-толиларсин) [15], трис(1-нафтил)арсин [5], 2-(ди-трет-бутиларсин)бифенил [16], 2-нитро-(1-фенилэтил)(дифенил)арсин [17], трис(2-тиенил)арсин [18], трис(2-фурил)фосфин [18], 7-фенил-дибензоарсепин [19], фенилдихинолиниларсин [20] и фенилзамещенные арсолы [21, 22]) являются мономерными (рис. 1).
Известен лишь один представитель монодентатных третичных арсиновых лигандов – циклический дипиридиноарсол, который при взаимодействии с солями Au(I) образует димерный комплекс состава L2Au2Cl2 [23] (рис. 1).
Ранее показано [24, 25], что 10-(арил)феноксарсины образуют устойчивые комплексы с младшим представителем d10 металлов подгруппы меди – ионом меди(I), при этом формируются либо димерные комплексы, либо кубаноподобные Cu4I4 кластеры, в которых реализуется металлофильное взаимодействие.
В настоящей работе исследовали комплексообразование циклических арсиновых лигандов 10-(арил)феноксарсинов по отношению к хлориду золота(I) и возможность реализации аурофильных взаимодействий в них.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Метиленхлорид, этанол, диэтиловый эфир и бензол очищали и высушивали перед использованием [26].
Согласно известным методикам синтезировали следующие исходные соединения: 10-(арил)феноксарсины [27] и Au(tht)Cl, где tht = тетрагидротиофен [28]. Для синтеза 10-(арил)феноксарсинов использовали следующие реактивы: 10-хлорфеноксарсин [29], соответствующие алкилмагнийгалогениды, сульфат натрия (ч. д. а.), диэтиловый эфир, бензол, этанол и дистиллированную воду. Реактивы для синтеза Au(tht)Cl (тетрахлороаурат(III) водорода, тетрагидротиофен) использовали товарные без предварительной очистки (Aldrich).
Спектры протонного магнитного резонанса арсиновых лигандов приведены в [24, 30].
Масс-спектры матрично-активированной лазерной десорбция/ионизация (МАЛДИ) получали на масс-спектрометре Ultraflex III TOF/TOF (Bruker Daltonik GmbH, Германия), оснащенном лазером Nd:YAG (λ = 355 нм, частота 100 Гц), в линейном режиме с регистрацией положительно заряженных ионов. Масс-спектр получали с ускоряющим напряжением 25 кВ и временем задержки экстракции ионов 30 нс. Итоговый масс-спектр сформирован за счет многократного облучения лазером кристалла (50 лазерных импульсов). Использовали металлическую мишень MTP AnchorChipTM. На мишень последовательно наносили и упаривали 0.5 мкл 1%-ного раствора матрицы в ацетонитриле и 0.5 мкл 0.1%-ного раствора образца в метаноле. Данные получали с помощью программы FlexControl (Bruker Daltonik GmbH, Германия) и обрабатывали с помощью программы FlexAnalysis 3.0 (Bruker Daltonik GmbH, Германия).
Элементный анализ осуществляли на CHNS анализаторе EuroEA3028-HT-OM производства Eurovector SpA (Италия). Образцы взвешивали на микровесах Sartorius CP2P (Германия) в оловянных капсулах. Для проведения количественных измерений, оценки полученных данных использовали программное обеспечение Callidus 4.1.
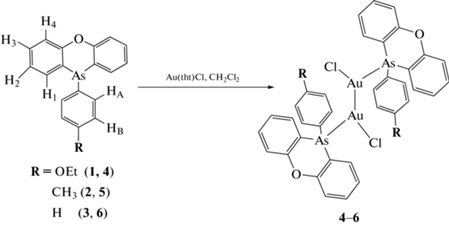
Комплексы 4–6 состава [Au2Cl2L2], где L = 10‑(п-этоксифенил)феноксарсин, 10-(п-толил)феноксарин и 10-фенилфеноксарсин, получали по однотипной методике синтеза. К раствору Au(tht)Cl (0.25 ммоль) в 3 мл дихлорметана при перемешивании добавляли соответствующий феноксарсиновый лиганд (0.25 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Растворитель упаривали, полученный осадок перекристаллизовывали из диэтилового эфира, промывали три раза диэтиловым эфиром, высушивали при пониженном давлении (2 × 10–2 мбар) в течение 3 ч.
Комплекс 4. Выход: 63%. tпл= 120–121°C. MS (МАЛДИ, m/z (Irel, %), ион): 1157.2 (100, [M–Cl]+). ЯМР 1H, м.д. (400 MГц, CDCl3): 1.37 (т, 3H, 3J = = 7.00 Гц, –CH3); 3.99 (кв, 3H, 3J = 7.00 Гц, O–CH2); 6.86 (д, 2H, 3J = 8.7 Гц, HB); 7.25 (тд, 2H, 3J21 = 3J23 = 7.4, 4J24 = 1.0 Гц, сигнал протона H2 перекрывается с растворителем); 7.37 (дд, 2H, 3J43 = = 8.2, 3J42 = 1.0 Гц, H4); 7.41 (д, 2H, 3J = 8.7 Гц, HA); 7.52 (ддд, 2H, 3J32 = 7.4, 3J34 = 8.2, 4J31 = 1.6 Гц, H3); 7.60 (дд, 2H, 3J12 = 7.4, 4J13 = 1.6 Гц, H1).
| C | H | Cl | Au | As | |
| Найдено, %: | 40.24; | 2.86; | 5.97; | 32.98; | 12.59. |
| Для C40H34As2Au2Cl2O4 | |||||
| вычислено, %: | 40.26; | 2.87; | 5.94; | 33.01; | 12.56. |
Комплекс 5. Выход: 79%. tпл = 195–196°C. MS (МАЛДИ, m/z (Irel, %), ион): 1097.3 (100, [M–Cl]+). ЯМР 1H, м.д. (400 MГц, CDCl3): 2.31 (с, 3H, –CH3); 7.17 (д, 2H, 3J = 8.0 Гц, HB); 7.25 (тд, 2H, 3J21 = 3J23 = = 7.5, 4J24 = 1.0 Гц, сигнал протона H2 перекрывается с растворителем); 7.36 (дд, 2H, 3J43 = 8.0, 3J42 = 1.0 Гц, H4); 7.38 (д, 2H, 3J = 8.0 Гц, HA); 7.53 (ддд, 2H, 3J32 = 7.5, 3J34 = 8.0, 4J31 = 1.5 Гц, H3); 7.62 (дд, 2H, 3J12 = 7.5, 4J13 = 1.5 Гц, H1).
| C | H | Cl | Au | As | |
| Найдено, %: | 40.25; | 2.62; | 6.29; | 34.79; | 13.24. |
| Для C38H30As2Au2Cl2O2 | |||||
| вычислено, %: | 40.27; | 2.67; | 6.26; | 34.76; | 13.22. |
Комплекс 6. Выход: 86%. tпл = 194 – 195 °C. MS (МАЛДИ, m/z (Irel, %), ион): 1069.2 (100, [M–Cl]+). ЯМР 1H, м.д. (400 MГц, CDCl3): 7.25 (тд, 2H, 3J21 = = 3J23 = 7.4, 4J24 = 1.1 Гц, H2); 7.31–7.41 (м, 5H, Ph); 7.46 (дд, 2H, 3J43= 8.2, 4J42=1.1 Гц, H4); 7.52 (ддд, 2H, 3J32 = 7.4, 3J34 = 8.2, 4J31 = 1.5 Гц, H3); 7.62 (дд, 2H, 3J12 = 7.4, 4J13 = 1.5 Гц, H1).
| C | H | Cl | Au | As | |
| Найдено, %: | 39.15; | 2.33; | 6.38; | 35.59; | 13.60. |
| Для C36H26As2Au2Cl2O2 | |||||
| вычислено, %: | 39.12; | 2.37; | 6.41; | 35.64; | 13.56. |
Рентгеноструктурный анализ. Кристаллы (C40H34As2Au2Cl2O4 ⋅ CHCl3, M = 1312.72), моноклинные, при 150 K a = 33.591(7), b = 13.237(3), c = = 24.401(9) Å, β = 125.805(2)°, V = 8799(4) Å3, Z = 8, пространственная группа C2/c, dвыч = 1.982 г/см3, μ = 8.497 мм–1, F(000) = 4976. Параметры ячейки и экспериментальные данные получены при T = = 150 K на автоматическом дифрактометре Bruker Kappa APEX II CCD [λ(MoKα) = 0.71073 Å, ω-сканирование], 2θ < 56°, Rint = 0.073. Измерено 38 833 отражений, из них 10 614 независимых, число наблюдаемых отражений с I > 2σ(I) 8434.
Структура расшифрована прямым методом по программе SHELXS-97 [31] и уточнена полноматричным МНК по программе SHELXL-2018/3 [32]. Все расчеты выполнены с использованием программ WinGX [33], окончательные значения факторов расходимости R 0.0378, wR2 0.0952, GOF = 0.99, число уточняемых параметров 489. Анализ межмолекулярных взаимодействий проведен с помощью программы PLATON [34]. Рисунок сделан в программе MERCURY [35].
Координаты атомов и структурные параметры кристаллов 4 депонированы в Кембриджской базе кристаллоструктурных данных (CCDC 2143396).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Комплексы 4–6 синтезированы взаимодействием 10-(арил)феноксарсинов 1–3 с Au(tht)Cl в эквимолярном соотношении в хлористом метилене (схема 1 ).
Схема 1 . Синтез комплексов золота Au(I) 4–6.
После удаления растворителя и кристаллизации из диэтилового эфира получены комплексы 4–6 в виде белых порошков, хорошо растворимых в дихлорметане, хлороформе и ацетонитриле.
Структура комплексов установлена комплексом физико-химических методов анализа (ФХМА). В масс-спектрах МАЛДИ комплексов 4–6 регистрируется ион, соответствующий составу [M–Cl]+, что свидетельствует о димерной структуре полученных комплексов, а данные элементного анализа свидетельствовали об образовании комплекса состава L2Au2Cl2. Спектры ПМР комплексов 4–6 в CDCl3 показывают сдвиг сигналов протонов в слабые поля по сравнению со свободным лигандом, в частности, протоны при атомах углерода, близких к атомом мышьяка, смещены на 0.13–0.15 м.д. в случае протона H1, и на 0.23–037 м.д для протона HA, что также подтверждает координацию атома мышьяка по атому золота.
Структура соединения 4 установлена методом рентгеноструктурного анализа. Желтоватые монокристаллы соединения 4, пригодные для РСА, получены медленной диффузией диэтилового эфира в насыщенный раствор комплекса в хлороформе. Проведенный РСА комплекса 4 свидетельствует о димерной структуре комплекса (рис. 2).
Рис. 2.
Молекулярная структура комплекса 4. Молекула растворителя не показана для упрощения рисунка.
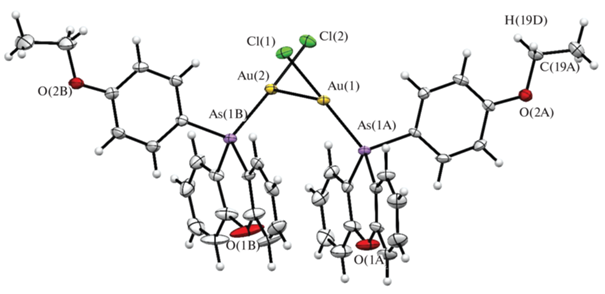
Комплекс 4 кристаллизуется в моноклинной пр. гр. C2/c в виде кристаллосольвата с одной молекулой хлороформа. Атомы золота имеют линейную геометрию (без учета Au…Au взаимодействия), углы As–Au–Cl составляют 173.40° и 175.55°. Расстояние Au…Au меньше суммы ван-дер-ваальсовых радиусов и составляет 2.979 Å, что и сопоставимо с расстоянием Au…Au в комплексе золота(I) на основе дипиридиноарсола (3.077 Å) [23]. Длина связей Au–As составляет 2.337 и 2.338 Å, что больше, чем в комплексах золота с третичными фосфинами [36], и сопоставимо с катионными комплексами золота(I) на основе PPh3 [37]; расстояния Au–Cl составляют 2.291 и 2.294 Å. Феноксарсиновые фрагменты двух лигандов в комплексе 4 практически плоские и находятся в стабилизирующей молекулу стекинг-конформации. Выбранные длины связей (Å) и углы (градусы) в комплексе 4 приведены в табл. 1.
Таблица 1.
Избранные геометрические параметры
| Параметр | 4 |
|---|---|
| Au1–Au2 | 2.9786(13) |
| Au1–Cl1 | 2.2907(19) |
| Au2–Cl2 | 2.2931(18) |
| Au1–As1A | 2.3378(11) |
| Au2–As1B | 2.3367(11) |
| As1A–C13A | 1.918(6) |
| As1B–C13B | 1.917(6) |
| As1A–Au1–Cl1 | 174.55(6) |
| As1B–Au2–Cl2 | 173.40(6) |
| Au1–As1A–C13A | 112.88(18) |
| Au2–As1B–C13B | 114.19(18) |
| C1A–As1A–C12A | 98.1(3) |
| C1B–As1B–C12B | 97.8(3) |
Как было отмечено, стерические особенности лигандов играют важную роль в формировании димерных комплексов золота(I). Известно, что наиболее информативным для определения стерической загруженности лиганда является его конический угол, поэтому в данной работе были рассчитаны и проанализированы конические углы Толмана арсиновых лигандов как в известных комплексах, так и в новых на основе 10-(п-этоксифенил)феноксарсина.
Конические углы Толмана (Θ) соединений были рассчитаны по формуле [38]:
где ${{{{\theta }}}_{i}}$ – половинные конические углы для каждого заместителя у атома мышьяка.Значение ${{{{\theta }}}_{i}}$ рассчитано по формуле:
Расчет конических углов Толмана арсиновых лигандов в комплексах Au (I) представлен в табл. 2. Видно, что конический угол дипиридиноарсола в димерном комплексе L2AuCl2 составляет 134°, что меньше конических углов Толмана, рассчитанных для арсиновых лигандов в мономерных комплексах золота(I) (150°–192°). Конический угол Толмана для двух молекул 10-(п-этоксифенил)феноксарсина в комплексе 4 составляет 142° и 151°, что меньше или равно наблюдаемым для лигандов в мономерных комплексах. Вероятно, реализация межмолекулярных аурофильных взаимодействий в комплексе 4 также, как это было показано для фосфиновых комплексов [13], в значительной мере зависит и от кристаллической упаковки и наличия/отсутствия других слабых внутри- и межмолекулярных взаимодействий. При анализе данных РСА кристаллической упаковки комплекса 4 обнаружили лишь взаимодействия C–H…Cl-типа, которые приводят к образованию слоев вдоль оси 0b (рис. 3). Параметры межмолекулярных контактов в кристалле соединения 4 представлены в табл. 3. В то же время в кристалле присутствует большое количество внутримолекулярных слабых π–π-взаимодействий, стабилизирующих димерную структуру.
Таблица 2.
Расчет конических углов арсиновых лигандов на основе данных РСА
| Лиганд | Расстояние (H–M) | Угол (H–M–As), град | Половинный конический угол заместителя | Конический угол |
|---|---|---|---|---|
| Комплекс LAuCl | ||||
| Трис(2-тиенил)арсин | 3.648 3.387 3.408 |
57.45 64.29 63.30 |
73.36 81.46 80.36 |
157 |
| Фенилдихинолиниларсин | 4.369 3.136 4.517 |
82.54 63.23 79.63 |
95.77 81.83 92.42 |
180 |
| 7-Фенил-дибензоарсепин | 3.006 2.996 4.016 |
64.57 65.33 46.43 |
84.00 84.83 60.85 |
153 |
| 1,2,5-Трифенил-1H-арсол | 3.380 7.106 6.981 |
59.35 65.03 68.00 |
76.56 73.12 76.24 |
151 |
| Трифениларсин | 3.235 3.725 3.241 |
61.20 53.29 58.94 |
79.21 68.86 76.91 |
150 |
| Трис(1-нафтил)арсин | 4.708 4.730 4.877 |
85.51 84.42 81.03 |
97.77 96.63 92.86 |
192 |
| Трис(о-толил)арсин* | 2.753 2.992 3.032 |
69.05 72.07 77.94 |
90.35 91.60 97.20 |
186 |
| 2.813 2.907 2.796 |
71.63 71.76 75.89 |
92.45 91.88 96.85 |
188 | |
| Комплекс L2AuCl2 | ||||
| Дипиридиноарсол | 4.071 4.134 3.145 |
49.58 47.92 62.38 |
63.80 61.92 80.92 |
134 |
| 10-(п-Этоксифенил)феноксарсин** | 3.099 3.988 3.647 |
63.53 46.51 53.26 |
82.86 61.03 69.17 |
142 |
| 3.032 3.421 3.703 |
64.76 56.75 52.76 |
84.02 73.75 68.43 |
151 | |
Рис. 3.
Кристаллическая упаковка соединения 4 вдоль оси 0b и 0c, соответственно (показаны CH…Cl взаимодействия).
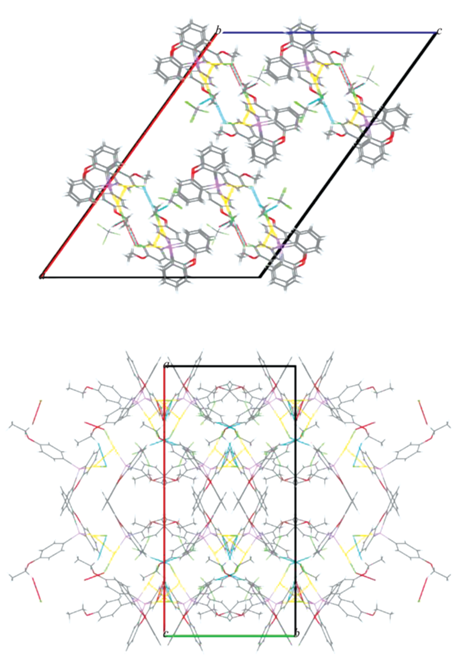
Таблица 3.
Параметры межмолекулярных контактов в кристалле соединения 4
| D—H⋅⋅⋅A | D—H, Å | H⋅⋅⋅A, Å | D⋅⋅⋅A, Å | DHA, град | Операции симметрии |
|---|---|---|---|---|---|
| C19A–H19D⋅⋅⋅ Cl1' | 0.9900 | 2.7800 | 3.673(7) | 151.00 | 1/2–x, –1/2 + y, 1/2 – z |
| C100– H100⋅⋅⋅Cl2’ | 1.0000 | 2.4900 | 3.452(9) | 161.00 | x,1 + y,z |
Таким образом, малые конические углы феноксарсинового лиганда и наличие стабилизирующих внутримолекулярных взаимодействий в комплексе 4 способствуют реализации димерной структуры с аурофильным взаимодействием.
ЗАКЛЮЧЕНИЕ
Взаимодействие феноксарсиновых лигандов с хлоро(тетрагидротиофен)золотом(I) приводит к образованию нейтральных димерных комплексов с As-монодентатной координацией лигандов. Показано, что в случае комплексов с третичными арсиновыми лигандами реализация аурофильных взаимодействий зависит как от стерических свойств используемого лиганда, так и от стабилизации такой структуры за счет внутри- или межмолекулярных взаимодействий.
Список литературы
Grzelczak M., Perez-Juste J., Mulvaney P. et al. // Chem. Soc. Rev. 2008. V. 37. № 9. P. 1783. https://doi.org/10.1039/B711490G
Hakkinen H. // Chem. Soc. Rev. 2008. V. 37. P. 1847. https://doi.org/10.1039/B717686B
Sperling R. A., Rivera Gil P., Zhang F. et al. // Chem. Soc. Rev. 2008. V. 37. P. 1896. https://doi.org/10.1039/B712170A
Wilson R. // Chem. Soc. Rev. 2008. V. 37. P. 2028. https://doi.org/10.1039/B712179M
Shawkataly Ob., Goh C.-P., Tariq A. et al. // Plos One. 2015. V. 10. № 3. e0119620. https://doi.org/10.1371/journal.pone.0119620
Mironov I.V., Kharlamova V.Yu. // Russ. J. Inorg. Chem. 2018. V. 63. № 7. P. 978. https://doi.org/10.1134/S0036023618070173
Della Pina C., Falletta E., Prati L. et al. // Chem. Soc. Rev. 2008. V. 37. P. 2077. https://doi.org/10.1039/B707319B
Chen M., Goodman D.W. // Chem. Soc. Rev. 2008. V. 37. P. 1860. https://doi.org/10.1039/B707318F
Schmidbaur H., Schier A. // Z. Naturforsch. 2011. V. 66. № 4. P. 329. https://doi.org/10.1515/znb-2011-0401
Marion N., Nolan S. // Chem. Soc. Rev. 2008. V. 37. P. 1776. https://doi.org/10.1039/B711132K
Ionov S.P., Kuznetsov N.T. // Russ. J. Coord. Chem. 2001. V. 27. № 9. P. 628. https://doi.org/10.1023/A:1017945404464
Sarcher C., Farsadpour S., Taghizadeh Ghoochany L. et al. // Dalton Trans. 2014. V. 43. P. 2397. https://doi.org/10.1039/C3DT52893F
Barnes N.A., Brisdon A.K., William Brown F.R. et al. // Dalton Trans. 2011. V. 40. P. 1743. https://doi.org/10.1039/C3DT52893F
Weissbart B., Larson L.J., Olmstead M.M. et al. // Inorg. Chem. 1995. V. 34. P. 393. https://doi.org/10.1021/ic00105a060
Barnes N.A., Flower K.A., Godfrey S.M. et al. // CrystEngComm. 2010. V. 12. P. 4240. https://doi.org/10.1039/C0CE00024H
Carreras J., Pereira A., Zanini M. et al. // Organometallics 2018. V. 37. P. 3588. https://doi.org/10.1021/acs.organomet.8b00276
Tay W.S., Yang X.-Y., Li Y. et al. // Chem. Commun. 2017. V. 53. P. 6307. https://doi.org/10.1039/C7CC02044A
Monkowius U., Nogai S., Schmidbau H. // Z. Naturforsch. 2003. V. 58b. P. 751. https://doi.org/10.1515/znb-2003-0806
Kawashima I., Imoto H., Ishida M.et al. // Angew. Chem. Int. Ed. 2019. V.58. № 34. P. 11686. https://doi.org/10.1002/anie.201904882
Kihara H., Tanaka S., Imoto H. et al. // Eur. J. Inorg. Chem. 2020. V.2020. № 38. P. 3662. https://doi.org/10.1002/ejic.202000542
Imoto H., Urushizaki A., Kawashima I. et al. // Chem. Eur. J. 2018. V. 24. № 35. P. 8797. https://doi.org/10.1002/chem.201801589
Ishidoshiro M., Matsumura Y., Imoto H. et al. // Org. Lett. 2015. V. 17. № 19. P. 4854. https://doi.org/10.1021/acs.orglett.5b02416
Fujii T., Tanaka S., Hayashi S. et al. // Chem. Commun. 2020. V.56. P. 6035. https://doi.org/10.1039/D0CC02389B
Musina E.I., Galimova M.F., Musin R.R. et al. // ChemistrySelect. 2017. V. 2. P. 11755. https://doi.org/10.1002/slct.201702031
Galimova M.F., Zueva E.M., Dobrynin A.B. et al. // Dalton Trans. 2020. V. 49. P. 482. https://doi.org/10.1039/C9DT04122B
Гордон А., Форд Р. Спутник химика. Физико-химические свойства, методики, библиография / Пер. с англ. под ред. Розенберга Е.Л., Коппель С.И. М.: Мир, 1976.
Гаврилов В. И., Хлебников В.Н., Комлева А.А. и др. // Журн. общ. химии 1974. Т. 44. № 11. С. 2506.
Hashmi A.S.K., Hengst T., Lothschütz C. et al. // Adv. Synthesis Catalysis. 2010. V. 352. № 8. P. 1315. https://doi.org/10.1002/adsc.201000126
Гаврилов В.И., Гаврилова Г.Р., Хлебников В.Н. и др. // Известия ВУЗов. Химия и хим. технол. 1973. Т. 16. С. 1602.
Galimova M.F., Begaliev T.A., Zueva E.M. et al. // Inorg. Chem. 2021. V. 60. № 9. P. 6804. https://doi.org/10.1021/acs.inorgchem.1c00672
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Crystallogr. 2008. V.64. P. 112. https://doi.org/10.1107/S0108767307043930
Sheldrick G.M. // Acta Crystallogr., Sect. C: Cryst. Struct. Commun. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Farrugia L.J. // J. Appl. Crystallogr. 1999. V. 32. P. 837. https://doi.org/10.1107/S0021889899006020
Spek A.L. // Acta Crystallogr., Sect D: Biol. Crystallogr. 2009. V. 65. P. 148. https://doi.org/10.1107/S090744490804362X
Macrae C.F., Bruno I.J., Chisholm J.A. et al. //J. Appl. Crystallogr. 2008. V. 41. P. 466. https://doi.org/10.1107/S0021889807067908
Spiridonova Yu.S., Strelnik I.D., Musina E.I. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 7. P. 477. https://doi.org/10.1134/S107032842007009X
Avdeeva V.V., Malinina E.A., Belousova O.N. et al. // Russ. J. Inorg. Chem. 2011. V. 56. № 4. P. 524. https://doi.org/10.1134/S003602361104005X
Tolman A.C. // Chem. Rev. 1977. V. 77. № 3. P. 313. https://doi.org/10.1021/cr60307a002
Дополнительные материалы
- скачать ESM.docx
- Приложение 1.
Инструменты
Журнал неорганической химии