Журнал неорганической химии, 2022, T. 67, № 8, стр. 1175-1182
Модификация поверхности угольных электродов наночастицами оксида марганца
В. В. Чернявина a, *, А. Г. Бережная a, Я. А. Дышловая a
a Южный федеральный университет
344090 Ростов-на-Дону, ул. Зорге, 7, Россия
* E-mail: vchernyavina@yandex.ru
Поступила в редакцию 08.12.2021
После доработки 10.02.2022
Принята к публикации 11.02.2022
- EDN: ULJOYG
- DOI: 10.31857/S0044457X22080074
Аннотация
Композит МnO2/С получен методом катодного электрохимического осаждения в различных условиях. Исследованы структурные характеристики и элементный состав МnO2/С методом энергодисперсионного микроанализа с использованием комплексного аналитического прибора на сканирующем электронном микроскопе VEGA II LMU и системой микроанализа INCA ENERGY450/XT с детектором X-Act DDD. Электрохимические характеристики электродов определены методами циклической вольт-амперометрии, гальваностатического заряда-разряда и импедансной спектроскопии. Показано, что активированный уголь марки Norit DLS SUPRA 50 можно использовать в качестве материала подложки для электроосаждения MnO2. Установлена зависимость электрохимических свойств композитных электродов МnO2/С от условий электрохимического осаждения. Емкостные характеристики композита МnO2/С на 30% больше по сравнению с угольным электродом, что делает его перспективным материалом электрода для электрохимических конденсаторов на водном электролите.
ВВЕДЕНИЕ
Постоянно растущий спрос на энергию способствует поиску новых материалов, а также разработке и усовершенствованию технических характеристик устройств накопления заряда. Среди таких систем выделяют электрохимические конденсаторы (ЭХК) из-за их способности к быстрому заряду-разряду, высокой удельной мощности и циклической стабильности. В настоящее время ЭХК используются совместно с аккумуляторами для обеспечения дополнительной мощности в электромобилях, локомотивах, системах бесперебойного электропитания и т.д. ЭХК не могут использоваться в качестве автономных устройств, поскольку их удельная энергия ниже, чем у батарей [1]. Удельная мощность и срок службы электрохимических конденсаторов намного больше, чем литий-ионных аккумуляторов. Повысить энергию и удельную мощность ЭХК можно за счет использования новых электродных материалов и разных электролитов, а также путем разработки оригинальной конструкции устройства в зависимости от сферы использования [2].
Для изготовления электродов ЭХК используют разные типы материалов: углеродистые материалы, оксиды/гидроксиды переходных металлов и проводящие полимеры [3–8]. Главным недостатком углеродных материалов является их небольшая емкость, что ограничивает их применение.
Емкостные свойства углеродных материалов повышают за счет введения проводящих полимеров или оксидов металлов. Среди оксидов переходных металлов выделяют MnO2 благодаря низкой стоимости, экологичности и высокой теоретической удельной емкости (1370 Ф/г) [9]. Кроме того, он обладает широким рабочим потенциалом в нейтральных водных электролитах по сравнению с другими оксидами переходных металлов, используемыми в кислотных и щелочных электролитах [10]. Однако MnO2 имеет низкую удельную электропроводность (10–5–10–6 См/см), что ограничивает достижение высокой теоретической емкости [11].
Перспективным подходом к решению этой проблемы является включение MnO2 в электропроводящие каркасы, такие как графен, углеродные нанотрубки, проводящие полимеры и мезопористые угли. Углеродные каркасы формируют пористую структуру, которая обеспечивает диффузию ионов электролита и увеличение электрической емкости. Кроме того, снижается сопротивление переноса электронов, что компенсирует низкую проводимость оксида марганца. Механизм накопления заряда в композитных электродах MnO2/С основан на сочетании двойнослойного процесса и фарадеевских окислительно-восстановительных реакций, которые наблюдаются на границе раздела между оксидом и раствором электролита, обеспечивая, таким образом, псевдоемкость [12, 13].
Электрохимические свойства MnO2 определяются химической структурой, морфологией поверхности, пористостью и электрической проводимостью [14, 15].
Авторами [16] методом химического осаждения получены α-, β-, γ- и δ-MnO2. Установлено, что емкостные характеристики любой фазы MnO2 снижаются с увеличением кристалличности, а слабокристаллизованный α-MnO2 обладает самой высокой удельной емкостью (200 Ф/г) при плотности тока 1 А/г.
В работе [17] получен композит MnO2/C методами анодного и катодного электроосаждения оксида марганца на подложку мезопористого углерода с высокой удельной площадью поверхности. Согласно результатам рентгенофазового анализа, MnO2 эффективно осаждается на подложку как при анодном, так и при катодном электроосаждении. Электрохимические измерения показали, что емкостное поведение композита зависит от метода получения оксида марганца. При анодном осаждении наблюдается равномерная пленка α-MnO2, а при катодном осаждении частицы γ-MnO2 имеют игольчатое строение. Композитный электрод γ-MnO2/С, полученный в результате катодного осаждения, демонстрирует высокую удельную емкость и циклическую стабильность.
Наночастицы оксида марганца с различной морфологией были получены методом анодного электроосаждения путем регулирования концентрации серной кислоты и плотности тока осаждения [18]. Композитные электроды с наносферами, нанолистами, наноцветками, наностержнями имели удельные емкости 134, 226, 235 и 362.5 Ф/г при скорости заряда-разряда 0.5 А/г соответственно.
Оксид марганца синтезирован методом электрохимического осаждения при плотности тока 0.5 А/г с изменением частоты вращения от 0 до 4000 об/мин при 25°С в течение 90 мин [19]. Установлено, что удельная емкость (Суд) и удельная площадь поверхности зависят от частоты вращения. Максимальное значение Суд = 277.9 Ф/г было получено для электродного материала MnO2 при частоте вращения 3000 об/мин.
Цель настоящей работы – исследование характеристик композитных электродов MnO2/С, полученных методом электрохимического осаждения в разных условиях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Рабочие электроды изготавливали путем смешивания активированного угля, поливинилиденфторида в N-метилпирролидоне до образования суспензии, которую наносили на никелевую фольгу и сушили при 60°С до постоянного веса. Удельная масса активного материала на электроде составляла 5–6 мг/см2.
Исследование микроструктуры и элементного состава образцов выполняли на растровом электронном микроскопе Vega II LMU (фирмы Tescan) с системой энергодисперсионного микроанализа Inca Energy 450/XT (детектор Silicon Drift).
Электрохимическое осаждение и измерения проводили на потенциостате-гальваностате Р-30J (ООО “Элинс”, Россия) в стандартной трехэлектродной ячейке. В качестве электрода сравнения использовали насыщенный хлорсеребряный электрод, противоэлектродом служил стеклоуглерод. Стеклоуглеродный электрод представлял собой стеклоуглеродную пластину (стеклоуглерод марки СУ-2000) площадью 1 см2 с медным токоподводом.
Оксид марганца получали методом катодного электроосаждения на угольных электродах, изготовленных из активированного угля марки Norit DLS Supra 50. Электрохимическое осаждение проводили в диапазоне потенциалов –0.2–0.3 В в течение 15 мин в растворе следующего состава: 0.01 М KMnO4 + 0.1 М Na2SO4. В результате протекания окислительно-восстановительной реакции на поверхности угольного электрода осаждался оксид марганца:
Электрохимические измерения проводили в 1 М водном растворе сульфата натрия. По результатам циклической вольт-амперометрии рассчитывали удельную емкость:
(1)
${{С}_{{{\text{уд}}}}} = ~\frac{1}{{m\nu ~\left( {{{E}_{k}} - {{E}_{{\text{н}}}}} \right)~}}\int\limits_{{{E}_{{\text{н}}}}}^{{{E}_{k}}} {I\left( E \right)dE} ,~$Расчет удельной емкости по гальваностатическому методу заряда-разряда проводили по формуле:
где I, ΔЕ, Δτ – ток, интервал напряжений и время заряда или разряда соответственно.Импедансные измерения проводили на импедансметре Z-500P (Electrochemical Instruments, Россия) в двухэлектродной ячейке с одинаковыми электродами при потенциале 0 В в интервале частот от 50 мГц до 500 кГц.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Получение композитных материалов методом электрохимического осаждения в разных условиях позволяет контролировать морфологию и микроструктуру поверхности. В связи с этим композиты MnO2/С получали при изменении времени или потенциала электроосаждения, далее методом циклической вольтамперометрии определяли удельную емкость угольного электрода до и после электрохимического осаждения.
На рис. 1 представлены циклические кривые для угольного и композитных электродов MnO2/С, полученных электроосаждением при потенциале 0.2 В и разном времени. Вид циклической кривой для композитов отличается от таковой для угольного электрода.
Рис. 1.
Циклические вольт-амперные кривые, снятые со скоростью развертки потенциала ν = 5 мВ/с для угольного электрода и композитов MnO2/С, полученных при Е = 0.2 В и разном времени электрохимического осаждения
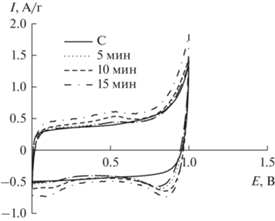
Для композита MnO2/С, полученного при времени электрохимического осаждения 15 мин, наблюдается наибольшее увеличение удельного тока на циклических кривых. Реализуется максимальное увеличение удельной емкости (Суд) на 30–35 Ф/г по сравнению с Суд угольного электрода, которая составляет 90–95 Ф/г. При увеличении времени осаждения до 20 мин наблюдается снижение площади, ограниченной кривой ЦВА, что свидетельствует об уменьшении удельной емкости. Вероятно, в этих условиях электроосаждения образуется более плотный слой диоксида марганца, что приводит к уменьшению активной площади поверхности и препятствует доступу ионов внутрь пористой структуры композита.
Исследованы электрохимические свойства композитных электродов MnO2/С, полученных при одинаковом времени электроосаждения 15 мин, но разном потенциале Е. Вид циклических кривых для композитов (рис. 2) показывает, что в диапазоне Е электрохимического осаждения от –0.1 до 0.2 В сохраняется прямоугольная рабочая область потенциалов и максимальное значение Суд.
Рис. 2.
Вольт-фарадные циклические кривые, снятые со ν = 5 мВ/с для угольного и композитных электродов MnO2/С, полученных при электрохимическом осаждении в течение 15 мин при разных потенциалах.
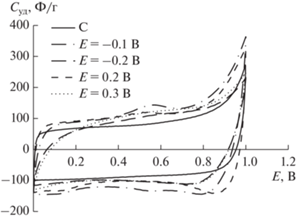
На основании предварительных исследований были подобраны оптимальные условия электроосаждения с целью получения MnO2/С с высокими электрохимическими свойствами. Дальнейшие исследования проводили с композитами, полученными при времени осаждения 15 мин и постоянном потенциале 0.2 В.
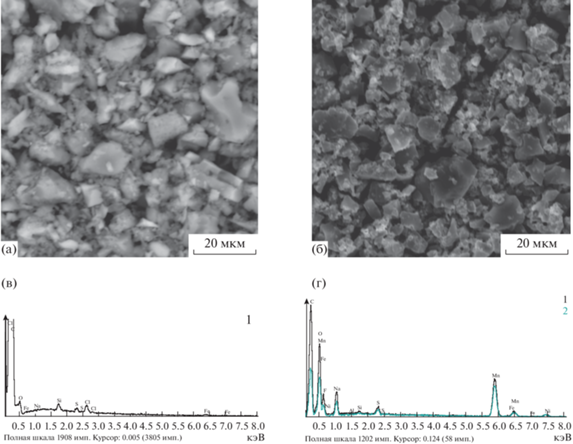
Для уточнения поверхностного химического состава и однородности распределения соответствующих элементов проводили СЭМ-EDX исследование в разных точках поверхности (рис. 3). Морфология поверхности изменяется после осаждения оксида марганца на угольный электрод (рис. 3а, 3б). В присутствии оксида марганца на СЭМ-микрофотографии наблюдаются более светлые фазы и участки (рис. 3б). Спектры EDX показывают присутствие элемента Mn в случае композитного электрода, в отличие от угольного электрода (рис. 3в, 3г).
Ранее [20] установлено, что углеродный материал Norit DLС Supra 50 представляет собой совокупность частиц, близких к сферической форме, размером 30–50 нм. В процессе электрохимического осаждения наночастицы оксида марганца равномерно распределяются по поверхности и закрепляются на сферических частицах активированного угля.
Изменение формы циклических кривых и удельной емкости композитных электродов по сравнению с угольным электродом связано как с увеличением активной площади поверхности, так и с псевдоемкостью MnO2 (рис. 4, табл. 1). Удельная емкость композита MnO2/С больше, чем Суд угольного электрода при всех скоростях развертки потенциала.
Рис. 4.
Циклические вольт-амперные кривые для С (1) и MnO2/С (2), снятые при ν = 5 (а), 25 (б), 50 мВ/с (в).
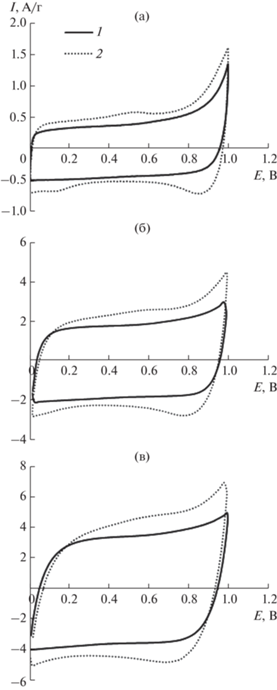
Таблица 1.
Удельная емкость Суд (Ф/г) угольного и композитного электродов при скорости развертки потенциала ν, мВ/с
| Электрод | Удельная емкость Суд (Ф/г) композитных электродов при скорости развертки потенциала ν, мВ/с | |||||
|---|---|---|---|---|---|---|
| 2 | 5 | 10 | 25 | 50 | 100 | |
| С | 124 | 95 | 85 | 74 | 69 | 62 |
| MnO2/С | 153 | 126 | 112 | 98 | 87 | 75 |
Существует два механизма, объясняющих псевдоемкостное поведение композитных электродов, одним из основных компонентов которых является оксид марганца. Первый основан на интеркаляции-деинтеркаляции протонов и катионов щелочных металлов в мезопоры оксида марганца при восстановлении и окислении [21], который можно представить как
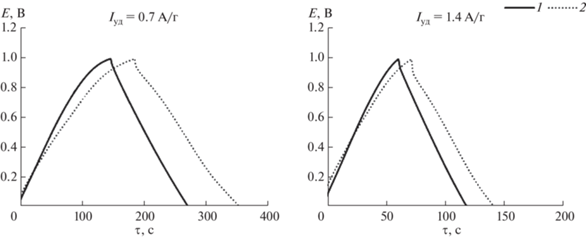
На рис. 5 при удельных токах заряда-разряда Iз/р = 0.7 и 1.4 А/г для всех электродов наблюдаются симметричные кривые заряда-разряда, что указывает на обратимость процессов. Для композита MnO2/С (рис. 5, кривая 2) реализуется более длительный по времени заряд-разряд по сравнению с угольным электродом С (рис. 5, кривая 1).
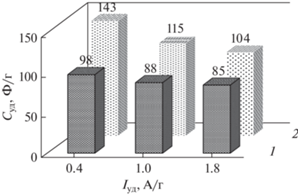
Удельная емкость композита MnO2/С при небольших токах заряда-разряда (Iуд = 0.4 А/г) увеличивается на 45 Ф/г по сравнению с Суд угольного электрода, которая составляет 98 Ф/г (рис. 6). При Iуд = 1.8 А/г увеличение Суд для композита составляет всего 19 Ф/г, что связано с диффузионными ограничениями, возникающими при высоких токах заряда-разряда.
Для определения сопротивления были проанализированы спектры импеданса методом подбора эквивалентной схемы с помощью программы EIS Spectrum Analyser. Эквивалентная схема включает СPE1-элемент постоянного сдвига фаз, эквивалентное последовательное сопротивление электролита R1, сопротивление переноса заряда R2, сопротивление Варбурга W1 (рис. 7).
Рис. 7.
Диаграммы Найквиста, полученные при 50 мГц–500 кГц в 1 М растворе Na2SO4 для электродов С (1) и MnO2/С (2).
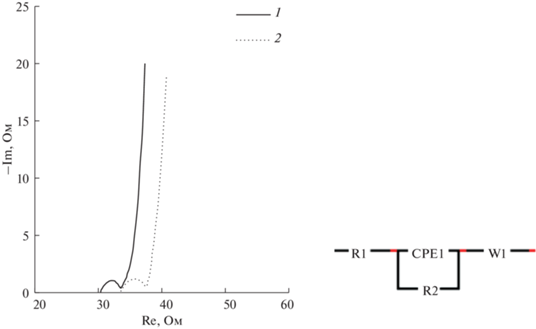
Кривые для электродов С (1) и MnO2/С (2) имеют одинаковый вид (рис. 7). В области высоких частот наблюдается полукруг, который определяет сопротивление переноса заряда R2 на границе раздела электрод/электролит. Сопротивление R2 зависит от пористости электрода. Пересечение графика Найквиста с действительной осью представляет собой эквивалентное последовательное сопротивление электролита R1, контактное сопротивление активного материала к токоотводу и внутреннее сопротивление активного материала.
Анализ результатов импедансных измерений показывает, что сопротивление композитного электрода немного увеличивается по сравнению с угольным электродом. В случае композитного электрода MnO2/С R1 = 33.4 Ом, R2 = 3.5 Ом, а для угольного электрода R1 = 30.4 Ом, R2 = 2.8 Ом. Несмотря на небольшое увеличение сопротивления для MnO2/С, наклонная линия в области низких частот имеет почти вертикальное расположение, свидетельствующее о хорошем емкостном поведении материалов.
ЗАКЛЮЧЕНИЕ
Таким образом, активированный уголь марки Norit DLS Supra 50 можно использовать в качестве материала подложки для электроосаждения MnO2. Установлена зависимость электрохимических свойств композитных электродов MnO2/С от условий электрохимического осаждения. Показано, что емкостные характеристики композита MnO2/С выше по сравнению с таковыми для угольного электрода. Композитный электрод MnO2/С, полученный методом электрохимического осаждения, является перспективным материалом для использования в качестве электродов электрохимических конденсаторов.
Список литературы
Simon P., Gogotsi Y. // Nature Mater. 2008. V. 7. № 11. P. 845. https://doi.org/10.1038/nmat2297
Вольфкович Ю.М. // Электрохимия. 2021. Т. 57. № 4. С. 197. [Volfkovich Yu.M. // Russ. J. Electrochem. 2021. V. 57. № 4. Р. 311.] https://doi.org/10.1134/S1023193521040108
Нижегородова А.О., Кондратьев В.В. // Электрохимия. 2014. Т. 50. № 12. С. 1292. [Nizhegorodova A.O., Kondratiev V.V. // Russ. J. Electrochem. 2014. V. 50. № 12. P. 1157.] https://doi.org/10.1134/S1023193514120052
Шабалина А.В., Шарко Д.О., Корсакова Д.Р. и др. // Журн. неорган. химии. 2020. Т. 65. № 2. С. 271. [Shabalina A.V., Sharko D.O., Korsakova D.R. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 2. Р. 271.] https://doi.org/10.1134/S003602362002014X
Kornilov D.Yu., Gubin S.P. // Russ. J. Inorg. Chem. 2020. V. 65. № 13. P. 1965. https://doi.org/10.1134/S0036023620130021
Huang M., Zhang Y., Li F. et al. // J. Power Sources. 2014. V. 252. P. 98. https://doi.org/10.1016/j.jpowsour.2013.12.030
Chen L.-F., Huang Z.-H., Liang H.-W. et al. // Adv. Mater. 2013. V. 25. № 34. P. 4746. https://doi.org/10.1002/adma.201204949
Иванова А.Г., Карасев Л.В., Масалович М.С. и др. // Физика и химия стекла. 2020. Т. 46. № 1. С. 99. [Ivanova A.G., Masalovich M.S., Zagrebelny O.A. et al. // Glass Phys. Chem. 2020. V. 46. № 1. P. 96.] https://doi.org/10.1134/S1087659620010101
Toupin M., Brousse T., Belanger D. // Chem. Mater. 2004. V. 16. № 16. P. 3184. https://doi.org/10.1021/cm049649j
Dai Y., Chen L., Babayan V. et al. // J. Mater. Chem. A. 2015. V. 3. P. 21337. https://doi.org/10.1039/C5TA06958K
Bailey M., Denman J., King B. et al. // J. Electrochem. Soc. 2011. V. 159. № 2. P. A158. https://doi.org/10.1149/2.080202jes
Hatzell K.B., Fan L., Beidaghi M. et al. // Appl. Mater. Interf. 2014. V. 6. P. 8886. https://doi.org/10.1021/am501650q
Huang Z.H., Song Y., Xu X.X. et al. // Appl. Mater. Interf. 2015. V. 7. P. 25506. https://doi.org/10.1021/acsami.5b08830
Subramanian V., Zhu H., Wei B. // Chem. Phys. Lett. 2008. V. 453. P. 242. https://doi.org/10.1016/j.cplett.2008.01.042
Wang X., Wang X., Huang W. // J. Power Sources. 2005. V. 140. P. 211. https://doi.org/10.1016/j.jpowsour.2004.07.033
Zhang Y., Sun C., Lu P. et al. // CrystEngComm. 2012. V. 14. P. 5892. https://doi.org/10.1039/C2CE25610J
Kim I.-T., Kouda N., Yoshimoto N. et al. // J. Power Sources. 2015. V. 298. P. 123. https://doi.org/10.1016/j.jpowsour.2015.08.046
Ye Z., Li T., Ma G. et al. // J Power Sources. 2017. V. 351. P. 51. https://doi.org/10.1016/j.jpowsour.2017.03.104
Du J., Shao G., Qin X. et al. // Mater. Lett. 2012. V. 84. P. 13. https://doi.org/10.1016/j.matlet.2012.06.059
Чернявина В.В., Бережная А.Г. // Электрохимия. 2018. Т. 54. № 11. С. 1. [Chernyavina V.V., Berezhnaya A.G. // Russ. J. Electrochem. 2018. V. 54. № 11. P. 835.] https://doi.org/10.1134/S1023193518110022
Devaraj S., Munichandraiah N. // J. Phys. Chem. C. 2008. V. 112. № 11. P. 4406. https://doi.org/10.1021/jp7108785
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии