Журнал неорганической химии, 2022, T. 67, № 8, стр. 1041-1049
Новые комплексные соли – предшественники пористых наносплавов Pd–Ir–Rh
М. В. Гладышева a, b, *, П. Е. Плюснин a, Ю. В. Шубин a, А. А. Ведягин c, С. В. Коренев a
a Институт неорганической химии им. А.В. Николаева СО РАН
630090 Новосибирск,
пр-т Академика Лаврентьева, 3, Россия
b Новосибирский государственный университет
630090 Новосибирск, ул. Пирогова, 2, Россия
c Институт катализа им. Г.К. Борескова СО РАН
630090 Новосибирск, пр-т Академика Лаврентьева, 5, Россия
* E-mail: m.gladysheva@g.nsu.ru
Поступила в редакцию 20.01.2022
После доработки 11.02.2022
Принята к публикации 14.02.2022
- EDN: WRBNMV
- DOI: 10.31857/S0044457X2208013X
Аннотация
Синтезированы новые комплексные соли [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI), являющиеся твердыми растворами на основе двойных комплексных солей (ДКС) – [Pd(NH3)4]3[Ir(NO2)6]2 (I) и [Pd(NH3)4]3[Rh(NO2)6]2. Полученные соединения охарактеризованы методами РФА, ИК-спектроскопии и элементного анализа. Соединения кристаллизуются в кубической сингонии (пр. гр. $F4\bar {3}c$). Исследовано термическое поведение соединений I–VI в различной газовой атмосфере. Конечными продуктами термолиза [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x в восстановительной (H2) и инертной (He) атмосфере являются триметаллические пористые наносплавы Pd–Ir–Rh. В окислительной атмосфере конечными продуктами являются смеси оксидных фаз металлов с примесью металлической фазы. Исследованы структурные и морфологические свойства образующихся наносплавов. Полученные твердые растворы ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x использованы для синтеза сплавных наночастиц на поверхности оксидного носителя γ-Al2O3. Каталитическая активность и стабильность полученных образцов катализаторов испытаны в модельной реакции окисления CO в режиме форсированного термического старения.
ВВЕДЕНИЕ
Пористые би- и полиметаллические наносплавы представляют собой трехмерные структуры, образованные поликристаллическими фрагментами (зернами), которые связаны между собой перемычками размером 5–200 нм [1–4]. Пористые наносплавы обладают рядом преимуществ по сравнению с нано- и макроразмерными металлическими частицами. В частности, для пористых наносплавов характерны устойчивость к спеканию при высоких температурах [5–7] и наличие контакта фрагментов между собой, обусловливающее высокую электропроводность [8, 9]. Поэтому пористые наносплавы находят применение во многих системах в качестве активных компонентов, например, в биосенсорах [10], катализаторах реакций восстановления органических веществ [11], электрокаталитических системах [12, 13]. Одним из подходов к синтезу пористых наносплавов является термолиз в восстановительной или инертной атмосфере соединений-предшественников, в качестве которых могут выступать комплексные соединения, содержащие необходимые компоненты получаемого сплава, например, двойные комплексные соли (ДКС) [14–16]. Преимущество использования комплексных солей в качестве предшественников заключается в том, что компоненты в прекурсоре перемешаны на молекулярном уровне, что позволяет получать пористые наносплавы, в которых металлы распределены равномерно [17–19].
Следует отметить, что палладийсодержащие катализаторы широко используются в окислении СО и углеводородов, в том числе в составе трехмаршрутных каталитических нейтрализаторов [20, 21]. Стабилизация монометаллических палладиевых катализаторов представляется достаточно сложной задачей, поскольку дисперсные частицы палладия склонны к поверхностной миграции и агломерации в более крупные структуры, что является основной причиной потери их активности [22]. Применение наносплавов позволяет решить эту проблему, а варьирование соотношения металлов в сплаве является основным инструментом управления активностью и стабильностью катализаторов, эксплуатируемых в условиях высоких температур [23].
В работе представлены синтез и исследование новой двойной комплексной соли [Pd(NH3)4]3[Ir(NO2)6]2 и твердых растворов ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x, где x = 0.2, 0.4, 0.5, 0.6, 0.8. Синтезированные соединения являются перспективными предшественниками для создания новых функциональных материалов – пористых наносплавов в системе Pd–Ir–Rh. Нанесенные на γ-Al2O3 наносплавы Pd–Ir–Rh с варьируемым соотношением металлов были сопоставлены по активности и стабильности в реакции окисления СО.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходные соединения [Pd(NH3)4](NO3)2, Na3[Ir(NO2)6] и Na3[Rh(NO2)6] синтезировали согласно методикам [24]. В работе использовали дистиллированную воду, ацетон (ос. ч.), этанол (ректификат), аммиак водный (ос. ч.), азотную кислоту (ос. ч.), NaNO2 (ч. д. а.), IrCl4 · nH2O (ОАО “Красцветмет”, ωIr = 52.86%), RhCl3 · nH2O (ОАО “Красцветмет”, ωRh = 37.53%), Pd металлический (ОАО “Красцветмет”, ωPd = 99.99%).
ИК-спектры исследуемых соединений регистрировали на ИК-фурье-спектрометре Scimitar FTS 2000 в таблетках KBr (400–4000 см–1).
Элементный анализ на содержание H и N выполняли на приборе Euro EA 3000 по стандартной методике. Анализ на содержание металлов проводили атомно-эмиссионным методом на спектрометре Thermo Scientific, iCAP-6500. Для этого навеску соли растворяли при нагревании в азотной кислоте, упаривали до минимального объема, переносили в мерную колбу и доводили до метки 0.5 М раствором HNO3. Содержание аналитов (Pd, Ir, Rh) составляло 100–400 мкг/мл.
Рентгенофазовый анализ (РФА) проводили на дифрактометре Shimadzu XRD-7000 (CuKα-излучение, Ni-фильтр) при комнатной температуре и атмосферном давлении. Диапазон углов 2θ составлял 5°–60° для комплексных соединений и 5°–135° для продуктов термолиза, шаг сканирования 0.05°. Образцы готовили нанесением суспензии растертого в этаноле образца на плоскую сторону кюветы из плавленого кварца. В качестве внешнего эталона использовали образец поликристаллического кремния (a = 5.4309 Å), приготовленный аналогичным способом.
Однофазность полученных соединений установлена в результате индицирования порошковых рентгенограмм по аналогии с расчетными дифрактограммами комплексов, изученных методом рентгеноструктурного анализа. Индици-рование дифрактограмм продуктов термолиза проводили с использованием данных картотеки PDF [25]. Уточнение параметров решетки осуществляли полнопрофильным методом с помощью программы PowderCell 2.4 [26].
Синхронный термический анализ, включающий в себя одновременное проведение термогравиметрических определений, дифференциальной сканирующей калориметрии и масс-спектрометрического анализа выделенного газа, проводили на приборе STA 449F1 Jupiter фирмы Netzsch, совмещенном с квадрупольным масс-спектрометром QMS 403D Aëolos. Эксперименты выполняли в атмосфере гелий-водородной смеси (10 об. % H2 в He, 30 мл/мин) и в атмосфере синтетического воздуха (20 об. % O2 в Ar, 50 мл/мин). Использовали тигли из Al2O3, скорость нагрева составляла 10 град/мин в диапазоне температур 30–1000°С. Обработку экспериментальных данных проводили с использованием пакета программ Proteus analysis [27].
Эксперименты по изучению морфологии осуществляли на сканирующем электронном микроскопе Hitachi Regulus SU 8230 FE-SEM (Япония) с ускоряющим напряжением от 5 до 30 кВ в режимах вторичных, обратно-отраженных и прошедших электронов. Прибор оснащен энергодисперсионным спектрометром рентгеновского характеристического излучения AztecLive (Oxford Instruments, Англия) с полупроводниковым Si-детектором с разрешением по энергии 128 эВ. Для проведения исследований на электронном микроскопе частицы образцов наносили на дырчатые углеродные подложки, закрепленные на медных или молибденовых сетках, с помощью ультразвукового диспергатора УЗД-1УЧ2, что позволяло добиться равномерного распределения частиц по поверхности подложки. Образец помещали в спирт, нанесенный на ультразвуковой диспергатор, после этого происходило испарение и последующее осаждение частиц образца на медную сеточку. Для проведения исследований на электронном микроскопе частицы образцов наносили на двухсторонний проводящий скотч.
Синтез двойной комплексной соли [Pd(NH3)4]3[Ir(NO2)6]2 (I). К 5 мл водного раствора [Pd(NH3)4](NO3)2 (0.8338 г, 2.79 ммоль) добавляли при перемешивании 5 мл водного раствора Na3[Ir(NO2)6] (1.0000 г, 1.86 ммоль). Полученный раствор охлаждали на ледяной бане до 10°С, после чего выпавший светло-желтый осадок отфильтровывали на пористом стеклянном фильтре, промывали ацетоном и высушивали на воздухе. Выход 1.114 г, 83%.
| Н | Ir | N | Pd | ∑тг(Pd + Ir) | |
| Найдено, %: | 2.3; | 26.9; | 22.2; | 21.8; | 47.9. |
| Для H36Ir2N24O24Pd3 (1460.13 г/моль) | |||||
| вычислено, %: | 2.48; | 26.33; | 23.02; | 21.86; | 48.19. |
Синтез твердых растворов [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI). Синтез осуществляли аналогично синтезу ДКС [Pd(NH3)4]3[Ir(NO2)6]2 и [Pd(NH3)4]3[Rh(NO2)6]2 [28] смешением водного раствора [Pd(NH3)4](NO3)2 и совместного водного раствора с заданным мольным соотношением Na3[Ir(NO2)6] и Na3[Rh(NO2)6].
Типичный синтез твердого раствора на примере [Pd(NH3)4]3[Ir(NO2)6]1.6[Rh(NO2)6]0.4 (II). К 2 мл водного раствора [Pd(NH3)4](NO3)2 (0.2515 г, 0.84 ммоль) прибавляли при перемешивании 3 мл водного раствора, содержащего Na3[Ir(NO2)6] (0.2414 г, 0.45 ммоль) и Na3[Rh(NO2)6] (0.0503 г, 0.11 ммоль). Мольное соотношение Pd : Ir : Rh в реакционной смеси составляло 3 : 1.6 : 0.4. Полученный раствор охлаждали на ледяной бане до 10°С, затем полученный светло-желтый осадок отфильтровывали на пористом стеклянном фильтре, промывали ацетоном и высушивали на воздухе. Выход 320 мг, 80%.
Образцы нанесенных катализаторов Pd0.6(IrxRh1 –x)0.4/Al2O3 (∑ω = 0.2%) готовили пропиткой γ-Al2O3 (Sasol, Germany) водным раствором [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x. Затем образец высушивали в сушильном шкафу в течение 12 ч при 105°С и прокаливали в атмосфере аргон–водородной смеси (10 об. % H2 в Ar, 30 мл/мин) в течение 1 ч. Образцы катализаторов Pd0.6(IrxRh1 –x)0.4/γ-Al2O3 (∑ω = 0.2%) были исследованы в реакции окисления CO в условиях форсированного термического старения на установке проточного типа [29]. Режим форсированного термического старения применяли для оценки стабильности катализаторов в отношении дезактивации активного компонента – наносплава Pd0.6(IrxRh1– x)0.4. Поток реакционной смеси, состоящей из 0.15 об. % CO, 14.0 об. % O2 и азота (остальное), подавали в реактор со скоростью 334 мл/мин. Скорость подъема температуры во всех случаях составляла 10 град/мин. На выходе контролировали концентрацию СО при помощи газового анализатора Ultramat 6 (Siemens, Germany). Каждый образец подвергали семи каталитическим циклам нагрева–охлаждения при варьировании конечной температуры цикла, при этом конечная температура для первого и второго циклов составляла 320°C, для третьего и четвертого циклов – 600°C, для последующих трех циклов – 800°C. В качестве критерия активности использовали параметр Т50 (температуру 50%-ного превращения CO). Чем ниже значение этого параметра, тем выше активность катализатора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I) и твердых растворов ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI) протекает в водном растворе с высоким выходом (80–85%), что обусловлено низкой растворимостью получаемых координационных соединений. В ходе синтеза образуется безводная фаза ДКС, изоструктурная [Pd(NH3)4]3[Rh(NO2)6]2 [27], при перекристаллизации возможно получение моногидратов координационных соединений, как в случае [Pd(NH3)4]3[Rh(NO2)6]2 · H2O [28] и [Pd(NH3)4]3[Ir(NO2)6]2 · H2O [30]. В ходе синтеза твердых растворов ДКС образуется продукт, соотношение металлов в котором близко к задаваемому, что обусловлено близкими значениями произведений растворимости [Pd(NH3)4]3[Ir(NO2)6]2 и [Pd(NH3)4]3[Rh(NO2)6]2 (табл. 1).
Таблица 1.
Аналитические данные продуктов синтеза ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I) и твердых растворов ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI)
| Соединение | Задано* | Получено (АЭС) | H, %** | Ir, % | N, % | Pd, % | Rh, % | ∑ТГ M, % |
|---|---|---|---|---|---|---|---|---|
| I | 3 : 2 | 3 : 2 | 2.3/2.48 | 26.9/26.33 | 22.2/23.02 | 21.8/21.86 | – | 47.9/48.19 |
| II | 3 : 1.6 : 0.4 | 3 : 1.6 : 0.4 | 2.6/2.55 | 21.0/21.59 | 23.0/23.60 | 22.4/22.41 | 2.8/2.89 | 46.3/46.89 |
| III | 3 : 1.2 : 0.8 | 3 : 1.2 : 0.8 | 2.6/2.61 | 16.9/16.61 | 23.5/24.21 | 22.8/22.99 | 5.8/5.93 | 5.8/5.93 |
| IV | 3 : 1.0 : 1.0 | 3 : 1.0 : 1.0 | 2.6/2.65 | 14.5/14.02 | 23.3/24.52 | 23.4/23.29 | 7.3/7.51 | 44.6/44.82 |
| V | 3 : 0.8 : 1.2 | 3 : 0.8 : 1.2 | 2.7/2.68 | 11.6/11.37 | 24.2/24.85 | 24.2/23.60 | 8.8/9.13 | 46.3/46.89 |
| VI | 3 : 0.4 : 1.6 | 3 : 0.4 : 1.6 | 2.7/2.75 | 5.7/5.84 | 24.9/25.52 | 24.2/25.52 | 12.5/12.50 | 41.7/42.57 |
ИК-спектроскопия
В табл. 2 представлены волновые числа основных колебаний ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I) и твердых растворов ДКС [Pd(NH3)4]3[Ir(NO2)6]1.6[Rh(NO2)6]0.4 (II), [Pd(NH3)4]3[Ir(NO2)6]1.2[Rh(NO2)6]0.8 (III), [Pd(NH3)4]3[Ir(NO2)6]1.0[Rh(NO2)6]1.0 (IV), [Pd(NH3)4]3[Ir(NO2)6]0.8[Rh(NO2)6]1.2 (V) и [Pd(NH3)4]3[Ir(NO2)6]0.4[Rh(NO2)6]1.6 (VI). Отнесение сделано на основании сопоставления спектров и литературных данных [28, 31]. ИК-спектр представляет собой суперпозицию колебаний гексанитрометаллат-анионов и катиона тетрааминпалладия. Спектры ДКС I и твердых растворов ДКС II–VI подобны между собой. В спектрах наблюдаются интенсивные полосы поглощения при 3300–3200, 1625, 1396, 1325, 1270, 826, 780, 650 см–1, характерные для колебаний координированных молекул NH3 и ${\text{NO}}_{2}^{ - }.$ В ИК-спектрах комплексных солей присутствуют интенсивные полосы поглощения при 510 и 410 см–1, характерные для колебаний связей Pd–N и Ir–N, Rh–N. Значения частот основных колебаний ДКС I и твердых растворов ДКС II–VI отличаются от литературных данных не более чем на 30 см–1.
Таблица 2.
Значения волновых чисел (см–1) основных полос в ИК-спектрах [Pd(NH3)4]3[Ir(NO2)6]2 (I), [Pd(NH3)4]3[Ir(NO2)6]1.6[Rh(NO2)6]0.4 (II), [Pd(NH3)4]3[Ir(NO2)6]1.2[Rh(NO2)6]0.8 (III), [Pd(NH3)4]3[Ir(NO2)6]1.0[Rh(NO2)6]1.0 (IV), [Pd(NH3)4]3[Ir(NO2)6]0.8[Rh(NO2)6]1.2 (V) и [Pd(NH3)4]3[Ir(NO2)6]0.4[Rh(NO2)6]1.6 (VI)
| I | II | III | IV | V | VI | Отнесение [31] |
|---|---|---|---|---|---|---|
| 3269 | 3269 | 3268 | 3268 | 3268 | 3267 | νas(NH3) |
| 1626 | 1626 | 1626 | 1626 | 1626 | 1625 | δ(HNH) |
| 1397 | 1396 | 1396 | 1396 | 1396 | 1396 | νas(NO2) |
| 1327 | 1338 1326 |
1337 | 1325 | 1325 | 1336 | νs(NO2) |
| 1273 | 1272 | 1272 | 1270 | 1271 | 1270 | δs(HNH) |
| 828 | 827 | 827 | 827 | 826 | 826 | δ(ONO) + ρr(NH3) |
| 780 | 780 | 779 | 779 | 779 | 776 | ρr(NH3) |
| 649 | 649 618 |
649 619 |
649 618 |
649 618 |
649 617 |
ρω(NO2) |
| 511 484 |
512 | 495 | 513 | – | – | ν(Pd–N) |
| 405 | 405 | 406 | 418 | 418 | 418 | ν(Ir–N) + ν(Rh–N) |
Дифрактограммы поликристаллических ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I) и [Pd(NH3)4]3[Rh(NO2)6]2 полностью проиндицированы по данным исследования монокристалла ДКС [Pd(NH3)4]3[Rh(NO2)6]2, структура которой установлена ранее [28]. Полученные данные свидетельствуют об изоструктурности ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I) и [Pd(NH3)4]3[Rh(NO2)6]2. Изоструктурность комплексных солей обеспечивает возможность синтеза твердых растворов [Pd(NH3)4]3[Ir(NO2)6]2x [Rh(NO2)6]2 – 2x в широкой области составов, что подтверждено экспериментально – получены твердые растворы ДКС во всей области составов (рис. 1).
Рис. 1.
Дифрактограммы ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I), [Pd(NH3)4]3[Rh(NO2)6]2 [28] и твердых растворов ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI).
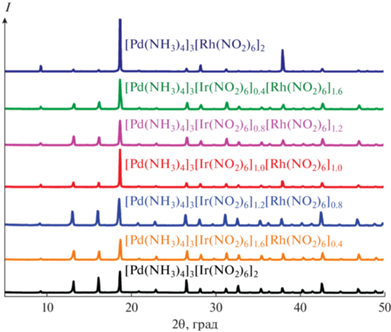
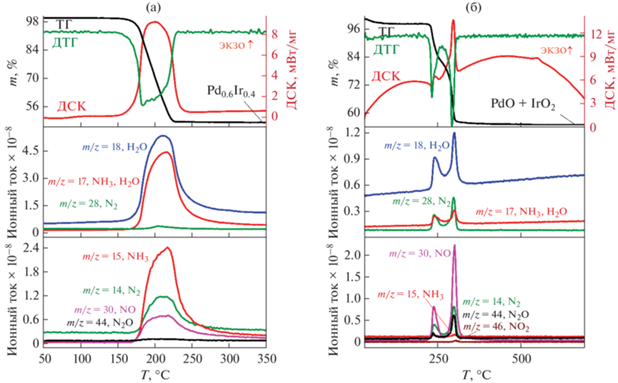
ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I), [Pd(NH3)4]3[Rh(NO2)6]2 [28] и твердые растворы ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI) разлагаются подобно. Термолиз соединения I в восстановительной атмосфере (рис. 2а) протекает в две плохо разделенные ступени в диапазоне температур 150–240°C и сопровождается экзотермическим эффектом. Основными газообразными продуктами термического разложения являются H2O (m/z = 18, 17), NH3 (m/z = 17, 15) и незначительные количества N2 (m/z = 28, 14). Конечным продуктом термолиза [Pd(NH3)4]3[Ir(NO2)6]2 в восстановительной атмосфере является пористый наносплав Pd0.6Ir0.4. Масса конечного продукта составляет 46.3% от исходной навески, что хорошо согласуется с расчетным значением ∑x = = 46.89%. В окислительной атмосфере ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (рис. 2б) разлагается в четыре плохо разделенные ступени в диапазоне температур 175–400°C и сопровождается экзотермическим эффектом на протяжении всего разложения. Первые две плохо разделенные ступени термолиза соединения I протекают в диапазоне температур 175–275°C. Основными газообразными продуктами являются H2O (m/z = 18, 17) и N2 (m/z = 28, 14). На следующих третьей и четвертой плохо разделенных ступенях, протекающих в диапазоне температур 275–400°C, происходит полное разложение ДКС, при этом основными газообразными продуктами являются H2O (m/z = = 18, 17), N2 (m/z = 28, 14) и незначительные количества оксидов азота NO (m/z = 30) и N2O (m/z = 44). Конечным продуктом термолиза [Pd(NH3)4]3[Ir(NO2)6]2 в окислительной атмосфере, согласно данным РФА, является смесь оксидов PdO и IrO2 с примесью металлической фазы. Масса конечного продукта составляет 54.4% от исходной. Экспериментальное значение занижено по сравнению с теоретически рассчитанным из предположения, что в ходе термолиза образуются только оксидные фазы (∑x = 55.86%), что также подтверждает образование металлической примеси наряду со смесью оксидных фаз.
Рис. 2.
Кривые термического анализа [Pd(NH3)4]3[Ir(NO2)6]2 (I): а – в восстановительной атмосфере (10 об. % H2 в He); б – в окислительной атмосфере (20 об. % O2 в Ar, 50 мл/мин). Скорость нагрева 10 град/мин.
Согласно данным РФА, в ходе термолиза комплексных соединений I–VI в восстановительной атмосфере образуются однофазные твердые растворы на основе ГЦК-ячейки (рис. 3). При увеличении содержания Ir в наносплаве параметр элементарной ячейки (ПЭЯ) закономерно увеличивается, что также подтверждает наличие трех металлов в заданном в эксперименте соотношении (табл. 3, рис. 4). Данные СЭМ подтверждают пористую структуру продукта термолиза [Pd(NH3)4]3[Rh(NO2)6]2 – биметаллического наносплава (рис. 5). Таким образом, ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I), [Pd(NH3)4]3[Rh(NO2)6]2 и твердые растворы ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI) являются перспективными предшественниками би- и полиметаллических пористых наносплавов.
Рис. 3.
Дифрактограммы продуктов термолиза ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I), [Pd(NH3)4]3[Rh(NO2)6]2 и твердых растворов ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI) при 400°C в восстановительной атмосфере (10 об. % Н2 в Не).
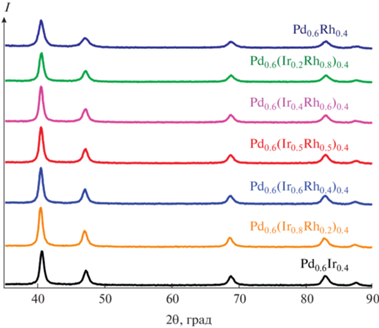
Таблица 3.
Характеристики металлических фаз – продуктов термолиза ДКС при 400°C в восстановительной атмосфере (10 об. % Н2 в Не)
| Соединение | Состав фаз | ПЭЯ фаз, Å | ОКР, нм |
|---|---|---|---|
| [Pd(NH3)4]3[Ir(NO2)6]2 | Pd0.6Ir0.4 | 3.853(2) | 7.4 |
| [Pd(NH3)4]3[Ir(NO2)6]1.6[Rh(NO2)6]0.4 | Pd0.6(Ir0.8Rh0.2)0.4 | 3.853 | 8.8 |
| [Pd(NH3)4]3[Ir(NO2)6]1.2[Rh(NO2)6]0.8 | Pd0.6(Ir0.6Rh0.4)0.4 | 3.855 | 8.9 |
| [Pd(NH3)4]3[Ir(NO2)6]1.0[Rh(NO2)6]1.0 | Pd0.6(Ir0.5Rh0.5)0.4 | 3.856 | 9.2 |
| [Pd(NH3)4]3[Ir(NO2)6]0.8[Rh(NO2)6]1.2 | Pd0.6(Ir0.4Rh0.6)0.4 | 3.858 | 9.4 |
| [Pd(NH3)4]3[Ir(NO2)6]0.4[Rh(NO2)6]1.6 | Pd0.6(Ir0.2Rh0.8)0.4 | 3.860 | 9.4 |
| [Pd(NH3)4]3[Rh(NO2)6]2 | Pd0.6Rh0.4 | 3.864 | 9.5 |
Рис. 4.
Зависимость ПЭЯ продуктов термолиза ДКС [Pd(NH3)4]3[Ir(NO2)6]2 (I), [Pd(NH3)4]3[Rh(NO2)6]2 и твердых растворов ДКС [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI) от мольного содержания Ir.
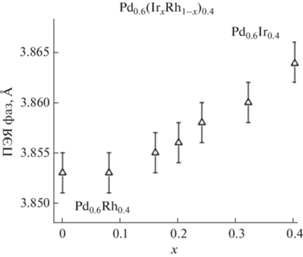
Рис. 5.
СЭМ-изображения продукта термолиза [Pd(NH3)4]3[Rh(NO2)6]2 при 400°C в восстановительной атмосфере (10 об. % Н2 в Не).

Синтезированные образцы триметаллических катализаторов были исследованы в реакции окисления CO в условиях форсированного термического старения. На рис. 6 в качестве примера представлены температурные зависимости для образца Pd0.6(Ir0.4Rh0.6)0.4/Al2O3. Все кривые имеют классическую S-образную форму. Смещение кривых в сторону бóльших температур относительно конечной температуры предшествующего цикла указывает на снижение каталитической активности в результате термического старения. Для удобства сопоставления образцов на рис. 7а и 7б представлены зависимости параметра Т50 от номера цикла. Видно, что для всех образцов характерны схожие зависимости. Наибольшую активность образцы проявляют в исходном состоянии, однако уже после первого цикла параметр Т50 увеличивается на 30–40°C. Дальнейшее увеличение параметра связано с эффектами термического старения при 600 и 800°C.
Рис. 6.
Температурные зависимости конверсии CO в режиме форсированного термического старения для образца Pd0.6(Ir0.4Rh0.6)0.4/Al2O3.
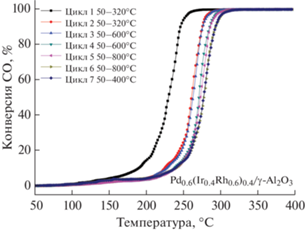
Рис. 7.
Зависимость параметра Т50 от номера цикла (а) и соотношения Ir : Rh (б) в ходе испытаний триметаллических образцов в условиях форсированного термического старения.
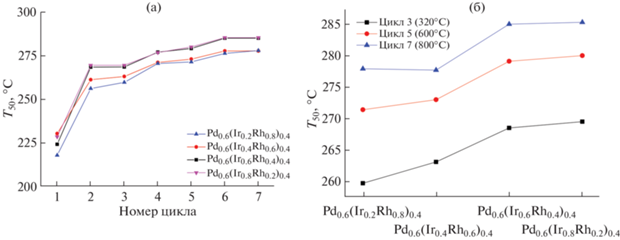
Сравнивая образцы между собой, можно заметить, что соотношение Ir : Rh в катализаторах существенно влияет на их активность и стабильность. При минимальной температуре испытания (320°C) увеличение доли иридия приводит к монотонному падению активности (увеличению параметра T50). После высокотемпературных обработок (цикл 5, 60°C и цикл 7, 800°C) поведение образцов меняется. Более высокую активность и приемлемую стабильность демонстрируют катализаторы Pd0.6(Ir0.2Rh0.8)0.4/γ-Al2O3 и Pd0.6(Ir0.4Rh0.6)0.4/γ-Al2O3, в которых содержание иридия не превышает 0.032 мас. %. Увеличение содержания иридия приводит к снижению общей каталитической активности несмотря на то, что содержание палладия – наиболее активного металла из присутствующих в сплаве – остается неизменным. Полученные данные показывают, что при большем содержании Ir в сплаве наблюдается обратный синергический эффект.
ЗАКЛЮЧЕНИЕ
Синтезированы и охарактеризованы новая двойная комплексная соль [Pd(NH3)4]3[Ir(NO2)6]2 (I) и твердые растворы на ее основе [Pd(NH3)4]3[Ir(NO2)6]2x[Rh(NO2)6]2 – 2x (II–VI). Методом РФА подтверждена изоструктурность полученных координационных соединений. Показана возможность получения би- и триметаллических пористых наносплавов в системах Pd–Ir, Pd–Rh и Pd–Ir–Rh при термолизе комплексных солей и их твердых растворов в восстановительной и инертной атмосфере. Изучена каталитическая активность триметаллических образцов Pd0.6(IrxRh1 –x)0.4/γ-Al2O3 (∑ω = 0.2%) в реакции окисления СО. Показано, что практический интерес представляют системы, в которых соотношение Ir : Rh не превышает 2 : 3, что соответствует общему содержанию иридия в катализаторе 0.032 мас. %.
Список литературы
Sohn H., Xiao Q., Seubsai A. et al. // ACS Appl. Mater. Interfaces. 2019. V. 11. № 24. P. 21435. https://doi.org/10.1021/acsami.8b21661
Thanh T.D., Balamurugan J., Lee S.H. et al. // Biosens. Bioelectron. 2016. V. 85. P. 669. https://doi.org/10.1016/j.bios.2016.05.075
Wang X., Liao J., Li H. et al. // Int. J. Hydrogen Energy. 2018. V. 43. № 37. P. 17543. https://doi.org/10.1016/j.ijhydene.2018.07.147
Anumol E.A., Halder A., Nethravathi C. et al. // J. Mater. Chem. 2011. V. 21. № 24. P. 8721. https://doi.org/10.1039/c1jm10287g
Huang S., Xu H., Li H. et al. // Fuel Process. Technol. 2021. V. 218. P. 106858. https://doi.org/10.1016/j.fuproc.2021.106858
Ferrando R., Jellinek J., Johnston R.L. // Chem. Rev. 2008. V. 108. № 3. P. 845. https://doi.org/10.1021/cr040090g
Zhang B., Li G., Zhai Z. et al. // AIChE J. 2021. V. 67. № 7. P. 1. https://doi.org/10.1002/aic.17295
Weissmüller J., Viswanath R.N., Kramer D. et al. // Science (80-). 2003. V. 300. № 5617. P. 312. https://doi.org/10.1126/science.1081024
Kramer D., Viswanath R.N., Weissmüller J. // Nano Lett. 2004. V. 4. № 5. P. 793. https://doi.org/10.1021/nl049927d
Zhao Y., Tian L., Fan Y. et al. // J. Mater. Sci. 2021. V. 56. № 23. P. 13066. https://doi.org/10.1007/s10853-021-06157-w
Mauriello F., Ariga-Miwa H., Paone E. et al. // Catal. Today. 2019. № November 2018. P. 1. https://doi.org/10.1016/j.cattod.2019.06.071
Ryu J., Choi J., Lim D.H. et al. // Appl. Catal. B Environ. 2015. V. 174–175. P. 526. https://doi.org/10.1016/j.apcatb.2015.03.019
Lu L. // Microchim. Acta. 2019. V. 186. № 9. https://doi.org/10.1007/s00604-019-3772-3
Popov A.A., Shubin Y.V., Bauman Y.I. et al. // Nanotechnology. 2020. V. 31. № 49. https://doi.org/10.1088/1361-6528/abb430
Rajar K., Alveroglu E. // J. Mol. Struct. 2017. V. 1146. P. 592. https://doi.org/10.1016/j.molstruc.2017.06.026
Wang D., Zhao P., Li Y. // Sci Rep. 2011. V. 1. P. 37. https://doi.org/10.1038/srep00037
Avisar S., Shner Y., Abu-Reziq R. et al. // J. Alloys Compd. 2022. V. 891. P. 161936. https://doi.org/10.1016/j.jallcom.2021.161936
Гладышева М.В., Плюснин П.Е., Комаров В.Ю. et al. // J. Struct. Chem. 2022. V. 63. № 4. P. 449. https://doi.org/10.26902/JSC_id90372
Pechenyuk S.I., Domonov D.P., Gosteva A.N. // Russ. J. Gen. Chem. 2021. V. 91. P. 1834. https://doi.org/https://doi.org/10.1134/S1070363221090310
Osaki T., Yamada K., Watari K. et al. // Catal. Lett. 2012. V. 142. № 1. P. 95. https://doi.org/10.1007/s10562-011-0692-1
Liu X., Wang R., Song L. et al. // Catal. Commun. 2014. V. 46. P. 213. https://doi.org/10.1016/j.catcom.2013.12.003
Vedyagin A.A., Volodin A.M., Kenzhin R.M. et al. // Catal. Today. 2018. V. 307. P. 102. https://doi.org/10.1016/j.cattod.2017.01.033
Vedyagin A.A., Stoyanovskii V.O., Plyusnin P.E. et al. // J. Alloys Compd. 2018. V. 749. P. 155. https://doi.org/10.1016/j.jallcom.2018.03.250
Chernyaev I. // Synthesis of Complex Compounds of Platinum Group Metals. M.: Nauka, 1964.
Powder Diffraction File, PDF-2/Release 2009. International Centre for Diffraction Date: USA, 2009.
Sheldrick G.M. SHELXTL-97, Progr. Refinement Cryst. Struct. Univ. of Göttingen: Göttingen, Germany, 1998.
NETZSCH Proteus Thermal Analysis, v. 6.1.0. Selb/ NETZSCH-Gerätebau GmbH: Bayern, Germany, 2013.
Rybinskaya A.A., Plyusnin P.E., Bykova E.A. et al. // J. Struct. Chem. 2012. V. 53. № 3. P. 527.
Vedyagin A.A., Gavrilov M.S., Volodin A.M. et al. // Top. Catal. 2013. V. 56. № 11. P. 1008. https://doi.org/10.1007/s11244-013-0064-8
Rybinskaya A.A., Shusharina E.A., Plyusnin P.E. et al. // J. Struct. Chem. 2011. V. 52. № 4. P. 836.
Nakamoto K. // Infrared and Raman Spectra of Inorganic and Coordination Compounds. 1991.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии


