Журнал неорганической химии, 2022, T. 67, № 7, стр. 931-938
Образование полиборатов при проведении димеризации клозо-декаборатного аниона и изомеризации октадекагидроэйкозаборатного аниона
А. С. Кубасов a, И. В. Новиков b, П. А. Стародубец c, В. В. Авдеева a, *, К. Ю. Жижин a, b, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Россия
b МИРЭА – Российский технологический университет (Институт тонких химических технологий
им. М.В. Ломоносова)
119571 Москва, пр-т Вернадского, 86, Россия
c Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 17.12.2021
После доработки 10.01.2022
Принята к публикации 15.01.2022
- EDN: AACEGK
- DOI: 10.31857/S0044457X22070133
Аннотация
Изучено строение полиборатов цезия и тетрафенилфосфония, полученных в ходе проведения мягкого окисления клозо-декаборатного аниона [B10H10]2– в воде солью церия(IV) с образованием в качестве основного продукта Cs2[trans-B20H18] и в ходе длительной изомеризации аниона [trans-B20H18]2– под действием УФ-облучения с образованием (Ph4P)2[iso-B20H18] в качестве основного продукта. Соединения выделены в виде сольватов Cs[B5O6(OH)4] · 2H2O и PPh4[B5O6(OH)4] · 2DMF · H2O из фильтратов, полученных после выведения целевых соединений из реакционных растворов. Образование полиборатов объясняется протеканием процессов деградации кластерных анионов бора во времени в реакционных растворах.
ВВЕДЕНИЕ
Полиэдрические кластерные анионы бора [B10H10]2– и [B12H12]2– [1–4] и переходные металлы способны образовывать комплексы различного состава и строения. В комплексах с металлами, которые относят к “мягким” кислотам Пирсона (Cu(I), Ag(I), Pb(II) и др.), кластеры бора могут входить в координационную сферу металла [5–8], тогда как в комплексах с более “жесткими” кислотами Пирсона кластерные анионы бора обычно играют роль противоионов [9–14]. Реакции с некоторыми катионами и комплексами переходных металлов также могут приводить к образованию продуктов замещения терминальных атомов водорода на молекулы лигандов или растворителей [15–20], окислению [15, 21] или восстановлению полиэдров бора, которое сопровождается внедрением металла [22, 23].
В реакциях, которые сопровождаются окислительно-восстановительными превращениями с участием кластерных анионов бора, в качестве побочных продуктов образуются продукты деградации борного кластера. Они легко идентифицируются методами ИК- и 11B ЯМР-спектроскопии. Обычно их строение не рассматривается подробно, однако данный вид соединений также заслуживает внимания [24–26]. К полиборатам относятся соединения различных металлов, анионные фрагменты которых содержат атомы бора, координированные тремя или четырьмя атомами кислорода с образованием треугольников BO3 и тетраэдров BO4. В частности, в обзоре [27] проанализирован широкий круг неорганических полиборатов; проведенный анализ позволил определить место новых соединений среди исследованных ранее, сопоставить их структуры и выявить особенности строения, а также обосновать свойства новых материалов и оптимизировать их поиск.
Наиболее близко к материалам данной работы относятся полибораты [Cu(NH3)4(H2O)2][B4O5(OH)4] · ⋅ 2H2O, [Cu(Phen)2(OC(H)O)][B5O6(OH)4] · DMF, [Ni(Bipy)3][B5O6(OH)4]Cl · 0.5Bipy · 5H2O, [Cd(Bipy)2SO4]2 · 2H3BO3, (Ph4P)[B5O6(OH)4] · 2DMF · H2O и (Me2NH2)[B5O6(OH)4], строение которых установлено методом РСА [28]. Соединения получены в результате окисления аниона [B11H14]– при изучении реакций комплексообразования меди, серебра, свинца, никеля, кадмия в присутствии данного кластерного аниона бора.
В настоящей работе исследовано строение полиборатов цезия и тетрафенилфосфония, синтезированных в ходе полного окисления аниона [B10H10]2– при получении анионов [trans-B20H18]2– и [iso-B20H18]2–.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Все реакции проводили на воздухе. (Et3NH)2[B10H10] синтезировали из декаборана-14 по методике [29]. В работе использовали (NH4)2Ce(NO3)6 и Ph4PCl (reagent grade, Aldrich). Cs2[B10H10] синтезировали по методике [30].
Синтез I и Ia. Cs2[trans-B20H18] (I) получали окислением клозо-декаборатного аниона аналогично методике [30] в воде при использовании нитрата церия(IV)-аммония в качестве окислителя. К раствору Cs2[B10H10] (0.5 ммоль) в воде при постоянном перемешивании приливали оранжевый раствор (NH4)2Ce(NO3)6 (1 ммоль). Наблюдали быстрое обесцвечивание раствора, что говорит о протекании окислительно-восстановительной реакции и восстановлении церия(IV) до церия(III), и образование хлопьевидного осадка целевого соединения. Осадок соединения I отфильтровывали и высушивали на воздухе, раствор оставляли под тягой. Выход I составил 76%.
Спектр 11B ЯМР (DMSO-d6, δ, м.д.): 31.66 (d, 2Baп), 17.51 (s, 2B, B2, B2'), –5.42 (d, 2Bэкв), –11.06 (d, 4Bэкв), –14.42 (d, 4Bэкв), –18.01 (d, 4B), –24.25 (d, 2Baп).
ИК-спектр (NaCl, ν, см–1): ν(BH) 2542, 2520, 2505; δ(ВВН) 998.
Спустя 2 недели из фильтрата выпадали кристаллы побочного продукта Cs[B5O6(OH)4] · 2H2O (Ia), которые отфильтровывали и исследовали методом РСА.
Спектр 11B ЯМР (DMSO-d6, δ, м.д.): 20.5. ИК-спектр (NaCl, ν, см–1): ~1420.
Синтез II и IIa. Облучение раствора Cs2[trans-B20H18] (1 ммоль) в ДМФА (30 мл) в течение 5 сут с помощью УФ-лампы ДРТ-400 привело к изомеризации [trans-B20H18]2– → [iso-B20H18]2– в реакционном растворе, что контролировалось методом 11В ЯМР-спектроскопии. В реакционный раствор добавляли воду (10 мл) и раствор избытка Ph4PCl (2.1 ммоль) в воде (10 мл). Наблюдали образование белого осадка (Ph4P)2[iso-B20H18] (II), который отфильтровывали и высушивали на воздухе. Выход II составил 69%.
Спектр 11B ЯМР (DMSO-d6, δ, м.д.): –1.60 (d, 4B), –2.44 (d, 4B), –23.97 (d, 4B), –25.75 (d, 4B), –27.12 (d, 4B). ИК-спектр (NaCl, ν, см–1): ν(BH) 2532, 2515, ν(BH)BHB 1778; δ(ВВН) 998.
Спустя 4 недели из фильтрата выпали кристаллы побочного продукта PPh4[B5O6(OH)4] · 2DMF · · H2O (IIa), которые отфильтровали и исследовали методом РСА.
Спектр 11B ЯМР (DMSO-d6, δ, м.д.): 20.7. ИК-спектр (NaCl, ν, см–1): ~1420.
ИК-спектры записывали на ИК-фурье-спектрометре ИНФРАЛЮМ ФТ-02 (Люмекс, Россия) в области 4000–400 см–1 с разрешением 1 см–1. Образцы готовили в виде суспензии вещества в вазелиновом масле (Aldrich), пластинки NaCl.
Спектры 11B и 11B {1H} ЯМР записывали на спектрометре Bruker AC 200 на частоте 64.297 МГц, внешний стандарт – Et2OBF3.
РСА. Набор дифракционных отражений для кристаллов Ia и IIa получен в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker APEX2 CCD (λMoKα, графитовый монохроматор, ω–ϕ-сканирование). Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы уточнены в анизотропном приближении. Все атомы водорода в структуре Ia уточнены независимо в изотропном приближении. Все атомы водорода в IIa уточнены по модели “наездника” с тепловыми параметрами Uизо = 1.2 Uэкв (Uизо) соответствующего неводородного атома (1.5Uизо для СН3-групп). При сборе и обработке массива отражений использовали программы APEX2, SAINT и SADABS [31]. Структура расшифрована и уточнена с помощью программ комплекса OLEX2 [32].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структуры приведены в табл. 1. Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 1994750, 1994751).
Таблица 1.
Некоторые длины связей и валентные углы в соединениях Ia и IIa
| Связь, Å, угол, град | Ia | IIa |
|---|---|---|
| sp3-B | ||
| B3O4 | 1.476(5) | 1.509(4) |
| B3O5 | 1.469(5) | 1.485(4) |
| B3O6 | 1.475(4) | 1.481(4) |
| B3O7 | 1.478(5) | 1.508(4) |
| O4B3O5 | 111.6(3) | 111.1(2) |
| O6B3O7 | 110.9(3) | 110.7(2) |
| sp2-B | ||
| B1O1 | 1.360(5) | 1.382(4) |
| B1O2 | 1.375(5) | 1.404(4) |
| B1O5 | 1.364(4) | 1.362(4) |
| B2O2 | 1.382(5) | 1.408(4) |
| B2O3 | 1.359(5) | 1.380(4) |
| B2O4 | 1.352(4) | 1.370(4) |
| B4O6 | 1.358(4) | 1.357(4) |
| B4O8 | 1.355(4) | 1.388(4) |
| B4O9 | 1.378(5) | 1.407(4) |
| B5O7 | 1.352(4) | 1.367(4) |
| B5O9 | 1.387(5) | 1.403(4) |
| B5O10 | 1.352(5) | 1.393(4) |
| O2B1O5 | 121.8(4) | 121.8(3) |
| O3B2O4 | 119.4(4) | 123.6(3) |
| O6B4O9 | 121.0(3) | 121.4(3) |
| O7B5O9 | 121.0(3) | 121.4(3) |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
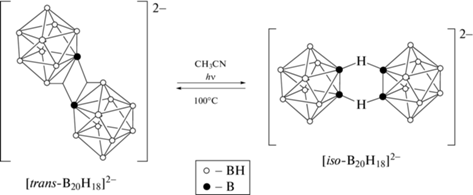
Анион [trans-B20H18]2– образуется в результате мягкого окисления клозо-декаборатного аниона в воде под действием окислителей, таких как FeCl3 или Ce(IV) [30]:
В литературе описано, что в растворе солей аниона [trans-B20H18]2– в ацетонитриле под действием УФ-облучения кластерный анион бора способен переходить в изо-изомер [iso-B20H18]2–, а при нагревании реакционного раствора или с течением времени происходит обратная реакция [33–36]:
Кроме того, твердофазная обратимая изомеризация [trans-B20H18]2– ↔ [iso-B20H18]2– изучена в кристаллах комплексов серебра(I) с Ph3P и свинца(II) с Bipy [37, 38]. При облучении комплексов серебра(I) и свинца(II) анион [trans-B20H18]2– полностью переходит в [iso-B20H18]2–; при нагревании кристаллов комплекс серебра(I) подвергается обратимой изомеризации, а комплекс свинца не подвергается. Cамопроизвольная реакция [trans-B20H18]2– → [iso-B20H18]2– в отсутствие УФ-облучения изучена в реакциях комплексообразования серебра [37] и кобальта [39].
В настоящей работе изучены продукты окисления кластерных анионов бора, которые образуются в качестве побочных при получении солей [B20H18]2–. Отметим, что результаты спектроскопических методов анализа соединений I и II полностью соответствуют данным, описанным в работах [33–39] для соединений с анионами [trans-B20H18]2– и [iso-B20H18]2–.
В ИК-спектрах соединений Ia и IIa присутствует уширенная полоса с максимумом около 1420 см–1, которая соответствует валентным колебаниям ν(BO) в соединении; отсутствие в спектре полос в области 2500 см–1 указывает на полное окисление кластерных анионов бора и отсутствие связей бор–водород. В спектрах 11В ЯМР наблюдается уширенный синглет около 21 м.д., который указывает на присутствие в соединениях связей бор–кислород.
Соединение Ia получено при полном окислении клозо-декаборатного аниона под действием солей церия(IV). Соль церия(III) остается в реакционном растворе:
Соединение IIa получено из фильтрата после выведения из реакционного раствора соединения (Ph4P)2[iso-B20H18]. Процесс изомеризации проводили в DMF для предотвращения испарения воды в ходе длительного УФ-облучения реакционного раствора:
Полученные соединения образуются в реакционных растворах в результате длительного нахождения реакционной смеси в растворенном виде после выведения целевых продуктов. При этом в фильтрате протекают процессы окисления кластерных анионов бора с образованием полиборатов.
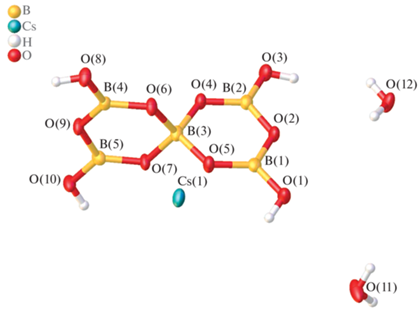
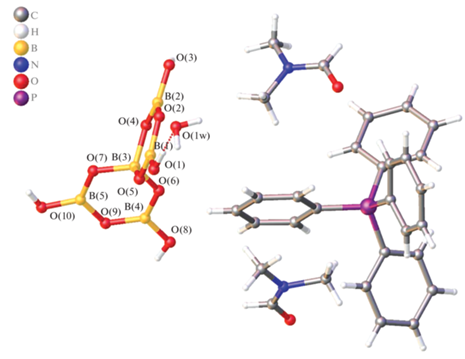
Кристаллографически независимая часть моноклинной элементарной ячейки (P21/c) кристалла Ia содержит катион Cs+, анион [B5O6(OH)4]– и две молекулы воды (рис. 1). Кристаллографически независимая часть триклинной элементарной ячейки IIa (P-1) включает аналогичный анион [B5O6(OH)4]–, катион ${\text{PPh}}_{4}^{ + },$ две молекулы DMF и молекулу воды (рис. 2).
В каждом случае анион [B5O6(OH)4]– состоит из двух колец [B3O3], связанных общим тетраэдрическим фрагментом [BO4] с sp3-гибридным атомом бора. Каждое кольцо [B3O3] сформировано двумя плоскотреугольными фрагментами [BO2OH], в которых атом бора имеет sp2-гибридизацию (табл. 2). Длина связей B–O в треугольных фрагментах [BO2OH] лежит в диапазоне 1.352(4)–1.387(5) Å для Ia и 1.357(4)–1.408(4) Å для IIa. Длина связей B–O для тетраэдрического фрагмента [BO4] в соединениях Ia и IIa составляет 1.469(5)–1.478(5) и 1.481(4)–1.509(4) Å соответственно. Данные согласуются с результатами, опубликованными ранее для аниона[B5O6(OH)4]– с другими органическими катионами [28, 39–44].
Таблица 2.
Водородные связи в Ia
| D | H | A | d(D–H), Å | d(H–A), Å | d(D–A), Å | DHA, град |
|---|---|---|---|---|---|---|
| O1 | H1 | O31 | 0.84 | 1.92 | 2.671(4) | 148.3 |
| O3 | H3 | O112 | 0.84 | 1.84 | 2.676(3) | 172.3 |
| O8 | H8 | O123 | 0.84 | 1.84 | 2.680(3) | 175.0 |
| O10 | H10 | O84 | 0.84 | 1.96 | 2.730(3) | 152.4 |
| O11 | H11A | O65 | 0.81 | 2.04 | 2.835(4) | 168.7 |
| O11 | H11B | O76 | 0.96 | 1.81 | 2.760(3) | 167.1 |
| O12 | H12A | O57 | 0.79 | 2.03 | 2.795(4) | 164.6 |
| O12 | H12B | O45 | 1.00 | 1.85 | 2.832(4) | 166.8 |
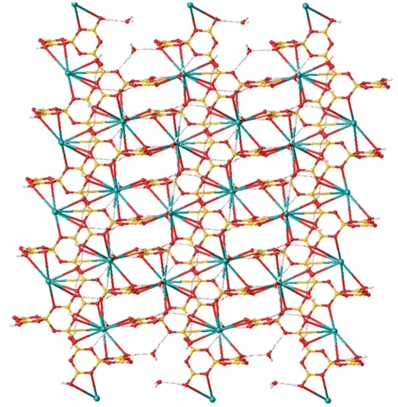
В структуре Ia анионы [B5O6(OH)4]– и молекулы воды образуют 3D-пространственные сети, связанные водородными связями (табл. 3, рис. 3). Катионы цезия располагаются в пустотах, стабилизируя таким образом отрицательно заряженный каркас (рис. 4).
Таблица 3.
Водородные связи в IIa
| D | H | A | d(D–H), Å | d(H–A), Å | d(D–A), Å | DHA, град |
|---|---|---|---|---|---|---|
| O1 | H1 | O1w | 0.82 | 1.96 | 2.735(4) | 157.9 |
| O3 | H3A | O41 | 0.82 | 2.00 | 2.792(3) | 162.0 |
| O8 | H8A | O122 | 0.82 | 2.11 | 2.909(6) | 164.1 |
| O8 | H8A | O132 | 0.82 | 2.02 | 2.76(2) | 150.8 |
| O10 | H10A | O73 | 0.82 | 1.97 | 2.775(3) | 165.8 |
Рис. 3.
Фрагмент трехмерного каркаса, образованного водородными связями между анионами [B5O6(OH)4]– и молекулами воды в соединении Ia.
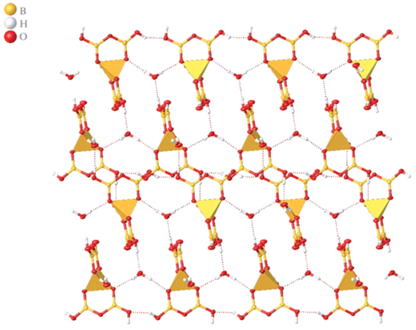
В отличие от структуры Ia, в структуре IIa анионы [B5O6(OH)4]– и молекулы воды образуют отрицательно заряженные слои, связанные водородными связями (табл. 3, рис. 5), в то время как катионы ${\text{PPh}}_{4}^{ + }$ расположены между этими слоями. Молекулы DMF располагаются в катионном слое и связаны водородными связями OH–O с анионами.
Полученные данные предоставляют новую информацию для детального изучения механизмов окислительно-восстановительных процессов, протекающих с участием кластерных анионов бора [45–49].
ЗАКЛЮЧЕНИЕ
Таким образом, методом РСА изучено строение продуктов деградации кластерных анионов бора Cs[B5O6(OH)4] · 2H2O и PPh4[B5O6(OH)4] · ⋅ 2DMF · H2O, полученных при проведении окислительно-восстановительных взаимодействий с использованием клозо-декаборатного аниона в качестве исходного реагента.
Список литературы
Muetterties E.L., Knoth W.H. // Polyhedral Boranes. New York: Marcel Dekker, 1968.
Sivaev I.B., Bregadze V.I., Sjöberg S. et al. // Collect. Czech. Chem. Commun. 2002. V. 87. P. 679.
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. P. 1149.
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. et al. // Russ. J. Inorg. Chem. 2010. V. 55. P. 2089.
Korolenko S.E., Kubasov A.S., Goeva L.V. et al. // Inorg. Chim. Acta. 2021. V. 527. P. 120587. https://doi.org/10.1016/j.ica.2021.120587
Zhang Y., Yang L., Wang L. // Chem. Int. Ed. 2019. V. 58. P. 8145.
Korolenko S.E., Zhuravlev K.P., Tsaryuk V.I. et al. // J. Lumin. 2021. V. 237. P. 118156. https://doi.org/10.1016/j.jlumin.2021.118156
Avdeeva V.V., Malinina E.A., Churakov A.V. et al. // Polyhedron. 2019. Т. 169. P. 144.
Avdeeva V.V., Polyakova I.N., Goeva L.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 302.
Malinina E.A., Korolenko S.E., Zhdanov A.P. et al. // J. Clust. Chem. 2021. V. 32. P. 755. https://doi.org/10.1007/s10876-020-01840-5
Korolenko S.E., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1350. https://doi.org/10.1134/S0036023621090047
Sadikin Y., Didelot E., Łodziana Z., Černý R. // Dalton Trans. 2018. V. 47. P. 5843.
Zhang Z., Zhang Y., Li Z. et al. // Eur. J. Inorg. Chem. 2018. P. 981.
Malinina E.A., Kochneva I.K., Avdeeva V.V. et al. // Russ. J. Inorg. Chem. 2019. V. 64. P. 1210.
Norman A.H., Kaczmarczyk A. // Inorg. Chem. 1974. V. 13. P. 2316.
Dziova A.E., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2011. V. 440. P. 253.
Avdeeva V.V., Dziova A.E., Polyakova I.N. et al. // Russ. J. Inorg. Chem. 2013. V. 58. P. 657.
Safronova E.F., Avdeeva V.V., Polyakova I.N. et al. // Dokl. Chem. 2013. V. 452. P. 240.
Avdeeva V.V., Vologzhanina A.V., Goeva L.V. et al. // Inorg. Chim. Acta. 2015. V. 428. P. 154.
Avdeeva V.V., Polyakova I.N., Churakov A.V. et al. // Polyhedron. 2019. V. 162. P. 65.
Avdeeva V.V., Malinina E.A., Goeva L.V. et al. // Dokl. Chem. 2017. V. 474. P. 141.
Miao J., Nie Y., Chen H. et al. // Z. Naturforsch. 2011. V. 66B. P. 387.
Nie Y., Miao J.-L., Hu C.-H. et al. // Polyhedron. 2012. V. 31. P. 607.
Abakumov G.A., Piskunov A.V., Cherkasov V.K. et al. // Russ. Chem. Rev. 2018. V. 87. P. 393. https://doi.org/10.1070/RCR4795
Pechenyuk S.I., Domonov D.P., Gosteva A.N. // Russ. J. Gen. Chem. 2021. V. 91. P. 1834. https://doi.org/10.1134/S1070363221090310
Bardin V.V., Prikhod’ko S.A., Shmakov M.M. et al. // Russ. J. Gen. Chem. 2020. V. 90. P. 50. https://doi.org/10.1134/S1070363220010089
Topnikova A.P., Belokoneva E.L. // Russ. Chem. Rev. 2019. V. 88. P. 204. https://doi.org/10.1070/RCR4835
Avdeeva V.V., Malinina E.A., Vologzhanina A.V. et al. // Inorg. Chim. Acta. 2020. V. 509. Art. 119693. https://doi.org/10.1016/j.ica.2020.119693
Miller H.C., Miller N.E., Muetterties E.L. et al. // J. Am. Chem. Soc. 1963. V. 85. P. 3885. https://doi.org/10.1021/ja00906a033
Chamberland B.L., Muetterties E.L. // Inorg. Chem. 1964. V. 3. P. 1450. https://doi.org/10.1021/ic50020a025
Sheldrick G.M. // Acta Crystallogr., Sect. C. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Kaczmarczyk A., Dobrott R.D., Lipscomb W.N. // Proc. Nat. Acad. Sci. USA. 1962. V. 48. P. 729.
Hawthorne M.F., Pilling R.L., Stokely P.F., Garrett P.M. // J. Am. Chem. Soc. 1963. V. 85. P. 3704.
Curtis Z.B., Young C., Dickerson R., Kaczmarczyk A. // Inorg. Chem. 1974. V. 13. P. 1760.
Li F., Shelly K., Knobler C.B., Hawthorne M.F. // Angew. Chem., Int. Ed. 1998. V. 37. P. 1865.
Avdeeva V.V., Buzin M.I., Malinina E.A. et al. // Cryst-EngComm. 2015. V. 17. P. 8870. https://doi.org/10.1039/C5CE00859J
Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // J. Struct. Chem. 2019. V. 60. P. 692. https://doi.org/10.1134/S0022476619050020
Avdeeva V.V., Kubasov A.S., Korolenko S.E. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 5. C. 628. https://doi.org/10.1134/S0036023622050023
Xuetao Xu, Kanyi Liang, Yirou Lin // Z. Anorg. Allg. Chem. 2014. V. 640. P. 110.
Beckett M.A., Coles S.J., Horton P.N. // J. Cluster Sci. 2017. V. 28. P. 2087.
Sa-Ying Li, Zhi-Hong Liu // J. Therm. Anal. Calorim. 2016. V. 126. P. 913.
Yang Yang, DongSheng Fu, GuoFa Li, Yun Zhang // Z. Anorg. Allg. Chem. 2013. P. 639.
Abakumov G.A., Piskunov A.V., Cherkasov V.K. et al. // Russ. Chem. Rev. 2018. V. 87. P. 393. https://doi.org/10.1070/RCR4795
Korolenko S.E., Goeva L.V., Kubasov A.S. et al. // Russ. J. Inorg. Chem. 2020. V. 65. P. 846. https://doi.org/10.1134/S0036023620060091
Sivaev I.B. // Russ. J. Inorg. Chem. 2020. V. 65. P. 1854. https://doi.org/10.1134/S0036023620120165
Matveev E.Yu., Novikov I.V., Kubasov A.S. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 187. https://doi.org/10.1134/S0036023621020121
Klyukin I.N., Kolbunova A.V., Selivanov N.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1798. https://doi.org/10.1134/S003602362112007X
Burdenkova A.V., Zhdanov A.P., Klyukin I.N. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1616. https://doi.org/10.1134/S0036023621110036
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии