Журнал неорганической химии, 2022, T. 67, № 5, стр. 591-598
Комплексные соединения диоксомолибдена(VI) с ацилгидразонами. Кристаллическая структура никотиноилгидразона 5-нитросалицилового альдегида (H2L) и сольватокомплекса МоО2(L)·Me2SO
В. С. Сергиенко a, *, В. Л. Абраменко b, М. Д. Суражская a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Луганский государственный университет им. В. Даля
910341 Луганск, Молодежный квартал, 20А, Украина
* E-mail: sergienko@igic.ras.ru
Поступила в редакцию 03.09.2021
После доработки 25.10.2021
Принята к публикации 01.11.2021
- EDN: JXVNPM
- DOI: 10.31857/S0044457X22050154
Аннотация
Проведены синтез и исследование строения никотиноилгидразона 5-нитросалицилового альдегида (H2L) и сольватокомплекса МоО2(L)⋅Me2SO (I) методами ИК-спектроскопии и рентгеноструктурного анализа. По данным РСА, атом молибдена в I имеет октаэдрическую координацию двумя лигандами цис-О2(оксо), атомами N(L), О(Solv) в транс-позициях к О(оксо) и двумя атомами О(L) в цис-положениях к О(оксо) и в транс-позициях друг к другу. Атом Мо координирует лиганд L2– тридентатным (2О, N) бис-хелатным способом. Средние длины связей в I: Мо–О(оксо) 1.690, Мо–N(L) 2.249, Мо–О(L) 1.965, Мо–О(Me2SO) 2.260 Å, валентный угол О(оксо)МоО(оксо) равен 105.1°. Рассмотрены изменения геометрических параметров лиганда L2– при переходе от H2L и координации атомом Мо в комплексе I. Получен аддукт МоО2Сl2⋅2H2L (II), на основании данных ИК-спектроскопии обсуждено его строение.
ВВЕДЕНИЕ
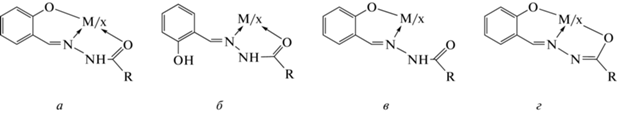
Гидразоны и комплексные соединения на их основе интенсивно изучаются в связи с широким спектром их применения, а именно: в качестве лекарственных препаратов [1–5], моделей для изучения механизма биохимических процессов [6–8], селективных катализаторов [9–14], эффективных присадок к смазочным материалам [15, 16] и др. В теоретическом плане гидразоны представляют интерес как амбидентные лигандные системы, для которых характерно наличие в растворах органических растворителей равновесия различных таутомерных форм, что позволяет получать комплексы переходных металлов различного типа и строения – аддукты, или молекулярные комплексы (МК), в которых лиганд координирован в нейтральной кетогидразинной форме, и внутрикомплексные соединения (ВКС), в молекулах которых лиганд обычно находится в депротонированной енолиминной таутомерной форме [17]. Авторами [17, 18] показано, что в комплексах металлов с ароил(ацил)гидразонами замещенных салициловых альдегидов возможна реализация четырех основных типов координации лигандов:
Проведенные в последнее время исследования комплексообразования диоксомолибдена(VI) с ацилгидразонами замещенных салициловых альдегидов убедительно свидетельствуют о том, что состав и строение комплексов существенно зависят от температурных условий синтеза, а также от природы реагирующих компонентов и растворителей [10]. В частности, авторами [10] взаимодействием МоО2Сl2 с никотиноилгидразонами замещенных салициловых альдегидов в среде метанола при комнатной температуре получены комплексы состава [MoO2(HL)(MeOH)]Cl, тогда как реакция ацетилацетоната молибденила МоО2(Асас)2 с теми же гидразонами в кипящем метаноле приводит к образованию моноядерных ВКС [MoO2(L)(MeOH)]. Обработка моноядерных комплексов парами растворителей или проведение реакций при высоких температурах сопровождается структурной перестройкой с образованием координационных полимеров [10]. Примечательно, что в мягких условиях (комнатная температура, бензол, эфир) МоО2Сl2 реагирует с ацилгидразонами замещенных салициловых альдегидов с образованием МК, аддуктов, МоО2Сl2⋅2H2L, а не ВКС [19].
В настоящем сообщении представлены результаты исследования методами ИК-спектроскопии и рентгеноструктурного анализа (РСА) сольватокомплекса диоксомолибдена(VI) [МоО2(L)(Ме2SO)] (I) с малоизученным ацилгидразоном – производным 5-нитросалицилового альдегида и гидразида никотиновой кислоты (H2L) (R = 3-С5H4N), а также свободной молекулы H2L. Реакцией МоО2Сl2 с H2L в тетрагидрофуране получен МК МоО2Сl2⋅2H2L (II) и рассмотрено его возможное строение. Поскольку в сольватокомплексах типа I “сольватная” молекула координирована с атомом молибдена, структурную формулу подобных соединений естественно заключить в квадратные скобки: [МоО2(Ln)(Solv)], n = 0–11, Solv = Ме2SO, MeOH, EtOH, OPPh3.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез. Исходный ацилгидразон получали аналогично [19] конденсацией 5-нитросалицилового альдегида с эквимолярным количеством гидразида никотиновой кислоты в этаноле. Получены желтые кристаллы с tпл = 271–273°С.
Комплекс I синтезировали методом лигандного обмена между ацетилацетонатом молибденила и H2L в среде кипящего метанола. К горячему раствору 0.326 г (0.001 моль) МоО2(Асас)2 в 20 мл метанола добавляли раствор 0.286 г (0.001 моль) H2L в 10 мл метанола, затем по каплям добавляли 0.5 мл диметилсульфоксида и кипятили реакционную смесь в течение получаса. Смесь оставляли при комнатной температуре для кристаллизации. Выпавшие желтые кристаллы отделяли на фильтре Шотта, промывали холодным метанолом и сушили вначале в токе сухого аргона, затем в эксикаторе над CaCl2. Выход составил 82% от теоретического. Комплекс десольватируется при нагревании выше 160°C, разлагается выше 300°С.
| C | Н | N | Mo | |
| Найдено, %: | 36.83; | 2.95; | 11.54; | 19.48. |
| Для C15H14MoN4O7S | ||||
| вычислено, %: | 36.74; | 2.88; | 11.43; | 19.57. |
Аддукт II получали взаимодействием диоксодихлорида молибдена с гидразоном в тетрагидрофуране при слабом нагревании до ~40°С и перемешивании в течение 2 ч. Образовавшийся желтый аморфный осадок отделяли на фильтре Шотта, снабженном осушительной системой, и промывали холодным эфиром. Выход комплекса составил 93% от теоретического, tпл = 157–159°С.
| C | Н | N | Cl | Mo | |
| Найдено, %: | 40.56; | 2.69; | 14.60; | 9.22; | 12.37. |
| Для C26H20Cl2MoN8O10 | |||||
| вычислено, %: | 40.49; | 2.61; | 14.53; | 9.19; | 12.44. |
Элементный анализ проводили с помощью C,H,N-анализатора Carlo-Erba 1106. Содержание молибдена в комплексах определяли прокаливанием навески до весовой формы МоО3 [19]. Хлор определяли по известной методике Фольгарда.
ИК-спектры соединений регистрировали на спектрометре ИКС-29 в области 3600–400 см–1 (суспензия в вазелиновом масле).
РСА монокристаллов I и H2L выполнен на автоматическом дифрaктометре Enraf-Nonius CAD-4 при комнатной температуре (293 K, графитовый монохроматор, МоKα-излучение, λ = 0.71073 Å и СuKα-излучение, λ = 1.54178 Å соответственно). Поправка на поглощение введена на основании измерений интенсивности эквивалентных отражений [20]. Кристаллографические и экспериментальные данные для комплекса I и H2L приведены в табл. 1. Обе структуры определены прямым методом и уточнены полноматричным анизотропным МНК по F 2 для всех неводородных атомов [21]. Все атомы водорода найдены из разностного ряда электронной плотности и уточнены изотропно. Структурные характеристики комплекса I и H2L депонированы в Кембриджском банке структурных данных (CCDC, № 2102263 и 2102264 соответственно).
Таблица 1.
Кристаллографические данные и детали РСА для I и H2L
| Параметр | I | H2L |
|---|---|---|
| Брутто-формула | C15H14MoN4O7S | C13H11N4O4 |
| М | 490.30 | 287.26 |
| Размер кристалла, мм | 0.17 × 0.15 × 0.10 | 0.14 × 0.13 × 0.03 |
| Излучение | λMoKα | λCuK |
| Сингония | Моноклинная | Ромбическая |
| Пр. гр. | Р21/c | Pna21 |
| Параметры ячейки: | ||
| a, Å | 8.388(6) | 8.8083(10) |
| b, Å | 19.3105(10) | 29.11(2) |
| c, Å | 21.1612(10) | 4.781(2) |
| β, град | 93.03(7) | 90 |
| V, Å3 | 1827.5(1.1) | 1225.9(10) |
| Z | 4 | 4 |
| ρвыч, г/см3 | 1.782 | 1.551 |
| μ, мм–1 | 0.880 | 1.006 |
| F(000) | 984 | 596 |
| Область θ, град | 2.20–29.97 | 5.25–69.93 |
| Интервалы индексов | –11 ≤ h ≤ 11 –14 ≤ k ≤ 14 –29 ≤ l ≤ 29 |
–10 ≤ h ≤ 10 –35 ≤ k ≤ 35 –5 ≤ l ≤ 5 |
| Всего отражений | 15 610 | 8580 |
| Независимых отражений | 5221 (Rint = 0.1025) |
2306 (Rint = 0.0664) |
| Количество переменных | 253 | 194 |
| R1(I > 2σ(I)) | 0.0355 | 0.0365 |
| wR2 (все данные) | 0.0877 | 0.1113 |
| Добротность по F 2 | 0.931 | 0.881 |
| Δρmin/Δρmax, e/Å3 | –0.837/0.521 | –0.207/0.154 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ИК-спектре комплекса I исчезают полосы поглощения валентных колебаний NH-группы, присутствующие в спектре свободного гидразона при 3210 см–1. В области 1500—1700 см–1 в спектре ацилгидразона наблюдается серия интенсивных полос, обозначаемых как “амид I” (полоса амидной карбонильной группы ν(С=О) при 1660 см–1) и “амид II” (полоса δ(N–H) при 1557 см–1) [19]. В спектре комплекса I полосы поглощения “амид I” и “амид II” исчезают, но появляется новая полоса при 1250 см–1, обусловленная колебаниями одинарной связи С–О, что может свидетельствовать о координации ацилгидразона в депротонированной имидоалкогольной форме г. Косвенным подтверждением этого предположения является увеличение интенсивности полосы поглощения ν(С=N) лиганда (1624 см–1) в результате комплексообразования и ее смещение в низкочастотную область на 8 см–1 в спектре I. Интенсивный дублет при 940 и 907 см–1 относится к асимметричным и симметричным валентным колебаниям группы цис-МоО2 [19]. В области низких частот полосы поглощения при 635 и 580 см–1 соответствуют колебаниям связей Мо—N(L) и Мо—O(L) [22]. Полоса валентных колебаний связи S=O, фиксируемая в спектре свободного ДМСО при 1040 см–1, в спектре I понижается на 35 см–1, что свидетельствует о координации ДМСО с атомом металла через атом кислорода [23].
На основании результатов ИК-спектроскопии, элементного анализа и литературных данных [24, 25] можно предположить, что в комплексе I атом молибдена имеет искаженную октаэдрическую координацию с двумя оксолигандами цис-МоО2-группы, атомом азота азометиновой группы и двумя атомами кислорода депротонированной молекулы лиганда L2– (структура г). Шестую позицию в координационном октаэдре молибдена занимает атом кислорода сольватной молекулы ДМСО. Данные ИК-спектроскопии подтверждаются результатами монокристального РСА комплекса I.
В ИК-спектре МК II сохраняется полоса поглощения валентных колебаний NH-группы при ~3210 см–1. Полосы поглощения, соответствующие валентным колебаниям связи С=О (“амид I”), также практически не изменяют своего положения, что свидетельствует о неучастии в донорно-акцепторном взаимодействии атома кислорода карбонильной группы. Полосы поглощения “амид II” в спектре комплекса II смещаются незначительно, что является дополнительным подтверждением отсутствия координации органического лиганда через амидный атом кислорода. Отсутствие смещения полосы валентных колебаний гетерокольца (1575 см–1) указывает на неучастие в координации с молибденом атома азота пиридинового фрагмента гидразона.
Можно предположить, что в МК, подобно салицилиденалкил(арил)иминам, ацилгидразоны координированы в хиноидной таутомерной форме с локализацией координационной связи на атоме кислорода группы С=О(хиноид) альдегидного фрагмента H2L. Наблюдаемую в спектре II интенсивную полосу при 1655 см–1, по-видимому, следует отнести к пониженному вследствие комплексообразования карбонильному поглощению хиноидного таутомера молекулы H2L. Этот вопрос неоднократно обсуждался в литературе (например, [19, 25–27]). Однако окончательное решение вопроса о координации в комплексе II определенной таутомерной формы молекулы лиганда H2L возможно лишь на основании данных РСА. К сожалению, не удалось получить кристаллы комплекса II, пригодные для проведения прямых рентгеноструктурных исследований.
Строение комплекса I ([МоО2(L)(Ме2SO)]) установлено методом РСА. Двухосновный лиганд L2– координирован к атому молибдена дважды депротонированным тридентатным бис(хелатным) способом (ONO) с образованием двух хелатных колец. Атом N(L) расположен в транс-положении к кратносвязанному оксолиганду, два атома О(L) – в цис-позициях к лигандам О(оксо) и в транс-положении друг к другу. Шестую позицию в координационном октаэдре МоО5N соединения I занимает атом О сольватной молекулы диметилсульфоксида в транс-позиции к оксолиганду молибдениловой группы МоО22+. Средняя длина связи в комплексе I: Мо—О(оксо) 1.690(3) Å. Расстояния Мо—N(L) и Мо—О(ДМСО) (соответственно 2.249(3) и 2.260(3) Å) сильно увеличены вследствие структурного проявления трансвлияния кратносвязанного лиганда О(оксо). Одинарные связи Мо—О(L) в цис-положениях к лигандам О(оксо) и в транс-позициях друг к другу (среднее значение 1.965(2) Å) заметно короче, чем Мо—О(Solv) (в среднем на 0.295 Å). Лиганд L2– в структурe I при координации с атомом металла замыкает два xелатных кольца, сочлененных по связи М—N: шестичленное МоNC3O и пятичленное MoN2CO.
Валентные углы при атоме металла в координационном полиэдре MoO5N в данной структуре существенно (и закономерно) отклоняются от идеальных значений 90° и 180°. Нaибoльший угол – ОоксоМоОоксо 105.1(1)°. Четыре угла ОоксоМоО(L) 97.8(1)°–104.0(1)°, как и О(5)оксоМоN(L) 103.0(1)°, также превышают 90°. Углы в металлоциклах О(L)MoN(L) (71.73(9)° и 81.36(9)°) значительно меньше 90°, как и угол N(L)MoO(Solv) (78.95(9)°). Транс-угoл О(L)MoO(L) (148.5(1)°) более чем на 30° отклонен от строго линейного значения 180°. Заметно меньше отклонены от 180° углы ОоксоМоN(L) (163.0(1)°) и ОоксоМоО(Solv) (168.5(1)°).
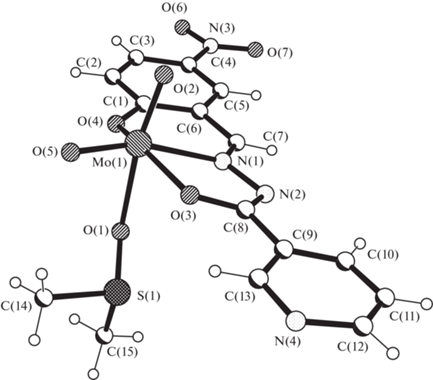
Строение комплекса I приведено на рис. 1. В структуре I нет коротких внутри- и межмолекулярных контактов.
Рис. 1.
Строение комплекса I. Основные межатомные расстояния и валентные углы: Мо(1)–О(2) 1.688(3), Мо(1)–О(5) 1.692(2), Мо(1)–О(3) 1.990(2), Мо(1)–О(4) 1.939(2), Мо(1)–О(1) 2.260(2), Mo–N(1) 2.249(2), N(1)–N(2) 1.396(3), N(1)–C(7) 1.284(4), N(2)–C(8) 1.294(4) Å, N(1)N(2)C(8) 108.8(2)°, N(2)N(1)C(7) 116.6(3)°.
Строение органической молекулы H2L приведено на рис. 2а. В структуре плоские циклы – фенильный (A, С(1)–С(6)) и пиридильный (Б, С(10)–С(14), N(3)) – связаны зигзагообразной четырехзвенной цепочкой (В) С(8)Н—N(1)—N(2)Н—С(9)Н. При координации с атомом молибдена дважды депротонированного (по атомам О(2) и N(2)) лиганда L2– некоторые геометрические параметры остаются неизменными (N(1)—N(2) 1.396(3) и 1.378(3), N(1)—C 1.289(4) и 1.282(3), N—О 1.214(5) и 1.226(3) Å соответственно в I и H2L ), тогда как два расстояния (и ряд валентных углов) существенно меняются. При переходе от структуры H2L к I: а) при координации атома кислорода (О(1) в H2L, О(3) в I) связь О—С удлиняется от 1.234(3) до 1.327(4) Å; б) при переходе от группы НN(2) к атому N(2)– связь N(2)—С укорачивается от 1.344(3) до 1.294(4) Å. При переходе от структуры H2L к I меняется также величина (в пределах 3.5°–10.6°) как минимум восьми валентных углов: О(1)С(9)С(10) в H2L (О(3)С(8)С(9) в I) уменьшается от 121.1(2)° до 115.8(3)°; О(2)С(1)С(2) в H2L (О(4)С(1)С(6) в I) увеличивается от 117.2(2)° до 122.9(3)°; О(2)С(1)С(6) в H2L (О(4)С(1)С(2) в I) уменьшается от 122.6(2)° до 116.9(2)°; N(1)С(8)С(2) в H2L (N(1)С(7)С(6) в I) увеличивается от 119.6(2)° до 123.1(3)°; N(1)N(2)С(9) в H2L (N(1)N(2)С(9) в I) уменьшается от 119.4(2)° до 108.8(2)°; N(2)С(9)С(10) в H2L (N(2)С(8)С(9) в I) увеличивается от 116.8(2)° до 120.3(3)°. Изменение величины указанных валентных углов может свидетельствовать о некотором изменении степени гибридизации центрального атома (С или N).
Рис. 2.
Строение органического соединения H2L (а). Основные межатомные расстояния и валентные углы: N(1)–N(2) 1.378(3), N(1)–C(8) 1.282(3), N(2)–C(9) 1.344(3) Å, N(1)N(2)C(9) 119.4(2)°, N(2)N(1)C(8) 115.1(2)°. Упаковка структурных единиц в соединении H2L (б). Пунктирными линиями показаны водородные связи.
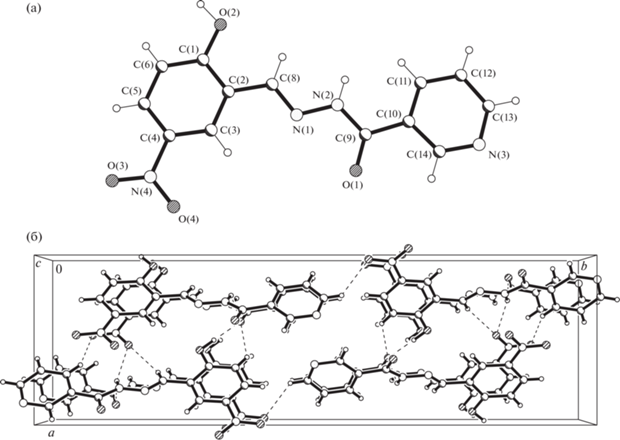
В структуре H2L молекулы объединены короткими межмолекулярными контактами (рис. 2б), которые можно трактовать как достаточно слабые водородные связи типа D—H…O: N(2)—Н(2А)…О(4) #1, O(2)—Н(2O)…О(1) #1, N(2)—Н(2А)…О(1) #2 (#1 x +1/2, –y + 3/2, z – 1; #2 x, y, z – 1). Соответственно D—H 0.86 (D = N), 0.95(4) (D = O), 0.86 (D = N); H…O 2.45, 1.78(4), 2.50; D…O 3.186(3) (D = N), 2.708(2) (D = O), 3.063(3) (D = N); углы DHO 145° (D = N), 165(3)° (D = O), 124° (D = N).
Комплексные молекулы в структуре I объединены π–π-стэкинг-взаимодействиями, тогда как аналогичные взаимодействия в структуре органической молекулы H2L отсутствуют.
Сходное строение с соединением I имеют еще девять сольватных комплексов МоО2Ln · Solv с основаниями Шиффа (Ln)2– – тридентатными (О,N,O) бис(хелатными) гидразоновыми лигандaми: [МоО2L1(МеОН)] (исследован методом РСА при 150 (IIIа) [28] и 293 K (IIIб) [29]), [МоО2L2(Me2SO)] (IV) [28], [MoO2L3(MeOH)] (V) [30], [MoO2L4(OPPh3)] (VI) [31], [MoO2L5(MeOH)] (VII) [29], [MoO2L6(MeOH)] (VIII) [29], [MoO2L7(MeOH)] (IX) [32], [MoO2L8(MeOH)] (Х) [24] и [MoO2L9(EtOH)] (ХI) [31]; H2L1 – изоникотиноилгидразон ацетилацетона С11Н12N3О2; H2L2 – безоилгидразон бензоилацетона С17Н11N2О2; H2L3 – бензоилгидразон салицилового альдегида C14H13N2O2; H2L4 – бензоилгидразон бензоилацетона C17H14N2O2, H2L5 – (4-оксо-4-фенилбутан-2-илиден)изоникотиноилгидразид С16Н15N3O2, H2L6 – (2,3-дигидроксибензилиден)бензогидразид C14H1N2O3, H2L7 – изоникотиноилгидразон салицилового альдегида C13H11N3O2; H2L8 – α-нафтилацетилгидразон салицилового альдегида C19H16N2O2, H2L9 – конденсат 5-нитросалицилальдегида и никотингидразида C13H10N4O. Геометрические параметры комплексов III—ХI cопоставимы с большинством аналогичных величин в исследованном нами соединении I (табл. 2): интервал значений Мо=О(оксо) 1.684—1.698; Mo—N(Ln)транс 2.216—2.254, Мо—О(Ln)цис 1.956—1.988 Å. Исключение составляют длины связей Mo—O(Solv)транс, разброс значений для которых достаточно велик (2.239–2.392 Å). При этом минимальное расстояние Mo–O(Solv)транс — для сольватной молекулы трифенилфосфиноксида в структуре VI (2.239 Å). Аналогичные связи для Solv = Me2SO в структуре I и IV несколько длиннее (2.260 и 2.316 Å), а связи Mo—O(МеОН )транс в структуре IIIa, IIIб, V, VII—Х — самые длинные (2.333—2.392 Å). Расстояние Mo—O(EtОН)транс в структуре ХI (2.290 Å) имеет промежуточное значение.
Таблица 2.
Средние межатомные расстояния (Å) в мономерных октаэдрических комплексах [MoO2(Ln)]·Solv
| Комплекс | Мо=O(oкco) | Мо–О(Ln)цис | Мо–N(Ln )транс | Мо–О(Solv)транс | Δ(=О)* | Источник |
|---|---|---|---|---|---|---|
| [MoO2(L)(Me2SO)] (I) | 1.690(3) | 1.965(2) | 2.249(3) | 2.2600(3) | 0.295 | Наст. работа |
| [МоO2(L1)(МеОН)], 159К (IIIа) | 1.698(2) | 1.985(2) | 2.216(2) | 2.333(2) | 0.348 | [28] |
| [МоO2(L1)(МеОН)], 293К (IIIб) | 1.695(2) | 1.988(2) | 2.219(2) | 2.351(2) | 0.363 | [29] |
| [МоO2(L2)(Ме2SО)] (IV) | 1.695(3) | 1.969(3) | 2.217(3) | 2.316(3) | 0.317 | [28] |
| [МоO2(L3)(МеОН)] (V) | 1.694(3) | 1.961(3) | 2.243(3) | 2.356(3) | 0.395 | [30] |
| [МоO2(L4)(ОPPh3)] (VI) | 1.694(2) | 1.960(2) | 2.226(4) | 2.239(2) | 0.279 | [31] |
| [МоO2(L5)(МеОН)] (VII) | 1.697(2) | 1.958(1) | 2.245(2) | 2.367(2) | 0.404 | [29] |
| [МоO2(L6)(МеОН)] (VIII) | 1.693(3) | 1.964(2) | 2.245(2) | 2.359(3) | 0.395 | [29] |
| [МоO2(L7)(МеОН)] (IX) | 1.696(3) | 1.965(2) | 2.250(2) | 2.333(2) | 0.368 | [32] |
| [МоO2(L8)(МеОН)] (Х) | 1.690(3) | 1.956(3) | 2.224(4) | 2.392(4) | 0.436 | [24] |
| [МоO2(L9)(EtОН)] (ХI) | 1.684(4) | 1.977(4) | 2.254(4) | 2.290(4) | 0.313 | [31] |
| 1.690(3) | 1.956(3) | 2.224(4) | 2.392(4) | 0.436 [24] |
ЗАКЛЮЧЕНИЕ
Приведенные результаты исследования с учетом ранее полученных данных [19] убедительно свидетельствуют о возможности получения с ацилгидразонами ароматических о-оксиальдегидов как внутрикомплексных соединений диоксомолибдена(VI), так и комплексов молекулярного типа – аддуктов. Вопрос о строении последних и координации центральным атомом определенных таутомерных форм ацилгидразонов остается дискуссионным, поскольку до сих пор не удается получить кристаллы, пригодные для РСА, а выводы о строении МК основываются лишь на данных спектроскопических исследований, что интерпретируется достаточно неоднозначно. Напротив, согласно результатам рентгеноструктурных исследований, в сольватокомплексах диоксомолибдена(VI) с ацилгидразонами, как и в комплексах других d-металлов [32–35], лиганд координируется в дважды депротонированной имидоалкогольной таутомерной форме с образованием пяти- и шестичленного хелатных металлоциклов (2О,N бис-хелатный тридентатный тип координации). Шестую позицию в координационном октаэдре молибдена занимают донорные атомы органических растворителей (Solv) в транс-позиции к оксолиганду цис-МоО2-группы. При этом расстояния Мо–N(L) и Мо–О(Solv) сильно увеличены по сравнению со стандартными значениями вследствие структурного проявления транс-влияния кратносвязанного лиганда О(оксо).
Список литературы
Машковский М.Д. Лекарственные средства. М.: Новая волна, 2019. 1216 с.
Xia L.X., Xia Y.F., Huang L.R. et al. // Eur. J. Med. Chem. 2015. V. 97. P. 83. https://doi.org/10.1016/j.ejmech.2015.04.042
Cvijanović D., Pisk J., Pavlović G. et al. // New. J. Chem. 2019. V. 43. P. 1791.
Küçük H.B., Mataraci E., Çelik B.Ö. // Turkish J. Chem. 2015. V. 1. № 1. P. 1. https://doi.org/10.3906/kim-1502-122
Kaplanek R., Havlik M., Dolensky B. et al. // Bioorg. Med. Chem. 2015. V. 23. P. 1651. https://doi.org/10.1016/j.bmc.2015.01.029
Singh V.P., Gupta P. // J. Enzym. Inhib. 2008. V. 23. P. 797. https://doi.org/10.1080/14756360701733136
Singh V.P., Singh S., Singh D.P. // J. Enzym. Inhib. 2012. V. 27. P. 319. https://doi.org/10.3109/14756366.2011.588228
Backes G.L., Neuman D.M., Jursic B.S. // Bioorg. Med. Chem. 2014. V. 22. № 17. P. 4629. https://doi.org/10.1016/j.bmc.2014.07.022
Bikas R., Lippolis V., Noshiranzadeh N. et al. // Eur. J. Inorg. Chem. 2017. V. 6. P. 999.
Vrdoljak V., Mandarić M., Hrenar T. et al. // Cryst. Crowth Des. 2019. V. 19. P. 3000. https://doi.org/10.1021/acs.cgd.9b0023
Pisk J., Bilić L., Đaković M. et al. // Polyhedron. 2018. V. 145. P. 70.
Cordas C.M., Moura J.J.G. // Coord. Chem. Rev. 2019. V. 394. P. 53.
Asha T.M., Kurup M.R.P. // Polyhedron. 2019. V. 169. P. 151.
Kuriakose D., Kurup M.R.P. // Polyhedron. 2019. V. 170. P. 749.
Jaiswal V., Gupta S.R., Rastogi R.B. et al. // J. Mater. Chem. A. 2015. V. 3. № 9. P. 5092. https://doi.org/10.1039/c4ta05663a
Rastogi R.B., Maurya J.L., Jaiswal V. // Tribol. Trans. 2013. № 56. P. 592. https://doi.org/10.1080/10402004.2012.748115
Коган В.А., Зеленцов В.В., Ларин Г.М., Луков В.В. Комплексы переходных металлов с гидразонами: Физико-химические свойства и строение. М.: Наука, 1990. 112 с.
Burlov A.S., Vlasenko V.G., Chal’tsev B.V. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 7. P. 439. https://doi.org/10.1134/S1070328421070010
Абраменко В.Л., Гарновский А.Д., Абраменко Ю.В. // Коорд. химия. 1994. Т. 20. № 1. С. 39.
Sheldrick G.M. SADABS. Program for scaling and correction of area detector data. University of Gottingen. Germany, 1966.
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71C. № 1. P. 3.
Sergienko V.S., Abramenko V.L., Surazhskaya M.D. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 495. https://doi.org/10.1134/S0036023620040166
Беллами Л. Инфракрасные спектры сложных молекул. М.: Изд-во иностр. литер., 1963. 592 с.
Сергиенко В.С., Абраменко В.Л., Миначева Л.Х. // Коорд. химия. 1993. Т. 19. № 1. С. 28.
Abramenko V.L., Sergienko V.S. // Russ. J. Inorg. Chem. 2009. V. 54. № 13. P. 2031. https://doi.org/10.1134/S00360236091.30014
Гарновский А.Д. // Коорд. химия. 1992. Т. 18. № 7. С. 675.
Гарновский А.Д., Васильченко И.С., Гарновский Д.А. Современные аспекты синтеза металлокомплексов. Основные лиганды и методы. Ростов-на-Дону: ЛаПО, 2000. 355 с.
Сергиенко В.С., Абраменко В.Л., Чураков А.В., Суражская М.Д. // Журн. неорган. химии. 2021. Т. 66. № 12. С. 1732. https://doi.org/10.31857/S0044457X21120151
Nandy M., Shit S., Rizzoli C. et al. // Polyhedron. 2015. V. 88. № 1. P. 63. https://doi.org/10.1016/j.poly.2014.12.017
Banße W., Ludwig E., Schilde U., Uhlemann E. // Z. Anorg. Allg. Chem. 1995. Bd. 621. № 8. S. 1275.
Kargar H., Forootan P., Fallah-Mehrjjatdi M. et al. // Inorg. Chim. Acta. 2021. V. 523. P. 120414. https://doi.org/10.1016./j.icf.2021.1204414
Юсупов В.Г., Насирдинов С.Д., Якимович С.И., Парпиев Н.Я. // Коорд. химия. 1984. Т. 10. № 3. С. 387.
Ludwig E., Hefele H., Uhlemann E. et al. // Z. Anorg. Allg. Chem. 1995. Bd. 621. № 1. S. 23.
Hefele H., Ludwig E., Uhlemann E. et al. / Z. Anorg. Allg. Chem. 1995. Bd. 621. № 9. S. 1431.
Banße W., Ludwig E., Schilde U. et al. // J. Inorg. Biochem. 1995. V. 59. № 2–3. P. 730.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии