Журнал неорганической химии, 2022, T. 67, № 5, стр. 599-605
Гекса(тиоцианато-N)хроматные(III) комплексы лантаноидов(III) c диметилсульфоксидом: синтез и кристаллическая структура
Т. Г. Черкасова a, *, Н. В. Первухина b, Н. В. Куратьева b, Е. В. Черкасова a, Ю. Р. Гиниятуллина a, Э. С. Татаринова a
a Кузбасский государственный технический университет им. Т.Ф. Горбачева
650000 Кемерово, ул. Весенняя, 28, Россия
b Институт неорганической химии им. А.В. Николаева СО РАН
630092 Новосибирск, пр-т Академика Лаврентьева, 3, Россия
* E-mail: ctg.htnv@kuzstu.ru
Поступила в редакцию 30.08.2021
После доработки 15.11.2021
Принята к публикации 29.11.2021
- EDN: JOUSUQ
- DOI: 10.31857/S0044457X22050051
Аннотация
Методами ИК-спектроскопии и рентгеноструктурного анализа изучены двойные комплексные соединения состава [Ln(DMSO)8][Cr(NCS)6], где Ln = Nd (1), Eu (2), Gd (3), Dy(4), Ho (5), Lu (6), Tb (7), Yb (8), синтезированные по реакции между водными растворами Ln(NO3)3 и K3[Cr(NCS)6] и диметилсульфоксидом C2H6SO (DMSO). Монокристаллы соединений для РСА получены изотермической перекристаллизацией порошков комплексов из диметилсульфоксидных растворов. Соединения 1–8 изоструктурны, кристаллизуются в триклинной сингонии, пр. гр. P$\overline 1 $. Кристаллическая структура островная с катионами [Ln(DMSO)8]3+ и анионами [Cr(NCS)6]3–. В независимой части присутствует по два катиона и по два аниона. Координационное окружение атома Ln состоит из 8 атомов О, принадлежащих молекулам DMSO, располагающимся в вершинах искаженной квадратной антипризмы. В изолированных анионах [Cr(NCS)6]3– координационный полиэдр хрома(III) близок к правильному октаэдру и состоит из атомов N шести NCS-ионов. Упаковка по центрам комплексных катионов и анионов представляет собой искаженную структуру NaCl.
ВВЕДЕНИЕ
На основе разнолигандных неорганических-органических комплексных соединений, имеющих разнообразные структурные топологии и физико-химические свойства, создаются новые материалы, которые могут найти применение в различных областях науки и технологиях [1].
В дополнение к традиционным областям применения – медицине и фармакологии [2] – водные растворы диметилсульфоксида (DMSO) используются также в оптике, в частности, для производства полимерных оптических волокон. DMSO является эффективным апротонным растворителем для электролитов, обладает высокой диэлектрической проницаемостью, сильной донорной способностью электронных пар и высоким молекулярным дипольным моментом, что позволяет координировать как “мягкие”, так и “жесткие” ионы металлов [3–8].
Известны многочисленные координационные соединения лантаноидов с DMSO. Гетеробиметаллические разнолигандные комплексные соединения перспективны как предшественники для получения разнообразных функциональных материалов и композитов [9–13]. В частности, интерес представляют термохромные вещества, изменяющие окраску при воздействии различных температур, особенно вещества возвратного действия [14–18].
Ранее нами сообщалось о получении обратимых термочувствительных двойных комплексных соединений (ДКС) состава [Ln(DMSO)8][Cr(NCS)6] [19], перспективных для создания многократно используемых термохромных материалов, однако получить монокристаллы и установить кристаллическую структуру удалось только в случае комплекса [La(DMSO)8][Cr(NCS)6] [20]. Проведенные ранее исследования роданохроматных комплексов лантаноидов с другими органическими лигандами позволили установить структурные особенности соединений цериевой и иттриевой групп состава [Ln(ε-C6H11NO)8][Cr(NCS)6] и [Ln(C5H5NCOO)3(H2O)2][Cr(NCS)6] ⋅ nH2O [21, 22]. Представляло интерес выяснить структурные закономерности в ряду аналогичных комплексов с ДМSО.
Цель настоящей работы – установление строения комплексных соединений [Ln(DMSO)8][Cr(NCS)6], где Ln = Nd (1), Eu (2), Gd (3), Dy (4), Ho (5), Lu (6), Tb (7), Yb (8).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реагенты Ln(NO3)3 ⋅ 6H2O, где Ln = Nd (1), Eu (2), Gd (3), Dy (4), Ho (5), Lu (6), Tb (7), Yb (8), и DMSO (все соединения марки “х. ч.”) использовали в коммерчески доступной форме без дополнительной очистки (производитель солей лантаноидов – Завод редких металлов, Новосибирск, поставщик DMSO – ООО “Компонент-Реактив”, Москва), K3[Cr(NCS)6] ⋅ 4H2O получали по известной методике [23] из KNCS и KCr(SO4) ⋅ 12H2O (реактивы марки “х. ч.”, поставщик НПО “Химпроект”, Уфа).
Синтез соединений. К 1 М водным растворам, содержащим по 0.001 моль гексагидрата нитрата лантаноида(III) и K3[Cr(NCS)6] · 4H2O, добавляли по каплям DMSO. Мольное соотношение реагентов составляло 1 : 1 : 8 соответственно. Полученные в результате реакции кристаллические порошки бледно-малинового цвета промывали холодной водой, отфильтровывали и высушивали на воздухе. Выход соединений составил 65–70%.
Химический анализ на ионы редкоземельных металлов(III) выполняли в виде оксидов, полученных при прокаливании оксалатов [24], хром определяли фотоколориметрически [25], элементный C,H,N,S-анализ проводили на приборе ThermoFlash 2000 фирмы ThermoScientific. Результаты элементного анализа приведены в табл. 1.
Таблица 1.
Результаты элементного анализа [Ln(DMSO)8][Cr(NCS)6], ω, мас. %
| Эле-мент | Nd | Eu | Gd | Dy | Ho | Lu | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| най-дено | вычис-лено | най-дено | вычис-лено | най-дено | вычис-лено | най-дено | вычис-лено | най-дено | вычис-лено | най-дено | вычис-лено | |
| Ln | 12.27 | 12.33 | 12.85 | 12.90 | 13.22 | 13.29 | 13.62 | 13.68 | 13.80 | 13.85 | 14.52 | 14.57 |
| Cr | 4.38 | 4.44 | 4.36 | 4.42 | 4.35 | 4.40 | 4.33 | 4.38 | 4.33 | 4.37 | 4.30 | 4.33 |
| C | 22.53 | 22.59 | 22.40 | 22.44 | 22.30 | 22.34 | 22.20 | 22.24 | 22.15 | 22.20 | 21.95 | 22.01 |
| H | 4.08 | 4.14 | 4.05 | 4.11 | 4.05 | 4.09 | 4.04 | 4.07 | 4.02 | 4.06 | 4.00 | 4.03 |
| N | 7.12 | 7.18 | 7.10 | 7.14 | 7.07 | 7.10 | 7.05 | 7.07 | 7.03 | 7.06 | 6.97 | 7.00 |
| S | 38.32 | 38.38 | 38.08 | 38.12 | 37.92 | 37.95 | 37.75 | 37.79 | 37.67 | 37.71 | 37.35 | 37.39 |
ИК-спектры комплексов регистрировали на ИК-фурье- спектрометре Cary 630 FTIR фирмы Agilent в интервале 4000–400 см–1 в матрице KBr. Ниже приведены основные частоты полос поглощения соединений (ν, см–1): 1 – 2998 (сл.), 2918 (сл.), 2075 (оч. с.), 1723 (сл.), 1662 (сл.), 1405 (ср.), 1321 (ср.), 1003 (оч. с.), 959 (с.), 825 (ср.), 719 (ср.), 685 (ср.), 485 (ср.); 2 – 2996 (сл.), 2918 (сл.), 2075 (оч. с.), 1723 (сл.), 1662 (сл.), 1405 (ср.), 1321 (ср.), 1003 (оч. с.), 964 (с.), 830 (ср.), 719 (ср.), 685 (ср.), 480 (ср.); 3 – 2996 (сл.), 2912 (сл.), 2080 (оч. с.), 1740 (сл.), 1662 (сл.), 1405 (ср.), 1321 (ср.), 1003 (оч. с.), 964 (с.), 830 (ср.), 719 (ср.), 685 (ср.), 485 (ср.); 4 – 2996 (сл.), 2912 (сл.), 2069 (оч. с.), 1736 (сл.), 1662 (сл.), 1405 (ср.), 1321 (ср.), 998 (оч. с.), 959 (с.), 850 (ср.), 719 (ср.), 685 (ср.), 485 (ср.); 5 – 2996 (сл.), 2912 (сл.), 2075 (оч. с.), 1706 (сл.), 1651 (сл.), 1405 (ср.), 1321 (ср.), 1003 (оч. с.), 964 (с.), 820 (ср.), 719 (ср.), 685 (ср.), 480 (ср.); 6 – 2996 (сл.), 2912 (сл.), 2075 (оч. с.), 1706 (сл.), 1662 (сл.), 1416 (ср.), 1321 (ср.), 998 (оч. с.), 964 (с.),835 (ср.), 724 (ср.), 685 (ср.), 480 (ср.); 7 – 2996 (сл.), 2918 (сл.), 2080 (оч. с.), 1706 (сл.), 1405 (ср.), 1321 (ср.), 1003 (оч. с.), 964 (с.), 825 (ср.), 719 (ср.), 682 (сл.), 480 (ср.); 8 – 2996 (сл.), 2912 (сл.), 2069 (оч. с.), 1958 (сл.), 1662 (сл.), 1405 (ср.), 1331 ( ср.), 998 (оч. с.), 959 (с.), 815 (ср.), 724 (ср.), 480 (ср.).
Рентгеноструктурный анализ (РСА) соединений 1–6 выполнен на дифрактометре Bruker Nonius X8Apex с 4K CCD-детектором с использованием φ- и ω-сканирования. Поправки на поглощение введены с помощью программы SADABS [26], которая использует многократные измерения одних и тех же отражений при разных ориентациях кристалла. Структуры расшифрованы прямым методом и уточнены полноматричным МНК по F2 в анизотропном приближении для неводородных атомов с помощью комплекса программ SHELX2014 [27]. Атомы водорода органических лигандов расставлены геометрически и уточнены в приближении жесткого тела. Для соединений 2–6 были введены ограничения на длины некоторых связей S–O на уровне 1.51(2) Å и некоторых связей S–C на уровне 1.78(2) Å в связи с присутствующим в структурах позиционным разупорядочением диметилсульфоксидных лигандов. Кристаллографические данные и детали дифракционного эксперимента приведены в табл. 2, основные длины связей для соединений 1–6 – в табл. 3. Структурные данные депонированы в КБСД (ССDС 2105882-2105887) и могут быть получены по запросу на сайте www.ccdc.cam.ac.uk/data_reguest/cif.
Таблица 2.
Кристаллографические данные и условия дифракционного эксперимента для ДКС 1–6
| Формула C22H48CrN6LnO8S14 | Ln = Nd (1) | Ln = Eu (2) | Ln = Gd (3) | Ln = Dy (4) | Ln = Ho (5) | Ln = Lu (6) |
|---|---|---|---|---|---|---|
| М, г/моль | 1169.74 | 1177.46 | 1182.75 | 1188.00 | 1190.43 | 1200.47 |
| Сингония, пр. гр. | Триклинная, P$\overline 1 $ | |||||
| a, Å | 12.9120(4) | 12.8734(9) | 12.8276(3) | 12.6254(8) | 12.7964(5) | 12.8161(3) |
| b, Å | 18.6554(6) | 18.6998(14) | 18.5524(4) | 18.8020(9) | 18.5521(7) | 18.6827(6) |
| c, Å | 22.5531(7) | 22.6193(17) | 22.4064(5) | 22.8305(13) | 22.4064(8) | 22.6245(7) |
| α, град | 111.846(1) | 111.766(2) | 111.910(1) | 110.407(2) | 111.855(1) | 111.650(1) |
| β, град | 91.756(1) | 91.611(2) | 91.974(1) | 92.379(2) | 91.900(1) | 91.606(1) |
| γ, град | 92.642(1) | 92.667(2) | 92.7450(10) | 92.415(2) | 92.694(1) | 92.5730(1) |
| V, Å3 / Z | 5030.4(3)/4 | 5045.4(6)/4 | 4933.6(2)/4 | 5065.8(5)/4 | 4924.2(3)/4 | 5024.2(3)/4 |
| ρвыч, г/см3 | 1.545 | 1.550 | 1.592 | 1.558 | 1.606 | 1.587 |
| μ, мм–1 | 1.860 | 2.068 | 2.188 | 2.297 | 2.452 | 2.794 |
| Размер кристалла, мм | 0.28 × 0.22 × × 0.18 | 0.33 × 0.24 × × 0.14 | 0.17 × 0.12 × × 0.06 | 0.25 × 0.15 × × 0.15 | 0.13 × 0.12 × × 0.07 | 0.22 × 0.18 × × 0.11 |
| Диапазон сбора данных по σ, град | 0.974–26.453 | 0.970–25.681 | 0.981–26.454 | 0.953–27.217 | 0.981–26.438 | 0.969–27.179 |
| Диапазон h, k, l | –16 ≤ h ≤ 15 –23 ≤ k ≤ 23 –24 ≤ l ≤ 28 |
–15 ≤ h ≤ 15 –22 ≤ k ≤ 22 –207 ≤ l ≤ 23 |
–16 ≤ h ≤ 15 –21 ≤ k ≤ 23 –28 ≤ l ≤ 26 |
–16 ≤ h ≤ 16 –24 ≤ k ≤ 21 –29 ≤ l ≤ 29 |
–16 ≤ h ≤ 15 –22 ≤ k ≤ 23 –25 ≤ l ≤ 28 |
–15 ≤ h ≤ 16 –23 ≤ k ≤ 24 –29 ≤ l ≤ 29 |
| Ihkl измеренных | 41 813 | 34 741 | 41 898 | 45 844 | 41 440 | 45 569 |
| Ihkl > 2σI (Rint) | 20 675 (Rint = 0.0203) |
19 031 (Rint = 0.0153) |
19 973 (Rint = 0.0490) |
22 398 (Rint = 0.0377) |
20 017 (Rint = 0.0467) |
22 061 (Rint = 0.0323) |
| Макс. и мин. пропускание | 0.745 и 0.679 | 0.746 и 0.630 | 0.745 и 0.655 | 0.746 и 0.629 | 0.745 и 0.588 | 0.746 и 0.608 |
| GOOF для $F_{{hkl}}^{2}$ | 1.113 | 1.040 | 1.018 | 1.035 | 1.052 | 1.046 |
| R (I > 2σI) | R1 = 0.0414, wR2 = 0.0926 |
R1 = 0.0369, wR2 = 0.0832 |
R1 = 0.0536, wR2 = 0.1099 |
R1 = 0.0769, wR2 = 0.2027 |
R1 = 0.0621, wR2 = 0.1412 |
R1 = 0.0474, wR2 = 0.1244 |
| R (Ihkl изм.) | R1 = 0.0480, wR2 = 0.0948 |
R1 = 0.0441, wR2 = 0.0861 |
R1= 0.0877, wR2 = 0.1185 |
R1 = 0.1056, wR2 = 0.2167 |
R1 = 0.0911, wR2 = 0.1492 |
R1 = 0.0650, wR2 = 0.1315 |
| Макс. и мин. ост. эл. плотность, e/Å3 | 2.106 и –0.857 | 2.314 и –1.369 | 1.846 и –1.189 | 3.265 и –2.478 | 3.419 и –1.128 | 2.617 и –1.165 |
Таблица 3.
Основные межатомные расстояния (d, Å) для комплексов 1–6
| Связь | Nd (1) | Eu (2) | Gd (3) | Dy (4) | Ho (5) | Lu (6) |
|---|---|---|---|---|---|---|
| Ln(1)–O(11) | 2.423(3) | 2.461(3) | 2.342(4) | 2.331(6) | 2.313(5) | 2.342(3) |
| Ln(1)–O(12) | 2.427(3) | 2.363(3) | 2.442(4) | 2.403(6) | 2.417(5) | 2.424(3) |
| Ln (1)–O(13) | 2.500(3) | 2.381(3) | 2.359(4) | 2.302(7) | 2.276(6) | 2.343(4) |
| Ln (1)–O(14) | 2.466(3) | 2.395(3) | 2.415(4) | 2.349(7) | 2.375(5) | 2.397(3) |
| Ln (1)–O(15) | 2.410(3) | 2.458(3) | 2.450(4) | 2.410(6) | 2.413(5) | 2.421(3) |
| Ln (1)–O(16) | 2.430(3) | 2.364(3) | 2.363(4) | 2.334(6) | 2.321(5) | 2.349(3) |
| Ln (1)–O(17) | 2.488(3) | 2.380(3) | 2.337(4) | 2.337(10) | 2.286(7) | 2.335(4) |
| Ln (1)–O(18) | 2.404(3) | 2.430(3) | 2.388(4) | 2.364(7) | 2.362(6) | 2.365(3) |
| Ln (2)–O(21) | 2.491(3) | 2.413(3) | 2.407(4) | 2.348(7) | 2.368(6) | 2.390(4) |
| Ln (2)–O(22) | 2.416(3) | 2.373(3) | 2.353(4) | 2.312(6) | 2.320(5) | 2.340(3) |
| Ln (2)–O(23) | 2.463(3) | 2.387(3) | 2.332(4) | 2.278(8) | 2.248(6) | 2.337(4) |
| Ln (2)–O(24) | 2.409(3) | 2.445(3) | 2.452(4) | 2.367(6) | 2.423(6) | 2.436(3) |
| Ln (2)–O(25) | 2.455(3) | 2.425(3) | 2.359(4) | 2.319(7) | 2.315(6) | 2.349(3) |
| Ln (2)–O(26) | 2.412(3) | 2.375(3) | 2.403(4) | 2.369(7) | 2.380(6) | 2.377(4) |
| Ln (2)–O(27) | 2.480(3) | 2.369(3) | 2.384(4) | 2.343(7) | 2.339(6) | 2.359(4) |
| Ln (2)–O(28) | 2.416(3) | 2.459(3) | 2.435(4) | 2.362(7) | 2.401(5) | 2.419(3) |
| Cr(1)–N(11) | 2.003(4) | 2.005(4) | 2.006(6) | 1.984(10) | 2.002(8) | 2.003(5) |
| Cr(1)–N(12) | 1.992(4) | 1.996(4) | 1.986(5) | 1.997(9) | 1.994(7) | 1.995(5) |
| Cr(1)–N(13) | 2.003(4) | 1.994(4) | 1.994(6) | 2.002(8) | 1.992(8) | 2.008(5) |
| Cr(1)–N(14) | 1.999(4) | 2.005(4) | 1.997(6) | 1.994(11) | 1.985(8) | 1.993(5) |
| Cr(1)–N(15) | 2.012(4) | 2.017(4) | 2.010(5) | 2.000(9) | 2.006(7) | 2.011(5) |
| Cr(1)–N(16) | 1.991(4) | 2.002(4) | 1.995(6) | 2.001(8) | 2.002(8) | 2.000(5) |
| Cr(2)–N(21) | 1.997(4) | 1.995(4) | 1.996(6) | 1.984(10) | 1.992(8) | 1.999(5) |
| Cr(2)–N(22) | 2.011(4) | 2.007(4) | 1.985(6) | 2.011(9) | 2.001(7) | 2.005(5) |
| Cr(2)–N(23) | 1.997(4) | 2.010(4) | 1.999(5) | 1.995(8) | 2.002(7) | 2.004(5) |
| Cr(2)–N(24) | 1.995(4) | 2.001(4) | 1.996(6) | 1.990(9) | 1.993(8) | 1.999(5) |
| Cr(2)–N(25) | 2.000(4) | 1.994(4) | 2.008(6) | 1.999(8) | 2.003(7) | 2.007(5) |
| Cr(2)–N(26) | 2.008(4) | 1.998(4) | 2.004(5) | 2.005(8) | 2.009(8) | 2.006(5) |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтезированы устойчивые на воздухе кристаллические порошки бледно-малинового цвета с растворимостью в воде (25.0 ± 0.5°С): 1 – 0.03 моль/л; 2 – 0.02 моль/л; 3 – 0.4 моль/л, 4 – 0.03 моль/л, 5 – 0.02 моль/л, 6 – 0.01 моль/л. ДКС не растворяются в спиртах, н-углеводородах, эфирах, ацетоне, толуоле, бензоле, разлагаются концентрированными растворами минеральных кислот, растворимы в DMFA и DMSO.
По данным [28–30], для иона SCN– характерными являются колебания ν(CN), ν(CS) и δ(NCS) при 2066.3, 744 и 468.1 см–1 соответственно. Способ координации тиоцианатной группы влияет на степень кратности связей, что отражается в смещении указанных полос. Значения ν(CN) в интервале 2069–2080 см–1 указывают на отсутствие тиоцианатных мостиков в комплексах. Получение (тиоцианато-N)-комплексов подтверждается повышением частот ν(CS) до значений 815–850 см–1, характеризующих увеличение кратности связи CS. Дополнительную информацию дает полоса δ(NCS) при 480–485 см–1. Частота валентного колебания “свободного” DMSO равна 1055 см–1, при его координации через кислород это значение всегда понижается на 60–100 см–1. Таким образом, органические лиганды в катионах комплексов координируются с комплексообразователями – ионами Ln3+ – через атомы кислорода: ν(SO) = 959–964 см–1, ν(CS) до 719–724 см–1 [31–33].
Медленной изотермической кристаллизацией при 298 K из разбавленных диметилсульфоксидных растворов порошков соединений получены монокристаллы ДКС.
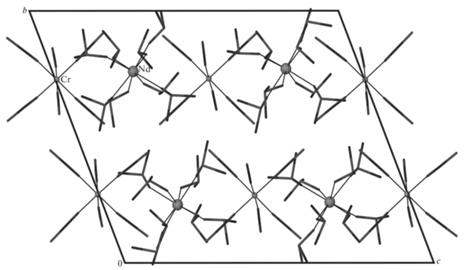
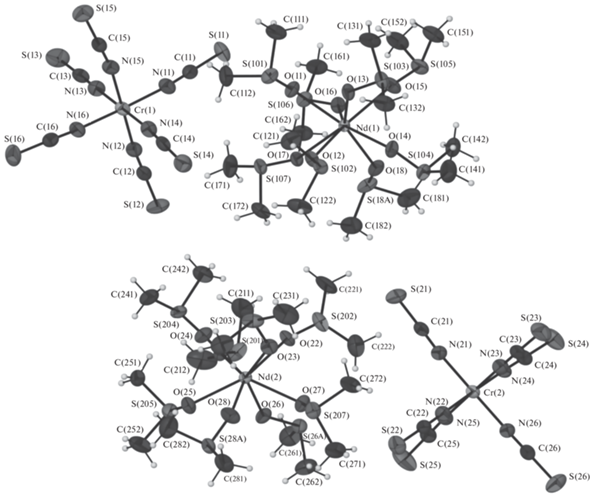
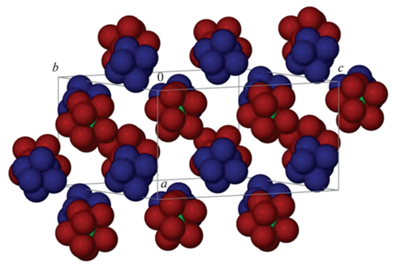
Все полученные комплексы изоструктурны. Кристаллическая структура островная, с катионами [Ln(DMSO)8]3+ и анионами [Cr(NCS)6]3–. В независимой части присутствует по два катиона и по два аниона (рис. 1). Координационное окружение атома Ln состоит из восьми атомов О, принадлежащих молекулам DMSO, располагающимся в вершинах искаженной квадратной антипризмы. Расстояния Ln–О лежат в диапазоне 2.404(3)–2.500(3) Å, среднее 2.44(3) Å для 1; 2.363(3)–2.461(3) Å, среднее 2.40(4) Å для 2; 2.332(4)–2.452(4) Å, среднее 2.39(4) Å для 3; 2.278(8)–2.410(6) Å, среднее 2.35(3) Å для 4; 2.248(6)–2.417(5) Å, среднее 2.34(5) Å для 5; 2.335(4)–2.436(3) Å, среднее 2.37(3) Å для 6. Геометрические характеристики координированных молекул DMSO хорошо согласуются с известными литературными данными [34]. Координационный полиэдр хрома(III) в изолированных анионах [Cr(NCS)6]3– состоит из атомов N шести NCS-ионов и близок к правильному октаэдру (отклонение углов от 90° не превышает 1.90°) (рис. 2). Упаковка по центрам комплексных катионов и анионов представляет собой искаженную структуру NaCl (рис. 3).
Рис. 3.
Атомы металлов и первой координационной сферы вокруг них в произвольной ориентации ячейки. Видно чередование катионов и анионов по типу NaCl.
Для соединений [Ln(DMSO)8][Cr(NCS)6], где Ln = Tb и Yb, определены кристаллоструктурные характеристики (P$\overline 1 $, a = 12.5996(8), b = = 18.8078(11), c = 22.8852(16) Å, α = 110.523(3)°, β = 92.419(3)°, γ = 92.508(3)° и a = 12.350(7), b = = 18.995(12), c = 23.097(14) Å, α = 110.48(1)°, β = 90.04(2)°, γ = 89.92(2)° соответственно), показывающие, что они изоструктурны с вышеописанной серией соединений. Однако недостаточно хорошее качество кристаллов не позволило получить достаточный массив экспериментальных данных для определения структуры, и, как следствие, из-за низкого качества данных и полученных моделей с R1 ∼ 15% и частично не локализованными лигандами DMSO результаты не депонировались в КБСД. Попытки заново окристаллизовать эти соединения предпринимались неоднократно, но так и не привели нас к хорошим результатам.
Проведенные исследования ДКС [Ln(DMSO)8] [Cr(NCS)6] показали, что для них, как и для других подобных соединений с ε-капролактамом и никотиновой кислотой состава [Ln(ε-C6H11NO)8][Cr(NCS)6] и [Ln(C5H5NCOO)3(H2O)2] [Cr(NCS)6] ⋅ nH2O, характерны ионные островные структуры, состоящие из изолированных катионов [Ln(DMSO)8]3+ и анионов [Cr(NCS)6]3– [21, 22]. Образование соединений ионного типа хорошо объяснимо на основе “жестко-жесткого” взаимодействия “жестких” кислот – акцепторов электронных пар Ln3+ и Cr3+ с “жесткими” основаниями Льюиса – кислородом DMSO и азотом NCS-группы [35–37].
ЗАКЛЮЧЕНИЕ
Двойные комплексные соединения [Ln(DMSO)8][Cr(NCS)6] исследованы методами ИК-спектроскопии и РСА. Изучение кристаллографических характеристик монокристаллов ДКС представителей лантаноидов как цериевой (Nd, Eu), так и иттриевой (Gd, Tb, Dy, Ho, Yb, Lu) группы показало, что комплексы всего ряда лантаноидов однотипны, кристаллизуются в триклинной сингонии (пр. гр. P$\overline 1 $) и представляют собой комплексные соли с катионами [Ln(DMSO)8]3+ и анионами [Cr(NCS)6]3–. Полученные данные еще раз свидетельствуют в пользу концепции ЖМКО, позволяющей прогнозировать строение и, соответственно, характеристики, в частности ДКС, являющихся перспективными прекурсорами для получения различных функциональных, в том числе наноразмерных материалов. Для этого необходимо изучение основных физико-химических характеристик веществ. Ранее установлено, что ДКС состава [Ln(DMSO)8][Cr(NCS)6] перспективны для создания возвратных, многократно используемых термохромных материалов, пригодных для визуального контроля температурных режимов в технологических процессах, поэтому исследование таких соединений представляет и практический интерес.
Список литературы
Mishra S., Jeanneau E., Ledoux G., Daniele S. // CrystEngComm. 2012. V. 14. № 11. P. 3894.
Verstakov E.S., Korobkova S.A., Nosaeva T.A.// Russ. J. Phys. Chem. 2020. V. 94. № 4. P. 738. [Верстаков Е.С., Коробкова С.А., Носаева Т.А. // Журн. физ. химии. 2020. Т. 94. № 4. С. 564.] https://doi.org/10.1134/SOO3602442004024X
Abbasi A., Risberg E.D., Eriksson L. et al. // Inorg. Chem. 2007. V. 46. P. 7731. https://doi.org/10.1021/ic7006588
Pasgreta E., Puchta R., Galle M. et al. // ChemPhysChem. 2007. V. 8. P. 1315.
Galvao J., Davis B., Tilley M. et al. // FASEB J. 2014. V. 28. № 3. P. 1. https://doi.org/10.1096/fj.13-235440
Alessio E. // Chem. Rev. 2004. V. 104. P. 4203. https://doi.org/10.1021/cr0307291
Verma V., Awasthi A., Kumar M. et al. // Phys. Chem. Liq. 2020. V. 59. № 3. P. 1. https://doi.org/10.1080/00319104.2020.1731809
Akhmedov M.A., Ibragimova K.O., Khidirov Sh.Sh. // Russ. J. Electrochem. 2020. V. 56. № 5. P. 396. [Ахмедов М.А., Ибрагимова К.О., Хидиров Ш.Ш. // Электрохимия. 2020. Т. 56. № 5. С. 416.]https://doi.org/10.1134/S1023193520040023
Pechenyuk S.I., Domonov D.P., Shimkin A.A. et al. // Russ. J. Gen. Chem. 2017. V. 87. № 9. P. 2212. [Печенюк С.И., Домонов Д.П., Шимкин А.А. и др. // Журн. общ. химии. 2017. Т. 87. № 9. С. 2212.]https://doi.org/10.1134/S1070363217090481
Tretyakov Yu.D. // Russ. J. Chem. Rev. 2004. V. 73. № 9. P. 831. [Третьяков Ю.Д. Успехи химии. 2004. Т. 73. № 9. С. 831.]https://doi.org/10.1070/RC2004v073n09ABEH000914
Velikanova L.N., Semchenko V.V., Khentov V.Ya. // Russ. J. Appl. Chem. 2011. V. 84. № 9. P. 1470. [Великанова Л.Н., Семченко В.В., Хентов В.Я. // Журн. прикл. химии. 2011. Т. 84. № 9. С. 1418.]https://doi.org/10.1134/S1070427211090023
Khentov V.Ya., Velikanova L.N., Semchenko V.V., Slavinskaya A.B. // Russ. J. Appl. Chem. 2007. V. 80. № 7. P. 1027. [Великанова Л.Н., Семченко В.В., Хентов В.Я. // Журн. прикл. химии. 2007. Т. 80. № 7. С. 1057.]https://doi.org/10.1134/S1070427207070014
Помогайло А.Д., Розенберг А.С., Джардималиева Г.И. // Рос. хим. журн. (Журн. Рос. хим. общества им. Д.И. Менделеева). 2009. Т. 53. № 1. С. 140.
Абрамович Б.Г. // Химия и химики. 2008. № 5. С. 19.
Кукушкин Ю.Н. Соединения высшего порядка. Л.: Химия, 1991. 110 с.
Sone K., Fukuda Y. Inorganic Thermochromism. Berlin: Springer-Verlag, 1987. 134 p.
Беленький Е.Ф., Рискин И.В., Корсунский И.В., Шапиро И.С. Химия и технология пигментов. Л.: Химия, 1974. 656 с.
Хентов В.Я., Семченко В.В., Шачнева Е.Ю. Процессы комплексообразования природного и техногенного происхождения. М.: РУСАЙНС, 2020. 266 с.
Черкасова Т.Г., Татаринова Э.С., Кузнецова О.А., Трясунов Б.Г. // Пат. RU 2097714 от 27.11.1997.
Черкасова Т.Г. // Журн. неорган. химии. 1994. Т. 39. № 8. С. 1316.
Virovets A.V., Peresypkina E.V., Cherkasova E.V. et al. // J. Struct. Chem. 2009. V. 50. № 1. P. 137. [Вировец А.В., Пересыпкина Е.В., Черкасова Е.В. // Журн. структур. химии. 2009. Т. 50. № 1. С. 144.]https://doi.org/10.1007/s10947-009-0018-y
Черкасова Т.Г., Первухина Н.В., Куратьева Н.В. и др. // Журн. неорган. химии. 2018. Т. 63. № 7. С. 858. [Cherkasova T.G., Pervukhina N.V., Kuratieva N.V. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 7. P. 899.] https://doi.org/10.1134/S0036023618070045
Руководство по неорганическому синтезу / Под ред. Брауэра Г. М.: Мир, 1985. Т. 5. 360 с.
Коровин С.С., Букин В.И., Федоров П.И., Резник А.М. Редкие и рассеянные элементы. Химия и технология. М.: МИСИС, 2003. 439 с.
Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим методам анализа. Л.: Химия, 1986. 431 с.
Sheldrick G.M. SADABS. Version 2.01. Bruker AXS Inc. Madison. Wisconsin, 2004.
Sheldrick G.M. // Acta Crystallogr. 2015. V. C71. P. 3. https://doi.org/10.1039/p298700000s1
Химия псевдогалогенидов / Под ред. Голуба А.М., Келера X., Скопенко В.В. Киев: Вища. шк., 1981. 360 с.
Костромина Н.А., Кумок В.Н., Скорик Н.А. Химия координационных соединений. М.: Высш. шк., 1990. 432 с.
Gordon D.J., Smith D.F. // Spectrochim. Acta. 1974. V. A30. № 10. P. 1953.
Кукушкин Ю.Н. Химия координационных соединений. М.: Высш. шк., 1985. 455 с.
Преч Э., Бюльманн Ф., Аффольтер К. Определение строения органических соединений. Таблицы спектральных данных. М.: Мир, БИНОМ. Лаборатория знаний, 2006. 438 с.
Васильев А.В., Гриненко Е.В., Щукин А.О., Федулина Т.Г. Инфракрасная спектроскопия органических и природных соединений. СПб.: СПбЛТА, 2007. 54 с.
Allen F.H., Kennard O., Watson D.G. // J. Chem. Soc., Perkin Trans. 1987. V. 12. P. S1. https://doi.org/10.1039/p298700000s1
Гарновский А.Д., Садименко А.П., Осипов О.А., Цинцадзе Г.В. Жестко-мягкие взаимодействия в координационной химии. Ростов-на-Дону: Изд-во Ростовск. ун-та, 1986. 272 с.
Неудачина Л.К., Лакиза Н.В. Химия координационных соединений. М.: Юрайт, 2019. 123 с.
Киселев Ю.М. Химия координационных соединений. М.: Юрайт, 2019. Ч. 1. 439 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии