Журнал неорганической химии, 2022, T. 67, № 5, стр. 582-590
Синтез и строение комплексных соединений меди(I) [Cu2[B10H10]] и таллия(I) Tl2[B10H10] с клозо-декаборатным анионом
В. В. Авдеева a, *, А. С. Кубасов a, С. Е. Короленко a, Л. В. Гоева a, Е. А. Малинина a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: avdeeva.varvara@mail.ru
Поступила в редакцию 02.11.2021
После доработки 21.12.2021
Принята к публикации 22.12.2021
- EDN: QJFJRQ
- DOI: 10.31857/S0044457X22050026
Аннотация
Cинтезированы безводные комплексы меди(I) и таллия(I) общей формулы [M2[B10H10]]. Соединения идентифицированы методами ИК-спектроскопии и РСА. Согласно данным РСА, структура соединений представляет собой трехмерный каркас. В комплексе меди(I) [Cu2[B10H10]] наблюдается образование трехцентровых связей M–H–B, в соединении таллия(I) Tl2[B10H10] связь между катионами и анионами ионная, что подтверждается данными ИК-спектроскопии. Для идентификации и анализа внутримолекулярных взаимодействий выполнен анализ поверхности Хиршфельда кластерного аниона бора для обоих соединений.
ВВЕДЕНИЕ
Кластерные анионы бора [BnHn]2– [1–5] образуют самостоятельную область химии бора, которая находится на стыке координационной, неорганической, органической и элементоорганической химии. Этот класс координационных соединений может участвовать в реакциях замещения терминальных атомов водорода на различные функциональные группы с образованием большого числа замещенных производных [6–9], а также образует комплексные соединения металлов с внутрисферными кластерными анионами бора или их замещенными производными [10–15].
Среди огромного разнообразия комплексных соединений металлов с кластерными анионами бора безводные комплексы вида [Mx[BnHn]] (М – атом металла, x = 1 (для металлов в степени окисления +2) или 2 (для металлов в степени окисления +1); [BnHn] – кластерный анион бора или его замещенное производное) весьма немногочисленны. Первый комплекс подобного рода, комплекс меди(I) с клозо-декаборатным анионом [Cu2[B10H10]]n, получен в 1962 г. [16, 17] при взаимодействии ацетата меди(II) с солями клозо-декаборатного аниона в воде. Комплекс [Cu2[B10H10]]n – первое соединение, в котором предположено, что связь металла с клозо-бороводородным анионом реализуется благодаря трехцентровым двухэлектронным взаимодействиям CuHB. Отметим, что автор данной работы Уильям Нанн Липскомб был награжден в 1976 г. Нобелевской премией по химии “за исследование структуры боранов, выявляющее проблему образования химических связей”.
Синтезированные позднее комплексы металлов с кластерными анионами бора подтвердили, что именно этот способ связывания металла с борным кластером наиболее распространен в комплексных соединениях металлов с координированными кластерными анионами бора.
Аналогичный комплекс меди(I) с клозо-додекаборатным анионом [B12H12]2– получен при термической обработке аквакомплекса меди(II) с клозо-додекаборатным анионом [Cu(H2O)6][B12H12] [18]. Соединение [Cu2[B12H12]]n представляет собой трехмерный каркас. Теми же авторами при термической обработке аквакомплексов кобальта(II) и никеля(II) с клозо-додекаборатным анионом [М(H2O)6][B12H12] получены безводные комплексы кобальта(II) и никеля(II) [М[B12H12]]n (M = Co, Ni) [18]. Соединения построены из бесконечных цепей M–[B12H12]–M. Термическая обработка комплексов марганца(II) [Mn(EtOH)6][B12H12] и железа(II) [Fe(MeOH)6][B12H12], содержащих шесть молекул спирта, привела к получению безводных структур [M[B12H12]]n (M = Mn, Fe), которые имеют различное строение [18]. Комплекс железа(II), так же как и описанные выше комплексы кобальта и никеля, построен из бесконечных цепей M–[B12H12]–M, тогда как комплекс марганца [Mn[B12H12]]n имеет слоистую структуру, образованную трехъядерными кластерами марганца Mn3, которые связаны между собой кластерными анионами бора.
В работе [19] рассмотрены синтез и свойства солей таллия(I) с анионами [В10Н10]2– и [B12H12]2–, полученных при взаимодействии соответствующих клозо-бороводородных кислот с гидроксидом таллия(I). Сравнительный анализ ИК-спектров и физико-химических свойств двух соединений позволил авторам высказать предположение о различном характере связывания в соединениях Tl2[В10Н10] и Tl2[В12Н12]. В соединении Tl2[B12H12] связь между атомом Tl(I) и анионом [B12H12]2– носит практически ионный характер. В аналогичном соединении с клозо-декаборатным анионом в связи Tl(I)–анион [В10Н10]2– присутствует значительная доля ковалентной составляющей. Авторы делают вывод, что атом Tl(I) связан с вершинными атомами бора в анионе, однако вопрос об участии атомов водорода во взаимодействии не обсуждается.
Позднее в работах [20, 21] при взаимодействии (H3O)2[B12H12] с карбонатом Tl2CO3 получено соединение Tl2[B12H12], строение которого установлено методом РСА. Это соединение изоструктурно M2[B12H12] (M = K+, Cs+, Rb+) [22, 23]. Атомы таллия находятся в тетраэдрических пустотах между четырьмя анионами [B12H12]2–, т.е. двенадцать атомов водорода четырех треугольных граней ВВВ анионов [B12H12]2– образуют практически совершенную кубооктаэдрическую координационную сферу вокруг каждого атома таллия, расстояния Tl–H составляют 2.956 Å.
Безводные комплексы получены также для замещенных производных кластерных анионов бора. Комплекс никеля [Ni[B12Cl12]] получен при нагревании аквакомплекса [Ni(H2O)6][B12Cl12] ⋅ ⋅ 6H2O при температуре >450°С [24]. Установлено, что при повышении температуры аквакомплекс никеля теряет кристаллизационные и сольватные молекулы воды с образованием безводного соединения [Ni[B12Cl12]].
Описан синтез комплексов серебра(I) [Ag2[B10H10]] [25, 26] и [Ag2[B12H12]] [27]. Соединения образуются при взаимодействии нитрата серебра с солями кластерных анионов бора и мгновенно выводятся из водных растворов с выходом, близким к количественному. Комплексы идентифицированы методами элементного анализа и ИК-спектроскопии. Структура соединений методом РСА не изучена.
При проведении аналогичной реакции с декахлор-клозо-декаборатным анионом в результате длительного упаривания раствора, содержащего AgNO3 и K2[B10Cl10], получен комплекс [Ag2[B10Cl10]]n [14]. Методом РСА установлено, что атом серебра(I) координирует три кластерных аниона бора хелатным способом с образованием октаэдра AgCl6 с расстояниями Ag–Cl 2.706(1)–2.893(1) Å. Каждый кластерный анион взаимодействует с шестью атомами металла, четыре из них координируют один апикальный и один экваториальный атомы хлора, а два атома серебра взаимодействуют с двумя экваториальными атомами хлора.
Для додекахлор-клозо-додекаборатного аниона был синтезирован аналогичный комплекс [Ag2[B12Cl12]]n [28]. Каждый анион [B12Cl12]2– координируется двумя атомами хлора к атому серебра, что приводит к шестикоординационному окружению атома серебра с искаженной октаэдрической геометрией. Длины связей Ag–Cl (2.83–2.85 Å) в данном комплексе сравнимы с длинами связей в AgCl (2.77 Å) и в различных соединениях серебра с хлорированными карборановыми анионами. В соединениях [Ag2[B10Cl10]] и [Ag2[B12Cl12]] атом серебра находится в октаэдрическом окружении, а кластерный анион бора связан с шестью атомами металла, но строение трехмерного каркаса в структурах различно.
В настоящей работе уточнена структура известного полимерного комплекса [Cu2[B10H10]]n и синтезирован аналогичный комплекс таллия Tl2[B10H10], проведено сравнение структур соединений, изучены особенности координации кластерного аниона бора и обсуждена природа связей металла с кластером бора, образующихся в структурах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Декагидро-клозо-декаборат триэтиламмония (Et3NH)2[B10H10] синтезировали из декаборана-14 через стадию образования 1,6-бис(триэтиламин)декаборана согласно методике, описанной в работе [29]. клозо-Декаборат натрия получали кипячением (Et3NH)2[B10H10] в водном растворе гидроксида натрия до полного удаления триэтиламина.
Синтез [Cu2[B10H10]]n (I). К водному раствору сульфата меди(II) (20 мл) приливали раствор Na2[B10H10] в воде (10 мл). Наблюдали образование мелкокристаллического осадка. Выход по бору 41%. Кристалл, подходящий для РСА, выбран непосредственно из реакционного раствора.
ИК-спектр (см–1): 2565, 2539, 2512, 2144.
Синтез Tl2[B10H10] (II). К раствору (Et3NH)2[B10H10] (1 ммоль) в воде (10 мл) добавляли раствор TlNO3 (2 ммоль) в воде. В течение недели наблюдали образование бесцветных кристаллов. Кристаллы отфильтровывали и высушивали на воздухе. Выход 67%.
ИК-спектр (см–1): 2523, 2458.
Элементный анализ проводили на автоматическом газовом анализаторе CHNS-3 FA 1108 Elemental Analyser (Carlo Erba). Определение содержания бора и металлов методом ICP MS выполнено на атомно-эмиссионном спектрометре с индуктивно связанной плазмой iCAP 6300 Duo. Для проведения анализа образцы высушивали до постоянной массы.
ИК-спектры исходных соединений и продуктов термолиза записывали на ИК-фурье-спектрофотометре Инфралюм ФТ-02 (НПФ АП “Люмекс”, Россия); суспензия в вазелиновом масле (Aldrich), пластинки NaCl, область измерения 4000–400 см–1, разрешение 1 см–1.
РСА. Наборы дифракционных отражений получены в Центре коллективного пользования ИОНХ РАН на автоматических дифрактометрах Bruker SMART APEX2 (для кристаллов I) и Enfaf Nonius CAD4 (для II). Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все атомы водорода уточнены по модели наездника с тепловыми параметрами Uизо = 1.2Uэкв (Uизо) соответствующего неводородного атома. Все неводородные атомы уточнены в анизотропном приближении.
При сборе и обработке массива отражений использовали программы APEX2, SAINT и SADABS [30]. Структура расшифрована и уточнена с помощью программ комплекса OLEX2 [31].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структуры приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные, параметры эксперимента и уточнения структур I и II
| Соединение | I | II |
|---|---|---|
| Брутто-формула | B10H10Cu2 | B10H10Tl2 |
| М | 245.26 | 526.92 |
| T, K | 150 | 297 |
| Сингония | Орторомбическая | Моноклинная |
| Пр. гр. | Pbca | P21/n |
| a, Å | 11.3547(12) | 7.0283(10) |
| b, Å | 10.0587(11) | 11.0848(10) |
| c, Å | 14.4589(15) | 12.7739(10) |
| β, град | 90 | 94.922(10) |
| V, Å3 | 1651.4(3) | 991.51(18) |
| Z | 8 | 4 |
| ρрасч, г/см3 | 1.973 | 3.530 |
| μ, мм–1 | 5.054 | 32.384 |
| F(000) | 944.0 | 888.0 |
| Излучение, λ, Å | MoKα (λ = 0.71073) | MoKα (λ = 0.71073) |
| Число измеренных отражений |
13750 | 1379 |
| Число независимых отражений | 2395 [Rint = 0.0543, Rsigma = 0.0423] | 1265 [Rint = 0.0429, Rsigma = 0.1218] |
| GOOF по F2 | 1.019 | 1.081 |
| R1, wR2 по N0 | R1 = 0.0307, wR2 = 0.0680 | R1 = 0.0840, wR2 = 0.2131 |
| R1, wR2 по N | R1 = 0.0485, wR2 = 0.0750 | R1 = 0.1643, wR2 = 0.2539 |
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2118147 и 2118148).
Анализ поверхности Хиршфельда. Для анализа взаимодействий в кристалле использовали программу The Crystal Explorer 17.5 [32]. Донорно-акцепторные группы визуализируются с использованием стандартного (высокого) разрешения поверхности, а поверхности dnorm отображаются по фиксированной цветовой шкале от –0.640 (красный) до 0.986 а.е. (синий).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез и строение комплекса [Cu2[B10H10]]n
Комплекс [Cu2[B10H10]]n синтезирован при взаимодействии сульфата меди(II) и клозо-декаборатного аниона по реакции [16, 17]:
(I)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{ }}{{\left[ {{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}} \right]}^{{2--}}}\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}\left[ {{\text{C}}{{{\text{u}}}_{2}}} \right[{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}]{{]}_{n}}.$При этом выход соединения невысокий, так как часть аниона расходуется на протекание окислительно-восстановительной реакции с атомами меди(II), что приводит к частичной деградации кластерного аниона.
Отметим, что для получения целевого соединения использовали соль Na2[B10H10], так как при использовании клозо-декабората с крупным органическим катионом, например (Et3NH)2[B10H10], возможно образование анионного комплекса {(Et3NH)Cu[B10H10]}n. Комплексы {Cat[Cu[B10H10]]}n подробно изучены в работах [26, 33].
В ИК-спектре соединения I наблюдается сильно расщепленная полоса валентных колебаний ВН-связей ν(BH) с максимумами при 2565, 2539, 2512 и 2144 см–1, что свидетельствует об участии кластерного аниона бора в координации к металлу.
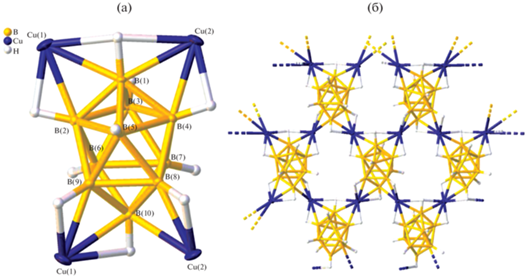
В отличие от работы [16] атомы водорода борного кластера в соединении I локализованы в разностном синтезе Фурье и уточнены независимо в изотропном приближении. Кристаллографически независимая часть орторомбической ячейки (пр. гр. Pbca) комплекса [Cu2[B10H10]] содержит два атома меди и один анион. В кристаллической структуре комплекса образуется 2D-полимер за счет образования четырех пар трехцентровых двухэлектронных связей CuHB борного остова с четырьмя атомами меди. Координация осуществляется по двум противоположным аксиальным ребрам одной из вершин аниона (B1B2 и B1B4) и двум соседним ребрам другой (B8B10 и B9B10). Длины связей Cu–B и Cu–H приведены в табл. 2 и согласуются с данными для комплекса, описанного в работе [16].
Таблица 2.
Длины связей Cu–B и Cu–H в комплексе I
| Связь | Длина связи, Å | Связь | Длина связи, Å |
|---|---|---|---|
| Cu1–B1 | 2.226(2) | Cu1–H1 | 2.033 |
| Cu1–B2 | 2.161(3) | Cu1–H2 | 1.804 |
| Cu1–B9а | 2.160(2) | Cu1–H9а | 1.823 |
| Cu1–B101 | 2.232(2) | Cu1–H10а | 2.062 |
| Cu2–B1 | 2.228(2) | Cu2–H1 | 2.097 |
| Cu2–B4 | 2.148(2) | Cu2–H4 | 1.768 |
| Cu2–B8б | 2.143(2) | Cu2–H8б | 1.73 |
| Cu2–B10б | 2.320(2) | Cu2–H10б | 2.248 |
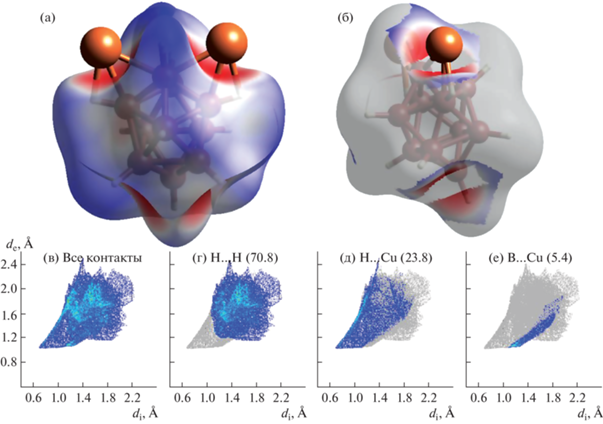
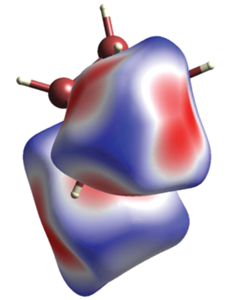
Контакты Cu–H показаны на рис. 1 (выделены цветом). Анализ поверхности Хиршфельда аниона [B10H10]2– показывает, что на контакты H…H c соседними кластерами приходится 70.8% поверхности аниона, на контакты Н–Cu – 23.8% поверхности, а на контакты B–Cu – 5.4% (рис. 2).
Синтез и строение комплекса Tl2[B10H10]
Комплекс таллия(I) получен при взаимодействии нитрата таллия с солью (Et3NH)2[B10H10] по реакции:
(II)
$2{\text{T}}{{{\text{l}}}^{ + }} + {{\left[ {{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{10}}}} \right]}^{{2--}}}\xrightarrow{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}{\text{T}}{{{\text{l}}}_{{\text{2}}}}\left[ {{{{\text{B}}}_{{{\text{10}}}}}{{{\text{H}}}_{{{\text{10}}}}}} \right].$Соединение образуется с высоким выходом (67%).
В ИК-спектре соединения наблюдаются полосы ν(BH) с максимумами при 2523 и 2458 см–1, это позволяет предположить отсутствие координации между катионом металла и кластерным анионом бора, так как в спектре не фиксируется низкочастотная полоса ν(BH)MHB координированных ВН-групп борного кластера, максимум которой обычно наблюдается в области 2300–2200 см–1.
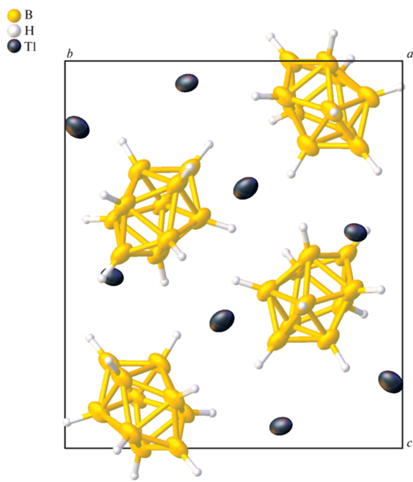
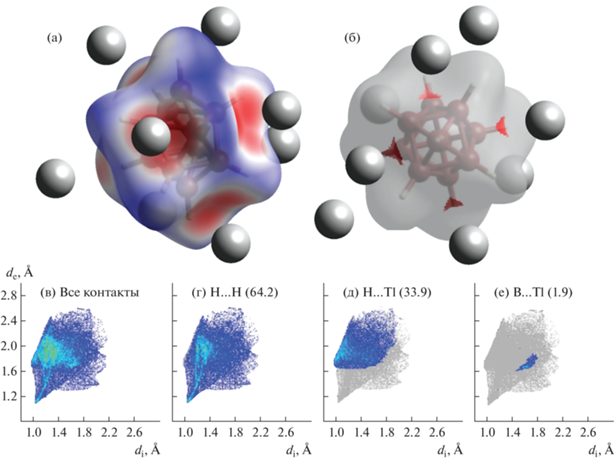
Соль II изоструктурна описанным ранее солям клозо-декаборатного аниона с щелочными металлами Na, K, Rb [34] аналогично соли Tl2[B12H12] [20, 21], изоструктурной солям клозо-додекаборатного аниона с K, Rb и Cs [22, 23]. Кристаллографически независимая часть моноклинной элементарной ячейки (пр. гр. P21/n) включает анион [B10H10]2– и два катиона, которые находятся в общей позиции (рис. 3). Клозо-декаборатный анион находится в окружении восьми катионов Tl+ (рис. 2) c расстояниями Tl…B 3.17–3.65 Å (рис. 2) и Tl…H 2.67–3.44 Å. Как видно на поверхности Хиршфельда кластерного аниона бора (рис. 2a), катионы талия находятся над центрами граней клозо-декаборатного аниона, и длины контактов Tl…B меньше суммы их ван-дер-ваальсовых радиусов (красный цвет на рис. 2б). При этом на контакты Tl…B приходится 1.9% поверхности аниона, с расстоянием Tl–B меньше суммы их ван-дер-ваальсовых радиусов. на контакты Tl…H – 33.9%, а оставшиеся 64.2% приходятся на контакты H…H соседних анионов с наименьшим расстоянием ~2.15 Å.
В каждом случае катион таллия находится в окружении четырех граней борного остова (рис. 3) четырех разных анионов [B10H10]2–.
Анализ поверхности Хиршфельда двух соединений показывает, что в комплексе меди существенно возрастает доля контакта M–B, в отличие от соли II (5.4% по сравнению с 1.9%), в то время как доля контактов M–H в комплексе I составляет 23.8%, а в соли II – 33.9%, что связано с большим ионным радиусом Tl+.
Полученные комплексные соединения, строение которых представляет собой трехмерный каркас, в дальнейшем могут быть использованы для направленного синтеза металлоорганических полимеров (MOF) [35–40] с участием кластерных анионов бора.
Отметим, что комплексные соединения с кластерными анионами бора находят свое применение в качестве экстрагентов солей тяжелых металлов, компонентов для получения термозащитных покрытий, в медицине, катализе и т.д. [41–45].
ЗАКЛЮЧЕНИЕ
Таким образом, в работе синтезированы комплексы меди(I) и таллия(I) состава M2[B10H10]. Соединения изучены методами ИК-спектроскопии и РСА. В комплексе меди(I) [Cu2[B10H10]]nклозо-декаборатный анион координирован атомами металла с образованием трехцентровых связей M–H–B, расстояния Cu–B составляют 2.143(2)–2.320(2) Å. В ИК-спектре соединения присутствует полоса ν(BH)MHB, также свидетельствующая о координации кластерного аниона бора. В комплексе таллия(I) Tl2[B10H10] можно предположить ионный характер связывания катиона с анионом, расстояния Tl…B составляют 3.17–3.65 Å. В ИК-спектре присутствуют только полосы ν(BH) некоординированных ВН-связей.
Список литературы
Greenwood N.N., Earnshaw A. Chemistry of the Elements. Butterworth-Heinemann, 1997.
Grimes R.N. Carboranes. London: Academic Press, 2016. 1058 p. https://doi.org/10.1016/B978-0-12-801894-1.09989-3
Boron Science: New Technologies and Applications / Ed. Hosmane N.S. CRC Press, 2012.
Boron-Based Compounds: Potential and Emerging Applications in Medicine / Eds. Hey-Hawkins E., Viñas Teixidor C. John. Wiley & Sons Ltd., 2018. 470 p. https://doi.org/10.1002/9781119275602
Sivaev I.B., Bregadze V.I. Polyhedral Boron Hydrides in Use: Current Status and Perspectives. Hauppauge: Nova Science Publishers, 2009. 85 p.
Сиваев И.Б. // Журн. неорган. химии. 2021. Т. 66. № 9. С. 1192. [Sivaev I.B. // Russ. J. Inorg. Chem. 2021. V. 66. № 9. P. 1289. ] https://doi.org/10.1134/S0036023621090151
Клюкин И.Н., Селиванов Н.А., Быков А.Ю. и др. // Журн. неорган. химии. 2020. Т. 65. № 10. С. 1345. [Klyukin I.N., Selivanov N.A., Bykov A.Y. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 10. P. 1547.] https://doi.org/10.1134/S0036023620100113
Нелюбин А.В., Селиванов Н.А., Быков А.Ю. и др. // Журн. неорган. химии. 2020. Т. 65. № 6. С. 719. [Nelyubin A.V., Selivanov N.A., Bykov A.Y. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 6. P. 795.] https://doi.org/10.1134/S0036023620060133
Sivaev I.B., Prikaznov A.V., Naoufal D. // Coll. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Авдеева В.В., Малинина Е.А., Жижин К.Ю., Кузнецов Н.Т. // Журн. коорд. химии. 2021. Т. 47. № 8. С. 457. [Avdeeva V.V., Malinina E.A., Zhizhin K.Y., Kuznetsov N.T. // Russ. J. Coord. Chem. 2021. V. 47. № 8. P. 519.] https://doi.org/10.1134/S1070328421080017
Kravchenko E.A., Gippius A.A., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 546. https://doi.org/10.1134/S0036023620040105
Матвеев Е.Ю., Новиков И.В., Кубасов А.С. и др. // Журн. неорган. химии. 2021. Т. 66. № 2. С. 187. [Matveev E.Y., Novikov I.V., Kubasov A.S., et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 2. P. 187.] https://doi.org/10.1134/S0036023621020121
Malinina E.A., Korolenko S.E., Zhdanov A.P. et al. // J. Cluster Sci. 2020. V. 32. P. 755. https://doi.org/10.1007/s10876-020-01840-5
Avdeeva V.V., Buzanov G.A, Malinina E.A. et al. // Crystals. 2020. V. 10. № 5. P. 389. https://doi.org/10.3390/cryst10050389
Короленко С.Е., Авдеева В.В., Малинина Е.А. и др. // Журн. коорд. химии. 2020. Т. 46. № 5. С. 259. [Korolenko S.E., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Coord. Chem. V. 46. № 5. P. 297.] https://doi.org/10.1134/S1070328420050024
Dobrott R.D., Lipscomb W.N. // J. Chem. Phys. 1962. V. 37. P. 1779. https://doi.org/10.1063/1.1733368
Paxton T.E., Hawthorne M.F., Brown L.D., Lipscomb W.N. // Inorg. Chem. 1974. V. 13. № 11. P. 2772.
Didelot E., Sadikin Y., Łodzian Z., Černýa R. // Solid State Sci. 2019. V. 90. P. 86. https://doi.org/10.1016/j.solidstatesciences.2019.02.005
Канаева О.А., Климчук Г.С., Солнцев К.А. // Журн. неорган. химии. 1987. Т. 32. № 3. С. 803.
Van N.-D., Tiritiris I., Schleid T. // Z. Anorg. Allg. Chem. 2004. V. 630. № 11. P. 1764. https://doi.org/10.1002/zaac.200470140
Tiritiris I., Van N.-D., Schleid T. // Z. Anorg. Allg. Chem. 2011. V. 637. № 6. P. 682. https://doi.org/10.1002/zaac.201000457
Tiritiris I., Schleid T., Müller K., Preetz W. // Z. Anorg. Allg. Chem. 2000. V. 626. № 2. P. 323. https://doi.org/10.1002/(SICI)1521-3749(200002)626:2<323::AID-ZAAC323>3.0.CO;2-Q
Tiritiris I., Schleid Th. // Z. Anorg. Allg. Chem. 2003. V. 629. № 78. P. 1390. https://doi.org/10.1002/zaac.200300098
Kleeberg F.M., Dinnebier R.E., Schleid T. // Inorg. Chim. Acta. 2017. V. 467. P. 147. https://doi.org/10.1016/j.ica.2017.07.066
Muetterties E.L., Baltnis J.H., Chia Y.T. et al. // Inorg. Chem. 1964. V. 3. № 3. P. 444. https://doi.org/10.1021/ic50013a030
Малинина Е.А., Жижин К.Ю., Полякова И.Н. и др. // Журн. неорган. химии. 2002. Т. 47. № 8. С. 1275.
Дроздова В.В., Малинина Е.А., Белоусова О.Н. и др. // Журн. неорган. химии. 2008. Т. 53. № 7. С. 1105. [Drozdova V.V., Malinina E.A., Belousova O.N. et al. // Russ. J. Inorg. Chem. 2008. V. 53. № 7. P. 1024.] https://doi.org/10.1134/S0036023608070097
Tiritiris I., Schleid T. // Z. Anorg. Allg. Chem. 2003. V. 629. № 5. P. 581. https://doi.org/10.1002/zaac.200390095
Knoth W.H., Miller H.C., Sauer J.C. et al. // Inorg. Chem. 1964. V. 3. № 2. P. 159. https://doi.org/10.1021/ic50012a002
Sheldrick G.M. // Acta Crystallogr., Sect. A: Found. Adv. 2015. V. 71. P. 3. https://doi.org/10.1107/S2053273314026370
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339.
Spackman P. R., Turner M. J., McKinnon J. J. et al. // J. Appl. Cryst. 2021. V. 54. P. 1006. https://doi.org/10.1107/S1600576721002910
Малинина Е.А., Дроздова В.В., Полякова И.Н., Кузнецов Н.Т. // Журн. неорган. химии. 2008. Т. 53. № 2. С. 238. [Malinina E.A., Drozdova V.V., Polyakova I.N., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2008. V. 53. № 2. P. 197.] https://doi.org/10.1007/s11502-008-2008-y
Hofman K., Albert B. // Z. Kristallogr. 2005. V. 220. P. 142. https://doi.org/10.1524/zkri.220.2.142.59144
Трофимова О.Ю., Ершова И.В., Малеева А.В. и др. // Журн. коорд. химии. 2021. Т. 47. № 9. С. 552. [Trofimova O.Y., Ershova I.V., Maleeva A.V. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 9. P. 610.] https://doi.org/10.1134/S1070328421090086
Kang H.X., Fu Y.Q., Xin L.Y. et al. // Russ. J. Gen. Chem. 2020. V. 90. № 12. P. 2365. https://doi.org/10.1134/S107036322012021X
Gusarov V.S., Cheplakova A.M., Samsonenko D.G. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1374. https://doi.org/10.1134/S0036023621090035
Wang Y.F., Zhang S.Q., Feng Y.X. et al. // Russ. J. Gen. Chem. 2021. V. 91. P. 1566. https://doi.org/10.1134/S1070363221080193
Mikhaylov V.N., Balova I.A. // Russ. J. Gen. Chem. 2021. V. 91. P. 2194. https://doi.org/10.1134/S1070363221110098
Pechenyuk S.I., Domonov D.P., Gosteva A.N. // Russ. J. Gen. Chem. 2021. V. 91. P. 1834. https://doi.org/10.1134/S1070363221090310
Plešek J. // Chem. Rev. 1992. V. 92. P. 269. https://doi.org/10.1021/cr00010a005
Teixidor F., Viñas C., Demonceau A., Núñez R. // Pure Appl. Chem. 2003. V. 75. P. 1305. https://doi.org/10.1351/pac200375091305
Sivaev I.B., Bregadze V.I // Organometallic Chemistry Research Perspectives / Ed. Irwin R.P. Nova Publ., 2007. P. 1.
Sivaev I.B., Bregadze V.I. // Eur. J. Inorg. Chem. 2009. V. 11. P. 1433. https://doi.org/10.1002/ejic.200900003
Leśnikowski Z.J. // J. Med. Chem. 2016. V. 59. № 17. P. 7738. https://doi.org/10.1021/acs.jmedchem.5b01932
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии