Журнал неорганической химии, 2022, T. 67, № 4, стр. 476-482
Теплоемкость и термодинамические функции станната гадолиния в области 0–350 K
К. И. Печковская a, *, Г. Е. Никифорова a, А. В. Тюрин a, О. Н. Кондратьева a, А. В. Гуськов a, М. А. Рюмин a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
* E-mail: bryuhanova@igic.ras.ru
Поступила в редакцию 15.09.2021
После доработки 21.10.2021
Принята к публикации 27.10.2021
- EDN: OZQGAV
- DOI: 10.31857/S0044457X22040158
Аннотация
Теплоемкость поликристаллического станната гадолиния Gd2Sn2O7 впервые экспериментально изучена методами релаксационной и адиабатической калориметрии в интервале 2.35–350.35 K. Значения теплоемкости, полученные двумя независимыми методами, в перекрывающемся интервале практически совпадают и хорошо согласуются с литературными данными по теплоемкости станната гадолиния ниже 7 K. Показано, что низкотемпературная аномалия теплоемкости, обусловленная магнитным переходом из парамагнитного в антиферромагнитное состояние при TN = = 1.015 K, продолжается до 21 K. На основе полученных значений теплоемкости $С_{p}^{^\circ }$(Т) рассчитаны температурные зависимости термодинамических функций Gd2Sn2O7 в интервале 0–350 K. Определена энтальпия образования ΔfH°(298.15 K), энергия Гиббса образования ΔfG°(298.15 K) и характеристическая температура Дебая ΘD станната гадолиния.
ВВЕДЕНИЕ
Соединения состава RE2X2O7 (RE = РЗЭ, X = = Zr, Hf, Sn, Ti) со структурой пирохлора вызывают повышенный исследовательский интерес, связанный с их уникальными характеристиками: высокими температурами плавления, отсутствием фазовых превращений в широком температурном диапазоне, низкой теплопроводностью, высокой ионной проводимостью, химической инертностью, а также высокими параметрами прочности. Перспективные свойства станнатов редкоземельных элементов позволяют использовать керамику на основе этих соединений в качестве электрохимических сенсоров [1], кислород-ионных проводников [2], катализаторов [3], матриц для утилизации радиоактивных отходов (поскольку ионный радиус гадолиния близок к радиусу америция) [4].
В структуре пирохлора атомы редкоземельного элемента образуют подрешетку, состоящую из связанных вершинами тетраэдров, для которой характерно возникновение геометрической магнитной фрустрации при понижении температуры. Спин-спиновые корреляции и другие обменные и дипольные взаимодействия, возникающие при охлаждении из парамагнитного состояния, способствуют возникновению нестандартных низкотемпературных термодинамических свойств и магнитных состояний, таких как спиновые стекла, спиновый лед [5–8]. Поэтому большое внимание уделяется изучению магнитных свойств и структурных искажений геометрически фрустрированного антиферромагнетика Gd2Sn2O7 в области экстремально низких температур [9–11].
Теплоемкость станната гадолиния ранее была изучена в интервалах 0.1–0.8 [9] и 0.35–7.0 K [12]. На температурной зависимости теплоемкости Ср(Т) было обнаружено широкое гало, на которое накладывается острый пик с максимумом при 1.015 K и амплитудой 120 Дж/(K моль Gd). Такая высокая амплитуда пика позволила авторам [12] утверждать, что данный переход относится к переходам первого рода. Однако при температуре фазового перехода TN реализуется лишь 40% магнитной энтропии, т.е. аномалия теплоемкости должна наблюдаться и при более высоких температурах. Отметим, что данные по теплоемкости Gd2Sn2O7 выше 7 K в литературе не найдены.
Целью настоящей работы является исследование теплоемкости Gd2Sn2O7 в интервале 0–350 K, согласование полученных данных с литературными значениями в области магнитного перехода и расчет термодинамических характеристик станната гадолиния в изучаемом температурном интервале.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез и идентификация образцов
В качестве исходных реагентов использовали оксид олова SnO2 (чистота 99.0%, Русхим) и предварительно прокаленный при 1000°С оксид гадолиния Gd2O3 (чистота 99.9%, Химмед).
Образец станната гадолиния Gd2Sn2O7 получали постадийно методом твердофазного синтеза при температурах 1000, 1200 и 1400°С. Смесь оксидов первоначально гомогенизировали в агатовой ступке под слоем ацетона. После каждой стадии отжига проводили дополнительную гомогенизацию смеси без добавления растворителей. На первых двух стадиях отжиг проводили 24 ч, на последней стадии – 4 ч.
Фазовый состав полученных порошков на всех стадиях синтеза изучали методом рентгенофазового анализа (РФА) на дифрактометре фирмы Bruker Advance D8 (CuKα-излучение, λ = 1.5418 Å, никелевый фильтр, геометрия на отражение) в интервале углов 2θ = 10°–65° с шагом 0.0133° и временем накопления сигнала 0.3 с. Для интерпретации данных РФА использовали программу Bruker Diffrac.Eva и базу данных ICDD PDF-2. Кристаллографические параметры определяли с использованием программного обеспечения TOPAS-R (Bruker).
Химическую чистоту однофазного образца и соотношение катионов контролировали с помощью ретгенофлуоресцентного спектрометра Bruker M4 TORNADO, оснащенного трубкой с родиевым анодом и поликапиллярной линзой. Точность анализа составляет 5% от измеряемой величины.
Форма и размер частиц оценены с помощью растрового электронного микроскопа (РЭМ) фирмы JEOL JCM-7000 NeoScope.
Измерение теплоемкости Gd2Sn2O7 со структурой пирохлора
Измерение теплоемкости в температурном диапазоне 2.35–35.04 K выполнено методом релаксационной калориметрии на установке PPMS-9 Quantum Design по методике, описанной ранее в [13]. В диапазоне 5.11–350.35 K измерения проводили с помощью адиабатического вакуумного калориметра БKT-3 (АОЗТ “Термис”, Россия) в атмосфере гелия (p = 30 кПа). В качестве эталонных образцов использовали бензойную кислоту марки “К-2” (99.99%), медь (99.999%), синтетический сапфир (α-Al2O3 99.999%). Установлено, что погрешность измерений достигает 2% ниже 15 K, 0.8% – в диапазоне температур 15–50 K, 0.2% – выше 50 K. Более детальное описание установок и методик измерения теплоемкости приведено в [14].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синтез и исследование образца Gd2Sn2O7
Согласно литературным данным, твердофазный синтез пирохлоров состава Ln2Sn2O7 требует продолжительного высокотемпературного отжига (например, при 1400–1500°С 5 сут [15], 1600°С 10 ч [16], 1400°С 24 ч [17], 1700°С 10 ч [18]). Для определения оптимальной температуры синтеза и снижения времени отжига при высоких температурах была проведена постадийная термическая обработка стехиометрической смеси исходных оксидов при температурах 1000, 1200 и 1400°С. Динамику превращения простых оксидов в Gd2Sn2O7 прослеживали методом РФА после каждого этапа отжига смеси. Рентгенограммы образцов Gd2Sn2O7, синтезированных при указанных температурах, представлены на рис. 1. Видно, что взаимодействие компонентов начинается уже при 1000°С, однако после отжига в течение 24 ч количество целевой фазы составляло лишь 7%. Как и для ранее изученного станната лантана [14], формирование Gd2Sn2O7 начинается при 1200°С, но длительности отжига оказалось недостаточно для получения однофазного образца. В результате дополнительного отжига при 1400°С в течение 4 ч был получен поликристаллический порошок станната гадолиния бежевого цвета.
Рис. 1.
Дифрактограммы порошков, полученных в результате постадийной термической обработки стехиометрической смеси Gd2O3 и SnO2.
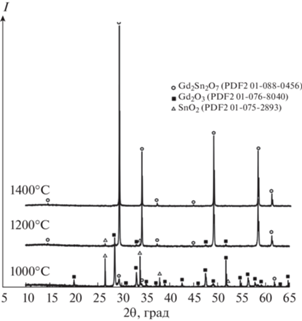
На дифрактограмме полученного образца все дифракционные рефлексы соответствуют кубической структуре пирохлора (пр. гр. Fd$\bar {3}$m) с параметром элементарной ячейки a = 10.459(1) Å и объемом V = 1144.2(1) Å3, что хорошо согласуется с литературными данными [15, 19–21].
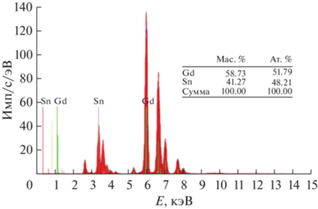
Результаты элементного анализа образца Gd2Sn2O7, выполненного методом рентгенофлуоресцентной спектроскопии, представлены на рис. 2. Среднее соотношение Gd к Sn, вычисленное на основании 10 точек, близко к 1 : 1. Небольшое отклонение от стехиометрии лежит в пределах погрешности метода анализа.
Микрофотографии полученного станната гадолиния представлены на рис. 3. Поликристаллический образец Gd2Sn2O7 представляет собой совокупность ограненных частиц округлой формы, связанных в агломераты. Следует отметить узкое распределение частиц по размерам, средний диаметр составляет ~400 нм.
Теплоемкость Gd2Sn2O7
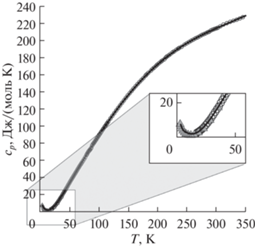
На рис. 4 приведены экспериментальные значения молярной теплоемкости Gd2Sn2O7 в области низких температур, полученные методом релаксационной (2.35–35.04 K, 50 экспериментальных точек) и адиабатической калориметрии (5.11–350.35 K, 141 экспериментальная точка), а также сглаженные значения теплоемкости в области 3–350 K. На вставке видно, что в интервале температур 6–35 K данные, полученные двумя различными методами, совпадают в пределах точности экспериментов. Поэтому весь набор экспериментальных точек был аппроксимирован единым уравнением, представляющим собой линейную комбинацию ортонормированных полиномов [22]:
(1)
${{C}_{p}} = \sum\limits_0^m {{{A}_{j}}{{U}^{j}}} ,\,\,\,\,{\text{где}}\,\,\,\,U = \ln \left( {\frac{T}{{400}}} \right).$Рис. 4.
Экспериментальные значения теплоемкости Gd2Sn2O7, полученные методами релаксационной (треугольники) и адиабатической (кружки) калориметрии, и температурная зависимость теплоемкости $С_{p}^{^\circ }$(Т), рассчитанная по уравнению (1) (сплошная линия), в интервале 0–350 K.
Значения полиномиального множителя Aj приведены в табл. 1.
Таблица 1.
Коэффициенты Aj в уравнении (1)
| j | Aj , Дж/(K моль) |
|---|---|
| 0 | 246.6459 |
| 1 | 158.8691 |
| 2 | 313.7606 |
| 3 | 674.342815399 |
| 4 | 704.91285256 |
| 5 | 423.0413224 |
| 6 | 157.89121773 |
| 7 | 37.288063114 |
| 8 | 5.418519916 |
| 9 | 0.4420608898 |
| 10 | 0.01549398577 |
| σ2 | 0.041099 |
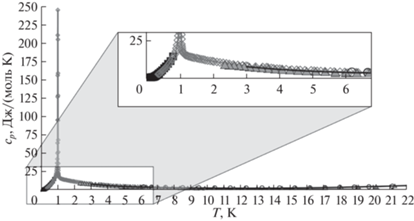
Выше 15 K теплоемкость станната гадолиния закономерно увеличивается с ростом температуры без каких-либо аномалий на зависимости Ср(Т). При этом ниже 15 K наблюдается увеличение теплоемкости с понижением температуры, связанное с антиферромагнитным упорядочением ионов Gd3+. В данной работе мы зафиксировали нисходящую ветвь низкотемпературной аномалии теплоемкости, обусловленной магнитным фазовым переходом первого рода при температуре 1.015 K, изученным ранее Бонвиллем [12]. Сопоставление результатов настоящей работы с литературными данными приведено на рис. 5. Небольшое расхождение кривых теплоемкости в области 2.5–3 K (не более 6%) не внесет дополнительной неопределенности в дальнейшие термодинамические расчеты.
Рис. 5.
Tемпературные зависимости теплоемкости Gd2Sn2O7 в интервале 0–22 K. Квадраты – данные [9]; серые линия и ромбы – данные [12]; сплошная черная линия – зависимость $С_{p}^{^\circ }$(Т), рассчитанная по уравнению (1); треугольники и круги – наши экспериментальные данные.
Для корректного расчета термодинамических функций необходимо экстраполировать температурную зависимость теплоемкости к 0 K. Поэтому в области магнитного фазового перехода решеточную составляющую теплоемкости станната гадолиния принимали пропорциональной кубу температуры и рассчитывали по формуле:
Температуру возникновения спин-спиновых корреляций при охлаждении парамагнитного Gd2Sn2O7 определяли по разности значений теплоемкости, рассчитанных по уравнениям (1) и (2). Эта разница принимает нулевое значение при ~21 K.
На основе сглаженных значений теплоемкости $С_{р}^{^\circ }$(Т) с учетом низкотемпературных данных работ [9, 12] рассчитаны температурные зависимости термодинамических функций станната гадолиния (изменения энтальпии H°(T) – H°(0), энтропии S°(T) и приведенной энергии Гиббса Φ°(T) = (H°(T) – H°(0))/T – S°(T)) (табл. 2). Молярная магнитная энтропия фазового перехода ΔSmag при 21 K составила 35.07 Дж/(K моль), что сопоставимо с величиной максимальной энтропии магнитной подсистемы, определяемой как Rln(2J + 1) = Rln8 = 17.3 Дж/(K моль Gd), т.е. 34.6 Дж/(K моль Gd2Sn2O7).
Таблица 2.
Сглаженные термодинамические функции Gd2Sn2O7 (теплоемкость $C_{p}^{^\circ }(T),$ энтропия S°(T), приращение энтальпии H°(T) – H°(0) и приведенная энергия Гиббса Φ°(T) = (H°(T) – H°(0))/T – S°(T)) в интервале температур 2–350 K, рассчитанные с учетом низкотемпературного магнитного перехода [12]
| T, K | $C_{p}^{^\circ },$ Дж/(K моль) | S°, Дж/(K моль) | Н°(T) – H°(0), Дж/моль | –Ф°, Дж/(K моль) |
|---|---|---|---|---|
| 2 | 10.87 | 26.40 | 27.24 | 12.78 |
| 3 | 7.801 | 30.10 | 36.24 | 18.02 |
| 4 | 5.304 | 31.90 | 42.46 | 21.29 |
| 5 | 4.095 | 32.95 | 47.12 | 23.52 |
| 6 | 3.258 | 33.62 | 50.77 | 25.16 |
| 7 | 2.683 | 34.07 | 53.71 | 26.40 |
| 8 | 2.288 | 34.40 | 56.19 | 27.38 |
| 9 | 2.005 | 34.66 | 58.33 | 28.18 |
| 10 | 1.812 | 34.86 | 60.22 | 28.83 |
| 12 | 1.684 | 35.17 | 63.67 | 29.87 |
| 14 | 1.869 | 35.44 | 67.17 | 30.64 |
| 16 | 2.357 | 35.72 | 71.34 | 31.26 |
| 18 | 3.142 | 36.04 | 76.80 | 31.77 |
| 20 | 4.183 | 36.42 | 84.12 | 32.22 |
| 21 | 4.777 | 36.64 | 88.59 | 32.42 |
| 25 | 7.617 | 37.69 | 112.8 | 33.18 |
| 30 | 12.26 | 39.48 | 162.2 | 34.07 |
| 35 | 17.49 | 41.75 | 236.4 | 35.00 |
| 40 | 23.05 | 44.45 | 337.6 | 36.01 |
| 45 | 28.77 | 47.49 | 467.1 | 37.11 |
| 50 | 34.54 | 50.82 | 625.4 | 38.31 |
| 55 | 40.33 | 54.39 | 812.6 | 39.61 |
| 60 | 46.09 | 58.14 | 1029 | 41.00 |
| 65 | 51.81 | 62.06 | 1273 | 42.47 |
| 70 | 57.48 | 66.10 | 1547 | 44.01 |
| 75 | 63.08 | 70.26 | 1848 | 45.62 |
| 80 | 68.63 | 74.51 | 2177 | 47.29 |
| 85 | 74.10 | 78.84 | 2534 | 49.02 |
| 90 | 79.50 | 83.22 | 2918 | 50.80 |
| 95 | 84.82 | 87.66 | 3329 | 52.62 |
| 100 | 90.06 | 92.15 | 3766 | 54.49 |
| 110 | 100.3 | 101.2 | 4718 | 58.32 |
| 120 | 110.1 | 110.4 | 5771 | 62.28 |
| 130 | 119.5 | 119.6 | 6919 | 66.33 |
| 140 | 128.5 | 128.7 | 8160 | 70.46 |
| 150 | 137.0 | 137.9 | 9488 | 74.65 |
| 160 | 145.1 | 147.0 | 10 898 | 78.89 |
| 170 | 152.7 | 156.0 | 12 388 | 83.16 |
| 180 | 159.8 | 165.0 | 13 951 | 87.45 |
| 190 | 166.5 | 173.8 | 15 582 | 91.77 |
| 200 | 172.7 | 182.5 | 17 278 | 96.09 |
| 210 | 178.4 | 191.1 | 19 034 | 100.4 |
| 220 | 183.7 | 199.5 | 20 845 | 104.7 |
| 230 | 188.7 | 207.8 | 22 707 | 109.0 |
| 240 | 193.3 | 215.9 | 24 617 | 113.3 |
| 250 | 197.5 | 223.9 | 26 571 | 117.6 |
| 260 | 201.4 | 231.7 | 28 566 | 121.8 |
| 270 | 205.1 | 239.4 | 30 599 | 126.0 |
| 280 | 208.6 | 246.9 | 32 668 | 130.2 |
| 290 | 211.8 | 254.3 | 34 770 | 134.4 |
| 300 | 214.9 | 261.5 | 36 904 | 138.5 |
| 310 | 217.9 | 268.6 | 39 068 | 142.6 |
| 320 | 220.9 | 275.5 | 41 262 | 146.6 |
| 330 | 223.8 | 282.4 | 43 485 | 150.6 |
| 340 | 226.7 | 289.1 | 45 737 | 154.6 |
| 350 | 229.6 | 295.7 | 48 019 | 158.5 |
По коэффициенту а уравнения (2) было рассчитано значение характеристической температуры Дебая ΘD станната гадолиния, равное 347 K. Это значение сопоставимо с величиной ΘD для La2Sn2O7 (ΘD = 339 K), рассчитанной по коэффициенту а решеточного вклада, приведенному в работе [14].
Оценка энергии Гиббса образования Gd2Sn2O7
Энергию Гиббса образования станната гадолиния можно рассчитать исходя из величины абсолютной энтропии S° (298.15 K), определенной в данной работе, значений стандартных энтропий простых веществ (Gd, Sn, O2) и величины энтальпии образования ΔfH°(298.15 K) Gd2Sn2O7, информация о которой в литературе отсутствует. Для оценки энтальпии образования станната гадолиния был использован подход, предложенный в работе [23], который основан на корреляционной зависимости энтальпии образования $\Delta _{f}^{{{\text{ox}}}}H$ соединений лантаноидов со структурой пирохлора от ионного радиуса лантаноида Ln3+ [24]. Экспериментальные значения $\Delta _{f}^{{{\text{ox}}}}H,$ полученные в работе [19] для станнатов РЗЭ (РЗЭ = La, Nd, Sm, Eu, Dy, Yb) со структурой пирохлора, были описаны следующей зависимостью:
(3)
$\begin{gathered} D_{f}^{{{\text{ox}}}}H({{R}_{i}}) = \\ = --1\,652\,275 + 3\,528\,519{{R}_{i}}--1\,919\,038{{R}_{i}}^{2}. \\ \end{gathered} $Ионный радиус Gd3+ с координационным числом 8 равен 1.053 Å [25], в этом случае величина $\Delta _{f}^{{{\text{ox}}}}H$(Ri)(Gd2Sn2O7) составляет –64.6 кДж/моль. Исходя из полученной величины и значений энтальпии образования оксидов Gd2O3 (ΔfH°(Gd2O3, 298.15 K) = –1819.7 кДж/моль) [26] и SnO2 (ΔfH°(SnO2, 298.15 K) = –577.6 кДж/моль) [19] можно оценить величину энтальпии образования станната гадолиния из простых веществ: ΔfH°(Gd2Sn2O7) = –3039.5 кДж/моль. Энергия Гиббса образования, рассчитанная с учетом параметров низкотемпературного магнитного фазового перехода, составила ΔfG°(Gd2Sn2O7, 298.15 K) = = –2836.3 кДж/моль.
Значения термодинамических функций станната гадолиния при 298.15 K представлены в табл. 3.
Таблица 3.
Термодинамические свойства Gd2Sn2O7 со структурой пирохлора при Т = 298.15 K
| Соединение | Gd2Sn2O7 |
|---|---|
| $C_{p}^{^\circ }$(298.15 K), Дж/(K моль) | 214.4 |
| S°(298.15 K), Дж/(K моль) | 260.2 |
| H°(298.15 K) – H°(0), кДж/моль | 36.51 |
| ΔfoxH(298.15 K), кДж/моль | – 64.6 |
| ΔfH°(298.15 K), кДж/моль | – 3039.5 |
| ΔfG°(298.15 K), кДж/моль | – 2836.3 |
| ΘD, K | 347 |
ЗАКЛЮЧЕНИЕ
Поликристаллический станнат гадолиния со структурой пирохлора получен твердофазным методом синтеза и охарактеризован с помощью рентгенофазового и рентгенофлуоресцентного анализа. Морфология и размер частиц определены с помощью РЭМ. Теплоемкость полученного образца Gd2Sn2O7 изучена методами релаксационной и адиабатической калориметрии в интервале температур 2.35–350.35 K. Полученные экспериментальные данные находятся в хорошем согласии с литературными данными по теплоемкости станната гадолиния в области ниже 7 K. По аппроксимированным значениям теплоемкости $C_{p}^{^\circ }$(Т) рассчитаны температурные зависимости стандартных термодинамических функций Gd2Sn2O7 в интервале 0–350 K.
Список литературы
Balamurugan K., Rajakumaran R., Chen S.M. et al. // Int. J. Electrochem. Sci. 2021. V. 16. P. 210368-1. https://doi.org/10.20964/2021.03.20
Srinivasan N., Kiruthika G.V.M. // Solid State Sci. 2019. V. 96. P. 105957. https://doi.org/10.1016/j.solidstatesciences.2019.105957
Xu J., Zhang Y., Xu X. et al. // ACS Catalysis. 2019. V. 9. P. 4030. https://doi.org/10.1021/acscatal.9b00022
Lang M., Zhang F., Zhang J. et al. // Nucl. Instrum. Methods Phys. Res., Sect. B. 2010. V. 268. P. 2951. https://doi.org/10.1016/j.nimb.2010.05.016
Zhou H.D., Wiebe C.R., Janik J.A. et al. // Phys. Rev. Lett. 2008. V. 101. P. 227204. https://doi.org/10.1103/PhysRevLett.101.227204
Fennell T., Kenzelmann M., Roessli B. et al. // Phys. Rev. Lett. 2012. V. 109. P. 017201-1. https://doi.org/10.1103/PhysRevLett.109.017201
Paddison J.A.M., Ehlers G., Petrenko O.A. et al. // J. Phys.: Condens. Matter. 2017. V. 29. P. 144001. https://doi.org/10.1088/1361-648X/aa5d2e
Gardner J.S., Gingras M.J.P., Greedan J.E. // Rev. Modern Phys. 2010. V. 82. P. 53. https://doi.org/10.1103/RevModPhys.82.53
Quilliam J.A., Ross K.A., Del Maestro A.G. et al. // Phys. Rev. Lett. 2007. V. 99. P. 097201-1. https://doi.org/10.1103/PhysRevLett.99.097201
Freitas R.S., Gardner J.S. // J. Phys.: Condens. Matter. 2011. V. 23. P. 164215. https://doi.org/10.1088/0953-8984/23/16/164215
Wills A.S., Zhitomirsky M.E., Canals B. et al. // J. Phys.: Condens. Matter. 2006. V. 18. P. L37. https://doi.org/10.1088/0953-8984/18/3/L02
Bonville P., Hodges J.A., Ocio M. et al. // J. Phys.: Condens. Matter. 2003. V. 15. P. 7777. https://doi.org/10.1088/0953-8984/15/45/016
Rosen P.F., Woodfield B.F. // J. Chem. Thermodyn. 2020. V. 141. P. 105974. https://doi.org/10.1016/j.jct.2019.105974
Ryumin M.A., Nikiforova G.E., Tyurin A.V. et al. // Inorg. Mater. 2020. V. 56. № 1. P. 97. https://doi.org/10.1134/S0020168520010148
Kennedy B.J., Hunter B.A., Howard C.J. // J. Solid State Chem. 1997. V. 130. P. 58. https://doi.org/10.1006/jssc.1997.7277
Zhao M., Ren X., Yang J. et al. // J. Am. Ceram. Soc. 2016. V. 99. P. 293. https://doi.org/10.1111/jace.13979
Turner K.M., Tracy C.L., Mao W.L. et al. // J. Phys.: Condens. Matter. 2017. V. 29. P. 504005. https://doi.org/10.1088/1361-648X/aa9960
Xia X.-L., Ouyang J.-H., Liu Z.-G. // J. Power Sources. 2009. V. 189. P. 888. https://doi.org/10.1016/j.jpowsour.2008.12.136
Lian J., Helean K.B., Kennedy B.J. et al. // J. Phys. Chem. B. 2006. V. 110. P. 2343. https://doi.org/10.1021/jp055266c
Feng J., Xiao B., Qu Z.X. et al. // Appl. Phys. Lett. 2011. V. 99. P. 201909. https://doi.org/10.1063/1.365948
Zhao J., Liu Y., Fan Y. et al. // J. Mater. Sci. Technol. 2021. V. 73. P. 23. https://doi.org/10.1016/j.jmst.2020.09.033
Гуревич В.М., Хлюстов В.Г. // Геохимия. 1979. № 6. С. 829.
Tyurin A.V., Khoroshilov A.V., Ryumin M.A. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 12. P. 1891. https://doi.org/10.1134/S0036023620120207
Helean K.B., Ushakov S.V., Brown C.E. et al. // J. Solid State Chem. 2004. V. 177. P. 1858. https://doi.org/10.1016/j.jssc.2004.01.009
Shannon R.D. // Acta Crystallogr., Sect. A. 1976. V. A32 P. 751. https://doi.org/10.1107/S0567739476001551
Konings R J.M., Beneš O., Kovács A. et al. // J. Phys. Chem. Ref. Data. 2014. V. 43. P. 013101-1. https://doi.org/10.1063/1.4825256
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии