Журнал неорганической химии, 2022, T. 67, № 3, стр. 281-285
Образование твердой фазы в жидком катоде тлеющего разряда над растворами KMnO4
К. В. Смирнова a, А. Н. Иванов a, Д. А. Шутов a, *, А. С. Манукян a, В. В. Рыбкин a
a Ивановский государственный химико-технологический университет
153000 Иваново, Шереметевский пр-т, 7, Россия
* E-mail: shutov@isuct.ru
Поступила в редакцию 08.09.2021
После доработки 18.10.2021
Принята к публикации 27.10.2021
- EDN: VXNOWR
- DOI: 10.31857/S0044457X22030126
Аннотация
Описаны закономерности образования твердой фазы в водных растворах перманганата калия под действием разряда постоянного тока в воздухе над жидкой фазой при атмосферном давлении. Ток разряда составлял 40 мА (суммарная вкладываемая в систему мощность 6 Вт). Разряд зажигался в системе без контакта электродов с жидкой фазой. Высказаны предположения о существенном отличии механизмов процессов, протекающих под действием разряда, по сравнению с процессами, происходящими в тех же условиях с растворами солей переходных металлов. Полученное твердофазное соединение исследовано методами рентгеноструктурного и термогравиметрического анализа, сканирующей электронной микроскопии.
ВВЕДЕНИЕ
В последние 10–15 лет значительно выросло число работ, посвященных эффектам воздействия электрических газовых разрядов различного типа при атмосферном давлении на водные растворы органических и неорганических соединений [1]. Интерес к плазменно-растворным системам обусловлен двумя основными причинами. Во-первых, это способ очистки воды от различного рода загрязнений (преимущественно органической природы) [2, 3], во-вторых, это перспективный метод получения мелкодисперсных (в том числе наноразмерного диапазона) порошков неорганических элементов и их соединений [4, 5]. К преимуществам данных методов можно отнести относительную техническую простоту реализации процесса, отсутствие необходимости использования посторонних реагентов, которые могут загрязнять жидкую фазу и/или полученное вещество, и небольшую стоимость, обусловленную затратами только на электроэнергию. Воздействие электрических разрядов на водные растворы приводит к появлению в жидкой фазе химически активных частиц, способных выступать в роли как окислителей (например, радикалы OH и HO2, молекулы H2O2 и O3, атомы O), так и восстановителей (атомы и молекулы водорода, сольватированные электроны) [6, 7]. При этом наблюдается изменение рН раствора.
Промышленные и бытовые сточные воды помимо органических загрязнений содержат примеси тяжелых металлов в виде катионов или в составе анионов. В зависимости от того, в каком виде в жидкой фазе присутствует металл, процесс очистки/формирования твердой фазы может различаться. Это могут быть окислительно-восстановительные или ионно-обменные процессы. Ранее нами была показана возможность синтеза гидроксосоединений цинка и кадмия в анодной части плазменно-растворной системы с использованием тлеющего разряда постоянного тока в воздухе [8, 9]. Установлена морфология, химический, гранулометрический и кристаллический состав соединений и предложены механизмы синтеза указанных соединений в приповерхностном слое водных растворов нитратов цинка и кадмия, которые являлись анодом газового разряда, горящего над поверхностью растворов. Работ, в которых бы уделялось внимание восстановлению металлов в составе анионов, значительно меньше. Например, в случае хрома (работы по плазменно-растворному синтезу его соединений в литературе отсутствуют) известны только три работы, в которых изучалось восстановление сильного токсиканта, мутагена и канцерогена [10] Cr6+ (в составе дихромат- и хромат-анионов) до катионов Cr3+ в жидкой фазе под действием разрядов в воздухе и аргоне [11–13]. Очистка водных источников от другого распространенного загрязнителя – марганца – с использованием плазменно-растворных систем практически не изучена. Нам известна только одна работа такого рода [14], где помимо снижения концентрации марганца в высших степенях окисления (Mn7+) отмечалось образование твердой фазы в жидком катоде разряда. При этом анализ получаемого в плазменно-растворной системе вещества не проводился. Однако существует ряд работ, в которых авторы изучали возможности других методов получения марганецсодержащих твердых микро- и наночастиц [15–18].
Цель настоящей работы – изучение химического состава и морфологии твердой фазы, образующейся в растворе перманганата калия, являющегося жидким катодом тлеющего разряда постоянного тока в воздухе при атмосферном давлении.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
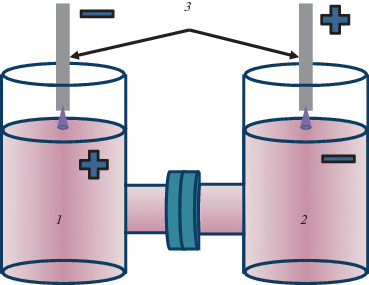
Реактор представляет собой Н-образную стеклянную ячейку объемом 200 мл, плечи которой разделены целлофановой мембраной (рис. 1). Высокое напряжение подавалось на титановые электроды, расположенные над поверхностью раствора, таким образом, что одно из плеч плазмохимической системы для разряда являлось жидким анодом (А-ячейка), а второе – жидким катодом (К-ячейка). Разряд зажигался в воздухе при атмосферном давлении, ток разряда составлял 40 мА (суммарная вкладываемая в систему мощность 6 Вт). Суммарное время горения разряда не превышало 5 мин. В качестве жидкой фазы использовали водные растворы перманганата калия, которые готовили растворением KMnO4 квалификации “ч.д.а.” в дистиллированной воде. Концентрация раствора составляла 1.45 ммоль/л (по марганцу).
Рис. 1.
Схема экспериментальной установки для синтеза: 1 – жидкий анод, 2 – жидкий катод, 3 – титановые электроды.
Под действием разряда в катодной части ячейки наблюдалось образование суспензии. Синтезированное в ней твердое вещество собирали, центрифугировали, промывали дистиллированной водой и сушили на воздухе при температуре 60°C в течение 24 ч. Полученный порошок затем подвергали отжигу в течение 1 ч в атмосфере воздуха при температурах 300, 600 и 900°С.
Изображения поверхности порошков и их элементный состав получали с помощью сканирующего электронного микроскопа (СЭМ) Tescan Vega 3SBH (Чехия) с приставкой для рентгеновской энергодисперсионной спектроскопии Aztec EDS (Англия). Рентгеноструктурный анализ проводили с помощью рентгеновского дифрактометра ДРОН 3M (Россия) в CuKα-излучении, анализ дифрактограмм – при помощи программного обеспечения QualX2 с использованием открытой кристаллографической базы данных COD [12]. Термогравиметрический анализ (ТГА) и дифференциальную сканирующую калориметрию (ДСК) выполняли на приборе STA 449 F1 Jupiter (Германия) в диапазоне температур 30–900°C при скорости нагрева 5 град/мин в атмосфере Ar : O2 = 80 : 20%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
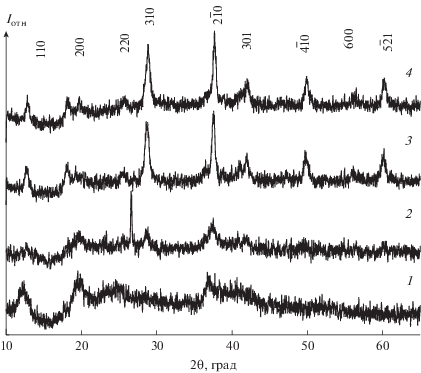
Уже в первую минуту после зажигания разряда в ячейке именно с жидким катодом образуется коллоидная взвесь, равномерно распределенная по всему объему. В ячейке с жидким анодом процесс образования начинается намного позже (после ~3 мин горения разряда) и взвеси образуется существенно меньше. В отличие от материалов, получаемых в А-ячейке [8, 9], в данном случае образующееся в К-ячейке соединение не демонстрирует ярко выраженной кристалличности (рис. 2). Только прокаливание порошка приводит к появлению на дифракционной картине характерных рефлексов.
Рис. 2.
Рентгеновские спектры порошков: непрокаленный (1), после 1 отжига при 300 (2), 600 (3) и 900°C (4).
В работах по воздействию тлеющего разряда в воздухе на воду отмечается, что в жидком катоде интенсивно образуется пероксид водорода, тогда как в анодной ячейке образование пероксида водорода не наблюдается [19]. В то же время электрофизические характеристики разрядов с жидким анодом и жидким катодом мало отличаются [20]. В нашем случае жидкий катод “подкисляется” до pH ~ 3. Можно наблюдать образование коричневой суспензии с первых минут обработки раствора, начиная с приповерхностного слоя. По-видимому, происходит реакция восстановления Mn7+ в составе перманганата образующимся пероксидом водорода с образованием бурого вещества, вероятно, оксида марганца. С увеличением времени обработки pH раствора снижается вследствие окисления молекул воды по реакции: H2O = 2H+ + O⋅, а также растворения образующихся в самом разряде в воздухе оксидов азота. Поэтому промежуточный продукт в виде оксида марганца в дальнейшем растворяется с образованием бесцветного раствора соли марганца в степени окисления +2. Суммарный брутто-процесс можно записать сокращенно в ионном виде:
Поэтому спустя 300 с обработки мы наблюдаем в приповерхностном слое К-ячейки обесцвечивание раствора. Показатель кислотности раствора после выключения разряда составил 3.2. Для подтверждения состава образующейся суспензии она была отобрана и исследована описанными методами.
Тем самым показано, что для перевода химически активного перманганат-аниона в более безопасную восстановленную форму в виде оксидного осадка или катионов Mn2+ нет необходимости использовать дополнительные восстановители, достаточно только плазмохимической обработки раствора в катодной ячейке.
Любопытным является состав синтезированного материала и порошков после прокаливания (табл. 1). Элементный состав полученного порошка может соответствовать стехиометрическому MnO с примесью калия. Прокаливание данного вещества приводит к значительному изменению в стехиометрии. Даже с учетом неточности метода рентгеновской энергодисперсионной спектроскопии, в частности при определении содержания кислорода, стехиометрическое соотношение Mn : O изменяется при прокаливании от 1 : 1 до ~1 : 2, что соответствует оксиду MnO2 (рис. 2, кривые 3 и 4) [21].
Таблица 1.
Элементный состав образцов
| Образец | K : Mn : O | K : Mn : O | Mn : O |
|---|---|---|---|
| вес. % | |||
| Синтезированный | 7.1 : 64.1 : 28.8 | 1 : 6.4 : 6.4 | 1 : 1 |
| Прокаленный, 300°С | 6.64 : 62.27 : 31.09 | 1 : 6.7 : 11.4 | 1 : 1.7 |
| Прокаленный, 600°С | 9.86 : 50.73 : 39.41 | 1 : 3.7 : 9.8 | 1 : 2.7 |
| Прокаленный, 900°С | 8.71 : 56.07 : 35.23 | 1 : 4.6 : 9.9 | 1 : 2.2 |
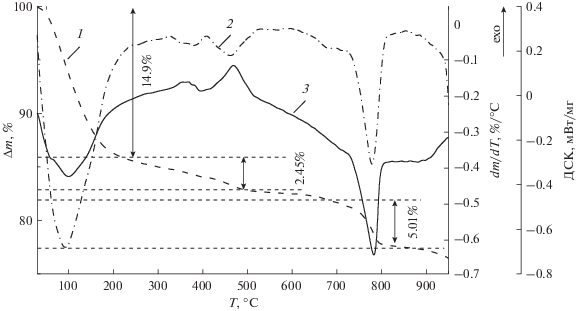
На рис. 3 приведены кривые ТГА, ДСК и дифференциальные термогравиметрические (ДТГ) кривые, полученные в процессе прокаливания образцов. На рис. 4 показана морфология поверхности синтезированных порошков, а также проиллюстрированы изменения, происходящие с порошками в процессе их прокаливания.
Рис. 4.
СЭМ-изображения синтезированного порошка (а) и порошков после отжига при 300 (б), 600 (в) и 900°С (г).

На СЭМ-изображениях можно отметить изменения морфологии порошков. Так, прокаливание при 300°С (рис. 4б) сопровождается убылью массы и эндотермическим процессом при температурах до 100°С (рис. 3). Как правило, такого рода процессы связаны с дегидратацией (или частичной дегидратацией) полученных из водных растворов твердых материалов (кристаллогидратов). В диапазоне температур 350–500°С наблюдается протекание экзотермических процессов. Следует отметить, что в работах [8, 9] для синтезированных твердых веществ в А-ячейке экзотермические процессы не наблюдались. Возможно, в данном диапазоне температур отжиг приводит к окислению материала. По-видимому, это объясняет увеличение стехиометрического соотношения Mn : O (табл. 1) и наблюдаемое (рис. 4в) уплотнение порошка. Дальнейшее увеличение температуры отжига приводит к очередной убыли массы образца в эндотермическом процессе (рис. 3) и разрыхлению его поверхностной структуры.
ЗАКЛЮЧЕНИЕ
Процессы плазменно-растворного синтеза соединений марганца из его водных растворов под действием тлеющего разряда постоянного тока в воздухе при атмосферном давлении существенно отличаются от аналогичных процессов, протекающих при синтезе целого ряда соединений металлов из растворов их водных нитратов. Основное отличие связано с возможностью получения твердофазных соединений в растворе, являющемся жидким катодом. Интерес также представляет возможность изменения стехиометрического соотношения Mn : O как в процессе синтеза, так и в процессе высокотемпературной обработки полученных соединений.
Список литературы
Akishev Y.S. // Изв. вузов. Химия и хим. технология. 2019. Т. 62. № 8. С. 26. https://doi.org/10.6060/ivkkt.20196208.5908
Jiang B., Zheng J., Qiu S. et al. // Chem. Eng. J. 2014. V. 236. P. 348. https://doi.org/10.1016/j.cej.2013.09.090
Gusev G.I., Gushchin A.A., Grinevich V.I. et al. // Изв. вузов. Химия и хим. технология. 2020. Т. 63. № 7. С. 88. https://doi.org/10.6060/ivkkt.20206307.6182
Sevost’yanov M.A., Lysenkov A.S. // Russ. J. Inorg. Chem. 2021. V. 66. P. 1055. https://doi.org/10.1134/S0036023621080258
Saito G., Akiyama T. // J. Nanomater. 2015. Art. 123696. https://doi.org/10.1155/2015/123696
Рыбкин В.В., Шутов Д.А. // Физика плазмы. 2017. Т. 43. № 11. С. 929. https://doi.org/10.1007/s11090-014-9596-3
Bruggeman P.J., Frontiera R.R., Kortshagen U.R. et al. // J. Appl. Phys. 2021. V. 129. P. 200902. https://doi.org/10.1063/5.0044261
Shutov D.A., Rybkin V.V., Ivanov A.N. et al. // High Energy Chem. 2017. V. 51. P. 65. https://doi.org/10.1134/S0018143917010118
Shutov D.A., Smirnova K.V., Gromov M.V. et al. // Plasma Chem. Plasma Proc. 2018. V. 38. P. 107. https://doi.org/10.1007/s11090-017-9856-0
Kimbrough Y., Cohen A.M., Winer L. et al. // Crit. Rev. Environ. Sci. Technol. 1999. V. 29. № 1. P. 1. https://doi.org/10.1080/10643380701643650
Shutov D.A., Sungurova A.V., Choukourov A., Rybkin V.V. // Plasma Chem. Plasma Process. 2016. V. 36. № 5. P. 1253. https://doi.org/10.1007/s11090-016-9725-2
Ke Z., Huang Q., Zhang H., Yu Z. // Environ. Sci. Technol. 2011. V. 45. № 18. P. 7841. https://doi.org/10.1021/es201680m
Shutov D.A., Sungurova A.V., Smirnova K.V., Rybkin V.V. // High Energy Chem. 2018. V. 52. № 1. P. 95. https://doi.org/10.1134/S0018143918010125
Шутов Д.А., Сунгурова А.В., Смирнова К.В. и др. // Изв. вузов. Химия и хим. технология. 2018. Т. 61. № 9–10. С. 23. https://doi.org/10.6060/ivkkt.20186109-10.5802
Egorova A.A., Bushkova T.M., Kolesnik I.V. et al. // Russ. J. Inorg. Chem. 2021. V. 66. P. 146. https://doi.org/10.1134/S0036023621020066
Gyrdasova O.I., Krasil’nikov V.N., Bazuev G.V. // Russ. J. Inorg. Chem. 2009. V. 54. P. 1035. https://doi.org/10.1134/S0036023609070080
Korotkov R.F., Baranchikov A.E., Boytsova O.V. et al. // Russ. J. Inorg. Chem. 2016. V. 61. P. 129. https://doi.org/10.1134/S0036023616020091
Altomare A., Corriero N., Cuocci C. et al. // J. Appl. Crystallogr. 2015. V. 48. P. 598. https://doi.org/10.1107/S1600576715002319
Шутов Д.А., Батова Н.А., Рыбкин В.В. // Химия высоких энергий. 2020. Т. 54. № 1. С. 68. https://doi.org/10.31857/S0023119320010118
Шутов Д.А., Иванов А.Н., Рыбкин В.В. и др. // Изв. вузов. Химия и хим. технология. 2020. Т. 63. № 2. С. 91. https://doi.org/10.6060/ivkkt.20206302.6194
Kondrashe Y.D., Zaslavskii A.I. // Izvestiya Akademii Nauk SSSR. 1951. V. 15. P. 179.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии