Журнал неорганической химии, 2022, T. 67, № 3, стр. 271-280
Подводная низкотемпературная плазма как инструмент синтеза неорганических наноматериалов
А. В. Агафонов a, Н. А. Сироткин a, В. А. Титов a, А. В. Хлюстова a, *
a Институт химии растворов им. Г.А. Крестова РАН
153045 Иваново, ул. Академическая, 1, Россия
* E-mail: kav@isc-ras.ru
Поступила в редакцию 08.09.2021
После доработки 05.10.2021
Принята к публикации 15.10.2021
- EDN: DONMRZ
- DOI: 10.31857/S0044457X22030023
Аннотация
Методы синтеза наноструктур оказывают влияние на свойства получаемых материалов. Использование традиционных препаративных методов синтеза требует дальнейшей очистки полученных соединений от непрореагировавших прекурсоров и побочных продуктов реакций синтеза и их утилизации. Комбинация низкотемпературной плазмы, генерированной между двумя металлическими электродами, и дистиллированной воды позволяет избежать вышеупомянутых недостатков. Представлены обобщающие результаты исследований применения плазмы, горящей в объеме раствора, для синтеза наноструктурированных неорганических материалов. Изучены структуры, полученные с использованием электродов из одного и двух материалов. Полученные наноструктуры исследованы с помощью сканирующей электронной микроскопии и рентгенофазового анализа. Установлено, что в условиях подводной плазмы можно получать оксидные наноструктуры с разными степенями окисления металлов. Показаны возможности формирования металл-полимерных нанокомпозитов, допированных оксидных наноструктур, смешанных оксидов и наносплавов. Рассмотрен возможный механизм формирования оксидов металлов в зоне плазмы. Представлены результаты применения полученных наноматериалов в качестве фотоэлементов, сорбентов органических и неорганических загрязнений, бактерицидных агентов.
ВВЕДЕНИЕ
Низкотемпературная плазма – это частично ионизированный квазинейтральный газ, содержащий электроны, ионы, радикалы, возбужденные частицы, концентрация которых значительно превышает равновесную при реализующихся в плазме температурах газа. Важной особенностью низкотемпературной плазмы является ее неравновесность – большое (до двух порядков величины) отличие средней энергии электронов от энергии тяжелых частиц. Следствием этого является эффективное образование активных частиц и высокая химическая активность плазмы при относительно низкой температуре газа. В последнее время интерес к низкотемпературной плазме связан с многочисленными аспектами ее практического применения. Здесь следует упомянуть такие области, как синтез наночастиц, обработка и модификация поверхности, биомедицинское и сельскохозяйственное назначение, очистка объектов окружающей среды [1].
В настоящей работе рассмотрены возможности использования низкотемпературной плазмы, образующейся в объеме жидкости (воды), для синтеза оксидных наноматериалов на основе ранее опубликованных работ и новых результатов, полученных авторами. Синтез наночастиц металлов и их химических соединений при горении разряда между металлическими электродами в растворах является интересным и перспективным подходом к получению наноматериалов и модификации полимеров, физико-химические основы которого лежат в области физики плазмы и электрохимии, таких как анодный электролиз, дуговой разряд и низкотемпературная плазма, контактирующая с жидкими средами [2–8]. Рассматриваемый в данной работе метод интересен тем, что может конкурировать с традиционными препаративными подходами неорганической химии, используемыми для получения неорганических материалов, а именно: соосаждением [9–11], гидросольвотермальным [12–15], золь-гель синтезом [16–18]. Одним из преимуществ данного метода является то, что для его реализации не требуется использование прекурсоров (неорганических солей, алкоксидов металлов и элементоорганических соединений), что освобождает технологию от утилизации побочных продуктов. При рассматриваемом плазмохимическом синтезе металлические электроды используются в качестве прекурсоров наноматериалов, которые формируются либо на электродах, либо в зоне плазмы. Это отличает его от плазмохимической обработки растворов реагентов, при которой образуется значительное количество побочных продуктов [19–25]. Понимание взаимодействия между наночастицами, генерируемыми в низкотемпературной плазме, и раствором очень важно и играет значительную роль в синтезе современных наноматериалов, а также в корректировке их свойств. Необходимо отметить, что при синтезе наночастиц в плазме, формируемой в жидкости, образующиеся частицы охлаждаются с колоссальной скоростью от температуры синтеза до температуры кипения растворителя, что превышает скорости закалки, реализующиеся в таком перспективном процессе, как самораспространяющийся высокотемпературный синтез [26]. Очевидно, что условия, реализуемые в процессе синтеза в плазме, генерируемой в объеме раствора, приводят к неравновесным продуктам, обладающим новыми, во многом еще не изученными свойствами. Поиск закономерностей формирования таких свойств при синтезе наночастиц и использование низкотемпературной плазмы в жидкости для модификации полимерных материалов являются важной научной задачей, имеющей значительный инновационный потенциал.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
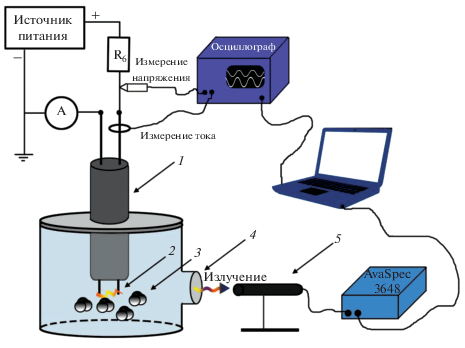
Схема установки для синтеза оксидных наноматериалов с использованием плазмы в объеме жидкости представлена на рис. 1. Все эксперименты проводили в ячейке с объемом жидкости 200 мл. Газовый разряд создавали между двумя электродами (стержнями диаметром 1 мм), погруженными в дистиллированную воду. В качестве материалов электродов использовали серебро, молибден, титан, вольфрам (Sigma Aldrich), алюминий, медь, никель, цинк (ООО “Цветметсплав”) и графит (Dungguan Chang’an Store). Электроды помещали в керамическую трубку диаметром 7 мм, расстояние между ними составляло 1.5 мм. Такой межэлектродный зазор был выбран эмпирически и обеспечивал устойчивое горение разряда в течение всего времени эксперимента (до 30 мин) при использовании источника постоянного тока с выходным напряжением до 5 кВ.
Рис. 1.
Экспериментальная установка для синтеза неорганических материалов с использованием подводной плазмы: 1 – керамическая трубка с металлическими стержнями, 2 – разряд, 3 – образующиеся наночастицы, 4 – кварцевое окно, 5 – волоконно-оптический волновод.
Несмотря на то, что к электродам прикладывалось постоянное напряжение, разряд имел квазипериодический импульсный характер. Высокая плотность тока на электродах и в межэлектродном зазоре вызывала локальный перегрев жидкости и интенсивное газовыделение на электродах. Образующиеся парогазовые пузырьки размыкали электрическую цепь, и при достаточно большой разности потенциалов на электродах происходил электрический пробой в пузырьках с возникновением плазмы. Схлопывание пузырей сопровождалось образованием акустических волн.
Осциллограммы тока и напряжения горения разряда получали с использованием цифрового осциллографа ADS-2072 (АКТАКОМ, Россия). По осциллограммам определяли амплитудные и средние значения тока и напряжения горения разряда, а также рассчитывали мощность, рассеиваемую в разрядной ячейке, согласно методике, представленной в работе [8]. При использовании электродов из меди, алюминия и железа амплитудные значения напряжения горения разряда составляли 3500–4500 В при среднем токе разряда 0.25 А. Средняя частота следования разрядных импульсов в зависимости от использованных электродов составляла 11–27 с–1, а рассеиваемая в ячейке средняя мощность – 22–38 Вт [27].
Спектры излучения плазмы в диапазоне длин волн 200–950 нм регистрировали через кварцевое окно в ячейке спектрометром AvaSpec ULS3648 (Avantes BV, Нидерланды). Внешний вид разряда регистрировали с помощью фотокамеры Canon 1100 D с объективом Compact Macro 55 мм.
Электроды взвешивали до и после эксперимента на аналитических весах AND HR-15AZ с точностью 0.1 мг. Размер формирующихся в плазмохимических процессах наночастиц оценивали по результатам динамического рассеяния света (Zetasizer Nano, Malvern). Для определения фазового состава продуктов синтеза использовали рентгенодифракционный анализ, который проводили на порошковом дифрактометре D2 Phaser (Brucker, CuKα-излучение, λ = 1.5406 Å). Морфологию поверхности и элементный состав полученных порошкообразных образцов исследовали при помощи сканирующего электронного микроскопа (Tescan Vega 3 SBH), оснащенного энергодисперсионным спектрометром (Oxford Instruments).
ХАРАКТЕРИСТИКИ ПОЛУЧЕННЫХ ПРОДУКТОВ
Возможны различные варианты организации плазмохимического синтеза оксидных наночастиц с использованием плазмы, контактирующей с жидкостью. Простейшими генераторами такой плазмы являются газовые разряды между двумя электродами, изготовленными из одного и того же материала, или между двумя электродами из разных металлов, которые погружены в жидкость (в частности, в дистиллированную воду). Естественно ожидать, что состав и свойства продуктов синтеза при этом будут различаться. Далее представлены первые результаты, полученные при двух названных способах возбуждения плазмы.
Разряд между электродами из одного материала
Результаты оценок размеров частиц методом динамического рассеяния света приведены в табл. 1. Средние значения размеров частиц в водных дисперсиях составляют 85–400 нм. Для большинства продуктов эти значения выше, чем принятая верхняя граница размеров нанообъектов (100 нм). Однако следует принять во внимание, что гидродинамические диаметры частиц в суспензиях, определяемые методом динамического рассеяния света, дают завышенную оценку размеров частиц в силу их сольватации. Кроме того, в описываемых экспериментах не применялись специальные меры по предотвращению процессов агломерации и агрегации частиц. Результаты просвечивающей электронной микроскопии показали возможность получения частиц с размерами <100 нм [8].
Таблица 1.
Средние размеры частиц и скорости эрозии электродов в разрядах, контактирующих с дистиллированной водой
| Материал электрода | Dср, нм | v, г/мин | tпл, °С |
|---|---|---|---|
| Ag | 400 | 0.006 | 961 |
| Al | 130 | 0.06 | 660 |
| Cu | 120 | 0.009 | 1089 |
| Mo | 200 | 0.002 | 2623 |
| Ni | 140 | 0.003 | 1455 |
| Ti | 300 | 0.004 | 1668 |
| W | 125 | 0.009 | 3422 |
| Zn | 85 | 0.01 | 420 |
Используя скорости эрозии электродов, приведенные в табл. 1, и предполагая, что все частицы распыляемых металлов переходят в оксиды, можно грубо оценить концентрацию оксидных частиц в суспензиях. Такие оценки показывают, что за 30 мин плазмохимического процесса концентрация продуктов составляет от 5 до 20 мас. %. Накопление частиц в суспензии приводит к незначительному росту тока и уменьшению напряжения горения разряда. Возможно, это связано с облегчением ионизации электронным ударом в плазме, а также с изменением электропроводности жидкости.
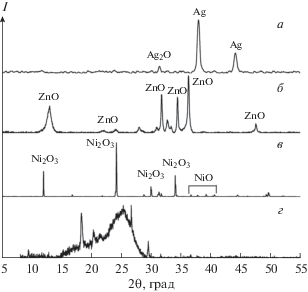
Рентгенофазовый анализ полученных в процессе плазмохимического синтеза порошков показал, что только при использовании электродов из серебра образуются наночастицы металла с примесью его оксида Ag2O (рис. 2, кривая а). Для остальных исследованных металлов характерно формирование оксидов различной структуры. Так, при использовании электродов из алюминия получены частицы γ-Al2O3 [13], вольфрама – γ-WO3 [8], цинка – ZnO (рис. 2, кривая б). В экспериментах с электродами из меди, молибдена и никеля образовывались смеси оксидов: Cu2O + CuO [27], α-MoO3 + MoO2 + Mo4O11 [28], NiO + Ni2O3 (рис. 2, кривая в). Плазмохимический синтез оксидов титана приводил к формированию TiO2 в двух модификациях: рутила и анатаза [29]. При использовании графитовых электродов дифракционный анализ показал образование многослойного графена (рис. 2, кривая г) [30] со средним числом слоев, согласно оценкам, сделанным по методике [31], равным 9. Дифракционный пик с относительно малой интенсивностью при 2θ = 9.5° указывает на присутствие оксида графена.
На рис. 3 представлены результаты сканирующей электронной микроскопии. В случае оксидов алюминия, никеля и титана при высушивании формируются агрегированные структуры нерегулярной формы. Частицы γ-WO3 имеют форму нитей и вытянутых пластин. В осадках нестехиометрического оксида молибдена (смесей оксидов) формируются самоорганизованные структуры типа “цветок” (рис. 3з). Микрофотографии порошка графена показывают образование нитевидных структур.
Рис. 3.
СЭМ-изображения синтезируемых структур: а – AgO, б – Al2O3, в – CuOx, г – NiOx, д – TiO2, е – WO3, ж – MoOx, з – ZnO, и – графен.

Таким образом, при использовании плазмы, генерируемой в объеме жидкости, возможно получение оксидных наноструктур с разными степенями окисления металлов. Главная задача при этом – научиться управлять составом и структурой продуктов путем варьирования параметров плазмы. В частности, в работе [27] исследовали синтез оксидов при использовании разрядов с электродами из меди, алюминия и железа, погруженными в дистиллированную воду, при двух значениях тока разряда: 0.25 и 0.8 А. Установлено, что при токе разряда 0.25 А формируются частицы γ-Al2O3, а при 0.8 А – γ-AlOОН. В случае электродов из железа при меньшем токе образуется смесь оксидов FeO + Fe3O4, в то время как при большем токе (0.8 А) была получена смесь полиморфных модификаций Fe2O3.
Разряд между электродами из различных материалов
Использование для генерации плазмы электродов из двух различных металлов открывает пути формирования оксидных наноструктур переменного состава. При этом всегда образуются оксиды обоих металлов, из которых изготовлены электроды, но состав основной фазы определяется полярностью напряжения, приложенного к электродам (рис. 4). Так, при возбуждении разряда между катодом из вольфрама и анодом из титана рентгенограммы продуктов показали наличие γ-WO3 и TiO2 (рис. 4, кривая а). При смене полярности напряжения интенсивность пиков, относящихся к оксиду вольфрама, увеличивается, а диоксида титана уменьшается (рис. 4, кривая б). Подобные результаты получены и в экспериментах, в которых разряд возбуждался между титановым и молибденовым электродами. При положительной полярности молибденового электрода образовывались преимущественно частицы MoO3, декорированные оксидом титана, а при отрицательной полярности – частицы диоксида титана, декорированные нестехиометрическим оксидом молибдена [32].
Рис. 4.
Рентгенограммы порошков, синтезированных с двумя разными электродами: а – Ti-W, б – W-Ti, в – Ni-C, г – C-Ni.
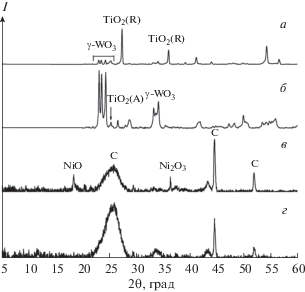
Иная картина наблюдается при разряде между электродами из графита и никеля. В экспериментах с графитовым анодом и никелевым катодом на рентгенограммах продуктов присутствуют рефлексы, относящиеся как к графену, так и к оксидам никеля (рис. 4, кривая в), однако при смене полярности электродов рефлексы, характерные для оксидов никеля, исчезают.
Снимки, полученные на сканирующем электронном микроскопе, показали, что полярность напряжения, приложенного к электродам в процессе синтеза, влияет не только на состав продуктов, но и на морфологию частиц (рис. 5).
О механизмах плазмохимического формирования оксидных наноструктур
При использовании классического дугового разряда, горящего между двумя металлическими электродами при атмосферном давлении, наиболее вероятным механизмом образования оксидных структур считается расплавление материала электрода с последующим его испарением и окислением в зоне плазмы. Механизмы процессов, которые реализуются в низкотемпературной плазме, генерируемой в объеме воды, к настоящему времени не изучены, но есть основания полагать, что они существенно отличаются от процессов в плазме дугового разряда. Во-первых, эффективное охлаждение электродов при возбуждении плазмы в жидкости делает маловероятным термический перевод металла в плазму. Наиболее вероятно, он обусловлен ионной бомбардировкой электродов.
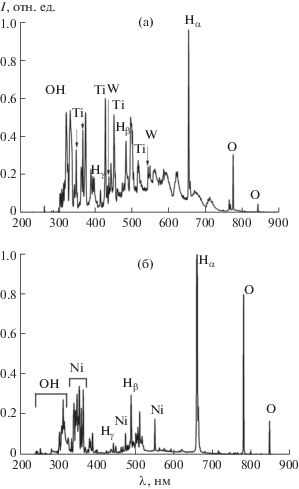
В спектрах излучения плазмы присутствуют не только линии и полосы продуктов диссоциации молекул воды: атомарного водорода (Hα (656 нм), Hβ (486 нм) и Hγ (434 нм)) и кислорода (777 и 844.5 нм), а также радикалов ОН (306–308 нм), но и линии атомов металлов (рис. 6). Естественно предположить, что первичными являются реакции атомов металлов в плазме с такими активными окислителями, как атомарный кислород и гидроксил-радикалы. С окислительными реакциями могут конкурировать процессы восстановления образующихся оксидов с участием атомарного водорода, а быстрая “закалка” продуктов при их попадании в жидкую фазу определяет различные степени окисления металлов в получаемых продуктах. По-видимому, объединение первичных кластеров, зарождающихся в газовой фазе, и их последующие трансформации протекают уже на границе плазма–жидкость и непосредственно в жидкости, поскольку именно там существуют более выгодные условия для отвода энергии присоединения новых молекул к кластерам.
ПОЛУЧЕНИЕ МЕТАЛЛООРГАНИЧЕСКИХ КОМПОЗИТОВ
Наноструктурированные оксидные материалы представляют большой интерес в качестве перспективных материалов для электроники [33, 34]. Их управляемое внедрение в полимерные матрицы является серьезным шагом в создании изделий гибкой электроники [35, 36].
При возбуждении газового разряда между электродами, погруженными в водные растворы или дисперсии полимеров, одновременно протекает ряд процессов. Наряду с распылением металла и образованием оксидных наноструктур происходят разрывы макроцепей полимера, его активация и модифицирование. Опыт показывает, что при этом наночастицы металлов или оксидов могут быть встроены в полимерную матрицу [37, 38]. Так, при возбуждении разряда между электродами из меди или цинка в водном растворе поливинилового спирта в полимерную матрицу внедряются наночастицы оксидов соответствующих металлов [38]. При использовании алюминиевых электродов в матрицу встраиваются наночастицы γ-AlOOH. Об этом свидетельствуют рентгенограммы полученных композиционных материалов и данные сканирующей электронной микроскопии. Композиционные материалы на основе поливинилового спирта с наночастицами γ-AlOOH, CuO и ZnO характеризуются нелинейными вольтамперными характеристиками, а их диэлектрическими параметрами можно управлять, выбирая условия получения наночастиц [38].
Композиционный материал на основе полилактида с наночастицами серебра был получен в работе [37] при разряде между серебряными электродами, погруженными в водную суспензию полимолочной кислоты. В электронных спектрах поглощения суспензий после кратковременной плазмохимической обработки отчетливо проявлялись полосы поглощения, обусловленные поверхностным плазмонным резонансом в наночастицах серебра. Наличие наночастиц в пленках после испарения растворителя было подтверждено методами просвечивающей электронной микроскопии, рентгеновской дифракции и рентгеновской энергодисперсионной спектроскопии. Такой композиционный материал обладает бактерицидной активностью по отношению к грамположительным (Staphylococcus aureus, Bacillus subtilis) и грамотрицательным (Escherichia coli) бактериям, а также фунгицидной активностью по отношению к Сandida albicans. Подобные результаты были получены и с пленками хитозана, содержащими наночастицы серебра [39].
СОЗДАНИЕ ДОПИРОВАННЫХ СТРУКТУР И НАНОСПЛАВОВ
В работах [40, 41] была изучена возможность использования плазмы, контактирующей с жидкостью, для допирования частиц диоксида титана, полученного золь-гель методом. Обработке подвергали золи TiO2 в плазме разрядов с электродами из алюминия, меди, молибдена, вольфрама. Результаты рентгеноструктурного анализа показали, что распыленные частицы материалов электродов встраиваются в решетку TiO2. Это приводит к увеличению удельной поверхности порошков, улучшению их сорбционных свойств и изменению ширины запрещенной зоны (3.28 эВ для исходного TiO2 и 2.98–3.19 эВ для допированного диоксида титана) [40]. Установлено, что допирование увеличивает фотокаталитическую активность при разложении модельного органического соединения (родамин Б) под действием видимого света.
При использовании разряда с электродами из титана и молибдена или титана и вольфрама формируются структуры TiO2–MoO3 и TiO2–WO3 (рис. 7а) [32]. Для исследований их фотоэлектрических свойств был изготовлен фотоэлемент (рис. 7б), в котором полученные структуры выполняли функции фотокатода. В табл. 2 приведены значения плотности фототока и темнового тока короткого замыкания, которые показывают, что данные структуры могут представлять интерес как материалы для изделий фотоэлектроники.
Рис. 7.
Микрофотографии ПЭМ структур, полученных в плазме с Ti-Mo-электродами (а), и схема фотоэлемента, созданная на основе полученных структур (б).
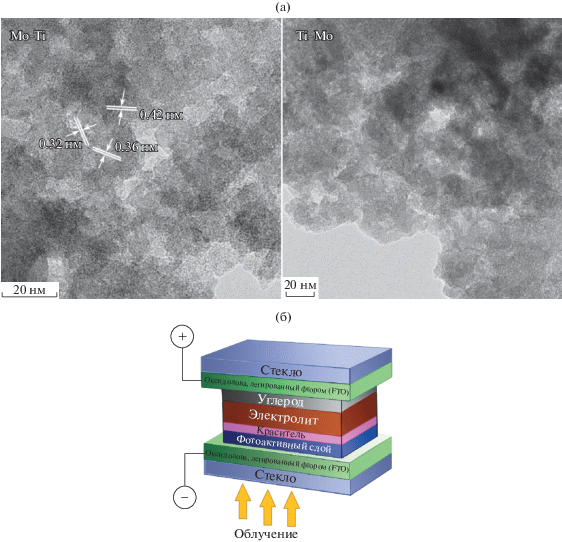
Таблица 2.
Плотность фототока (Jmax) и темнового тока (Jsc) фотоэлемента с наноструктурированными оксидными катодами [32]
| Материал | Jmax, мА/см2 | Jsc, мА/см2 |
|---|---|---|
| MoOx | 0.99 | 0.238 |
| TiO2 | 0.39 | 0.111 |
| MoO3/TiO2 | 1.04 | 0.244 |
| TiO2/MoOx | 1.30 | 0.42 |
Оксидные наноматериалы, обладая высокой удельной поверхностью, рассматриваются и как эффективные сорбенты. В качестве оценки сорбционных свойств продуктов, синтезированных в плазмохимических процессах, была исследована эффективность удаления модельных красителей и ионов хрома из водных растворов, результаты представлены в табл. 3. Эксперименты показали, что максимальной эффективностью по отношению к сорбции красителей характеризуется нестехиометрический оксид молибдена (MoOx) [42], а ионы хрома Cr(VI) могут быть удалены из растворов сорбцией на частицах оксида алюминия (γ-Al2O3), синтезированных плазмохимическим методом [27].
Таблица 3.
| Материал | Загрязнитель | Эффективность, % |
|---|---|---|
| γ-Al2O3 | Cr(VI) | 90 |
| CuOx | Cr(VI) | 55 |
| Графен | Смесь красителей (родамин Б + метиленовый голубой) | 60 |
| MoOx | Метиленовый голубой | 100 |
| Родамин Б | 100 | |
| Активный красный 6С | 100 | |
| NiOx | Смесь красителей | 72–81 |
| TiO2 | Cu2+ | 55–66 |
| Fe3+ | 50–60 | |
| Смесь красителей | 95 | |
| γ-WO3 | Метиленовый голубой | 100 |
| Родамин Б | 68 | |
| Активный красный 6С | 94 | |
| TiO2/γ-WO3 | Смесь красителей | 100 |
ЗАКЛЮЧЕНИЕ
Представленные данные показывают, что газоразрядная плазма, контактирующая с жидкостью, является одним из перспективных инструментов для синтеза оксидных наноматериалов. По сравнению с традиционными химическими процессами рассматриваемый метод отличается простотой аппаратурного оформления и сокращает расход реагентов, является экологически чистым. Показана принципиальная возможность получения допированных материалов и смешанных оксидных структур, а также композиционных материалов. Безусловно, дальнейшее развитие метода требует решения ряда серьезных проблем, связанных с оценкой его энергетической эффективности, селективности синтеза, с изучением механизмов плазмохимических превращений и поиском путей управления составом и структурой получаемых продуктов через изменение параметров плазмы.
Список литературы
Adamovich I., Baalrud S.D., Bogaerts A. et al. // J. Phys. D: Appl. Phys. 2017. V. 50. № 32. P. 323001.
Hou C., Zhang M., Kasama T. et al. // Adv. Mater. 2016. V. 28. № 21. P. 4097.
Bulychev N.A., Kazaryan M.A., Chaikov L.L. et al. // Bull. Lebedev Phys. Inst. 2014. V. 41. № 9. P. 264.
Singh S.C., Swarnkar R.K., Gopal R. // J. Nanosci. Nanotechnol. 2009. V. 9. № 9. P. 5367.
Sasaki T., Shimizu Y., Koshizaki N. // J. Photochem. Photobiol. A: Chem. 2006. V. 182. № 3. P. 335.
Ashkarran A.A. // J. Cluster Sci. 2011. V. 22. № 2. P. 233.
Khlyustova A.V., Sirotkin N.A., Krayev A.S. et al. // Plasma Sci. Technol. 2019. V. 21. № 2. P. 025505.
Sirotkin N.A., Khlyustova A.V., Titov V.A. et al. // Plasma Chem. Plasma Process. 2020. V. 40. № 2. P. 571.
Petcharoen K., Sirivat A. // Mater. Sci. Eng. B. 2012. V. 177. № 5. P. 421.
Ahamed A.J., Kumar P.V. // J. Chem. Pharm. Res. 2016. V. 8. № 5. P. 624.
Cherian E., Rajan A., Baskar G. // Int. J. Modern Sci. Technol. 2016. V. 1. № 1. P. 17.
Madathil A.N.P., Vanaja K.A., Jayaraj M.K. // Nanophotonic Mater. IV. Int. Soc. Optics Photonics. 2007. V. 6639. P. 66390J.
Panahi-Kalamuei M., Alizade S., Mousavi-Kamazani M. et al. // J. Ind. Eng. Chem. 2015. V. 21. № 1. P. 1301.
Yan A., Liu X., Qiu G. et al. // J. Alloys Compd. 2008. V. 458. № 1-2. P. 487.
Mishra D., Arora R., Lahiri S. et al. // Prot. Met. Phys. Chem. Surf. 2014. V. 50. № 5. P. 628.
Alwan R.M., Kadhim Q.A., Sahan K.M. et al. // Nanosci. Nanotechnol. 2015. V. 5. № 1. P. 1.
Alagiri M., Ponnusamy S., Muthamizhchelvan C. // J. Mater. Sci.: Mater. Electron. 2012. V. 23. № 3. P. 728.
Parashar M., Shukla V.K., Singh R. // J. Mater. Sci.: Mater. Electron. 2020. V. 31. № 5. P. 3729.
Shutov D.A., Rybkin V.V., Ivanov A.N., Smirnova K.V. // High Energy Chem. 2017. V. 51. № 1. P. 65.
Kareem T.A., Kaliani A.A. // Ionics. 2012. V. 18. № 3. P. 315.
Allagui A., Baranova E.A., Wüthrich R. // Electrochim. Acta. 2013. V. 93. P. 137.
Shirai N., Uchida S., Tochikubo F. // Jpn. J. Appl. Phys. 2014. V. 53. № 4. P. 046202.
Saito G., Akiyama T. // J. Nanomater. 2015. V. 16. № 1. P. 299.
Shutov D.A., Ivanov A.N., Rakovskaya A.V. et al. // J. Phys. D: Appl. Phys. 2020. V. 53. № 44. P. 445202.
Shutov D.A., Smirnova K.V., Gromov M.V. et al. // Plasma Chem. Plasma Process. 2018. V. 38. № 1. P. 107.
Юхвид В.И. Самораспространяющийся высокотемпературный синтез: теория и практика. Черноголовка: Территория, 2001.
Khlyustova A., Sirotkin N., Kraev A. et al. // Materialia. 2021. V. 16. № 5. P. 101081.
Khlyustova A., Sirotkin N., Titov V., Agafonov A. // Curr. Appl. Phys. 2020. V. 20. № 12. P. 1396.
Khlyustova A.V., Sirotkin N.A., Kraev A.S. et al. // Plasma Chem. Plasma Process. 2021. V. 41. № 2. P. 643.
Rao C.N.R., Biswas K., Subrahmanyam K.S., Govindaraj A. // J. Mater. Chem. 2009. V. 19. № 17. P. 2457.
Saikia B.K., Boruah R.K., Gogoi P.K. // J. Chem. Sci. 2009. V. 121. № 1. P. 103.
Khlyustova A., Sirotkin N., Titov V., Agafonov A. // J. Alloys Compd. 2021. V. 858. № 3. P. 157664.
Yu X., Marks T.J., Facchetti A. // Nature Mater. 2016. V. 15. № 4. P. 383.
Wu W., Wang M., Ma J. et al. // Adv. Electron. Mater. 2018. V. 4. № 8. P. 1800185.
Dang Z.M., Yuan J.K., Yao S.H., Liao R.J. // Adv. Mater. 2013. V. 25. № 44. P. 6334.
Salvatore G.A., Münzenrieder N., Kinkeldei T. et al. // Nature Commun. 2014. V. 5. № 1. P. 1.
Sirotkin N.A., Gurina D.L., Khlyustova A.V. et al. // Plasma Process. Polym. 2021. V. 18. № 2. P. 2000169.
Khlyustova A., Sirotkin N., Kraev A. et al. // J. Appl. Polym. Sci. 2021. V. 138. № 40. P. 51174.
Titov V., Nikitin D., Naumova I. et al. // Materials. 2020. V. 13. № 21. P. 4821.
Khlyustova A., Sirotkin N., Kusova T. et al. // Mater. Adv. 2020. V. 1. № 5. P. 1193.
Khlyustova A., Sirotkin N., Kraev A. et al. // J. Chem. Technol. Biotechnol. 2021. V. 96. № 4. P. 1125.
Khlyustova A., Sirotkin N., Kraev A. et al. // Dalton Trans. 2020. V. 49. № 19. P. 6270.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии