Журнал неорганической химии, 2022, T. 67, № 3, стр. 397-402
Сорбция ионов тяжелых металлов из водных растворов мезопористым 2-этилимидазолатом никеля
Д. В. Филиппов a, *, В. А. Фуфаева a, М. В. Шепелев a
a Ивановский государственный химико-технологический университет
Шереметевский пр-т, 7
153000 Иваново, Россия
* E-mail: filippov@isuct.ru
Поступила в редакцию 08.09.2021
После доработки 28.09.2021
Принята к публикации 30.09.2021
- EDN: EOHIIZ
- DOI: 10.31857/S0044457X22030084
Аннотация
Представлены результаты исследования процессов сорбции ионов меди(II), кадмия(II) и хрома(III) в присутствии мезопористого 2-этилимидазолата никеля при 298 K. Определены важнейшие сорбционные характеристики, в частности значения предельной адсорбции для данного материала по каждому металлу. Предельная адсорбция 2-этилимидазолата никеля по меди(II), кадмию(II) и хрому(III) достигает 5.98, 5.05 и 7.65 моль/кг соответственно. Показано, что на адсорбционные характеристики 2-этилимидазолата никеля по отношению к тяжелым металлам оказывают влияние как величина кристаллографических радиусов и заряда элементов, так и распределение их в фазе раствора. Установлено, что процесс адсорбции тяжелых металлов является термодинамически самопроизвольным. Образец 2-этилимидазолата никеля изучен с помощью сканирующей электронной микроскопии, ИК-спектроскопии (НПВО) и порошковой рентгеновской дифракции.
ВВЕДЕНИЕ
Распространение ионов тяжелых металлов в окружающей среде является результатом глобальной индустриализации [1–5]. Тяжелые металлы не поддаются биологическому разложению и имеют тенденцию накапливаться в живых организмах, проявляя по отношению к ним цитотоксическое действие, в частности, они связываются с аминокислотами белков через –NH2- и –SH-группы, инактивируя ряд ферментов и другие биологически активные вещества. В настоящее время применяются различные по происхождению и механизму действия сорбенты, но они имеют относительно низкую сорбционную емкость и селективность [6–12]. Поэтому эффективное удаление тяжелых металлов из водных сред остается актуальной задачей. В качестве эффективных сорбентов большой интерес вызывают имидазолатные каркасные структуры (ИКС), являющиеся подклассом металлоорганических каркасных структур, не только в связи с их высокой удельной поверхностью и воспроизводимостью функциональных свойств, но и с возможностью получения в “мягких” условиях. На данный момент получены каркасы, использование которых без дополнительных модификаций возможно в ряде адсорбционных процессов, эти материалы демонстрируют большой потенциал для извлечения ионов тяжелых металлов. В настоящее время получены ИКС, достаточно эффективно извлекающие ионы Cd(II), Cr(III, VI), As(VI), Cu(II) [13–18]. Однако используемые имидазолатные каркасные структуры имеют относительно небольшую сорбционную емкость по многим тяжелым металлам, а адсорбционное равновесие в системе сорбент–раствор при извлечении ионов тяжелых металлов из водных растворов устанавливается через 3–7 ч, что является достаточно продолжительным в производственных масштабах процессом [19–22].
Цель настоящей работы – изучение сорбционных характеристик и закономерностей адсорбции тяжелых металлов в присутствии имидазолатных каркасных структур с улучшенными сорбционными характеристиками.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали (без дополнительной очистки) хлорид никеля (NiСl2 · 6H2O, х. ч.), 2-этилимидазол (Sigma Aldrich, >98.0%), додецилдиметиламин-N-оксид (х. ч.), аммиак водный 20%-ный (NH4OH, ч. д. а.), сульфат меди(II) (CuSO4 · 5H2O, х. ч.), хлорид кадмия(II) (CdCl2 · 2.5H2O, ч. д. а.), сульфат хрома(III) (Cr2(SO4)3 · 6H2O, ч. д. а.).
Синтез 2-этилимидазолата никеля проводили прямым смешением. Этот метод можно считать высокоэффективным как с точки зрения выхода, так и с позиции продолжительности и энергозатрат. Основной особенностью данного метода является контакт растворов соответствующих предшественников в присутствии структурирующих агентов при комнатной температуре и постоянном перемешивании. Так, хлорид никеля(II) растворяли в 30 мл дистиллированной воды, 2-этилимидазол – в 30 мл изопропилового спирта совместно со 100 мкл 20%-ного водного раствора аммиака. Раствор додецилдиметиламин-N-оксида (ДДАО) получали отдельно по следующей схеме: 150 мкл ДДАО растворяли в 40 мл дистиллированной воды при постоянном перемешивании (200 об/мин), затем к водному раствору ДДАО совместно приливали приготовленные растворы хлорида никеля и 2-этилимидазола. Мольное соотношение лиганд : металл = 4. Реакционную смесь выдерживали при комнатной температуре (25 ± 1°C) и постоянном перемешивании (400 об/мин) в течение 30 мин. Затем образцы отделяли от раствора центрифугированием, трехкратно промывали изопропиловым спиртом и дистиллированной водой. Полученный 2-этилимидазолат никеля сушили в вакуумном сушильном шкафу при температуре 120°С до постоянной массы.
Данные о морфологии имидазолатных каркасных структур получены методом сканирующей электронной микроскопии с помощью сканирующего электронного микроскопа Tescan VEGA 3 SBH при ускоряющем напряжении 5 кВ.
Инфракрасные спектры регистрировали с помощью ИК-фурье-спектрометра Shimadzu IRAffinity-1S методом нарушенного полного внутреннего отражения в диапазоне 4000–500 см–1.
Фазовый состав изучали методом рентгенофазового анализа на дифрактометре XRD Advance Bruker (CuKα-излучение, 40 кВ, 50 мА). Диапазон сканирования 2θ 5°–35°, размер шага 0.008° (2θ).
Расчет удельной поверхности и радиуса пор 2-этилимидазолата никеля путем обработки изотерм, полученных методом низкотемпературной адсорбции азота, а также изучение и описание кинетики сорбции ионов меди(II) в присутствии 2-этилимидазолата никеля представлены в работе [23].
Диффузионный массоперенос ионов меди изучали в рамках теории Вебера–Морриса, описываемой уравнением (1):
где qτ – сорбционная емкость в текущий момент времени, мг/г; kid ‒ константа скорости внутрипористой диффузии; c ‒ параметр, связанный с толщиной пограничного слоя, мг/г.Эксперименты по сорбции ионов тяжелых металлов проводили в статических условиях из водных растворов при термостатировании (298 K). Процесс сорбции тяжелых металлов и получения изотерм сорбции описан на примере извлечения ионов меди(II). Навески образцов 2-этилимидазолата никеля массой 0.1 г помещали в 10 мл водного раствора сульфата меди. Начальную концентрацию Cu(II) варьировали в интервале 7 × 10–4–0.07 моль/л. Время контакта соответствовало времени достижения адсорбционного равновесия, определенного в кинетическом эксперименте [23]. Начальную и конечную концентрацию металлов в растворе фиксировали с помощью атомно-абсорбционного спектрометра 210 VGP. Для получения сорбционных характеристик процесса изотермы адсорбции ионов меди(II) обрабатывали в линейных координатах моделей Ленгмюра (2), Фрейндлиха (3) и Дубинина–Радушкевича (4):
(3)
${\text{ln}}{\kern 1pt} {{q}_{e}} = {\text{ln}}{\kern 1pt} {{K}_{F}} + \frac{1}{n}{\text{ln}}{\kern 1pt} C{\text{,}}$(4)
${\text{ln}}{\kern 1pt} {{q}_{\tau }} = {\text{ln}}{\kern 1pt} {{q}_{m}} + \frac{{RT}}{B}{\text{ln}}\frac{{{{C}_{s}}}}{{{{C}_{\tau }}}},$Значения констант Генри (Нi, л/кг) рассчитывали по формуле:
где Am – предельная адсорбция, моль/кг; b – адсорбционный коэффициент, численно равный константе Ленгмюра (уравнение 2).Для расчета величин изменения энергии Гиббса $(\Delta G_{a}^{0})$, кДж/моль) использовали уравнение:
где R – универсальная газовая постоянная, кДж/(моль K); T – абсолютная температура, K; b – адсорбционный коэффициент, численно равный константе Ленгмюра (уравнение (2)).Значения максимальной степени заполнения поверхности (θ) определяли по формуле:
где A и Am – равновесная и предельная адсорбция, моль/кг.РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что в ходе адсорбции на пористых телах появляется стадия переноса вещества внутри пор, для которой характерен диффузионный механизм. При этом стадия диффузионного массопереноса может определять время достижения адсорбционного равновесия, всего процесса в целом. Диффузию ионов меди(II) из объемной фазы раствора в объемную фазу сорбента изучали в рамках теории Вебера–Морриса (рис. 1, табл. 1).
Рис. 1.
Кинетика сорбции ионов меди(II), представленная в координатах диффузионной модели Вебера–Морриса.
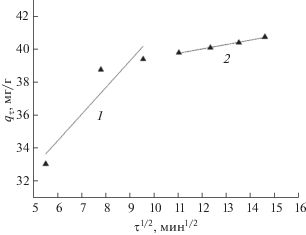
Таблица 1.
Параметры внутренней диффузии по модели Вебера–Морриса. R2 – коэффициент корреляции
| Участок | kid, мг/(г мин1/2) | c, мг/г | R2 |
|---|---|---|---|
| 2-этилимидазолат никеля | |||
| 1 | 1.618 | 24.76 | 0.97 |
| 2 | 0.276 | 36.75 | 0.99 |
Из вида зависимости следует, что в процессе сорбции можно выделить две последовательные стадии массопереноса ионов меди для всех образцов. Первый линейный участок графика характеризует диффузию Cu(II) из объема раствора через внешний диффузионный слой к поверхности 2-этилимидазолата никеля (внешнедиффузионный массоперенос). Здесь лимитирующей стадией является диффузия через границу у поверхности. В точке излома происходит снижение влияния внешнедиффузионного и увеличение внутридиффузионного фактора. Второй линейный участок относится к диффузии ионов Cu(II) внутрь сорбента (внутридиффузионный массоперенос). Здесь сорбционный процесс лимитируется переносом ионов меди(II) в фазе сорбента.
Сорбционное равновесие в системе 2-этилимидазолат никеля–раствор CuSO4, определенное в кинетическом эксперименте [23], наступает через 120 мин, что соответствует второму участку зависимости. Таким образом, достижение сорбционного равновесия лимитируется переносом металла в фазе сорбента.
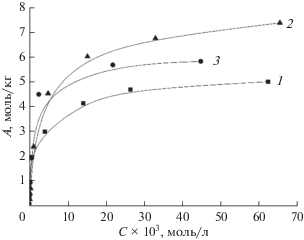
Сорбцию ионов меди(II), кадмия(II) и хрома(III) 2-этилимидазолатом никеля осуществляли в статических условиях в ограниченном объеме раствора при 298 K. Изотермы сорбции получены в интервале концентраций 7 × 10–4–0.07 моль/л (рис. 2).
Экспериментальные значения предельной адсорбции для образца 2-этилимидазолата никеля, полученного в водно-спиртовом растворе в присутствии додецилдиметиламин-N-оксида, по отношению к ионам меди, кадмия и хрома составляют 5.85, 4.8 и 7.34 моль/кг соответственно.
Обработку изотерм адсорбции проводили в линейных координатах изотерм Ленгмюра, Фрейндлиха и Дубинина–Радушкевича. Параметры процессов адсорбции рассчитаны и обобщены в табл. 2. Результаты расчетов величин коэффициентов распределения, констант Генри, изменения энергии Гиббса и максимальной степени заполнения представлены в табл. 3.
Таблица 2.
Константы процесса адсорбции ионов кадмия(II) и хрома(III) в присутствии образца. M – металл, R2 – коэффициент корреляции
| М | А, моль/кг | Ленгмюр | Фрейндлих | Дубинин–Радушкевич | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Am, моль/кг | KL, л/моль | R2 | n | KF, (мг/г)/(л/мг)1/n | R2 | Am, моль/кг | E, кДж/моль | R2 | ||
| Cu | 5.85 | 5.98 | 847.45 | 0.99 | 2.5 | 1.565 | 0.88 | 3.45 | 9.56 | 0.97 |
| Cd | 4.8 | 5.02 | 777.53 | 0.99 | 1.34 | 0.985 | 0.88 | 2.1 | 8.39 | 0.99 |
| Cr | 7.34 | 7.65 | 897.12 | 0.99 | 1.91 | 1.371 | 0.89 | 4.06 | 9.91 | 0.97 |
Таблица 3.
Результаты расчетов величин коэффициентов распределения, констант Генри, изменения энергии Гиббса и максимальной степени заполнения
| М | KD, л/г | Hi, л/кг | $\Delta G_{a}^{0}$, кДж/моль | θ |
|---|---|---|---|---|
| Cu(II) | 1.517 | 5067.75 | –16.71 | 0.98 |
| Cd(II) | 1.175 | 3903.2 | –16.48 | 0.96 |
| Cr(III) | 2.7 | 6862.96 | –16.83 | 0.98 |
Показано, что предельная адсорбция для 2-этилимидазолата никеля по кадмию, полученная из линейных координат изотермы Ленгмюра, составляет 5.02 моль/кг, что значительно меньше, чем при извлечении ионов меди(II) (5.98 моль/кг). Известно, что при равном заряде адсорбирующихся ионов адсорбционная способность увеличивается с ростом их кристаллографического радиуса, так как возрастает их поляризуемость и, как следствие, энергия дисперсионного взаимодействия, т.е. адсорбционная способность. Кристаллографический радиус кадмия равен 0.152 нм, меди – 0.128 нм [24]. Однако в данном случае весомый вклад вносит фактор растворимости соли металла и, следовательно, его доступность в растворе. Максимально возможная концентрация ионов кадмия в водном растворе при температуре 25°С составляет 5.86 моль/л, что в 4 раза больше максимально возможной концентрации ионов меди в растворе (1.4 моль/л). При увеличении растворимости адсорбата показательно снижаются его константы распределения (KD, табл. 3) между адсорбентом и объемной фазой, понижаетcя избирательность адсорбции, что отражается на величинах предельной адсорбции Am.
Значения кристаллографических радиусов хрома и меди близки (0.128 нм) [24]. Однако на адсорбционную способность при извлечении хрома(III) в присутствии 2-этилимидазолата никеля влияют несколько факторов. Известно, что адсорбционная способность иона возрастает с увеличением его заряда, что объясняется значительной энергией кулоновского взаимодействия иона большого радиуса с поверхностью. Наряду с указанным фактором вносит вклад доступность хрома в растворе. Максимально возможная концентрация ионов хрома(III) в растворе составляет 1.28 моль/л, т.е. в данном случае снижение растворимости и, как следствие, рост адсорбционной способности ионов хрома за счет увеличения распределения в гетерофазной системе приводит к увеличению предельной адсорбции 2-этилимидазолата никеля по данному металлу до 7.34 моль/л.
По данным, полученным из линейных координат изотермы Дубинина–Радушкевича, видно, что ионообменная природа адсорбции сохраняется преимущественно для всех тяжелых металлов (E = 8–16 кДж/моль) [18]. Из полученных значений изменения энергии Гиббса следует, что процесс адсорбции ионов тяжелых металлов является термодинамически самопроизвольным. Максимальная степень заполнения поверхности по меди, кадмию и хрому составляет 0.98, 0.96 и 0.98 соответственно.
Морфология 2-этилимидазолата никеля показана на рис. 3. Образец представляет собой микрогетерогенный материал со средним размером частиц 0.4 мкм. Материал является мезопористым, наиболее вероятный радиус пор составляет 7.5 нм, а значение удельной поверхности достигает 703.5 м2/г [23].
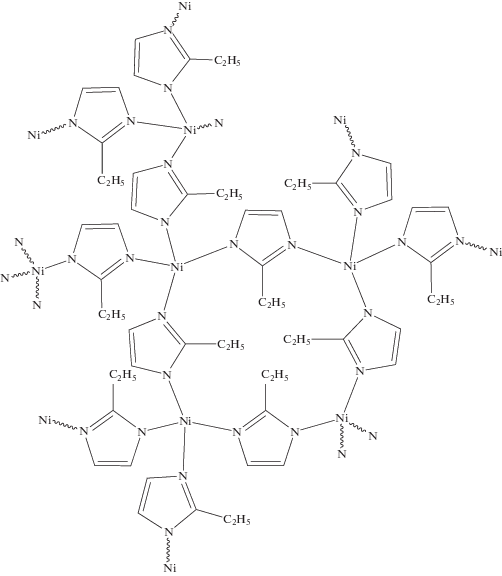
Структурная формула полученного 2-этилимидазолата никеля построена на основе подобных структур, приведенных в Кембриджской кристаллографической базе данных и представлена на рис. 4.
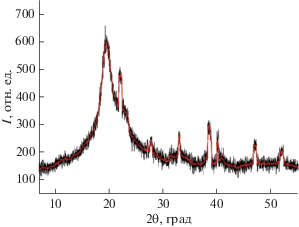
На рис. 5 приведена рентгеновская дифрактограмма образца 2-этилимидазолата никеля. Видно, что на графике присутствуют рефлексы, характерные для кристаллической структуры, что согласуется с известными литературными данными для этого класса соединений [25].
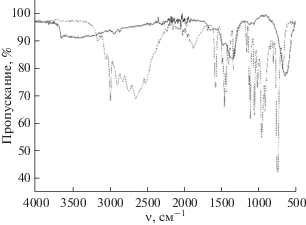
В ИК-спектре 2-этилимидазолата никеля по сравнению со спектром 2-этилимидазола присутствуют уширенные пики, свидетельствующие о комплексообразовании никеля с имидазолом. Так, пики при 1400–1300 см–1 отвечают связи никеля с атомом азота гетероцикла, а при 530–525 см–1 – связи третичного атома азота гетероцикла с никелем (рис. 6).
ЗАКЛЮЧЕНИЕ
Определена эффективность применения мезопористого 2-этилимидазолата никеля, полученного методом прямого смешения, в процессах сорбции ионов тяжелых металлов. На основании координат Вебера–Морриса установлено, что, проходя через стадию снижения влияния внешнедиффузионного фактора, наблюдаемого в начале процесса, и увеличения внутридиффузионного фактора, процесс адсорбции в дальнейшем лимитируется переносом ионов меди(II) в фазу сорбента. Извлечение ионов меди, кадмия и хрома в присутствии образца 2-этилимидазолата никеля лимитируется как предельной растворимостью, так и значениями кристаллографических радиусов элементов. Значения характеристической энергии адсорбции указывают на ионообменную природу процесса сорбции тяжелых металлов. В целом процессы извлечения меди(II), кадмия(II) и хрома(III) являются термодинамически самопроизвольными, а максимальная степень заполнения в ходе адсорбции достигает 0.98.
Список литературы
Gordienko P.S., Shabalin I.A., Yarusova S.B. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 12. P. 1579. https://doi.org/10.1134/s0036023619120052
Алиева А.Ф., Гусейнов Ф.Э., Эфендиева Н.Т. и др. // Изв. вузов. Химия и хим. технология. 2019. Т. 62. № 8. С. 71. https://doi.org/10.6060/ivkkt.20196208.5898
Bezhin N.A., Dovhyi I.I., Lyapunov A.Y. et al. // Russ. J. Inorg. Chem. 2019. V. 64. № 9. P. 117. https://doi.org/10.1134/s0036023619090031
Пугачева И.Н., Карманов А.В., Зуева С.Б. // Изв. вузов. Химия и хим. технология. 2020. Т. 63. № 2. С. 105. https://doi.org/10.6060/ivkkt.20206302.6098
Fufaeva V.A., Nikiforova T.E. // Int. J. Adv. Med. Biomed. Sci. 2020. V. 2. P. 3.
Rasheed T., Ahmad A., Bilal M. et al. // Chemosphere. 2020. V. 259. P. 127369. https://doi.org/10.1016/j.chemosphere.2020.127369
Abdi J., Abedini H. // Chem. Eng. J. 2020. V. 400. P. 125862. https://doi.org/10.1016/j.cej.2020.125862
Shen B., Wang B., Zhu L. et al. // Nanomaterials. 2020. V. 10. P. 1636. https://doi.org/10.3390/nano10091636
Begum J., Hussain Z., Noor T. // Mater. Res. Express. 2020. V. 7. P. 015083. https://doi.org/10.1088/2053-1591/ab6b66
Manousi N., Giannakoudakis D.A., Rosenberg E. et al. // Molecules. 2019. V. 24. P. 4605. https://doi.org/10.3390/molecules24244605
Zhou L., Li N., Owens G. et al. // Chem. Eng. J. 2019. V. 362. P. 628. https://doi.org/10.1016/j.cej.2019.01.068
Wang C., Yang R., Wang H. // Materials. 2020. V. 13. № 1. P. 214. https://doi.org/10.3390/ma13010214
Liu B., Khan A., Kim K. et al. // Crit. Rev. Environ. Sci. Technol. 2019. P. 2441. https://doi.org/10.1080/10643389.2019.1694820
Shahrak N., Ghahramaninezhad M., Eydifarash M. // Environ. Sci. Pollut. Res. 2017. V. 24. № 10. P. 9624. https://doi.org/10.1007/s11356-017-8577-5
Xiao T., Liu D. // Microporous Mesoporous Mater. 2019. V. 283. P. 88. https://doi.org/10.1016/j.micromeso.2019.03.002
Younis S.A., Bhardwaj N., Bhardwaj S.K. et al. // Coord. Chem. Rev. 2020. V. 6. P. 213620. https://doi.org/10.1016/j.ccr.2020.213620
Safaei M., Foroughi M.M., Ebrahimpoor N. et al. // TrAC, Trends Anal. Chem. 2019. V. 118. P. 401. https://doi.org/10.1016/j.trac.2019.06.007
Gao Q., Xu J., Bu X.H. // Coord. Chem. Rev. 2019. V. 378. P. 17. https://doi.org/10.1016/j.ccr.2018.03.015
Siddiqui S.I., Ravi R. // A New Generation Mater. Graphene: Appl. Water Tech. 2019. P. 221. https://doi.org/10.1007/978-3-319-75484-0_9
Pillai P.S., Dharaskar S., Sasikumar S. et al. // Appl. Water Sci. 2019. V. 9. № 7. P. 150. https://doi.org/10.1007/s13201-019-1030-9
Li K., Miwornunyuie N., Chen L. et al. // Sustainability. 2021. V. 13. № 2. P. 984. https://doi.org/10.3390/su13020984
Liu C., Wang P., Liu X. et al. // Chem. Asian J. 2018. P. 261. https://doi.org/10.1002/asia.201801431
Фуфаева В.А., Филиппов Д.В. // Изв. вузов. Химия и хим. технология. 2021. Т. 64. № 5. С. 24. https://doi.org/10.6060/ivkkt.20216405.6354
Бугаенко Л.Т., Рябых С.М., Бугаенко Ф.Л. // Вестник Моск. ун-та. Сер. 2. Химия. 2008. Т. 49. № 6. С. 363.
Zhang Y., Jia Y., Li M. et al. // Sci. Rep. 2018. V. 8. № 1. P. 9597. https://doi.org/10.1038/s41598-018-28015-7
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии