Журнал неорганической химии, 2022, T. 67, № 3, стр. 326-333
Синтез и люминесцентные свойства комплексов магния с фталоцианиновыми лигандами, содержащими феноксильные заместители
А. А. Ботнарь a, *, С. А. Знойко a, Н. П. Домарева a, К. Ю. Казарян a, Т. В. Тихомирова a, О. В. Горнухина a, С. Г. Кошель b, А. С. Вашурин a
a Ивановский государственный химико-технологический университет
153000 Иваново,
Шереметевский пр-т, 7, Россия
b Ярославский государственный технический университет
150023 Ярославль,
Московский пр-т, 88, Россия
* E-mail: ann4botnar@gmail.com
Поступила в редакцию 08.09.2021
После доработки 20.09.2021
Принята к публикации 22.09.2021
- EDN: DOCDGR
- DOI: 10.31857/S0044457X22030047
Аннотация
Путем нуклеофильного замещения нитрогруппы/атомов брома на фрагменты производных фенола получен ряд фталонитрилов с закономерно изменяющимися периферическими феноксильными заместителями. На основе данных фталонитрилов синтезированы комплексные соединения магния с фталоцианиновыми лигандами различной структуры. Для таковых комплексов определена роль природы, местоположения и количества заместителей при рассмотрении спектральных и флуоресцентных параметров в различных растворителях. Показано, что для исследуемых металлофталоцианинов на спектральные характеристики в значительной степени влияет местоположение заместителя, в то время как на значения квантовых выходов флуоресценции – все вышеперечисленные характеристики.
ВВЕДЕНИЕ
Комплексы фталоцианинов с металлами весьма перспективны при создании светочувствительных материалов с высокими скоростями фотоотклика [1–3]. Прежде всего это обусловлено особенностями спектральных и флуоресцентных характеристик, проявляемых соединениями данного класса [4, 5]. Возможность регулирования спектрально-люминесцентными свойствами фталоцианиновых макроциклов достигается путем варьирования структуры периферического и непериферического окружения металлофталоцианинов [6–8], а также природой центрального катиона металла [9, 10]. Кроме того, природа металла в некоторой мере определяет и возможность дополнительной сольватации фталоцианинового макроцикла за счет специфических взаимодействий [11–13], что также дает свой вклад в спектры этих соединений [14]. В связи с этим введение в состав периферического и непериферического окружения фталоцианинового остова заместителей, например, содержащих феноксильные фрагменты, может стать тонким инструментом регулирования фотохимических и фотофизических свойств металлофталоцианинов за счет настройки как структурных, так и сольватационных факторов. В настоящем исследовании авторами предпринята попытка выявить некоторые закономерности между природой макроциклического лиганда для ряда феноксизамещенных фталоцианинатов магния и их спектральными и флуоресцентными характеристиками.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе в качестве растворителей применяли хлороформ, ацетон, диметилформамид, толуол, тетрагидрофуран квалификации “х. ч.” (Экос-1). 3-Нитрофталонитрил (99%), 4-нитрофталонитрил (99%), 4-нитро-5-бромфталонитрил (98%), 2-циклогексилфенол (98%), 4-циклогексилфенол (98%), 4-бензилоксифенол (98%), 4-гидроксибифенил (98%) (Sigma-Aldrich), а также тетрагидрат ацетата магния (х. ч.) и мочевину (фарм.) (Merck) использовали без дополнительной очистки.
Элементный анализ синтезированных соединений осуществляли на элементном анализаторе CHNS-O FlashEA 1112. ИК-спектры регистрировали на приборе Shimadzu IRAffinity-1S с использованием приставки QATR-S однократно нарушенного полного внутреннего отражения в области 400–4000 см–1. ЯМР-спектры в дейтерированном растворителе (CDCl3) были получены с использованием спектрометра AVANCE 500 (Bruker). Масс-спектры регистрировали на времяпролетном масс-спектрометре Shimadzu Axima Confidence MALDI-TOF MS, электронные спектры поглощения (ЭСП) – на спектрофотометре Unico-280 (США) в спектральном диапазоне 300–1000 нм, спектры флуоресценции – на флуориметре Varian Cary Eclipse с применением кварцевых кювет.
Квантовый выход флуоресценции определяли с помощью сравнительного метода, описанного в работе [15], с использованием в качестве стандарта фталоцианината цинка в растворе ДМСО (Φc = 0.2) [16] по формуле:
Время жизни флуоресценции (τфлуор) измеряли на приборе Fluorescence Lifetime Spectrometer FluoTime 300 (Германия). Расчет времени жизни флуоресценции проводили с помощью программного пакета EasyTau.
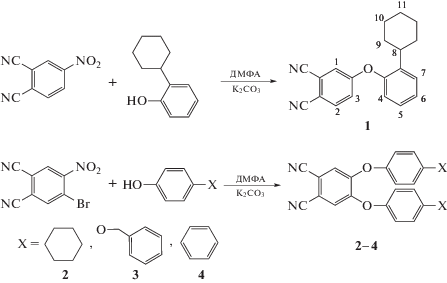
Синтез 4-[2-циклогексилфенокси]фталонитрила (1) проводили при помощи нуклеофильного замещения. Смесь 1.73 г (1 ммоль) 4-нитрофталонитрила и 1.76 г (1 ммоль) 2-циклогексилфенола растворяли в 30 мл ДМФА, затем добавляли 2.07 г (1.5 ммоль) карбоната калия, растворенного в 3 мл воды. Полученную массу нагревали при 90°C и постоянном перемешивании в течение 12 ч. После охлаждения смесь выливали в 300 мл воды, образовавшийся осадок отфильтровывали на фильтре Шотта, промывали 2-пропанолом и водой, высушивали при 60°С. Выход 68% (2.05 г).
ИК-спектр (ν, см–1): 2924; 2851 (CH2); 2232 (C≡N); 1244 (Ar–O–Ar). ЯМР 1H (СDCl3), δ, м.д.: 7.74 (d, J = 8.7 Гц, H3, 1H), 7.43 (dd, J = 7.3, 2.1 Гц, H1, 1H), 7.34–7.19 (m, H5,6,7, 3H), 6.95 (dd, J = 7.5, 1.8 Гц, H4, 1H), 2.66 (t, J = 12.0 Гц, H8, 1H), 1.81–1.75 (m, H9, 4H), 1.44 (q, J = 15.0, 12.4 Гц, H10, 4H), 1.36–1.22 (m, H11, 2H).
Синтез 4,5-ди(циклогексилфенокси)фталонитрила (2) осуществляли по известной методике [17]. Выход 3.33 г (70%).
ИК-спектр (ν, см–1): 2887, 2929 (СН2), 2227 (C≡N), 1222 (Ar–O–Ar). Масс-спектр (MALDI-TOF), m/z (Iотн, %): 476 [M]+.
Синтез 4,5-ди(R-фенокси)фталонитрилов выполняли по методике, аналогичной получению соединения 2. В двугорлую колбу, снабженную обратным холодильником и мешалкой, помещали смесь 1.26 г (0.005 моль) 4-бром-5-нитрофталонитрила, 0.01 моль соответствующего замещенного фенола и 30 мл ДМФА. Затем в колбу вносили раствор 2.07 г (0.015 моль) карбоната калия в 2 мл воды, полученную реакционную массу нагревали при 80°С и перемешивали при этой температуре в течение 12 ч. По окончании нагревания реакционную массу выливали в воду, образовавшийся осадок отфильтровывали на фильтре Шотта и промывали 2-пропанолом, а затем водой.
4,5-Ди(4-бензилоксифенокси)фталонитрил (3) получали по общей методике из 2.00 г 4-бензилоксифенола. Выход составил 2.73 г (52%).
ИК-спектр (ν, см–1): 2878, 2918 (СН2), 2232 (C≡N), 1217 (Ar–O–Ar). Масс-спектр (MALDI-TOF), m/z = = 524 [M]+.
4,5-Ди(4-фенилфенокси)фталонитрил (4) получали по общей методике, используя 1.70 г 4-гидроксибифенила. Выход 3.62 г (78%).
ИК-спектр (ν, см–1): 2234 (C≡N), 1218 (Ar–O–Ar). Масс-спектр (MALDI-TOF), m/z (Iотн, %): 465 [M + H]+ (100).
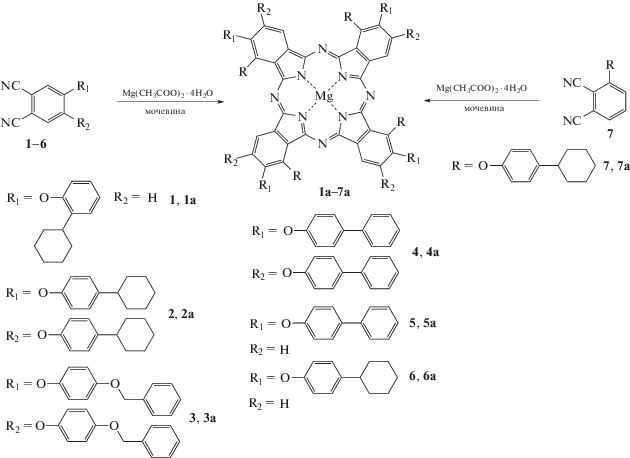
Синтез комплексов магния с замещенными фталоцианинами осуществляли по стандартной методике темплатной конденсации. Тщательно растертую смесь 1 ммоль соответствующего нитрила (1–7), 3 ммоль мочевины и 0.3 ммоль тетрагидрата ацетата магния нагревали при температуре 180–190°С до затвердевания реакционной массы. После охлаждения реакционную массу измельчали, экстрагировали целевой продукт хлороформом, дальнейшую очистку проводили хроматографией на силикагеле М 60, элюируя хлороформом.
Тетра-4-[2-циклогексилфенокси]фталоцианинат магния (1a). Выход 0.18 г (60%). ИК-спектр (ν, см–1): 2924, 2852 (CH2); 1241 (Ar–O–Ar). Масс-спектр, m/z (Iотн, %): 1232 (100) [M + 2H]+.
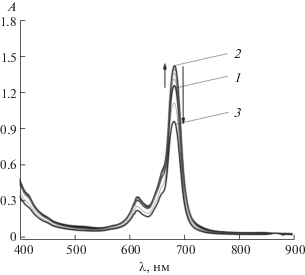
Рис. 2.
Изменения ЭСП раствора 1а в хлороформе при добавлении пиридина: 1 – исходный спектр; 2 – спиридин = 0.72 моль/л; 3 – конечный спектр.
Окта-4,5-(4-циклогексилфенокси)фталоцианинат магния (2а). Выход 0.36 г (78%). ИК-спектр (ν, см–1): 2924, 2859 (СН2); 1223 (Ar–O–Ar). Масс-спектр, m/z = 1928 [M]+.
Окта-4,5-(4-бензилоксифенокси)фталоцианинат магния (3а). Выход 0.30 г (68%). ИК-спектр (ν, см–1): 2912, 2833 (СН2); 1226 (Ar–O–Ar). Масс-спектр, m/z = 2162 [M–Н]+.
Окта-4,5-(4-фенилфенокси)фталоцианинат магния (4а). Выход 0.18 г (39%). ИК-спектр (ν, см–1): 1223 (Ar–O–Ar). Масс-спектр, m/z = 1881 [M + Н]+.
Тетра-4-(4-фенилфенокси)фталоцианинат магния (5а) [18]. Выход 0.82 г (68%). ИК-спектр (ν, см–1): 1239 (Ar–O–Ar). Масс-спектр, m/z = = 1209.49 [M]+; М вычислено 1209.61.
Тетра-4-[4-циклогексилфенокси]фталоцианинат магния (6a) [19]. Выход 0.16 г (52%). ИК-спектр (ν, см–1): 2918, 2853 (CH2); 1230 (Ar–O–Ar). Масс-спектр, m/z = 1236 (100) [M + 4H]+.
Тетра-3-[4-циклогексилфенокси]фталоцианинат магния (7a) [19]. Выход 0.14 г (45%). ИК-спектр (ν, см–1): 2920, 2850 (CH2); 1244 (Ar–O–Ar). Масс-спектр, m/z = 1235 (100) [M+3H]+.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно [20, 21], что наиболее простым и эффективным методом получения металлокомплексов фталоцианинов является “нитрильный”, который заключается в темплатной конденсации соответствующих фталонитрилов с солями металлов. Данный способ получения металлокомплексов универсален и позволяет получать целевой продукт с высокой степенью чистоты и с хорошим выходом. В связи с этим синтез магниевых комплексов R-феноксизамещенных фталоцианинов проводили сплавлением ацетата магния в присутствии мочевины с соответствующими замещенными фталонитрилами (1–7), которые получали нуклеофильным замещением нитрогруппы/атома брома в 4-нитрофталонитриле или 4-нитро-5-бромфталонитриле (схема 1 ).
Схема 1 . Получение феноксизамещенных фталонитрилов.
Темплатную конденсацию проводили при температуре 180–190°С до затвердения реакционной массы (схема 2 ). Из литературы [22] известно, что комплексы магния с фталоцианитами лабильны и могут деметаллироваться сильными кислотами до свободных лигандов. В связи с этим выделение и очистку полученных комплексов проводили с помощью экстракции хлороформом и последующей колоночной хроматографии на силикагеле. Важно отметить, что хлороформ предварительно стабилизировали, пропуская через окись алюминия, чтобы исключить присутствие соляной кислоты.
Схема 2 . Получение феноксизамещенных фталоцианинатов магния.
Известно [20, 23], что тетразамещенные фталоцианины образуются в виде смеси четырех изомеров положения – рандомеров с симметрией D2h, C4h, C2v и Cs. Фталоцианины, содержащие заместители в положении 3, всегда присутствуют в ожидаемой статистической смеси изомеров 12.5% C4h, 25% C2v, 50% Cs и 12.5% D2h. Для 4-замещенных комплексов состав смеси зависит от центрального иона металла и структуры периферических заместителей. Разделить полученные изомеры трудно, а иногда и невозможно. Поэтому разделение полученных рандомеров не проводили.
В ИК-спектрах синтезированных фталоцианинов 1а–7а зафиксированы полосы поглощения, характерные для соединений фталоцианинового ряда [24], а также полоса поглощения, характерная для арилоксигруппы, при 1223–1241 см–1, отмеченная в исходных спектрах фталонитрилах 1–7 [25]. Кроме того, для комплексов 1а, 2а, 6а и 7а, содержащих на периферии циклогексильные группы, и для соединения 3а отмечены интенсивные полосы поглощения при 2920–2833 см–1, соответствующие валентным колебаниям связи –СН2–. В масс-спектрах комплексов регистрируются интенсивные сигналы, соответствующие целевым молекулярным ионам. Например, для окта-4,5-(4-циклогексилфенокси)фталоцианината магния (2а) зафиксирован единичный сигнал при 1928 Да, который отвечает целевому молекулярному иону [M]+.
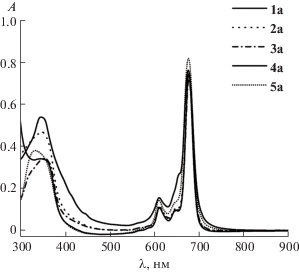
Наличие растворимости у синтезированных фталоцианинатов 1а–7а в органических растворителях позволило изучить их спектральные характеристики. Характер электронных спектров поглощения исследуемых макроциклов демонстрирует наличие узкой и интенсивной Q-полосы, что свидетельствует о нахождении комплексов в мономерном состоянии (рис. 1). Проведено сравнение влияния природы, количества и местоположения заместителей на максимумы поглощения в различных растворителях. Показано, что для периферически замещенных металлокомплексов 1а–6а значение максимума поглощения в таких растворителях, как толуол, ацетон, тетрагидрофуран (ТГФ), ДМФА, хлороформ, практически не изменяется и находится в пределах 1–3 нм (табл. 1). Таким образом, можно сделать вывод о том, что за счет значительного удаления терминальных фрагментов от π-электронной системы фталоцианинового макроцикла они практически не оказывают влияния на положение Q-полосы в ЭСП в исследуемых растворителях. Для непериферически замещенного комплекса 7а наблюдается значительный батохромный сдвиг максимума (~15 нм), что вызвано уменьшением энергетической щели между граничными молекулярными орбиталями. Батохромное смещение максимума в спектрах синтезированных соединений наблюдается в ряду ацетон ≈ ТГФ ≈ ДМФА < толуол < хлороформ (табл. 1).
Таблица 1.
Спектральные характеристики замещенных фталоцианинатов магния в различных растворителях
| Макроцикл | Толуол | Ацетон | ТГФ | ДМФА |
|---|---|---|---|---|
| 1а | 615, 679 | 610, 676 | 613, 676 | 615, 676 |
| 2а | 615, 681 | 610, 676 | 613, 678 | 614, 679 |
| 3а | 615, 682 | 611, 677 | 613, 678 | 614, 679 |
| 4а | 615, 681 | 610, 676 | 612, 678 | 614, 678 |
| 5а | 615, 681 | 610, 676 | 612, 677 | 614, 678 |
| 6а [19] | 613, 681 | 609, 677 | 611, 678 | 611, 679 |
| 7а [19] | 637, 699, 743 | 621, 690 | 625, 694 | 625, 695 |
В электронных спектрах поглощения соединения 1а в вышеперечисленных растворителях по сравнению с рассматриваемым рядом макроциклов имеется незначительное отличие – присутствует уширенное плечо в области 655 нм (рис. 1). Проведено титрование пиридином раствора тетра-4-[2-циклогексилфенокси]фталоцианината магния в хлороформе для исключения агрегационных процессов, так как азотсодержащий малый органический лиганд может встраиваться между двумя фталоцианиновыми лигандами, приводя к мономеризации макроциклов. С увеличением концентрации пиридина в растворе вид электронного спектра поглощения не изменяется (рис. 2). В спектрах поглощения наблюдается увеличение Q-полосы до концентрации пиридина 0.72 моль/л, что, очевидно, связано с сольватационными особенностями пиридина по отношению к данному макроциклу, дальнейшее увеличение концентрации приводит к уменьшению интенсивности поглощения вследствие разбавления раствора. Вероятно, наличие уширенного плеча связано со стерическими затруднениями, которые испытывает терминальный циклогексильный фрагмент, находящийся в орто-положении феноксигруппы, что может привести к снижению симметрии макроцикла.
Одним из требований, предъявляемых к “идеальному” фотосенсибилизатору, является наличие высоких квантовых выходов флуоресценции, так как это обеспечит не только реализацию фотодинамического эффекта, который оценивается по значениям квантового выхода синглетного кислорода, но и одновременное проведение флуоресцентной диагностики. Исследуемый ряд металлофталоцианинов имеет довольно разнообразные заместители: с терминальными циклогексильными и фенильными фрагментами; окта- и тетразамещенные, последние из которых представлены как периферически и непериферически замещенные, циклогексильный фрагмент находится как в пара-, так и в орто-положении феноксифрагмента. Для соединений 1а–5а были зарегистрированы спектры поглощения и возбуждения, общая спектральная картина которых подобна и имеет практически одинаковые значения максимума (табл. 2), т.е. можно сделать вывод, что конфигурация макромолекул в процессе возбуждения не изменяется. В отличие от спектральных, флуоресцентные параметры в растворе хлороформа, а именно квантовые выходы флуоресценции, достаточно чувствительны к изменениям вводимых в аннелированные бензольные кольца заместителей. Установлено, что наибольший квантовый выход флуоресценции имеют октазамещенные макроциклы, а именно соединения 2а и 3а. Уменьшение этого значения для фталоцианина 4а, вероятно, связано со способностью терминального фенильного фрагмента к вращению, на которое затрачивается дополнительная энергия молекулы. Аналогичное снижение квантового выхода флуоресценции отмечается для тетразамещенных аналогов 5а и 6а. В ряду 1а–7а–6а прослеживается влияние стерического эффекта на интенсивность флуоресценции. Установлено, что наибольшей флуоресцентной способностью обладают менее стерически затрудненные металлофталоцианины, а именно 6а и 7а.
Таблица 2.
Флуоресцентные характеристики замещенных фталоцианинатов магния
| Макроцикл | λпогл | λвозб | λфлуор | Стоксов сдвиг | Φфлуор | τфлуор, нс | χ2 |
|---|---|---|---|---|---|---|---|
| нм | |||||||
| 1а | 684 | 683 | 694 | 10 | 0.20 | 4.53 | 1.21 |
| 2а | 685 | 685 | 695 | 10 | 0.43 | 5.07 | 1.12 |
| 3а | 685 | 685 | 695 | 10 | 0.41 | 5.36 | 1.11 |
| 4а | 684 | 684 | 691 | 7 | 0.31 | 5.27 | 1.03 |
| 5а | 683 | 683 | 694 | 11 | 0.34 | 5.60 | 1.05 |
| 6а [19] | 684 | 686 | 695 | 11 | 0.36 | 5.84 | 1.04 |
| 7а [19] | 704 | 704 | 716 | 12 | 0.33 | 5.50 | 1.03 |
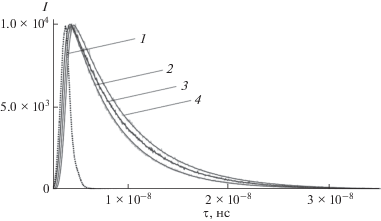
Для полученных соединений затухание флуоресценции определяли методом счета одиночных фотонов с корреляцией по времени (Time Correlated Single Photon Counting). Кривая затухания для всех соединений была описана моноэкспоненциальной функцией. В среднем время жизни флуоресценции составляло 5.5 нс.
ЗАКЛЮЧЕНИЕ
Нуклеофильным замещением нитрогруппы/атома брома в 4-нитрофталонитриле или 4-нитро-5-бромфталонитриле на производные фенола получены замещенные R-феноксифталонитрилы с закономерно изменяющимися заместителями. Темплатной конденсацией последних с ацетатом магния образованы соответствующие замещенные фталоцианинаты магния. Спектральные характеристики исследованы в широком ряду растворителей (толуол, ацетон, тетрагидрофуран, ДМФА, хлороформ). Показано, что положение максимума в электронных спектрах поглощения для периферически замещенных макрогетероциклов (1а–6а) практически не изменяется и находится в пределах 1–3 нм. При переходе от периферически к непериферически замещенному фталоцианину (7а) наблюдается значительный батохромный сдвиг максимума. Для всех исследуемых фталоцианинатов магния в ряду ацетон ≈ ТГФ ≈ ДМФА < толуол < хлороформ регистрируется батохромное смещение Q-полосы. Наибольшими квантовыми выходами флуоресценции обладают октазамещенные макроциклы, у которых терминальный фрагмент не способен к вращению (2а, 3а).
Список литературы
Gounden D., Nombona N., van Zyl W.E. // Coord. Chem. Rev. 2020. V. 420. P. 213359. https://doi.org/10.1016/j.ccr.2020.213359
Pereira G.F., Tasso T.T. // Inorg. Chim. Acta. 2021. V. 519. P. 120271. https://doi.org/10.1016/j.ica.2021.120271
Wong R.C.H., Lo P.C., Ng D.K.P. // Coord. Chem. Rev. 2019. V. 379. P. 30. https://doi.org/10.1016/j.ccr.2017.10.006
Urbani M., Ragoussi M.E., Nazeeruddin M.K. et al. // Coord. Chem. Rev. 2019. V. 381. P. 1. https://doi.org/10.1016/j.ccr.2018.10.007
Nyokong T., Antunes E. // Coord. Chem. Rev. 2013. V. 257. № 15–16. P. 2401. https://doi.org/10.1016/j.ccr.2013.03.016
Vashurin A., Maizlish V., Kuzmin I. et al. // J. Porphyrins Phthalocyanines. 2017. V. 21. № 1. P. 37. https://doi.org/10.1142/S108842461750002X
Ekineker G., Göksel M. // Tetrahedron. Pergamon. 2020. V. 76. № 5. P. 130878. https://doi.org/10.1016/j.tet.2019.130878
Ramachandran R., Hu Q., Rajavel K. et al. // J. Power Sources. 2020. V. 471. P. 228472. https://doi.org/10.1016/j.jpowsour.2020.228472
Gradova M.A. Ostashevskaya I., Gradov O. et al. // Macroheterocycles. 2018. V. 11. № 4. P. 404. https://doi.org/10.6060/mhc181001g
Erzunov D., Vashurin A., Koifman O. // Russ. Chem. Bull. 2018. V. 67. P. 2250. https://doi.org/10.1007/s11172-018-2364-4
Voronina A., Filippova A., Znoiko S. et al. // Russ. J. Inorg. Chem. 2015. V. 60. № 11. P. 1407. https://doi.org/10.1134/S0036023615110236
Lebedeva N., Kumeev R., Alper G. et al. // J. Solut. Chem. 2007. V. 36. № 6. P. 793. https://doi.org/10.1007/s10953-007-9148-z
Vashurin A., Badaukaite R., Futerman N. et al. // Pet. Chem. 2013. V. 53. № 3. P. 197. https://doi.org/10.1134/S0965544113030122
Rio Y., Rodríguez-Morgade M.S., Torres T. // Org. Biomol. Chem. 2008. V. 6. № 11. P. 1877. https://doi.org/10.1039/b800617b
Fery-Forgues S., Lavabre D. // J. Chem. Educ. 1999. V. 76. № 9. P. 1260. https://doi.org/10.1021/ed076p1260
Ogunsipe A., Maree D., Nyokong T. // J. Mol. Struct. 2003. V. 650. № 1–3. P. 131. https://doi.org/10.1016/S0022-2860(03)00155-8
Znoiko S., Tolstykh N., Mikhailova A. et al. // Russ. J. Gen. Chem. 2020. V. 90. № 12. P. 2289. https://doi.org/10.1134/S1070363220120117
Tikhomirova T., Peledina A., Maizlish V. et al. // Russ. J. Gen. Chem. 2018. V. 88. № 4. P. 742. https://doi.org/10.1134/S1070363218040199
Botnar A., Tikhomirova T., Kazaryan K. et al. // J. Mol. Struct. 2021. V. 1238. P. 130438. https://doi.org/10.1016/j.molstruc.2021.130438
Kadish K., Smith K., Guilard R. The porphyrin handbook. N.Y.: Academic Press, 2000. 284 p.
Шапошников Г., Кулинич В., Майзлиш В.М. Модифицированные фталоцианины и их структурные аналоги. М.: Красанд, 2012. 480 с.
Березин Б.Д. Координационные соединения порфиринов и фталоцианина. М.: Наука, 1976. 280 с.
Rager C., Schmid G., Hanack M. // Chem. A Eur. J. 1999. V. 5. № 1. P. 280.
Robinson J.W. Practical Handbook of Spectroscopy. Boca Raton: Routledge, 2017. 944 p.
Дайер Д.Р. Приложения адсорбционной спектроскопии органических соединений / Пер. с англ. Ивановой В. М.: Химия, 1970. 163 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии