Журнал неорганической химии, 2022, T. 67, № 10, стр. 1398-1410
Комплексы меди(II) с 5-нитро-2-фуранкарбоновой кислотой: синтез, строение, термические свойства и биологическая активность
К. А. Кошенскова a, И. А. Луценко a, *, Ю. В. Нелюбина b, П. В. Примаков b, Т. М. Алиев b, О. Б. Беккер c, А. В. Хорошилов a, С. Н. Мантров d, М. А. Кискин a, И. Л. Еременко a
a Институт общей и неорганической химии им. Н.С. Курнакова PAH
119991 Москва, Ленинский пр-т, 31, Россия
b Институт элементоорганических соединений им. А.Н. Несмеянова PAH
119334 Москва, ул. Вавилова, 28, Россия
c Институт общей генетики им. Н.И. Вавилова PAH
117971 Москва, ул. Губкина, 3, Россия
d Российский химико-технологический университет им. Д.И. Менделеева
125047 Москва, Миусская пл., 9, Россия
* E-mail: irinalu05@rambler.ru
Поступила в редакцию 07.03.2022
После доработки 25.04.2022
Принята к публикации 05.05.2022
- EDN: HLSRYE
- DOI: 10.31857/S0044457X22700106
Аннотация
Взаимодействием ацетата меди(II) с 5-нитро-2-фуранкарбоновой кислотой (NO2-Hfur), а также N-донорными лигандами 2,2'-бипиридином (bpy) и пиридином (py) получены моно-[Cu(NO2-fur)2(H2O)2] · 2H2O (I), [Cu(NO2-fur)2(py)2(H2O)] (II) и биядерный [Cu2(NO2-fur)4(bpy)2] · H2O (III) комплексы, структура которых расшифрована методом РСА. Катион Cu2+ находится в плоскоквадратном (I) или квадратно-пирамидальном (II, III) окружении, реализуя КЧ(Cu) = 4 (I) или 5 (II, III) соответственно. Стабильность комплексов I–III в твердой фазе определена методом синхронного термического анализа, а в растворе – с помощью электронных спектров поглощения. Термически стабильными (>100°С) являются соединения I и II. Наличие в составе исследуемых комплексов нитрогруппы обусловливает мощные экзотермические эффекты, интенсивность которых нивелируется донорными лигандами. Хранение растворов соединений в 5%-ном растворе глюкозы и 0.9%-ном NaCl в течение 2 сут, по данным УФ-спектроскопии, не вызывает их деградации. Биологическая активность комплексов I–III изучена in vitro в отношении непатогенного штамма M. smegmatis (является модельным для M. tuberculosis); для II проведены исследования на противомикробную активность против ряда Г(+) и Г(–) бактерий.
ВВЕДЕНИЕ
Туберкулез – одно из опасных заболеваний человечества (по данным ВОЗ), ежегодно уносящее жизни десятки тысяч людей [1]. Со времени открытия Р. Кохом (1882 г.) возбудителя туберкулеза – микобактерии туберкулеза (МБТ; палочка Коха) прошло более 130 лет, однако однозначно победить эту инфекцию медикам, биологам и биохимикам до сих пор не удается. Проблема заключается в быстрой выработке микобактериями различных видов резистентности, которые на сегодняшний день насчитывают более десятка: лекарственная и множественная лекарственная устойчивость, вич-ассоциированные разновидности туберкулеза, латентные, дормантные и др. виды, в том числе и мультирезистентные, которые обусловливают глобальные трудности для терапии данного заболевания. Cоздание препаратов для химиотерапии туберкулеза является одной из фундаментальных составляющих современной медицины. Очевидно, что на первый план выходит проблема поиска веществ с новыми механизмами действия. Возможно, одним из путей решения могут стать координационные соединения с эссенциальными (жизненно необходимыми) металлами (Cu, Zn, Co, Fe, Mg и др.). Несмотря на то, что металлсодержащие препараты достаточно широко используются в медицине (лечение различных видов анемии – препараты железа и кобальта; противопаразитарные, противомикробные и антисептические – соединения цинка, серебра, ртути; противораковые – комплексы платины и т.д. [2–6]), на сегодняшний день нет противотуберкулезных лекарственных средств на основе координационных соединений. По-видимому, создание таких препаратов сдерживается недостаточным пониманием роли ионов металлов в физиологии и гомеостазе микобактерий. Тем не менее исследования в этом направлении проводятся. Так, авторы [7] продемонстрировали на препарате Элескломол (эффективен против МБТ H37Rv с минимальной ингибирующей концентрацией (МИК) 4 мг/л) повышение эффективности более чем в 65 раз при комплексообразовании с медью(II). Ранее [8–14] нами получены комплексы Cu(II), Zn(II), Co(II), Fe(III), Ni(II) с 2-фуранкарбоновой кислотой (2Hfur), а также с различными N-донорными лигандами и установлена активность in vitro против непатогенного микобактериального штамма Mycolicibacterium smegmatis, в частности, определены катионы, к которым наиболее чувствительна микобактерия, а также солиганды, способные усиливать/подавлять биологическую эффективность. В представленной работе 2-фуранкарбоновая кислота была заменена на 5-нитро-2-фуранкарбоновую (5NO2-Hfur), являющуюся родоначальником группы противомикробных препаратов (фуразолидон, энтерофурил, хинифурил и др.) с целью повышения биологической активности. Заметим, что в литературе присутствуют данные о том, что анион ${\text{NO}}_{2}^{ - },$ входя в состав соединений, способен повышать биоэффективность [15]. Взаимодействием ацетата меди(II) с NO2-Hfur, а также с N-донорными лигандами 2,2′-бипиридином (bpy) и пиридином (py) получены моно-[Cu(NO2-fur)2(H2O)2] · 2H2O (I), [Cu(NO2-fur)2(py)2(H2O)] (II) и биядерный [Cu2(NO2-fur)4(bpy)2] · H2O (III) комплексы, структура которых расшифрована с помощью РСА. Стабильность комплексов I–III определена методом синхронного термического анализа (СТА), а в растворе – с помощью электронных спектров поглощения (ЭСП). Биологическая активность полученных соединений изучена in vitro в отношении непатогенного штамма M. smegmatis (является модельным для M. tuberculosis); для II против ряда бактерий: стафилококков, стрептококков и др.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез новых соединений проводили на воздухе с использованием дистиллированной воды и растворителей: ацетонитрила (ос. ч., Химмед), этанола (х. ч., Химмед), метанола (х. ч., Химмед), хлороформа (х. ч., Химмед), 0.9% NaCl (Солофарм), 5%-ного раствора глюкозы (Солофарм). Для синтеза использовали коммерчески доступные реактивы: медь(II) ацетат моногидрат (95%, Acros), 5-нитро-2-фуранкарбоновую кислоту (98%, Sigma Aldrich), 2,2′-бипиридин (х. ч., Химмед), пиридин (ч., Химмед).
Элементный анализ выполняли на автоматическом С,H,N-анализаторе Carlo Erba EA 1108. ИК-спектры соединений регистрировали на ИК-спектрофотометре с фурье-преобразованием Perkin–Elmer Spectrum 65 методом нарушенного полного внутреннего отражения (НПВО) в интервале частот 400–4000 см–1.
Синтез [Cu(NO2-fur)2(H2O)2] · 2H2O (I). Навески Сu(OAc)2 · H2O (0.100 г, 0.5 ммоль) и 5NO2-Hfur (0.157 г, 1 ммоль) растворяли в смеси MeCN : : EtOH : H2O (3 : 1 : 1) и выдерживали при нагревании (70°С) до полного растворения суспензии (180 мин). Полученный голубой раствор отфильтровывали и оставляли при комнатной температуре для медленного испарения растворителей. Через 3 сут образовывались кристаллы бирюзового цвета, которые отделяли от маточного раствора декантацией и сушили на воздухе. Выход I 0.21 г. (94%).
ИК-спектр (НПВО; ν, см–1): 3665 уш. сл, 3588 ср, 3220 уш. ср, 3160 уш. ср, 2983 уш. ср, 2903 уш. ср, 1793 о. сл, 1606 ср, 1580 ср, 1526 с, 1404 ср, 1321 о. с, 1247 ср, 1157 ср, 1071 уш. ср, 1018 с, 956 ср, 904 уш. ср, 805 с, 779 с, 734 с, 628 с, 564 уш. с, 467 о. с, 411 о. с.
Синтез [Cu(NO2-fur)2(py)2(H2O)] (II). Навески Сu(OAc)2 · H2O (0.100 г, 0.5 ммоль) и 5NO2-Hfur (0.157 г, 1 ммоль) растворяли в смеси MeCN : : MeOH : CHCl3 (4 : 1 : 2). К полученной суспензии добавляли py (0.15 мл, 2 ммоль) и выдерживали реакционную смесь при 70°С в течение 180 мин. Полученный синий раствор отфильтровывали в шленк и концентрировали до 20 мл. Через сутки образовывались игольчатые кристаллы синего цвета, которые отделяли от маточного раствора декантацией и сушили на воздухе. Выход II 0.24 г. (87%).
ИК-спектр (ν, см–1): 3670 уш. сл, 3367 уш. сл, 3169 сл, 2980 уш, ср, 2901 уш. сл, 1927 о. сл, 1844 о. сл, 1626 с, 1580 ср, 1529 с, 1490 ср, 1446 ср, 1401 ср, 1333 о. с, 1236 ср, 1216 ср, 1151 ср, 1069 ср, 1015 ср, 970 ср, 948 ср, 916 сл, 844 ср, 788 с, 754 ср, 691 с, 640 ср, 609 с, 563 уш. ср, 524 ср, 483 ср, 432 с.
Синтез [Cu2(NO2-fur)4(bpy)2] · H2O (III). Навески Сu(OAc)2 · H2O (0.100 г, 0.5 ммоль), 5NO2-Hfur (0.157 г, 1 ммоль) растворяли в смеси MeCN : : MeOH : CHCl3 (4 : 1 : 2). К полученной суспензии добавляли bpy (78 мг, 0.5 ммоль) и выдерживали реакционную смесь при 70°С в течение 180 мин. Полученный синий раствор отфильтровывали в шленк и концентрировали до 20 мл. Через сутки образовывались кристаллы синего цвета, которые отделяли от маточного раствора декантацией и сушили на воздухе. Выход III 0.2 г. (75%).
ИК-спектр (ν, см–1): 3156 сл, 3115 сл, 3066 сл, 3040 сл, 2962 сл, 2867 уш. сл, 2148 о. сл, 1955 о. сл, 1602 о.с, 1569 с, 1524 с, 1512 с, 1478 с, 1453 ср, 1407 ср, 1394 сл, 1359 с, 1320 о. с, 1303 о. с, 1245 с, 1236 с, 1200 ср, 1184 ср, 1165 ср, 1152 ср, 1141 ср, 1111 сл, 1066 сл, 1034 ср, 1020 с, 1014 с, 979 сл, 966 ср, 944 ср, 916 сл, 900 сл, 856 сл, 835 сл, 823 ср, 810 с, 791 с, 778 о. с, 737 с, 730 с, 663 ср, 651 ср, 641 ср, 629 ср, 609 ср, 571 ср, 530 сл, 519 сл, 496 с, 476 ср, 458 сл, 443 сл, 432 сл, 417 с, 402 сл.
Рентгеноструктурное исследование (РСА) комплексов I–III проводили при 120 K на дифрактометре Bruker ApexII DUO (CCD-детектор, MoKα, λ = 0.71073 Å, графитовый монохроматор). Структуры расшифрованы с использованием программы ShelXT [16] и уточнены в полноматричном МНК с помощью программы Olex2 [17] в анизотропном приближении для неводородных атомов. Атомы водорода молекул воды в I и II локализованы из разностных синтезов Фурье, положения остальных атомов водорода рассчитаны геометрически, и все они уточнены в изотропном приближении в модели “наездника”. Кристаллографические параметры и детали уточнения комплексов I–III приведены в табл. 1. Координаты атомов и другие параметры депонированы в Кембриджском банке структурных данных (№ 2149568-2149570; deposit@ccdc.cam.ac.uk или http://www.ccdc.cam.ac.uk/data_request/cif).
Таблица 1.
Кристаллографические параметры и детали уточнения соединений I–III
| Параметр | I | II | III |
|---|---|---|---|
| Брутто-формула | C10H12CuN2O14 | C20H16CuN4O11 | C40H26Cu2N8O21 |
| M | 447.76 | 551.916 | 1081.785 |
| Сингония | Моноклинная | Моноклинная | Триклинная |
| Пр. гр. | P21/n | С2 | P1 |
| a, Å | 5.78370(10) | 18.1115(8) | 8.5249(5) |
| b, Å | 5.24960(10) | 5.9467(2) | 10.4071(6) |
| c, Å | 25.5565(6) | 11.4784(5) | 13.1871(8) |
| α, град | 90 | 90 | 73.272(3) |
| β, град | 94.8740(10) | 119.459(3) | 86.343(3) |
| γ, град | 90 | 90 | 70.961(3) |
| V, Å3 | 773.14(3) | 1076.43(8) | 1058.56(11) |
| Z | 2 | 2 | 1 |
| ρвыч, г/см3 | 1.923 | 1.703 | 1.697 |
| μ, мм–1 | 15.00 | 10.88 | 11.03 |
| F(000) | 454 | 563 | 549 |
| Область сбора данных по θ, град | 60 | 52 | 52 |
| Число измеренных отражений | 10 813 | 8142 | 15 529 |
| Число независимых отражений | 2354 | 2119 | 4136 |
| Число отражений с I > 2σ(I) | 2142 | 1923 | 3709 |
| Rint | 0.0308 | 0.0695 | 0.0540 |
| Переменных уточнения | 124 | 165 | 0.0271 |
| GООF | 1.084 | 0.9849 | 1.0712 |
| R-факторы по F2 > 2σ(F2) | 0.0221, 0.0556 | 0.0379, 0.0558 | 0.0309, 0.0770 |
| R-факторы по всем отражениям | 0.0253, 0.0570 | 0.0452, 0.0581 | 0.0353, 0.0795 |
| Остаточная электронная плотность (min/max), e/Å3 | –0.398/0.493 | –0.3353/0.2937 | –0.4750/0.0525 |
Термическое поведение соединений I–III изучали методом СТА в атмосфере аргона с одновременной регистрацией кривых термогравиметрии (ТГ) и дифференциальной сканирующей калориметрии (ДСК). Исследование проводили на приборе CTA 449 F1 Jupiter (фирмы NETZSCH) в алюминиевых тиглях под крышкой с отверстием, обеспечивающим давление паров при термическом разложении образцов в 1 атм. Скорость нагрева составляла 10 град/мин до 500°С. Масса навесок: 5.25 (I), 0.65 (II), 2.15 мг (III). Точность измерения температуры ±0.7°С, изменения массы ±1 × 10−2 мг. При съемке кривых ТГ и ДСК использовали файл коррекции, а также калибровки по температуре и чувствительности для заданной температурной программы и скорости нагрева. После проведения термического анализа химический состав и микроморфологию остаточного вещества III анализировали с помощью растрового электронного микроскопа Carl Zeiss NVision 40, оснащенного рентгеноспектральным детектором Oxford X-Max (80 мм2). Увеличение составило ×30 000. Количественные данные и данные картирования элементов были получены при ускоряющем напряжении 20 кВ.
Электронные спектры поглощения I–III регистрировали на спектрофотометре Shimadzu UV-2600i. В качестве растворителей использовали коммерчески доступные готовые 0.9%-ный раствор NaCl и 5%-ый раствор глюкозы (Солофарм). Все УФ-видимые спектры регистрировали в диапазоне 220–600 нм. Устойчивость растворов изучали путем измерения оптической плотности исследуемых растворов комплексов (50 мМ) каждые 6 ч в течение 48 ч при комнатной температуре.
Биологическую активность соединений I–III определяли в тест-системе M. smegmatis mc2155 методом бумажных дисков. Фиксировали величину зоны подавления роста штамма, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих вещество в различных концентрациях. Бактерии, смытые с чашек Петри со средой Триптон–соевый агар М-290 (Himedia), выращивали в течение ночи в жидкой среде Lemco-TW (Lab Lemco’ Powder 5 г/л (Oxoid), Peptone special 5 г/л (Oxoid), NaCl 5 г/л, Tween-80) при +37°С до среднелогарифмической фазы роста при оптической плотности OD600 = 1.5 смешивали с расплавленной агаризованной средой М-290 в соотношении 1 : 9 : 10 (культура : Lemco-TW : М-290). Культуру инкубировали в течение 24 ч при +37°С. Минимальной ингибирующей концентрацией (MИК) считали концентрацию вещества, при которой зона подавления роста минимальна. Тест-система M. smegmatis проявляет более высокую степень устойчивости к антибиотикам и противотуберкулезным агентам, чем M. tuberculosis, поэтому критерием отбора является концентрация вещества <100 µг/диск. Метод испытания включает количественную оценку диаметра зоны подавления роста культуры M. smegmatis, выращенной газоном на агаризованной среде, вокруг бумажных дисков, пропитанных испытуемыми соединениями. Исследуемое соединение наносили на диски в разных концентрациях и регистрировали диаметр halo (зона ингибирования роста). Активность соединений определяли относительно препаратов первого ряда лечения туберкулеза – изониазида (INH) и рифампицина (Rif).
Противомикробную активность II определяли in vitro в отношении десяти грамположительных и грамотрицательных штаммов. Сравнительнаю оценку спектра антибактериального действия на эталонных штаммах Г(+) и Г(–) микроорганизмов проводили мeтодом серийных разведений в бульоне Мюллера–Хинтона с использованием 96-луночных стерильных планшетов. Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии комплексного соединения меди(II) с ростом культуры без них. Первую наименьшую концентрацию вещества, где визуально не определялся рост бактерий, считали минимальной подавляющей концентрацией (МПК). В качестве препарата сравнения был выбран антибиотик широкого спектра действия – левофлоксацин.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
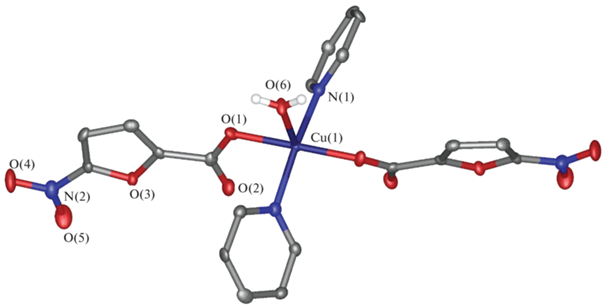
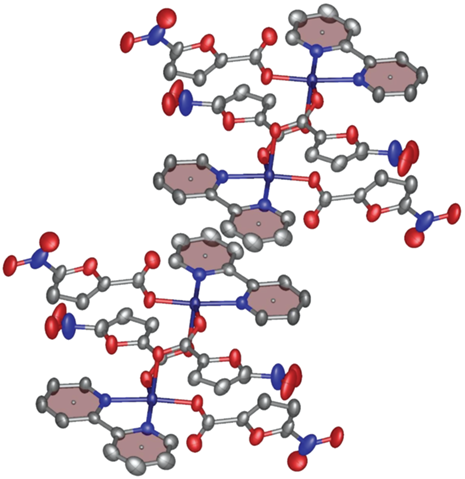
По данным рентгеноструктурного анализа, I кристаллизуется в моноклинной пр. гр. P21/n c двумя сольватными молекулами воды на одну молекулу комплекса (табл. 1, рис. 1). Ион меди(II), занимающий в кристалле частное положение (центр инверсии), находится в искаженном плоскоквадратном окружении, образованном карбоксильными группами двух анионов кислоты и двумя молекулами воды (табл. 2), попарно связанными водородными связями O–H…O (O…O 2.6759(11) Å, OHO 147.92(7)°). Аналогичные водородные связи (O…O 2.7521(12) Å, OHO 170.86(6)°) соединяют единственную симметрически-независимую молекулу воды, координированную к иону металла, с сольватной молекулой воды (рис. 2), дополнительно связанной с атомом кислорода фуранового фрагмента (O…O 3.2303(11) Å, OHO 156.69(6)°). Вторая водородная связь, образованная сольватной молекулой воды с атомом кислорода карбоксильной группы аниона кислоты соседнего комплекса (O…O 2.7188(12) Å, OHO 160.13(6)°), приводит к формированию в кристалле водородно-связанных цепей (рис. 2).
Рис. 1.
Общий вид комплекса I. Показаны только атомы водорода молекул воды, неводородные атомы представлены в виде эллипсоидов тепловых колебаний (p = 50%), а нумерация приведена только для гетероатомов независимой части элементарной ячейки. Здесь и далее пунктирными линиями изображены водородные связи.
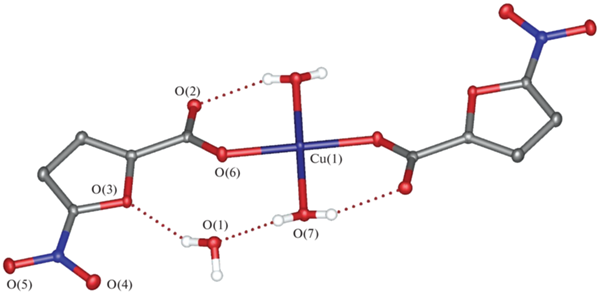
Таблица 2.
Основные длины связей, Å
| Параметр | I | II | III |
|---|---|---|---|
| Cu−O(fur) | 1.9398(8) | 1.9496(14) | 1.9396(14); 2.3228(18) |
| Cu−O(H2O) | 1.9756 (9); 2.4441(18) | 2.230 (2) | – |
| Cu−N | – | 2.014(3) | 2.009(2); 2.010(2) |
| Cu…Cu | – | – | 4.5684(4) |
Рис. 2.
Фрагмент кристаллической упаковки комплекса I, иллюстрирующий образование водородно-связанных цепей.
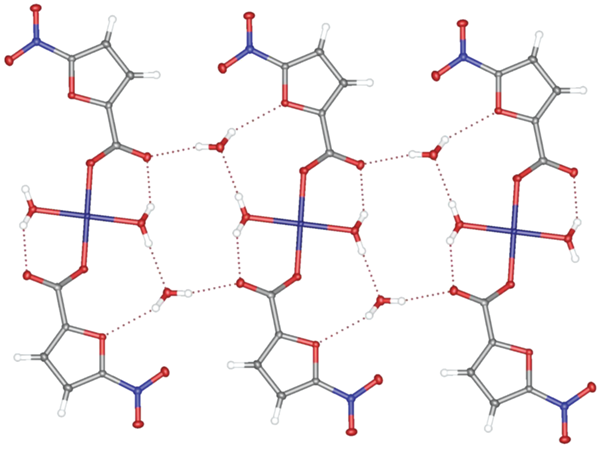
Комплекс II кристаллизуется в моноклинной пр. гр. C2 (табл. 1). Координационное окружение иона меди(II), занимающего в кристалле частное положение (ось второго порядка), имеет форму искаженной квадратной пирамиды, в основании которой находятся атомы кислорода карбоксильных групп двух симметрически-эквивалентных анионов кислоты и атомы азота двух симметрически-эквивалентных пиридиновых лигандов, а в вершине – молекула воды (рис. 3, табл. 2). Последняя образует водородные связи с атомами кислорода карбоксильных групп, не координированными к иону металла (O…O 2.180(4) Å, OHO 162.16(12)°), тем самым объединяя молекулы II в водородно-связанные цепи (рис. 4).
Рис. 4.
Фрагмент кристаллической упаковки комплекса II, иллюстрирующий образование водородно-связанных цепей.
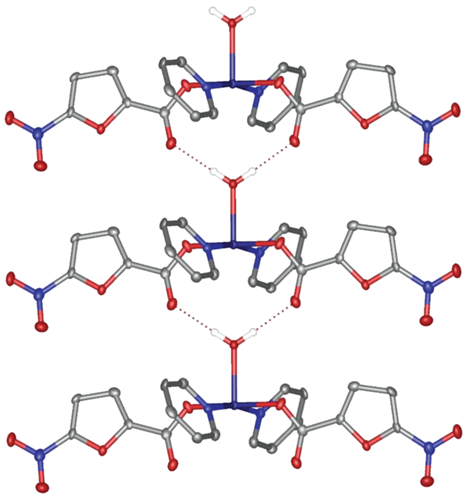
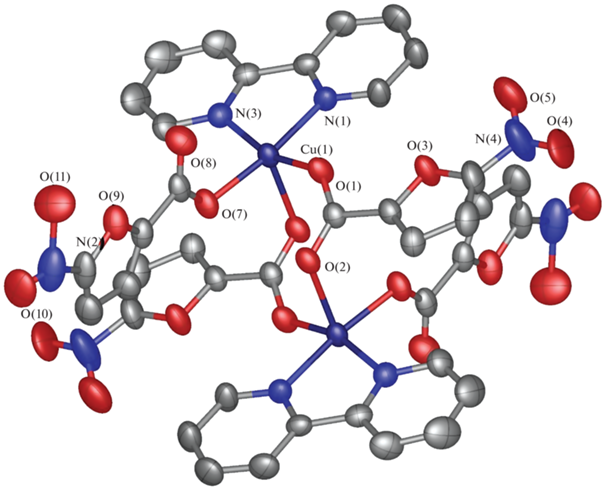
Комплекс III, кристаллизующийся в триклинной пр. гр. $P\bar {1}$ (табл. 1), содержит два симметрически-эквивалентных иона Cu2+ в искаженном квадратно-пирамидальном координационном окружении, образованном тремя атомами кислорода карбоксильных групп одного терминального и двух мостиковых анионов кислоты и двумя атомами азота бипиридинового лиганда (табл. 2, рис. 5). В результате такой координации в молекуле комплекса образуется восьмичленное кольцо –Cu–OCO–Cu–OCO–, геометрический центр которого совпадает с частным положением в кристалле – центром инверсии. Стекинг-взаимодействия между бипиридиновыми лигандами соседних молекул комплекса объединяют их в бесконечные цепи, соответствующее расстояние между центроидами взаимодействующих пиридиновых фрагментов составляет 3.6142(18) Å, а угол между их плоскостям – 1.14(11)° (рис. 6).
Рис. 6.
Фрагмент кристаллической упаковки комплекса III, иллюстрирующий образование “бесконечных цепей” за счет стекинг-взаимодействий между бипиридиновыми лигандами (выделены цветом).
Термическое поведение соединений I–III было исследовано методом СТА в атмосфере аргона с одновременной регистрацией кривых ТГ и ДСК до 500°С (рис. 7). Наличие нитрогрупп в составе комплексов обусловило протекание процессов, сопровождающихся образованием взрывчатых продуктов, что отражается в интенсивных экзотермических эффектах (рис. 7а–7в, кривая 2). Соединения термически устойчивы до 114 (I) и 107°С (II). На начальных стадиях термического разложения диссоциируют химические связи с наименьшей энергией разрыва [18, 19], например, С–N. Первый этап потери массы на кривой ТГ соответствует элиминированию диоксида азота от аниона кислоты и одной координированной молекулы воды (mэксп = 15.3% (I)/11.5% (II); mвыч = = 14.2% (I)/11.6% (II)) (рис. 7а, 7б, кривая 1; табл. 3). Этому процессу соответствуют эндотермические эффекты на кривой ДСК (рис. 7а, 7б, кривая 2; табл. 3) с экстремумами при 132 и 151°С (I)/108°С (II). Накопление в газовой атмосфере продуктов с высокой кинетической энергией [20]: диоксида азота, паров воды, а также углекислого газа, образующегося в результате декарбоксилирования фуранкарбоновой кислоты, приводит к сильному экзотермическому эффекту, в результате которого в эксперименте для комплекса I происходит разрыв тигля (экстремум соответствует 269°С). В комплексе II наличие только одной молекулы воды и присутствие N-донорного лиганда смягчают протекание данного процесса, и наблюдается смещение пика экзотермического эффекта в более низкотемпературную область (243°С) (рис. 7б, кривая 2; табл. 3). Соединение III, в отличие от I и II, начинает разлагаться уже при 62°С без эндотермических эффектов. Отсутствие воды в составе комплекса и наличие бипиридиновых фрагментов обусловливают сдвиг экзотермического процесса еще в более низкотемпературную область (экстремум при 186°С). Химический состав и микроморфологию остаточного вещества после термолиза III анализировали с помощью растрового электронного микроскопа (рис. 8а) и рентгенофотоэлектронной спектроскопии (рис. 8б). Проведенные ранее эксперименты по термическому исследованию карбоксилатных комплексов свидетельствуют о преимущественном образовании оксидов соответствующих металлов или чистых металлов [8, 10, 12, 21–25]. Энергодисперсионный спектр финального продукта термолиза III включает высокоинтенсивные пики от атомов С и Cu, что свидетельствует о зауглероженности остаточного вещества (инертная атмосфера не позволяет закончить окислительные процессы). Данный факт также подтверждается большой конечной массой 48.2% (II)/31.2% (III).
Рис. 7.
Кривые ТГ (1) и ДСК (2) для комплексов I (а), II (б) и III (в). Звездочкой отмечена температура, при которой произошел разрыв тигля.
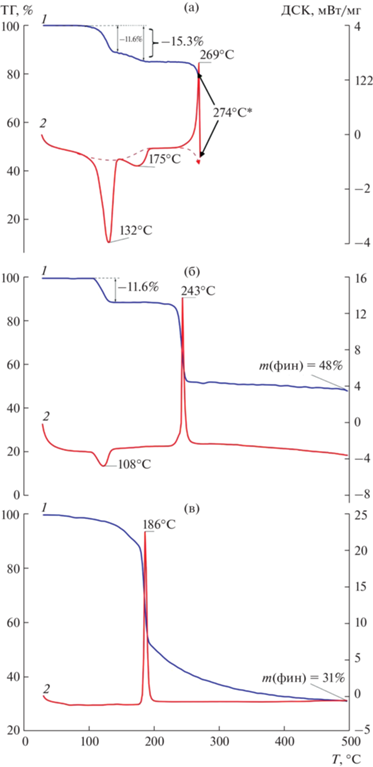
Рис. 8.
Фотография микроморфологии (×30000) (а) и энергодисперсионный спектр (б) конечного продукта термолиза III.
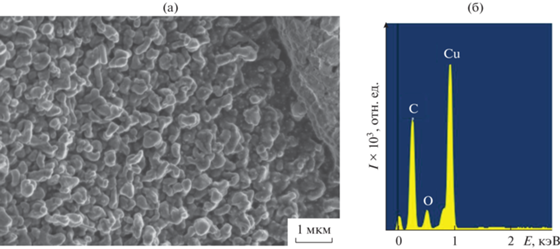
Таблица 3.
Данные СТА для комплексов I–III (атмосфера аргона)
| Комплекс | Этап/ΔT, °С | Δm (TГ), % | Tэндо/экзо, °С | mкон, % |
|---|---|---|---|---|
| I | 1/114–192 2/192–274* |
15.3 – |
132 ± 0.7; 175 ± 0.7 269 ± 0.7 |
– |
| II | 1/107–134 2/134–248 |
11.6 37.1 |
108 ± 0.7 243 ± 0.7 |
48 |
| III | 1/62–80 2/80–191 |
2.4 48.9 |
71 ± 0.7 186 ± 0.7 |
31 |
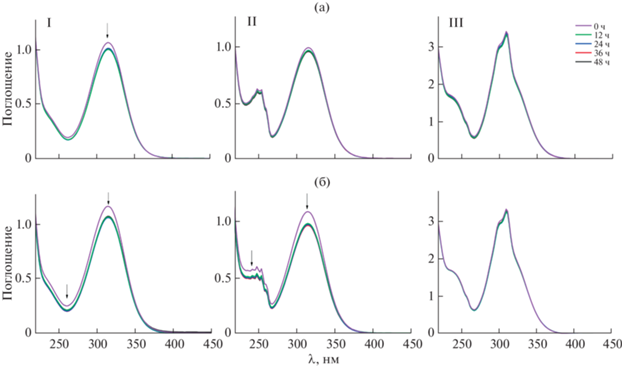
Устойчивость комплексов в водных растворах оценивали по данным УФ-спектроскопии. Спектры растворов I–III (50 мМ) в 5%-ном растворе глюкозы и физрастворе (0.9% NaCl) регистрировали каждые 6 ч на протяжении 2 сут (рис. 9а, 9б). ЭСП всех исследуемых комплексов содержат интенсивную полосу в области 320 нм, соответствующую n–π*- и π–π*-переходам внутри фуранового лиганда [25]. В случае медных комплексов полоса переноса заряда с металла на лиганд наблюдается в области 300–350 нм [26, 27], однако из-за своей слабой интенсивности она полностью перекрывается. С течением времени для растворов комплексов I и II (рис. 9а, 9б) наблюдались схожие изменения. В течение первых 12 ч общая интенсивность спектра снижалась, однако последующее хранение растворов при комнатной температуре не вызывало дальнейшей деградации. По-видимому, происходило быстрое перераспределение лигандного окружения, приводившее к незначительному падению интенсивности. Для более структурно жесткого комплекса III (рис. 9в) изменений в интенсивности не наблюдается, что говорит о высокой стабильности соединения в растворах глюкозы и физиологическом.
Рис. 9.
Электронные спектры поглощения комплексов I–III; а – 5%-ный раствор глюкозы; б – 0.9%-ный раствор NaCl.
Антибактериальная активность комплексов I–III была определена в отношении непатогенного штамма M. smegmatis. Известно, что устойчивость микобактерий к химиотерапевтическим агентам связана с низкой проницаемостью микобактериальной клеточной стенки с ее необычной структурой. M. smegmatis являются быстрорастущими непатогенными бактериями и поэтому используются в качестве модельного организма для медленнорастущих бактерий M. tuberculosis, а также для первичного скрининга противотуберкулезных препаратов [28, 29]. Как следует из данных табл 4, наиболее эффективным в отношении микобактерий оказался комплекс III (МИК = = 22 µг/диск). Полученное значение в 2 раза выше, чем для моноядерного комплекса с 2-HFur [14] (возможно, здесь сказывается эффект присутствия NO2-фрагмента), и, таким образом, соединение III в 3.6 раз эффективнее, чем индивидуальный bpy. Среди изученных комплексов меди(II) (табл. 4) это значение является третьим по активности (наилучшие показатели наблюдаются для моноядерного комплекса с 1,10-фенантролином [Cu(2fur)2(phen)] [8] и его метилированного аналога неокупроина [Cu(2fur)2(neoc)(H2O)] [14]). Ранее полученные результаты биологической активности для различных фуроатных комплексов Fe3+, Zn2+, Co2, Ni2+ свидетельствуют о том, что N-донорные лиганды, входя в состав комплекса, способны детерминировать (повышать или ослаблять) биологическую активность [8–14, 30]. Эффективность подавления жизнеспособности M. smegmatis для I и II очень низкая (МИК > > 400 µг/диск) (табл. 4).
Таблица 4.
Результаты антибактериальной активности в отношении M. smegmatis
| Комплекс | МИК, µг/диск | Зона ингибирования, мм | Работа | |
|---|---|---|---|---|
| 24 ч | 24 ч | 120 ч | ||
| I | 450 | 6.7 ± 0.1 | 6.4 ± 0.1 | Наст. работа |
| II | 445 | 6.8 ± 0.3 | 6.6 ± 0* | » |
| III | 22 | 7.0 ± 0.0 | 6.9 ± 0.1* | » |
| [Cu(2fur)2(phen)] | 2 | 7.0 ± 0.5 | 7.0 ± 0.5* | [8] |
| [Cu(2fur)2(neoc1)(H2O)] | 12 | 6.7 ± 0.3 | 6.6 ± 0.1 | [14] |
| [Cu(2fur)2(bpy)] | 46 | 7.0 ± 0.5 | 7.0 ± 0.5* | [9] |
| [Cu2(2fur)4(CH3CN)2] | 122 | 7.0 ± 0.5 | 7.0 ± 0.5* | [29] |
| [Cu2(2fur)4(py)2] | 146 | 7.0 ± 0.5 | 7.0 ± 0.5* | [8] |
| [Cu(2fur)2(py)2(H2O)] | 153 | 7.0 ± 0.5 | 7.0 ± 0.5* | [8] |
| [Cu(2fur)2(phpy)2(H2O)] · phpy2 | 224 | 7.0 ± 0.5 | 7.0 ± 0.5* | [9] |
| [Cu(2fur)2(NH2–py)2] | 474 | 7.0 ± 0.5 | 7.0 ± 0.5* | [11] |
| bpy | 78 | 0 | 0 | |
| Rif | 5 | 6.5 ± 0.0 | 6.5 ± 0.0 | |
| INH | 100 | 7.0** | 6.5** | |
Противомикробная активность II была определена в отношении десяти грамположительных и грамотрицательных штаммов. Оценку роста культур проводили визуально, сравнивая рост микроорганизмов в присутствии изучаемых тест-соединений с ростом культуры без них. За минимальную подавляющую концентрацию принимали минимальную концентрацию, обеспечивающую полное подавление видимого роста исследуемых штаммов микроорганизмов. В качестве препарата сравнения был выбран антибиотик широкого спектра действия левофлоксацин. Как следует из данных табл. 5, соединение II не обладает антибактериальной активностью – МПК > 64 мкг/мл.
Таблица 5.
Результаты противомикробной активности
| Бактериальные штаммы | МПК, мкг/мл | |
|---|---|---|
| II | Levofloc | |
| Staphylococcus aureus 25923 ATCC | >64 | 0.25 |
| Staphylococcus aureus 10 КИ | >64 | 0.13 |
| Staphylococcus epidermidis 533 КИ | >64 | 0.25 |
| Staphylococcus haemoliticus 602 КИ | >64 | 0.25 |
| Streptococcus agalactis 52 КИ | >64 | 0.25 |
| Enterococcus faecium 568 | >64 | 1.0 |
| Escherichia coli 25922 ATCC | >64 | 0.13 |
| Klebsiella pneumoniae 13883 ATCC | >64 | 0.5 |
| Proteus vulgaris 13315 ATCC | >64 | 0.25 |
| Salmonella cholerasuis 14028 ATCC | >64 | 0.25 |
Список литературы
WHO Global tuberculosis report 2020. Geneva: World Health Organization. https://reliefweb.int/report/world/global-tuberculosis-report-2020.
Louie A.Y., Meade T. // J. Proc. Natl. Acad. Sci. U.S.A. 1998. V. 95. № 12. P. 6663. https://doi.org/10.1073/pnas.95.12.6663
Rojas S., Quartapelle-Procopio E., Carmona F.J. et al. // Mater. Chem. B. 2014. V. 2. № 17. P. 2473. https://doi.org/10.1039/c3tb21455a
Thompson K.H., Orvig C. // J. Inorg. Biochem. 2006. V. 100. № 1. P. 1925. https://doi.org/10.1016/j.jinorgbio.2006.08.016
Bello-Vieda N., Pastrana H., Garavito M. et al. // Molecules. 2018. V. 23. № 2. P. 361. https://doi.org/10.3390/molecules23020361
Goodwin L. // Trop. Med. Hyg. 1995. V. 89. № 3. P. 339. https://doi.org/10.1016/0035-9203(95)90572-3
Ngwane A.H., Petersen R.D., Baker B. et al. // IUBMB Life. 2019. V. 71. № 5. P. 532. https://doi.org/10.1002/iub.2002
Луценко И.А., Баравиков Д.Е., Кискин М.А. и др. // Коорд. химия. 2020. Т. 46. № 6. С. 366. https://doi. org/10.31857/S0132344X20060055 [Lutsenko I.A., Baravikov D.E., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. №. 6. P. 411. https://doi.org/10.1134/S1070328420060056].
Луценко И.А., Ямбулатов Д.С., Кискин М.А. и др. // Коорд. химия. 2020. Т. 46. № 12. С. 715. https://doi. org/10.31857/S0132344X2012004X [Lutsenko I.A., Baravikov D.E., Kiskin M.A. et al. // Russ. J. Coord. Chem. 2020. V. 46. № 12. P. 787. https://doi.org/10.1134/S1070328420120040].
Lutsenko I.A., Yambulatov D.S., Kiskin M.A. et al. // Chem. Select. 2020. V. 5. № 38. P. 11837. https://doi.org/10.1002/slct.202003101
Луценко И.А., Кискин М.А., Кошенскова К.А. и др. // Изв. АН. Сер. хим. 2021. № 3. С. 463. [Lutsenko I.A., Kiskin M.A., Koshenskova K.A. et al. // Russ. Chem. Bull. 2021. V. 70. № 3. P. 463. https://doi.org/10.1007/s11172-021-3109-3]
Uvarova M.A., Lutsenko I.A., Kiskin M.A. et al. // Polyhedron. 2021. V. 203. P. 115241. https://doi.org/10.1016/j.poly.2021.115241
Lutsenko I.A., Nikiforova M.E., Koshenskova K.A. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 12. P. 881. https://doi.org/10.1134/S1070328421350013
Lutsenko I.A., Baravikov D.E., Koshenskova K.A. et al. // RSC Advances. 2022. V. 12. P. 5173. https://doi.org/10.1039/d1ra08555g
Elsaman T., Mohamed M.S., Mohamed M.A. // Bioorg. Chem. 2019. V. 88. P. 102969. https://doi.org/10.1016/j.bioorg.2019.102969
Sheldrick G.M. // Acta Crystallogr. 2015. V. 71. P. 3.
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. P. 339.
Храповский Г.М., Марченко Г.Н., Шамов А.Г. Влияние строение молекул на кинетические параметры мономолекулярного распада С- и О-нитросоединений. Казань: ФЭН, 1997. 224 с.
Манелис Г.Б., Назин Г.М., Рубцов Ю.И. и др. Термическое разложение и горение взрывчатых веществ. М.: Наука, 1996. 223 с.
Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. М.: Химия, 1975. 736 с.
Lutsenko I.A., Kiskin M.A., Efimov N.N. et al. // Polyhedron. 2017. V. 137. P. 165. https://doi.org/10.1016/j.poly.2017.08.028
Lutsenko I.A., Kiskin M.A., Nelyubina Y.V. et al. // Polyhedron. 2019. V. 159. P. 426. https://doi.org/10.1016/j.poly.2018.12.018
Lutsenko I.A., Kiskin M.A., Nelyubina Y.V. et al. // Polyhedron. 2020. V. 190. P. 114764. https://doi.org/10.1016/j.poly.2020.114764
Lutsenko I.A., Kiskin M.A., Nikolaevskii S.A. et al. // Chem. Select. 2019. V. 4. № 48. P. 14261. https://doi.org/10.1002/slct.201904585
Dağlı Ö., Köse D.A., Şahin O., Şahin Z.S. // J. Therm. Anal. Calorim. 2017. V. 128. № 3. P. 1373. https://doi.org/10.1007/s10973-016-6053-y
Toigo J., Farias G., Salla C.A.M. et al. // Eur. J. Inorg. Chem. 2021. V. 2021. № 31. P. 3177. https://doi.org/10.1002/ejic.202100454
Liu Y.-T., Yin X., Lai X.-Y., Wang X. // Dyes and Pigments. 2020. V. 176. № 11. P. 108244. https://doi.org/10.1016/j.dyepig.2020.108244
Ramon-García S., Ng C., Anderson H. et al. // Antimicrob. Agents. Chemother. 2011. V. 55. № 8. P. 3861. https://doi.org/10.1128/AAC.00474-11
Bekker O.B., Sokolov D.N., Luzina O.A. et al. // Med. Chem. Res. 2015. V. 24. № 7. P. 2926. https://doi.org/10.1007/s00044-015-1348-2
Луценко И.А., Никифорова М.Е., Кошенскова К.А. и др. // Коорд. химия. 2022. Т. 48. № 2. С. 83. https://doi.org https://doi.org/10.31857/S0132344X22020049 [Lutsenko I. A., Nikiforova M. E., Koshenskova K. A. et al. // Russ. J. Coord. Chem. 2021. V. 47. P. 879. 10.31857/S0132344X22020049].
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии