Журнал неорганической химии, 2022, T. 67, № 10, стр. 1411-1416
Изучение процесса протонирования этилоксипроизводного клозо-декаборатного аниона [B10H9OC2H5]2–
И. Н. Клюкин a, *, А. В. Колбунова a, b, Н. А. Селиванов a, А. Ю. Быков a, А. С. Кубасов a, А. П. Жданов a, К. Ю. Жижин a, Н. Т. Кузнецов a
a Институт общей и неорганической химии им. Н.С. Курнакова РАН
119991 Москва, Ленинский пр-т, 31, Россия
b Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, Мясницкая ул., 20, Россия
* E-mail: klukinil@gmail.com
Поступила в редакцию 27.04.2022
После доработки 06.05.2022
Принята к публикации 11.05.2022
- EDN: FTADGN
- DOI: 10.31857/S0044457X22600670
Аннотация
В настоящее время химия протонированных комплексов клозо-боратных анионов активно исследуется. Интерес продиктован возможностью использования подобных комплексов для дальнейшей направленной функционализации. В работе изучен процесс количественного протонирования алкоксипроизводного [2-B10H9OC2H5]2– под действием трифторметансульфоновой кислоты CF3SO3H. Установлено, что процесс протонирования происходит по борному остову, а не по атому кислорода экзополиэдрического заместителя. При этом дополнительный протон локализован на одной из граней борного полиэдра, а не мигрирует по одному из экваториальных поясов, как в случае аниона [B10H11]–.
ВВЕДЕНИЕ
Химия кластерных анионов бора является одной из активно развивающихся областей современной неорганической химии [1, 2]. Особое место в ней занимают бороводородные соединения, в первую очередь клозо-боратные анионы с общей формулой [BnHn]2–, n = 6–12 [3, 4]. Это связано с разнообразием строения борного полиэдра и химической реакционной способности [5, 6], что позволяет находить новые потенциальные области применения клозо-боратных анионов и их родственных соединений – карборанов и металлоборанов [7, 8]. Одним из первых направлений практического использования указанных соединений является создание ракетного топлива на их основе, а также лекарственных препаратов для бор-нейтронозахватной терапии (БНЗТ) [9, 10]. Вместе с тем появляются и новые аспекты применения: водородная энергетика [11], создание магнитных материалов [12, 13], разработка новых типов электролитов для электрических аккумуляторов [14].
В настоящее время основное внимание исследователей направлено не на создание новых полиэдрических каркасов, а на изучение их модификации путем замещения атомов водорода на экзополиэдрические группы. При этом в качестве заместителей могут выступать фрагменты органических молекул: нитрилы, кислоты, простые и сложные эфиры, амиды, мочевины [15–17]. Существует множество методов получения подобных борилированных производных [18]. Одним из наиболее изученных подходов является процесс электрофильно-индуцируемого замещения [19], механизм которого рассмотрен в работах [20, 21]. Ключевыми интермедиатами в данном процессе являются комплексы с кислотами Льюиса. При этом в качестве кислот Льюиса могут выступать H+, AlCl3 и другие [22, 23]. Особый интерес представляют комплексы с клозо-боратными анионами с уже введенными экзополиэдрическими заместителями.
В данной работе расширен ряд протонированных комплексов клозо-декаборатного аниона на основе взаимодействия алкоксипроизводного [2-B10H9OC2H5]2– с трифторметансульфоновой кислотой CF3SO3H.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР (11B, 1H, 13C) растворов исследуемых веществ в CD2Cl2 записывали на спектрометре Bruker Avance II-300 на частотах 300.3, 96.32 и 75.49 МГц соответственно с внутренней стабилизацией по дейтерию. В качестве внешних стандартов использовали тетраметилсилан и эфират трехфтористого бора. Исследования проводили на оборудовании ЦКП ФМИ ИОНХ РАН, функционирующем при поддержке государственного задания ИОНХ РАН в области фундаментальных научных исследований.
Кристаллы ((С6H5)4P)2((C4H9)4N)[B10H9OH2· ·B10H9OH]·2С2H5OH были получены парофазным насыщением раствора (Bu4N)2[2-B10H9OH] с двумя эквивалентами Ph4PCl в метаноле диэтиловым эфиром при добавлении соляной кислоты. Набор дифракционных отражений для кристалла получен в Центре коллективного пользования ИОНХ РАН на автоматическом дифрактометре Bruker SMART APEX2 (λMoKα, графитовый монохроматор, ω–ϕ-сканирование). Данные были проиндексированы и интегрированы с помощью программы SAINT [24]. Применялась поправка на поглощение, основанная на измерениях эквивалентных отражений (SADABS) [25]. Структуры расшифрованы прямым методом с последующим расчетом разностных синтезов Фурье. Все неводородные атомы уточнены в анизотропном приближении. Все атомы водорода CH- и BH-групп уточнены по модели “наездника” с тепловыми параметрами Uизо = 1.2Uэкв (Uизо) соответствующего неводородного атома (1.5Uизо для СН3-групп). Атомы водорода OH-групп, локализованные из разностных синтезов Фурье, уточняли в изотропном приближении.
Все расчеты проводили с использованием программы SHELXTL [26]. Структура расшифрована и уточнена с помощью программного комплекса OLEX2 [27].
Основные кристаллографические данные, параметры эксперимента и характеристики уточнения структуры приведены в табл. 1.
Таблица 1.
Основные кристаллографические данные ((С6H5)4P)2((C4H9)4N)[B10H9OH2·B10H9OH]·2С2H5OH
| Соединение | ((С6H5)4P)2((C4H9)4N)- [B10H9OH2·B10H9OH]·2С2H5OH |
|---|---|
| Брутто-формула | C66H105B20NO4P2 |
| М | 1254.64 |
| T, K | 150 |
| Сингония | Орторомбическая |
| Пр. гр. | Pna21 |
| a, Å | 37.2987(8) |
| b, Å | 10.5566(3) |
| c, Å | 18.6620(5) |
| V, Å3 | 7348.1(3) |
| Z | 4 |
| Pрасч, г/см3 | 1.134 |
| μ, мм–1 | 0.105 |
| F(000) | 2680.0 |
| Размеры кристалла, мм | 0.8 × 0.6 × 0.3 |
| Излучение, λ, Å | MoKα (λ = 0.71073) |
| Интервал углов 2θ, град | 4.01–51.364 |
| Число отражений: измеренных независимых (N) [Rint] |
37 880 12 502 [0.0309] |
| GooF | 1.038 |
| R1, wR2 по N0 | R1 = 0.0488, wR2 = 0.1293 |
| R1, wR2 по N | R1 = 0.0561, wR2 = 0.1349 |
Кристаллографические данные депонированы в Кембриджском банке структурных данных (CCDС № 2166031).
Соединение ((C4H9)4N)[2-B10H9OC2H5] получали по известной методике [28].
Протонирование аниона [2-B10H9OC2H5]2–. К раствору 30 мг (0.04 ммоль) (C4H9)4N)[2-B10H9OC2H5]2– в 1 мл дейтерированного дихлорметана CD2Cl2 в атмосфере сухого аргона добавляли 0.008 мл (0.09 ммоль) CF3SO3OH. Полученную смесь выдерживали в течение 10 мин при комнатной температуре. Выход целевого продукта, по данным мультиядерной ЯМР-спектроскопии, составил 100%. ЯМР 11B-{1H} (CD2Cl2, м. д.): 19.7 (д, 1B, Bап), 1.1 (с, 1B, Bзам), –15.8 (д, 2B, Bэкв), –20.1 (д, 2B, Bэкв), –22.3 (д, 3B, Bэкв), –28.0 (д, 1B, Bап). ЯМР 1H (CD2Cl2, м. д.): 11.75 (с, 1H, CF3SO3H), –0.3–3.50 (м, 10 Н, В10Н9 + Hfac), 3.47 (кв, 2H, СН2(α)), 3.19 (м, 8H, Bu4N), 1.65 (м, 8H, Bu4N), 1.42 (м, 8H, Bu4N), 1.34 (т, 3H, СН3(β)), 1.00 (т, 12H, Bu4N); ЯМР 13С (CD2Cl2, м. д.): 118.1 (CF3SO3H), 80.1 (СН2(α)), 58.1 (Bu4N), 23.2 (Bu4N), 19.1 (Bu4N), 14.5 (СН2(β)), 12.8 (Bu4N).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
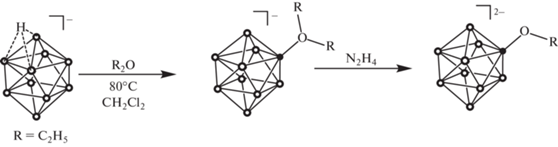
Ранее в работе [28] предложен подход к получению алкоксипроизводных клозо-декаборатного аниона общего вида [2-B10H9OR]2–. Данный подход основан на двухстадийной схеме (рис. 1). На первом этапе при взаимодействии аниона [B10H11]– с простыми циклическими эфирами образуется оксониевое производное кластерного аниона бора. На второй стадии происходит расщепление связи C–O с образованием алкокси-производного под действием водного раствора гидразина N2H4.
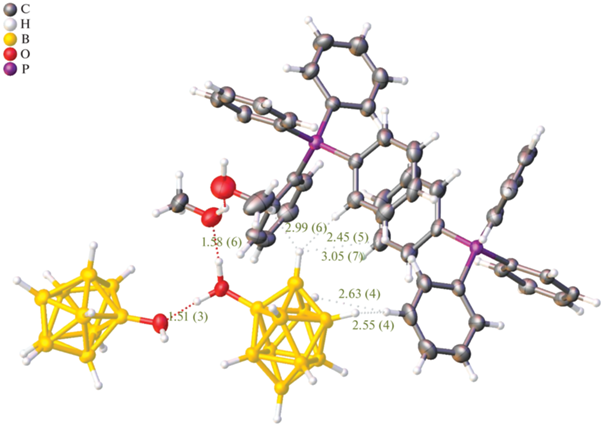
Однако в таких условиях помимо целевого продукта наблюдается образование гидроксипроизводного [2-B10H9OH]2–. Условия выделения и очистки позволяют успешно отделить данный побочный продукт от целевого алкокси-производного. Гидроксипроизводное клозо-декаборатного аниона [2-B10H9OH]2– представляет ценность, так как его можно использовать для дальнейшей модификации как по кластерному остову, так и по гидрокси-группе. Для выделения целевого продукта мы использовали несколько подходов: экстракцию с использованием дихлорметана и кристаллизацию [2-B10H9OH]2– из раствора в виде тетрафенилфосфониевой соли. Оба подхода оказались эффективными. При кристаллизации мы подкисляли раствор путем добавления соляной кислоты HCl. В результате была получена кристаллическая структура, в которой кластерный анион содержится в виде смешанной соли с тетрабутиламмониевым и тетрафенилфосфониевым катионами. Целевой продукт находился как в форме аниона [2-B10H9OH]2–, так и в протонированной форме с образованием [2-B10H9(OH2)]–. Данная система интересна за счет образования большого количества невалентных контактов, возникающих между катионами и борным кластером, а также между борными кластерами.
Как видно из анализа структуры, длины диводородных контактов между атомами водорода кластерного остова и тетрафенилфосфониевого катиона BH–HC лежат в интервале 2.4–3.1 Å (рис. 2). При этом невалентное взаимодействие осуществляется именно за счет диводородных контактов, а не за счет взаимодействия водорода кластера с π-системой бензольного кольца. Невалентные контакты могут осуществляться как за счет апикальных атомов водорода, так и за счет экваториальных. При локализации атомов водорода в апикальном положении образуется большее количество невалентных контактов. По-видимому, это связано с особенностью кристаллической упаковки полученного гидроксипроизводного, а также с тем, что апикальные атомы водорода имеют больший частичный отрицательный заряд и могут электростатически сильнее взаимодействовать с положительно заряженными атомами водорода фенильного заместителя. Помимо BH–HC-контактов в полученной системе наблюдаются взаимодействия между атомами водорода и кислорода гидроксильной группы. Длина этих контактов составляет 1.50–1.55 Å.
Рис. 2.
Кристаллическая структура соли ((С6H5)4P)2((C4H9)4N)[B10H9OH2· B10H9OH]·2С2H5OH по данным РСА.
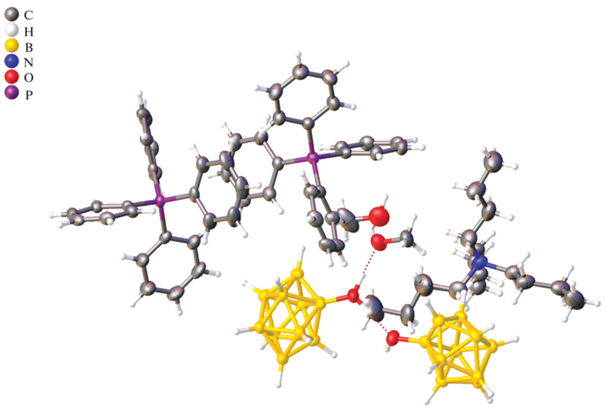
Рис. 5.
Спектры 11B-{1H} ЯМР алкоксипроизводного клозо-декаборатного аниона [B10H9OC2H5]2– и его протонированного аналога [2-B10H9OC2H5·Hfac]–.
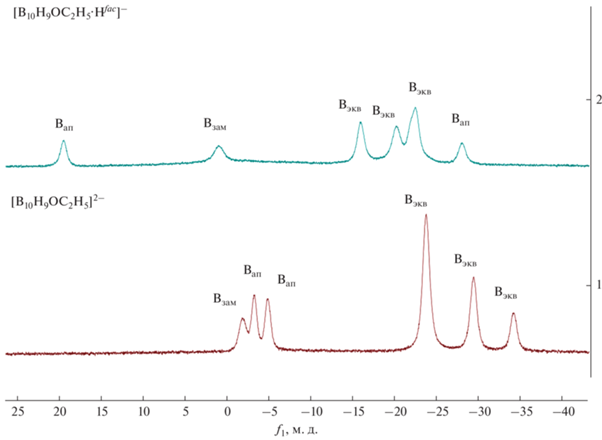
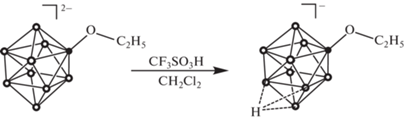
Для алкоксипроизводного [2-B10H9OC2H5]2– был изучен процесс протонирования кластерного остова. Данный процесс проводили в среде дихлорметана CH2Cl2 при комнатной температуре. Дихлорметан является ненуклеофильным растворителем и не способен вступать в реакции замещения с кластером, в отличие от других распространенных в лабораторной практике растворителей, таких как ацетонитрил CH3CN или тетрагидрофуран C4H8O. В качестве кислоты Бренстеда выступала трифторметансульфониевая кислота CF3SO3H. Использование даже избытка трифторуксусной кислоты CF3COOH не приводит к протонированию кластерного остова. Как и в случае аниона [2-B10H9O2CCH3]–, для исчерпывающего протонирования необходим избыток кислоты. Однако в данном случае достаточно всего двух эквивалентов трифторметан-сульфоновой кислоты CF3SO3H. Стоит отметить, что использование большого избытка кислоты не приводит к дополнительному протонированию борного кластера.
Протонирование кластера может осуще-ствляться по различным позициям. В первую очередь, по атому кислорода экзополиэдрического заместителя. Также протон может быть локализован на одной из граней борного полиэдра. Определить строение образующегося комплекса и локализацию Hfac наиболее легко и наглядно можно с помощью метода 11B ЯМР-спектроскопии. Процесс образования целевого комплекса [2-B10H9OC2H5·Hfac]– проще детектировать по появлению характерного сигнала при 18.5 м. д. В предыдущей работе на основании расчетов спектров 11B ЯМР [2-B10H9OC2H5·Hfac]– было доказано, что данный сигнал относится к апикальной позиции, противоположной к той, на которой локализован дополнительный атом водорода Hfac. Сигнал от замещенной позиции смещается в слабое поле относительно исходного аниона [2-B10H9OC2H5]2– и проявляется при 0.7 м. д. В сильном поле присутствуют сигналы от экваториальных и апикального атомов бора.
Такая структура спектра позволяет высказать предположение что, как и в случае аниона [2-B10H9O2CCH3]–, протон не мигрирует по кластерному остову, а локализован на одной из граней, содержащей апикальный атом бора. При этом протонирование происходит не по атому кислорода экзополиэдрического заместителя, а по борному полиэдру. На данный момент однозначно пока не удалось установить, на какой из граней локализован дополнительный протон. Вероятнее всего, протон локализован на грани, противоположной к замещенной позиции. В дальнейшем планируется однозначно установить структуру комплекса [2-B10H9OC2H5·Hfac]– с применением двумерной 11B–11B ЯМР-спектроскопии и детальных квантово-химичеcких расчетов.
ЗАКЛЮЧЕНИЕ
В работе изучен процесс протонирования алкоксипроизводного [2-B10H9OC2H5]2– под действием трифторметансульфониевой кислоты CF3SO3H. В исследуемой реакции борный кластер протонируется количественно. Установлено, что процесс протонирования происходит по борному остову, а не по атому кислорода экзополиэдрического заместителя. При этом дополнительный протон локализован на одной из граней борного остова, а не делокализован по одному из экваториальных поясов.
Список литературы
Zhu Y., Prommana P., Hosmane N.S. et al. // ACS Omega. 2022. V. 7. № 7. P. 5864. https://doi.org/10.1021/acsomega.1c05888
Fink K., Uchman M. // Coord. Chem. Rev. 2021. V. 431. P. 213684. https://doi.org/10.1016/j.ccr.2020.213684
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czechoslov. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Zhao X., Yang Z., Chen H. et al. // Coord. Chem. Rev. 2021. V. 444. P. 214042. https://doi.org/10.1016/j.ccr.2021.214042
Sivaev I.B. // Russ. J. Inorg. Chem. 2021. V. 66. № 9. P. 1289. https://doi.org/10.1134/S0036023621090151
Axtell J.C., Saleh L.M.A., Qian E.A. et al. // Inorg. Chem. 2018. V. 57. № 5. P. 2333. https://doi.org/10.1021/acs.inorgchem.7b02912
Shmal’ko A.V., Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1726. https://doi.org/10.1134/S0036023619140067
Avdeeva V.V., Garaev T.M., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 1. P. 28. https://doi.org/10.1134/S0036023622010028
Ali F., S Hosmane N., Zhu Y. // Molecules. 2020. V. 25. № 4. P. 828. https://doi.org/10.3390/molecules25040828
Hu K., Yang Z., Zhang L. et al. // Coord. Chem. Rev. 2020. V. 405. P. 213139. https://doi.org/10.1016/j.ccr.2019.213139
Hagemann H. // Molecules. 2021. V. 26. № 24. https://doi.org/10.3390/molecules26247425
Oña O.B., Alcoba D.R., Massaccesi G.E. et al. // Inorg. Chem. 2019. V. 58. № 4. P. 2550. https://doi.org/10.1021/acs.inorgchem.8b03156
Didelot E., Łodziana Z., Murgia F. et al. // Crystals. 2019. V. 9. № 7. P. 372. https://doi.org/10.3390/cryst9070372
Brighi M., Murgia F., Łodziana Z. et al. // J. Power Sources. 2018. V. 404. P. 7. https://doi.org/10.1016/j.jpowsour.2018.09.085
Nelyubin A.V., Selivanov N.A., Bykov A.Y. et al. // Int. J. Mol. Sci. 2021. V. 22. № 24. P. 13391. https://doi.org/10.3390/ijms222413391
Laskova J., Ananiev I., Kosenko I. et al. // Dalton Trans. 2022. V. 51. P. 3051. https://doi.org/10.1039/D1DT04174F
Avdeeva V.V., Garaev T.M., Breslav N.V. et al. // JBIC J. Biol. Inorg. Chem. 2022. https://doi.org/10.1007/s00775-022-01937-4
Cao K., Zhang C.-Y., Xu T.-T. et al. // Molecules. 2020. V. 25. № 2. P. 391. https://doi.org/10.3390/molecules25020391
Jelinek T., Štibr B., Mareš F. et al. // Polyhedron. 1987. V. 6. № 9. P. 1737. https://doi.org/10.1016/S0277-5387(00)86544-4
Golub I.E., Filippov O.A., Belkova N.V. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 11. P. 1639. https://doi.org/10.1134/S0036023621110073
Golub I.E., Filippov O.A., Belkova N.V. et al. // Molecules. 2021. V. 26. № 12. https://doi.org/10.3390/molecules26123754
Klyukin I.N., Kolbunova A.V., Selivanov N.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 12. P. 1798. https://doi.org/10.1134/S003602362112007X
Shore S.G., Hamilton E.J.M., Bridges A.N. et al. // Inorg. Chem. 2003. V. 42. № 4. P. 1175. https://doi.org/10.1021/ic020540s
Bruker, SAINT, Bruker AXS Inc., Madison, WI, 2018.
Krause L., Herbst-Irmer R., Sheldrick G.M. et al. // J. Appl. Crystallogr. 2015. V. 48. № 1. P. 3. https://doi.org/10.1107/S1600576714022985
Sheldrick G.M. // Acta Crystallogr., Sect. C: Struct. Chem. 2015. V. 71. № 1. P. 3. https://doi.org/10.1107/S2053229614024218
Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Crystallogr. 2009. V. 42. № 2. P. 339. https://doi.org/10.1107/S0021889808042726
Klyukin I.N., Voinova V.V., Selivanov N.A. et al. // Russ. J. Inorg. Chem. 2018. V. 63. № 12. P. 1546. https://doi.org/10.1134/s0036023618120112
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии