Журнал неорганической химии, 2022, T. 67, № 10, стр. 1390-1397
Синтез нового родакарборана [3,3-(1',5'-COD)-8-PrNH=C(Et)NH-3,1,2-RhC2B9H10]
М. Ю. Стогний a, *, Е. В. Богданова a, С. А. Ануфриев a, И. Б. Сиваев a
a Институт элементоорганических соединений им. А.Н. Несмеянова РАН
119991 Москва, ул. Вавилова, 28, Россия
* E-mail: stogniy@ineos.ac.ru
Поступила в редакцию 17.04.2022
После доработки 11.05.2022
Принята к публикации 11.05.2022
- EDN: OCJOHQ
- DOI: 10.31857/S0044457X22100567
Аннотация
Установлено, что комплексообразование амидинового производного нидо-карборана 10-PrNHC(Et)= HN-7,8-C2B9H11 с димером хлорида (1,5-циклооктадиен)родия(I) [(COD)RhCl]2 в тетрагидрофуране в присутствии трет-бутилата калия в качестве основания приводит к новому 18-электронному комплексу родия(I) полусэндвичевого типа, в котором дикарболлидный лиганд хелатирует металл по η5-типу. Строение полученного комплекса подтверждено методами ЯМР-, ИК- и УФ-спектроскопии, а также масс-спектрометрии. Синтезированный комплекс представляет собой первый пример комплекса родия(I) на основе симметрично замещенного производного нидо-карборана со связью бор–азот.
ВВЕДЕНИЕ
Одним из наиболее значимых представителей семейства полиэдрических гидридов бора, наряду с икосаэдрическими карборанами C2B10H12 [1, 2], клозо-декаборатным [B10H10]2– и клозо-додекаборатным [B12H12]2– анионами [3–10] и их монокарборановыми аналогами [CB9H10]– и [CB11H12]– [11–13], является 7,8-дикарба-нидо-ундекаборатный анион (нидо-карборан) [7,8-C2B9H12]–, образующийся при селективном деборировании 1,2-дикарба-клозо-додекаборана (орто-карборана) [14, 15]. Главной особенностью нидо-карборана является наличие открытой пентагональной грани с эндо-полиэдрическим атомом водорода, отрыв которого с помощью сильных оснований приводит к образованию дикарболлидного дианиона [7,8-C2B9H11]2–, являющегося трехмерным π-лигандом, изолобальным циклопентадиенид-аниону [16]. Практически сразу с момента открытия нидо-карборана начались исследования по синтезу металлокомплексов на его основе, в ходе которых были получены дикарболлидные комплексы подавляющего большинства d- и f-металлов [17–19]. При этом повышенный заряд дикарболлидного лиганда может быть частично компенсирован введением заместителей ониевого типа: –O+R2, –S+R2, –N+R3, –P+R3 и т.п. Способность нидо-карборана к образованию заряд-компенсированных ониевых производных типа X-L-7,8-C2B9H11 (X = 9, 10; L = OR2, SR2, NR3, PR3) активно используется при синтезе металлокомплексов, так как позволяет уменьшить общий заряд системы, стабилизировать в ряде случаев неустойчивые степени окисления металлов, а также упростить процедуру очистки и выделения соединений [20, 21]. При этом наибольший интерес представляют симметрично замещенные заряд-компенсированные производные нидо-карборана с заместителем при десятом атоме бора, так как в этом случае отсутствуют энантиомерные смеси, характерные для асимметричных С- и В(9)-замещенных производных, а наличие плоскости симметрии существенно упрощает исследование продуктов методом спектроскопии ЯМР.
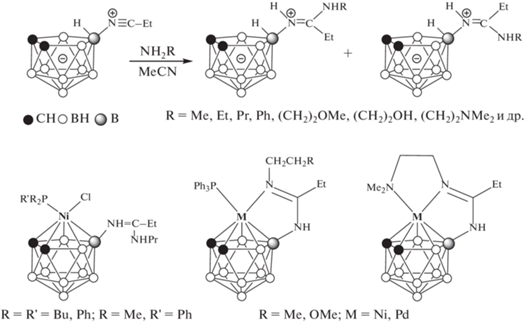
Ранее нами был разработан препаративный метод синтеза 10-замещенных нитрилиевых производных нидо-карборана 10-RC≡N-7,8-C2B9H11 (R = Me, Et, CH2CH2Br, CH2CH2OCH2CH2CN) и показано, что посредством реакций нуклеофильного присоединения по тройной связи нитрилиевой группы –N+≡C этих соединений возможно получение заряд-компенсированных нидо-карборансодержащих иминолов, имидатов, тиоимидатов и амидинов [22–26]. Полученные таким образом амидины оказались перспективными лигандами для синтеза металлокомплексов никеля(II) и палладия(II) полусэндвичевого строения, в которых дикарболлидный лиганд может координироваться атомом металла как по η5-типу, так и по η5:κ1-N- и η5:κ2-N,N'-типам (рис. 1) [25, 27].
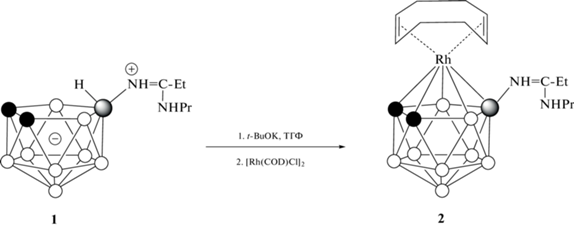
В данной работе описан синтез нового родакарборана [3,3-(1',5'-COD)-8-PrNH=C(Et)NH-3,1,2-RhC2B9H10] путем взаимодействия амидинового производного нидо-карборана 10-PrNHC(Et)= HN-7,8-C2B9H11 с димером хлорида (1,5-циклооктадиен)родия(I) [(COD)RhCl]2.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Амидиновое производное нидо-карборана 1 было синтезировано по методике [24]. Тетрагидрофуран осушали перегонкой над металлическим натрием в присутствии бензофенона, используя стандартную процедуру [28]. Ход реакции контролировали с помощью тонкослойной хроматографии на пластинках Kieselgel 60 F245 (Merck), для проявления использовали 0.5%-ный раствор PdCl2 в метаноле с добавлением 1% HCl. Для колоночной хроматографии использовали силикагель Acros Organics 0.06–0.2 мм, 60 A.
Спектры ЯМР 1Н, 11В, 11В{1Н}, 13С и корреляционные спектры (HH)gCOSY, (HC)HSQC, (HH)NOESY были зарегистрированы на спектрометре Varian Inova 400. Для спектров ЯМР 1Н и 13С химические сдвиги приведены относительно Me4Si, для спектров ЯМР 11В, 11В{1Н} – относительно BF3·Et2O. Для спектров ЯМР использованы следующие сокращения: м.д. – миллионные доли, J – константа спин-спинового взаимодействия, с – синглет, уш. с – уширенный синглет, д – дублет, т – триплет, к – квартет, м – мультиплет. ИК-спектр записывали на приборе ФСМ2201 (ИНФРАСПЕК, УФ-спектр – на прибора SF-2000 (OKB SPECTR LLC). Масс-спектр высокого разрешения (ESI HRMS) получен на масс-спектрометре Bruker Daltonics microOTOF II в диапазоне масс m/z от 50 до m/z = 3000.
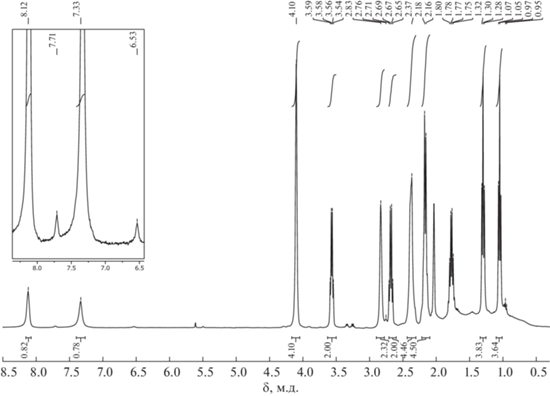
Синтез [3,3-(1',5'-COD)-8-PrNH=C(Et)NH-3,1,2-RhC2B9H10] (2). Синтез проводили в атмосфере аргона. В круглодонную колбу помещали 0.13 г (0.50 ммоль) 10-PrNHC(Et)=HN-7,8-C2B9H11 (1), 20 мл сухого тетрагидрофурана и 0.17 г (1.50 ммоль) t-BuOK. Реакционную смесь перемешивали в течение ~10 мин при комнатной температуре, а затем добавляли одной порцией 0.25 г (0.50 ммоль) [(COD)RhCl]2. Цвет реакционной смеси быстро изменялся с бледно-желтого на коричневый. Реакционную смесь перемешивали при комнатной температуре в течение ~30 мин, а затем упаривали. Для очистки вещества применяли колоночную хроматографию на силикагеле, используя хлористый метилен в качестве элюента. В результате получили 0.21 г желто-коричневого кристаллического продукта. Выход составил 92%. 1H ЯМР-спектр (ацетон-d6, м.д.): 8.12 (1H, с, NHPr), 7.33 (1H, с, NH=C), 4.05–4.15 (4H, м, COD), 3.57 (2H, к, J = 6.9 Гц, NHCH2CH2CH3), 2.83 (уш. с, 2H, CHкарб), 2.68 (2H, к, J = 7 Гц, CH2CH3), 2.25–2.40 (4H, м, COD), 2.05–2.15 (4H, м, COD), 1.77–1.80 (2H, м, NHCH2CH2CH3), 1.30 (3H, т, J = 7 Гц, CH2CH3), 1.05 (3H, т, J = 6.9 Гц, NHCH2CH2CH3), 3.0–0.6 (уш. с, 8H, BH). 13C ЯМР (ацетон-d6, м.д.): 167.1 (NH=C), 75.0 (CH=CH от COD, д, J = 12 Гц), 44.8 (NHCH2CH2CH3), 34.2 (CHкарб), 32.1 (СН2 от COD), 24.5 (CH2), 23.4 (NHCH2CH2CH3), 11.0 (CH3), 10.6 (NHCH2CH2CH3). 11B ЯМР (ацетон-d6, м.д.): 4.9 (с, 1B), ‒12.5 (д, J = 135 Гц, 2B), ‒16.1 (д, J = 126 Гц, 3B), ‒23.7 (д, J = 150 Гц, 2B), ‒26.7 (д, J = 155 Гц, 1B). ИК-спектр (тонкая пленка, см‒1): 3380 (νNH), 3305 (νNH), 3246 (νNH), 2989, 2969, 2941, 2880 (νCH), 2832 (νCH), 2589 (νBH), 2558 (νBH), 2510 (νBH), 1641 (νN=C), 1614 (νС=С), 1555, 1476, 1459, 1329, 1243. УФ-спектр (λ, нм): 204, 316, 405. Масс-спектр высокого разрешения ESI HRMS: m/z для C16H36B9N2Rh, вычислено: 479.2733 [M + Na]+, найдено: 479.2738 [M + Na]+.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
К настоящему моменту получено большое количество комплексов родия на основе нидо-карборана [29–33], представляющих интерес в качестве катализаторов целого ряда органических процессов, таких как реакции окислительного сочетания [34], аннелирования [33], гидрирования и изомеризации олефинов [31, 35] и др. [32]. Однако синтез комплексов родия с использованием в качестве лиганда симметрично замещенных заряд-компенсированных производных нидо-карборана ограничивается лишь несколькими примерами. Так, на основе симметрично замещенных сульфониевых производных нидо-карборана получены полусэндвичевые комплексы родия(I) с двумя трифенилфосфиновыми лигандами [3,3-(Ph3P)2-8-RR′S-3,1,2-RhC2B9H10] (R = R' = = Me, Et; RR′ = (CH2)4; R = Et, R' = Ph) [36], а также комплексы родия(I) с циклооктадиеном [1,2-R2-3,3-(COD)-8-Me2S-3,1,2-RhC2B9H8] (R = H; Me) и показано, что комплекс [3,3-(COD)-8-Me2S-3,1,2-RhC2B9H10] при обработке I2 в бензоле димеризуется в [3,3-I2-8-Me2S-3,1,2-RhC2B9H10]2 [36, 37]. Установлено, что комплексы родия(I) легко окисляются в растворе хлороформа или четыреххлористого углерода с образованием соответствующих комплексов родия(III) [3-Ph3P-3,3-Cl2-8-RR'S-3,1,2-RhC2B9H10] (R = R′ = Me, Et; RR′ = = (CH2)4; R = Et, R′ = Ph) [36]. В качестве еще одного примера металлокомплексов с заряд-компенсирующей группой при десятом атоме бора можно привести комплекс родия(III) [1,2-Me2-3-Ph3P-3-Cl-3Н-8-Ph3P-3,1,2-RhC2B9H8], который был получен реакцией углеродзамещенного нидо-карборана [7,8-Me2-7,8-C2B9H10]– с [(Ph3P)3RhCl], сопровождающейся замещением в карборановом лиганде [38].
Синтез комплексов родия на основе заряд-компенсированных производных нидо-карборана со связью бор–азот представлен только асимметрично замещенными лигандами [31, 39–41]. В связи с этим нами изучено комплексообразование нидо-карборансодержащего амидина 10-PrNHC(Et)=HN‑7,8‑C2B9H11 (1) с комплексом родия(I) [(COD)RhCl]2. Реакцию проводили в сухом тетрагидрофуране в инертной атмосфере во избежание окисления металла. В качестве основания для удаления эндо-водорода использовали трет-бутилат калия (схема 1 ).
Схема 1 . Синтез [3,3-(1',5'-COD)-8-PrNH=C(Et)NH-3,1,2-RhC2B9H10].
Обнаружено, что комплексообразование протекает достаточно быстро даже при комнатной температуре. Согласно данным, полученным с помощью метода тонкослойной хроматографии в хлористом метилене, полная конверсия амидина 1 в комплекс 2 проходит менее чем за 30 мин. Процесс выделения целевого продукта из реакционной смеси включал в себя колоночную хроматографию на силикагеле с использованием в качестве элюента хлористого метилена. Комплекс 2 желто-коричневого цвета был получен с высоким выходом (92%).
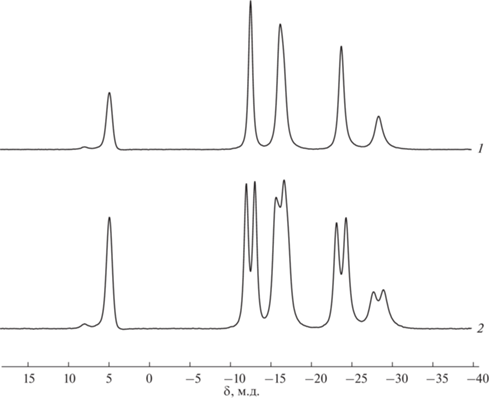
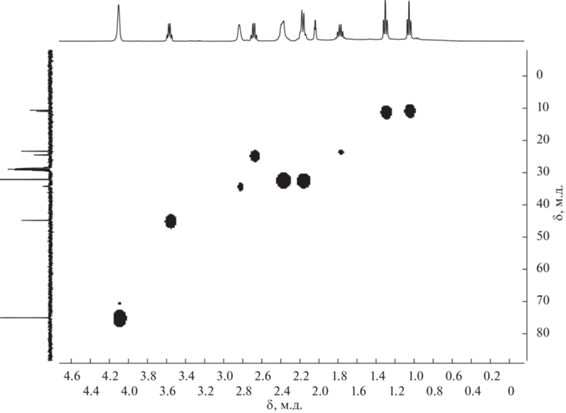
Полученный комплекс охарактеризован различными методами спектроскопии ЯМР. При этом наиболее значимыми являются спектры ЯМР 11В и 11B{1H}. Так, в спектре ЯМР 11B (рис. 2) сигналы от девяти атомов бора дикарболлидного лиганда присутствуют в области примерно от 5 до –30 м.д., что соответствует типичной картине спектров комплексов полусэндвичевого типа на основе нидо-карборана. В спектре наблюдается всего пять сигналов, что говорит о наличии плоскости симметрии в соединении. Синглет от замещенного атома бора находится при 4.9 м.д., остальные сигналы представляют собой дублеты при ‒12.5, ‒16.1, ‒23.7 и ‒26.7 м.д. с общим соотношением интегральных интенсивностей 1 : 2 : 3 : 2 : 1.
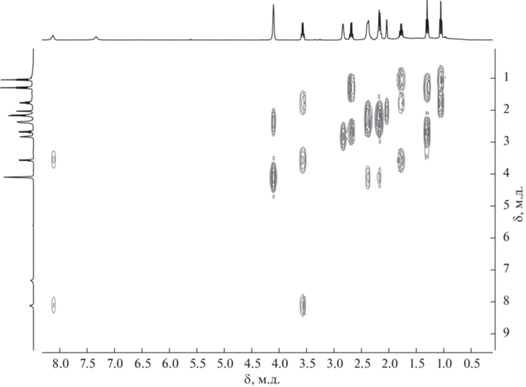
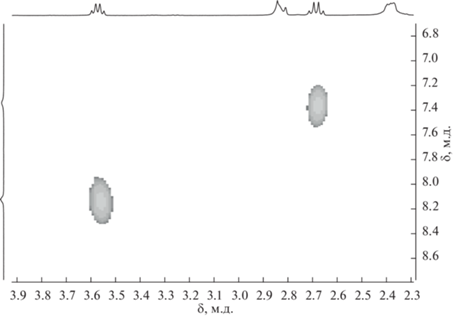
В спектре ЯМР 1H соединения 2 отсутствует характеристичный сигнал эндо-водорода нидо-карборанового остова, а синглет от СН-протонов дикарболлидного лиганда наблюдается при 2.83 м.д., что подтверждает факт образования комплекса. В спектре также присутствуют сигналы циклооктадиенового лиганда и заместителя в дикарболлидном лиганде. При этом наблюдаются два сигнала NH-групп бокового заместителя при 8.12 и 7.33 м.д., что подтверждает предполагаемую структуру комплекса 2, в которой дикарболлидный лиганд координируется атомом металла по η5-типу. Таким образом, боковой заместитель, как и в случае C-амидинкарборанильного комплекса родия(III) [3-Cp*-1 (2',6'-iPr2-C6H3N=C(NHC6H3-2'',6''-iPr2)-3,1,2-RhC2B9H10] [42], не принимает непосредственного участия в комплексообразовании. Для соотнесения сигналов NH-протонов был получен спектр ЯМР (HH)gCOSY (рис. 3). Из данного спектра видно, что сигнал при 8.12 м.д. имеет кросс-пик с квартетом от NHCH2CH2CH3 и, следовательно, соответствует атому водорода группы NHPr, тогда как синглет при 7.33 м.д. не имеет кросс-пиков ни с одной из групп, что хорошо согласуется с ожидаемой спектральной картиной для атома водорода при двойной связи NH=C.
Интересной особенностью спектра ЯМР 13С комплекса 2 является расщепление сигналов от атомов углерода при двойной связи в 1,5-циклооктадиене на атоме родия. Сигналы проявляются в виде дублета при 75.0 м.д. с константой спин-спинового взаимодействия, равной 12 Гц. Сигнал от атома углерода группы NH=C наблюдается при 167.1 м.д. Метиленовые группы циклооктадиенового лиганда, проявляющиеся в спектре ЯМР 1H в виде мультиплетов при 2.25–2.40 и 2.05–2.15 м.д., в спектре ЯМР 13C наблюдаются в виде одного сигнала при 32.1 м.д. (рис. 4).
Следует отметить, что исходный амидин 1 представляет собой смесь Е- и Z-изомеров в соотношении примерно 1 : 1 (рис. 1) [24]. На основе анализа спектров ЯМР 1Н и 11В комплекса 2 можно предположить, что полученный комплекс также представляет собой смесь стереоизомеров, один из которых является минорным. Так, в спектре ЯМР 1Н (рис. 5) помимо основных сигналов можно также наблюдать второй набор сигналов малой интенсивности. Наиболее четко выделяются сигналы при 7.71 и 6.53 м.д. от NH-протонов, синглет от СН-протона при 2.76 м.д. и триплет от метильной группы пропильного заместителя при 0.97 м.д. Остальные сигналы накладываются на сигналы основного изомера и не поддаются идентификации. В спектре ЯМР 11В также четко прослеживается синглет от замещенного десятого атома бора минорного изомера при 8.0 м.д. (рис. 2). Исходя из интегральной интенсивности синглетов обоих изомеров можно сделать вывод, что содержание минорного продукта составляет ~5%.
Для определения абсолютной конфигурации основного изомера был получен спектр ЯМР (HH)NOESY. На рис. 6 приведен фрагмент этого спектра, из которого видно, что сигнал протона NH=C при 7.33 м.д. имеет кросс-пик с квартетом метиленовой группы этильного заместителя при 2.68 м.д. Это свидетельствует о том, что указанные группы находятся по одну сторону от двойной связи, что соответствует Z-конфигурации для основного изомера. Отсутствие кросс-пика между сигналом протона NH=C и квартетом метиленовой группы пропильного заместителя также говорит в пользу данного предположения.
ЗАКЛЮЧЕНИЕ
Таким образом, обнаружено, что комплексообразование симметрично замещенного заряд-компенсированного карбораниламидина 10-PrNHC(Et)=HN-7,8-C2B9H11 с [(COD)RhCl]2 приводит к полусэндвичевому комплексу родия(I) [3,3-(1',5'-COD)-8-PrNH=C(Et)NH-3,1,2-RhC2B9H10], в котором дикарболлидный лиганд связан с атомом металла по η5-типу. В растворе синтезированный комплекс находится преимущественно в виде Z-изомера с небольшой примесью E-изомера, что было подтверждено методом ЯМР-спектроскопии.
Список литературы
Grimes R.N. Carboranes. London: Academic Press, 2016. P. 283. https://doi.org/10.1016/B978-0-12-801894-1.00009-3
Sivaev I.B. // Russ. J. Inorg. Chem. 2021. V. 66. № 9. P. 1289. [Сиваев И.Б. // Журн. неорган. химии. 2021. Т. 66. № 9. С. 1192.] https://doi.org/10.1134/S0036023621090151
Sivaev I.B., Bregadze V.I., Sjöberg S. // Collect. Czech. Chem. Commun. 2002. V. 67. № 6. P. 679. https://doi.org/10.1135/cccc20020679
Sivaev I.B., Prikaznov A.V., Naoufal D. // Collect. Czech. Chem. Commun. 2010. V. 75. № 11. P. 1149. https://doi.org/10.1135/cccc2010054
Zhizhin K.Yu., Zhdanov A.P., Kuznetsov N.T. // Russ. J. Inorg. Chem. 2010. V. 55. № 14. P. 2089. https://doi.org/10.1134/S0036023610140019
Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // Russ. J. Inorg. Chem. 2020. V. 65. № 4. P. 514. [Авдеева В.В., Малинина Е.А., Жижин К.Ю. и др. // Журн. неорган. химии. 2020. Т. 65. № 4. С. 495.] https://doi.org/10.1134/S0036023620040026
Avdeeva V.V., Malinina E.A., Zhizhin K.Yu. et al. // Russ. J. Coord. Chem. 2021. V. 47. № 8. P. 519. [Авдеева В.В., Малинина Е.А., Жижин К.Ю. и др. // Коорд. химия. 2021. Т. 47. № 8. С. 457.] https://doi.org/10.1134/S1070328421080017
Korolenko S.E., Avdeeva V.V., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2021. V. 66. № 9. P. 1350. [Короленко С.Е., Авдеева В.В., Малинина Е.А. и др. // Журн. неорган. химии. 2021. Т. 66. № 9. С. 1255.] https://doi.org/10.1134/S0036023621090047
Avdeeva V.V., Garaev T.M., Malinina E.A. et al. // Russ. J. Inorg. Chem. 2022. V. 67. № 1. P. 28. [Авдеева В.В., Гараев Т.М., Малинина Е.А. и др. // Журн. неорган. химии. 2022. Т. 67. № 1. С. 33.] https://doi.org/10.1134/S0036023622010028
Avdeeva V.V., Korolenko S.E., Malinina E.A. et al. // Russ. J. Gen. Chem. 2022. V. 92. № 3. P. 393. [Авдеева В.В., Короленко С.Е., Малинина Е.А. и др. // Журн. общ. химии. 2022. Т. 92. № 3. С. 443.] https://doi.org/10.1134/S1070363222030070
Körbe S., Schreiber P.J., Michl J. // Chem. Rev. 2006. V. 106. № 12. P. 5208. https://doi.org/10.1021/cr050548u
Douvris C., Michl J. // Chem. Rev. 2013. V. 113. № 10. P. R179. https://doi.org/10.1021/cr400059k
Shmal’ko A.V., Sivaev I.B. // Russ. J. Inorg. Chem. 2019. V. 64. № 14. P. 1726. https://doi.org/10.1134/S0036023619140067
Hawthorne M.F., Young D.C., Garrett P.M. et al. // J. Am. Chem. Soc. 1968. V. 90. № 4. P. 862. https://doi.org/10.1021/ja01006a006
Yoo J., Hwang J.-W., Do Y. // Inorg. Chem. 2001. V. 40. № 3. P. 568. https://doi.org/10.1021/ic000768k
Hawthorne M.F., Young D.C., Andrews T.D. et al. // J. Am. Chem. Soc. 1968. V. 90. № 4. P. 879. https://doi.org/10.1021/ja01006a008
Grimes R.N. Transitional metal metallacarbaboranes // Comprehensive Organometallic Chemistry II. Oxford: Elsevier, 1995. V. 1. P. 373. https://doi.org/10.1016/B978-008046519-7.00009-5
Grimes R.N. // Coord. Chem. Rev. 2000. V. 200–202. P. 773. https://doi.org/10.1016/S0010-8545(00)00262-9
Hosmane N.S., Maguire J.A. Metallacarboranes of d- and f-block metals // Comprehensive Organometallic Chemistry III. Oxford: Elsevier, 2007. V. 3. P. 175. https://doi.org/10.1016/B0-08-045047-4/00046-7
Stogniy M.Yu., Sivaev I.B. // Reactions. 2022. V. 3. № 1. P. 172. https://doi.org/10.3390/reactions3010013
Timofeev S.V., Sivaev I.B., Prikaznova E.A. et al. // J. Organomet. Chem. 2014. V. 751. № 1. P. 221. https://doi.org/10.1016/j.jorganchem.2013.08.012
Stogniy M.Yu., Erokhina S.A., Suponitsky K.Yu. et al. // New J. Chem. 2018. V. 42. № 22. P. 17958. https://doi.org/10.1039/C8NJ04192J
Stogniy M.Yu., Erokhina S.A., Anisimov A.A. et al. // Polyhedron. 2019. V. 174. № 1. P. 114170. https://doi.org/10.1016/j.poly.2019.114170
Stogniy M.Yu., Erokhina S.A., Suponitsky K.Yu. et al. // J. Organomet. Chem. 2020. V. 909. № 1. P. 121111. https://doi.org/10.1016/j.jorganchem.2020.121111
Stogniy M.Yu., Erokhina S.A., Suponitsky K.Yu. et al. // Dalton Trans. 2021. V. 50. № 14. P. 4967. https://doi.org/10.1039/d1dt00373a
Stogniy M.Yu., Anufriev S.A., Bogdanova E.V. et al. // Russ. Chem. Bull. 2022. V. 71. № 1. P. 91. [Стогний М.Ю., Ануфриев С.А., Богданова Е.В. и др. // Изв. АН, Сер. хим. 2022. № 1. С. 91.] https://doi.org/10.1007/s11172-022-3381-x
Stogniy M.Yu., Erokhina S.A., Suponitsky K.Yu. et al. // Crystals. 2021. V. 11. № 3. P. 306. https://doi.org/10.3390/cryst11030306
Purification of Laboratory Chemicals; Butterworth-Heinemann: Burlington, NJ, USA, 2009.
Grimes R.N. Carboranes. London: Academic Press, 2016. P. 711. https://doi.org/10.1016/B978-0-12-801894-1.00013-5
Molotkov A.P., Vinogradov M.M., Moskovets A.P. et al. // Eur. J. Inorg. Chem. 2017. № 38–39. P. 4635. https://doi.org/10.1002/ejic.201700498
Chan A.P.Y., Parkinson J.A., Rosair G.M. et al. // Inorg. Chem. 2020. V. 59. № 3. P. 2011. https://doi.org/10.1021/acs.inorgchem.9b03351
Vinogradov M.M., Loginov D.A. // J. Organomet. Chem. 2020. V. 910. P. 121135. https://doi.org/10.1016/j.jorganchem.2020.121135
Molotkov A.P., Timofeev S.A., Loginov D.A. // Russ. Chem. Bull. 2021. V. 70. № 10. P. 1922. [Молотков А.П., Тимофеев С.А., Логинов Д.А. // Изв. АН Сер. хим. 2021. № 10. С. 1922.] https://doi.org/10.1007/s11172-021-3297-x
oginov D.A., Belova A.O., Kudinov A.R. // Russ. Chem. Bull. 2014. V. 63. № 4. P. 983. [Логинов Д.А., Белова А.О., Кудинов А.Р. // Изв. АН, Сер. хим. 2014. № 4. С. 983.] 10.1007/s11172-014-0537-
Alekseev L.S., Lyubimov S.E., Dolgushin F.M. et al. // Organometallics. 2011. V. 30. № 7. P. 1942. https://doi.org/10.1021/om101201e
Núñez R., Tutusaus O., Teixidor F. et al. // Organometallics. 2004. V. 23. № 10. P. 2273. https://doi.org/10.1021/om030635h
Vinogradov M.M., Nelyubina Y.V., Ikonnikov N.S. // J. Organomet. Chem. 2018. V. 867. P. 224. https://doi.org/10.1016/j.jorganchem.2018.01.025
Baker R.T., Delaney M.S., King III R.E. et al. // J. Am. Chem. Soc. 1984. V. 106. № 10. P. 2965. https://doi.org/10.1021/ja00322a038
Teller R.G., Wilczynski J.J., Hawthorne M.F. // J. Chem. Soc. Chem. Commun. 1979. № 11. P. 472. https://doi.org/10.1039/C39790000472
Timofeev S.V., Zhidkova O.B., Sivaev I.B. et al. // J. Organomet. Chem. 2018. V. 867. P. 342. https://doi.org/10.1016/j.jorganchem.2017.11.014
Timofeev S.V., Zhidkova O.B., Suponitsky K.Yu. et al. // Inorg. Chim. Acta. 2021. V. 518. P. 120243. https://doi.org/10.1016/j.ica.2020.120243
Xu B., Yao Z.-Y., Jin G.-X. // Russ. Chem. Bull. 2014. V. 63. № 4. P. 963. [Сюй Б., Яо Ц.-Ц., Цзинь Г.-С. // Изв. АН Сер. хим. 2014. № 4. С. 963.] https://doi.org/10.1007/s11172-014-0534-6
Дополнительные материалы отсутствуют.
Инструменты
Журнал неорганической химии